-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Osteoprotektivní léčba bisfosfonáty nebo denosumabem u nemocných s mnohočetným myelomem: přínos a rizika
Osteoprotective therapy with bisphosphonates or denosumab in patients with multiple myeloma: benefit and risks
Bisphosphonates have been used during the complete treatment of multiple myeloma for more than twenty years. They slow osteolysis and thereby contribute to the improvement of quality of life. Their long-term use, however, is related to 2 serious, usually later appearing complications: osteonecrosis of the jaw, occurring in 6–9 % of patients, and rarer atypical bone fractures. Both these complications are very difficult to heal, and all the more emphasis is therefore laid on prevention. This first of all includes discussion about the risk with the patient, followed by a dental checkup before the commencement of therapy and then repeated during its course, as well as reduced use of these drugs for a necessary period of time. However osteonecrosis of the jaw does not only develop as a consequence of bisphosphonate therapy. The complication is also caused by some new drugs (denosumab and others) used in cancer therapies. The text includes an overview of the drugs currently used in cancer treatment, which also increase the risk of appearance of osteonecrosis of the jaw. For patients with multiple myeloma, who achieve the complete or very good partial remission after chemotherapy, it is recommended to administer these drugs for more than 1 year after achieving the positive treatment response, but not longer than for 2 years. Only regarding those who do not reach the good treatment response, bisphosphonates are administered over the long term, as long as osteolytic activity of the disease lasts.
Key words:
atypical bone fractures – bisphosphonates – drug induced osteonecrosis of the jaw – multiple myeloma
Autori: Zdeněk Adam 1; Jan Straub 2; Marta Krejčí 1; Luděk Pour 1; Dagmar Brančiková 1; Lenka Ostřížková 1; Viera; Sandecká 1; Martin Štork 1
Pôsobisko autorov: Interní hematologická a onkologická klinika LF MU a FN Brno, pracoviště Bohunice 1; I. interní klinika – klinika hematologie 1. LF UK a VFN v Praze 2
Vyšlo v časopise: Vnitř Lék 2017; 63(5): 311-321
Kategória: Přehledné referáty
Súhrn
Bisfosfonáty jsou součástí kompletní léčby mnohočetného myelomu po více než 2 desetiletí. Zpomalují osteolýzu a přispívají tak k lepší kvalitě života. Jejich dlouhodobé podávání je však spojeno se dvěma závažnými, obvykle později nastupujícími komplikacemi: osteonekrózou čelisti, vyskytující se u 6–9 % léčených, a vzácnějšími atypickými frakturami kostí. Obě tyto komplikace se velmi obtížně hojí, a proto se o to větší důraz klade na prevenci. V první řadě je třeba probrat rizika s pacientem a před zahájením léčby a v průběhu léčby je nutná kontrola u stomatologa. V neposlední řadě omezujeme podávání těchto léků na dobu nezbytně nutnou. Osteonekróza čelisti nevzniká však jen v důsledku léčby bisfosfonáty. Tuto komplikaci způsobují také některé nové léky (denosumab a další) používané při léčbě onkologických onemocnění. V textu je uveden přehled léků, které jsou dnes používány v onkologii a které zvyšují riziko vzniku osteonekrózy čelisti. U pacientů s mnohočetným myelomem, kteří po chemoterapii dosáhnou kompletní či velmi dobré parciální remise, se doporučuje podávat tyto léky sice více než 1 rok od dosažení této léčebné odpovědi, ale ne déle než 2 roky. Pouze u pacientů, kteří nedosáhnou uvedených léčebných odpovědí, se bisfosfonáty podávají dlouhodobě, pokud trvá osteolytická aktivita nemoci.
Klíčová slova:
atypické fraktury kostí – bisfosfonáty – léky indukovaná osteonekróza čelisti – mnohočetný myelomÚvod
Více než 80 % nemocných s mnohočetným myelomem (MM) má typická osteolytická ložiska, a tak jsou bisfosfonáty standardní a nedílnou součástí jeho komplexní léčby. Tento fakt se více než po 2 desetiletí nemění. Kontinuálně však zrají a mění se názory na to, kdy začít s podáváním těchto léků, jak dlouho je podávat a jak se liší jednotlivé léky ve své účinnosti.
Bisfosfonáty mají několik vedlejších účinků, které jsou zpravidla mírného či středního stupně. Tento fakt je akceptován jak lékaři, tak především nemocnými. Vysazení léků či přechodné přerušení jejich podáváni a redukce dávky jsou běžné metody, které téměř ve 100 % vedou v rutinní praxi k plné úpravě vedlejších účinků, jako je dyspepsie, zhoršení funkce ledvin apod [1].
Po více než jednom desetiletí používání těchto léků byly teprve popsány 2 pozdní, naštěstí řídce se vyskytující komplikace této léčby. A toto poznání pak modifikovalo dříve platné názory na to, jak dlouho tyto léky podávat.
Jde o osteonekrózu čelisti, obvykle následující po extrakci zubu, a pak o zvýšenou křehkost kostí zcela výjimečně se projevující atypickými (únavovými) frakturami, k nimž dojde bez odpovídajícího násilí. Osteonekróza čelisti v souvislosti s dlouhodobým užíváním bisfosfonátů byla poprvé popsána až v roce 2003 a 2004 (stomatochirurgy Marxem a Ruggierem) [2,3], ačkoliv léčebný efekt pamidronátu byl popsán již v roce 1991. Tedy až po 12 letech používání pamidronátu dali právě stomatologové do souvislosti vyšší četnost osteonekrózy čelisti s užíváním bisfosfonátů. Po prvním popisu této komplikace ke konci roku 2003 pak následovala exploze článků s touto tématikou a dnes víme, že postihuje 6–9 % pacientů s mnohočetným myelomem, kteří užívají bisfosfonáty!
Osteonekróza čelisti nejčastěji vzniká jako důsledek extrakce zubu, ale tento proces může nastartovat i zákrok spojený se zakotvením zubního implantátu [5–7], anebo tlakem zubní protézy na měkké tkáně nad čelistí.
V roce 2017 však již je známo, že osteonekrózu čelisti mohou způsobit nejen bisfosfonáty, ale i četné další léky, jak rozvádíme v odstavci o osteonekróze.
Vznik atypických únavových fraktur je ještě vzácnější komplikací než osteonekróza čelisti.
Podávání bisfosfonátů zvyšuje kostní hustotu (denzitu), se zvyšování hustoty se však nezvyšuje lineárně pevnost kosti. Ta závisí na optimální architektuře kostních trámců a bisfosfonáty, mimo jiné, tuto remodelaci brzdí. Tato komplikace je vzácnější než osteonekróza čelisti, a proto byla popsána ještě později než osteonekróza čelisti, až v roce 2008, tedy po 18 letech používání těchto léků. Nejčastěji to bylo v oblasti femoru [8–10].
K atypické zlomenině může dojít i v oblasti metatarzálních kůstek (obdoba pochodových fraktur), jak jsme u jednoho našeho pacienta popsali. Vzácnost výskytu této komplikace signalizuje, že tato komplikace postihuje pouze některé osoby, ale jejich identifikace v průběhu léčby není žádnými dostupnými metodami možná.
Tyto pozdní nežádoucí účinky, rozpoznané až po více než 10 letech podávání bisfosfonátů pacientům s maligní osteolýzou, ale i s osteoporózou, vedly k úpravě názorů na indikaci a délku podávání bisfosfonátů. Proto považujeme za vhodné podat přehled názorů z pozice roku 2017 a také přehled dalších léků, které mohou způsobit osteonekrózu čelisti.
Klinické studie potvrzující přínos bisfosfonátů pro pacienty s mnohočetným myelomem
Bolesti kostí, hyperkalcemie a patologické fraktury jsou u této skupiny pacientů hlavní příčinou morbidity a mortality. V prospektivních randomizovaných studiích byl prokázán statisticky významný přínos klodronátu [11–13], pamidronátu [14,15] a zoledronátu [16]. Podrobnosti z těchto prací byly rozvedeny i v českých publikacích [17]. U ibandronátu je situace složitější. Ve formě článku byla zveřejněna pouze jedna randomizovaná studie, která u pacientů s mnohočetným myelomem srovnávala ibandronát s placebem. A právě v této studii byl ibandronátsilně poddávkován, pacienti dostávali ibandronát 1krát měsíčně i.v. pouze v dávce 2 mg, zatímco dnešní běžná dávka je trojnásobná (6 mg). A tak není překvapením, že ibandronát nebyl v této studii dostatečně účinný. Ve studii byla testována pouze třetina dávky, která se dnes běžně podává [18]. Ibandronát v dávce 6 mg/měsíc má u pacientů s kostními metastázami solidních tumorů prokázanou klinickou účinnost srovnatelnou se zoledronátem [19–22]. Formou abstraktu byly publikovány závěry německé studie, v rámci níž byl srovnáván ibandronat 6 mg 1krát měsíčně se zoledronatem 4 mg 1krát měsíčně v souboru pacientů s mnohočetným myelomem. Léčebný efekt byl po všech stránkách lepší u ibandronátu než u zoledronátu [23]. Vzhledem k prokázané účinnosti ibandronátu u solidních tumorů se předpokládal analogický účinek u mnohočetného myelomu (názor expertů), pro což svědčilo i srovnání Knaufa [23].
Účinnost ibandronátu u mnohočetného myelomu potvrdila i nejnovější metaanalýza [24]. Registrovány jsou další 2 preparáty ze skupiny bisfosfonátů, alendronát a risedronát, které jsou indikovány pouze pro léčbu osteoporózy, jejíž příčinou není maligní onemocnění, stejně tak jako preparát Bonviva (ibandronát). Ve fázi klinického zkoušení u mnohočetného myelomu je blokátor ligandu RANKL denosumab. Zatím je k dispozici pouze jedna publikace „in extenso“ klinické studie fáze III, která srovnávala zoledronát a denosumab u pacientek s karcinomem prsu a u pacientů s mnohočetným myelomem. Autoři uvádějí, že v účinnosti obou preparátů nenalezli signifikantní rozdíly. K dispozici je pouze metaanalýza randomizovaných klinických studií srovnávající zoledronát s denosumabem. Autoři této metaanalýzy uvádějí, že denosumab byl o něco účinnější než zoledronát v oddálení vzniku kostních komplikací (skeletal releated events). Ale v délce celkového přežití nebyl rozdíl mezi pacienty léčenými denosumabem či zoledronátem [25].
V březnu roku 2017 byla poprvé přednesena na 16. myelomovém workshopu a zveřejněna ve formě abstraktu data z první velké klinické studie srovnávající denosumab a zoledronát u nově diagnostikovaných pacientů s mnohočetným myelomem. Pacienti byli randomizováni do skupiny dostávající podkožní injekce denosumabu 120 mg 1krát měsíčně anebo do skupiny dostávající 4 mg zoledronátu 1krát měsíčně. Celkem bylo randomizováno 1 718 pacientů, tedy v každé skupině bylo 859 osob. Při mediánu sledování 17,4 měsíce mělo 43,8 % pacientů užívajících denosumab a 44,6 % pacientů užívajících zoledronát první kostní komplikaci (skeletal releated event). Medián intervalu do první kostní komplikace byl 22,83 měsíců při léčbě denosumabem a 23,98 měsíce při léčbě zoledronátem. Ze statistického hodnocení vyplývá, že denosumab neměl horší účinnost než zoledronát z hlediska délky intervalu do první kostní komplikace. Celkové přežití nebylo signifikantně odlišné v obou skupinách. Frekvence nežádoucích účinků byly následující – hypokalcemie: denosumab 16,9 %, zoledronát 12,4 %, osteonekróza čelisti: denosumab 4,1 %, zoledronát 2,8 %. Tato klinická studie tedy neprokázala signifikantní rozdíl mezi zoledronátem a denosumabem v délce intervalu do první kostní komplikace, prokázala však o něco vyšší incidenci závažných nežádoucích účinků denosumabu, tedy osteonekrózy čelisti a hypokalcemie [26]. I když denosumab v této studii neprokázal větší léčebný přínos než zoledronát, jedna přednost se mu upřít nedá: podkožní způsob podání a nezávislost dávky na funkci ledvin.
Volba léku
Volba preparátů se klasicky děje na základě srovnávacích studií. V posledních 2 desetiletích proběhly sice velmi četné studie srovnávající jednotlivé preparáty ze skupiny bisfosfonátů s placebem, ale v uvedeném období byly zveřejněny pouze 3 velké randomizované studie, které srovnávaly 2 rozdílné preparáty nebo alespoň 2 rozdílné dávky. Bylo prokázáno, že zoledronát byl stejně účinný jako pamidronát z hlediska vlivu na bolesti, na interval do první skeletální komplikace a na incidenci skeletálních komplikací [27]. Druhá randomizovaná klinická studie srovnávala účinek 2 odlišných dávek pamidronátu 90 mg vs 30 mg 1krát za měsíc. V hodnoceném souboru 504 pacientů po 3 letech nebyl nalezen rozdíl v počtu skeletálních komplikací [28]. Třetí randomizovaná studie srovnávala nitrožilní podávání zoledronátu s perorální léčbou klodronátem 1 600 mg denně v souboru 2 000 pacientů. Tato studie prokázala signifikantně nižší počet kostních komplikací ve skupině se zoledronátem oproti pacientům s klodronátem. A zatím bylo v této studii jako v jediné popsáno prodloužení délky celkového přežití (overal survival = OS) ve skupině léčebné zoledronátem ve srovnání se skupinou léčenou klodronátem [29–31]. Toto je jediná studie, která prokázala výraznější účinek zoledronátu oproti klodronátu. Klodronát je nejstarší z této skupiny, není další klinická studie, které by srovnávala jeho účinek s jinými bisfosfonáty.
Otázce, zda některý z preparátů bisfosfonátů má potenciál prodloužit celkové přežití, se pak věnovala metaanalýza dat obsažených v Cochrane databázi. Metaanalýza však nepotvrdila prodloužení přežití vlivem podávání zoledronatu oproti léčbě dalšími dnes používanými bisfosfonáty [32].
Závěry této metaanalýzy neopravňují k upřednostnění některého z dostupných bisfosfonátů. U pacientů s mnohočetným myelomem považujeme za indikované a vhodné všechny preparáty bisfosfonátů (klodronát, pamidronát, zoledronát, ibandronát) při odpovídajícím dávkování. Každý z uvedených preparátů se mírně liší spektrem nežádoucích účinků. Proto se domníváme, že optimální je individuální volba bisfosfonátů pro konkrétního pacienta.
Indikace a délka podávání bisfosfonátů u pacientů s mnohočetným myelomem
Indikací pro zahájení podávání bisfosfonátů je „symptomatický mnohočetný myelom“. Toto jednoznačné doporučení nevyžaduje průkaz osteoporózy či osteolytických ložisek u osob s prokázaným mnohočetným myelomem, protože je pravděpodobné, že i kdyby osteolytická ložiska nebyla v počátku onemocnění patrná, tak se časem vyvinou. Nicméně pacientů se symptomatickým mnohočetným myelomem s osteolytickými ložisky je jistě větší imperativ pro indikování bisfosfonátů než u pacientů se symptomatickým myelomem, u nichž výjimečně není žádné osteolytické poškození skeletu detekovatelné a symptomem myelomu, neboli důvodem, proč je pacient léčen, je anémie způsobená myelomem či poškození ledvin mnohočetným myelomem. Velmi ojedinělé jsou případy mnohočetného myelomu bez kostního postižení a přínos bisfosfonátů pro tuto malou podskupinu nebyl žádnou studií analyzován.
Indikace pro zahájení podávání bisfosfonátů u mnohočetného myelomu, platná již více než jedno desetiletí, se v podstatě nemění. Ale mění se názory na otázku, jak dlouho je podávat.
V době před rozpoznáním pozdních nežádoucích účinků bisfosfonátů nebyla jasná pravidla pro délku podávání. Pacientů v kompletní remisi bylo před 10 lety méně, než je dnes, a tak většina nemocných s mnohočetným myelomem užívala dříve tyto léky dlouhodobě.
Po rozpoznání pozdních komplikací bisfosfonátů typu osteonekrózy čelisti a atypických fraktur se začala délka podávání bisfosfonátů omezovat s cílem snížit počty těchto pozdních komplikací. Proto mezinárodně platná léčebná doporučení pro léčbu mnohočetného myelomu preferují podávání bisfosfonátů ukončit u těch pacientů, kteří po protimyelomové léčbě dosáhnou dlouhodobé kompletní remise (complete response – CR) či velmi dobré parciální remise nemoci (very good partial response – VGPR). Mezinárodní doporučení se shodují v tom, že bisfosfonáty by měly být podávány u pacientů v CR či VGPR nejméně jeden rok od dosažení takto definované léčebné odpovědi, ale ne déle než 2 roky [33–37].
Doporučení podávat bisfosfonáty ještě rok po dosažení CR (ukončení léčby) se odvíjí od faktu, že u části nemocných myelom do jednoho roku recidivuje.
Doporučení nepodávat bisfosfonáty pacientům v kompletní remisi či parciální remisi déle než 2 roky od dosažení CR či VGPR (od ukončení léčby) se odvíjí od zjištěné skutečnosti, že incidence osteonekróz čelisti začíná výrazněji narůstat po 2 letech podávání bisfosfonátů [33].
V současnosti jsou tato pravidla respektována většinou lékařů, protože léčba v souladu s platnými doporučeními je nejlepší ochranou v případě stížnosti pacienta při vzniku osteonekrózy.
Dlouhodobé podávání bisfosfonátů se doporučuje jen těm pacientům s mnohočetným myelomem a s osteolytickými projevy, kteří nedosáhnou ani VGPR nemoci, u kterých je dlouhodobě přítomná aktivita nemoci [34–37].
V případě biochemického relapsu, který ale zatím nevyžaduje léčbu, se má obnovit léčba bisfosfonáty. Obnovení podávání bisfosfonátů při známkách laboratorního relapsu vedlo k oddálení vzniku dalších kostních komplikací, ne však k prodloužení intervalu do vzniku jiných signálů aktivity nemoci [38].
Ne u každého pacienta jsou tato doporučení realizovatelná
Uvedená doporučení se zakládají na výsledcích četných klinických studií. Výsledky studií nám pouze mohou napomoci v rozhodování o léčbě, ale určitě nemohou být v léčbě 100% závazná. Navíc, ať chceme, nebo nechceme, každý výsledek klinické studie je svým způsobem výsledkem léčby jasně definované skupiny pacientů, a proto se nedá zcela paušalizovat pro všechny. Do žádné recentní studie s bisfosfonáty by jistě nešel zařadit pacient s kariézním chrupem s několika váčky, vypadlými implantáty, nebo nespolupracující pacient. Ale my musíme léčit i tyto nemocné, ty, kteří o svůj chrup nebudou pečovat z důvodu svého životního stylu, z důvodu ekonomické situace či z důvodu zhoršené hybnosti vlivem maligní nemoci, která jim znemožňuje navštěvovat zubní lékaře. Ošetřující hematolog si musí uvědomit, že současná extrakce více zubů v případě, že není zajištěna navazující protetická práce, povede k potížím s příjmem stravy a může vést k malnutrici.
Proto je před zahájením léčby bisfosfonáty vždy nutné zvážit riziko případné osteonekrózy. Zejména u pacientů s vyšším rizikem osteonekrózy čelisti, u kterých nelze očekávat fyzickou i ekonomickou dostupnost komplexní stomatologické péče, raději léčbu bisfosfonáty oddalujeme, či vůbec nezahajujeme. Tuto situaci je nutno vždy s pacientem individuálně prodiskutovat, protože i zde platí, že „v životě nic není zadarmo, za vše se něčím platí“. A osteoprotektivní účinek bisfosfonátů u pacientů s maligní osteolýzou je vykoupen rizikem osteonekrózy, jejíž riziko se zvyšuje s délkou léčby bisfosfonáty.
Podávat bisfosfonáty u asymptomatického myelomu?
Otázku, zda podávat bisfosfonáty pacientů s mnohočetným myelomem, kteří splňují diagnózu asymptomatického myelomu, řešilo mnoho studií. Závěry všech těchto studií byly podobné. Podávání bisfosfonátů pacientům s asymptomatickým myelomem, tedy myelomem bez prokazatelných osteolytických ložisek, kteří ještě nevyžadují zahájení cytostatické léčby, vedlo k tomu, že v době přechodu do symptomatické formy mnohočetného myelomu měli tito nemocní skelet podstatně méně poškozený nemocí než ti, kteří bisfosfonáty nedostávali. Vlivem podávání bisfosfonátů však nedošlo k prodloužení asymptomatické fáze myelomu [39–41]. Tyto výsledky byly před 10 lety interpretovány jako jednoznačná indikace pro zahájení podávání bisfosfonátů pacientům s asymptomatickým, a tedy neléčeným myelomem. Za posledních 10 let se však hodně zlepšily možnosti detekce počátků osteolytické aktivity mnohočetného myelomu (celotělové low-dose CT, FDG-PET/CT). To znamená, že mnozí pacienti, kteří by dříve byli dle RTG snímků ponecháni ve skupině asymptomatického myelomu, jsou dnes přeřazováni do symptomatické formy a léčeni díky průkazu časných forem osteolýzy metodou celotělového low-dose CT nebo FDG-PET/CT vyšetření.
Podání bisfosfonátů u pacientů s asymptomatickým myelomem nevyžadujícím cytostatickou léčbu v roce 2017 závisí na rozhodnutí ošetřujícího lékaře, který individuálně vyhodnotí potenciální přínos oproti riziku pozdních komplikací při dlouhodobém podávání bisfosfonátů.
Dávkování v závislosti na funkci ledvin
Klodronát je k dispozici ve dvou preparátech (Bonefos a Lodronat). Pro Bonefos je v příbalovém letáku doporučení pro úpravu dávek při renální insuficienci, takže ani závažné renální selhání není kontraindikací jeho podání, je tedy třeba pouze upravit dávku. Při závažném renálním selhání se snižuje nitrožilní dávka na 50 %, v případě perorální dávky je důraz na redukci méně striktní, je však nutno pečlivěji monitorovat případné nežádoucí účinky (sledování hladiny kalcia a další vývoj hodnot urey, kreatininu, případně clearance).
Dle naší zkušenosti lze podat při hyperkalcemii Bonefos v dávce 1 500 mg v pomalé infuzi injektomatem či infuzní pumpou v průběhu 12 hod, aniž bychom pozorovali jakékoliv nežádoucí účinky. Bisfosfonáty mají krátký plazmatický poločas, krev je po průchodu kostní tkání zbavena bisfosfonátů, a tak velmi pomalé podávání nevede k vyšší plazmatické hladině.
Pamidronát je možné podávat i při závažném renálním selhání, a to dokonce bez redukce dávky, ale s prodloužením intervalu nitrožilní infuze s maximální rychlostí 20 mg/hod. Pro potencionální nefrotoxicitu přípravku se doporučuje sledovat hladinu urey a kreatininu při každé aplikaci.
Zoledronát je omezen pouze pro nemocné s dobrou funkcí ledvin. Výrobce doporučuje nepodávat jej dlouhodobě u nemocných s hodnotnou kreatininu > 265 μmol/l. Pro jednorázovou aplikaci v případě hyperkalcemie je povolená hladina vyšší, 400 μmol/l.
V roce 2005 bylo nově zveřejněno doporučení pro úpravy dávek zoledronátu dle clearence kreatininu, což platí pro nemocné s kreatininem v rozsahu od normálních hodnot až do 256 μmol/l. Pro potencionální nefrotoxicitu se doporučuje sledovat hodnoty urey a kreatininu při každé aplikaci zoledronátu a při zjištěném vzestupu léčbu přerušit. Zhoršování renálních funkcí se v klinických studiích objevilo po mediánu 4 měsíců a dále pokračovalo zhruba po další 2 měsíce i po ukončení podávání zoledronátu.
Ibandronát má velmi příznivý bezpečnostní profil a ledvinné funkce nezhoršuje [42,43]. Podává se v dávce 6 mg i.v. a při snížení clearence < 0,5 ml/s je doporučena redukce nitrožilní dávky ze 6 na 2 mg a prodloužení trvání infuze nejméně na 1 hod.
U pacientů s těžkou poruchou renálních funkcí (CLcr < 30 ml/min) se doporučuje snížení perorální dávky na jednu 50 mg tabletu 1krát týdně.
U ibandronátu se v dokumentaci objevuje doporučení redukovat dávku při chronické renální insuficienci. Pokud je kreatininová clearence > 30 ml/min (0,5 ml/s), podává se plná dávka. Při clearenci < 30 ml/min (0,5 ml/s) se doporučuje podávat 2 mg v intervalu 3–4 týdnů a infuze by měla trvat nejméně 1 hod.
Nicméně v literatuře lze najít více publikací malých sérií pacientů s hyperkalcemií léčenou neredukovanou dávkou ibandronátu i při renální insuficienci, u nichž nebylo popsáno žádné poškození ledvin. Autoři těchto sdělení doporučují neredukovat dávku ibandronátu u pacientů s akutní hyperkalcemií a zhoršenou funkcí ledvin [42–47].
Běžné nežádoucí účinky léčby bisfosfonátů
Bisfosfonáty indukovaná hypokalcemie
Všechny preparáty mohou způsobovat symptomatickou nebo asymptomatickou hypokalcemii, a proto se doporučuje současná substituce kalcia a vitaminu D [48–51].
Gastrointestinální nežádoucí účinky
Dráždění v oblasti horní části zažívacího traktu (jícnu, žaludku) je typické pro perorální preparáty ze skupiny bisfosfonátů obsahujících dusík. Z těch je v případě mnohočetného myelomu používán pouze ibandronát. Pamidronát se v perorální formě nepodává. Zbývající bisfosfonáty obsahující dusík, risedronát a alendronát, se pro léčbu maligní osteolýzy nepoužívají a v této indikaci nebyly testovány v žádné klinické studii. U těchto preparátů se doporučuje po polknutí tablety neuléhat do postele.
To však neplatí pro klodronát, u něhož nebyla toxicita v oblasti jícnu popsána. Klodronát může způsobit mírné dráždění v dolní části zažívacího traktu až řidší stolice. Pokud mají pacienti zácpu po jiných lécích (centrálně působících analgeticích), je to spíše výhodou. Klodronátu se doporučení neuléhat po polknutí zpět do postele netýká, protože poškození jícnu nebylo nikdy po klodronátu popsáno [52].
Flu-like syndrom
Horečka se vzestupem reaktantů akutní fáze provází aplikaci bisfosfonátů obsahujících dusík asi zcela výjimečně, řádově v procentech. Je na to třeba pacienty upozornit, aby teplotu po této infuzi neinterpretovali jako infekci. Klodronát nezpůsobuje flu-like syndrom, takže jej lze použít u osob s flu-like syndromem po podání bisfosfonátů obsahujících dusík [1,52].
Poškození ledvin
Ledviny jsou hlavním místem vylučování bisfosfonátů, buňky ledvin se dostávají do kontaktu s vyšší koncentrací bisfosfonátů více než ostatní buňky v těle, a to zřejmě v některých případech způsobí jejich poškození.
První preparáty ze skupiny bezdusíkatých bisfosfonátů ohrožovaly ledviny jen při příliš rychlém podání, při němž poškození souviselo s vychytáním jejich komplexů v ledvinách. Při dodržení doporučené délky i.v. aplikace či při p.o. podání klodronátu není nefrotoxicita uváděna.
V případě obsahujících dusík bisfosfonátů (pamidronát, zoledronát) se nepravidelně objevuje postupně narůstající nefrotoxicita. Incidence zhoršování funkce ledvin v průběhu léčby zoledronátem dosahovala až 10 %. Ve studii srovnávající 4 mg zoledronátu s placebem činila nefrotoxicita zoledronátu 10,9 % a nefrotoxicita placeba 6,7 %, rozdíl nebyl signifikantní [16]. Nicméně nežádoucí působení zoledronátu na ledviny nelze ignorovat. Při každé aplikaci je nutné sledovat hodnotu urey i kreatininu a v případě jejich vzestupu léčbu přerušit a obnovit ji až po návratu na původní hodnoty nebo adekvátně snížit dávku zoledronátu.
Podstatné je, že toto poškození nenastupuje skokem, ale postupně se vyvíjí v průběhu aplikací. Z toho plyne doporučení pečlivě sledovat hodnoty kreatininu u všech pacientů léčených bisfosfonáty a při jejich vzestupu analyzovat příčiny a případně přerušit podávání použitého preparátu bisfosfonátu. Medián intervalu mezi zahájením léčby a zřetelnou nefrotoxicitou činí 4–5 měsíců [53,54].
Zhoršování funkce ledvin obvykle pokračuje 1–2 měsíce po přerušení podávání bisfosfonátu.
U pacientů s poškozením ledvin v průběhu léčby těmito preparáty bylo popsáno jak glomerulární, tak i tubulární poškození [55].
Léky indukovaná osteonekróza čelisti
Rizikové faktory a četnost této komplikace
Léky navozená osteonekróza čelisti (medication releated osteonecrosis of the jaw) je velmi závažná komplikace s progresivní destrukcí kosti v oblasti maxilofaciální. Tato komplikace může být indukována jak léky inhibujícími osteolýzu, tedy bisfosfonáty, tak preparátem denosumab, ale také léky inhibujícími angioneogenezi. Proto v roce 2014 Asociace amerických maxillofaciálních chirurgů navrhla změnit název Bisphosphonate-Releated Osteonecrosis of the Jaw na Medication Releated Osteonecrosis of the Jaw (MRONJ), čili léky indukovanou osteonekrózu čelisti. A postupně přibývají další léky, které mohou přispět ke vzniku osteonekrózy (tab. 1) [56,57]. Osteonekrózu čelisti mohou způsobit i některé léky, které neovlivňují kostní resorpci [58]. U karcinomu prsu a karcinomu prostaty a ostatních solidních nádorů prokázala léčba denosumabem o něco vyšší incidenci osteonekrózy čelisti než léčba zoledronátem, jak ukázala metaanalýza 7 klinických studií na 8 973 pacientech (1,7 % vs 1,1 %, RR 1,48, 95% CI 0,96–2,29) [59].
Tab. 1. Léky s rizikem indukce osteonekrózy dle tabulky Americké asociace maxilofaciálních chirurgů. 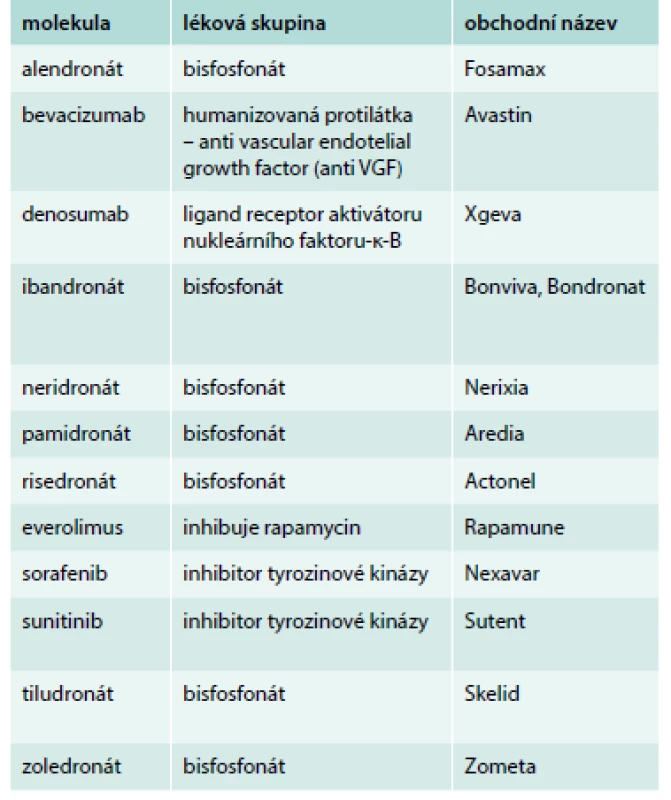
Upraveno podle [56,57] První informace o vzniku osteonekrózy čelisti vlivem inhibice angioneogeneze preparátem bevacizumab jsou z roku 2008 [60,61]. A opětovně po prvním popisu následovaly četné další publikace s tímto tématem. AntiVEGFR inhibitor – bevacizumab – zvyšuje riziko onemocnění osteonekrózy čelisti v kombinaci s bisfosfonáty na 2,4 %, při samostatném užití bez bisfosfonátu se vyskytuje tato komplikace jen u 0,2 % pacientů z 5 680 analyzovaných.
Sunitinib (inhibitor VEGF receptoru, PDGF receptoru, c-Kit, FLT3 a RET kináz) je používán u nádorů ledvin, pankreatického neuroektodermálního tumoru (NET) a u gastrointestinálního stromálního tumoru (GIST) v kombinaci s bisfosfonáty. Sunitinib výrazně zvýšil riziko vzniku osteonekrózy. První popis této komplikace je z roku 2009 [62–64].
Do souvislosti s touto komplikací byl dán také lék s názvem ziv-aflibercet [65].
Karbozantinib (Cometriq) je také inhibitor tyrozinkináz, který je užíván u medulárního nádoru štítnice a u tumoru ledviny. Při použití tohoto léku byla osteonekróza čelisti hlášena u 1,4 % pacientů ve studii fáze III [66].
Sorafenib (Nexavar) je také dáván do souvislosti s osteonekrózou [67], podobně jako everolimus (např. Afinitor) [68,69]. Vzhledem k tomu, že se objevují stále nové léky, jejichž aplikace zvyšuje riziko osteonekrózy čelisti, se na stomatochirurgických pracovištích s tímto problémem setkávají lékaři častěji než dříve.
Na procesu vzniku osteonekrózy se podílejí: zánět a infekce, mikrotrauma, alterace kostní remodelace, suprese kostní resorpce, inhibice angiogeneze, alterovaná imunita pacienta. K rizikovým faktorům patří typ molekuly, kumulativní dávka, genetická predispozice, kouření, trauma dásní a čelisti, invazivní zákroky v oblasti čelisti. Riziko vzniku osteonekrózy stoupá se závažností imunosuprese (současná léčba glukokortikoidy případně dalšími imunosuprimujícími léky). Riziko vzniku osteonekrózy potencují komorbidity snižující imunitu: diabetes mellitus, revmatická artritida, renální insuficience pacientů na dialýze, obezita, věk, alkoholizmus. Rozvoj osteonekrózy potencuje tlak zubních protéz na dáseň a přítomnost zubních implantátů.
Při srovnání léčby bisfosfonáty a denosumabem se míra rizika vzniku osteonekrózy zásadně neliší, ale zásadně se liší průměrný interval do vzniku osteonekrózy. V případě léčby zoledronatem byl medián počtu aplikací při vzniku osteonekrózy 33, zatímco osteonekróza v případě léčby denosumabem se může objevit časně po zahájení léčby, nezávisle na počtu aplikací denosumabu [57]. Ale na druhé straně riziko vzniku osteonekrózy po denosumabu v případě jeho ukončení rychle klesá, zatímco po léčbě bisfosfonáty zůstává stabilní po několik let. Ke vzniku osteonekrózy vedle v 52–61 % případů extrakce zubu [57].
Riziko osteonekrózy v případě léčby perorálními bisfosfonáty se udává 0,5 %, riziko osteonekrózy po extrakci zubu při nitrožilní léčbě bisfosfonáty se udává od 1,6 do 14,8 % [57]. Osteonekróza postihuje v 73 % případů mandibulu, ve 22,5 % maxilu a v 4,8 % postihuje obě čelisti [57]. Riziko vzniku osteonekrózy v závislosti na léčbě a čase uvádí tab. 2.
Tab. 2. Míra rizika vzniku osteonekrózy v různých skupinách pacientů. 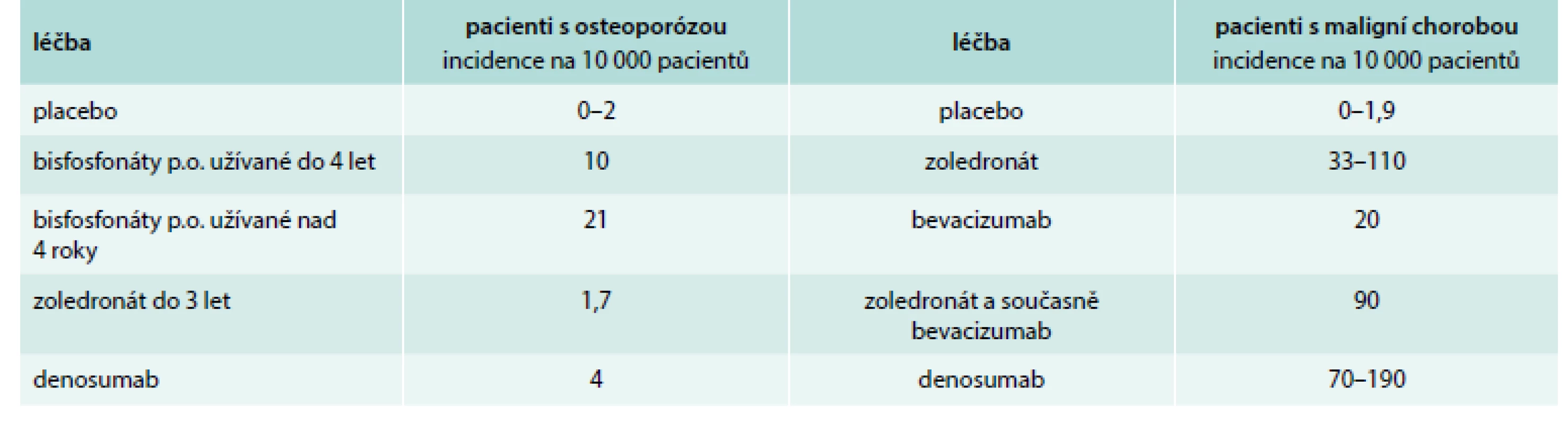
Upraveno podle [57] Incidence osteonekrózy je podle dostupných údajů u nemocných s mnohočetným myelomem nejvyšší ze všech nádorů. Durie et al uvádějí v retrospektivním hodnocení provedeném na 1 203 pacientech četnost osteonekrózy u 6,8 % nemocných s mnohočetným myelomem a jen u 4,4 % nemocných s karcinomem prsu [70]. Bamias (2005) uvádí v prospektivním hodnocení souboru 252 nemocných incidenci osteonekrózy čelisti u 9,9 % pacientů s mnohočetným myelomem a jen u 2,9 % pacientek s karcinomu prsu [71]. V obou klinických hodnoceních byly podávanými bisfosfonáty pamidronát a zoledronát. Je prokázáno, že riziko vzniku osteonekrózy čelisti roste s délkou podávání bisfosfonátu [71].
Definice léky indukované osteonekrózy čelisti
Pro léky indukovanou osteonekrózu čelisti lze najít více definicí. Klasická definice požaduje:
- současná či předcházející léčba některým z antiangiogeních nebo antiresorpčních léků uvedených v tab. 1
- nepředcházela žádná radioterapie na oblasti čelistí
- viditelná kost čelisti nepřekrytá dásněmi nebo přítomnost intraorální či extraorální píštěle v oblasti maxilofaciální trvající déle než 8 týdnů [56,75]
Italští odborníci (Italian Society of Oral Pathology and Medicine) ji definují nejen na základě stomatologického vyšetření, ale i na základě CT zobrazení a nevyžadují viditelně obnaženou čelistní kost. Léky indikovanou osteonekrózu čelisti definují jako progresivní destrukci a nekrózu kostí čelisti u pacientů léčených uvedenými léky. Podmínkou je opět nepřítomnost radioterapie [72].
Dle evropské studie splnilo 76 % osteonekróz kritéria dle Ruggiera, zatímco 24 % by uniklo diagnóze, protože osteonekrotická kost nebyla zrakem patrná, ale byla zřetelná při CT vyšetření [73]. Speciální CT vyšetření čelisti má tedy dnes díky časté detekci osteonekrózy také svoje místo. Pro hodnocení rozsahu osteonekrózy čelisti byly vytvořeny klasifikace, které uvádí tab. 3.
Tab. 3. Hodnocení rozsahu osteonekrózy čelisti dle jednotlivých publikovaných kritérií 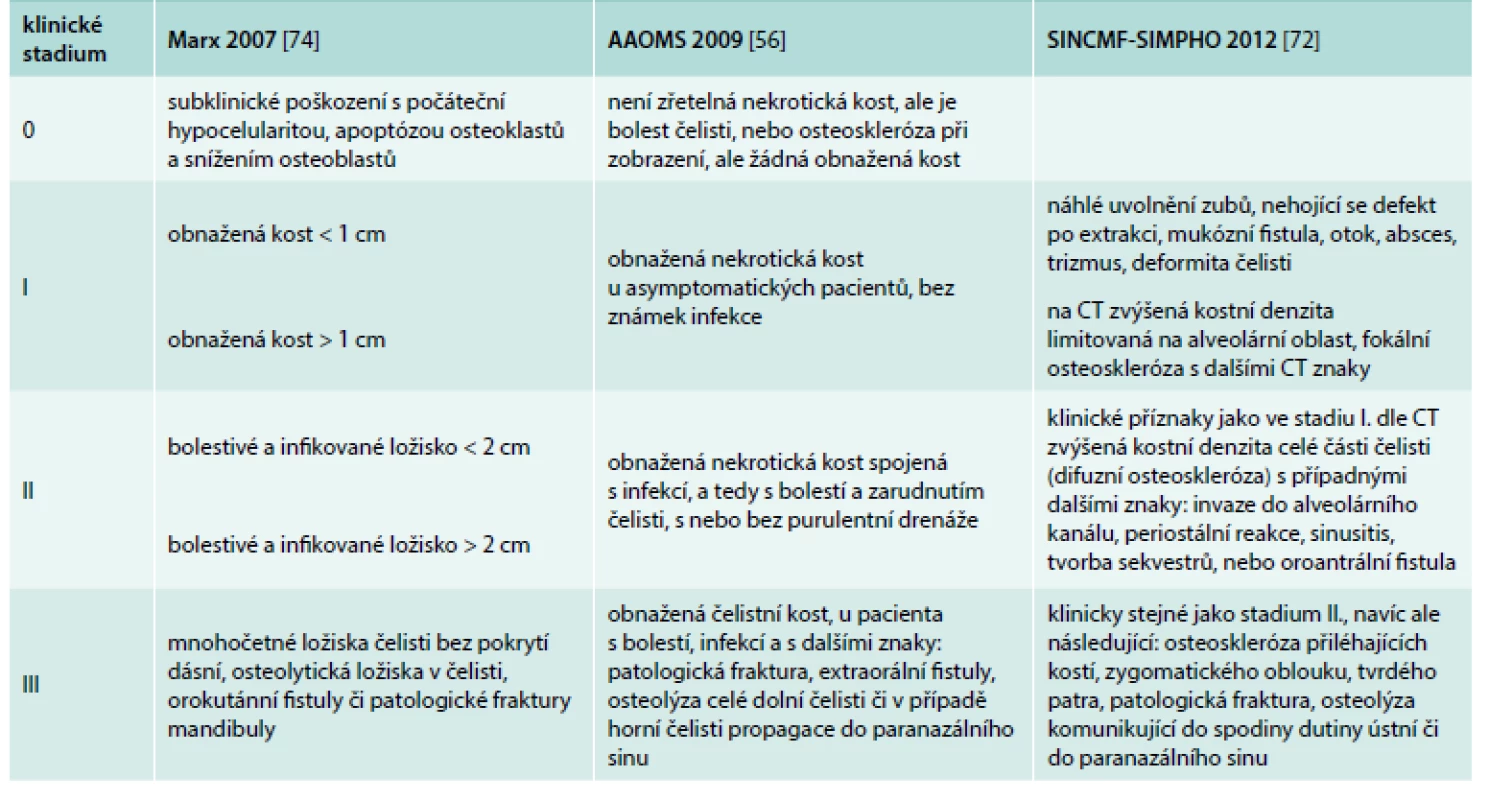
Diferenciálně diagnosticky musí stomatochirurg odlišit osteonekrózu čelisti od alveolární osteitidy, sinusitidy (zejména aspergilové), gingivitidy/periodontitidy, caries, následků periapikálních zánětů, karcinomu případně sarkomu dutiny ústní, chronické sklerotizující osteomyelitidy (proliferative periostitis), nemoci temporomandibulárního kloubu a osteoradionekrózy.
Preventivní opatření
Léčba již vzniklé osteonekrózy je omezeně úspěšná, a proto se důraz klade na prevenci.
seznámit pacienta s rizikem těchto léků
- před léčbou provést panoramatický snímek čelisti a prohlédnout čelisti stomatologem znalým problému, doporučuje se extrakce zubů s velkou mobilitou, grade III, nebo zubu s endodetálním a peridentálním nálezem, vždy s antibiotickou profylaxí
- pokud by extrakce více zubů však měla za následek dlouhodobější poruchu v příjmu stravy, musí se lékař domluvit s pacientem a vyhodnotit, co představuje větší negativum, zda nepodávání bisfosfonátů nebo provedení četných extrakcí s následnou neschopností kousat; pacienti s myelomem jsou často špatně pohybliví, takže dostavit se na odpovídající protetické práce nemusí být snadno řešitelný problém, proto se u těchto pacientů uchylujeme k odložení aplikaci bisfosfonátů do doby, než se zlepší hybnost nemocného, a tedy jeho schopnost docházet na protetické stomatologické ošetření
- před každou aplikací bisfosfonátů se ptáme pacienta, zda nemá nové problémy se zuby, které dříve neměl; v případě, že je nutná extrakce zubu, doporučuje se přerušení léčby až 2–3 měsíce před extrakcí, pokud to není urgentní výkon; tento postup však není podpořen žádnou klinickou studií [76,77], stomatochirurgický zákrok (prosté vytržení zubu) se doporučuje provádět s antibiotickou profylaxí (např. Augmentin či Amoksiklav à 1 g – 2 tbl 2 hod před samotným zákrokem a poté 2krát 1g à 12 hod po dobu 10–14 dnů); při alergii na peniciliny lze použít např. rovamycin 1–0–1 tbl, případně dalacin; po 14 dnech je doporučeno provést kontrolní stomatologické vyšetření, pokud není rána zhojena do 14 dnů, je vhodné provést mikrobiologické vyšetření, případně změnu antibiotika
- američtí stomatologové doporučují u nejrizikovějších, tedy u onkologických pacientů léčených i. v. bisfosfonáty nebo u pacientů léčených perorálními bisfosfonáty, více než 4 roky provádět v intervalu 6–12 měsíců pravidelné klinické prohlídky zkušeným stomatologem i s případným panoramatickým snímkem čelisti [56,77]; o kontrolní prohlídky stomatologem se snažíme v ročních intervalech i na našem pracovišti a provedení kontrolního panoramatického snímku čelisti necháme na rozhodnutí stomatologa
- s prodlužujícím se životem nemocných se častěji než dříve setkáváme s otázkou, zda se může implantovat dentální endoprotéza: pro tento zákrok bisfosfonáty představují výrazné zvýšení rizika a nejde jen o riziko osteonekrózy, ale i o riziko uvolnění implantátu, míře rizika zubních implantátů u pacientů užívajících bisfosfonáty se zatím nevěnovala žádná prospektivní randomizovaná studie, k dispozici jsou pouze popisy případů a přehledy dosud publikovaných sdělení; v roce 2016 se doporučuje pouze vysvětlit pacientovi, že v případě zubních implantátů je zvýšeno riziko vzniku osteonekrózy v místě implantátu, doporučuje se individuálně zvážit, jak moc stávající choroba inhibuje imunitní procesy hojení a vždy použít perioperativní antimikrobiální profylaxe [78,79]
Léčba již vzniklé osteonekrózy
Léčba by měla probíhat na centrech, která mají s touto komplikací zkušenosti.
Ve stadiu I, tedy při viditelné expozici nekrotické kosti, se doporučují výplachy antiseptickými roztoky, např. 3–4krát denně mezi jídly kloktat chlorhexidin (Corsodyl) do zhojení rány. Pokud po 8 týdnech není tendence k hojení, doporučuje se chirurgický debridement.
Ve stadiu II po 2 týdnech antibiotické terapie, která má snížit zánětlivé projevy, je ke zvážení chirurgický debridement po zvážení rizik a potenciálního přínosu.
Ve stadiu III se doporučují marginální či segmentální osteotomie. Invazivní chirurgie je indikována, jen pokud může radikální výkon zlepšit kvalitu života pacienta.
Léčba osteonekrózy čelisti by měla být prováděna v centrech, která mají s touto léčbou dostatek vlastních zkušeností [80].
Atypické fraktury
V roce 2008, tedy 5 let poté, co byla popsána osteonekróza čelisti při bisfosfonátech, si lékaři všimli, že dlouhodobá aplikace bisfosfonátů způsobuje zvýšenou křehkost kosti a že se objevují takzvané „atypické fraktury“, které vznikají v místech, v nichž nejsou žádná patologická osteolytická ložiska, bez odpovídajícího traumatického děje. První popisy této vzácné komplikace se tedy objevují více než po 20 letech podávání těchto léků. Tyto komplikace pravděpodobně existovaly i dříve, ale šlo zase o to, aby někdo z lékařů, kteří tyto léky svým pacientům předepisovali, zpozorněl, když se objevilo něco netypického, a tento jev popsal [81–86]. Atypické fraktury kostí vznikají bez zvýšené fyzické zátěže či bez traumatu u osob dlouhodobě užívajících bisfosfonáty. Tyto léky totiž inhibují nejen patologickou osteolýzu, a tak zmenšují počet kostních komplikací a zvyšují denzitu kosti, ale také blokují fyziologickou přestavbu kosti, což vede ke ztrátě pružnosti a zvýšené křehkosti. Typickými lokalizacemi jsou subtrochanterické fraktury femoru, fraktury pánve a femorů. O atypických frakturách v těchto lokalizacích je nejvíce publikací. Fraktury metatarzálních kostí jsou popisovány méně často, první popis je z roku 2006 [87].
Když vyhledáme v literární databázi Medline-Pubmed, kdy byly atypické fraktury v důsledku bisfosfonátů popsány u pacientů s mnohočetným myelomem, zjistíme, že se první popisy objevily až v roce 2008 a 2009. Popisují spontánní fraktury femoru u pacientů s mnohočetným myelomem, jeden dostával bisfosfonáty po dobu 9 let a druhý po dobu 11 let [88,89].
Největší soubor pacientů s atypickými frakturami metatarzálních kostí zveřejnili autoři z Kalifornie. Popisují osud 6 pacientů s mnohočetným myelomem, kteří byli mimo jiné léčeni také bisfosfonáty obsahujícícmi dusík. K fraktuře metatarzálních kostní u těchto 6 pacientů došlo nejdříve po 5,5 letech podávání bisfosfonátů (5,5; 7,5; 7,5; 7,6; 8,8 a 11 let), medián intervalu podávání bisfosfonátů do vzniku první fraktury uvádějí 7,55 roku. Uvedených 6 pacientů patřilo do skupiny 300 pacientů sledovaných v kalifornském centru. Z tohoto souboru pouze 49 pacientů dostávalo bisfosfonáty při mnohočetném myelomu déle než 5,5 let. Metatarzální fraktury se tedy objevily u 12 % pacientů, kteří dostávali bisfosfonáty déle lež 5,5 let. Autoři z toho soudí, že tento typ fraktur po 5 letech nitrožilní aplikace bisfosfonátů nemůže být nijak vzácný [90]. Fraktury metatarzálních kostní byly dříve popisovány u zdravých osob, např. u vojáků po dlouhých pochodech se zátěží, jako tzv. únavové fraktury. Nyní je můžeme vidět u osob užívajících dlouhodobě bisfosfonáty i bez zvýšené fyzické námahy. Jak osteonekrózu čelisti, tak atypické fraktury kostí jsme pozorovali také u našich pacientů [91,92].
Závěry pro praxi
- dlouhodobé léčebné podávání bisfosfonátů je doporučováno všem pacientům s nepochybnou diagnózou symptomatický mnohočetný myelom
- podávání bisfosfonátů nemocným s mnohočetným myelomem v asymptomatické fázi nemoci bez známek osteolýzy, kteří zatím nevyžadují léčbu, závisí na rozhodnutí ošetřujícího lékaře, který pro konkrétní situaci vyhodnocuje potenciální přínos a míru rizika
- výběr preparátu závisí na preferenci pacienta a lékaře a stavu organizmu před léčbou, zvláště s ohledem na poškození ledvin a možnost vzniku osteonekrózy
- v případě dosažení kompletní remise či velmi dobré parciální remise mnohočetného myelomu je vhodné léčbu časově omezit, aby léčby probíhala alespoň 1 rok od dosažení této léčebné odpovědi, ale ne dále než 2 roky
- v případně biochemicky zjevné recidivy myelomu je vhodné obnovit podávání bisfosfonátů
- při středním a závažném selhání ledvin je nutná opatrnost a úprava dávek těchto preparátů
- před podáním bisfosfonátů je nutné stomatologické vyšetření včetně panoramatického snímku čelisti a vhodné jsou i pravidelné kontroly stomatologem, který je informován o riziku osteonekrózy
- v případě problematického chrupu s nutností četných extrakcí je na zvážení, co je pro pacienta závažnější, zda:
- provedení četných extrakcí i s očekávanými obtížemi při zajištění protetického řešení a podání bisfosfonátu
- nebo ponechání problematického chrupu bez extrakcí a nepodání bisfosfonátů
- v případně vzniku jedné ze 2 vzácných komplikací, osteonekrózy čelisti či atypické fraktury vlivem zvýšení křehkosti kostí, je na lékaři, aby zvážil další potenciální přínos pokračování podávání bisfosfonátů oproti riziku progrese nežádoucích účinků a dle toho se rozhodl, zda v léčbě pokračovat či léčbu bisfosfonáty raději ukončit
- při léčbě bisfosfonáty je třeba monitorovat hladiny kalcemie a včas substituovat kalcium a všem přidávat vitamin D
prof. MUDr. Zdeněk Adam, CSc.
adam.zdenek@fnbrno.cz
Interní hematologická a onkologická klinika LF MU a FN Brno, pracoviště Bohunice
www.fnbrno.cz
Doručeno do redakce 20. 3. 2017
Přijato po recenzi 24. 4. 2017
Zdroje
1. Russell RG. Bisphosphonates: the first 40 years. Bone 2011; 49(1): 2–19. Dostupné z DOI: <http://dx.doi.org/10.1016/j.bone.2011.04.022>.
2. Marx RE. Pamidronate (Aredia) and zoledronate (Zometa) induced avascular necrosis of the jaws: a growing epidemic. J Oral Maxillofac Surg 2003; 61(9): 1115–1117.
3. Ruggiero SL, Mehrota B, Rosenberg TJ et al. Osteonecrosis of the jaws associated with the use of bisphophonates; a review of 63 cases. J Oral Maxillofac Surg 2004; 62(5): 527–534.
4. Marx RE, Sawatari Y, Fortin M et al. Bisphosphonates-induced exposed bone (osteonecrosis/osteopetrosis) of the jaws: risk factors, recognition, prevention and treatment. J Oral Maxillofac Surg 2005; 63(11): 1567–1575.
5. Ferlito S, Liardo C, Puzzo S. Bisphosponates and dental implants: a case report and a brief review of literature. Minerva Stomatol 2011; 60(1–2): 75–81.
6. Montoya-Carralero JM, Parra-Mino P, Ramírez-Fernández P et al. Dental implants in patients treated with oral bisphosphonates: a bibliographic review. Med Oral Patol Oral Cir Bucal 2010; 15(1): e65-e69. Dostupné z DOI: <http://dx.doi.org/10.4317/medoral.15.e65>.
7. Favia G, Piattelli A, Sportelli P et al. Osteonecrosis of the posterior mandible after implant insertion: a clinical and histological case report. Clin Implant Dent Relat Res 2011; 13(1): 58–63. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1708–8208.2009.00181.x>.
8. Lenart BA, Lorich DG, Lane JM. Atypical fractures of the femoral diaphysis in postmenopausal women taking alendronate. N Engl J Med 2008; 358(12): 1304–1306. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMc0707493>.
9. Tonogai I, Goto T, Hamada D et al. Bilateral atypical femoral fractures in a patient with multiple myeloma treated with intravenous bisphosphonate therapy. Case Rep Orthop 2014; 2014 : 452418. Dostupné z DOI: <http://dx.doi.org/10.1155/2014/452418>.
10. Puhaindran ME, Farooki A, Steensma MR et al. Atypical subtrochanteric femoral fractures in patients with skeletal malignant involvement treated with intravenous bisphosphonates. J Bone Joint Surg Am 2011; 93(13): 1235–1242. Dostupné z DOI: <http://dx.doi.org/10.2106/JBJS.J.01199>.
11. Delmas PD, Charhon S, Chapuy E et al. Long term effects of dichloromethylene diphosphate (C12MDP) on skeletal lesions in multiple myeloma. Metab Bone Dis Relat Res 1982; 4(3): 163–168.
12. Lahtinen R, Laakso M, Palva I et al. Randomised, placebo controlled multicentre trial of clodronate in multiple myeloma. Finnish leukemia Group. Lancet 1992; 340(8827): 1049–1052. Erratum in Lancet 1992; 340(8832): 1420.
13. McCloskey EV, MacLennan IC, Drayson MT et al. A randomized trial of the effect of clodronate on skeletal morbitidy in multiple myeloma. MRC Working Party on Leukemia in Aduls. Brit J Haematol 1998; 100(2): 317–325.
14. Berenson JR, Lichtenstein A, Porter L et al. [Myeloma Aredia Study Group]. Efficacy of pamidronate in reducing skeletal events in patients with advanced multiple myeloma. N Engl J Med 1996; 334(8): 488–493.
15. Berenson JR, Lichtenstein A, Porter L et al. [Myeloma Aredia Study Group]. Long-term pamidronate treatment of advanced multiple myeloma patients reduces skeletal events. J Clin Oncol 1998; 16(2): 593–602.
16. Rosen LS, Gordon D, Tchekmedyian NS et al. Zoledronic acid versus placebo in the treatment of skeletal metastases in patients with lung cancer and other solid tumors: a phase III, double-blind, randomized trial – the Zoledronic Acid Lung Cancer and Other Solid Tumors Study Group. J Clin Oncol 2003; 21(16): 3150–3157.
17. Adam Z, Ševčík P, Vorlíček J et al. Kostní nádorová choroba. Grada: Praha 2005. ISBN 80–247–1357–8.
18. Menssen HD, Sakalová A, Fontana A et al. Effects of long-term intravenous ibandronate therapy on skeletal-related events, survival, and bone resorption markers in patients with advanced multiple myeloma. J Clin Oncol 2002; 20(9): 2353–2359.
19. Body JJ, Diel IJ, Lichinitser MR et al. Intravenous ibandronate reduces the incidence of skeletal complications in patients with breast cancer and bone metastases. Ann Oncol 2003; 14(9): 1399–1405.
20. Barrett-Lee P, Casbard A, Abraham J et al. Oral ibandronic acid versus intravenous zoledronic acid in treatment of bone metastases from breast cancer: a randomised, open label, non-inferiority phase 3 trial. Lancet Oncol 2014; 15(1): 114–122. Dostupné z DOI: <http://dx.doi.org/10.1016/S1470–2045(13)70539–4>. Erratum in Lancet Oncol 2014;15(2):e52-e53.
21. Body JJ, Lichinitser M, Tjulandin S et al. Oral ibandronate is as active as intravenous zoledronic acid for reducing bone turnover markers in women with breast cancer and bone metastases. Ann Oncol 2007; 18(7): 1165–1171. Erratum in Ann Oncol 2008; 19(3): 601.
22. Pecherstorfer M, Rivkin S, Body JJ et al. Long-term safety of intravenous ibandronic acid for up to 4 years in metastatic breast cancer: an open-label trial. Clin Drug Investig 2006; 26(6): 315–322.
23. Knauf W, Berger R, Kropff M et al. Compare – result of a randomised study to assess the renal safety and efficacy of ibandronate and zoledronate in multiple myeloma patients. Onkologie 2010; 33(Suppl 6): 246. Abstr. 824.
24. Geng CJ, Liang Q, Zhong JH et al. Ibandronate to treat skeletal-related events and bone pain in metastatic bone disease or multiple myeloma: a meta-analysis of randomised clinical trials. BMJ Open 2015; 5(6): e007258. Dostupné z DOI: <http://dx.doi.org/10.1136/bmjopen-2014–007258>.
25. Chen F, Pu F. Safety of Denosumab Versus Zoledronic Acid in Patients with Bone Metastases: A Meta-Analysis of Randomized Controlled Trials. Oncol Res Treat 2016; 39(7–8): 453–459. Dostupné z DOI: <http://dx.doi.org/10.1159/000447372>.
26. Raje N, Terpos E, Willenbacher W et al. An international randomised trial comparing denosumab with zoledronic acid for the treatment of bone disease in patients with newly diagnosed multiple myelom. 16th international myeloma workshop. March 1–4 2017, New Delhi. Abstr. OP-046 e39.
27. Rosen LS, Gordon D, Kaminski M et al. Zolendronic acid versus pamidronate in the treatment of skeletal metastases in patients with breast cancer or osteolytic lesions of multiple myeloma. A phase III double blind comparative trial. Cancer J 2001; 7(5): 377–387.
28. Gimsing P, Carlson K, Turesson I et al. Effect of pamidronate 30 mg versus 90 mg on physical function in patients with newly diagnosed multiple myeloma (Nordic Myeloma Study Group): a double-blind, randomised controlled trial. Lancet Oncol 2010; 11(10): 973–982. Dostupné z DOI: <http://dx.doi.org/10.1016/S1470–2045(10)70198–4>.
29. Morgan GJ, Davies FE, Gregory WM et al. First-line treatment with zoledronic acid as compared with clodronic acid in multiple myeloma (MRC Myeloma IX): a randomised controlled trial. Lancet 2010; 376(9757): 1989–1999. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(10)62051-X>.
30. Morgan GJ, Child JA, Gregory WM et al. Effects of zoledronic acid versus clodronic acid on skeletal morbidity in patients with newly diagnosed multiple myeloma (MRC Myeloma IX): secondary outcomes from a randomised controlled trial. Lancet Oncol 2011; 12(8): 743–752. Dostupné z DOI: <http://dx.doi.org/10.1016/S1470–2045(11)70157–7>.
31. Morgan GJ, Davies FE, Gregory WM et al. Effects of induction and maintenance plus long-term bisphosphonates on bone disease in patients with multiple myeloma: the Medical Research Council Myeloma IX Trial. Blood 2012; 119(23): 5374–5383. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2011–11–392522>.
32. Mhaskar R, Redzepovic J, Wheatley K et al. Bisphosphonates in multiple myeloma: a network meta-analysis. Cochrane Database Syst Rev 2012; (5): CD003188. Dostupné z DOI: <http://dx.doi.org/10.1002/14651858.CD003188.pub3>.
33. Fung P, Bedogni G, Bedogni A et al. Time to onset of bisphosphonate-related osteonecrosis of the jaws: a multicentre retrospective cohort study. Oral Dis 2017; ;23(4):477–483. Dostupné z DOI: <http://dx.doi.org/10.1111/odi.12632>.
34. Terpos E, Morgan G, Dimopoulos MA et al. International Myeloma Working Group recommendations for the treatment of multiple myeloma-related bone disease. J Clin Oncol 2013; 31(18): 2347–2357. Dostupné z DOI: <http://dx.doi.org/10.1200/JCO.2012.47.7901>.
35. Snowden JA, Ahmedzai SH, Ashcroft J et al. Guidelines for supportive care in multiple myeloma 2011. Br J Haematol 2011; 154(1): 76–103. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2141.2011.08574.x>.
36. Terpos E, Sezer O, Croucher PI et al. The use of bisphosphonates in multiple myeloma: recommendations of an expert panel on behalf of the European Myeloma Network. Ann Oncol 2009; 20(8): 1303–1317. Dostupné z DOI: <http://dx.doi.org/10.1093/annonc/mdn796>.
37. Kyle RA, Yee GC, Somerfield MR et al. American Society of Clinical Oncology 2007 clinical practice guideline update on the role of bisphosphonates in multiple myeloma. J Clin Oncol 2007; 25(17): 2464–2472.
38. García-Sanz R, Oriol A, Moreno MJ. [Spanish Myeloma Group (GEM/PETHEMA)]. Zoledronic acid as compared with observation in multiple myeloma patients at biochemical relapse: results of the randomized AZABACHE Spanish trial. Haematologica 2015; 100(9): 1207–1213. Dostupné z DOI: <http://dx.doi.org/10.3324/haematol.2015.128439>.
39. Witzig TE, Laumann KM, Lacy MQ et al. A phase III randomized trial of thalidomide plus zoledronic acid versus zoledronic acid alone in patients with asymptomatic multiple myeloma. Leukemia 2013; 27(1): 220–225. Dostupné z DOI: <http://dx.doi.org/10.1038/leu.2012.236>.
40. D’Arena G, Gobbi PG, Broglia C et al. Pamidronate versus observation in asymptomatic myeloma: final results with long-term follow-up of a randomized study. Leuk Lymphoma 2011; 52(5): 771–775. Dostupné z DOI: <http://dx.doi.org/10.3109/10428194.2011.553000>.
41. Musto P, Petrucci MT, Bringhen S et al. A multicenter, randomized clinical trial comparing zoledronic acid versus observation in patients with asymptomatic myeloma. Cancer 2008; 113(7): 1588–1595. Dostupné z DOI: <http://dx.doi.org/10.1002/cncr.23783>.
42. Henrich DM, Hoffmann M, Uppenkamp M et al. Tolerability of dose escalation of ibandronate in patients with multiple myeloma and end-stage renal disease: a case series. Onkologie 2009; 32(8–9): 482–486. Dostupné z DOI: <http://dx.doi.org/10.1159/000226141>.
43. Bergner R, Henrich DM, Hoffmann M et al. Renal safety and pharmacokinetics of ibandronate in multiple myeloma patients with or without impaired renal function. J Clin Pharmacol 2007; 47(8): 942–950.
44. Bergner R, Henrich DM, Hoffmann M et al. Therapy of hypercalcemia with ibandronate in case of acute renal failure. Internist (Berl) 2006; 47(3): 293–296.
45. Diel IJ, Weide R, Köppler H et al. Risk of renal impairment after treatment with ibandronate versus zoledronic acid: a retrospective medical records review. Support Care Cancer 2009; 17(6): 719–725. Dostupné z DOI: <http://dx.doi.org/10.1007/s00520–008–0553–7>.
46. Henrich D, Hoffmann M, Uppenkamp M et al. Ibandronate for the treatment of hypercalcemia or nephrocalcinosis in patients with multiple myeloma and acute renal failure: Case reports. Acta Haematol 2006; 116(3):165–172.
47. Jackson GH. Renal safety of ibandronate. Oncologist 2005; 10(Suppl 1): 14–18.
48. Epperla N, Pathak R. Hypocalcemia Secondary to Zoledronate Therapy in a Patient with Low Vitamin D Level. WMJ 2015; 114(4): 163–166.
49. Noriega Aldave AP, Jaiswal S .Severe resistant hypocalcemia in multiple myeloma after zoledronic acid administration: a case report. J Med Case Rep 2014; 8 : 353. Dostupné z DOI: <http://dx.doi.org/10.1186/1752–1947–8–353>.
50. Kreutle V, Blum C, Meier C et al. Bisphosphonate induced hypocalcaemia – report of six cases and review of the literature. Swiss Med Wkly 2014; 144: w13979. Dostupné z DOI: <http://dx.doi.org/10.4414/smw.2014.13979>.
51. Do WS, Park JK, Park MI et al. Bisphosphonate-induced Severe Hypocalcemia – A Case Report. J Bone Metab 2012; 19(2): 139–145. Dostupné z DOI: <http://dx.doi.org/10.11005/jbm.2012.19.2.139>.
52. Atula S, Powles T, Paterson A et al. Extended safety profile of oral clodronate after long-term use in primary breast cancer patients. Drugs Safety 2003; 26(9): 661–671.
53. Markowitz GS, Appel GB, Fine PL et al. Collapsing focal segmental glomerulosclerosis following treatment with high dose pamidronate. J Am Soc Nephrol 2001; 12(6): 1164–1172.
54. Markowitz GS, Fine, PL, Stack FJ et al. Toxic acute tubular necrosis following treatment with zolendronate (Zometa). Kidney Int 2003; 64(1): 281–289.
55. Sauter M, Jülg B, Porubsky S et al. Nephrotic-range proteinuria following pamidronate therapy in a patient with metastatic breast cancer: Mitochondrial toxicity as a pathogenetic concept? Amer J Kidney Dis 2006; 47(6): 1075–1080.
56. Ruggiero SL, Dodson TB, Fantasia J et al. American association of oral and maxillofacial surgeons position paper on medication related osteonecrosis of the jaw 2014 update. J Oral Maxillofac Surg 2014; 72(10): 1938–1956. Dostupné z DOI: <http://dx.doi.org/10.1016/j.joms.2014.04.031>.
57. Rosella D, Papi P, Giardino R. Medication-related osteonecrosis of the jaw: Clinical and practical guidelines. J Int Soc Prev Community Dent 2016; 6(2): 97–104. Dostupné z DOI: <http://dx.doi.org/10.4103/2231–0762.178742>.
58. Fusco V, Santini D, Armento G et al. Osteonecrosis of jaw beyond antiresorptive (bone-targeted) agents: new horizons in oncology. Expert Opin Drug Saf 2016; 15(7): 925–935. Dostupné z DOI: <http://dx.doi.org/10.1080/14740338.2016.1177021>.
59. Qi WX, Tang LN, He AN et al. Risk of osteonecrosis of the jaw in cancer patients receiving denosumab: a meta-analysis of seven randomized controlled trials. Int J Clin Oncol 2014; 19(2):403–410. Dostupné z DOI: <http://dx.doi.org/10.1007/s10147–013–0561–6>.
60. Estilo CL, Fornier M, Farooki A et al. Osteonecrosis of the jaw related to bevacizumab. J Clin Oncol 2008; 26(24): 4037–4038. Dostupné z DOI: <http://dx.doi.org/10.1200/JCO.2007.15.5424>.
61. Greuter S, Schmid F, Ruhstaller T et al. Bevacizumab-associated osteonecrosis of the jaw. Ann Oncol 2008; 19(12): 2091–2092. Dostupné z DOI: <http://dx.doi.org/10.1093/annonc/mdn653>.
62. Brunello A, Saia G, Bedogni A et al Worsening of osteonecrosis of the jaw during treatment with sunitinib in a patient with metastatic renal cell carcinoma. Bone 2009; 44(1): 173–175. Dostupné z DOI: <http://dx.doi.org/10.1016/j.bone.2008.08.132>.
63. Koch FP, Walter C, Hansen T et al. Osteonecrosis of the jaw related to sunitinib. Oral Maxillofac Surg 2011; 15(1): 63–66. Dostupné z DOI: <http://dx.doi.org/10.1007/s10006–010–0224-y>.
64. Fusco V, Porta C, Saia G et al. Osteonecrosis of the Jaw in Patients with Metastatic Renal Cell Cancer Treated With Bisphosphonates and Targeted Agents: Results of an Italian Multicenter Study and Review of the Literature. Clin Genitourin Cancer 2015; 13(4): 287–294. Dostupné z DOI: <http://dx.doi.org/10.1016/j.clgc.2014.12.002>.
65. Mawardi H, Enzinger P, McCleary N et al. Osteonecrosis of the jaw associated with ziv-aflibercept. J Gastrointest Oncol 2016; 7(6): E81-E87. Dostupné z DOI: <http://dx.doi.org/10.21037/jgo.2016.05.07>. Erratum to “Osteonecrosis of the jaw associated with ziv-aflibercept”. [J Gastrointest Oncol. 2017].
66. Marino R, Orlandi F, Arecco F et al. Osteonecrosis of the jaw in a patient receiving cabozantinib. Aust Dent J 2015; 60(4): 528–531. Dostupné z DOI: <http://dx.doi.org/10.1111/adj.12254>.
67. Garuti F, Camelli V, Spinardi L et al. Osteonecrosis of the jaw during sorafenib therapy for hepatocellular carcinoma. Tumori 2016; 102(Suppl 2). Dostupné z DOI: <http://dx.doi.org/10.5301/tj.5000504>.
68. Giancola F, Campisi G, Lo Russo L et al. Osteonecrosis of the jaw related to everolimus and bisphosphonate: a unique case report? Ann Stomatol (Roma) 2013; 4(Suppl 2): 20–21.
69. Kim DW, Jung YS, Park HS et al. Osteonecrosis of the jaw related to everolimus: a case report. Br J Oral Maxillofac Surg 2013; 51(8): e302-e304. Dostupné z DOI: <http://dx.doi.org/10.1016/j.bjoms.2013.09.008>.
70. Durie BG, Katz, M, Crowley J. Osteonecrosis of the jaw and bisphosphonate. N Engl J Med 2005; 353(1): 99–102.
71. Bamias A, Kastritis E, Bamia C et al. Osteonecrosis of the jaw in cancer after treatment with bisphosphonates: incidence and risk factors. J Clin Oncol 2005; 23(34): 8580–8587.
72. Bedogni A, Fusco V, Agrillo A et al. Learning from experience. Proposal of a refined definition and staging system for bisphosphonate-related osteonecrosis of the jaw (BRONJ) Oral Dis 2012; 18(6): 621–623. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1601–0825.2012.01903.x>.
73. Fedele S, Bedogni G, Scoletta M et al. Up to a quarter of patients with osteonecrosis of the jaw associated with antiresorptive agents remain undiagnosed. Br J Oral Maxillofac Surg 2015; 53(1): 13–17. Dostupné z DOI: <http://dx.doi.org/10.1016/j.bjoms.2014.09.001>.
74. Marx RE. Oral and Intravenous Bisphosphonate-Induced Osteonecrosis of the Jaw. Quintessence: Chicago 2007.
75. Ruggiero SL, Dodson TB, Assael LA et al. American Association of oral and maxillofacial surgeons position paper on bisphosphonate-related osteonecrosis of the jaws – 2009 update. J Oral Maxillofac Surg 2009; 67(5 Suppl): 2–12. Dostupné z DOI: <http://dx.doi.org/10.1016/j.joms.2009.01.009>.
76. Damm DD, Jones DM. Bisphosphonate-related osteonecrosis of the jaws: A potential alternative to drug holidays. Gen Dent 2013; 61(5): 33–38.
77. Hellstein JW, Adler RA, Edwards B et al. Managing the care of patients receiving antiresorptive therapy for prevention and treatment of osteoporosis: Executive summary of recommendations from the American Dental Association Council on Scientific Affairs. J Am Dent Assoc 2011; 142(11): 1243–1251.
78. Walter C, Al-Nawas B, Wolff T et al. Dental implants in patients treated with antiresorptive medication – a systematic literature review. Int J Implant Dent 2016; 2(1): 9.
79. de-Freitas NR, Lima LB, de Moura MB et al. Bisphosphonate treatment and dental implants: A systematic review. Med Oral Patol Oral Cir Bucal 2016; 21(5): e644-e651.
80. Rugani P, Acham S, Kirnbauer B et al. Stage-related treatment concept of medication-related osteonecrosis of the jaw-a case series. Clin Oral Investig 2015; 19(6): 1329–1338. Dostupné z DOI: <http://dx.doi.org/10.1007/s00784–014–1384–1>.
81. Visekruna M, Wilson D, McKiernan FE. Severely suppressed bone turnover and atypical skeletal fragility. J Clin Endocrinol Metab 2008; 93(8): 2948–2952. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2007–2803>.
82. Kwek EB, Koh JS, Howe TS. More on atypical fractures of the femoral diaphysis. N Engl J Med 2008; 359(3): 316–317. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMc080861>.
83. Lee P, Seibel MJ. More on atypical fractures of the femoral diaphysis. N Engl J Med 2008; 359(3): 317–318.
84. Whyte MP. Atypical femoral fractures, bisphosphonates, and adult hypophosphatasia. J Bone Miner Res 2009; 24(6): 1132–1134. Dostupné z DOI: <http://dx.doi.org/10.1359/jbmr.081253>.
85. Black DM, Kelly MP, Genant HK et al. [Fracture Intervention Trial Steering Committee; HORIZON Pivotal Fracture Trial Steering Committee]. Bisphosphonates and fractures of the subtrochanteric or diaphyseal femur. N Engl J Med 2010; 362(19): 1761–1771. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1001086>.
86. Breglia MD, Carter JD. Atypical insufficiency fracture of the tibia associated with long-term bisphosphonate therapy. J Clin Rheumatol 2010; 16(2): 76–78. Dostupné z DOI: <http://dx.doi.org/10.1097/RHU.0b013e3181cf3e3d>.
87. Schneider JP. Should bisphosphonates continued indefinitely. An unusual fracture in healthy woman and long-term bisphosphonate. Geriatrics 2006; 61(1): 31–33.
88. Wernecke G, Namduri S, DiCarlo EF et al. Case report of spontaneous nonspinal fracture in multiple myeloma pacient on long term pamidronate and zoledronic acid. HSS J 2008; 4(2): 123–127. Dostupné z DOI: <http://dx.doi.org/10.1007/s11420–008–9077–4>.Erratum in HSS J; 5(2): 204.
89. Grasko JM, Hermann RP, Vasikaran SD. Recurrent low-energy femoral Shift fractures and osteonecrosis of the jaw in a case of multiple myeloma treated with bisphosphonates. J oral Maxillofac Surg 2009; 67(3): 645–649. Dostupné z DOI: <http://dx.doi.org/10.1016/j.joms.2008.11.005>.
90. Waterman GN, Yellin O, Jamshidinia K et al. Metatarsal stress fractures in patients with multiple myeloma treated with long-term bisphosphonates: a report of six cases. J Bone Joint Surg Am 2011; 93(18): e106. Dostupné z DOI: <http://dx.doi.org/10.2106/JBJS.J.00455>.
91. Adam Z, Sprláková-Puková A, Chaloupka R et al. Atypická fraktura metatarsální kostni u pacienta s mnohočetným myelomem, který byl dlouhodobě léčen bisfosfonáty. Vnitř Lék 2013; 59(11): 1022–1026.
92. Adam Z, Kozumplíková M, Pour L et al. Osteonekróza čelisti v průběhu podávání léčby mnohočetného myelomu bisfosfonáty. Vnitř Lék 2006; 52(2): 176–180.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2017 Číslo 5- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Prof. MUDr. Richard Češka, CSc., FACP, FEFIM, předseda České internistické společnosti České lékařské společnosti Jana Evangelisty Purkyně, šedesátiletý
- K šedesátinám Richarda Češky
- Poznámky ke střevní tuberkulóze – editorial
- Současný pohled na ivabradin v léčbě kardiovaskulárních onemocnění
- Osteoprotektivní léčba bisfosfonáty nebo denosumabem u nemocných s mnohočetným myelomem: přínos a rizika
- Zamyšlení nad chlopenními vadami včera a dnes
- Čo nám hovorí klinická štúdia GLAGOV?
- Novinky v léčbě hypertenze a dyslipidemie
- Cévní ektázie žaludečního antra a syndrom solitárního rektálního vředu – dvě vzácné diagnózy jako příčina anémie u téhož pacienta: kazuistika
- Záchrana diabetické nohy komplexní individualizovanou léčbou diabetika 2. typu: kazuistika
- Akutní lymfoblastická leukemie dospělých – případ dlouhého došetřování bolestí kyčlí s překvapivým závěrem: kazuistika
- Je to znovu střevní tuberkulóza? Kazuistika
- Stanovisko panelu expertů odborných společností k použití tikagreloru v léčbě akutních koronárních syndromů u nemocných se sníženou renální funkcí
- Mezioborové panelové diskuse společnosti Boehringer Ingelheim v rámci XXV. výročního sjezdu České kardiologické společnosti
- Doc. MUDr. Jozef Kollár, DrSc., osemdesiatpäťročný
- Korespondence ke článku
- Korespondence ke článku
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Osteoprotektivní léčba bisfosfonáty nebo denosumabem u nemocných s mnohočetným myelomem: přínos a rizika
- Akutní lymfoblastická leukemie dospělých – případ dlouhého došetřování bolestí kyčlí s překvapivým závěrem: kazuistika
- Je to znovu střevní tuberkulóza? Kazuistika
- Zamyšlení nad chlopenními vadami včera a dnes
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



