Možnosti stanovení likvorového tripletu tau proteinů a β-amyloidu 42 metodami ELISA a orientační normativní vodítka
Determination of tau proteins and β-amyloid 42 in cerebrospinal fl uid by ELISA methods and preliminary normative values
Aim: The aim of the study was to compare ELISA methods for determination of triplet protein levels – total (t-tau) and phosphorylated tau (p-tau) proteins and β-amyloid (1 – 42) (Aβ42) in cerebrospinal fluid (CSF) from manufacturers Fujirebio and EUROIMMUN; and to provide guidance for normal concentrations from cognitively healthy elderly people.
Patients and methods: The group consisted of 38 cognitively healthy persons over 55 years of age (19 men) whose average age was 67 ± 8 years. In each CSF sample, we examined the protein triplet by both ELISA INNOTEST and EUROIMMUN AG kits.
Results: A comparison of ELISA methods for determination of t-tau and p-tau proteins and Aβ42 using the Bland and Altman difference graph shows that the differences between methods, with the exception of isolated outliers, were within the range of compliance (mean ± 1.96 SD). Correlation coefficient values suggest significant agreement for t-tau protein assay kits. Based on our results and experience, we propose to classify CSF concentrations into three groups: 1. decreased; 2. questionable and borderline; 3. increased concentrations in ng/ L based on our consensus as follows: t-tau protein < 280 – 400 >, p181-tau protein < 50 – 60 > and Aβ42 < 430 – 480 >.
Conclusion: ELISA kits from two producers are suitable for determination of the triplet proteins in CSF. Our results based on real measurements of samples of carefully selected and examined healthy elderly people from the Czech Republic or the norms based on our consensus recommendation can be used as reference range of the triplet.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
ELISA法测定脑脊液中tau蛋白和β-淀粉样蛋白42的初步标准值
目的:本研究的目的是比较ELISA方法测定脑脊液中三联体蛋白水平–总蛋白(t-tau)和磷酸化tau(p-tau)蛋白以及β-淀粉样蛋白(1 - 42)(Aβ42)的水平( CSF),来自制造商Fujirebio和EUROIMMUN;并为认知健康的老年人提供正常浓度的指导。
患者和方法:该组由55岁以上的38名认知健康者(19名男性)组成,平均年龄为67±8岁。在每个CSF样本中,我们都通过ELISA INNOTEST和EUROIMMUN AG试剂盒检查了蛋白质三联体。
结果:使用Bland和Altman差异图对ELISA方法测定t-tau和p-tau蛋白以及Aβ42的比较显示,除孤立的异常值外,方法之间的差异均在适应性范围内(平均值± 1.96 SD)。相关系数值表明t-tau蛋白测定试剂盒具有显着一致性。根据我们的结果和经验,我们建议将脑脊液浓度分为三组:1.降低; 2.可疑3边界;.根据我们的共识,增加的ng / L浓度如下:t-tau蛋白<280 – 400>,p181-tau蛋白<50 – 60>和Aβ42<430 – 480>。
结论:两个生产商的ELISA试剂盒适用于测定CSF中的三联体蛋白。我们基于对捷克共和国经过精心挑选和检查的健康老年人的样本的真实测量结果得出的结果,或者根据我们的共识推荐得出的规范,可以用作三元组的参考范围。
关键词:阿尔茨海默氏病–β-淀粉样肽1-42 –脑脊液 – ELISA – tau蛋白
Keywords:
Alzheimer‘s disease – cerebrospinal fluid – β-amyloid peptide 1-42 – ELISA – tau proteins
Authors:
A. Bartoš 1,2; M. Smětáková 3; J. Říčný 2; L. Nosková 4; L. Fialová 4
Authors‘ workplace:
Neurologická klinika 3. LF UK, a FN Královské Vinohrady, Praha
1; Národní ústav duševního zdraví, Klecany
2; Národní referenční laboratoř lidských, prionových chorob – imunologie, Ústav patologie a molekulární, medicíny 3. LF UK a Thomayerovy, nemocnice v Praze
3; Ústav lékařské biochemie a laboratorní, diagnostiky, 1. LF UK a VFN, Praha
4
Published in:
Cesk Slov Neurol N 2019; 82(5): 533-540
Category:
Original Paper
doi:
https://doi.org/10.14735/amcsnn2019533
Overview
Cíl: Cílem práce bylo porovnat metody ELISA pro stanovení hladin tripletu proteinů – celkového (t-tau) a fosforylovaného tau (p-tau) proteinů a β-amyloidu (1 – 42) (Aβ42) v mozkomíšním moku (MMM) od dvou výrobců Fujirebio a EUROIMMUN a zároveň vytvořit orientační vodítka pro normální koncentrace u české populace od kognitivně zdravých starších osob.
Soubor a metodika: Koncentrace likvorového tripletu proteinů od 38 kognitivně zdravých osob starších 55 let (19 mužů, průměrný věk 67 ± 8 let) byly změřeny jak soupravami ELISA INNOTEST, tak soupravami EUROIMMUN AG.
Výsledky: Výsledky srovnání metod pro t-tau a p-tau proteiny a Aβ42 pomocí rozdílového grafu dle Blanda a Altmana ukazují, že hodnoty rozdílů mezi metodami ležely v rozsahu limitů shody (průměr ± 1,96 SD) až na ojedinělé výjimky odlehlých hodnot. Hodnoty korelačních koeficientů svědčí pro významnou shodu pro soupravy na stanovení t-tau proteinu. Na základě našich výsledků a zkušeností navrhujeme rozdělit koncentrace likvorového tripletu na tři skupiny: 1. snížené; 2. nerozhodné a hraniční; 3. zvýšené koncentrace v ng/ l na základě našeho konsenzu takto: t-tau protein < 280 – 400 >, p181-tau protein < 50 – 60 > a Aβ42 < 430 – 480 >.
Závěr: Soupravy ELISA obou výrobců jsou vhodné ke stanovení tripletu proteinů v MMM. Pro jejich referenční rozmezí lze orientačně využít naše výsledky, založené na reálném měření vzorků pečlivě vybraných a vyšetřených zdravých starších osob z ČR, nebo normy na základě našeho společného názoru.
Klíčová slova:
Alzheimerova nemoc – β-amyloid peptid 1-42 – mozkomíšní mok – ELISA – tau proteiny
Úvod
Alzheimerova nemoc (AN) patří k k závažným neurodegenerativním onemocněním, která se projevují narušením kognitivních funkcí a poklesem soběstačnosti. Pacientů s tímto onemocněním přibývá a odhaduje se, že v ČR by v roce 2020 mohlo žít až kolem 183 tisíc lidí s AN nebo jinou formou demence [1]. Vzhledem k tomu, že dosud neexistuje účinná léčba, představuje péče o pacienty s AN závažný zdravotnický a sociální problém. Na vývoj nových léků, které by zabraňovaly vzniku neuropatologických změn v mozku, se soustřeďuje úsilí mnoha vědeckých a farmakologických týmů. Intenzivní výzkum v oblasti farmakoterapie AN je úzce navázán i na zdokonalování časné a přesné diagnostiky AN a její klasifikace [2,3].
V našich podmínkách se diagnóza AN opírá o kombinaci nálezů z několika zdrojů. Jedná se o klinické vyšetření, krátké kognitivní testy a neuropsychologické metody a zhodnocení soběstačnosti [4]. Dále k diagnostickému procesu přispívají zobrazovací metody – MR, popř. CT mozku, které diagnózu AN podpoří nálezem mediotemporální nebo parietální atrofie a v rámci diferenciální diagnostiky odhalí jiné příčiny demence. V omezené míře je využíváno i SPECT (Single-Photon Emission Computed Tomography) mozku pro průkaz parietální nebo mediotemporální hypoperfuze [5 – 10]. Nově se v ČR může vyšetřovat mozek pomocí amyloidní PET [11].
Významným doplňkem k těmto metodám jsou i biochemická vyšetření zahrnující stanovení hladin celkového (t-tau) a fosforylovaného tau (p-tau) proteinu a β-amyloidu (1 – 42) (Aβ42) tvořící dohromady tzv. likvorový triplet [12]. Jako perspektivní se jeví výpočty poměrů t-tau/ Aβ42 a p-tau/ Aβ42, které vykazují výpovědní hodnotu srovnatelnou s mnohem dražším vyšetřením beta-amyloidové nálože pomocí PET mozku [13]. Kromě toho se hledají další ukazatele (např. oligomerní formy tau nebo neurofilamenta) nebo známky imunologické reakce v podobě protilátek proti tau proteinu či neurofilamentům. Sílí pokusy je stanovit nejen v mozkomíšním moku (MMM), ale také v séru u různých neurologických onemocnění [12,14 – 29].
Likvorový triplet proteinů odráží neuropatologické změny prokazované v mozku nemocných s AN – tvorbu senilních plaků a neurofibrilárních smotků společně s neurodegenerativními změnami [5,14]. Nedávná metaanalýza potvrdila, že uvedené tři proteiny stanovené v MMM patří mezi biomarkery, které nejlépe diferencují pacienty s rozvinutou AN nebo mírnou kognitivní poruchou od kontrolních osob [30].
Peptid Aβ42 tvořený 42 aminokyselinovými zbytky je jedním ze zástupců rodiny peptidů, které vznikají štěpením většího transmembránového amyloidového prekurzorového proteinu [31]. Aβ42 je peptid, který vzhledem ke své struktuře má tendenci vytvářet fibrily a následně agregovat. Je základní složkou nerozpustných extracelulárně uložených senilních plaků popisovaných u AN, ale i u non-AN demencí. Pokles hladin Aβ42 v MMM u AN je vysvětlován zapojením Aβ42 do polymerních struktur, popř. i jinými mechanizmy, zatím na úrovni hypotéz [14,32,33].
Tau protein je neurocytoskeletální protein, hojně zastoupený zejména v axonální části neuronů. Váže se na mikrotubuly a přispívá k jejich stabilizaci. Afinitu k mikrotubulům snižuje abnormální hyperfosforylace tau proteinu. Nenavázané molekuly hyperfosforylovaného tau proteinu vzájemně agregují za vzniku párových helikálních filament, které mohou vytvářet intraneuronálně uložené neurofibrilární smotky [5,32]. Tau protein může být fosforylován na mnoha místech molekuly, ale ve většině klinicky zaměřených studiích je pozornost věnována tau proteinu fosforylovaném na treoninu 181 (p181-tau) [30,33]. Na rozdíl od Aβ42 jsou koncentrace celkového i fosforylovaného tau proteinu v MMM u nemocných s AN zvýšeny [30]. Nárůst koncentrace celkového tau proteinu je nespecifický projev neuronálního, resp. axonálního poškození, a to nikoliv pouze u neurodegenerativních onemocnění. Naproti tomu zvýšené hladiny p-tau proteinu mají užší vztah ke specifičtějším neuropatologickým změnám u AN, kterými je tvorba neurofibrilárních smotků [33].
Pro stanovení uvedeného tripletu proteinů v MMM jsou k dispozici různé analytické metody [33]. V současnosti jsou v naší republice pro rutinní stanovení jednotlivých proteinů tripletu v MMM využívány metody ELISA.
Naše sdělení navazuje na předchozí práci [12], která uváděla první zkušenosti se stanovením tau proteinů (t-tau a p181-tau) a peptidu Aβ42 v MMM soupravami ELISA INNOTEST (Innogenetics, nyní Fujirebio, Gent, Belgie) a formulovala hraniční koncentrace pro uvedené analyty. Rozhodli jsme se získat zkušenosti i s jinými soupravami ELISA, stejně jako jsme učinili v minulosti pro tau protein [34], a provést jejich srovnání. Jako vhodná alternativa se nám jevilo použití souprav ELISA firmy EUROIMMUN AG (Lübeck, Německo), která má rovněž v nabídce soupravy pro stanovení všech tří proteinů likvorového tripletu jako společnost Fujirebio. Podobně jako soupravy INNOTEST jsou validovány pro in vitro diagnostiku. Pro soupravy EUROIMMUN nejsou dostupné referenční meze, které by byly pro všechny tři analyty vyjádřeny jednotným způsobem. Proto jsme se pokusili vytvořit orientační vodítka pro normální koncentrace od přísně vybraných zdravých starších osob. Hodnoty pro jednotlivé biomarkery jsme doplnili i o poměry t-tau/ Aβ42 a p-tau/ Aβ42.
Soubor a metodika
Pacienti
Pro účely srovnání souprav tvořilo náš soubor 38 pacientů starších 55 let (19 mužů), jejichž průměrný věk byl 67 ± 8 let. Tyto osoby byly vzácní pacienti, u nichž se ve vyšším věku indikovala lumbální punkce z diagnostických důvodů. Podle několika klinických a likvorových kritérií bylo z většího souboru vybráno 30 pacientů (15 mužů; průměrný věk byl 67 ± 8 let), kteří byli zařazeni do skupiny kognitivně zdravých. Hlavní podmínkou byly normální kognitivní funkce, likvorové nálezy a diagnózy, u nichž jsme nepředpokládali větší mozkové poškození. Mezi takové diagnózy patřily např. periferní parézy faciálního nervu, polyneuropatie, pseudoradikulární iritace při artralgii a koxartróze nebo olistézy. Přitom jsme se přidržovali evropských doporučení k sestavení kontrolní skupiny, na nichž se podílel jeden z autorů [35]. U všech jedinců byly hodnoceny kognitivní funkce pomocí testů MMSE (Mini Mental State Examination). Další podrobnější kognitivní vyšetření bylo provedeno českou verzí Addenbrookského kognitivního testu (ACE-CZ). Skóry obou testů u našich pacientů byly v pásmu nedávno publikovaných českých norem (průměr ± SD; MMSE: 29 ± 1 bodů, rozmezí 27 – 30 bodů; ACE-CZ: 94 ± 4,6 bodů, rozmezí 87 – 100 bodů) [36 – 39]. Tito pacienti měli zároveň v MMM počet erytrocytů nižší než 500 (skoro všichni 0) v µl podle mezinárodních doporučení [41], nižší počet leukocytů než 20/ µl a proteinorhachii nižší než 0,6 g/ l.
Pro stanovení orientačních norem jsme provedli další pečlivý výběr 15 osob ve vyšším věku (9 žen) pro skupinu kognitivně zdravých s normálním likvorem. Lumbální punkce u nich byla indikována z klinických důvodů (např. pro periferní parézu n. VII a jiné parézy, polyneuropatie nejasné etiologie). Vybrané osoby splňovaly tato přísná vstupní a vylučující kritéria: vyšší věk > 55 let (průměrný věk 63 ± 6 let), normální nález v MMM [41], normální likvorový triplet podle koncentrací publikovaných Bartošem et al [12], normální výsledky MMSE (27 – 30 bodů) a ACE-CZ (87 – 100 bodů) podle českých norem [36 – 39] a u většiny bylo provedeno vyšetření mozku pomocí MR.
U vybraných osob byla standardním způsobem provedena lumbální punkce jako součást diagnostického procesu v rámci diferenciální diagnostiky neurologických onemocnění bez kognitivní poruchy. Při odběru a manipulaci s MMM byl dodržován doporučený preanalytický postup [40]. Alikvoty MMM určené pro vyšetření tripletu proteinů byly uchovávány při – 80 °C do provedení analýzy.
Studie byla schválena etickou komisí FN Královské Vinohrady. Všichni pacienti podepsali informovaný souhlas.
Metody
V každém vzorku MMM pacientů našeho souboru jsme vyšetřili triplet proteinů (t-tau protein, p181-tau protein a Aβ42) jak soupravami ELISA INNOTEST, tak soupravami EUROIMMUN AG. Stanovení tripletu soupravami od uvedených výrobců bylo provedeno ve dvou různých laboratořích v jiném čase různými laboratorními pracovníky. Výjimku tvořila souprava pro stanovení p181-tau proteinu od firmy Fujirebio, která byla z níže uvedených důvodů použita v obou laboratořích. Při zpracování všech souprav jsme se řídili pokyny uvedenými v přiložených návodech.
Pracovní postup byl podobný u všech použitých souprav ELISA, které jsou určeny pro analýzy v MMM. Do jamek mikrotitračních proužků, na jejichž dně je navázána příslušná vychytávací („capture“) monoklonální protilátka, jsou přidávány vzorky, popř. kalibrátory a kontrolní vzorky společně s biotinylovanými signálními monoklonálními protilátkami. Po inkubaci a po následném odstranění nenavázaných složek v jamce je biotin detekován pomocí dalšího konjugátu, kterým je streptavidin značený peroxidázou. Po uplynutí další inkubace, kdy probíhá reakce mezi biotinem a streptavidinem, a po promytí jamek je peroxidáza prokázána pomocí substrátu, kterým je tetrametylbenzidin a peroxid vodíku. Zpracování souprav EUROIMMUN a soupravy INNOTEST pro Aβ42 je rozvrženo na jeden den, u souprav INNOTEST pro t-tau protein a p181-tau protein je zařazena jedna inkubace přes noc. Hodnoty variačních koeficientů pro přesnost ve stanovení (intra-assay) a mezi stanoveními (inter-assay) uváděné výrobci nepřesahují 10 %.
Jednotlivé vzorky MMM a kalibrátory byly v našich experimentech analyzovány v duplikátech. Pro validaci a vnitřní kontrolu jsou součástí souprav dva kontrolní vzorky pohybující se v nižších a vyšších koncentracích pro příslušné proteiny. Ty byly rovněž zpracovávány v duplikátech. Při všech analýzách se zjištěné hodnoty kontrolních vzorků pohybovaly v deklarovaných rozmezích. Měření absorbancí pro soupravy INNOTEST bylo provedeno na přístroji Infinite M200 Pro (Tecan Group Ltd., Männedorf, Švýcarsko), pro soupravy EUROIMMUN a INNOTEST pro p181-tau protein na přístrojích EL800 (BioTek® Instruments, Inc., Winooski, VT, USA) a DYNAREAD (DYNEX TECHNOLOGIES, spol. s r.o., Buštěhrad, ČR).
Statistická analýza
Normální rozložení výsledků jednotlivých parametrů jsme hodnotili D‘Agostinovo-Pearsonovým testem. U některých analytů základního souboru bylo normální rozložení zamítnuto, a proto pro další analýzy byly využity především neparametrické metody. Koncentrace jednotlivých proteinů likvorového tripletu vyšetřené dvěma různými soupravami ELISA, byly srovnávány pomocí Spearmannova korelačního koeficientu. Další porovnání souprav bylo prováděno za použití Passing-Bablokovy regrese a rozdílového grafu dle Blanda a Altmana podobně jako v našem podobném předchozím sdělení [34,42,43]. U Blandova-Altmanova rozdílového grafu se na osu Y nanáší rozdíl hodnot získaných měřením testovanými metodami (x – y) a na osu X jejich průměr (x + y) / 2. Do grafu se vyznačují linie, které představují průměr rozdílů a další přímky znázorňující limity shody (interval průměr ± 1,96 SD). Pokud diference opakovaných měření nepřekračují dané hranice, lze měření označit za reprodukovatelné [42,44]. Passing-Bablokova regrese je neparametrická metoda, která je odolnější vůči odlehlým hodnotám [44]. Ke statistické analýze jsme využili i výpočet konkordančního korelačního koeficientu, který je možný aplikovat pro srovnání používané metody s metodou nově zaváděnou. Je doporučován místo Spearmannova nebo Pearsonova korelačního koeficientu [45]. Výsledky byly hodnoceny jako statisticky významné při p < 0,05. Pro vyjádření orientačních vodítek normálního rozmezí jsme použili vyjádření prostřednictvím mediánu a 10. a 90. percentilů a dále robustní metodu podle dokumentu CLSI (Clinical and Laboratory Standards Institute) C28 – A3 doporučenou pro hodnocení menších souborů [46]. Pro statistické zpracování a vytvoření grafů byl použit software MedCalc (MedCalc, Ostende, Belgie).
Výsledky
Výsledky srovnání metod pomocí rozdílového grafu dle Blanda a Altmana ukazují, že hodnoty rozdílů pro t-tau protein s výjimkou dvou odlehlých hodnot ležely v rozsahu limitů shody (průměr ± 1,96 SD), pro p181-tau protein mimo hranice limitů shody byla nalezena pouze jedna hodnota a pro Aβ42 čtyři hodnoty (obr. 1A – C). Z grafů jsou zřejmé i odchylky průměrných diferencí od nuly u všech analytů, které jsou nejméně vyjádřeny pro p181-tau protein. Koncentrace t-tau proteinu analyzované soupravou EUROIMMUN byly vyšší než u soupravy INNOTEST, zatímco koncentrace Aβ42 měřené soupravou EUROIMMUN byly nižší než ty, které byly získány soupravami INNOTEST.
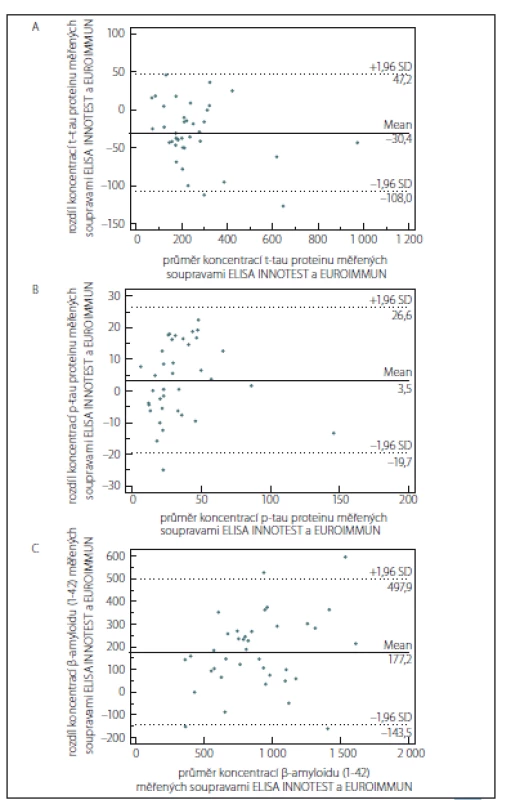
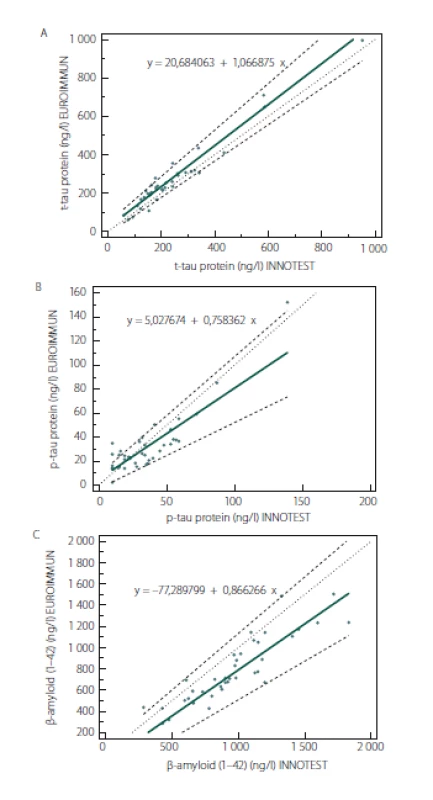
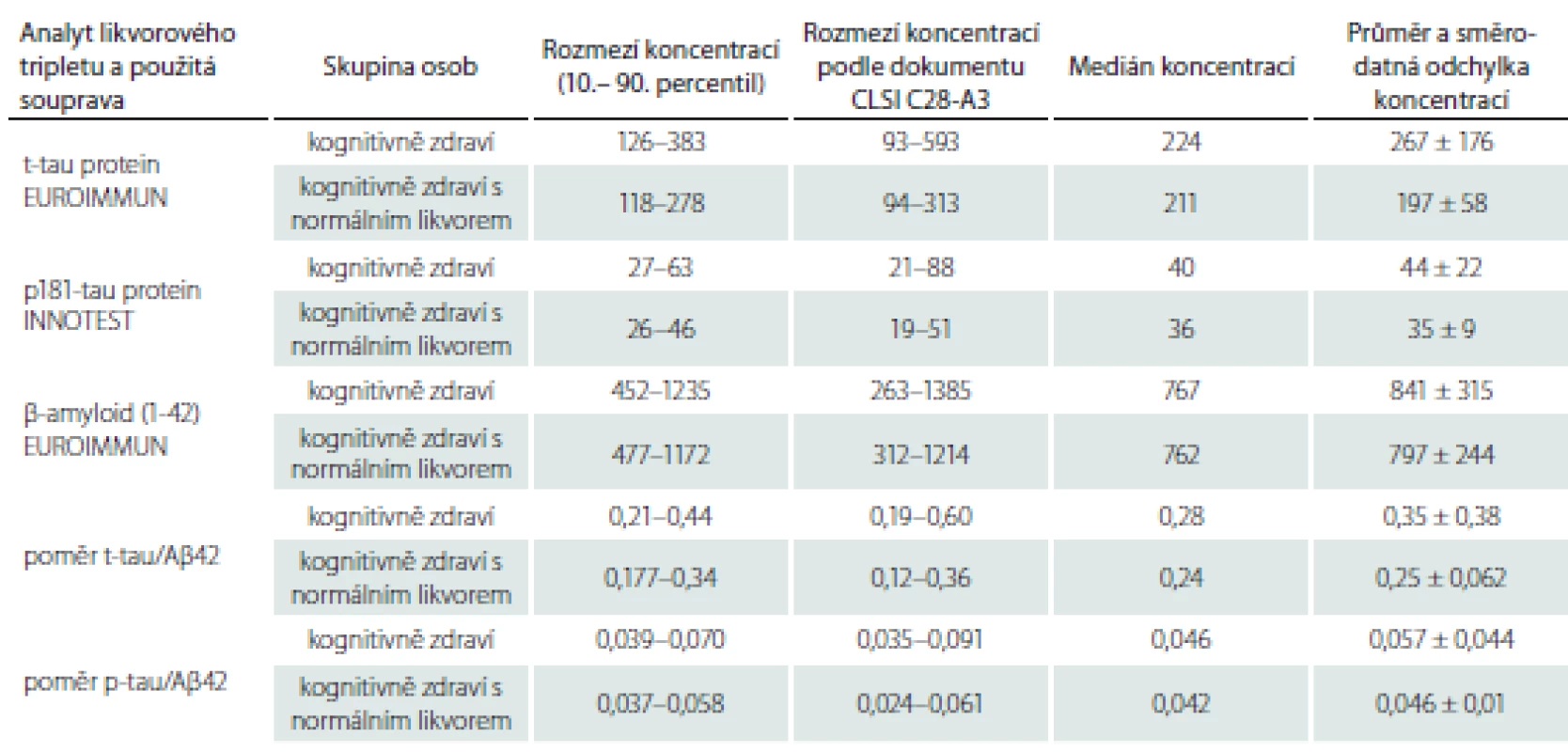
Passing-Bablokova regresní analýza neprokázala ani u jednoho analytu významnou odchylku od linearity. 95% intervaly spolehlivosti pro úsek (intercept) regresní přímky pro všechny parametry zahrnovaly 0. Podobně 95% intervaly spolehlivosti pro směrnici s výjimkou směrnice regresní přímky pro p181-tau protein obsahovaly 1. Z toho vyplývá, že srovnání metod ELISA pro stanovení t-tau proteinu a Aβ42 neodhalilo systematickou a proporcionální chybu, pro stanovení p-tau proteinu byla zjištěna hraniční proporcionální chyba (obr. 2A – C). Hodnoty Spearmannových (t-tau protein: r = 0,93; p-tau protein: r = 0,72; Aβ42: r = 0,91; p < 0,0001 pro všechny koeficienty) a konkordančních korelačních koeficientů (t-tau protein: r = 0,96; p-tau protein: r = 0,89; Aβ42: r = 0,76) svědčí pro významnou shodu pro soupravy na stanovení t-tau proteinu na rozdíl od zbylých dvou parametrů, kde hodnoty ukazují nižší úroveň shody mezi oběma soupravami. Tab. 1 uvádí orientační referenční rozmezí a sumární charakteristiky likvorového tripletu proteinů v základním souboru pacientů bez kognitivního deficitu (n = 30), vč. poměrů t-tau/ Aβ42 a p-tau/ Aβ42. K porovnání jsou zde současně orientační normy pro triplet proteinů v MMM u podskupiny kognitivně zdravých osob navíc s normálním MMM vč. likvorové tripletu podle předchozích norem [12]. Výsledky pocházejí ze souprav EUROIMMUN (pro Aβ42 a t-tau protein) a INNOTEST (pro p-tau protein), kterými je v současnosti triplet proteinů pro klinické diagnostické účely v ČR stanovován v laboratoři Thomayerovy nemocnice v Praze.
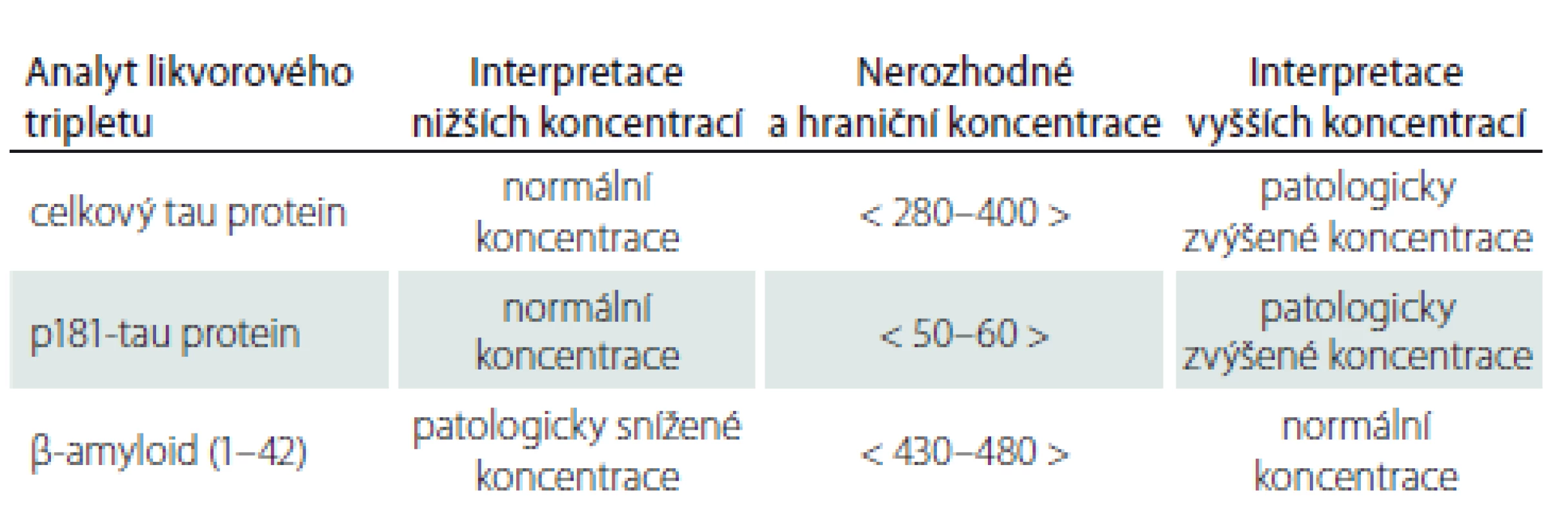
Pro srovnání našich výsledků jsme zařadili tab. 2, v níž uvádíme hraniční koncentrace doporučované pro soupravy používané v laboratoři v Thomayerově nemocnici. Na základě našich výsledků na reálných normativních osobách, hranic doporučených výrobcem a zkušeností z klinické praxe a literatury jsme stanovili dvojí hraniční meze tak, aby bylo možné výsledky interpretovat trojím způsobem: 1. jako normální; 2. jako nerozhodné nebo hraniční; 3. jako patologicky zvýšené (pro tau proteiny) či snížené (pro β-amyloid). Společný názor vyjadřuje tab. 3. V ní najdete hranice pro snížené, nerozhodné a vyšší koncentrace likvorového tripletu a jejich interpretaci. Pro zhodnocení výsledků lékaři doporučujeme používat tuto tabulku.
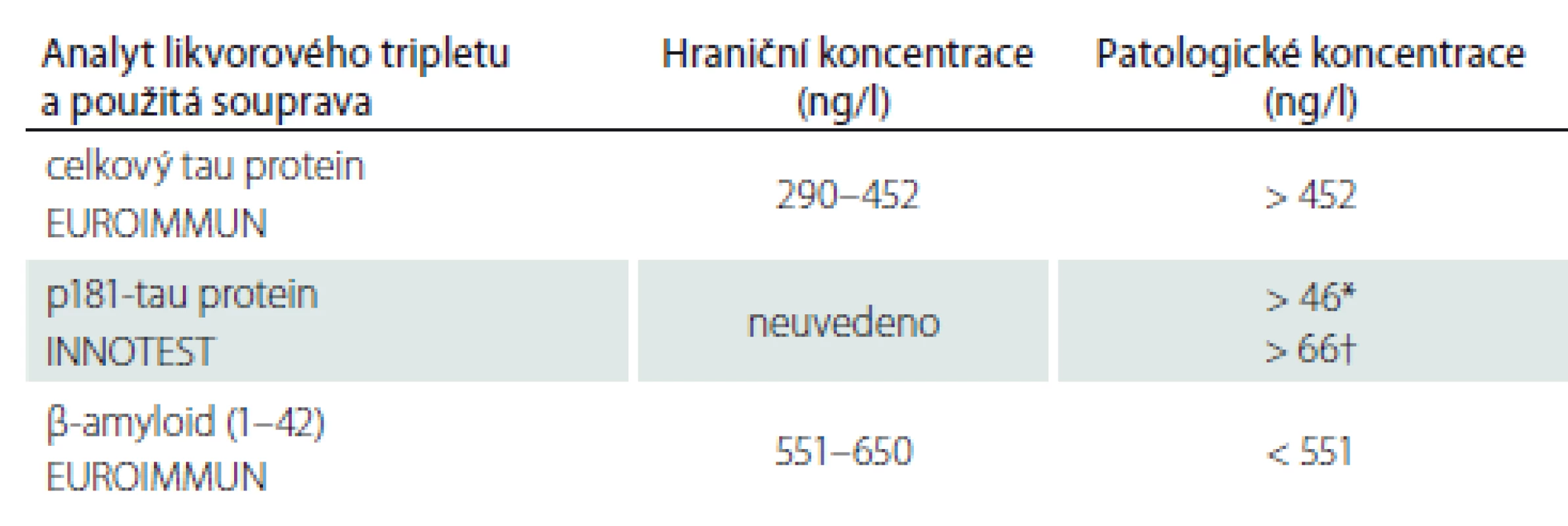
p181-tau protein – tau protein fosforylovaný na 181. aminokyselinovém zbytku
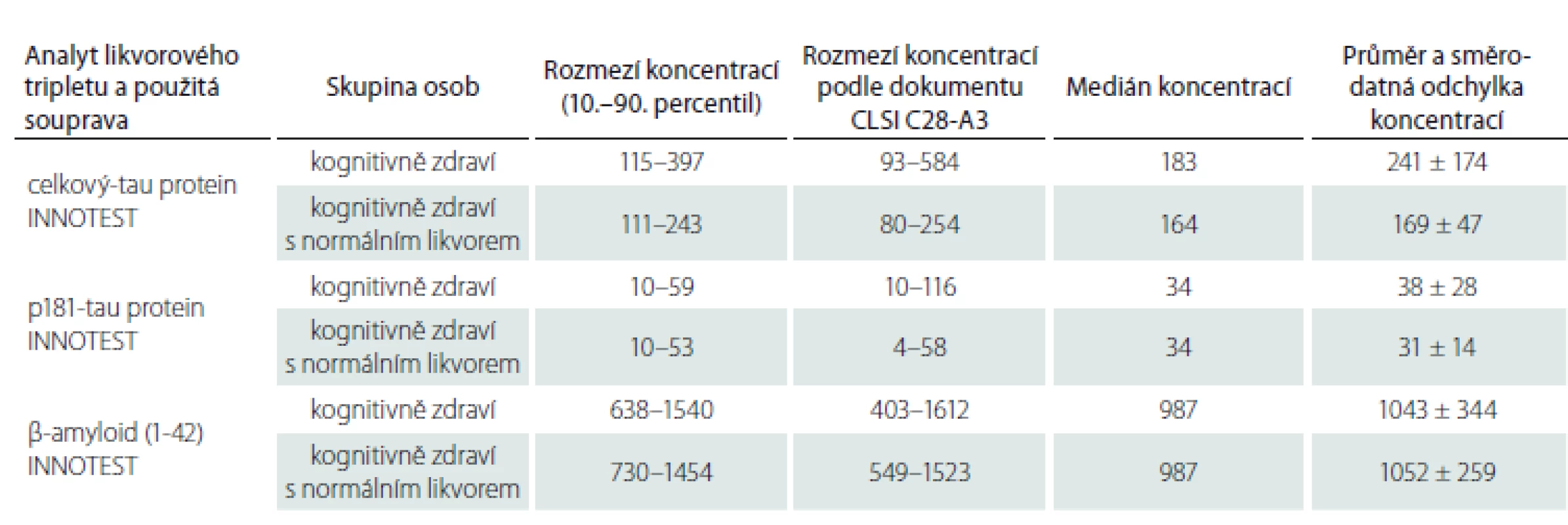
V tab. 4 jsou shrnuty podobné údaje získané pro soupravy INNOTEST a využívané jako orientační nomy pro výzkumné účely v laboratoři Psychiatrického centra Praha (nyní Národního ústavu duševního zdraví).
Diskuze
Použité soupravy ELISA INNOTEST a EUROIMMUN jsou postaveny na stejných principech nekompetitivní enzymové analýzy na pevné fázi. Oba výrobci využívají k detekci imunokomplexů specifických monoklonálních protilátek konjugovaných s biotinem. Ten je následně prokazován streptavidinem značeným peroxidázou a detekce pokračuje reakcí peroxidázy se substrátem tetrametylbenzidinem a peroxidem vodíku.
Přes tyto společné rysy odhalilo statistické srovnání výsledků získaných sledovanými metodami v některých ohledech určité rozdíly. U všech metod byly prostřednictvím Blandova-Altmanova rozdílového grafu nalezeny odchylky průměrných diferencí od 0. Kromě toho Passing-Bablokova regresní analýza odhalila u p181-tau proteinu proporcionální chybu. Na druhou stranu hodnoty korelačních koeficientů pro t-tau protein ukazují vysokou míru shody výsledků, dokonce lepší než v práci Chiasseriniho et al [47].
S přihlédnutím k některým odlišnostem mezi soupravami jsme neočekávali úplnou shodu výsledků. Soupravy EUROIMMUN jsou zpracovány během 1 dne, provedení souprav INNOTEST pro t-tau protein a p181-protein je rozděleno na 2 dny. Možné odlišnosti mohou být zapříčiněny i použitými protilátkami, jejichž výběr je důležitý pro specifičnost stanovení. Výrobce souprav INNOTEST charakterizuje použité monoklonální protilátky. U souprav EUROIMMUN nejsou protilátky detailněji specifikovány. Nedořešeným problémem, se kterým se stanovení likvorových biomarkerů AN zatím potýká, je vývoj mezinárodně uznávaných referenčních materiálů a vypracování referenční metody pro stanovení jednotlivých biomarkerů. Vyřešení tohoto omezení je předmětem intenzivního úsilí, na kterém spolupracují Mezinárodní federace klinické biochemie a laboratorní medicíny (IFCC) a Globální konsorcium pro standardizaci biomarkerů v mozkomíšním moku společně s akademickými institucemi a výrobními podniky [33].
Domníváme se, že soupravy ELISA obou výrobců jsou vhodné ke stanovení tripletu proteinů v MMM. V případě obou výrobců existuje i možnost rozšířit vyšetření tripletu proteinů v MMM o další parametr, kterým je β-amyloid 40. Předpokládá se, že poměr Aβ42/ Aβ40 přispívá ke zvýšení citlivosti a specificity diagnózy AN [33]. Další pozitivní skutečností je, že výrobce EUROIMMUN počítá i s možností zpracovávat soupravy na automatických analyzátorech.
Pro soupravy INNOTEST jsme již v předchozí studii stanovili rozmezí hodnot pro normální kontroly i hraniční koncentrace pro odlišení AN [12]. V rámci aktuální studie jsme ve skupině pečlivě vybraných osob bez neurologického onemocnění a bez kognitivního deficitu a za respektování etických norem stanovili poprvé v ČR pomocí ELISA souprav od fy EUROIMMUN hodnoty neurodegenerativních markerů v likvoru. Rozmezí uvedená v tab. 1 a zejména 3 mohou sloužit jako orientační vodítka pro posuzování výsledků likvorového tripletu proteinů u pacientů starších 55 let.
Ustanovit referenční meze nebo hraniční koncentrace je sice důležité téma, ale zároveň velmi složité. Promítá se do něj totiž mnoho faktorů. Některé z nich dobře demonstruje tab. 1, ve které se liší více nebo méně referenční rozmezí pro jednotlivé analyty likvorového tripletu. Uplatňuje se zde vliv hloubky vyšetření zdravých osob a jeho omezení (kognitivně zdraví vs. kognitivně zdraví s normálním likvorem), použitá metodika 10./ 90. percentilu nebo výpočet rozmezí podle programu. Jiné koncentrace uvádí výrobce a další bychom našli v literatuře. Tento problém jsme se rozhodli nakonec vyřešit konsenzem klinicko-biochemickým, než spoléhat na přesná čísla ze statistik nebo programů. Využili jsme přitom výsledků jak našich, tak výrobců zároveň s našimi klinickými i literárními zkušenostmi. Zároveň se opíráme o nové názory týkající se ukazatelů AN, že dichotomické dělení není ideální pro interpretaci kontinuální proměnné. Proto jsme zařadili doporučovanou skupinu s nerozhodnými koncentracemi mezi normálními a patologickými koncentracemi. Jim odpovídají naše předchozí hraniční koncentrace pro t-tau protein (334 ng/ l), p-tau protein (57 ng/ l) a β-amyloid 42 (450 ng/ l) [12]. Naše společné expertní stanovisko k interpretaci koncentrací u jednotlivého pacienta jsme shrnuli do tab. 3. Doporučujeme ho používat pro klinickou praxi pro neurology, kteří budou využívat služeb laboratoře v Thomayerově nemocnici v Praze. Sami máme v plánu je používat v naší klinické praxi nebo při výzkumu, např. k validizaci našich nových kognitivních testů POBAV a ALBA [48 – 50].
Praktické informace k vyšetřování likvorového tripletu v ČR
Stanovení likvorového tripletu lze vykazovat pojišťovně pod kódem 91571, který se při vyšetření všech proteinů tripletu uvádí 3×. Vyšetření likvorového tripletu proteinů pro rutinní klinickou praxi může zajistit Národní referenční laboratoři lidských prionových chorob – imunologie Ústavu patologie a molekulární medicíny 3. LF UK a Thomayerovy nemocnice. V současnosti jsou výsledky vyšetření likvorového tripletu dostupné většinou do 4 až 6 týdnů. Nyní je jako jediná laboratoř v ČR zapojena do mezinárodní externí kontroly kvality vyšetřování biomarkerů AN „The Alzheimer’s Association QC program for CSF biomarkers“ organizované a prováděné Univerzitou v Göteborgu, Švédsko. Pravidelná účast v cyklech externí kontroly kvality je jedním z předpokladů správnosti vydávaných výsledků. Na webových stránkách [51] najdete žádanku na vyšetření neurodegenerativních markerů v MMM spolu s požadavky na odběr, skladování a transport biologického materiálu. Nejdůležitějším krokem je odběr a přeprava MMM výhradně ve zkumavkách vyrobených jen z polypropylenu. Pokud se použije jiný materiál, hrozí ovlivnění výsledků vyšetření, zvláště falešný pokles hladiny Aβ42. Vliv erytrocytů na koncentraci proteinů likvorového tripletu je zanedbatelný pro většinu ukazatelů v moku, pokud jejich počet je menší než 500 v 1 µl. Arteficiální kontaminaci vzorku MMM krví při lumbální punkci řeší několik mezinárodních protokolů. Společnou zásadou je jednoduché opatření, aby se co nejmenší množství kontaminovaného moku nechalo odkapat mimo zkumavku, než se mok vyčeří od krve. Teprve, když je čirý, lze odebírat do propylenové zkumavky. Pokud se nelze vyhnout krevní kontaminaci, doporučuje se okamžitá centrifugace MMM k odstranění erytrocytů ze vzorku. Odebraný MMM je možné skladovat v lednici při teplotě 4 – 8 °C. Při transportu do externí laboratoře není nezbytné, ani není doporučováno chlazení či zamražení vzorku, pokud je dopraven do 6 dnů. Pro delší časové období je nutné MMM zmrazit a skladovat při teplotě – 15 až – 25 °C, pro několikaleté skladování je vhodnější hluboké zamražení na – 80 °C.
Spolu s vyšetřením likvorového tripletu je možné vyšetřit z MMM i protein 14-3-3. Jeho indikace je smysluplná pouze při podezření na rychle progredující demenci, a to Creutzfeld-Jakobovu nemoc. Není užitečný pro AN. V tomto případě je klíčové, aby byl mok buď čirý, nebo zbaven erytrocytů centrifugací.
Práce byla podpořena projekty PROGRES Q25 a Q35, „Udržitelnost pro Národní ústav duševního zdraví“, č. LO1611, MŠMT v rámci Národního programu udržitelnosti I (NPU I), MZ ČR – RVO VFN 64165, VFN v Praze a MZ ČR – RVO „Národní ústav duševního zdraví – NUDZ, IČ: 00023752“.
Poděkování patří také firmě EUROIMMUN, resp. jejímu zástupci v ČR – firmě DYNEX TECHNOLOGIES, spol. s r.o., a firmě Fujirebio, resp. jejímu zástupci v ČR – firmě ASCO-MED, spol. s r. o. za poskytnutí kitů pro měření. Firmě DYNEX TECHNOLOGIES, spol. s r. o. taktéž děkujeme za zapůjčení ELISA readeru – DYNAREAD.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
as. MUDr. Lenka Fialová, CSc.
Ústav lékařské biochemie
a laboratorní diagnostiky
1. LF UK a VFN
U Nemocnice 2
128 08 Praha
e-mail: lfial@lf1.cuni.cz
Přijato k recenzi: 10. 6. 2019
Přijato do tisku: 27. 8. 2019
Sources
1. Mátl O, Mátlová M, Holmerová I. Zpráva o stavu demence 2016. Praha: Česká alzheimerovská společnost, o. p. s. 2016.
2. Jack CR Jr, Bennett DA, Blennow K et al. A/ T/ N: an unbiased descriptive classification scheme for Alzheimer disease biomarkers. Neurology 2016; 87(5): 539 – 547. doi: 10.1212/ WNL.0000000000002923.
3. Golde TE, DeKosky ST, Galasko D. Alzheimer‘s disease: the right drug, the right time. Science 2018; 362(6420): 1250 – 1251. doi: 10.1126/ science.aau0437.
4. Bartoš A, Raisová M. Testy a dotazníky pro vyšetřování kognitivních funkcí, nálady a soběstačnosti. 1. vyd. Praha: Mladá fronta 2015.
5. Bartoš A, Řípová D. Pokroky v diagnostice Alzheimerovy nemoci. Psychiatr prax; 2007; 1 : 17 – 19.
6. Bartoš A, Zach P, Diblíková F et al. Vizuální kategorizace mediotemporální atrofie na MR mozku u Alzheimerovy nemoci. Psychiatrie 2007; 11 (Suppl 3): 49 – 52.
7. Šilhán D, Ibrahim I, Tintěra J et al. Parietální atrofie na magnetické rezonanci mozku u Alzheimerovy nemoci s pozdním začátkem. Cesk Slov Neurol N 2019; 82/ 115(1): 91 – 95. doi: 10.14735/ amcsnn201991.
8. Šilhán D, Ibrahim I, Tintěra J et al. Parietální atrofický skór na magnetické rezonanci mozku u normálně stárnoucích osob. Cesk Slov Neurol N 2018; 81/ 114(4): 414 – 419. doi: 10.14735/ amcsnn2018414.
9. Bartoš A, Píchová R, Trojanová H et al. SPECT mozku v diagnostice Alzheimerovy nemoci. Psychiatrie 2008; 12 (Suppl 3): 8 – 11.
10. Ressner P, Hort J, Rektorová I et al. Doporučené postupy pro diagnostiku Alzheimerovy nemoci a dalších onemocnění spojených s demencí. Ces Slov Neurol N 2008; 71/ 104(4): 494 – 501.
11. Kim Y, Rosenberg P, Oh E. A Review of diagnostic impact of amyloid positron emission tomography imaging in clinical practice. Dement Geriatr Cogn Disord 2018; 46(3 – 4): 154 – 167. doi: 10.1159/ 000492151.
12. Bartoš A, Čechová L, Švarcová J et al. Likvorový triplet (tau proteiny a beta-amyloid) v diagnostice Alzheimerovy-Fischerovy nemoci. Cesk Slov Neurol N 2012; 75/ 108(5): 587 – 594.
13. Hansson O, Seibyl J, Stomrud E et al. CSF biomarkers of Alzheimer‘s disease concord with amyloid-beta PET and predict clinical progression: a study of fully automated immunoassays in BioFINDER and ADNI cohorts. Alzheimers Dement 2018; 14(11): 1470 – 1481. doi: 10.1016/ j.jalz.2018.01.010.
14. Lashley T, Schott JM, Weston P et al. Molecular biomarkers of Alzheimer‘s disease: progress and prospects. Dis Model Mech 2018; 11(5). doi: 10.1242/ dmm.031781.
15. Dubois B, Feldman HH, Jacova C et al. Advancing research diagnostic criteria for Alzheimer‘s disease: the IWG-2 criteria. Lancet Neurol 2014; 13(6): 614 – 629. doi: 10.1016/ S1474-4422(14)70090-0.
16. Fialova L, Bartos A, Svarcova J. Neurofilaments and tau proteins in cerebrospinal fluid and serum in dementias and neuroinflammation. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2017; 161(3): 286 – 295. doi: 10.5507/ bp.2017.038.
17. Preische O, Schultz SA, Apel A et al. Serum neurofilament dynamics predicts neurodegeneration and clinical progression in presymptomatic Alzheimer‘s disease. Nat Med 2019; 25(2): 277 – 283. doi: 10.1038/ s41591-018-0304-3.
18. Fialová L, Bartoš A, Švarcová J. Lehké řetězce neurofilament v séru a mozkomíšním moku a stav hematolikvorové bariéry u vybraných neurologických onemocnění. Cesk Slov Neurol N 2018; 81/ 114(2): 185 – 192. doi: 10.14735/ amcsnn2018185.
19. Bartos A, Fialova L, Svarcova J. Lower serum antibodies against tau protein and heavy neurofilament in Alzheimer‘s disease. J Alzheimers Dis 2018; 64(3): 751 – 760. doi: 10.3233/ JAD-180039.
20. Noskova L, Fialova L, Bartos A et al. Avidity of antineurocytoskeletal antibodies in Alzheimer‘s disease patients. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2017; 161(2): 179 – 186. doi: 10.5507/ bp.2017.017.
21. Fialova L, Bartos A, Svarcova J et al. Serum and cerebrospinal fluid heavy neurofilaments and antibodies against them in early multiple sclerosis. J Neuroimmunol 2013; 259(1 – 2): 81 – 87. doi: 10.1016/ j.jneuroim.2013.03.009.
22. Fialova L, Bartos A, Svarcova J et al. Serum and cerebrospinal fluid light neurofilaments and antibodies against them in clinically isolated syndrome and multiple sclerosis. J Neuroimmunol 2013; 262(1 – 2): 113 – 120. doi: 10.1016/ j.jneuroim.2013.06.010.
23. Krestova M, Ricny J, Bartos A. Changes in concentrations of tau-reactive antibodies are dependent on sex in Alzheimer‘s disease patients. J Neuroimmunol 2018; 322 : 1 – 8. doi: 10.1016/ j.jneuroim.2018.05.004.
24. Krestova M, Hromadkova L, Bilkova Z et al. Characterization of isolated tau-reactive antibodies from the IVIG product, plasma of patients with Alzheimer‘s disease and cognitively normal individuals. J Neuroimmunol 2017; 313 : 16 – 24. doi: 10.1016/ j.jneuroim.2017.09.011.
25. Zetterberg H, Wilson D, Andreasson U et al. Plasma tau levels in Alzheimer‘s disease. Alzheimers Res Ther 2013; 5(2): 9. doi: 10.1186/ alzrt163.
26. Kolarova M, Sengupta U, Bartos A et al. Tau Oli-gomers in Sera of Patients with Alzheimer‘s Disease and Aged Controls. J Alzheimers Dis 2017; 58(2): 471 – 478. doi: 10.3233/ JAD-170048.
27. Piťha J. Biomarkery roztroušené sklerózy – současné možnosti a perspektivy. Cesk Slov Neurol N 2015; 78/ 111(3): 269 – 273.
28. Chiu MJ, Lue LF, Sabbagh MN et al. Long-term storage effects on stability of Abeta1-40, Abeta1-42, and total tau proteins in human plasma samples measured with immunomagnetic reduction assays. Dement Geriatr Cogn Dis Extra 2019; 9(1): 77 – 86. doi: 10.1159/ 000496099.
29. Bridel C, van Wieringen WN, Zetterberg H et al. Diag-nostic value of cerebrospinal fluid neurofilament light protein in neurology: a systematic review and meta-analysis. JAMA Neurol 2019; 76(9): 1035 –1048. doi: 10.1001/ jamaneurol.2019.1534.
30. Olsson B, Lautner R, Andreasson U et al. CSF and blood biomarkers for the diagnosis of Alzheimer‘s disease: a systematic review and meta-analysis. Lancet Neurol 2016; 15(7): 673 – 684. doi: 10.1016/ S1474-4422(16)00070-3.
31. Bernadič M, Cisár J, Bernadič M. Amyloidová teória v etiopatogenéze Alzheimerovej choroby. Psychiatria--psychoterapia-psychosomatika 2015; 22(2): 20 – 27.
32. Molinuevo JL, Ayton S, Batrla R et al. Current state of Alzheimer‘s fluid biomarkers. Acta Neuropathol 2018; 136(6): 821 – 853. doi: 10.1007/ s00401-018-1932-x.
33. Lewczuk P, Riederer P, O‘Bryant SE et al. Cerebrospinal fluid and blood biomarkers for neurodegenerative dementias: an update of the Consensus of the Task Force on Biological Markers in Psychiatry of the World Federation of Societies of Biological Psychiatry. World J Biol Psychiatry 2018; 19(4): 244 – 328. doi: 10.1080/ 15622975.2017.1375556.
34. Fialová L, Bartoš A, Švarcová J et al. Stanovení tau proteinu v mozkomíšním moku pacientů s roztroušenou sklerózou dvěma soupravami ELISA. Klin Biochem Metab 2011; 19/ 40(2): 113 – 118.
35. Teunissen C, Menge T, Altintas A et al. Consensus definitions and application guidelines for control groups in cerebrospinal fluid biomarker studies in multiple sclerosis. Mult Scler 2013; 19(13): 1802 – 1809. doi: 10.1177/ 1352458513488232.
36. Bartoš A, Raisová M. The Mini-Mental State Examination (MMSE) – Czech norms and cut-offs for mild dementia and mild cognitive impairment due to Alzheimer disease. Dementia and Geriatric Cognitive Disorders 2016; 42 : 50 – 57.
37. Bartoš A, Raisová M, Kopeček M. Důvody a průběh novelizace české verze Addenbrookského kognitivního testu (ACE-CZ). Cesk Slov Neurol N 2011; 74/ 107(6): 1 – 5.
38. Bartoš A, Raisová M, Kopeček M. Novelizace české verze Addenbrookského kognitivního testu (ACE-CZ). Cesk Slov Neurol N 2011; 74/ 107(6): 681 – 684.
39. Beránková D, Krulová P, Mračková M et al. Addenbrookský kognitivní test – orientační normy pro českou populaci. Cesk Slov Neurol N 2015; 78/ 111(3): 300 – 305.
40. Teunissen CE, Petzold A, Bennett JL et al. A consensus protocol for the standardization of cerebrospinal fluid collection and biobanking. Neurology 2009; 73(22): 1914 – 1922. doi: 73/ 22/ 1914.
41. Deisenhammer F, Bartos A, Egg R et al. Guidelines on routine cerebrospinal fluid analysis. Report from an EFNS task force. Eur J Neurol 2006; 13(9): 913 – 922. doi: 10.1111/ j.1468-1331.2006.01493.x.
42. Dušek L, Pavlík T, Koptíková J. Analýza dat v neurologii. VII. Reprodukovatelnost a opakovatelnost u spojitých dat. Cesk Slov Neurol N 2008; 71/ 104(4): 106 – 109.
43. Dohnal L. Porovnání. Desatero pro porovnání výsledku. Fons 2000(3): 27 – 32.
44. Hendl J. Statistické přístupy k porovnání biomedicinských metod měření. Česká kinantropologie 1997; (2): 87 – 96.
45. Gaško R. Porovnávanie metód merania – „Method comparison studies“ – príručka správnych štatistických postupov. 1. vyd. Košice: EduStat, s.r.o. 2017.
46. Ozarda Y. Reference intervals: current status, recent developments and future considerations. Biochemia medica 2016; 26(1): 5 – 16. doi: 10.11613/ BM.2016.001.
47. Chiasserini D, Biscetti L, Farotti L et al. Performance evaluation of an automated ELISA system for Alzheimer‘s disease detection in clinical routine. J Alzheimers Dis 2016; 54(1): 55 – 67. doi: 10.3233/ JAD-160298.
48. Bartoš A. Pamatujte na POBAV – krátký test pojmenování obrázků a jejich vybavení sloužící ke včasnému záchytu kognitivních poruch. Neurolog praxi 2018; 19 (Suppl 1) 5 – 10.
49. Bartos A. Dvě původní české zkoušky k vyšetření paměti za tři minuty – Amnesia Light and Brief Assessment (ALBA). Cesk Slov Neurol N 2019; 82(4): 420 – 429. doi: 10.14735/ amcsnn2019420.
50. Bartoš A. Netestuj, ale POBAV – písemné záměrné Pojmenování OBrázků A jejich Vybavení jako krátká kognitivní zkouška. Cesk Slov Neurol N 2016; 79/ 112(6): 671 – 679
51. Thomayerova nemocnice. Žádanky o vyšetření a laboratorní příručka. [online]. Dostupné z URL: http: / / www.ftn.cz/ zadanky-o-vysetreni-a-laboratorni-prirucka-728/ .
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2019 Issue 5
- Memantine Eases Daily Life for Patients and Caregivers
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Advances in the Treatment of Myasthenia Gravis on the Horizon
-
All articles in this issue
- Kompresivní neuropatie jako nemoc z povolání
- Refrakterní myastenia gravis – klinická charakteristika a možnosti biologické léčby
- Úloha pohybovej aktivity v liečbe pacientov s Parkinsonovou chorobou
- Změna struktury paraspinálních svalů u pacientů s chronickými nespecifickými bolestmi dolní části zad
- Léčba nespavosti při neuropatické bolesti
- Rozsáhlý cervikální hematom po minimálním traumatu
- Perinatální paréza brachiálního plexu na podkladě avulze, řešená konzervativně
- Plicní arteriovenózní malformace jako vzácná příčina ischemické cévní mozkové příhody
- Akutní amnestický syndrom při bilaterální lézi hipokampů jako raritní projev CMP
- Perforace jícnu způsobená dislokovanou krční dlahou pět let po operaci krční páteře – vzácná komplikace
- Závažné vaskulopatie u neurofibromatózy typu 1
- Simultánní vícečetné intracerebrální hemoragie
- Význam kolaterální cirkulace u akutní okluze arteria basilaris
- Možnosti stanovení likvorového tripletu tau proteinů a β-amyloidu 42 metodami ELISA a orientační normativní vodítka
- Endoskopické operace výhřezu bederních meziobratlových plotének – první zkušenosti
- Pegylovaný interferon beta 1-a v klinické praxi
- Kongenitální fibróza zevních okohybných svalů u české rodiny a její molekulárně genetická příčina
- Analýza dat v neurologii LXXVII. Korelační analýza vícerozměrných souborů kvantitativních dat – příklady
- Recenze knih
- Jiný pohled na inhibitor agregace krevních destiček klopidogrel – vhodné antiedematikum v předklinickém modelu poranění mozku?
- CRP stanovený vysoce senzitivní metodou u pacientů s ichemickou cévní mozkovou příhodou – od rizikových faktorů po vývoj
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Léčba nespavosti při neuropatické bolesti
- Kompresivní neuropatie jako nemoc z povolání
- Změna struktury paraspinálních svalů u pacientů s chronickými nespecifickými bolestmi dolní části zad
- Endoskopické operace výhřezu bederních meziobratlových plotének – první zkušenosti
