Pegylovaný interferon beta 1-a v klinické praxi
Pegylated inteferon beta 1-a in clinical routine
Aim: To evaluate the clinical effect, radiological parameters, tolerability and adverse events in patients treated with pegylated interferon beta 1-a (PEG IFN).
Patients and methods: A total of 117 patients with clinically isolated syndrome or relapse remitting form of multiple sclerosis were enrolled in the study, with regular clinical assessment including Expanded Disability Status Scale (EDSS), laboratory monitoring, and MRI of the brain and spinal cord.
Results: Relapse of the disease was present in 10.6% of the patients. The progression on brain MRI was present in 22.6% of the patients. There was significant improvement in EDSS (P = 0.049). In addition, the effect of treatment was demonstrated in patients with PEG IFN as a first-choice drug (P = 0.042) and in patients under 36 years of age (P < 0.001). The most common side effects were local reactions (53.8%), flu-like syndrome (35.9% of patients), changes in blood count (29.9%) and elevation of liver enzymes (27.6%). Other side effects were uncommon.
Conclusion: PEG IFN is an effective and well tolerated drug with a favorable safety profile.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
临床常规中的聚乙二醇干扰素β1-a
目的:评估使用聚乙二醇干扰素β1-a(PEG IFN)治疗的患者的临床疗效,放射学参数,耐受性和不良事件。
患者和方法:共有117名患有临床孤立综合征或复发缓解型多发性硬化症的患者入选该研究,并定期进行临床评估,包括扩展残疾状态量表(EDSS),实验室监测以及脑和脊髓MRI 。
结果:10.6%的患者存在该疾病的复发。 22.6%的患者出现了脑部MRI的进展。 EDSS有显著改善(P = 0.049)。此外,在以PEG IFN作为首选药物的患者中(P = 0.042)和在36岁以下的患者中(P <0.001)证明了治疗效果。最常见的副作用是局部反应(53.8%),流感样综合征(占患者的35.9%),血球变化(29.9%)和肝酶升高(27.6%)。其他副作用很少见。
结论:PEG IFN是一种有效且耐受性良好的药物,具有良好的安全性。
关键词:多发性硬化–聚乙二醇干扰素β1-a –复发 – MRI
Keywords:
Multiple sclerosis – MRI – pegylated interferon beta 1-a – relapse
Authors:
E. Němá; J. Libertínová; P. Ročková; M. Petržalka; E. Houžvičková; E. Meluzínová
Authors‘ workplace:
Neurologická klinika 2. LF UK, a FN Motol, Praha
Published in:
Cesk Slov Neurol N 2019; 82(5): 556-560
Category:
Original Paper
doi:
https://doi.org/10.14735/amcsnn2019556
Overview
Cíl: Sledování klinického efektu, radiologických parametrů, tolerance a nežádoucích účinků u pacientů léčených pegylovaným interferonem beta 1-a (PEG IFN).
Soubor a metodika: Ve studii bylo sledováno 117 pacientů s klinicky izolovaným syndromem nebo relaps remitentní formou roztroušené sklerózy, u kterých byla prováděna pravidelná klinická kontrola vč. stanovení skóre Expanded Disability Status Scale (EDSS), laboratorní monitoring a pravidelně byla prováděna MR mozku a míchy.
Výsledky: Relaps onemocnění proběhl u 10,6 % pacientů. Kontrolní MR byla v progresi počtu lézí ve 22,6 %. U pacientů léčených PEG IFN došlo k signifikantnímu zlepšení EDSS (p = 0,049). Dále byl prokázán příznivý efekt léčby na vývoj EDSS u pacientů, u kterých byla zahájena terapie PEG IFN jako lékem 1. volby ve srovnání s těmi, kteří byli předtím léčeni jiným preparátem (p = 0,042), a u pacientů mladších 36 let (p < 0,001). Z nežádoucích účinků byly nejčastější reakce v místě vpichu (53,8 %), flu-like syndrom (35,9 %), dále změny v krevním obraze (29,9 %) a elevace jaterních testů (27,6 %). Další nežádoucí účinky byly málo časté.
Závěr: PEG IFN je účinný a dobře tolerovaný preparát s příznivým bezpečnostním profilem.
Klíčová slova:
roztroušená skleróza – pegylovaný interferon beta 1-a – relaps – MR
Úvod
Pro léčbu pacientů s relaps remitentní formou RS (RR-RS) je nově od počátku roku 2017 k dispozici pegylovaný interferon beta-1a (PEG IFN), který se aplikuje subkutánně 1× za 14 dnů. PEG IFN vzniká připojením polyetylenglykolu k N-konci interferonu beta-1a. Pegylace vede ke zvýšené stabilitě léku, ke snížení imunogenicity a tím i ke snížení pravděpodobnosti vzniku neutralizačních protilátek (neutralizing antibodies; NAbs) [1–3]. PEG IFN byl hodnocen ve studii ADVANCE [4], kdy bylo prokázáno snížení počtu relapsů a snížení progrese trvalé disability. Z radiologických parametrů vedla terapie PEG IFN ke snížení počtu nových a zvětšujících se T1 a T2 lézí a také ke snížení počtu lézí s postkontrastním sycením na MR mozku. V celkovém objemu mozku nebyl mezi skupinami užívajícími PEG IFN a placebo signifikantní rozdíl. Přípravek byl dobře snášen, z nežádoucích účinků se nejčastěji objevovaly reakce v místě vpichu a flu-like syndrom. Laboratorně ve studii ADVANCE docházelo ke změnám v krevním obraze a k elevaci jaterních testů. Potenciálním závažným nežádoucím účinkem v souvislosti s terapií IFN je vznik depresivních příznaků. Jednoznačný vztah však nebyl prokázán, naopak některé práce popsaly u pacientů léčených IFN zlepšení kvality života a kognitivních funkcí [5–7]. Vzácně byly popsány případy trombotické mikroangiopatie a dysfunkce štítné žlázy [8,9] u pacientů léčených IFN. Spektrum nežádoucích účinků u PEG IFN bylo srovnatelné s ostatními IFN u pacientů s RR-RS [10]. Některé studie prokázaly vyšší efekt léčby u pacientů po změně léčby v rámci stejné linie (switch-in) na PEG IFN a IFN beta-1a 44 μg [10,11].
Cílem naší práce bylo zhodnotit klinický efekt, radiologické parametry, vliv léčby na snížení disability, toleranci a případné nežádoucí účinky u pacientů léčených PEG IFN.
Metodika
Do studie bylo zařazeno 117 pacientů, kteří byli vyšetřeni a sledováni v Centru pro diagnostiku a léčbu demyelinizačních onemocnění při Neurologické klinice 2. LF UK a FN Motol. Všichni pacienti buď prodělali klinicky izolovaný syndrom s vysokým rizikem dalšího rozvoje RS nebo splnili kritéria pro diagnózu RR-RS [12] a dále splňovali následující kritéria: věk 18–55 let, skóre Expanded Disability Status Scale (EDSS) < 3,5, ≥ 2 hyperintenzních T2 lézí na MR mozku a ≥ 2 oligoklonálních proužků v mozkomíšním moku. Všichni pacienti při zahájení terapie PEG IFN splňovali úhradová kritéria pro terapii léky 1. volby v ČR. Prospektivní sledování pacientů probíhalo od února 2017 do července 2018 a do analýzy byli zahrnuti pouze pacienti, kteří užívali PEG IFN minimálně 3 měsíce. Do analýzy zaměřené na hodnocení vlivu léčby PEG IFN na vývoj disability bylo zahrnuto celkem 77 pacientů, u kterých byla k dispozici hodnota EDSS v časech 0, 3, 6, 9 a 12 měsíců od zahájení terapie. EDSS bylo hodnoceno lékaři, kteří jsou certifikováni pro hodnocení EDSS. Každý pacient byl sledován stejným lékařem po celou dobu studie. Byl hodnocen celkový vliv léčby na vývoj EDSS, dále pak efekt léčby na disabilitu u nově nasazených a u pacientů, u nichž byl proveden switch, a vliv léčby na vývoj EDSS dle věku a pohlaví. Analýza dat byla provedena v software STATISTICA 12 (StatSoft, Praha, ČR). Statistické posouzení významnosti rozdílů mezi EDSS na počátku sledování a finální hodnotou po 12 měsících léčby bylo provedeno párovým t-testem. Testy byly provedeny na hladině významnosti 5 %. U všech pacientů byl prováděn pravidelný monitoring laboratoře (krevní obraz vč. diferenciálního rozpočtu, jaterní testy, hormony štítné žlázy). Odběry byly provedeny po 4 týdnech od zahájení terapie, poté po 8 týdnech a následně každých 12 týdnů. V rámci pravidelných laboratorních odběrů probíhala vždy i klinická kontrola u ošetřujícího lékaře. Každý rok byla provedena kontrolní MR mozku a krční míchy. Autoři prohlašují, že studie na lidských subjektech popsaná v manuskriptu byla provedena v souladu s etickými standardy příslušné komise (institucionální a národní) odpovědné za provádění klinických studií a Helsinskou deklarací z roku 1975, revidovanou v roce 2000.
Výsledky
Průměrný věk pacientů byl 36,8 ± 10,0 let, průměrná doba léčby PEG IFN byla 10,86 ± 1,5 měsíce. Jako lék 1. volby byl PEG IFN zvolen u 57 pacientů. Celkem 60 pacientů užívalo před nasazením PEG IFN jinou terapii chorobu modifikujícími léky (disease modifying drugs; DMD). Nejčastějším důvodem pro switch na PEG IFN byla hraniční tolerance předcházející léčby (konkrétně častější aplikace ostatních injekčních preparátů ve srovnání s PEG IFN) (53,3 %). Následovala progrese na MR mozku nebo míchy nebo lehká ataka (21,7 %). Další důvody, které vedly ke změně terapie, jsou uvedeny v tab. 1.
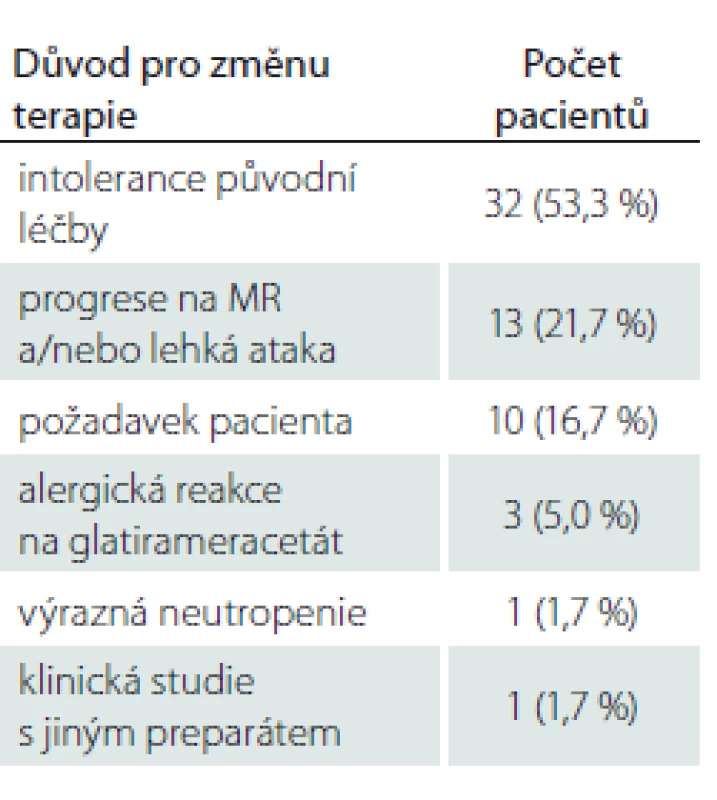
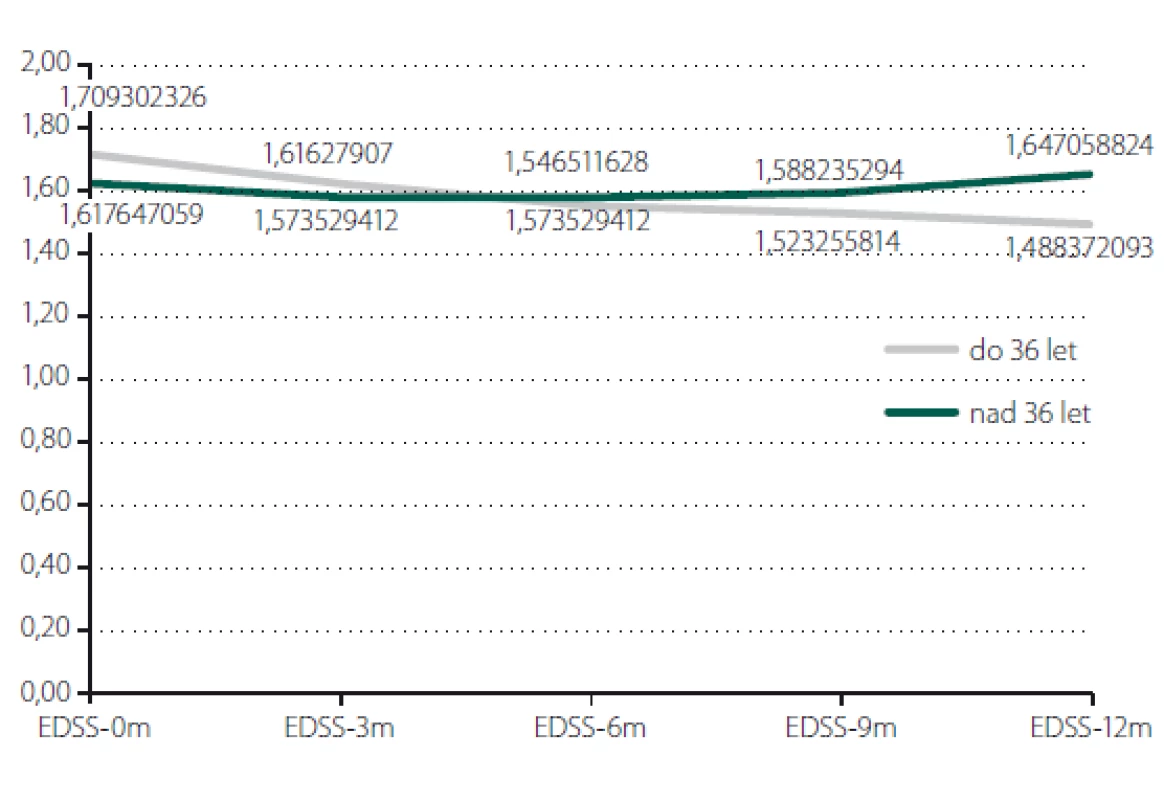
Relaps onemocnění proběhl u 10,6 % pacientů z celého souboru, tedy z počtu 117 pacientů. Většinou se jednalo o středně těžkou ataku (69,2 %), a u těchto pacientů byla proto indikována eskalace terapie na jiný preparát. Kontrolní MR byla realizována celkem u 62 (53,0 %) sledovaných pacientů. Bylo provedeno konvenční radiologické hodnocení progrese počtu viditelných lézí [13]. U 22,6 % pacientů došlo k progresi MR mozku nebo míchy, která však nebyla důvodem k eskalaci terapie s výjimkou těch pacientů, u kterých zároveň proběhla středně těžká ataka. Dále byl sledován vliv léčby PEG IFN na vývoj disability prostřednictvím parametru EDSS. Do analýzy bylo zahrnuto 77 pacientů, u kterých byla k dispozici měření EDSS v 3měsíčních intervalech po dobu alespoň 1 roku od nasazení PEG IFN. Všichni tito pacienti byli zároveň součástí celého souboru o počtu 117 pacientů. U pacientů došlo k signifikantnímu zlepšení EDSS po jednoleté léčbě (p = 0,049; obr. 1). Dále byl prokázán pozitivní efekt léčby na vývoj EDSS u naivních pacientů, u kterých byla zahájena terapie PEG IFN jako lékem 1. volby ve srovnání s pacienty, kteří byli předtím léčeni jiným preparátem 1. linie a teprve následně na PEG IFN převedeni (p = 0,042; obr. 2). Efekt PEG IFN na vývoj EDSS byl také přítomen u pacientů mladších 36 let (p < 0,001; obr. 3) ve srovnání s pacienty staršími 36 let. Vliv pohlaví na vývoj disability v souvislosti s terapií PEG IFN nebyl signifikantní. Všechny výsledky jsou uvedeny v tab. 2.
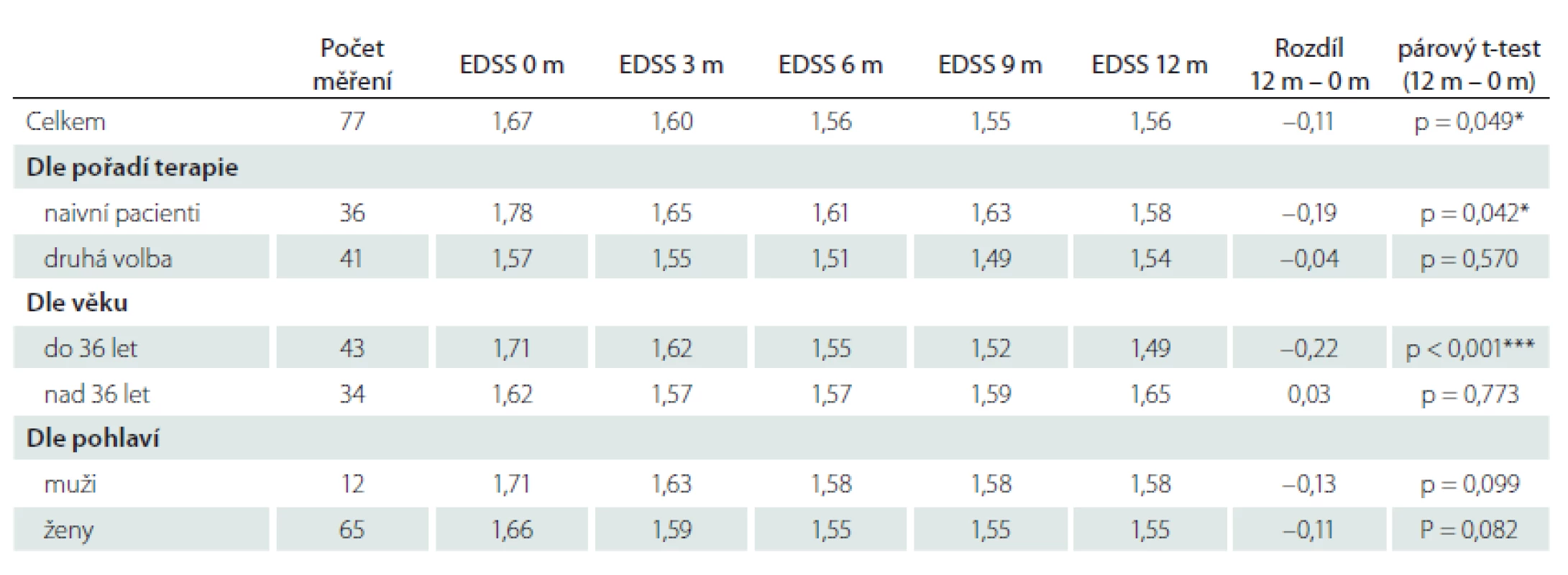
EDSS – Expanded Disability Status Scale
Fig. 1. Evaluation of EDSS in all patients.
EDSS – Expanded Disability Status Scale
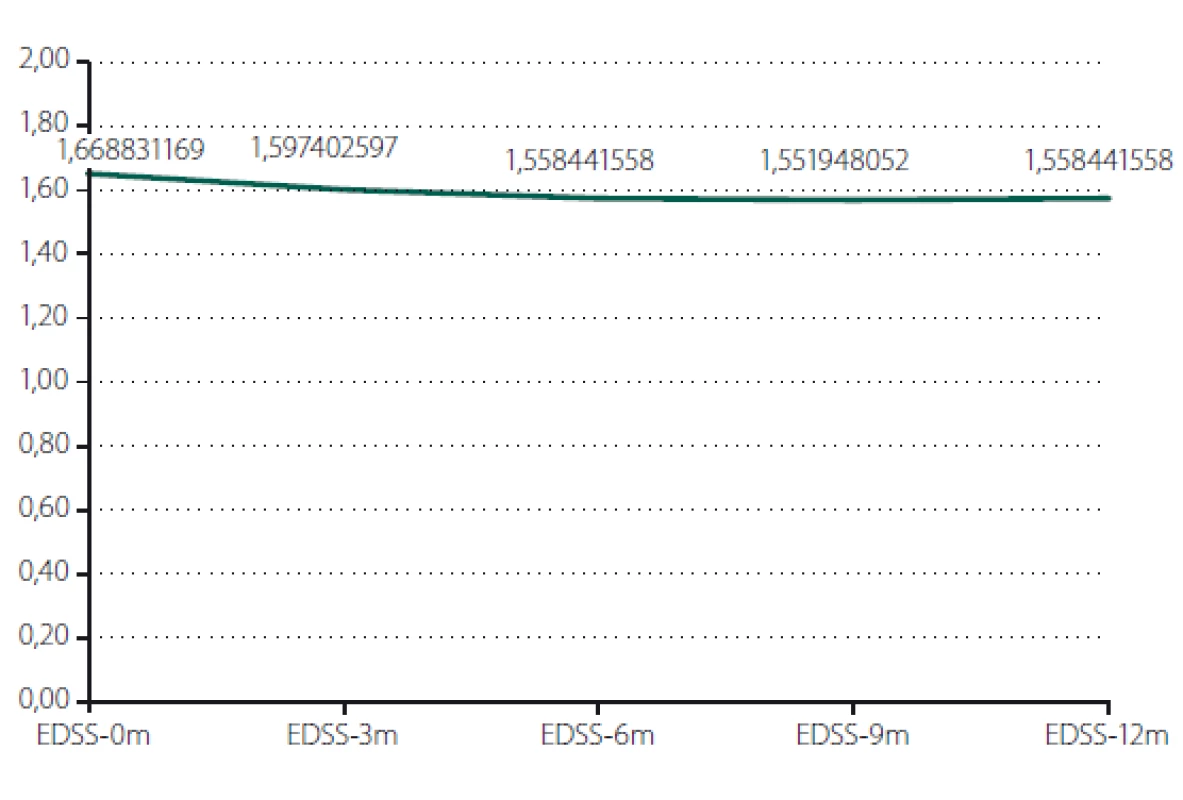
Fig. 2. Evaluation of EDSS according to order of therapy.
EDSS – Expanded Disability Status Scale
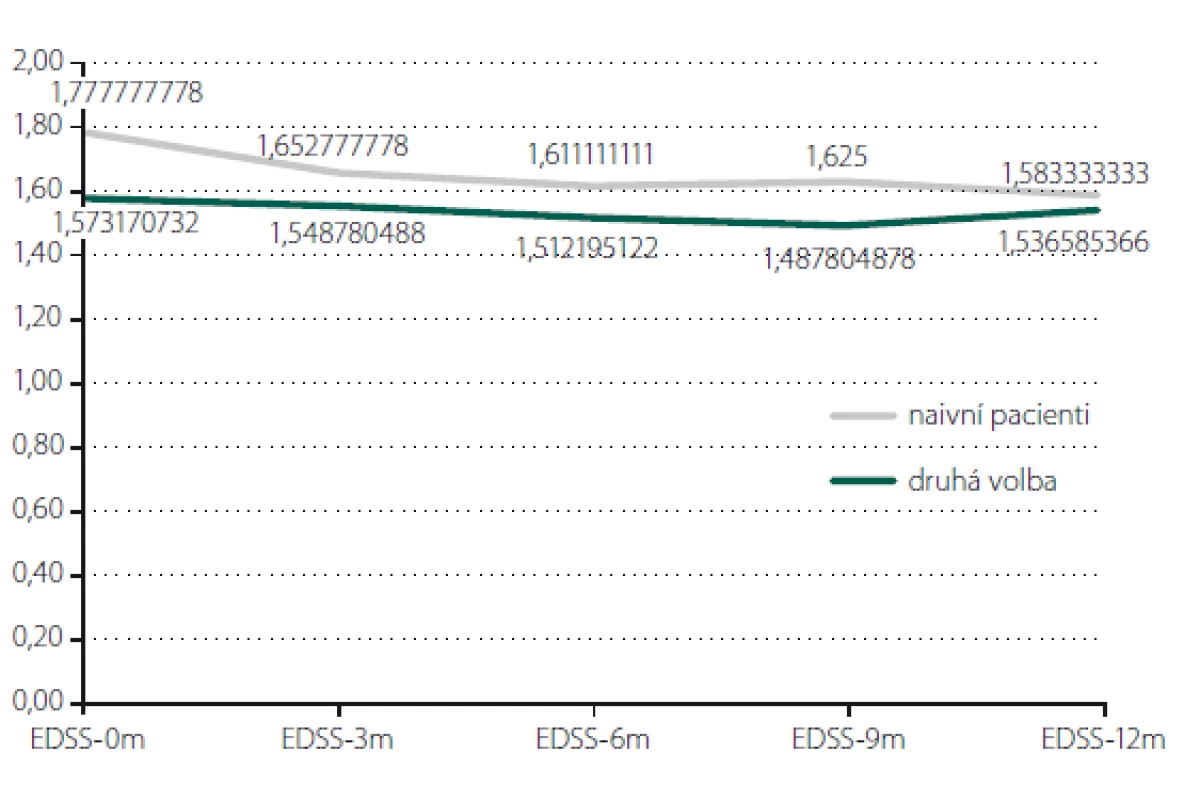
Fig. 3. Evaluation of EDSS according to age.
EDSS – Expanded Disability Status Scale
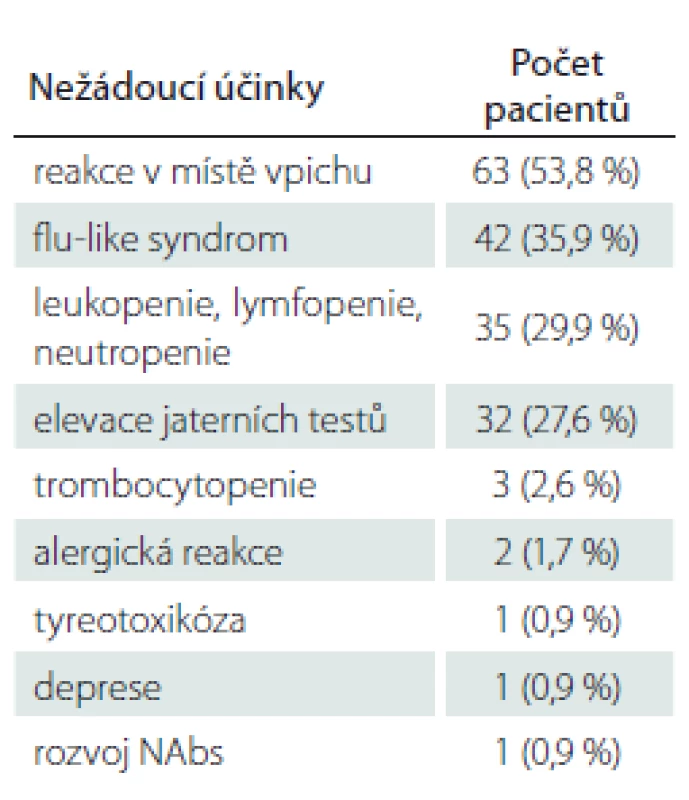
Z hlediska nežádoucích účinků v souvislosti s léčbou PEG IFN se nejčastěji vyskytovaly reakce v místě vpichu (53,8 %), a dále flu-like syndrom – celkem u 35,9 % pacientů. Důvodem pro ukončení terapie však byl flu-like syndrom pouze u 3 pacientů (2,6 %). Z laboratorních nežádoucích účinků se nejčastěji vyskytovaly změny v krevním obraze, konkrétně leukopenie (< 3,0 × 109 / l), lymfopenie (< 0,8 × 109 / l) či neutropenie (≤ 1,5 × 109 / l) byly přítomny celkem u 29,9 % pacientů z celého souboru. Nicméně pouze u jedné pacientky (0,9 %) byly abnormity v krevním obraze natolik závažné, že vedly nakonec k ukončení terapie PEG IFN. K elevaci jaterních testů nad trojnásobek hodnot horní hranice normy došlo celkem u 27,6 % pacientů, pouze v 5,1 % případů byla hodnota jaterních testů opakovaně více než pětinásobná, a byla tak důvodem pro ukončení terapie PEG IFN. Všichni pacienti, u nichž byl lék vysazen z důvodu elevace jaterních testů, byli léčeni PEG IFN jako lékem 1. volby. Celkem u třech pacientů byla přítomna mírná trombocytopenie (≤ 150 × 109 / l). U dvou pacientů vznikla alergická reakce na PEG IFN a dále se u jedné pacientky rozvinula tyreotoxikóza, u další pacientky těžká deprese a u jedné pacientky došlo k rozvoji NAbs. Přehled nežádoucích účinků v souvislosti s terapií PEG IFN je uveden v tab. 3.
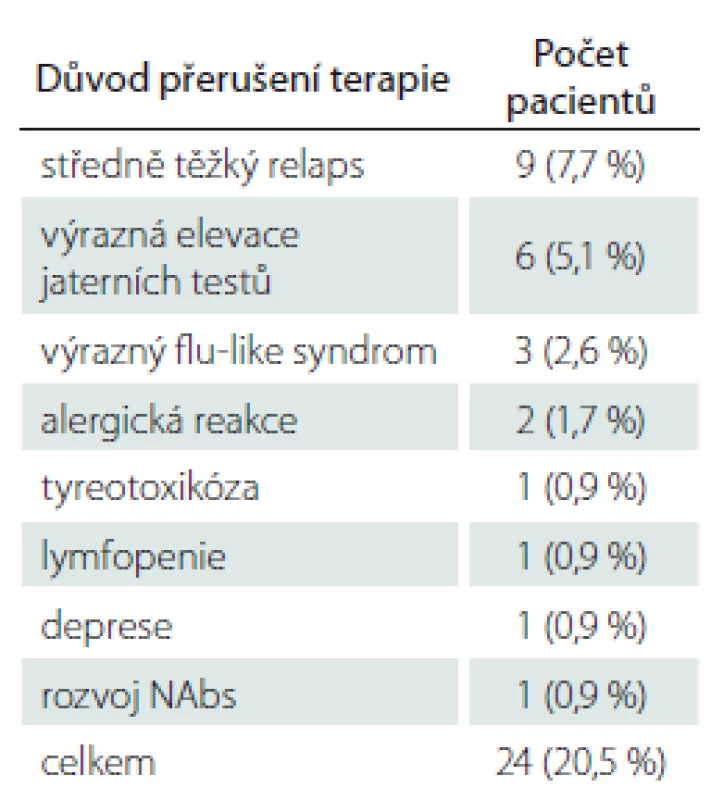
Celkem byla léčba PEG IFN ukončena u 20,5 % sledovaných pacientů. Nejčastějším důvodem byl prodělaný středně těžký relaps (7,7 %) nebo výrazná elevace jaterních testů (5,1 %). Další důvody byly méně časté a jsou uvedeny v tab. 4.
Diskuze
V naší práci jsme hodnotili klinický efekt, toleranci a případné nežádoucí účinky u pacientů léčených PEG IFN v reálné klinické praxi. Asi u poloviny pacientů byl zvolen PEG IFN jako lék 1. volby, zatímco v druhé polovině případů předcházela léčba jiným DMD. Důvodem pro switch na PEG IFN byla nejčastěji hraniční tolerance předchozí terapie vzhledem k častější injekční aplikaci ostatních preparátů ve srovnání s PEG IFN. Ačkoliv také PEG IFN je lék s injekčním podáním, tak vzhledem k nízké frekvenci aplikace (jednou za 14 dnů) může být jeho tolerance vyšší [14]. Dalším důvodem pro switch na PEG IFN byla mírná aktivita choroby (progrese na MR či lehká ataka). Tito pacienti byli buď léčeni jiným lékem 1. volby (glatiramer acetát, teriflunomid), a lze u nich proto vzhledem k jinému mechanizmu účinku IFN předpokládat pozitivní ovlivnění průběhu onemocnění [15]. Druhou skupinou byli pacienti již léčeni jiným IFN, u kterých switch na PEG IFN může vést ke snížení aktivity onemocnění [10].
Relaps proběhl asi u desetiny pacientů z celého souboru. Kontrolní MR byla v naší práci provedena u poloviny pacientů a téměř ve čtvrtině případů došlo k progresi. Ve studii ADVANCE byl zaznamenán jak větší počet relapsů, tak vyšší výskyt progrese počtu lézí na MR, konkrétně celkem u 25 % pacientů [4] a u 41 % pacientů [16], což je dáno pravděpodobně kratší dobou sledování v naší studii.
Dále byl sledován vliv léčby PEG IFN na vývoj disability. V průběhu sledování došlo ke statisticky signifikantnímu zlepšení EDSS, což bylo prokázáno i v předchozí studii ADVANCE [4]. V naší studii byla také většina pacientů klinicky stabilizovaných, což mohlo pozitivně ovlivnit skóre EDSS. Dále bylo prokázáno zlepšení EDSS u pacientů, u nichž byla léčba PEG IFN nově započata, na rozdíl od těch, kteří byli v minulosti léčeni jinými DMD. Studie, které se zabývají efektem léčby na vývoj disability u pacientů, u nichž byl proveden switch, nejsou k dispozici, nicméně zlepšení EDSS u terapeuticky naivních pacientů bylo opakovaně prokázáno v jiných studiích. Bylo zaznamenáno zlepšení parametru EDSS u pacientů léčených PEG IFN ve skupině mladších 36 let ve srovnání se skupinou starších 36 let, což je v souladu s jinými studiemi, které prokázaly, že u pacientů s počátkem onemocnění ve vyšším věku probíhá progrese disability rychleji než u mladších pacientů [17]. Efekt léčby PEG IFN na vývoj disability s ohledem na vliv pohlaví jsme neprokázali, což je ve shodě s předchozími studiemi [18].
Z hlediska nežádoucích účinků v souvislosti s léčbou PEG IFN se nejčastěji vyskytovaly reakce v místě vpichu a flu-like syndrom, který byl přítomen asi u třetiny pacientů, nicméně vedl k vysazení léku pouze ve třech případech. Ve studii ADVANCE byl flu-like syndrom přítomen asi u poloviny pacientů a vedl k ukončení léčby u 6 % z nich. Důvodem vyšší adherence k terapii v našem souboru může být edukace pacientů o nežádoucích účincích v souvislosti s užíváním PEG IFN. Z laboratorních nežádoucích účinků se nejčastěji vyskytovaly změny v krevním obraze (leukopenie, lymfopenie či neutropenie), které jsme zaznamenali téměř u třetiny pacientů. Nicméně pouze u jedné pacientky byla z tohoto důvodu indikována změna terapie. Ve studii ADVANCE byly změny v krevním obraze přítomny u 10 % pacientů. K elevaci jaterních testů došlo v našem souboru u více než čtvrtiny pacientů, pouze v 5 % však byla opakovaně hodnota jaterních testů více než pětinásobná, a byla tak důvodem pro ukončení terapie PEG IFN. Ve studii ADVANCE byla přítomna elevace jaterních testů u více než třetiny pacientů, ani v jednom případě nebyla důvodem k přerušení terapie a hodnoty se v průběhu dvouletého sledování normalizovaly. Vyšší výskyt elevace jaterních testů a abnormit v krevním obraze v našem souboru ve srovnání se studií ADVANCE je pravděpodobně důsledkem vyšší frekvence odběrů, což může vést k většímu záchytu laboratorních abnormit u námi sledovaných pacientů. Výrazná elevace jaterních testů se nevyskytovala u pacientů dříve již léčených jinými DMD. Nejpravděpodobnějším vysvětlením je anamnesticky prodělaná hepatopatie v souvislosti s léčbou DMD v minulosti, těmto pacientům proto nebyl PEG IFN nasazen. Všichni pacienti, u nichž byl lék vysazen z důvodu výrazné elevace jaterních testů, byli terapeuticky naivní. Většina pacientů v našem souboru byla klinicky stabilizovaná, z laboratorních výsledků má vliv na průběh onemocnění rozvoj NAbs, k čemuž došlo u jedné pacientky. Další nežádoucí účinky (mírná trombocytopenie, alergická reakce, tyreotoxikóza, rozvoj deprese) byly v našem souboru málo časté.
Závěr
Pegylovaný interferon beta 1-a je dobře tolerovaný preparát s příznivým bezpečnostním profilem, který vede ke stabilizaci onemocnění. Výhodou je nízká frekvence aplikace, což může vést ke zvýšené spokojenosti pacientů s léčbou a k vyšší ochotě pacienta dodržovat léčbu (compliance).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Eva Němá, Ph.D.
Neurologická klinika 2. LF UK a FN Motol
V Úvalu 84
150 06 Praha
e-mail: eva.nemaa@gmail.com
Přijato k recenzi: 9. 1. 2019
Přijato do tisku: 5. 8. 2019
Tato práce byla podpořena grantem GAUK č. 2120233.
Sources
1. Harris JM, Chess RB. Effect of pegylation on pharmaceuticals. Nat Rev Drug Discov 2003; 2(3): 214–221. doi: 10.1038/ nrd1033.
2. Kang JS, Deluca PP, Lee KC. Emerging PEGylated drugs. Expert Opin Emerg Drugs 2009; 14(2): 363–380. doi: 10.1517/ 14728210902907847.
3. Fishburn CS. The pharmacology of PEGylation: balancing PD with PK to generate novel therapeutics. J Pharm Sci 2008; 97(10): 4167–4183. doi: 10.1002/ jps.21278.
4. Kieseier BC, Arnold DL, Balcer LJ et al. Peginterferon beta-1a in multiple sclerosis: 2-year results from ADVANCE. Mult Scler 2015; 21(8): 1025–1035. doi: 10.1177/ 1352458514557986.
5. Nikfar S, Rahimi R, Abdollahi M. A meta-analysis of the efficacy and tolerability of interferon-β in multiple sclerosis, overall and by drug and disease type. Clin Ther 2010; 32(11): 1871–1888. doi: 10.1016/ j.clinthera.2010.10.006.
6. Alba Palé L, León Caballero J, Samsó Buxareu B et al. Systematic review of depression in patients with multiple sclerosis and its relationship to interferon β treatment. Mult Scler Relat Disord 2017; 17 : 138–143. doi: 10.1016/ j.msard.2017.07.008.
7. Štourač P, Horáková D, Klímová E et al. AMETYST – výsledky observační studie fáze IV sledující účinky intramuskulárně podávaného interferonu beta-1a u pacientů s klinicky izolovaným syndromem / klinicky definitivní roztroušenou sklerózou. Cesk Slov Neurol N 2017; 80/ 113(6): 660–665. doi: 10.14735/ amcsnn2017660.
8. Hunt D, Kavanagh D, Drummond I et al. Thrombotic microangiopathy associated with interferon beta. N Engl J Med 2014; 370(13): 1270–1271. doi: 10.1056/ NEJMc1316118.
9. Kreisler A, de Seze J, Stojkovic T et al. Groupe septentrional d‘étude et de recherche sur la Sclérose en Plaques (G-SEP). Multiple sclerosis, interferon beta and clinical thyroid dysfunction. Acta Neurol Scand 2003; 107(2): 154–157. doi: 10.1034/ j.1600-0404.2003.02009.x.
10. Tolley K, Hutchinson M, You X et al. A Network meta--analysis of efficacy and evaluation of safety of subcutaneous pegylated interferon beta-1a versus other injectable therapies for the treatment of relapsing-remitting multiple sclerosis. PLoS ONE 2015; 10(6): e0127960. doi: 10.1371/ journal.pone.0127960.
11. Pavelek Z, Sobíšek L, Horáková D et al. Srovnání účin¬nosti subkután¬ně podávaného interferonu β-1a 44 μg, dimetyl fumarátu a fingolimodu v reálné klinické praxi – multicentrická observační studie. Cesk Slov Neurol N 2018; 81/ 114(4): 457–465. doi: 10.14735/ amcsnn 2018457.
12. Thompson AJ, Banwell BL, Barkhof F et al. Diagnosis of multiple sclerosis: 2017 revisions of the McDonald criteria. Lancet Neurol 2018; 17(2): 162–173. doi: 10.1016/ S1474-4422(17)30470-2.
13. Keřkovský M, Stulík J, Obhlídalová I et al. P. Moderní techniky MR zobrazení u roztroušené sklerózy. Cesk Slov Neurol N 2017; 80/ 113(6): 647–657. doi: 10.14735/ amcsnn2017647.
14. Hendin B, Naismith RT, Wray SE et al. Treatment satisfaction significantly improves in patients with multiple sclerosis switching from interferon beta therapy to peginterferon beta-1a every 2 weeks. Patient Prefer Adherence 2018; 12 : 1289–1297. doi: 10.2147/ PPA.S157317.
15. Gajofatto A, Bacchetti P, Grimes B et al. Switching first-line disease-modifying therapy after failure: impact on the course of relapsing-remitting multiple sclerosis. Mult Scler 2009; 15(1): 50–58. doi: 10.1177/ 135245850809 6687.
16. Arnold DL, Calabresi PA, Kieseier BC et al. Peginterferon beta-1a improves MRI measures and increases the proportion of patients with no evidence of disease activity in relapsing-remitting multiple sclerosis: 2-year results from the ADVANCE randomized controlled trial. BMC Neurology 2017; 17(1): 29. doi: 10.1186/ s12883-017-0799-0.
17. Trojano M, Liguori M, Bosco Zimatore G et al. Age-related disability in multiple sclerosis. Ann Neurol 2002; 51(4): 475–480.
18. Magyari M, Koch-Henriksen N, Laursen B et al. Gender effects on treatment response to interferon-beta in multiple sclerosis. Acta Neurol Scand 2014; 130(6): 374–379. doi: 10.1111/ ane.12277.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2019 Issue 5
- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Memantine Eases Daily Life for Patients and Caregivers
-
All articles in this issue
- Kompresivní neuropatie jako nemoc z povolání
- Refrakterní myastenia gravis – klinická charakteristika a možnosti biologické léčby
- Úloha pohybovej aktivity v liečbe pacientov s Parkinsonovou chorobou
- Změna struktury paraspinálních svalů u pacientů s chronickými nespecifickými bolestmi dolní části zad
- Léčba nespavosti při neuropatické bolesti
- Rozsáhlý cervikální hematom po minimálním traumatu
- Perinatální paréza brachiálního plexu na podkladě avulze, řešená konzervativně
- Plicní arteriovenózní malformace jako vzácná příčina ischemické cévní mozkové příhody
- Akutní amnestický syndrom při bilaterální lézi hipokampů jako raritní projev CMP
- Perforace jícnu způsobená dislokovanou krční dlahou pět let po operaci krční páteře – vzácná komplikace
- Závažné vaskulopatie u neurofibromatózy typu 1
- Simultánní vícečetné intracerebrální hemoragie
- Význam kolaterální cirkulace u akutní okluze arteria basilaris
- Možnosti stanovení likvorového tripletu tau proteinů a β-amyloidu 42 metodami ELISA a orientační normativní vodítka
- Endoskopické operace výhřezu bederních meziobratlových plotének – první zkušenosti
- Pegylovaný interferon beta 1-a v klinické praxi
- Kongenitální fibróza zevních okohybných svalů u české rodiny a její molekulárně genetická příčina
- Analýza dat v neurologii LXXVII. Korelační analýza vícerozměrných souborů kvantitativních dat – příklady
- Recenze knih
- Jiný pohled na inhibitor agregace krevních destiček klopidogrel – vhodné antiedematikum v předklinickém modelu poranění mozku?
- CRP stanovený vysoce senzitivní metodou u pacientů s ichemickou cévní mozkovou příhodou – od rizikových faktorů po vývoj
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Léčba nespavosti při neuropatické bolesti
- Kompresivní neuropatie jako nemoc z povolání
- Změna struktury paraspinálních svalů u pacientů s chronickými nespecifickými bolestmi dolní části zad
- Endoskopické operace výhřezu bederních meziobratlových plotének – první zkušenosti
