COVID-19 asociovaná myelitida – kazuistika vzácné komplikace závažné SARS-CoV-2 infekce
Authors:
H. Bartoš 1,2; L. Fabianová 1,3; P. Dlouhý 1; D. Ospalík 4
Authors‘ workplace:
Infekční oddělení, Masarykova, nemocnice, Ústí nad Labem
1; 3. LF UK, Praha
2; LF MU, Brno
3; Neurologické oddělení, Masarykova, nemocnice, Ústí nad Labem
4
Published in:
Cesk Slov Neurol N 2021; 84/117(4): 410-412
Category:
Letters to Editor
doi:
https://doi.org/10.48095/cccsnn2021410
Vážená redakce,
popisujeme jednu ze vzácných neurologických komplikací onemocnění COVID-19, kterou je akutní myelitida.
Onemocnění COVID-19 se u většiny pacientů projeví horečkou a respiračními symptomy, část infekcí probíhá asymptomaticky. S celosvětově přibývajícím počtem nemocných se objevuje řada mimoplicních projevů: postižení srdce a cév [1], ledvin, gastrointestinálního traktu [2], kůže [3], očí [4] a také nervového systému. Z neurologických projevů se uvádějí nejčastěji anosmie a ageuzie, vzácnější jsou encefalopatie a poruchy vědomí nebo cerebrovaskulární komplikace [5]. Byly popsány také případy Guillain-Barréova syndromu [6]. Jak se ukazuje v několika publikovaných kazuistikách, závažnou komplikací může být i akutní myelitida [7–9].
Šedesátisedmiletý obézní pacient s arteriální hypertenzí, ischemickou chorobou srdeční a diabetem mellitem 2. typu byl na konci března 2020 přijat na jednotku intenzivní péče Infekčního oddělení Masarykovy nemocnice pro respirační insuficienci při infekci dýchacích cest. Vzhledem k epidemiologické situaci bylo vysloveno podezření na onemocnění COVID-19. Vstupně byl při plném vědomí, tachykardický, s normálním krevním tlakem, febrilní a výrazně dyspnoický. Pulzní oxymetrií změřená saturace kyslíkem (SpO2) dosahovala 86 % při dýchání atmosférického vzduchu, 94 % při podávání kyslíku maskou s průtokem 5 l/min. Dle vyšetření krevních plynů se jednalo o hypoxemicko-hyperkapnické respirační selhání. Při přijetí nemocný spontánně pohyboval všemi končetinami, také ostatní neurologický nález byl bez patrného deficitu. V laboratorních výsledcích byla nápadná výrazná elevace CRP (266,9 mg/l) s jen lehce zvýšenou koncentrací prokalcitoninu (0,9 µg/l), leukocytóza (12,6×109/l) bez lymfopenie, hyperlaktatémie (3,62 mmol/l) a vyšší hodnota D-dimerů (1,07 mg/l). Rentgenový snímek plic potvrdil rozsáhlou oboustrannou pneumonii.
Ihned byla zahájena neinvazivní plicní ventilace, byla podávána bronchodilatancia. Empiricky byla nasazena antibiotická terapie (ceftriaxon a azithromycin). Po potvrzení koronavirové etiologie metodou RT-PCR (SARS-CoV-2 RNA pozitivní ve výtěru z nosohltanu i v krvi) byla přidána v dané chvíli jediná dostupná specifická experimentální léčba hydroxychlorochinem (1. den 800 mg, další 4 dny v dávce 400 mg/den). Den po přijetí musel být pacient pro progresi dušnosti intubován a byla zahájena umělá plicní ventilace. Přiměřené oxygenace bylo dosahováno obtížně – v režimu BiPAP (bilevel positive airway pressure) s vysokým PEEP (positive end-expiratory pressure) a FiO2, většinu času v pronační poloze a za současné hluboké sedace a kontinuální svalové relaxace.
Vyšetření CT hrudníku ukázalo rozsáhlé zánětlivé infiltráty v obou plicních křídlech s rozvojem těžkého ARDS (acute respiratory distress syndrom). Ejekční frakce levé komory zůstala dle echokardiografického vyšetření dobře zachována. Pro trvající závislost na ventilátoru byla nutná tracheostomie. Při kontrolní CT plic zaujímaly fibroticko-zánětlivé změny cca 50–60 % parenchymu, proto byly nasazeny systémově glukortikoidy (prednison v dávce 0,5 mg/kg/den). V dalším průběhu došlo pozvolna ke zlepšení ventilačních parametrů, regresi patologických změn na RTG plic i zlepšení klinického stavu.
Průběh onemocnění byl komplikován opakovanými bakteriálními a mykotickými superinfekcemi plic (v aspirátu Enterococcus faecalis, Klebsiella pneumoniae ESBL+, Aspergillus fumigatus), které byly léčeny ampicilinem, karbapenemy a vorikonazolem.
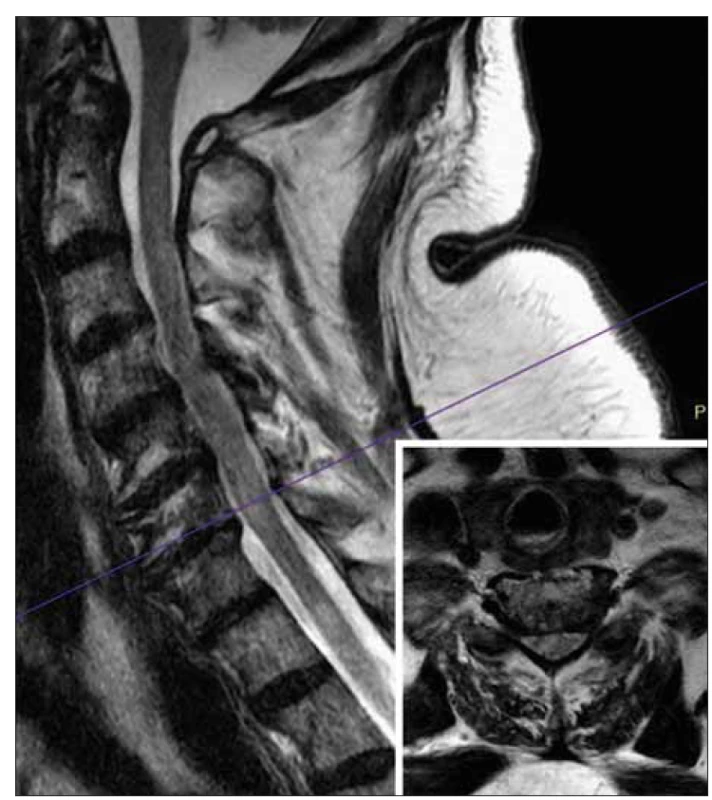
Když stav pacienta umožnil výrazné snížení sedace, byla nově pozorována paréza levé horní končetiny a plegie obou dolních končetin, dle klinického obrazu periferního typu, dále úplná anestezie dolních končetin a dolní části trupu od úrovně dermatomu Th 6–8. CT mozku vč. angiografie neprokázala patologické změny. Byla vyslovena suspekce na akutní demyelinizační polyneuropatii. Vyšetřením likvoru byla zjištěna proteinocytologická disociace: celková bílkovina 2 329 mg/l, polymorfonukleáry 6/3 µl, mononukleáry 20/3 µl, glykorhachie 4,53 mmol/l, koeficient energetické bilance 27,11, laktát 2,74 mmol/l. MR míchy zobrazila vícečetné hyperintenzní okrsky v krční a hrudní míše (C3–Th7) nahodilé distribuce charakteru infekční či postinfekční myelitidy (obr. 1). Na základě tohoto nálezu podstoupil pacient sérii 10 výměnných plazmaferéz. Bylo zvažováno použití rekonvalescentní plazmy jako výměnného roztoku, ale vyšetřením krve na přítomnost SARS-CoV-2 RNA již nebyla zjištěna virémie, a proto byl použit standardní fyziologický roztok s 20% albuminem. Od sedmé plazmaferézy prováděné současně s intenzivní rehabilitací docházelo k postupnému zlepšení neurologického nálezu – posunutí hranice čití kaudálně od úrovně dermatomu L1, objevila se minimální motorická aktivita dolních končetin (tonizace), paréza levé horní končetiny byla výrazně zlepšena se schopností úchopu a sebeobsluhy, s dopomocí se pacient i posadil.
Přes pohybové artefakty jsou v krční míše viditelné hypersignální oblasti T2 odpovídající
myelitidě. Fialová čára ukazuje rovinu příčného řezu, která byla následně znovu dokončena
v T2-váženém obrazu (viz malý obrázek v pravém dolním rohu). Tento příčný řez ukazuje
hypersignální oblast v pravé polovině míchy.
Fig. 1. MRI. Sagittal T2-weighted images of the cervical spinal cord.
Despite motion artifacts, T2 hypersignal areas corresponding to myelitis are visible in the
cervical spinal cord. The purple line shows the plane of the transverse section, which was
subsequently completed again in T2-weighted image (see small figure in the right lower
corner). This transverse section shows a hypersignal area in the right half of the spinal cord.
V likvoru nebyla metodou RT-PCR prokázána přítomnost SARS-CoV-2 RNA, ale vzorek byl odebrán po více než měsíci od počátku onemocnění. Vyšetření na přítomnost protilátek IgA i IgG anti-SARS-CoV-2 bylo pozitivní v séru, ale negativní v likvoru. Sérologická vyšetření nejčastějších infekčních původců myelitidy (influenza, parainfluenza, respirační synciciální virus, klíšťová encefalitida, borrelie, Mycoplasma pneumoniae, virus Epstein-Barrové, cytomegalovirus, HIV, lues) byla negativní. Negativní byly imunologické testy (antigangliosidové protilátky, protilátky proti aquaporinu-4, anti-MOG protilátky, oligoklonální pásy).
Po více než 80 dnech hospitalizace na jednotce intenzivní péče byl pacient přeložen na specializovanou spinální jednotku, při překladu pacient dýchal spontánně, otvor po tracheostomii se hojil, byl oběhově stabilní, se zachovalou diurézou, těžkou paraparézou dolních končetin, v dobré psychické kondici.
Vyšetření prezentovaného pacienta bylo limitováno nutností dlouhodobé, hluboké sedace a svalové relaxace, dostatečné odtlumení a validní neurologické vyšetření pacienta byly možné až po 27 dnech od zahájení umělé plicní ventilace. Některá vyšetření (např. EMG či MR mozku) nebyla provedena vzhledem k probíhající epidemii a kvůli závažnosti stavu nemocného s velmi obtížnou umělou plicní ventilací.
Léčbou volby u transverzální myelitidy je bolusová kortikoterapie. Nicméně v klinickém nálezu nebyla přítomná spastická paréza, jak by se dalo očekávat, nýbrž byla přítomná paréza periferní. Klinicky by stav mohl odpovídat i akutní polyradikuloneuritidě (acute inflammatory demyelinating polyradiculoneuropathy; AIDP), neboť hranice čití na trupu byla popisována i u polyradikuloneuritid – tzv. Guillain-Barré-myelitis overlap syndrome [10]. Výměnné plazmaferézy byly zvoleny z důvodu, že jsou druhou léčebnou modalitou transverzální myelitidy a současně první léčebnou modalitou AIDP (kde je kortikoterapie bez efektu). Akutně vzniklá myelitida v souvislosti s onemocněním COVID-19 byla referována již v několika publikovaných kazuistikách. V případě našeho pacienta byla zvažována jak duální infekce, tak souběh s autoimunitním onemocněním, nic z toho se ale nepotvrdilo. Teoreticky nelze vyloučit podíl lékové toxicity. V rámci širší diferenciální diagnostiky chybí vyšetření onkoneuronálních protilátek. Na tíži a délku trvání neurologického deficitu mělo jistě vliv i relativně pozdní stanovení diagnózy i podíl myopatie kriticky nemocných.
SARS-CoV-2 může být jedním z potenciálních spouštěčů myelitidy, u nemocných s COVID-19 je proto třeba pečlivě pátrat také po neurologických příznacích. U nemocných v intenzivní péči je důležité co nejčastější zhodnocení neurologického stavu, např. za použití denního přerušení sedace, pokud toto kritický stav dovolí.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manu script met the ICMJE “uniform requirements” for biomedical papers.
MUDr. Hynek Bartoš
Infekční oddělení
Masarykova nemocnice
Sociální péče 3316/12A
400 11 Ústí nad Labem
e-mail: hynek.bartos@kzcr.eu
Přijato k recenzi: 21. 2. 2021
Přijato do tisku: 15. 7. 2021
Sources
1. Guo T, Fan Y, Chen M et al. Cardiovascular implications of fatal outcomes of patients with coronavirus disease 2019 (COVID-19). JAMA Cardiol 2020; 5 (7): 811–818. doi: 10.1001/jamacardio.2020.1017.
2. Mao R, Qiu Y, He J-S et.al. Manifestations and prognosis of gastrointestinal and liver involvement in patients with COVID-19: a systematic review and meta-analysis. Lancet Gastroenterol Hepatol 2020; 5 (7): 667–678. doi: 10.1016/S2468-1253 (20) 30126-6.
3. Guarneri C, Rullo EV, Pavone P et al. Silent COVID-19: what your skin can reveal. Lancet Infect Dis 2021; 21 (1): 24–25. doi: 10.1016/S1473-3099 (20) 30402-3.
4. Wu P, Duan F, Luo C et al. Characteristics of ocular findings of patients with coronavirus disease 2019 (COVID-19) in Hubei Province, China. JAMA Ophthalmol 2020; 138 (5): 575–578. doi: 10.1001/jamaophthalmol.2020.1291.
5. Zubair AS, McAlpine LS, Gardin T et al. Neuropathogenesis and neurologic manifestations of the coronaviruses in the age of coronavirus disease 2019: A Review. JAMA Neurol 2020; 77 (8): 1018–1027. doi: 10.1001/jamaneurol.2020.2065.
6. Toscano G, Palmerini F, Ravaglia S et al. Guillain-Barré syndrome associated with SARS-CoV-2. N Engl J Med 2020; 382 (26): 2574–2576. doi: 10.1056/NEJMc2009191.
7. Munz M, Wessendorf S, Koretsis G, et al. Acute transverse myelitis after COVID-19 pneumonia. J Neurol 2020; 267 (8): 2196–2197. doi: 10.1007/s00415-020-09934-w.
8. AlKetbi R, AlNuaimi D, AlMulla M et al. Acute myelitis as a neurological complication of Covid-19: a case report and MRI findings. Radiol Case Rep 2020; 15 (9): 1591–1595. doi: 10.1016/j.radcr.2020.06.001.
9. Zhao K, Huang J, Dai D et al. Acute myelitis after SARS-CoV-2 infection: a case report (PREPRINT). MedRxiv 2020. doi: 10.1101/2020.03.16.20035105.
10. Guo F, Zhang YB. Clinical features and prognosis of patients with Guillain-Barré and acute transverse myelitis overlap syndrome. Clin Neurol Neurosurg 2019; 181 : 127–132. doi: 10.1016/j.clineuro.2019.04. 014.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2021 Issue 4
- Memantine Eases Daily Life for Patients and Caregivers
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Advances in the Treatment of Myasthenia Gravis on the Horizon
-
All articles in this issue
- Editorial
- Proč se dráhy kříží? Základní principy uspořádání mozku obratlovců
- Role mikroRNA v patogenezi spinální muskulární atrofie
- Nové možnosti laboratórnej diagnostiky ochorení spojených s tvorbou amyloidov
- Využití rohovkové konfokální mikroskopie u neurologických onemocnění
- Poruchy čichu po COVID-19 – diagnostika, význam a léčba
- Studijní protokol – robotická terapie chůze pomocí přístroje Lokomat Pro FreeD u pacientů v subakutní fázi ischemické cévní mozkové příhody
- Validace dotazníku pro poruchy chůze u pacientů s roztroušenou sklerózou – česká verze MSWS-12
- COVID-19 u nemocných s myasthenia gravis
- CANVAS – nově identifikovaná genetická příčina ataxie s pozdním nástupem. Popis prvních diagnostikovaných pacientů v České republice
- COVID-19 asociovaná myelitida – kazuistika vzácné komplikace závažné SARS-CoV-2 infekce
- Intramedulární absces
- Informace vedoucího redaktora
- Prof. MUDr. Hana Krejčová, DrSc. 90letá
- Aktualita z kongresu EAN 2021
- Voľné ľahké reťazce kappa pri roztrúsenej skleróze – diagnostická hodnota a porovnanie s ďalšími markermi
- Charakterizace poruch polykání při myasthenia gravis pomocí flexibilního endoskopického vyšetření
- Standardizace slovinské verze škály Alzheimer’s Disease Assessment Scale – kognitivní subškála (ADAS-Cog)
- Frekvence tichého mozkového infarktu při pravé polycytémii a esenciální trombocytóze
- Benefity vyšetření 18F-FET PET v předoperačním posouzení heterogenity gliálních tumorů demonstrovány na dvou kazuistikách
- Úspěšné použití rituximabu u pacienta s překrytím myelinové oligodendrocytové glykoproteinové encefalomyelitidy a systémového lupus erythematosus
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Poruchy čichu po COVID-19 – diagnostika, význam a léčba
- CANVAS – nově identifikovaná genetická příčina ataxie s pozdním nástupem. Popis prvních diagnostikovaných pacientů v České republice
- Proč se dráhy kříží? Základní principy uspořádání mozku obratlovců
- COVID-19 asociovaná myelitida – kazuistika vzácné komplikace závažné SARS-CoV-2 infekce
