Význam produktov Maillardovej reakcie v strave dojčiat
Maillard Reaction Products in Infant Nutrition
During food-processing under high temperatures, sugars, oxidized lipids and vitamin C spontaneously form with proteins substances called Maillard reaction products (MRPs). Industrial processing of artificial infant formulas (IF) requires heat-sterilization. Thus, content of MRPs in IF is much higher than in the human mother milk. Excessive intake of MRPs from thermally processed foods may exert biological effects in patients with diabetes or renal insufficiency, but also in healthy adults, e.g. increase of inflammatory markers and markers of oxidative damage, nephrotoxic and diabetogenic effects, weight gain, and thus may participate in the development or aggravation of obesity, atherosclerosis, nephropathy and diabetes. In infants, the high intake of MRPs in consumed artificial infant formulas represents a burden of potentially noxious substances. These results point at a new mechanism explaining the well-known physiological dominance of human breast milk over the artificial infant formula.
Key words:
thermally processed food, Maillard reaction products, CML, human breast milk, formula, hydrolyzed formula
Authors:
K. Klenovicsová 1,2; G. Saavedra 3; C. Zumpe 3; V. Somoza 4; I. Birlouez-Aragon 3; L. Kovács 2; K. Šebeková 1
Authors‘ workplace:
Oddelenie klinickej a experimentálnej farmakoterapie, Slovenská zdravotnícka univerzita, Bratislava
prednosta doc. MUDr. M. Gajdoš, CSc.
1; 2. detská klinika DFNsP a LFUK, Bratislava
prednosta prof. MUDr. L. Kovács, DrSc., MPH
2; Polytechnický inštitút LaSalle Beauvais, Francúzsko
3; Nemecký inštitút potravinovej chémie, Garching, Nemecko
4
Published in:
Čes-slov Pediat 2008; 63 (10): 565-573.
Category:
Review
Overview
Pri tepelnej úprave potravín vznikajú spontánne reakciou sacharidov, oxidovaných lipidov alebo vitamínu C s bielkovinami látky nazývané produkty Maillardovej reakcie (Maillard reaction products, MRP). Nakoľko priemyselná výroba dojčenských formúl vyžaduje tepelnú sterilizáciu, dojčenské formuly obsahujú v porovnaní s materským mliekom vysoké koncentrácie MRP. Ich nadmerný alimentárny prívod môže indukovať u zdravých dospelých, ale najmä u pacientov s diabetom či renálnou insuficienciou biologické účinky, ako napr. zvýšenie zápalových markerov, ukazovateľov oxidačného poškodenia, nefrotoxické a diabetogénne účinky, priberanie na hmotnosti, ktoré môžu viesť k prehĺbeniu alebo rozvoju obezity, aterosklerózy, nefropatie či diabetu. Prvé výsledky signalizujú, že vysoký príjem MRP v umelej strave dojčiat je spojený s vyššou záťažou detského organizmu týmito potenciálne škodlivými látkami. Tieto údaje poukazujú na nové skutočnosti vysvetľujúce všeobecne známu a jednoznačnú fyziologickú nadradenosť materského mlieka nad umelou výživou dojčiat.
Kľúčové slová:
tepelné spracovanie potravy, produkty Maillardovej reakcie, CML, materské mlieko, formula, hydrolyzovaná formula
Úvod
Tepelné spracovanie potravy zabezpečuje základné hygienické požiadavky mikrobiálnej nezávadnosti, umožňuje dlhšie skladovanie stravy a zvyšuje jej nutričnú hodnotu. Umožňuje konzumovať inak ťažko stráviteľné zložky potravy a spestruje jedálniček o potraviny s lákavou vôňou, chuťou a príťažlivým vzhľadom. Za kulinársky zážitok zodpovedajú najmä produkty Maillardovej reakcie (Maillard reaction products, MRP), ktoré vznikajú v potrave upravenej pri teplote >100 °C. Výsledky experimentálnych štúdií u hlodavcov a klinických štúdií u zdravých dobrovoľníkov a pacientov poukazujú na skutočnosť, že z potravy pochádzajúce MRP sa čiastočne vstrebávajú do cirkulácie [1, 2]. Tieto štúdie dávajú nadmernú konzumáciu vysoko tepelne upravenej stravy do súvislosti aj s nežiaducimi a zdraviu škodlivými účinkami [3–15].
Výživa v prvých mesiacoch života hrá dôležitú úlohu pre zdravý rast a vývoj dieťaťa [16]. Výhody dojčenia sú nesporné, účinkom tejto prirodzenej výživy sa venujú mnohé štúdie [17–20].
Produkty Maillardovej reakcie sú prítomné aj v prípravkoch umelej dojčenskej výživy, v rádovo vyšších koncentráciách v porovnaní s materským mliekom [21, 22]. V prehľadnom článku poukazujeme na skutočnosť, že MRP z prípravkov umelej dojčenskej výživy sa pravdepodobne vstrebávajú do obehu dojčiat, a v tejto súvislosti upozorňujeme na ich možné nežiaduce účinky.
Vznik MRP v potravinách
MRP boli prvýkrát popísané na začiatku 20. storočia francúzskym biochemikom C. Maillardom v súvislosti s farebnou zmenou – hnednutím – tepelne upravovaných potravín [23]. MRP vznikajú spontánne neenzymatickou glykáciou, t.j. reakciou cukrov s aminoskupinami bielkovín, peptidov, alebo aminokyselín. Amadoriho produkty, vznikajúce v prvom stupni reakcie, sa následnými komplexnými zmenami premieňajú na heterogénnu zmes MRP (obr. 1). Ich koncentrácia sa zvyšuje úmerne s teplotou prípravy pokrmu, dobou tepelného spracovania, ako aj dĺžkou skladovania. MRP vznikajú rýchlo pri teplotách nad 100 °C, napr. pri vyprážaní, grilovaní, fritovaní a pečení, a v podstatne nižšej miere pri krátkom varení alebo dusení stravy.
V súčasnosti je chemicky definovaných len niekoľko Maillardových produktov, napr. furozín, fruktózolyzín, laktulozyllyzín, pentozidín, imidazolóny, karboxyetyl - či karboxymetyl-lyzín (CML), ktorý sa považuje za výborný indikátor Maillardovej reakcie v potravinách [24].
Konzumácia MRP v bežnej strave človeka niekoľkonásobne prevyšuje množstvo AGEs (advanced glycation end products, viď nižšie) fyziologicky vznikajúcich v organizme [25]. Výsledky ostatných štúdií dokazujú, že časť glykačných produktov pochádzajúcich z tepelne upravenej stravy sa vstrebáva do obehu a vylučuje sa v dominantnej miere močom [1, 2].
V in vitro podmienkach majú niektoré MRP pozitívne účinky, ako napr. antioxidačnú aktivitu [26, 27], antimutagénny a antikarcinogénny účinok [28], zvyšovanie aktivity biotransformačných enzýmov [29], či schopnosť zabraňovať hnednutiu a tým znehodnoteniu potravín [30]. Iné MRP majú zo zdravotného hľadiska nežiaduce pôsobenie – prooxidačné, proaterogénne alebo prozápalové, poškodzujú DNA [31, 32], alebo prispievajú k dysfunkcii endotelu [33].
Údaje o účinkoch nadmerného prívodu MRP v potrave sú protichodné. Niektoré experimentálne štúdie u zdravých potkanov poukazujú – v súlade s in vitro štúdiami – na benefičné účinky: zvýšenie aktivity biotransformačných enzýmov II. fázy v pečeni [34], zvýšený celkový antioxidačný status [35] alebo zlepšenie glykémie a glykozúrie u diabetických potkanov [36].
Väčšina publikovaných štúdií u experimentálnych zvierat (zdravých, diabetických alebo v chronickej renálnej insuficiencii – CRI), ako i klinických štúdií u zdravých dobrovoľníkov, pacientov s diabetom alebo v CRI však popisuje po diéte s vysokým obsahom MRP významné zvýšenie cirkulujúcich AGEs, ich hromadenie v tkanivách, a dáva ich do súvislosti so širokou paletou pozorovaných negatívnych účinkov. U zdravých hlodavcov podávanie diéty bohatej na MRP viedlo k zvýšeniu koncentrácií markerov lipoperoxidácie [3, 4], homocysteínu, k zvýšeniu proteinúrie a hmotnosti tela a orgánov (srdce, pečeň, oblička, pľúca) [5]. U diabetických myší sa pozoroval prírastok na hmotnosti, vyššia inzulinémia na lačno, nižšia glukózová a inzulínová tolerancia, akcelerácia diabetickej nefropatie či aterosklerotických komplikácií, pomalšie hojenie rán a kratšie prežívanie zvierat [6–10]. U potkanov v CRI podávanie stravy s vysokým obsahom MRP zvyšovalo proteinúriu, akcelerovalo rozvoj renálnej fibrózy a zápalovej infiltrácie obličky [11].
U zdravých dobrovoľníkov sa po konzumácii potravy s vysokým obsahom Maillardových produktov pozorovalo zvýšenie koncentrácií AGEs v plazme, zvýšenie hmotnosti, zápalových markerov a inzulínu v sére, zvýšená renálna exkrécia AGEs a albumínu [12, 13]. U pacientov s diabetom sa popisuje zníženie vazodilatačnej funkcie endotelu už po jednorazovom príjme potravy s vysokým obsahom MRP [14]. Obmedzenie príjmu MRP v potrave pacientov s diabetom alebo pacientov v CRI bolo spojené s významným znížením koncentrácií cirkulujúcich AGEs, zápalových ukazovateľov (CRP, TNF-α) a markerov endoteliálnej dysfunkcie (VCAM-1) [15, 32].
Nežiaduce účinky nadmerného príjmu vysoko tepelne upravenej stravy popísané v experimentálnych štúdiách na hlodavcoch a klinických štúdiách sú zhrnuté v tabuľke 1.
![Biologické účinky nadmernej konzumácie tepelne spracovanej potravy (upravené podľa [2]).](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/a7912b3a620795e1c1c2af593968d333.png)
Produkty pokročilej glykácie – in vivo analógy MRP
Ako AGEs označujeme analógy MRP, vznikajúce in vivo, aj za fyziologických okolností v zdravom organizme, obdobnou reakciou ako sme uviedli vyššie. AGEs sa vekom prirodzene hromadia v cirkulácii, alebo v tkanivách s vysokým obsahom bielkovín s dlhou životnosťou (kolagén, elastín, myelín). Za určitých patologických stavov je možný aj alternatívny spôsob ich vzniku systémovo alebo lokálne, počas zvýšeného oxidačného alebo karbonylového stresu (napr. hyperglykémia, urémia) [37–40] (obr. 1).
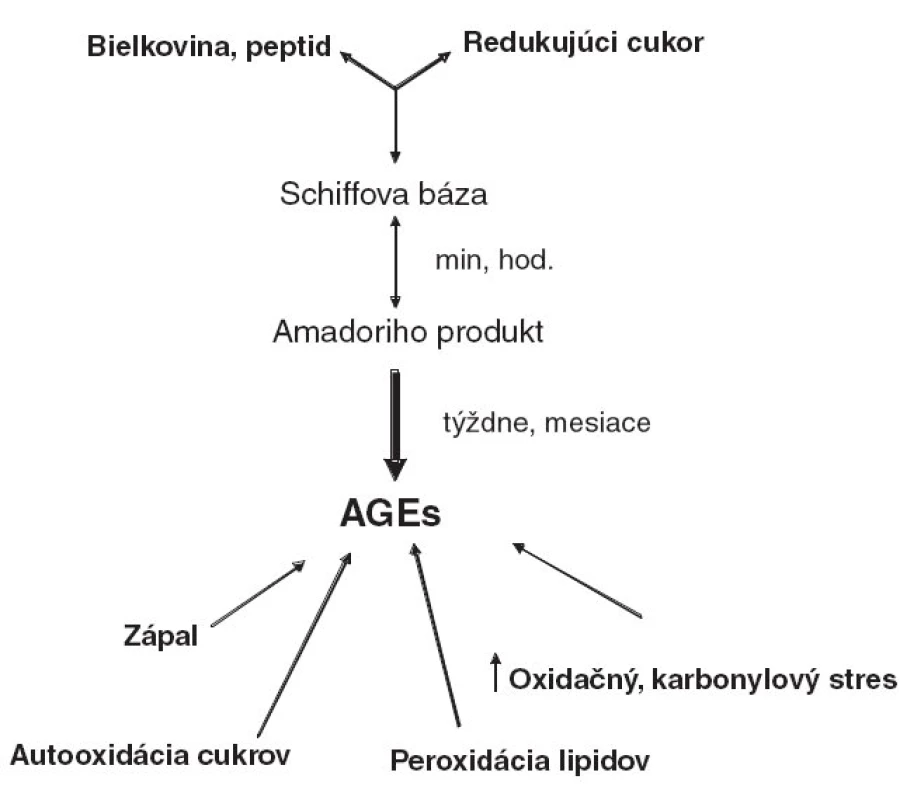
Metabolizmus AGEs
Za fyziologických okolností sú koncentrácie AGEs v plazme odrazom ich tvorby v telesných tekutinách a tkanivách, ich aktuálnej eliminácie: intracelulárnou degradáciou, klírensom v obličkách [41], a podľa niektorých autorov aj elimináciou v pečeni [42, 43], a závisia aj od obratu bielkovín v organizme (obr. 2).
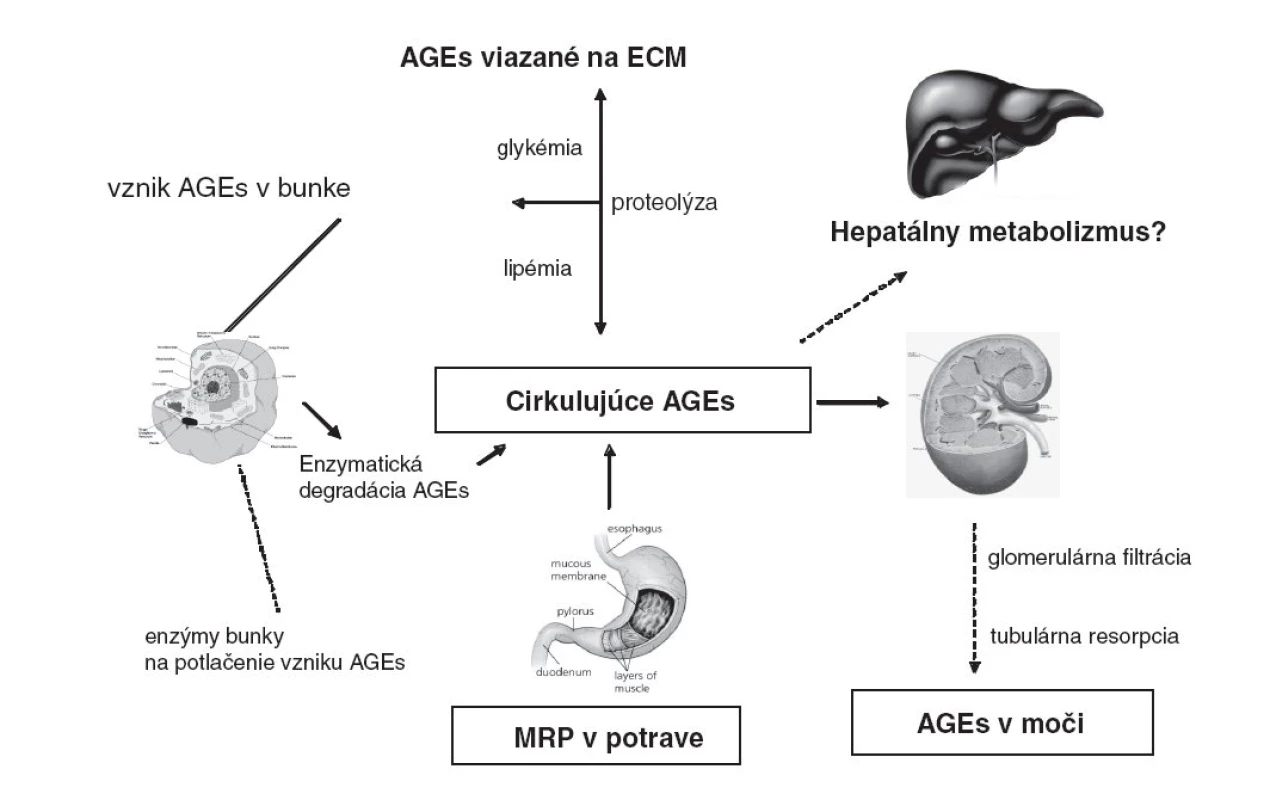
Toxické účinky AGEs
AGE-modifikácia môže priamo poškodzovať štruktúru a funkciu bielkovín, meniť vlastnosti a metabolizmus extracelulárnej hmoty (zhrubnutie bazálnych membrán, sieťovanie kolagénu, rezistencia na proteolytickú degradáciu), znižuje katalytickú aktivitu enzýmov, spomaľuje klírens lipoproteínov. Lokálne alebo systémové hromadenie AGEs môže zohrať úlohu pri vzniku alebo progresii obezity, diabetu, renálneho zlyhania, predčasnej aterosklerózy, Alzheimerovej choroby, katarakty či cirhózy pečene [43–45]. Poškodenie DNA glykovanými produktmi sa dáva do súvislosti s procesom predčasného starnutia organizmu, nárastom mutagenézy a karcinogenézy [46].
Za nepriame toxické účinky produktov pokročilej glykácie zodpovedá ich interakcia so špecifickými povrchovými receptormi buniek, napr. s receptorom pre produkty pokročilej glykácie – RAGE (receptor for advanced glycation end products). Jeho úlohou je väzba a inaktivácia AGEs [47]. Za patologických okolností, ako je zvýšený oxidačný či zápalový stav, dochádza k dlhodobej aktivácii receptor-ligandového komplexu [48], s konečnými dôsledkami v zmysle zápalového, oxidačného a aterogénneho poškodenia tkanív [49] a chronickej endoteliálnej dysfunkcie [50].
MRP vo formulách a materskom mlieku
Tepelné spracovanie dojčenských formúl pri výrobe (pasterizácia, homogenizácia, 3–6-sekundová sterilizácia pri 130–140 °C, sušenie) zabezpečuje ich mikrobiologickú nezávadnosť a skladovateľnosť. Tepelná úprava a skladovanie vo forme prášku prispievajú k vzniku produktov Maillardovej reakcie [21, 51].
Glykáciou lyzínu laktózou vzniká pri výrobe dojčenských formúl laktulozyllyzín. Jeho vznik znižuje nutričnú hodnotu mlieka dôsledkom blokády esenciálnej aminokyseliny lyzínu. Pri obdobnej úprave kravského mlieka a tekutých dojčenských formúl vzniká vo formulách 2–3-krát viac laktulozyllyzínu. V práškových formulách sa koncentrácie laktulozyllyzínu v porovnaní s práškovým kravským mliekom nelíšia [52–54].
V 16 práškových umelých mliečnych prípravkoch dojčenskej výživy komerčne dostupných na Slovensku sme stanovili obsah CML. Stanovenia sme uskutočnili vo formulách podávaných dojčatám zaradeným do klinickej štúdie ICARE [55]. V porovnaní s materským mliekom obsahovali formuly priemerne 70-krát vyššie koncentrácie CML (graf 1). Nemeckí autori udávajú priemerne 35-násobne vyšší obsah CML vo formulách v porovnaní s materským mliekom [56]. Obsah fluorescenčných MRP v práškových formulách je v porovnaní s kravským mliekom 2,5-násobne vyšší a v tekutých dojčenských prípravkoch 2,3-krát vyšší v porovnaní s práškovými formulami [21].

Prípravky s hydrolyzovanými bielkovinami, t.j. hypoantigénne mlieka, sú bohatším zdrojom MRP ako bežné, nehydrolyzované formuly. Pri hydrolýze dochádza k expozícii voľných aminoskupín, ktoré môžu vstupovať do Maillardovej reakcie. Podľa nemeckých autorov je koncentrácia CML v regulárnych formulách takmer 5-násobne vyššia v porovnaní s materským mliekom, ale v hypoalergénnych mliekach dosahuje až 50-násobok oproti koncentráciám v materskom mlieku [56]. Hydrolyzované formuly zo slovenského trhu obsahovali asi 3-krát viac CML ako nehydrolyzované mlieka (graf 1). Obsah CML v počiatočných a pokračujúcich formulách sa významne nelíšil [55]. Fortifikácia formúl vitamínom C, železom, vysoký obsah redukujúcich cukrov (laktóza), polynenasýtených mastných kyselín, alebo prídavok medu zvyšujú obsah MRP [21, 22].
Skladovaním potravín sa ich obsah MRP zvyšuje [51]. Výrobcovia mliečnych formúl odporúčajú spotrebovať obsah otvoreného balenia do 2–4 týždňov. Napriek relatívne krátkej odporúčanej dobe skladovania formúl po ich otvorení sa ich obsah CML v závislosti od doby a teploty skladovania zvyšuje. V nami analyzovaných formulách sa koncentrácia CML zvyšovala najviac v nehydrolyzovaných prípravkoch (+55 % oproti vzorke odobratej na začiatku skladovacieho obdobia) (graf 2) [55]. Počas niekoľkomesačného skladovania mliečno-obilninových kaší sa obsah furozínu, včasného produktu glykácie, zvyšuje o 40 až 90 %, najviac, ak sú skladované pri vyšších teplotách [57].

Z uvedeného vyplýva, že obsah MRP vo formulách, publikovaný v rôznych prácach, sa významne líši. Výsledky sú však ťažko porovnateľné vzhľadom na odlišné metódy predanalytickej prípravy vzoriek, stanovenia, rozdielne vyjadrovanie stupňa glykácie (prepočet na množstvo celkových bielkovín alebo lyzínu) a analýzu formúl od rozličných výrobcov. Výsledky sa však zhodujú v skutočnosti, že obsah produktov Maillardovej reakcie v prípravkoch umelej mliečnej výživy je výrazne vyšší v porovnaní s ich obsahom v materskom mlieku a skladovaním sa ďalej zvyšuje.
Teoretická záťaž dojčenského organizmu alimentárnymi MRP
Z obsahu CML v materskom mlieku a formulách a počtu a objemu denných dávok mlieka sme vypočítali teoretickú dennú expozíciu CML dojčených a umelo živených 6-mesačných detí. U dojčených detí priemerná denná záťaž CML predstavovala príjem 0,005–0,031 mg CML/deň. U umelo živených detí bola priemerná denná expozícia CML 0,76–14,14 mg/deň (p <0,001), t.j. 25–2800-násobne vyššia oproti dojčeným deťom [55].
Vzťah medzi MRP v strave a organizme dojčiat
Vyššie uvedené experimentálne a klinické štúdie sledovali potenciálnu absorpciu a účinky alimentárnych MRP u dospelých jedincov. Otvorenou otázkou ostáva, či sa MRP absorbujú z formúl do obehu dojčiat. Nepreskúmanou je i otázka metabolického tranzitu AGEs z obehu matky do materského mlieka a ich biologická dostupnosť pre dieťa. Ak sa MRP resorbujú z dojčenských formúl do nezrelého detského organizmu, nie sú známe ich biologické účinky.
Z týchto dôvodov sme porovnali koncentrácie CML v plazme a renálnu exkréciu CML v 2 skupinách zdravých 5–7-mesačných dojčiat: v skupine výlučne dojčených detí (n = 34; priemerný vek: 5,9 ± 1,0 mesiacov) a detí, ktoré boli kŕmené výhradne formulami od narodenia (n = 17; priemerný vek: 5,9 ± 1,0 mesiacov). Dojčené deti mali významne nižšie koncentrácie CML v plazme (priemerne o 37 %) v porovnaní s umelo živenými. Nepozorovali sme rozdiel v závislosti od druhu podávanej formuly (hydrolyzovaná versus nehydrolyzovaná) (graf 3) [55].

Renálna exkrécia CML bola u detí kŕmených výlučne formulami 40-násobne vyššia v porovnaní s dojčenými deťmi. Deti kŕmené hydrolyzovanými formulami vylúčili močom o 49 % viac CML ako dojčatá kŕmené nehydrolyzovanými prípravkami (graf 4). Podľa nemeckých autorov [56] sa medzi skupinou dojčených a umelo živených detí vo veku 1–164 dní renálna exkrécia CML nelíšila. Umelo živené dojčatá kŕmené hypoalergénnymi formulami však vylučovali 3-násobne viac CML ako deti, ktoré dostávali bežné formuly.

Zvýšené hodnoty CML v plazme a ich vysoká renálna exkrécia pri príjme potravy s vysokým obsahom MRP naznačujú, že CML sa vstrebáva z formúl do cirkulácie detí a následne sa rýchlo vylučuje z organizmu močom. Mechanizmus transportu CML cez črevnú stenu zatiaľ nie je jasný. V modeli karcinómu hrubého čreva sa aktívny transport CML peptidovými prenášačmi nepotvrdil, ale nemožno vylúčiť iné mechanizmy vstrebávania, napr. cez iónové kanály [58]. Ostáva nejasné, do akej miery môžu byť tieto experimentálne výsledky vzťahované k situácii in vivo, najmä v prípade nezrelého organizmu malých detí. Pri vylúčení aktívneho transportu CML z čreva do cirkulácie by zvýšené koncentrácie CML v plazme umelo živených detí mohli byť prejavom jeho zvýšenej endogénnej syntézy, indukovanej neznámym mechanizmom.
V súčasnosti nie sú známe štúdie, ktoré by sa venovali otázke možných nežiaducich biologických účinkov spôsobených vyššími koncentráciami produktov Maillardovej reakcie v obehu dojčiat kŕmených formulami. Výsledky dostupných experimentálnych a klinických štúdií u dospelých však jednoznačne poukazujú na vysokú aktualitu tejto otázky a potrebu venovať sa jej v budúcnosti.
Záver
V prehľadnej práci sme poukázali na jeden z nových aspektov, potvrdzujúcich známe a klinickými štúdiami dokladované početné výhody kŕmenia dojčiat materským mliekom v porovnaní s formulami. Napriek známym nedostatkom ostávajú formuly prvou voľbou výživy malých detí v prípade, že nemôžu byť dojčené.
Umelá mliečna výživa dojčiat obsahuje produkty Maillardovej reakcie v rádovo vyššej koncentrácii ako materské mlieko. Vysoký obsah MRP v hypoalergénnych – hydrolyzovaných mliekach oproti bežným by mal nabádať k väčšej opatrnosti pri ich podávaní. Produkty glykačnej reakcie sa pravdepodobne resorbujú do cirkulácie detí. O ich biologickej účinnosti a možných zdravotných rizikách na detský organizmus, vyplývajúcich z ich nadmerného príjmu v strave, vieme zatiaľ málo. Zodpovedanie tejto otázky vyžaduje ďalšie sledovanie vzťahu medzi príjmom formúl a zdravotným stavom detskej aj dospelej populácie.
Vzhľadom na vysokú záťaž umelo živených detí MRP z formúl a teoreticky možné nežiaduce zdravotné dôsledky tejto výživy by snahou každého pediatra malo byť preferovanie exkluzívneho dojčenia aspoň v prvom polroku života.
Autori ďakujú pediatrom prvého kontaktu: MUDr. Bradiak F., MUDr. Holanová E., MUDr. Chramcová N., MUDr. Kadlíčková A., MUDr. Kollárová E., MUDr. Križanová E., MUDr. Lásková J., MUDr. Lukyová M., MUDr. Petríková I., MUDr. Polláková V., MUDr. Prokopová E., MUDr. Rapošová R., MUDr. Salcerová J., MUDr. Sláviková E., MUDr. Šimeková L., MUDr. Špániková M., detským klinikám DFNsP a LFUK v Bratislave (MUDr. Vitáriušová E., doc. MUDr. Benedeková M., PhD., mim. prof., MUDr. Vicianová K.) a detským domovom (v Bratislave – PharmDr. Krausová M., Mgr. Malá E., v Trnave – MUDr.Uhrovič F.) za spoluprácu pri odbere vzoriek.
Vlastné výsledky súvisiace s obsahom MRP vo formulách a vzorkách materského mlieka a klinické výsledky u dojčiat uvedené v prehľade boli získané v rámci udeleného grantu 6RP EU: Projekt ICARE, COLL-CT-2005-516415.
MUDr. Kristína Klenovicsová
Oddelenie klinickej a experimentálnej
farmakoterapie
Slovenská zdravotnícka univerzita
Limbová 14
833 03 Bratislava
Slovenská republika
e-mail: kristina.klenovicsova@szu.sk
Sources
1. Somoza V, Wenzel E, Weiss C, et al. Dose-dependent utilization of casein-linked lysinoalanine, N(epsilon)-fructoselysine and N(epsilon)-carboxymethyllysine in food samples. J. Chromatogr. 2006;A1140 : 189–194.
2. Šebeková K, Somoza V. Dietary advanced glycation end products (AGEs) and their health effects – PRO. Mol. Nutr. Food Res. 2007;51 : 1079–1084.
3. Somoza V, Lindenmeier M, Hofmann T, et al. Dietary bread crust advanced glycation end products bind to the receptor for AGEs in HEK-293 kidney cells but are rapidly excreted after oral administration to healthy and subtotally nephrectomized rats. Ann. N. Y. Acad. Sci. 2005;1043 : 492–500.
4. Sandu O, Song K, Cai W, et al. Insulin resistance and type 2 diabetes high fat-fed mice are linked to high glycotoxin intake. Diabetes 2005;54 : 2314–2319.
5. Šebeková K, Hofmann T, Boor P, et al. Renal effects of oral Maillard reaction products load in the form of bread crusts in healthy and subtotally nephrectomized rats. Ann. N. Y. Acad. Sci. 2005;1043 : 482–491.
6. Peppa M, Brem H, Ehrlich P, et al. Adverse effects of dietary glycotoxins on wound healing in genetically diabetic mice. Diabetes 2003;52 : 2805–2813.
7. Zheng F, He C, Cai W, et al. Prevention of diabetic nephropathy in mice by a diet low in glycoxidation products. Diabetes Metab. Res. Rev. 2002;18 : 224–237.
8. Hofmann SM, Dong HJ, Li Z, et al. Improved insulin sensitivity is associated with restricted intake of dietary glycoxidation products in the db/db mouse. Diabetes 2002;51 : 2082–2089.
9. Peppa M, He C, Hattori M, et al. Fetal or neonatal low-glycotoxin environment prevents autoimmune diabetes in NOD mice. Diabetes 2003;52 : 1441–1448.
10. Lin RY, Choudhury RP, Ca W, et al. Dietary glycotoxins promote diabetic atherosclerosis in apolipoprotein E-deficient mice. Atherosclerosis 2003;168 : 213–220.
11. Liang M, Feng X, Hou FF. Food rich in advanced glycation end products accelerates renal fibrosis in the remnant kidney model via a redox-sensitive inflammatory pathway. J. Am. Kidney Dis. 2006;17, 745A (Abstract).
12. Wittmann I, Wagner Z, Mazák I, et al. Foods rich in advanced glycation and products (AGEs) induce microalbuminuria in healthy persons. Nephrol. Dial. Transplant. 2001;16, A106.
13. Uribarri J, Cai W, Sandu O, et al. Diet-derived advanced glycation end products are major contributors to the body’s AGE pool and induce inflammation in healthy subjects. Ann. N. Y. Acad. Sci. 2005;1043 : 461–466.
14. Negrean M, Stirban A, Horstmann T, et al. Dietary advanced glycation end products (AGEs) impair acute endothelium-dependent vasodilatation in patients with type 2 diabetes mellitus (T2DM). Diabetes 2005;54, A178 (Abstract).
15. Uribarri J, Peppa M, Cai W, et al. Restriction of dietary glycotoxins reduces excessive advanced glycation end products in renal failure patients. J. Am. Soc. Nephrol. 2003;14 : 728–731.
16. Maťašová K. Dlhodobý prínos optimálnej výživy novorodencov. Pediatria (Bratisl.) 2007;3 : 143–146.
17. Kovács L, Krajčírová M, Čierna I. Moderné trendy vo výžive novorodencov a dojčiat. Bratislava: Datapress Prešov, 2003.
18. Stožický F, Schneidrová D, Aujezdská A, et al. Sledování výživy kojenců v prvních 6 měsících života v České republice v letech 1998–1999 (Multicentrická studie). Čes.-slov. Pediat. 2001;6 : 344–348.
19. Müllerová D, Stožický F, Schneidrová D, et al. Výživové zvyklosti českých dětí v prvním půl roce života – zavádění příkrmů v praxi. Čes.-slov. Pediat. 2004;11 : 561–565.
20. Tláskal P. Historie a současnost počáteční dětské výživy. Pediatr. pro Praxi 2008;2 : 86–92.
21. Birlouez-Aragon I, Pischetsrieder M, Leclére J, et al. Assessment of protein glycation markers in infant formulas. Food Chemistry 2004;87 : 253–259.
22. Gliguem H, Birlouez-Aragon I. Effects of sterilization, packaging, and storage on vitamin C degradation, protein denaturation and glycation in fortified milks. J. Dairy Sci. 2005;88 : 891–899.
23. Maillard LC. Action des acides amines sur les sucres, formation des melaniodines par voie methodique. CR Acad. Sci. 1912;154 : 66–68.
24. Birlouez-Aragon I, Locquet N, De St. Louvent E, et al. Evaluation of the Maillard reaction in infant formulas by means of front-face fluorescence. Ann. N. Y. Acad. Sci. 2005;1043 : 308–318.
25. Henle T. A food chemist’s view of advanced glycation end-products. Perit. Dial. Int. 2001;3 : 125–130.
26. Lingnert H, Eriksson CE. Antioxidative effects of Maillard reaction products. Prog. Food Nutr. Sci. 1981;5 : 453–466.
27. Caemmerer B. Antioxidative activity of melanoidins. In Ames JM (eds.). Melanoidins in Food and Health. European Commission COST Action 919. Eur 19684, 2000 : 49–60.
28. Marko D, Kemeny M, Bernady E, et al. Studies on the inhibition of tumor cell growth and microtubule assembly by 3-hydroxy-4-(E)-(2-furyl)methylidene)methyl-3-cyclopentene-1,2-dione, an intensively colored Maillard reaction product. Food Chem. Toxicol. 2002;40 : 9–18.
29. Faist V, Wenzel E, Randel G, et al. In vitro and in vivo studies on the metabolic transit of N-carboxymethyllysine. Czech J. Food Sci. 2003;18 : 116–119.
30. Billaud C, Maraschin C, Chow JN, et al. Maillard reaction products as „natural antibrowning“ agents in fruits and vegetables technology. Mol. Nutr. Food Res. 2005;49 : 656–662.
31. Hiramoto K, Sekiguchi K, Ayuha K, et al. DNA breaking activity and mutagenicity of soy sauce: characterization of the active components and identification of 4-hydroxy-5-methyl-3(2H)-furanone. Mutat. Res. 1996;359 : 119–132.
32. Vlassara H, Cai W, Crandall J, et al. Inflammatory mediators are induced by dietary glycotoxins, a major risk factor for diabetic angiopathy. Proc. Natl. Acad. Sci. USA 2002;9 : 15596–15601.
33. Bucala R, Tracey KJ, Cerami A. AGEs quench nitric oxide and mediate defective endothelium-dependent vasodilatation in experimental diabetes. J. Clin. Invest. 1991;87 : 432–438.
34. Somoza V, Wenzel E, Lindenmeier M, et al. Influence of feeding malt, bread crust, and a pronylated protein on the activity of chemopreventive enzymes and antioxidative defense parameters in vivo. J. Agric. Food Chem. 2005;53 : 8176–8182.
35. Chuyen NV, Ijichi K, Umetsu H, et al. Antioxidative properties of products from amino acids or peptides in the reaction with glucose. Adv. Exp. Med. Biol. 1998;434 : 201–212.
36. Chuyen NV, Arai H, Nakanishi T, et al. Are food advanced glycation end products toxic in biological systems? Ann. N. Y. Acad. Sci. 2005;1043 : 467–473.
37. Miyata T, Maeda K, Kurokawa K, et al. Oxidation conspires with glycation to generate noxious advanced glycation end products in renal failure. Nephrol. Dial. Transplant. 1997;12 : 255–258.
38. Anderson MM, Heinecke JW. Production of Nε-carboxymethyllysine is impaired in mice deficient in NADPH oxidase: a role of phagocyte-derived oxidants in the formation of advanced glycation end products during inflammation. Diabetes 2003;52 : 2137–2143.
39. Brownlee M. Advanced protein glycosylation in diabetes and aging. Annu. Rev. Med. 1995;46 : 223–234.
40. Thornalley PJ. The glyoxalase system: new developments toward functional characterization of a metabolic pathway fundamental to biological life. Biochem. J. 1990;269 : 1–11.
41. Gugliucci A, Bendayana M. Renal fate of circulating advanced glycation end products (AGEs): Evidence for absorption and catabolism of AGEs-peptides by renal proximal tubular cells. Diabetologia 1996;39 : 149–160.
42. Smedsrod B, Melkko J, Araki N, et al. Advanced glycation end products are eliminated by scavenger-receptor-mediated endocytosis in hepatic sinusoidal Kupffer and endothelial cells. Biochem. J. 1997;322 : 567–573.
43. Šebeková K, Kupčová V, Schinzel R, et al. Markedly elevated levels of plasma advanced glycation end products in patients with liver cirrhosis – amelioration by liver transplantation. J. Hepatol. 2002;36 : 66–71.
44. Vlassara H. Advanced glycation in diabetic renal and vascular disease. Kidney Int. 1995;48 : 43–44.
45. Thornalley PJ. Glyoxalase I-structure, function and a critical role in the enzymatic defense against glycation. Biochem. Soc. Trans. 2003;31 : 1343–1348.
46. Pischetsrieder M, Eidel W, Munch G, et al. N(2)-(1-carboxyethyl)-deoxyguanosine, a nonenzymatic glycation adduct of DNA, induces single strand brakes and increases mutation frequencies. Biochem. Biophys. Res. Commun. 1999;264 : 544–549.
47. Schmidt AM, Hori O, Cao R, et al. RAGE: A novel cellular receptor for advanced glycation end products. Diabetes 1996;45 : 77–80.
48. Bierhaus A, Schiekofer S, Schwaninger M, et al. Diabetes-associated sustained activation of the transcription factor Nuclear Factor-κB. Diabetes 2001;50 : 2792–2808.
49. Bierhaus A, Humpert PM, Morcos M, et al. Understanding RAGE, the receptor for advanced glycation end products. J. Mol. Med. 2005;83 : 876–886.
50. Rashid G, Benchetrit S, Fishman D, et al. Effect of advanced glycation end-products on gene expression and synthesis of TNF-α and endothelial nitric oxide synthase by endothelial cells. Kidney Int. 2004;66 : 1099–1106.
51. Ferrer E, Alegria A, Farré R, et al. Evolution of available lysine and furosine contents in milk-based formulas throughout the self-life storage period. J. Sci. Food Agric. 2003;83 : 465–472.
52. Leclère J, Birlouez-Aragon I. Fortification of milk with iron-ascorbate promotes lysine glycation and tryptophan oxidation. Food Chemistry 2002;76 : 491–499.
53. Sarria B, Lopez-Fandino R, Vaquero P. Protein nutritive utilization in rats fed powder and liquid infant formulas. Food Sci. Technol. Intern. 2000;6 : 9–16.
54. Rerat A, Calmes R, Vaissade P, et al. Nutritional and metabolic consequences of the early Maillard reaction of heat treated milk in the pig. Significance for man. Eur. J. Nutr. 2002;41 : 1–11.
55. Šebeková K, Saavedra G, Zumpe C, et al. Plasma concentration and urinary excretion of Nε –(carboxymethyl)lysine in breast milk – and formula-fed infants. Ann. N. Y. Acad. Sci. 2008;1126 : 177–180.
56. Dittrich R, Hoffmann I, Stahl P, et al. Concentrations of N-carboxymethyllysine in human breast milk, infant formulas, and urine of infants. J. Agric. Food Chem. 2006;54 : 6924–6928.
57. Bosch L, Alegria A, Farré R. Milk-cereal based infant foods: formation of furosine during storage, Cost Action 927-IMARS, The Maillard Reaction in Food and Medicine 2006, Neapol, Italy, May 24–27 , Abstracts, p.91.
58. Hellwig M, Hultsh C, Grunwald S, et al. Interaction of Maillard reaction products with intestinal transport systems. 9th International Symposium on the Maillard Reaction 2007, Munich, Germany, September 1–5, Abstracts, p. 164.
Labels
Neonatology Paediatrics General practitioner for children and adolescentsArticle was published in
Czech-Slovak Pediatrics

2008 Issue 10
- What Effect Can Be Expected from Limosilactobacillus reuteri in Mucositis and Peri-Implantitis?
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Životné jubileum doc. MUDr. Kataríny Furkovej, CSc., mim. prof.
- Hodnotenie klinických príznakov intrakraniálnej hypertenzie vo vzťahu k indikácii drenážneho výkonu u novorodencov a dojčiat s hydrocefalom
- Komplexná mutačná analýza génu PAH u slovenských pacientov postihnutých fenylketonúriou
- Niektoré aspekty úmrtností detí na východnom Slovensku
- Akútna fokálna bakteriálna nefritída u 4,5-ročného dievčaťa
- Iatrogénna hypoproteinémia novorodenca vyvolávajúca subdurálnu kolekciu tekutiny
- Prader-Williho syndróm u novorodenca – dve kazuistiky
- Henochova-Schönleinova purpura z pohľadu preventívneho podávania kortikoidov
- Význam produktov Maillardovej reakcie v strave dojčiat
- Heterotopia žalúdočnej sliznice – literárny prehľad a naše skúsenosti
- Pediatrická prevencia pri chronických chorobách obličiek
- Primární hypertenze dětského věku
- Je potrebná spolupráca detského endokrinológa a detského nefrológa?
- Očkování proti rotavirovým infekcím
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Henochova-Schönleinova purpura z pohľadu preventívneho podávania kortikoidov
- Hodnotenie klinických príznakov intrakraniálnej hypertenzie vo vzťahu k indikácii drenážneho výkonu u novorodencov a dojčiat s hydrocefalom
- Heterotopia žalúdočnej sliznice – literárny prehľad a naše skúsenosti
- Prader-Williho syndróm u novorodenca – dve kazuistiky
