Nozokomiální pneumonie
Hospital-acquired pneumonias
Nosocomial infections are a common complication of hospital care. Hospital-acquired (HAP) pneumonia is one of the most common nosocomial infections and it is the most dangerous in terms of mortality. The problem is mainly selected hospital bacterial strains with rising antibiotic resistance. Diagnosis of the cause of pneumonia is difficult and often does not lead to a positive result. Management is complex and is based on timely and appropriate empirical antibiotic treatment. Local and extrapulmonary complications are relatively common and they increase morbidity and mortality. Prognosis of the HAP is often unfavorable, especially in the elderly and polymorbid individuals.
Key words:
complications – etiology – hospital-acquired pneumonia – management
Authors:
Petr Jakubec; Aneta Křenková; Vítězslav Kolek
Authors‘ workplace:
Klinika plicních nemocí a tuberkulózy LF UP a FN Olomouc
Published in:
Vnitř Lék 2017; 63(11): 776-785
Category:
Reviews
Overview
Nozokomiální infekce jsou častou komplikací nemocniční péče. Nozokomiální pneumonie patří k nejčastějším nozokomiálním infekcím a jsou z nich z hlediska mortality nejnebezpečnější. Problémem jsou hlavně selektované nemocniční bakteriální kmeny, pro které je charakteristická vzrůstající rezistence k antibiotikům. Diagnostika původce pneumonie je obtížná a často nevede k pozitivnímu výsledku. Terapie je komplexní a jejím základem je včasná a adekvátní empirická antibiotická léčba. Poměrně časté jsou lokální i mimoplicní komplikace, které zvyšují morbiditu i mortalitu. Nozokomiální pneumonie jsou prognosticky často nepříznivé, zvláště u starších a polymorbidních osob.
Klíčová slova:
etiologie – komplikace – léčba – nozokomiální pneumonie
Definice, epidemiologie, patofyziologie
Pneumonie je zánět plicních alveolů, respiračních bronchiolů a přilehlé intersticiální tkáně. Epidemiologicky je nozokomiální pneumonie (hospital-acquired pneumonia – HAP) definovaná jako pneumonie, která se rozvine po 48 hod od přijetí do nemocnice nebo do 10–14 dnů po propuštění ze zdravotnického zařízení. Historicky byla uváděna jako podtyp HAP ventilátorová pneumonie (ventilator-associated pneumonia – VAP), ale v posledních amerických doporučených postupech IDSA (Infectious Diseases Society of America) z roku 2016 je již vedena jako samostatná entita, postihující pacienty při umělé plicní ventilaci a vznikající za déle než 48 hod po endotracheální intubaci, zatímco HAP je nozokomiální pneumonie, která není spojená s umělou plicní ventilací [1]. V důsledku sílících důkazů byla v těchto guidelines z HAP vyřazena skupina pneumonií spojených se zdravotní péčí (health-care-associated pneumonia – HCAP). V Evropě nebyla HCAP nikdy přijata za součást HAP, a to právě kvůli nedostatku validních důkazů [2]. Klinická definice HAP/VAP, tak jak byla formulovaná doporučenými postupy ATS (American Thoracic Society)/IDSA v roce 2005, zůstala zachována: přítomnost nového plicního infiltrátu a klinické známky přítomnosti plicní infekce, kterými jsou nově vzniklé febrilie, purulentní sputum, leukocytóza a pokles saturace [1].
HAP/VAP patří mezi nejzávažnější respirační infekce a je nejčastější infekcí v intenzivní medicíně. HAP je 2. nejčastější nozokomiální infekce a tvoří asi 22 % těchto infekcí [3]. Tvoří téměř polovinu nozokomiálních infekcí na jednotkách intenzivní péče (JIP), VAP pak téměř 1/3 všech nozokomiálních infekcí na JIP [4]. Na jednotkách intenzivní péče je VAP hlavní příčinou nozokomiálních infekcí, zvyšuje mortalitu a náklady na poskytovanou péči [5]. Incidence HAP je udávána v počtu 5–10 případů na 1 000 přijetí do nemocnice [6]. Incidence VAP je pak uváděna 10–15 případů na 1 000 ventilovaných dnů [7]. VAP postihuje okolo 10 % pacientů při umělé plicní ventilaci (UPV) [8]. Incidence VAP je velmi závislá na studované populaci a použitých diagnostických kritériích [9]. Výskyt VAP narůstá o 3 % denně prvních 5 dnů mechanické ventilace, o 2 % denně 6.–10. den mechanické ventilace a o 1 % denně od 11. dne mechanické ventilace [10]. V britských guidelines NICE je uvedeno, že více než 50 % nemocničních pneumonií není spojeno s UPV [11].
Vznik HAP/VAP závisí na množství a virulenci patogena a imunitní odpovědi pacienta (mechanické, lokální, humorální a buněčné). Hlavním mechanizmem je mikroaspirace kontaminovaných orofaryngeálních a žaludečních sekretů. Zpočátku se jedná o komunitní bakteriální kmeny z běžného prostředí, ale během několika dnů hospitalizace dochází ke kolonizaci orofaryngu nemocných nemocničními kmeny, zvláště gramnegativními bakteriemi [7,12]. Méně často je HAP/VAP výsledkem přímé inhalace infikovaného aerosolu z kontaminovaných přístrojů nebo nemocničního prostředí včetně zdravotnického personálu. Nejvzácnější příčinou je bakteriemie se septickými emboly z jiného infekčního fokusu pacienta.
Rizikové faktory a mikrobiologická charakteristika
Pro včasné stanovení diagnózy je nezbytná identifikace rizikových faktorů. Nejdůležitějším rizikovým faktorem pro vznik VAP je samotná intubace a přítomnost endotracheální či tracheostomické kanyly. Orotracheální intubace s umělou plicní ventilací (UPV) zvyšuje riziko HAP 3–21krát [13]. Roli zde hraje několik mechanizmů (mikroaspirace, biofilm na povrchu kanyl, obtékání sekretů z horních cest dýchacích a žaludku, vyřazení mukociliárního transportu i ventilace pozitivním přetlakem, podporující zatékání sekretů do plic). K dalším rizikovým faktorům náleží věk > 55 let, předchozí hospitalizace, předchozí intravenózní ATB léčba (v 90 minulých dnech), chronická plicní onemocnění, chronické renální selhání, malignity, malnutrice, anémie, poruchy vědomí, nazogastrická sonda, imunosupresivní léčba, polytrauma, paralýza, operační výkony na hrudníku a horní části břicha, medikace léčivy snižujícími žaludeční sekreci (zvláště inhibitorů protonové pumpy).
Zvláště u ventilovaných pacientů je zvýšeno riziko infekce multirezistentními (multidrug-resistant – MDR) kmeny bakterií, které byly izolovány přibližně u poloviny pacientů s VAP [14,15]. Rizikovými faktory pro vznik MDR-VAP jsou proběhlá intravenózní antibiotická léčba v posledních 90 dnech, septický šok v průběhu VAP, proběhlá epizoda syndromu akutní dechové tísně (acute respiratory distress syndrome – ARDS) před vznikem VAP, nejméně 5denní hospitalizace před vznikem VAP, potřeba zahájení kontinuální dialýzy (CRRT – continuous renal replacement therapy) před vznikem VAP. Rizikovými faktory pro MDR-VAP způsobenou gramnegativními bacily včetně Pseudomonas aeruginosa jsou zdravotnická pracoviště bez znalosti lokálního antibiogramu či s přítomností > 10 % gramnegativních izolátů rezistentních k ATB užívaných v monoterapii. Rizikovým faktorem MDR-HAP je proběhlá intravenózní antibiotická léčba v posledních 90 dnech pro MDR-HAP způsobenou gramnegativními bacily včetně Pseudomonas aeruginosa, strukturální plicní choroby (bronchiektázie, cystická fibróza) a nález početných a dominujících gramnegativních bakterií v mikroskopickém vyšetření sekretů dolních cest dýchacích v barvení podle Grama. Společnými rizikovými faktory pro MDR-VAP a MDR-HAP způsobenou meticilin-rezistentním Staphylococcus aureus (MRSA) jsou zdravotnická pracoviště bez znalosti prevalence MRSA či s přítomností > 20 % meticilin-rezistentních izolátů Staphylococcus aureus (B). Při přítomnosti těchto rizikových faktorů je nutné na MDR patogeny myslet a adekvátně nastavit iniciální empirickou ATB léčbu.
Význam může mít i časový faktor, na základě nějž je v literatuře dělena nozokomiální pneumonie na časnou (early-onset) a pozdní (late-onset) formu [16,17]. U časné formy převládají komunitní kmeny bakterií, zatímco u pozdní formy dominují kmeny nozokomiální s vysokým rizikem MDR [16–19]. Nepanuje ale shoda o tom, ve kterém okamžiku začíná převládat riziko MDR infekce, někteří autoři uvádějí 4–5 dnů, jiní dokonce až 7 dní [11,16,17,20–22]. Ovšem Nair et al udávají, že epidemiologie VAP se mění a v poslední době dochází k setření této hranice mezi časnou a pozdní VAP. To znamená, že i u pacientů s časnou VAP jsou zachycovány rezistentní kmeny, a naopak kmeny citlivé lze zaznamenat jak u tzv. časné, tak i pozdní VAP. Varuje předtím, že volba antibiotické terapie dle časového faktoru vzniku VAP může vést jak k nadbytečné, tak i nedostatečné léčbě širokospektrými antibiotiky [23].
V etiologii HAP/VAP se uplatňuje řada patogenů a významná část infekcí je polymikrobiálních [24]. Obvyklé jsou aerobní gramnegativní bakterie (Pseudomonas aeruginosa, Klebsiella pneumoniae, Escherichia coli, Enterobacter sp., Acinetobacter sp., Stenotrophomonas maltophilia) a MRSA, u časné formy pak spíše Streptococcus sp. (zvláště Streptococcus pneumoniae), Staphylococcus aureus, Haemophilus influenzae [7,25–30]. Virové a mykotické patogeny jsou méně časté a postihují převážně imunokompromitované pacienty. Role anaerobních bakterií v etiologii HAP/VAP se zdá být přeceňovaná.
Klinický obraz a diagnostika
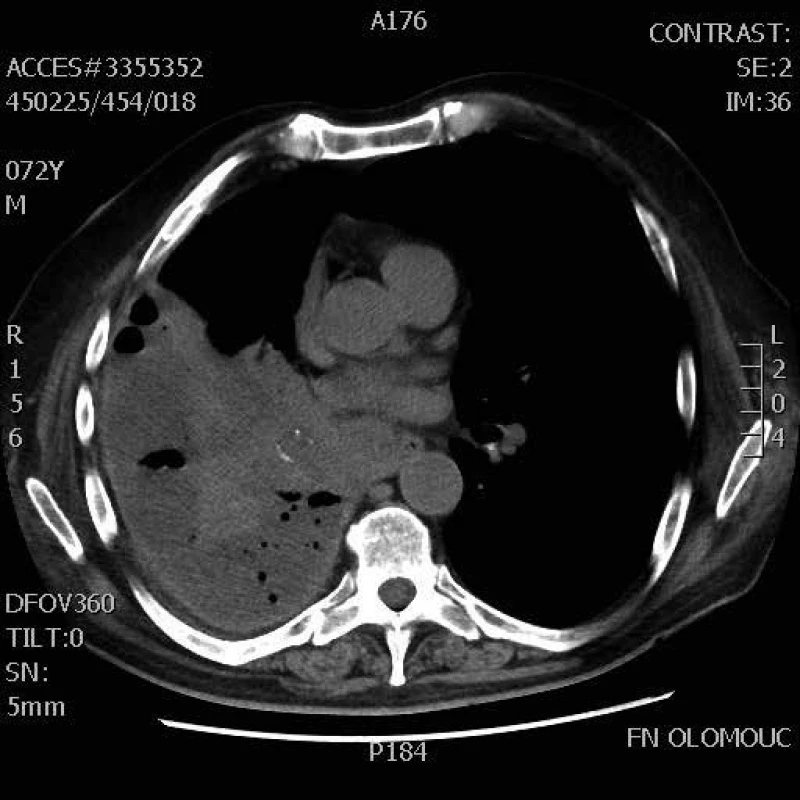
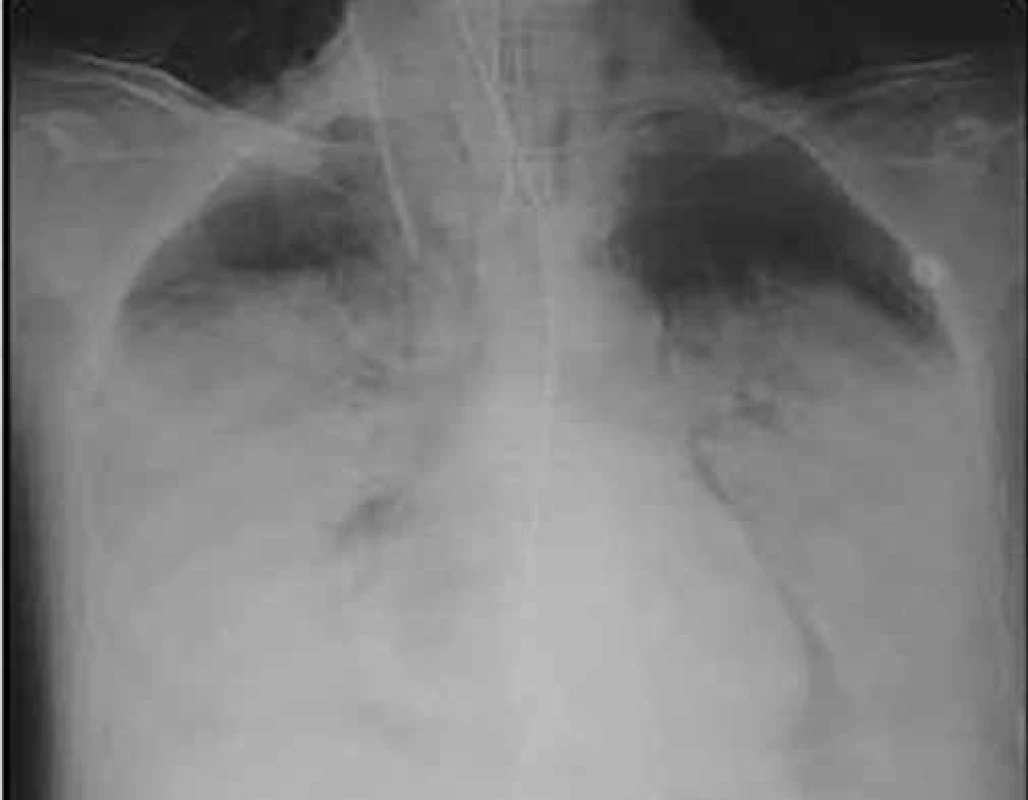
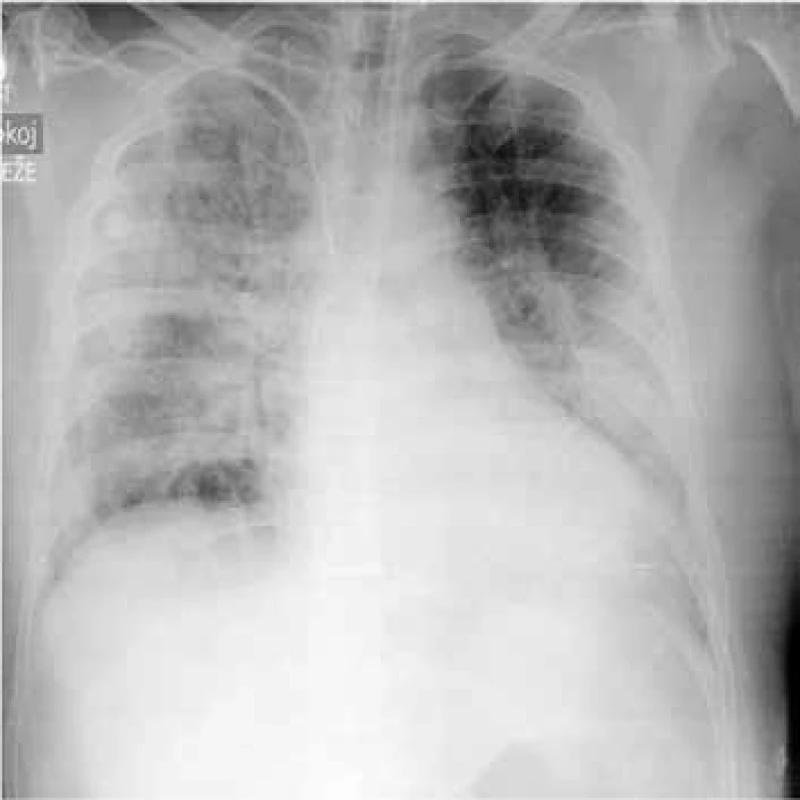
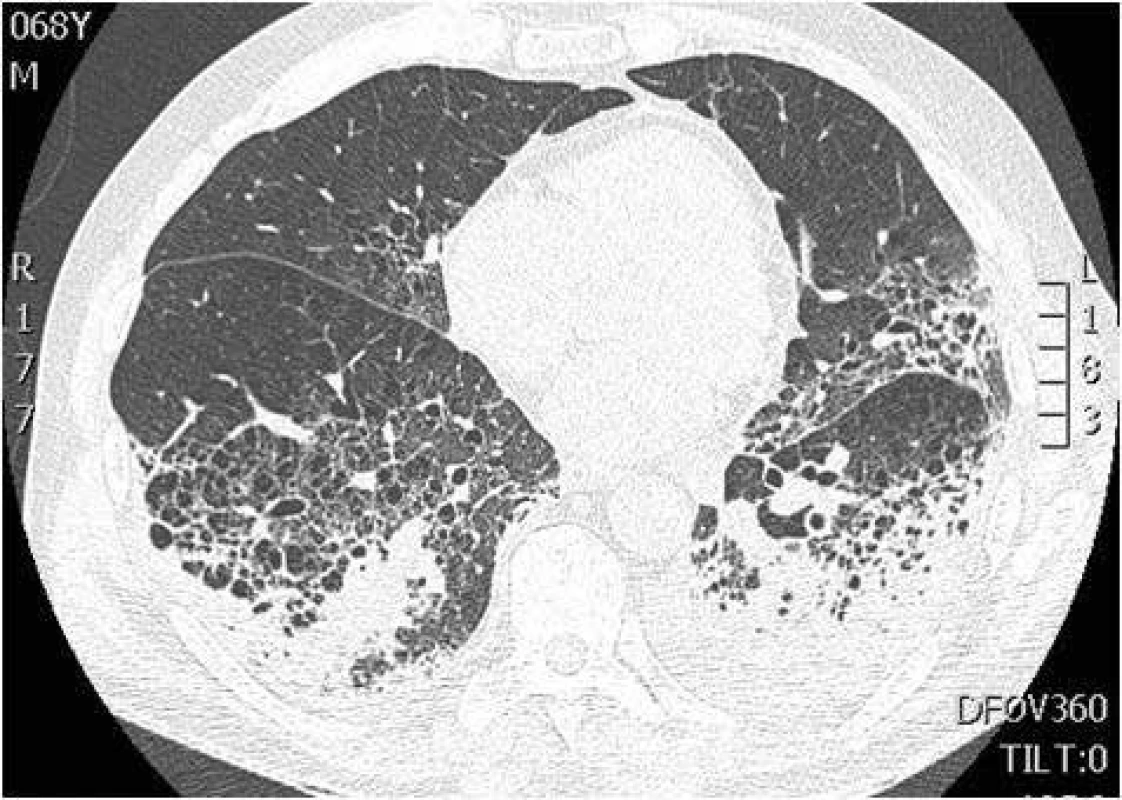
Možné symptomy zahrnují teploty, nový nebo zhoršený kašel, který bývá většinou produktivní, často s produkcí hnisavého sputa, dušnost, pleurální bolesti, hemoptýzu, tachypnoe, zvýšené dechové úsilí. Při fyzikálním vyšetření jsou nejčastěji nalezeny difuzní asymetrické vrzoty při zahlenění, dále mohou být chrůpky, oslabené dýchání, prodloužené exspirium a pískoty jako známky bronchospazmu. Na RTG hrudníku mohou být infiltráty, konsolidace, kavitace, atelektáza, pleurální výpotek (obr. 1–6). Běžnou ani ne tak komplikací, jako spíše součástí klinického obrazu HAP/VAP je respirační selhání a septický stav. U většiny případů dochází k akutnímu hypoxemickému respiračnímu selhání (AHRS – acute hypoxemic respiratory failure), u pacientů s obstrukčním plicním postižením, zvláště CHOPN, se ale může objevit i hyperkapnické respirační selhání. Sepse je definována jako syndrom systémové zánětlivé odpovědi (systematic inflammatory response syndrome – SIRS) vyvolaný infekcí. Těžká sepse je definována jako sepse se sepsí indukovanou orgánovou dysfunkcí a/nebo sepsí indukovanou tkáňovou hypoperfuzí. Sepsí indukovaná orgánová dysfunkce je charakterizována akutní plicním postižením (acute lung injury – ALI) s hypoxemickým indexem PaO2/FiO2 < 250 v nepřítomnosti pneumonie jako zdroje infekce, ALI s PaO2/FiO2 < 200 v přítomnosti pneumonie jako zdroje infekce, hladinou kreatininu > 176,8 μmol/l, hladinou bilirubinu > 34,2 μmol/l trombocytopenií < 100 × 109/mm3 a koagulopatií (international normalized ratio > 1,5), přičemž obecně je ALI definována jako akutně vzniklá těžká dysfunkce plic s hypoxemickým indexem PaO2/FiO2 < 300 a oboustrannými plicními infiltráty na skiagramu hrudníku. Sepsí indukovaná tkáňová hypoperfuze je sepsí indukovaná hypotenze, zvýšená hladina laktátu nebo oligurie. Sepsí indukovaná hypotenze je charakterizována systolickým krevním tlakem (systolic blood presssure – SBP) < 90 mm Hg a/nebo středním arteriálním tlakem (mean arterial pressure – MAP) < 70 mm Hg a/nebo poklesem SBP > 40 mm Hg nebo méně než 2 standardní odchylky pod normu odpovídající věku v nepřítomnosti jiných příčin hypotenze. Septický šok je definován jako sepsí indukovaná hypotenze perzistující i přes adekvátní tekutinovou resuscitaci. Podrobnější diagnostická kritéria a terapie septických stavů jsou uvedená v příslušných guidelines, která přesahují rámec tohoto textu [31].
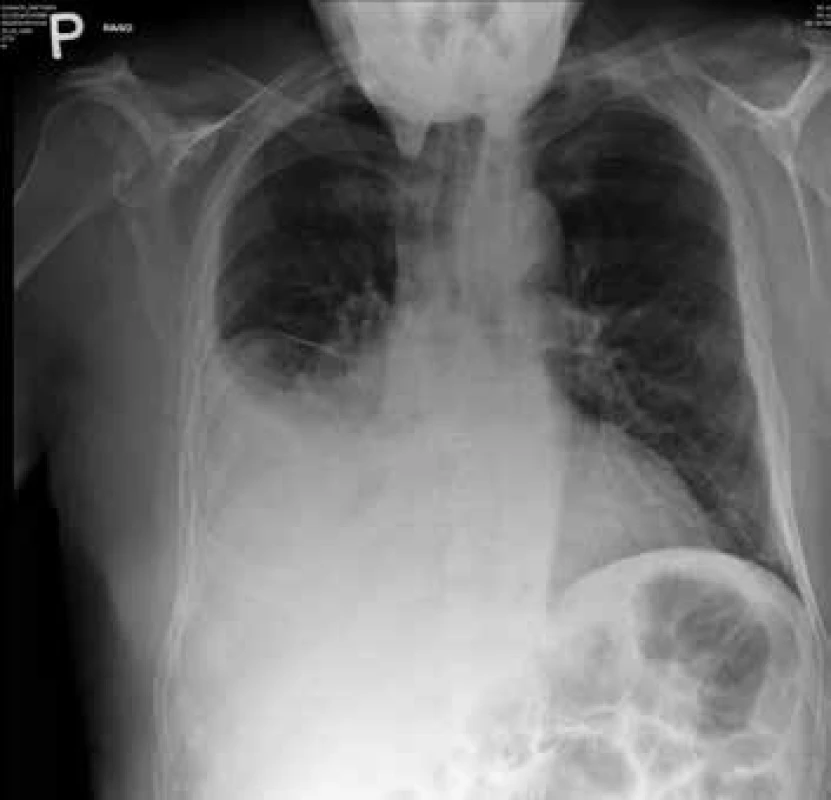
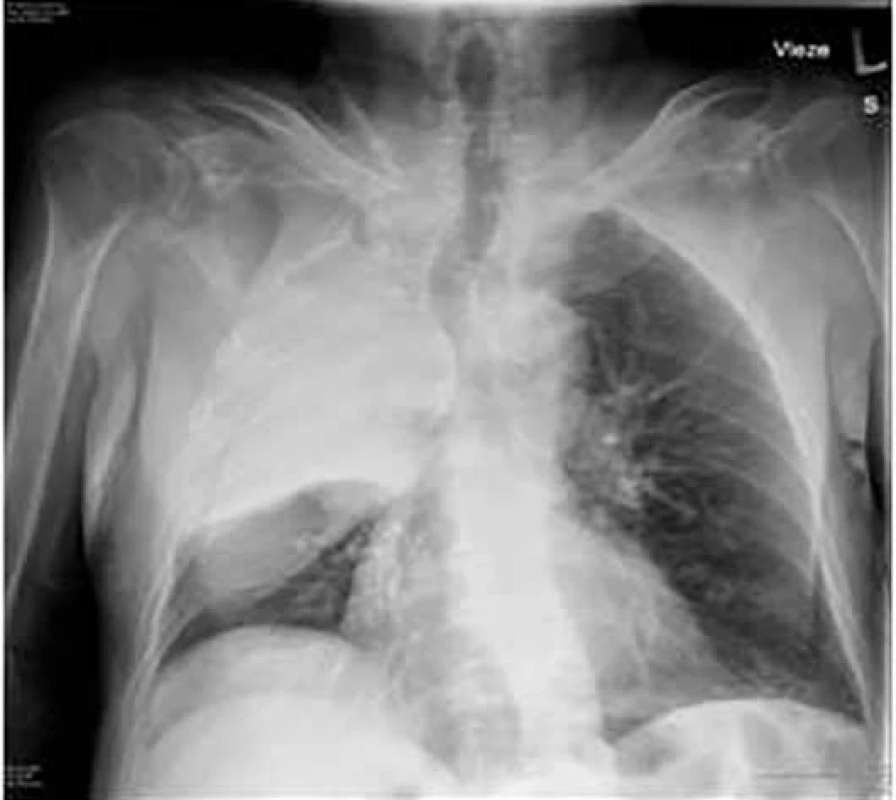
Diagnóza HAP je založena na výše uvedených klinických kritériích a nejsou doporučeny další laboratorní parametry: C-reaktivní protein (CRP), prokalcitonin (PCT), soluble triggering receptor expressed on myeloid cells (sTREM-1). Definitivním potvrzením diagnózy HAP/VAP je mikrobiologický průkaz patogena.
Byla vyvinuta a studována řada metod, sloužících k odběrům biologického materiálu na mikrobiologické vyšetření. Z hlediska techniky odběru můžeme tyto metody rozdělit na necílené (tzv. „blind“, nebronchoskopické) a cílené (bronchoskopické), které jsou prováděny pod endoskopickou (bronchoskopickou) kontrolou. Jak necílené, tak cílené odběry mohou být prováděny tzv. protektivním (chráněným) způsobem, který snižuje riziko kontaminace a falešně pozitivního výsledku. K necíleným odběrům řadíme neinvazivní techniky: sputum, indukované sputum, nazotracheální odsávání u neventilovaných pacientů a endotracheální aspirát (ETA) u ventilovaných pacientů. K invazivním technikám patří jak necílené metody: odsátí z bronchů (blind bronchial suction – BBS), blind bronchoalveolární laváž (blind BAL), blind odběr krytým brushem (blind protected specimen brushing, blind PSB), blind protektivní bronchoalveolární laváž (blind pBAL, mini-BAL), necílený odběr teleskopickým katétrem (blind plugged telescopic catheter, blind PTC), tak cílené metody: BAL, protektivní BAL (pBAL), PTC a PSB. Odběry materiálu z dolních cest dýchacích k mikrobiologickému vyšetření by měly být provedeny ještě před podáním ATB [1,32].
Zásadním problémem hodnocení mikrobiologických vyšetření vzorků získaných těmito vyšetřeními je odlišení infekce od prosté kolonizace či kontaminace. Klinicky manifestní plicní infekce je definována přítomností ≥ 104 CFU/g tkáně nebo ≥ 105 CFU/ml exsudátu, kde jedna CFU (colony forming unit) odpovídá jedné živé bakterii [33]. Proto byla vytvořena tzv. „bakteriologická strategie pneumonie“, která definuje hodnoty kvantitativního mikrobiologického vyšetření, které svědčí pro pneumonii. Pro ETA je to hodnota ≥ 106 CFU/ml, pro BAL ≥ 104 CFU/ml, pro PSB ≥ 103 CFU/ml [34]. U necílených metod jsou hodnoty ≥ 103 CFU/ml pro blind PSB a blind pBAL, pro blind BAL pak ≥ 104 CFU/ml [35].
Výsledky necílených i cílených metod v diagnostice etiologického agens HAP zjištěné v řadě studií se pohybují v obrovském rozmezí. U necílených metod senzitivita a specificita kolísají u ETA mezi 38–87 % a 31–92 %, u BBS mezi 74–97 % a 74–100 %, u blind BAL mezi 63–100 % a 66–96 % a u blind PSB mezi 58–96 % a 71–100 % [19,36]. U cílených metod jsou senzitivita a specificita BAL mezi 19–95 % a 45–100 %, u pBAL mezi 39–97 % a 66–100 % a PSB mezi 33–100 % a 50–100 % [37–44]. Řada autorů uvádí, že nebronchoskopické a bronchoskopické metody mají porovnatelnou výtěžnost v diagnostice HAP [45,46]. Bronchoskopické metody vedou k vyšší specificitě, ale nižší senzitivitě než vyšetření nebronchoskopická [47].
V literatuře ale můžeme sledovat postupný odklon od invazivních technik a aktuálně i preferenci semikvantitativních metod. Nejnovější americká guidelines doporučují neinvazivní odběr materiálu se semikvantitativním vyšetřením. Použití invazivních metod odběrů ani sofistikovanější vyšetření materiálu nevedlo ke zlepšení klinického výsledku, nedošlo k poklesu 28denní a celkové mortality, ani ke zkrácení délky pobytu na JIP nebo délky UPV. Navíc neinvazivní odběr je rychlejší, je zatížen menším počtem komplikací a je levnější. Totéž platí i pro semikvantitativní zpracování vzorků [1]. Lepší výsledky vyšetření endosekretu než PSB prokázala i naše studie [48].
U všech pacientů s podezřením na VAP by měly být odebrané hemokultury, i když výtěžnost není velká [1,49]. Z dalších metod lze využít vyšetření mikrobiálních antigenů v moči (Streptococcus pneumoniae, Legionella pneumophila) a další speciální vyšetření. V posledních letech dochází k velkému rozvoji PCR (polymerase chains reaction) a dalších molekulárně genetických metod, které mohou vést k rychlejší identifikaci patogenů a k lepším léčebným výsledkům [50,51].
V diferenciální diagnostice HAP/VAP musíme myslet na srdeční selhání, aspirační pneumonitidu, plicní embolii s plicním infarktem, syndrom akutní respirační tísně, krvácení do plic, kontuzi plic, tumory plic, postradiační pneumonitidu, lékové postižení plic, kryptogenní organizující se pneumonii (COP), plicní postižení u systémových onemocnění pojiva (např. lupusová pneumonitida).
Léčba a prevence
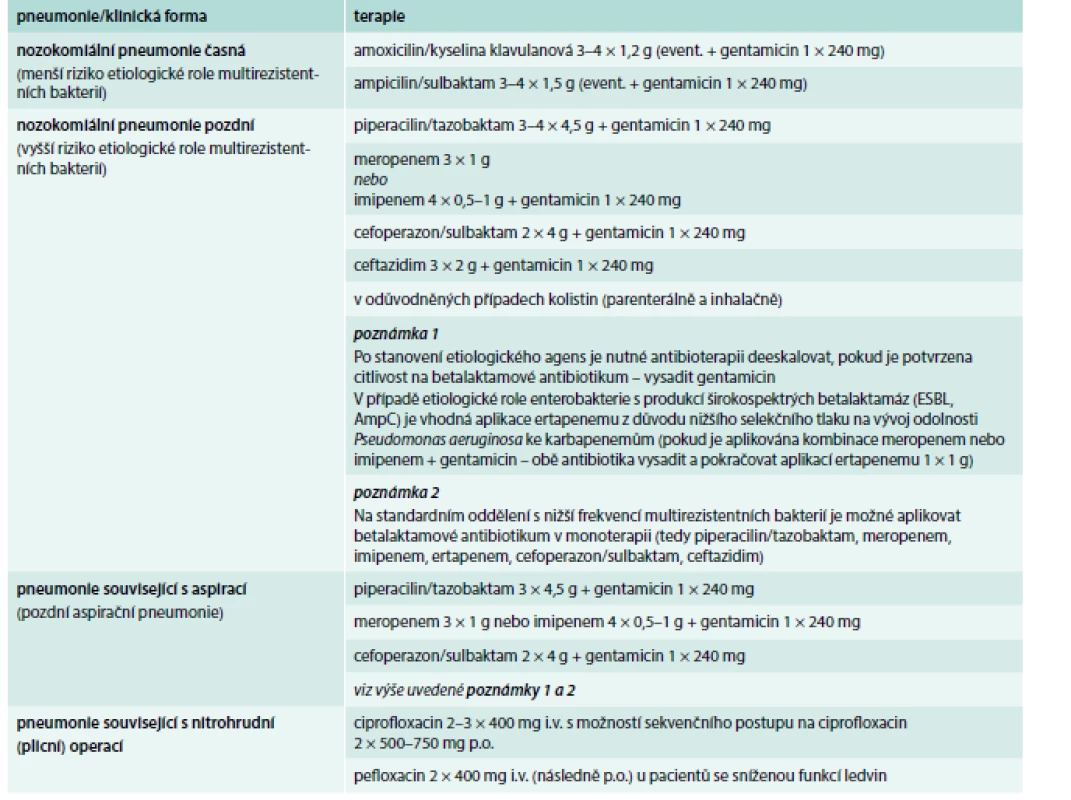
Základem léčby HAP/VAP je včasná a adekvátní ATB léčba, která by měla být při klinickém podezření zahájena co nejdříve [1]. Opožděná a neadekvátní ATB léčba zvyšuje mortalitu [1,52]. Dle recentních amerických IDSA guidelines z roku 2016 je zvolen odlišný přístup k ATB léčbě VAP oproti HAP [1]. Iniciální empirická ATB léčba HAP/VAP závisí na tom, zda jsou přítomny rizikové faktory smrti (nutná ventilační podpora a/nebo septický šok) a/nebo rizikové faktory infekce MDR kmeny (viz výše). V tomto případě je odůvodněná rozšířená kombinovaná ATB léčba s následnou deeskalací léčby [53]. Empirická ATB léčba VAP a HAP je uvedena v tab. 1 a 2.
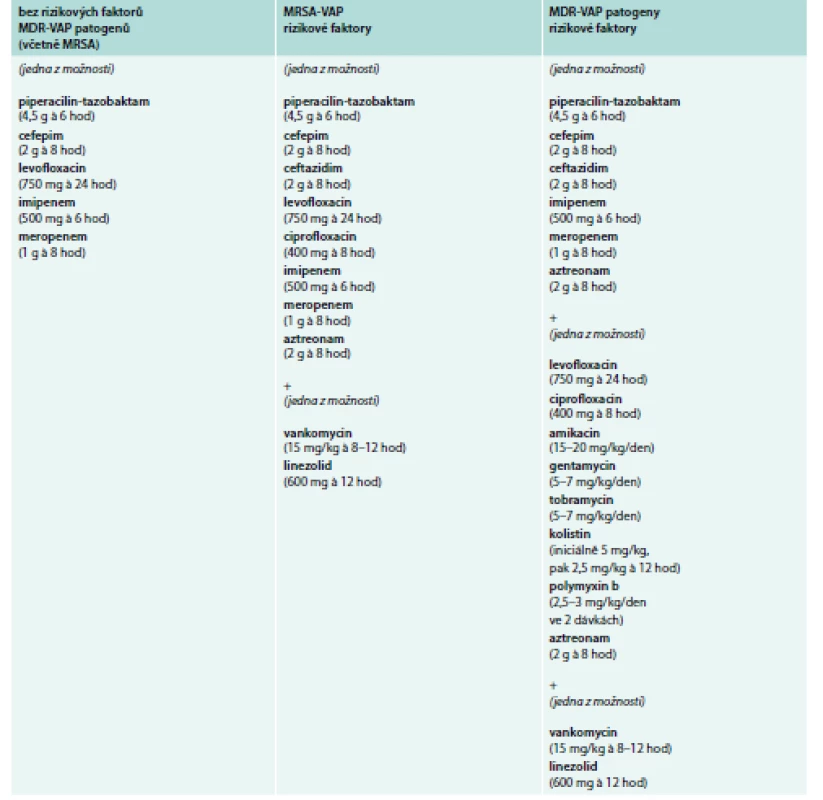
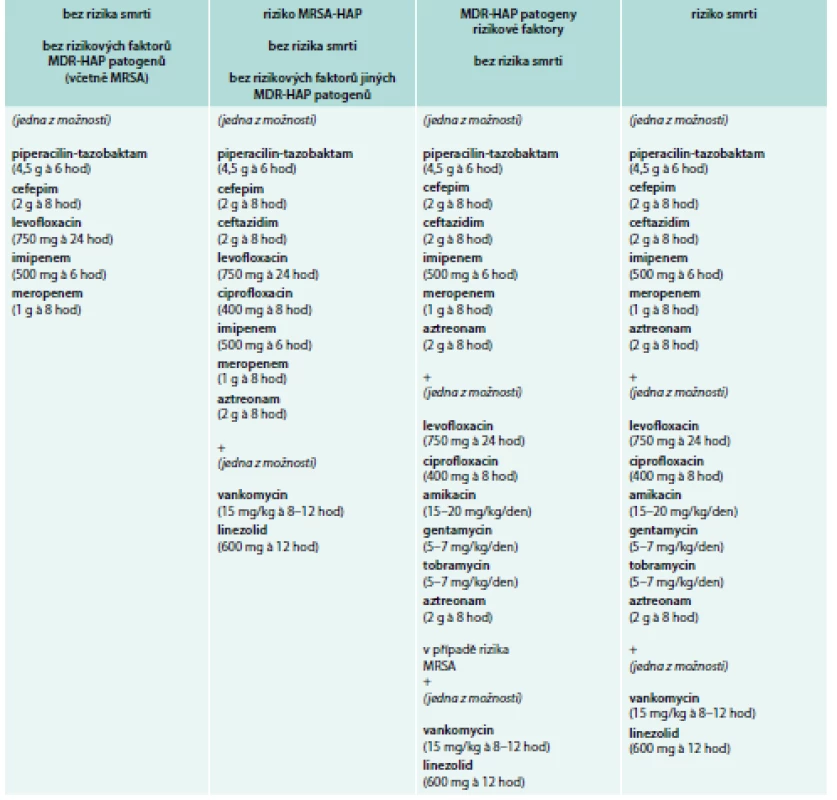
Ve specifických případech je zvolen speciální postup. U pacientů alergických na penicilin jsou v případě mírné alergie doporučený cefalosporiny 3. generace nebo karbapenemy, u těžké alergie pak aztreonam. U ceftazidimu a aztreonamu je však problém v nízké účinnosti proti Staphylococcus aureus (meticillin-sensitive Staphylococcus aureus – MSSA), a proto by mělo být přidáno ATB s účinkem na tohoto patogena (vankomycin, linezolid). U infekce Pseudomonas aeruginosa je doporučena dvojkombinace ATB jen v případě nebo vysokého rizika smrti, jinak je doporučena ATB monoterapie, ale nemělo by se jednat o aminoglykosidy. V případě VAP způsobené gramnegativními bakteriemi citlivými pouze na aminoglykosidy a polymyxiny (polymyxin B, kolistin) je doporučena kombinace systémové a inhalační ATB léčby. U HAP/VAP způsobených Acinetobacter sp. jsou první volbou karbapenemy nebo ampicilin/sulbaktam. Pokud je Acinetobacter sp. citlivý pouze na polymyxiny, pak je doporučena intravenózní léčba polymyxiny s inhalačním podáváním kolistinu, není doporučeno podávat rifampicin ani tigecyklin [1]. Tato doporučení vycházejí z epidemiologické situace v USA, ale v Evropě a v našich podmínkách je situace poněkud jiná, zvláště co se týká výskytu MRSA, a proto se i poněkud liší doporučení empirické ATB léčby (tab. 3).
Zhodnocení klinického stavu pacienta a efektu léčby je doporučeno provést po 72 hod [49]. Obecnou zásadou je dle mikrobiologických výsledků deeskalovat ATB léčbu, nikoliv pokračovat v iniciální ATB léčbě [1]. Doporučená délka podávání antimikrobiálních léků u pacientů s HAP/VAP je 7 dní, nicméně existují výjimky a je zde třeba vzít v úvahu klinický vývoj, RTG nález a vývoj laboratorních hodnot a délku léčby upravit [1,49]. K rozhodnutí o ukončení ATB léčby může být použita i dynamika hladiny prokalcitoninu, resp. její pokles na hodnoty ≤ 0,25 µg/l nebo o ≤ 80 % výchozí hodnoty [1,54,55].
Důležitou složkou terapie HAP je léčba respiračního selhání. První volbou bývá kontinuální oxygenoterapie s vysokým průtokem, resp. frakcí kyslíku. V poslední době se v některých případech s úspěchem používá vysokoprůtoková nosní kanyla (high-flow nasal cannula – HFNC) s průtokem kyslíku až 60 l/min [56]. V případě těžkého AHRS je však tato léčba nedostatečná a neúspěšná. V tomto případě se často zkouší neinvazivní ventilační podpora (neinvazivní ventilace – NIV), která v porovnání se samotnou oxygenoterapií snižuje nutnost endotracheální intubace a mortalitu [57]. Hlavním důvodem NIV je překlenutí období těžkého ARHS bez nutnosti endotracheální intubace se všemi doprovodnými komplikacemi. V případě kontraindikace, intolerance nebo selhání předchozí léčby respiračního selhání je indikována endotracheální intubace a invazivní mechanická ventilace. V případech ALI nebo ARDS jsou doporučovány vyšší hodnoty pozitivního end-exspiračního tlaku (positive end-exspiratory pressure – PEEP) okolo 15 cm H2O, které zlepšují přežití [58]. V případě neúspěchu této léčby se používají nekonvenční podpůrné ventilační režimy. První je pronační poloha, která by měla zlepšit oxygenaci redistribucí plicní ventilace a perfuze, alveolárním recruitmentem a zabráněním komprese srdce plícemi a u pacientů s ALI nebo ARDS snižuje mortalitu [59,60]. Vysokofrekvenční oscilační ventilace (high-frequency oscilatory ventilation – HFOV) využívá oscilaci malých dechových objemů s vysokou dechovou frekvencí (3–6 Hertzů) a vysokým středním tlakem v dýchacích cestách (mean airway pressure – mPaw). Snížení ventilačně-perfuzního nepoměru (ventilation/perfusion mismatch) u ARDS pacientů s refrakterní hypoxemií by mohla přinést inhalace vazodilatačních látek, např. oxidu dusnatého. U přísně indikované skupiny pacientů, u kterých i přes výše uvedené postupy přetrvává hypoxemie, lze indikovat provedení extrakorporální membránové oxygenace (extracorporeal membrane oxygenation – ECMO).
Nezbytné je udržování průchodnosti dýchacích cest včetně event. bronchoskopického odsávání sekretů a nebulizace. V řadě případů je nutné provedení tracheostomie. Další farmakologická léčba (mukolytika, expektorancia, antitusika, bronchodilatancia) se podává individuálně s přihlédnutím ke klinickým příznakům a celkovému stavu pacienta. Velmi důležitá, ale bohužel často opomíjená je respirační fyzioterapie.
Indikováno je profylaktické podávání nízkomolekulárního heparinu ve zvyklé dávce a časná mobilizace jako prevence vzniku tromboembolické nemoci. Samozřejmostí je adekvátní hydratace a udržování stálého vnitřního prostředí. HAP/VAP bývá pravidelně doprovázená malnutričním stavem, který je multifaktoriální etiologie. U těchto nemocných je indikován zvýšený energetický příjem s adekvátním zastoupením bílkovin, cukrů, tuků, minerálů, vitaminů i stopových prvků. V rámci nutriční podpory je dnes doporučováno podávání glutaminu, ω-3 mastných kyselin a taurinu. Otázkou zůstává význam podávání zinku v léčbě pneumonie. Nutriční podpora může probíhat parenterální nebo enterální cestou, která je jednoznačně preferována, a to co nejdříve. Podrobnější popis nutriční podpory vychází z obecných doporučení a přesahuje rámec tohoto sdělení.
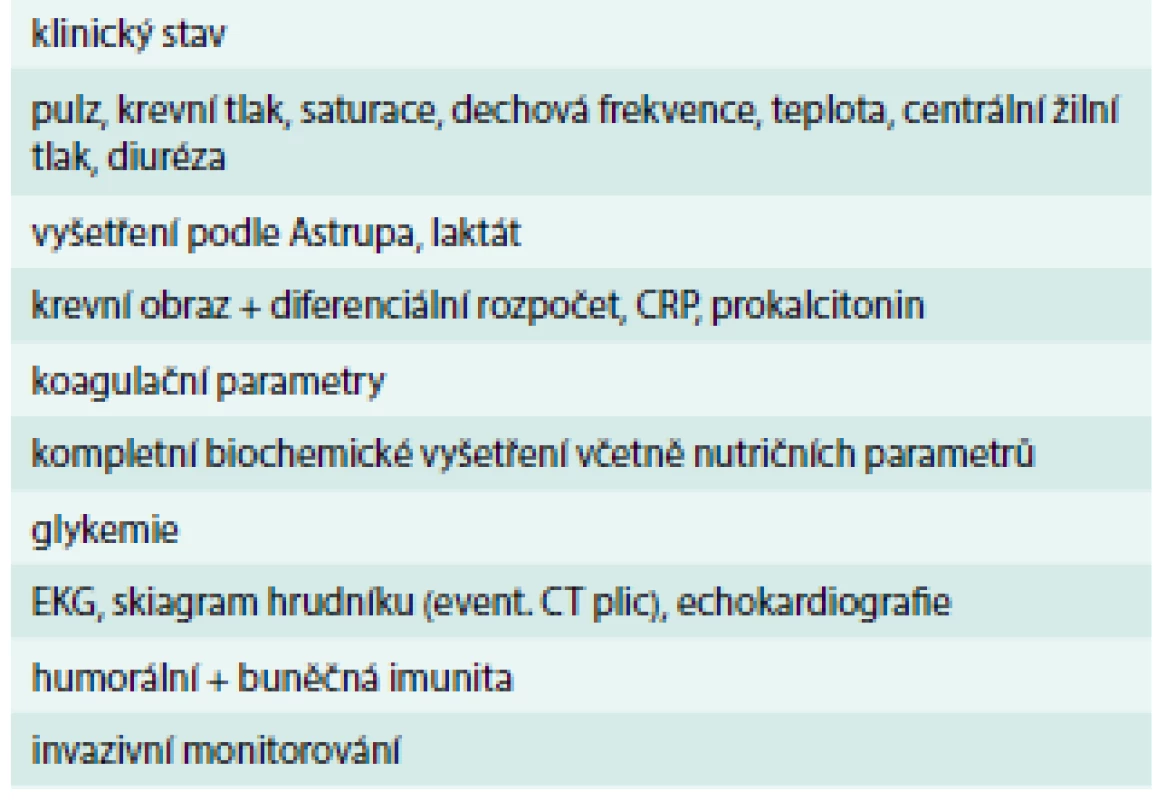
Samozřejmostí je pečlivé monitorování nemocných s těžkou HAP z hlediska vývoje onemocnění, reakce na léčbu, vzniku možných komplikací, objevení se nežádoucích účinků léčby či eventuální jiné příčiny plicního postižení, než je pneumonie. Základní sledované parametry u těchto pacientů jsou uvedeny v tab. 4.
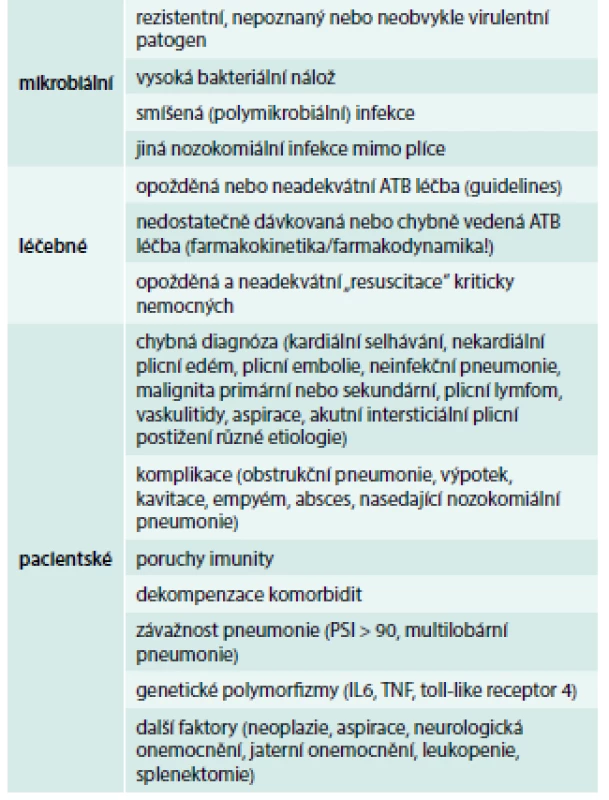
Efekt léčby bývá hodnocen po 72 hod. Pozitivní reakce na léčbu zahrnuje vymizení teplot, sníženou produkci hnisavého sekretu, pokles leukocytózy, odeznění orgánových dysfunkcí během 48–72 hod od zahájení ATB léčby [61]. Selhání léčby může mít řadu příčin, které jsou uvedeny v tab. 5.
Ve snaze snížit výskyt HAP/VAP byla vypracována a doporučena řada preventivních opatření, včetně časné tracheostomie [62]. Tyto procedury, tzv. ventilátorové balíčky („ventilatory bundles“) jsou uvedeny v tab. 6. Vedou ke snížení incidence VAP, ale nedokážou ji zcela zamezit [63].

Komplikace, prognóza
Vážné komplikace se objevují až u 50 % HAP/VAP [27]. Běžnými doprovodnými komplikacemi HAP/VAP je respirační selhání a sepse, jak již bylo uvedeno výše. Mimo ně se ale může objevit řada dalších komplikací, které jsou uvedeny v tab. 7. Komplikace mohou být lokální vznikající progresí základního patologického procesu nebo jeho přestupem do okolí. Nejobávanější lokální komplikací je ARDS, který je definován jako difuzní buněčná dysfunkce plicního parenchymu vyvolaná faktory, které jsou součástí celkové zánětlivé reakce organizmu na přímé či nepřímé poškození (inzult) a je jednou z hlavních příčin vysoké mortality. Druhým typem jsou komplikace vzdálené, postihující jiné orgány, většinou hematogenním přenosem infekce. Časté jsou komplikace kardiální, protože pneumonie jsou asociovány s akutními postiženími srdce, jako jsou akutní koronární příhody, arytmie (fibrilace síní, komorové tachykardie a další) a srdeční selhání. Příčinou bývá hypoxemie, zánětlivý stav a kardiální stres a tyto kardiální komplikace vedou ke klinickému zhoršení a zvyšují mortalitu [64]. Terapie komplikací těžké pneumonie vychází z doporučených standardů léčby těchto komplikací uvedených v příslušných dokumentech.
Postiženi bývají častěji pacienti ve vyšších věkových skupinách, kteří jsou většinou polymorbidní a dochází u nich pravidelně k dekompenzaci přidružených nemocí (nejčastěji se jedná o exacerbaci CHOPN, asthma bronchiale nebo intersticiálních plicních nemocí, kardiální selhání, různé arytmie, dekompenzaci ischemické choroby srdeční, diabetes mellitus, zhoršení chronických jaterních a ledvinových onemocnění s častým hepatálním a renálním selháním). Pro tyto případy platí obecná pravidla léčby těchto nemocí.
HAP/VAP je nejčastější příčina smrti mezi nozokomiálními infekcemi. Až 50 % všech těchto úmrtí na nozokomiální infekce souvisí s nozokomiální pneumonií [65]. Celková mortalita v souvislosti s HAP dosahuje 20–70 % v závislosti na patogenu, přidružených faktorech a komorbiditách [61,66]. Atributivní mortalita VAP se pohybuje mezi 13–29 %, u HAP okolo 20 % [67,68]. Faktory spojené se zvýšenou mortalitou jsou tíže choroby (APACHE skóre), multilobární postižení, kavitace, rychle progredující plicní infiltráty, sepse, šok, kóma, respirační selhání, ARDS, bakteriemie, MDR patogeny a těžké komorbidity.
Závěr
Přes veškeré pokroky v léčbě a preventivních opatřeních zůstává nozokomiální pneumonie častou a obávanou komplikací nemocniční péče. Její výskyt příliš neklesá, naopak s růstem antibiotické rezistence nemocničních bakteriálních kmenů stoupá riziko morbidity a mortality.
Je jisté, že tato entita zůstane dlouho vážným problémem, s nímž budou nuceni zdravotníci opakovaně, a doufejme, že úspěšně, bojovat.
MUDr. Petr Jakubec, Ph.D.
jakubecp@fnol.cz
Klinika plicních nemocí a tuberkulózy LF UP a FN Olomouc
www.fnol.cz
Doručeno do redakce 20. 8. 2017
Přijato po recenzi 26. 9. 2017
Sources
1. Kalil AC, Metersky ML, Klompas M et al. Management of Adults With Hospital-acquired and Ventilator-associated Pneumonia: 2016 Clinical Practice Guidelines by the Infectious Disease Society of America and the American Thoracic Society. Clin Infect Dis 2016; 63(5): e61-e111. Dostupné z DOI: <http://dx.doi.org/10.1093/cid/ciw353>.
2. Ewig S, Welte T, Chastre J et al. Rethinking the concepts of comunity-acquired and health-care-associated pneumonia. Lancet Infect Dis 2010; 10(4): 279–287.Dostupné z DOI: <http://dx.doi.org/10.1016/S1473–3099(10)70032–3>.
3. Magill SS, Edwards JR, Fridkin SK. [Emerging Infections Programme Healthcare-Associated Infections Antimicrobial Use Prevalence Survey Team]. Survey of healthcare-associated infections. N Engl J Med 2014, 370(26): 2542–2543. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMc1405194>.
4. Jakubec P, Kolář M, Kolek V. Diagnostika a léčba těžké pneumonie. In: Kolek V et al. Doporučené postupy v pneumologii. 2. ed. Maxdorf: Praha 2016. ISBN 978–80–7345–507–1.
5. Vincent JL, Bassetti M, François B et al. Advances in antibiotic therapy in the critically ill. Crit Care 2016; 20(1): 133. Dostupné z DOI: <http://dx.doi.org/10.1186/s13054–016–1285–6>.
6. Craven DE, Chroneou A. Nosocomial pneumonia. In: Madell GL, Benett JE, Dolin R (eds). Principles and Practices of Infectoius Diseases. 2 voll. 7th ed. Elsevier Churchill Livingstone: Philadelphia (PA) 2009 : 3717–3724. ISBN 978–0443068393.
7. Torres A, Ewig S, Lode H et al. [European HAP working group]. Defining, treating and preventing hospital acquired pneumonia. Intensive Care Med 2009; 35(1): 9–29. Dostupné z DOI: <http://dx.doi.org/10.1007/s00134–008–1336–9>.
8. Wang Y, Eldridge N, Metersky ML et al. National trends in patient safety for four common conditions, 2005–2011. N Engl J Med 2014, 370(4): 341–351. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMsa1300991>.
9. Ego A, Preiser JC, Vincent JL. Impact of diagnostic criteria on the incidence of ventilator-associated pneumonia. Chest 2015; 147(2): 347–355. Dostupné z DOI: <http://dx.doi.org/10.1378/chest.14–0610>.
10. [American Thoracic Society; Infectious Diseases Society of America]. Guidelines for the management of adults with hospital-acquired, ventilator-associated, and healthcare-associated pneumonia. Am J Respir Crit Care Med 2005; 171(4): 388–416.
11. [National Institute for Health and Care Excellence (NICE)]. Pneumonia in adults: diagnosis and manamagement. NICE 2014. [20.3.2017]. Dostupné z WWW: http://www.nice.org.uk/guidance/cg191. ISBN 978–1-4731–0864–6.
12. Sopena M, Heras E, Casas I et al. Risk factors for hospital-acquired pneumonia outside the intensive care unit: A case-control study. Am J Infect Control 2014, 42(1): 38–42. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ajic.2013.06.021>.
13. Fabregas N, Ewig S, Torres A et al. Clinical diagnosis of ventilator associated pneumonia revisited: comparative validation using immediate post-mortem lung biopsies. Thorax 1999; 54(10): 867–873.
14. Di Pasquale M, Ferrer M, Esperatti M et al. Assessment of severity of ICU-acquired pneumonia and association with etiology. Crit Care Med 2014, 42(2): 303–312. Dostupné z DOI: <http://dx.doi.org/10.1097/CCM.0b013e3182a272a2>.
15. Blot S, Koulenti D, Dimopoulos G et al. Prevalence, risk factors, and mortality for ventilator-associated pneumonia in middle-aged, old, and very old critically ill patients. Crit Care Med 2014; 42(3): 601–609.
16. Torres A, Ewig S (eds). Nosocomial and Ventilator-Associated Pneumonia. European Respiratory Society Monograph: Plymouth 2011. Vol. 53. ISBN 978–1-84984–016–3. Dostupné z DOI: <http://dx.doi.org/10.1183/1025448x.erm5310>.
17. Kalanuria AA, Zai W, Mirski M. Ventilator-associated pneumonia in the ICU. Crit Care 2014; 18(2): 208. Dostupné z DOI: <http://dx.doi.org/10.1186/cc13775>. Erratum in Ventilator-associated pneumonia in the ICU. [Crit Care. 2016]
18. Gamache J, Harrington A, Kamangar N et al. Bacterial pneumonia. Medscape. Updated 07.12.2016. [25.03.2017]. Dostupné z WWW: <http://emedicine.medscape.com/article/300157-overview>.
19. Amanullah S (ed), Posner DH, Talavera F et al. Ventilator-Associated Pneumonia Overview of Nosocomial Pneumonias, Medscape, Medscape. Updated 31.12.2015. [18.03.2017]. Dostupné z WWW: <http://emedicine.medscape.com/article/304836-overview#a1>.
20. Cook DJ, Walter SD, Cook RJ et al. Incidence of and risk factors for ventilator-associated pneumonia in critically ill patients. Ann Intern Med 1998; 129(6): 433–440.
21. Restrepo M, Peterson J, Fernandez JF et al. Comparison of the bacterial etiology of early-onset and late-onset ventilator-associated pneumonia in subjects enrolled in 2 large clinical studies. Respir Care 2013; 58(7): 1220–1225. Dostupné z DOI: <http://dx.doi.org/10.4187/respcare.02173>.
22. Giantsou E, Liratzopoulos N, Efraimidou E et al. Both early-onset and late-onset ventilator-associated pneumonia are caused mainly by potentially multiresistant bacteria. Intensive Care Med 2005; 31(11): 1488–1494.
23. Nair GB, Niederman MS. Ventilator-associated pneumonia: present understanding and ongoing debate. Intensive Care Med 2015; 41(1): 34–48. Dostupné z DOI: <http://dx.doi.org/10.1007/s00134–014–3564–5>.
24. Ferrer M, Difrancesco LF, Liapikou A et al. Polymicrobial Intensive Care Unit-acquired Pneumonia: Prevalence, Microbiology and Outcome. Crit Care 2015; 19 : 450. Dostupné z DOI: <http://dx.doi.org/10.1186/s13054–015–1165–5>.
25. Jones RN. Microbial etiologies of hospital-acquired bacterial pneumonia and ventilator-associated pneumonie. Clin Infect Dis 2010; 51(Suppl 1): S81-S87. Dostupné z DOI: <http://dx.doi.org/10.1086/653053>. Erratum in Clin Infect Dis 2010; 51(9): 1114.
26. Weber DJ, Rutala WA, Sickbert-Bennett EE et al. Microbiology of ventilator-associated pneumonia compared with that of hospital-acquired pneumonia. Infect Control Hosp Epidemiol 2007; 28(7): 825–831.
27. Sopena M, Sabria M. [Neunos Study Group]. Multicenter study of hospital-acquired pneumonia in non-ICU patients. Chest 2005; 127(1): 213–219.
28. Hanulík V, Uvízl R, Husičková V et al. Bakteriální původci pneumonií u pacientů v intenzivní péči. Klin Mikrobiol Infekc Lek 2011; 17(4): 135–140.
29. Uvizl R, Hanulik V, Husickova V et al. Hospital-acquired pneumonia in ICU patients. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2011; 155(4): 373–378.
30. Herkeĺ T, Uvízl R, Adamus M et al. Epidemiology of hospital-acquired pneumonia: results of a Central European multicenter, prospective, observational study compared with data from the European region. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2016; 160(3): 448–455.
31. Rhodes A, Evans LE, Alhazzani W et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016. Intensive Care Med 2017; 43(3): 304–377. Dostupné z DOI: <http://dx.doi.org/10.1007/s00134–017–4683–6>.
32. Chastre J, Combes A, Luyt CE. The Invasive (Quantitative) Diagnosis of Ventilator-Asssociated Pneumonia. Respir Care 2005; 50(6): 797–807.
33. Meduri GU, Chastre J. The Standardization of Bronchoscopic Techniques for Ventilator-Associated Pneumonia. Chest 1992; 102(5 Suppl 1): S557-S564.
34. [Japanese Respiratory Society]. Diagnosis of hospital-acquired pneumonia and methods of testing for pathogens. Respirology 2009; 14(Suppl 2): S10-S22. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1440–1843.2009.01572.x>.
35. Chastre J, Fagon JY. Ventilator-associated pneumonia. Am J Respir Crit Care 2002; 165(7): 867–903.
36. Campbell GD Jr. Blinded invasive diagnostic procedures in ventilator-associated pneumonia. Chest 2000; 117(4/Suppl 2): S207-S211.
37. Torres A, El-Ebiary M. Bronchoscopic BAL in the diagnosis of ventilator-associated pneumonia. Chest 2000; 117(4 Suppl 2): S198-S202.
38. Meduri GU, Beals DH, Maijub AG et al. Protected bronchoalveolar lavage. A new bronchoscopic technique to retrieve uncontaminated distal airway secretion. Am Rev Respir Dis 1991; 143(4 Pt 1): 855–864.
39. Baughman RP. Protected-specimen brush technique in the diagnosis of ventilator-associated pneumonia. Chest 2000; 117(4 Suppl 2): S203-S206.
40. Torres A, El-Ebiary M, Padro L et al. Validation of different techniques for the diagnosis of ventilator-associated pneumonia. Comparison with immediate postmortem pulmonary biopsy. Am J Respir Crit Care Med 1994; 149(2 Pt 1): 324–331.
41. Rea-Neto A, Youssef NCM, Tuche F et al. Diagnosis of ventilator-associated pneumonia: a systematic review of the literature. Crit Care 2008; 12(2): R56. Dostupné z DOI: <http://dx.doi.org/10.1186/cc6877>.
42. Shorr AF, Sherner JH, Jackson WL et al. Invasive approaches to the diagnosis of ventilator-associated pneumonia: a meta-analysis. Crit Care Med 2005; 33(1): 46–53.
43. Rello J, Vidaur L, Sandiumenge A et al. De-escalation therapy in ventilator-associated pneumonia. Crit Care Med 2004; 32(11): 2183–2190.
44. [Canadian Critical Care Trials Group]. A randomized trial of diagnostic techniques for ventilator-associated pneumonia. N Engl J Med 2006; 355(25): 2619–2630.
45. Kowalczyk W, Rybicki Z, Tomaszewski D et al. The comparison of different bronchial aspirate culturing methods in patients with ventilator-associated pneumonia. Anestezjol Intens Ter 2011; 43(2): 74–79.
46. Clec´h C, Jauréguy F, Hamza L et al. Agreement Between Quantitative Cultures of Postintubation Tracheal Aspiration and Plugged Telescoping Catheter, Protected Specimen Brush, or BAL for the Diagnosis of Nosocomial Pneumonia. Chest 2006; 130(4): 956–961.
47. Papazian L, Thomas P, Garbe L et al. Bronchoscopic or blind sampling techniques for the diagnosis of ventilator-associated pneumonia. Am J Respir Crit Care Med 1995; 152(6 Pt 1): 1982–1991.
48. Gabrhelík T, Hanulik V, Jakubec P et al. Porovnání validity různých vzorků biologického materiálu z dýchacích cest a jejich přínosu v detekci původců nozokomiální pneumonie. Klin Mikrobiol Infekc Lek 2015; 21(1): 4–9.
49. Dalhoff K, Ewig S. [Guideline Development Group]. Clinical Practise Guideline: Adult patients with nosocomial pneumonia – epidemiology, diagnosis and treatment. Dtsch Arztebl Int 2013; 110(38): 634–640. Dostupné z DOI: <http://dx.doi.org/10.3238/arztebl.2013.0634>.
50. Caliendo AM, Gilbert DN, Ginocchio CC et al. Better tests, better care: improved diagnostics for infectious diseases. Clin Infect Dis 2013; 57(Suppl 3): S139-S170. Dostupné z DOI: <http://dx.doi.org/10.1093/cid/cit578>. Erratum in Clin Infect Dis 2014; 58(9): 1346.
51. Lung M, Codina G. Molecular diagnosis in HAP/VAP. Curr Opin Crit Care 2012; 18(5): 487–494. Dostupné z DOI: <http://dx.doi.org/10.1097/MCC.0b013e3283577d37>.
52. Iregui M, Ward S, Sherman G. et al. Clinical importance of delaying the initiation of appropriate antibiotic treatment for ventilator associated pneumonia. Chest 2002; 122(1): 262–268.
53. Rello J, Lisboa T, Koulenti D. Respiratory infections in patients undergoing mechanical ventilation. Lancet Respir Med 2014; 2(9): 764–774. Dostupné z DOI: <http://dx.doi.org/10.1016/S2213–2600(14)70171–7>.
54. Schuetz P, Muller B, Christ-Crain M et al. Procalcitonin to initiate or discontinue antibiotics in acute respiratory tract infections. Cochrane Database Syst Rev 2012; (9): CD007498. Dostupné z DOI: <http://dx.doi.org/10.1002/14651858.CD007498.pub2>.
55. Stolz D, Smyrnios N, Eggimann P et al. Procalcitonin for reduced antibiotic exposure in ventilator-associated pneumonia: a randomized study. Eur Respir J 2009; 34(6): 1364–1375. Dostupné z DOI: <http://dx.doi.org/10.1183/09031936.00053209>.
56. Frat, JPD, Thille AW, Mercat A et al. High-Flow Oxygen through Nasal Cannula in Acute Hypoxemic Respiratory Failure. N Engl J Med 2015; 372(23): 2185–2196. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1503326>.
57. Ferrer M, Esquinas A, Leon M et al. Noninvasive ventilation in severe hypoxemic respiratory failure: a randomized clinical trial. Am J Respir Crit Care Med 2003; 168(12): 1438–1444.
58. Briel M, Meade M, Mercat A et al. Higher vs. lower positive end-expiratory pressure in patients with acute lung injury and acute respiratory distress syndrome: systematic review and meta-analysis. JAMA 2010; 303(9): 865–873. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.2010.218>.
59. Gattinoni L, Carlesso E, Taccone P et al. Prone positioning improves survival in severe ARDS: a pathophysiologic review and individual patient metaanalysis. Minerva Anestesiol 2010; 76(6): 448–454.
60. Sud S, Friedrich JO, Taccone P et al. Prone ventilation reduces mortality in patients with acute respiratory failure and severe hypoxemia: systematic review and meta-analysis. Intensive Care Med 2010; 36(4): 585–599. Dostupné z DOI: <http://dx.doi.org/10.1007/s00134–009–1748–1>.
61. Di Pasquale M, Aliberti S, Mantero M et al. Non-Intensive Care Unit Acquired Pneumonia: A New Clinical Entity? Int J Mol ASc. 2016; 17(3): 287. <http://dx.doi.org/10.3390/ijms17030287>.
62. Bouadma L, Wolff M, Lucet JC. Ventilator-associated pneumonia and its prevention. Curr Opin Infect Dis 2012; 25(4): 395–404. Dostupné z DOI: <http://dx.doi.org/10.1097/QCO.0b013e328355a835>.
63. Nair GB, Niederman MS. Ventilator-associated pneumonia: present understanding and ongoing debate. Intensive Care Med 2015; 41(1): 34–48. Dostupné z DOI: <http://dx.doi.org/10.1007/s00134–014–3564–5>.
64. Corrales-Medina VF, Musher DM, Shachkina S et al. Acute pneumonia and the cardiovascular system. Lancet 2013; 381(9865): 496–505. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(12)61266–5>.
65. Schulgen G, Kropec A, Kappstein I et al. Estimation of extra hospital stay attributable to nosocomial infections: heterogenity and timing of events. J Clin Epidemiol 2000; 53(4): 409–417.
66. Craven DE, Palladino R, McQuillen DP. Healthcare-associated pneumonia in adults: management principles to improve outcomes. Infect Dis Clin North Am 2004; 18(4): 939–962.
67. Melsen WG, Rovers MM, Groenwold RH et al. Atributable mortality of ventilator-associated pneumonia: a meta-analysis of individual patient data from randomized prevention studies. Lancet Infect Dis 2013; 13(8): 665–671. Dostupné z DOI: <http://dx.doi.org/10.1016/S1473–3099(13)70081–1>.
68. Kollef MH, Snorr A, Tabak YP et al. Epidemiology and outcomes of health-care-associated pneumonia: results from a large US database of culture-positive pneumonia. Chest 2005; 128(6): 3854–3862.Erratum in Chest 2006; 129(3): 831.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2017 Issue 11
-
All articles in this issue
- Cílené vyhledávání nemocných s chronickou obstrukční plicní nemocí: stručný přehled
- Diagnostika a léčba komunitní pneumonie – v jednoduchosti je klíč k úspěchu
- Nozokomiální pneumonie
- Pneumonie u imunokompromitovaných
- Idiopatická plicní fibróza. Umíme ji vždy správně diagnostikovat a léčit?
- Exogenní alergické alveolitidy: minimum pro praxi
- Sarkoidóza – nadále záhadné onemocnění
- Současný přístup k diagnostice, léčbě a prevenci tuberkulózy
-
Non-CF bronchiektázie dospělých: stručný přehled pro praxi
Dokument Sekce chorob s bronchiální obstrukcí České pneumologické a ftizeologické společnosti České lékařské společnosti J. E. Purkyně - Cystická fibróza dospělých
- Kardiovaskulární riziko spánkové apnoe a kazuistika
- Komplikace po transplantaci plic
- Nemalobuněčný karcinom plic
- Malobuněčný karcinom plic: epidemiologie, diagnostika a léčba
- Maligní mezoteliom pleury – dosud nepokořený nádor
- Spirometrie – základní vyšetření funkce plic
- Postavení bronchologie v pneumologické diagnostice
- Ultrasonografické vyšetření hrudníku v rukou lékaře klinika
- Neinvazivní ventilace
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Spirometrie – základní vyšetření funkce plic
- Neinvazivní ventilace
- Pneumonie u imunokompromitovaných
- Malobuněčný karcinom plic: epidemiologie, diagnostika a léčba