Malobuněčný karcinom plic: epidemiologie, diagnostika a léčba
Small-cell lung cancer: epidemiology, diagnostics and therapy
Authors present actual overview of information on diagnostic and therapeutic procedures in small-cell lung cancer (SCLC). This highly aggressive type of lung cancer is diagnosed in 14.8 % of Czech lung cancer patients. Vast majority of those patients (87 %) suffer from advanced and metastatic disease in the time of diagnosis. In this issue are presented prognostic factors, staging diagnostic procedures and therapeutic recommendations. The backbone of actual SCLC treatment is combined chemotherapy and radiotherapy and less frequently, carefully in selected cases, surgical procedures. SCLC should be have as chemosensitive, chemoresistent or chemorefractory disease. Actual cytostatic combinations used in 1st line treatment, different schedules of chemoradiotherapy, drugs used in second line treatment and schedules and timing of prophylactic brain irradiation are presented. In near future, perspectively, there are some promissible data on antitumour immunotherapy based on anti CTLA-4 and anti PD-1/PE-L1 antibodies also in SCLC patients.
Key words:
cancer immunotherapy – concomitant chemoradiotherapy – chemotherapy – chest radiotherapy – lung resections – prophylactic brain irradiation – small cell lung cancer
Authors:
Miloš Pešek 1; Jan Mužík 2
Authors‘ workplace:
Klinika pneumologie a ftizeologie LF UK a FN Plzeň
1; ÚZIS Praha
2
Published in:
Vnitř Lék 2017; 63(11): 876-883
Category:
Reviews
Overview
Autoři udávají aktuální přehled literárních údajů z oblasti diagnostiky a terapie malobuněčného karcinomu plic (small-cell lung cancer – SCLC). Tento vysoce agresivní typ karcinomu plic se v České republice zjišťuje u 14,8 % všech nemocných s diagnózou plicního karcinomu. V době stanovení diagnózy se pokročilá stadia nemoci prokazují u 87 % souboru nemocných SCLC. V přehledu jsou uvedeny prognostické faktory, způsob určování stadia onemocnění a doporučené léčebné postupy. Základem současné léčby SCLC je chemoterapie kombinovaná s radioterapií a spíše výjimečně i s chirurgickou léčbou. Z hlediska dosažení léčebné odpovědi se SCLC dělí na onemocnění chemosenzitivní a chemorefrakterní. V přehledu jsou uvedeny aktuální kombinace cytostatik v 1. a ve 2. léčebné linii, zdůrazněn je význam konkomitantní chemoradioterapie u limitovaných forem onemocnění i význam profylaktického ozáření mozku při dosažení remise nádoru. V blízké budoucnosti lze u SCLC očekávat i možnost využití protinádorové imunoterapie protilátkami proti CTLA-4 a PD-1/PD-L1.
Klíčová slova:
chemoterapie – chirurgická léčba – konkomitantní chemoradioterapie – malobuněčný karcinom plic – nádorová imunoterapie – profylaktické ozáření mozku – radioterapie
Úvod
Malobuněčný karcinom plic (small-cell lung cancer – SCLC) je jedním z méně častých podtypů karcinomu plic, představuje aktuálně 10–15 % nově diagnostikovaných případů onemocnění těchto onemocnění. V České republice je diagnostikován u 14,8 % nemocných s karcinomy plic, podobně jako je tomu u karcinomů nemalobuněčných, pozorujeme i zde stagnaci incidence SCLC u mužů ve srovnání s výrazným vzestupem nemalobuněčných i malobuněčných karcinomů plic v ženské populaci (graf 1).
![Trendy incidence ZN plic (C34) dle pohlaví a morfologických typů [25]](https://pl-master.mdcdn.cz/media/image/ff7aa4c1517dba88908add91876a5b45.png?version=1537797828)
Epidemiologie
Věkové charakteristiky a distribuci stadií u SCLC a NSCLC dokumentují graf 2 a graf 3 s. 876n.

![Věk pacientů s NSCLC v období let 2009–2013 [25]](https://pl-master.mdcdn.cz/media/image/ed9ac7fa60ec0d1e214a78d66e018ecd.png?version=1537797521)
SCLC bývají diagnostikovány častěji v pokročilých stadiích onemocnění. Rovněž časná úmrtnost je u SCLC vyšší ve srovnání s nemalobuněčnými karcinomy plic (graf 4).
SCLC je nádor zjišťovaný převážně u silných kuřáků, častěji v pokročilých stadiích – i více než 70 %, s velmi agresivním chováním [4,11,14]; 5leté přežití nemocných s touto diagnózou kolísá v Evropě v rozmezí 2,2–3,7 %, což je výrazně méně, než je tomu u karcinomů nemalobuněčných: 10,8–14 %.
Diagnostika a diferenciální diagnostika
Diagnóza SCLC musí být založena na výsledcích histologického a imunohistochemického vyšetření. Takto je třeba odlišit od SCLC např. malobuněčné varianty plicních karcinomů nemalobuněčných, např. od malobuněčných variant karcinomu skvamózního. Dále je třeba histologickými a genetickými vyšetřeními odlišit od SCLC malobuněčné nádory jiné histogeneze, jako jsou malobuněčný lymfom, malobuněčný osteosarkom či vzácněji karcinom z Merkelových buněk. V diferenciální diagnostice metastazujících malobuněčných karcinomů nejasné primární lokalizace je třeba vzít v úvahu, že kromě SCLC mohou být primárním zdrojem metastáz i např. malobuněčné karcinomy tymu, kolorekta, jícnu, případně karcinom hlavy a krku. Histologicky je nádor charakterizován přítomností monomorfních buněk s vysokým nukleoplazmatickým poměrem, přítomností nekróz a vysokou četností mitóz. Vyšší frekvence mitóz pomáhá diferencovat SCLC od jiných neuroendokrinních tumorů, jako jsou typické či atypické karcinoidy. Imunohistochemická vyšetření zahrnují průkaz tyreoidálního transkripčního faktoru 1 (thyroid transcription factor 1 – TTF1), dále chromogranin, synaptofyzin a CD 56 [18] (obr. 1 a obr. 2).
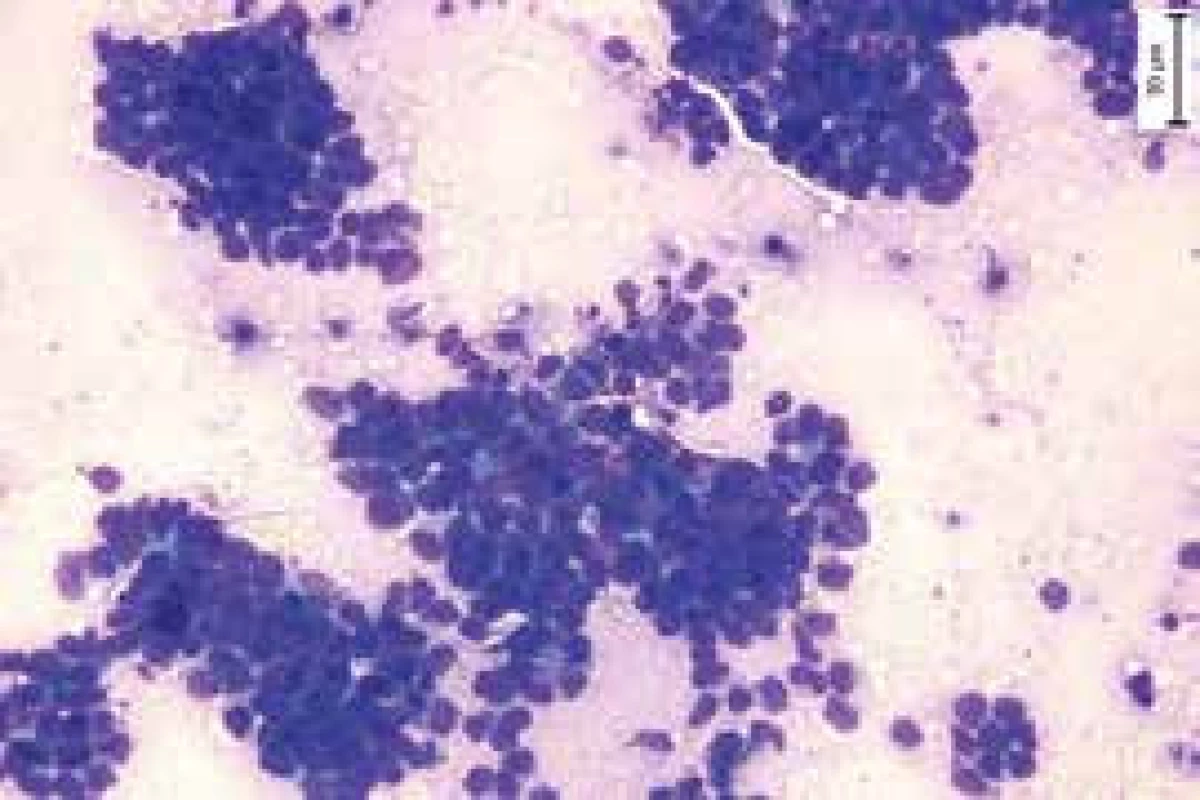
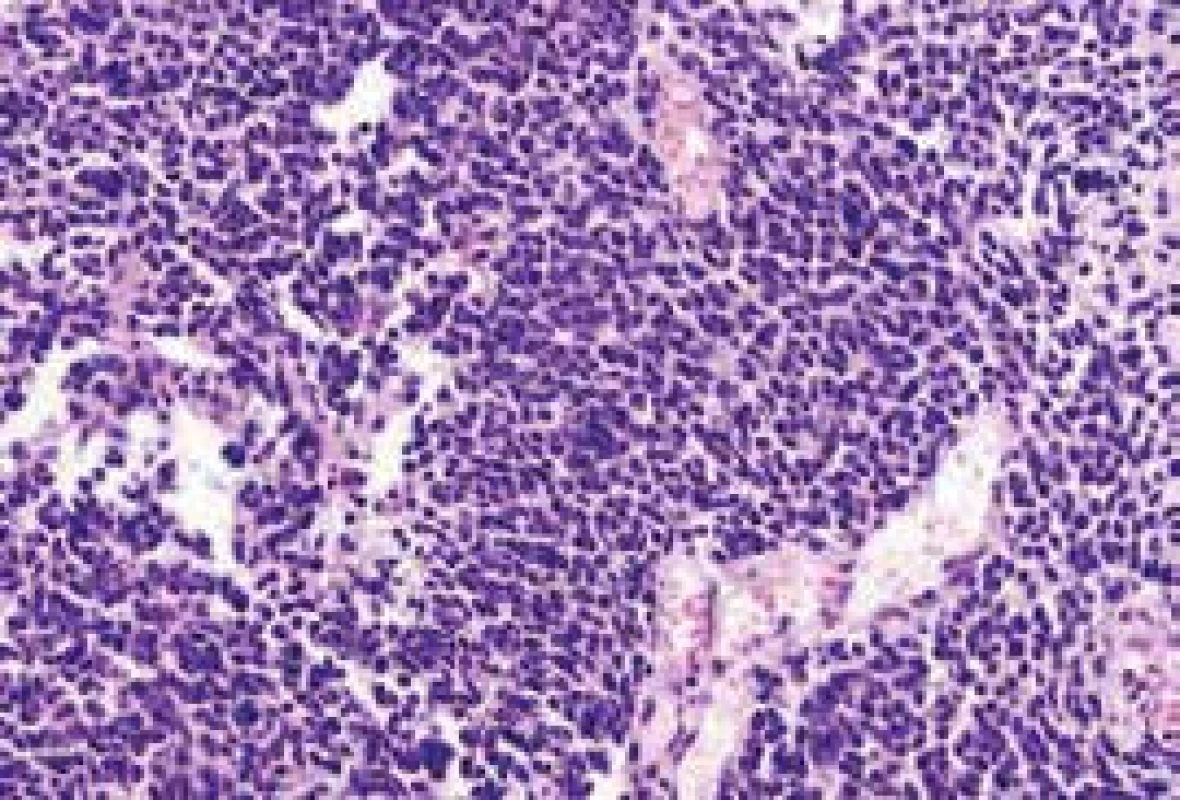
Genetika
SCLC je nádor geneticky značně heterogenní s vysokou mutační náloží. Velká mutační nálož v nádorech tohoto typu i charakter těchto genetických změn je charakteristický pro chronickou expozici kancerogenů obsažených v tabákovém kouři. Genetická vyšetření některých buněčných linií prokázala až 22 190 somatických mutací. Jsou nalézány defekty v genech DNA opravných drahách, inaktivační mutace genů TP53, RBI a PTEN. Naproti tomu aktivační mutace bývají nalézány u genů PIK3CA, EGFR a KRAS, prokazují se amplifikace genů rodiny MYC, EGFR a BCL2 a chybění genů RASSF1A, PTEN a FHIT. Bývají nalézány i rekurentní mutace řady dalších genů a amplifikace genu FGFR1. V současné době není známo, které z mutací zastávají funkci mutací řídících a které by mohly být využity jako terapeutické cíle. Pokles incidence SCLC posuzovaný v některých populacích může být důsledkem snižování počtu kuřáků či přechodem na kouření cigaret s nízkým obsahem dehtu [4].
Klasifikace
SCLC je velmi rychle rostoucí nádor. Výzkum zaměřený na tento typ plicních karcinomů vyhodnocený analýzou dat Národního screeningového programu pro karcinom plic (National Lung Screening Trial – NLST) prokázal, že tento screeningový program není schopen zachytit významný podíl časných stadií tohoto typu nádoru a ani benefit v přežití nemocných diagnostikovaných v rámci screeningu [19].
Prediktory prodlouženého specifického přežití u SCLC jsou: ženské pohlaví, mongoloidní (asijská) rasa, stadium III, věk nižší 50 let, bydliště na venkově a použití klasických léčebných postupů (chirurgická léčba, chemoterapie a radioterapie) [12]. Negativním prediktorem přežití je sarkopenie [9]. K dispozici jsou nomogramy, které predikují délku přežití pacientů, vycházející z vyhodnocení běžných vyšetření laboratorních parametrů z periferní krve [23]. U limitované nemoci může být prediktorem léčebné odpovědi i celkového přežití i exprese PD-l (programmed death) receptoru na nádorových buňkách [7,8].
Určení stadia nádorů tohoto typu, dříve omezené na 2 kategorie – limitovanou a extenzivní nemoc, se nyní doporučuje provádět v rámci aktuální TNM klasifikace [17] (tab. 1 a tab. 2). Stanovení kategorií TNM musí být podloženo klinickým vyšetřením, výsledky zobrazovacích vyšetřovacích metod, endoskopií nebo chirurgickou explorací.
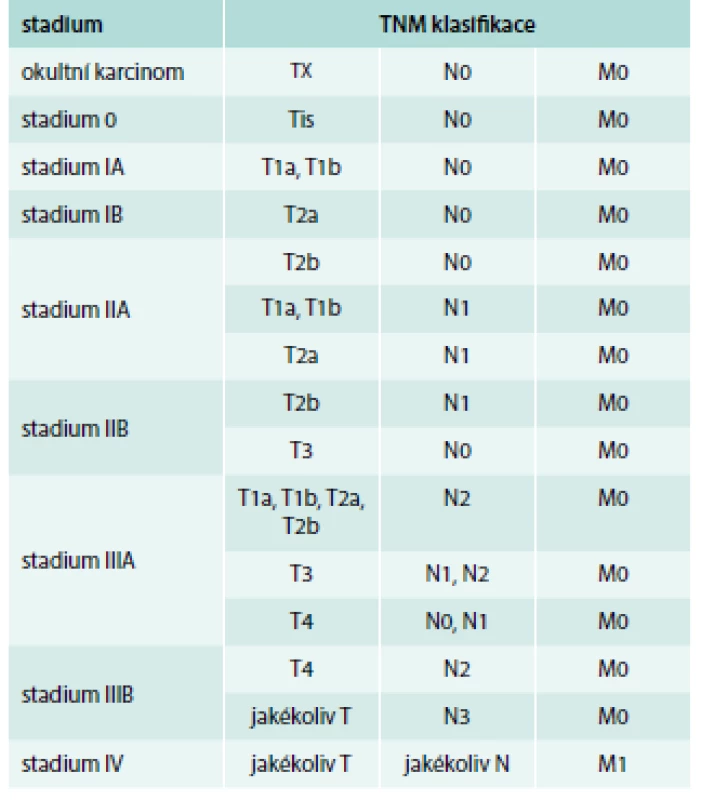
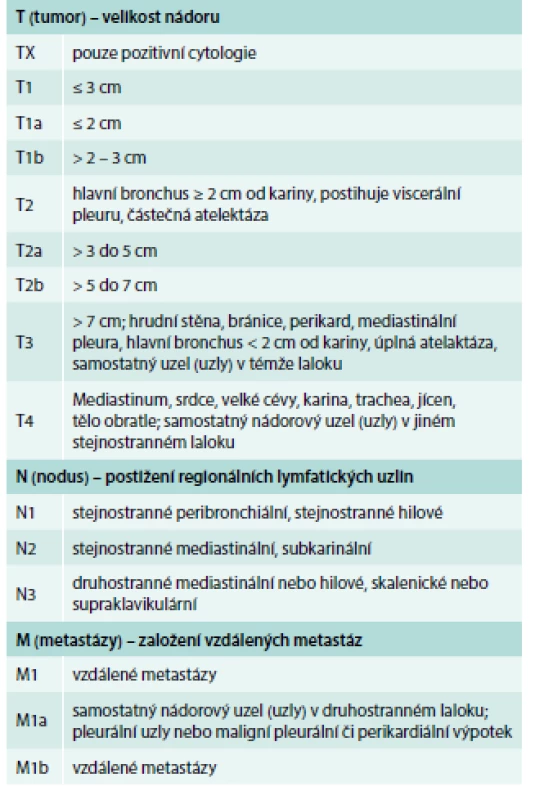
Vyšetření
Před rozhodnutím o léčbě jsou nemocní vyšetřeni podrobně na pneumologickém pracovišti, s využitím bronchoskopie, CT hrudníku a břicha, ultrasonografie nadklíčků, scintigrafie skeletu a CT mozku.
Nejvyšší senzitivitu a specificitu z hlediska stanovení rozsahu nádorové nemoci má hybridní vyšetření PET/CT. Při podezření na přítomnost kostních metastáz je toto vyšetření citlivější než kostní scintigrafie, jejíž specificitu může zvýšit vyšetření alkalické fosfatázy v séru [3]. Pro průkaz přítomnosti metastáz v mozku se pokládá za citlivější vyšetření nukleární magnetickou rezonancí než klasická výpočetní tomografie.
Zde uvedené deskriptory umožňují lépe než původní dělení zvolit adekvátní léčebný postup a lépe odhadnout prognózu zvolené terapie. Bylo například prokázáno, že T stadium nádoru koreluje s 5letým přežitím pacientů, významné rozdíly v přežití jsou i mezi skupinami N1 a N2, oproti tomu podskupina nemocných s pleurálními výpotky zahrnutá do kategorie limitované nemoci má výrazně horší přežití ve srovnání s ostatními pacienty hodnocenými v rámci souboru s limitovaným onemocněním.
Léčba
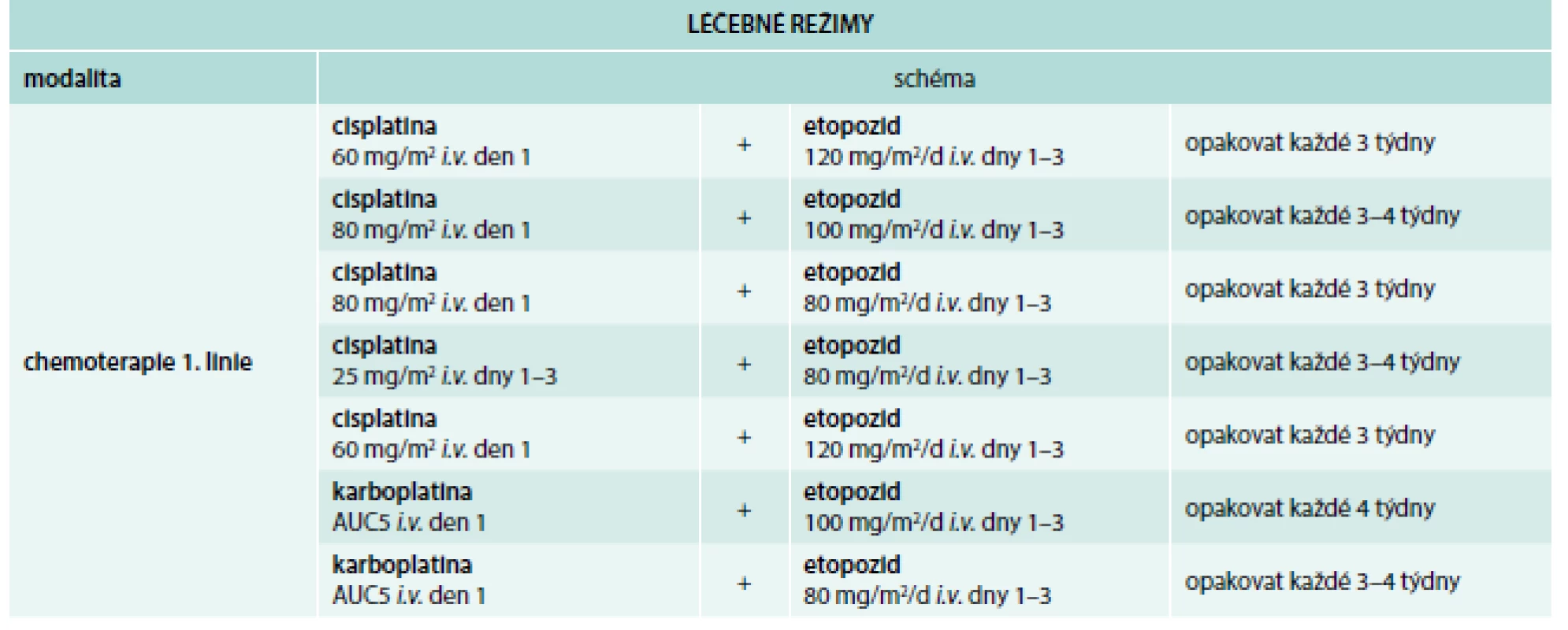
K léčbě SCLC v 1. linii jsou jako zlatý standard doporučovány režimy etopozid + cisplatina, případně etopozid + karboplatina. Léčebnou alternativu zde představují i kombinace irinotekan + cisplatina nebo irinotekan + karboplatina. Posledně uvedené režimy byly doloženy jako účinnější v populacích asiatů, konfirmační studie provedené v kazašské populaci však prokázaly srovnatelnou účinnost při porovnání s kombinacemi platinových derivátů a etopozidu [5]. Ve své studii Hermes et al [6] však prokázali i v kazašské populaci delší přežití nemocných léčených kombinací irinotekan + karboplatina ve srovnání s nemocnými léčenými kombinací etopozid + karboplatina. Důvodem rozdílných výsledků použití irinotekanových kombinací v kazašské populaci pacientů se SCLC mohou být rozdíly v dávkovacích schématech použitých režimů.
Rozdělení malobuněčného karcinomu plic z hlediska odpovědi na chemoterapii
Typ chemosenzitivní
V průběhu chemoterapie dojde ke kompletní nebo parciální remisi nádoru, tato remise trvá alespoň 60–90 dní po skončení chemoterapie. V případě relapsu chemosenzitivního typu nádoru je obvykle zachována citlivost k platinovým cytostatikům. Pravděpodobnost dosažení další remise onemocnění při použití původní léčebné kombinace činí více než 50 %.
Typ chemorefrakterní
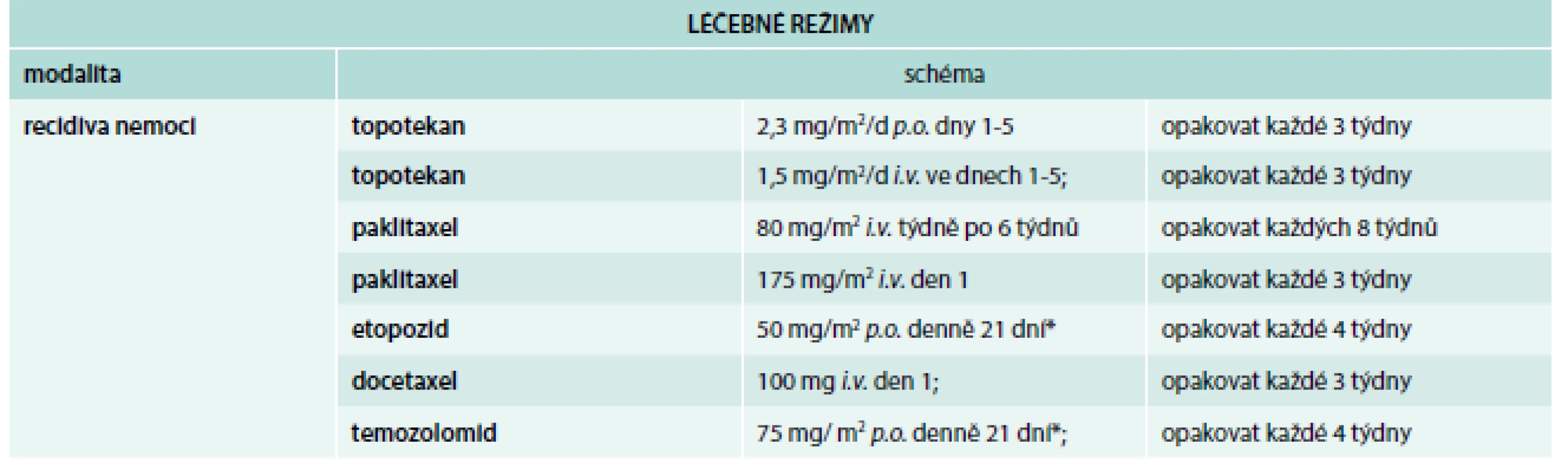
V průběhu chemoterapie dojde ke kompletní nebo k parciální remisi nádoru, k progresi nádoru však dojde do 60–90 dní po skončení chemoterapie. Při relapsu chemorezistentního nádoru je třeba počítat s rezistencí nádoru k platinovým derivátům [18]. Léčebné režimy ukazují tab. 3 a tab. 4.
Kombinace léčebných postupů u limitovaných forem SCLC
V kombinaci s chemoterapií lze využít léčbu chirurgickou nebo léčbu zářením.
Chirurgická léčba
Chirurgická léčba je přednostně indikována u nádorů s periferní lokalizací, do největšího průměru 3 cm. Indikovány jsou anatomické resekce s odběrem hilových a mediastinálních uzlin. Nezbytnou součástí léčby je zde adjuvantní chemoterapie výše uvedenými platinovými dublety v celkovém počtu 4–6 cyklů [20,24]. Přídatná pooperační radioterapie může být kontraproduktivní u nemocných se stadiem pN0, nepřínosná u nemocných se stadiem pN1, ale významně prodlužující život u nemocných se stadiem pN2.
Pacienti s malobuněčnými karcinomy plic vyšších stadií mohou tedy profitovat z chirurgické léčby doplněné o chemoterapii, ať už se jedná o nádory stadia > T1 nebo N0–N1. Studie provedená v Durhamu dokládá při porovnání nemocných s rozsahy onemocnění pT1–2-, pN1–N2 významně vyšší pravděpodobnost 5letého přežití u operovaných nemocných při porovnání s neoperovanými (mediány přežití 27,5 vs 19,6 měsíců, procento nemocných přežívajících 5 let 32,1 % vs 21,8 %) [20,22,24]. Radioterapie byla v tomto případě indikována u všech nemocných, kteří nebyli léčení chirurgicky, ale i u části souboru nemocných léčených chirurgicky a zároveň adjuvantní chemoterapií [24]. Chirurgickou léčbu můžeme pravděpodobně zvažovat i v případě úplné remise v uzlinách N1, N2 dosažené indukční léčbou, v případě perzistence nádoru po kompletní onkologické léčbě, či jako záchranné operace (salvage surgery) při operabilní recidivě nádoru v původní lokalizaci za předpokladu vyloučení přítomnosti metastáz v jiných lokalizacích [10].
Při přítomnosti vzdálených metastáz je chirurgická léčba vždy kontraindikována. U většiny případů limitovaného onemocnění SCLC se chemoterapie kombinuje s konkomitantně nebo sekvenčně aplikovanou radioterapií.
Radioterapie SCLC
Malobuněčný karcinom je považován za onemocnění radiosenzitivní, ne však za nemoc radiokurabilní, pokud by se zvažovalo požití léčby zářením jako primární či definitivní léčebné metody.
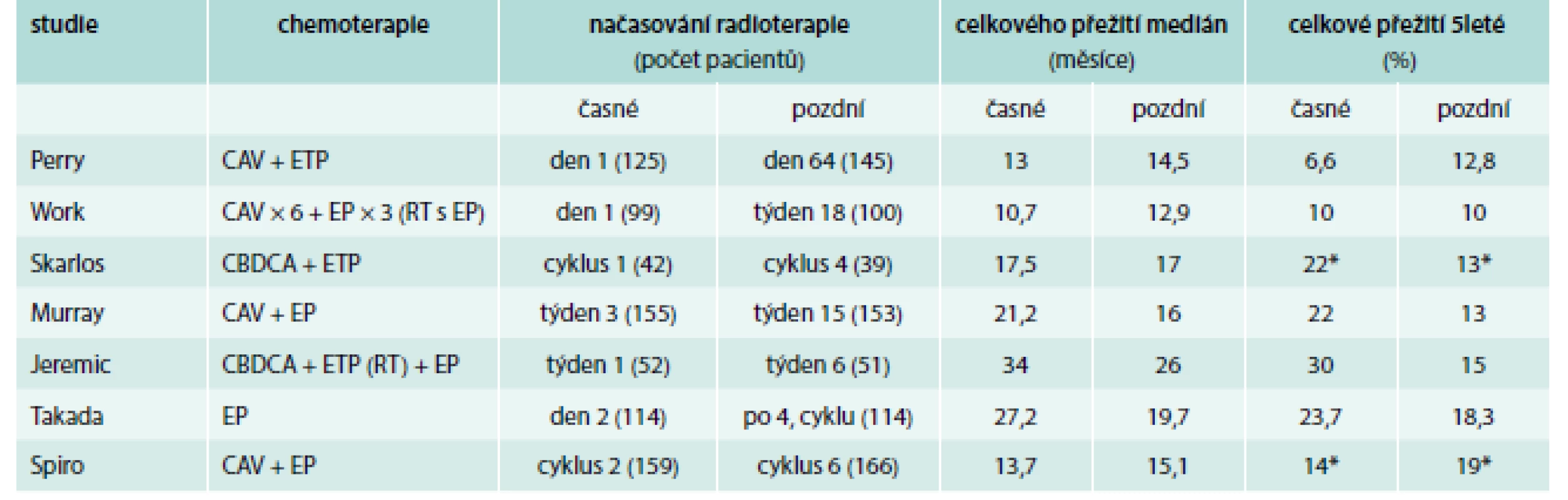
Přidání radioterapie k chemoterapii však u limitovaných stadií nemoci přináší výrazný benefit pro celkové přežití nemocných. Přednostně je zvažována tzv. konkomitantní (souběžná) radioterapie s chemoterapií, která se i přes vyšší toxicitu (radiační ezofagitida, hematologická toxicita) pokládá za účinnější, než je radioterapie aplikovaná sekvenčně, tj. v návaznosti na úvodní chemoterapii [1]. Optimální se jeví časné zařazení radioterapie již v době aplikace 1. či 2. cyklu chemoterapie, rozdíly mezi střední dobou přežití nemocných léčených konkomitantní a sekvenční chemoradioterapií činily 27,2 a 19,7 měsíce. Metaanalýza 7 kontrolovaných studií doložila zlepšení 2letého přežití nemocných léčených konkomitantní chemoradioterapií, benefit v přežití byl však omezen na nemocné léčené hyperfrakcionovanou radioterapií. Spojitá analýza 4 studií fáze III s využitím 2 různých režimů radioterapie v návaznosti na chemoterapii etopozidem a platinovými cytostatiky vyhodnotila efekt délky času uplynulého mezi jakýmkoliv začátkem léčby a ukončením radiace. Čím byl tento interval kratší, tím delší bylo 5leté přežití nemocných. Stejně tak se potvrdilo, že čím dříve byla léčba zářením zahájena po začátku chemoterapie, tím bylo celkové přežití nemocných delší. Konkomitantní chemoradioterapie může přinést významný benefit i u nemocných starších 70 let [2].
Některé randomizované studie rovněž potvrdily přínosy přežití při použití hyperfrakcionované radioterapie v porovnání s režimy se standardní frakcionací, byť dosažený za cenu vyšší frekvence radiační ezofagitidy III. stupně. V současné době je možné doporučit jak režim ozařování aplikovaného 1krát, tak i 2krát denně [18].
U nemocných s inoperabilními SCLC ve stadiu I lze doporučit použití stereotaktické radioterapie s adjuvantní, event. neoadjuvantní chemoterapií [21]. I u těchto nemocných podobně jako u pacientů léčených plicní resekcí a adjuvantní chemoterapií, je třeba zvažovat profylaktické ozáření mozku.
Paliativní ozáření plicních manifestací nádorů – konsolidační radioterapii – lze indikovat i u nemocných s původně extenzivním onemocněním, za předpokladu, že po předchozí chemoterapii dojde k remisi onemocnění [16].
Profylaktické ozáření mozku
Mozek je častým místem vzniku metastáz SCLC, již v době stanovení diagnózy se metastázy prokazují u 10–15 % pacientů a v dalším průběhu nemoci se objeví u dalších 20–30 % pacientů. Již v roce 1999 metaanalýza 7 randomizovaných studií 987 pacientů prokázala snížení rizika úmrtí a vzestup nemocných přežívajících déle než 3 roky o 5,4 % (z 15,3 % na 20,7 %), pokud po absolvování indukční léčby podstoupili ještě profylaktické ozáření mozku. Tato léčebná modalita rovněž vedle k 25% snížení incidence mozkových metastáz v průběhu 3 let od zahájení léčby. K podobným závěrům dospěla i analýza dat databáze SEER, která prokázala, že profylaktické ozáření mozku (prophylactic cranial irradiation – PCI) vedlo k téměř 2násobnému zvýšení podílu dlouhodobě žijících nemocných s limitovanými stadii onemocnění v průběhu 10letého sledování. Také u nemocných s extenzivním stadiem SCLC s příznivou odpovědí na indukční chemoterapii vedlo PCI sice k redukci rizika vzniku mozkových metastáz, ovlivnění času do progrese nemoci a celkového přežití dle výsledků provedených studií však nebylo jednoznačné [18] (tab. 5).
Nové možnosti cílené, biologické a imunologické terapie SCLC
Na rozdíl od nemalobuněčných karcinomů plic je poznávání řídících mutací a mechanizmů u SCLC značně pozadu. Cílená léčba tyrozinkinázovými inhibitory zatím nevedla k prokazatelně prodlouženému přežití nemocných se SCLC. Nadějným výzkumným směrem léčby SCLC bude pravděpodobně imunoterapie.
Tyto naděje vzbuzují některé prokázané zkušenosti z klinického pozorování nemocných, u nichž byly pozorovány imunitně zprostředkované paraneoplastické syndromy zejména neurologické, spojené s přítomností anti-Hu protilátek. Tito nemocní mají zlepšenou odpověď na protinádorovou léčbu a v porovnání s pacienty bez těchto syndromů mají i delší dobu přežití.
Inhibice kontrolních bodů imunitní odpovědi – imunoonkologie
V současnosti jsou již dostupné klinické zkušenosti s využíváním protilátek proti CTLA-4 a proti PD1/PDL1.
Ipilimumab
Ipilimumab je humanizovaná proti CTLA-4. Pro použití u SCLC byla provedena multicentrická randomizovaná, zaslepená studie fáze II v kombinaci s chemoterapií paklitaxel + karboplatina + ipilimumab 10 mg/kg u 334 pacientů s extenzivními SCLC. Podání protilátky vedlo k prodloužení času do progrese nemoci na 6,4 měsíce oproti 5,3 měsíce ve skupině s placebem (HR 0,64, 95% CI 0,40–1,02, p = 0,03). Frekvence léčebných odpovědí s využitím kritérií imuno-RECIST byla ve skupině léčené ipilimumabem 71 % vs 53 %, celkové přežití však nebylo v experimentální skupině statisticky významně delší – 12,9 měsíců vs 9,9 měsíce, HR 0,75, 95% CI 0,46–1,23, p = 0,13. Nežádoucí účinky léčby, které se vyskytly častěji v experimentální skupině, byly pruritus, rash a průjem. Nežádoucí účinky se vyskytly častěji u nemocných léčených ipilimumabem, častěji při jeho následném podávání po chemoterapii.
Nivolumab
Frekvence léčebných odpovědí k nivolumabu po selhání chemoterapie prezentovaná na ASCO 2015 byla 15 %, při použití kombinace nivolumab + ipilimumab byla frekvence léčebných odpovědí 20 %, uvádí se, že šlo o trvalé léčebné odpovědi. Mediány přežití nemocných léčených kombinovanou imunoterapií ve 2. linii léčby extenzivní nemoci činily 6,0 a 7,7 měsíců, podle použitých dávek jednotlivých preparátů. Určitý problém představují skutečnosti, že imunoterapie nepůsobí bezprostředně a může dojít k pseudoprogresi a zvětšení objemu nádorů, což může vést ke zhoršení stavu pacientů. Také pozorování ojedinělého úmrtí pacienta se SCLC léčeného kombinací nivolumab + ipilimumab na myasthenia gravis může znamenat možné ohrožení nemocných zhoršením paraneoplastických syndromů [11].
Pembrolizumab
Pembrolizumab, jiná monoklonální anti PD-1 protilátka, přinesla slibnou frekvenci léčebných odpovědí u nemocných s PDL1 pozitivními SCLC po progresi po předchozí chemoterapii byly u 25 % nemocných pozorovány parciální léčebné odpovědi, které trvaly déle než 4 měsíce, přibližně polovina léčených nemocných měla nežádoucí účinky léčby, jen jedna šestnáctina nemocných měla nežádoucí účinky 3. stupně. Studie Keynote 028 udává frekvenci léčebných odpovědí 33,3 %, 1roční frekvenci přežití nemocných 37,7 % a střední dobu přežití nemocných 9,7 měsíce [11,13,18].
Vyhlídky léčebných možností SCLC
V nejbližší budoucnosti zůstanou patrně hlavními léčebnými modalitami modality běžně užívané, chemoterapie v kombinaci s radioterapií, méně často s léčbou chirurgickou, součástí léčby pravděpodobně zůstane i radioterapie zbytkové nemoci u extenzivní nemoci a profylaktické ozáření mozku u všech stadií onemocnění po dosažení regrese plicních i mimoplicních projevů přítomnosti nádorové choroby. Další využitelné možnosti pak budou přicházet v úvahu podle imunohistochemických či genetických podrobnějších charakteristik nádorových onemocnění [1].
Imunoterapie protilátkami proti PD1 či PDL1 je další slibnou cestou. Zde by mohly přicházet v úvahu cílené terapie monoklonálními protilátkami, např. nivolumabem a pembrolizumabem [11,13,18].
Naději vzbuzuje i rovalpituzumab tesirin – protilátkový konjugát δ-like protein 3 s pyrolobenzodiazepinovým dimerizovaným toxinem [15]. Pravděpodobným prediktorem účinnosti zde může být vysoká exprese δ-like proteinu 3.
V současné době však, přes značný pokrok ve výzkumu genetických změn a signálních drah v nádorových buňkách SCLC, zůstává tento nádor z hlediska využitelnosti nových možností onkologické léčby, zejména léčby cílené a imunoterapie, v kategorii nádorů těmito možnostmi zatím neovlivnitelných.
prof. MUDr. Miloš Pešek, CSc.
pesek@fnplzen.cz
Klinika pneumologie a ftizeologie LF UK a FN
www.plzen.cz
Doručeno do redakce 4. 9. 2017
Přijato po recenzi 26. 9. 2017
Sources
1. Almquist D, Mosalpuria K, Ganti AK Multimodality Therapy for Limited-Stage Small-Cell LungCancer. J Oncol Pract 2016; 12(2): 111–117. Dostupné z DOI: <http://dx.doi.org/10.1200/JOP.2015.009068>.
2. Corso CD, Rutter CE, Park HS et al. Role of Chemoradiotherapy in Elderly Patients With Limited-Stage Small-Cell Lung Cancer. J Clin Oncol 2015; 33(36): 4240–4246. Dostupné z DOI: <http://dx.doi.org/10.1200/JCO.2015.62.4270>.
3. Fan M, Zhang J, Liu D et al. Comparison of PET/CT, 99mTc-MDP Bone Scan and Serum Alkaline Phosphatase for Detecting Bony Metastasis in Patients with Small Cell Lung Cancer. J Thorac Oncol 2015; 10(Suppl 2): S501. P1.07–016.
4. George J, Lim JS, Jang JS et al. Comprehensive genomic profiles of small cell lung cancer. Nature 2015; 524(7563): 47–53. Dostupné z DOI: <http://dx.doi.org/10.1038/nature14664>.
5. Hanna N, Bunn PA, Langer C et al. Randomized Phase III Trial Comparing Irinotecan/Cisplatin With Etoposide/Cisplatin in Patients With Previously Untreated Extensive-Stage Disease Small-Cell Lung Cancer. J Clin Oncol 2006; 24(13): 2038–2043.
6. Hermes A, Bergman B, Bremnes R et al. Irinotecan Plus Carboplatin Versus Oral Etoposide Plus Carboplatin in Extensive Small-Cell Lung Cancer: A Randomized Phase III Trial. J Clin Oncol 2008; 26(26): 4261–4267. Dostupné z DOI: <http://dx.doi.org/10.1200/JCO.2007.15.7545>.
7. Illei PB, Forde P, Hann C et al. Expression in Small Cell Lung Carcinoma: An Immunohistochemical Analysis of 26 Cases Using Two Anti-PD-L1 Antibodies. J Thorac Oncol 2015; 10(Suppl 2): S360.
8. Ishii H, Azuma K, Kawahara A et al. Significance of Programmed Cell Death-Ligand 1 Expression and its Association with Survival in Patients with Small Cell Lung Cancer. J Thorac Oncol 2015; 10(3): 426–430. Dostupné z DOI: <http://dx.doi.org/10.1097/JTO.0000000000000414>.
9. Kim EY, Kim YS, Park I et al. Prognostic Significance of CT-Determined Sarcopenia in Patients with Small-Cell Lung Cancer. J Thorac Oncol 2015; 10(12): 1795–1799. <http://dx.doi.org/10.1097/JTO.0000000000000690>.
10. Kolek V et al. Doporučené postupy v pneumologii. Maxdorf: Praha: 2013. ISBN 978–80–7345–359–6.
11. Mamdani H, Induru R, Jalal SI. Novel therapies in small cell lung cancer. Review Article on Lung Cancer Diagnostics and Treatments 2015: A Ranaissance of Patient Care. Transl Lung Cancer Res 2015; 4(5): 533–544. Dostupné z DOI: <http://dx.doi.org/10.3978/j.issn.2218–6751.2015.07.20>.
12. Nawal L, Islam KMM, Deviany PE et al. Survival Trends of Small Cell Lung Cancer (SCLC) in the United States: A SEER Database Analysis. J Thorac Oncol 2015; 10(Suppl.2): S402.
13. Ott P, Felip E, Hiret S et al. OA05.01 pembrolizumab in patients with extensive-stage small cell lung cancer: Updated survival results from KEYNOTE-028. J Thorac Oncol 2017; 12(1 Suppl): S259. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jtho.2016.11.250>.
14. Pillai RN, Owonikoko TK. Small Cell Lung Cancer: Therapies and targets. Semin Oncol 2014; 41(1): 133–142. Dostupné z DOI: <http://dx.doi.org/10.1053/j.seminoncol.2013.12.015>.
15. Rudin CM, Pietanza MC, Spigel DR et al. A DLL3-Targeted ADC, Rovalpituzumab Tesirine, Demonstrates Substantial Activity in a Phase I Study in Relapsed and Refractory SCLC. J Thorac Oncol 2015; 10(Suppl 2): S192.
16. Slotman B, Faivre-Finn C, Tinteren HV et al. Which Patients with ES-SCLC Should Receive Thoracic Radiotherapy (TRT) Routinely? J Thorac Oncol 2015; 10(Suppl 2): S193.
17. Sobin LH, Gospodarowicz MK, Wittekind C. TNM – klasifikace zhoubných novotvarů. 7. ed. UICC – International Union Against Cancer, global cancer control 2009. Česká verze 2011. ISBN 978–80–904259–6-5.
18. Stinchcombe TE Current Treatments for Surgically Resectable, Limited-Stage, and Extensive-Stage Small Cell Lung Cancer. Oncologist 2017; pii: theoncologist.2017–0204. Dostupné z DOI: <http://dx.doi.org/10.1634/theoncologist.2017–0204>.
19. Thomas A, Szabo E, Pinsky P. Screening for Small Cell Lung Cancer: Analysis of the National Lung Cancer Screening Trial Data. J Thorac Oncol 2015; 10(Ssuppl 2): S221. Abstract ORAL25.01.
20. Vandeusen A, Zaidi AH, Martin SA et al. “Peripheral Limited” Small Cell Lung Cancer (SCLC). Does Surgical Resection Have a Role in Primary Management? J Thorac Oncol 2015; 10(Ssuppl 2): S499.
21. Videtic GM, Reddy C, Woody N et al. Medically Inoperable Early Stage Small Cell Lung Cancer: Patterns of Failure after SBRT. J Thorac Oncol 2015; 10(Suppl 2): S626.
22. Wong AT, Rineer J, Schwartz D et al. Assessing the Impact of Postoperative Radiation Therapy for Completely Resected Limited-Stsage Small Cell Lung Cancer Using the National Cancer Database. J Thorac Oncol 2015; 11(2): 242–248. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jtho.2015.10.011>.
23. Xie D, Marks R, Zhang M et al. Nomograms Predict Overall Survival for Patients with Small-Cell Lung Cancer Incorporating Pretreatment Peripheral Blood Markers. J Thorac Oncol 2015; 10(8): 1213–1220. Dostupné z DOI: <http://dx.doi.org/10.1097/JTO.0000000000000585>.
24. Yang ChFJ, Chan DY, Speicher PJ et al. Long-Term Survival after Surgery for Pathologic N1 and N2 Small Cell Lung Cancer: A Comparison with Nonoperative Management. J Thorac Oncol 2015; 10(Suppl 2): S193.
25. Informace dostupné z WWW: <http://www.uzis.cz>
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2017 Issue 11
-
All articles in this issue
- Cílené vyhledávání nemocných s chronickou obstrukční plicní nemocí: stručný přehled
- Diagnostika a léčba komunitní pneumonie – v jednoduchosti je klíč k úspěchu
- Nozokomiální pneumonie
- Pneumonie u imunokompromitovaných
- Idiopatická plicní fibróza. Umíme ji vždy správně diagnostikovat a léčit?
- Exogenní alergické alveolitidy: minimum pro praxi
- Sarkoidóza – nadále záhadné onemocnění
- Současný přístup k diagnostice, léčbě a prevenci tuberkulózy
-
Non-CF bronchiektázie dospělých: stručný přehled pro praxi
Dokument Sekce chorob s bronchiální obstrukcí České pneumologické a ftizeologické společnosti České lékařské společnosti J. E. Purkyně - Cystická fibróza dospělých
- Kardiovaskulární riziko spánkové apnoe a kazuistika
- Komplikace po transplantaci plic
- Nemalobuněčný karcinom plic
- Malobuněčný karcinom plic: epidemiologie, diagnostika a léčba
- Maligní mezoteliom pleury – dosud nepokořený nádor
- Spirometrie – základní vyšetření funkce plic
- Postavení bronchologie v pneumologické diagnostice
- Ultrasonografické vyšetření hrudníku v rukou lékaře klinika
- Neinvazivní ventilace
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Spirometrie – základní vyšetření funkce plic
- Neinvazivní ventilace
- Pneumonie u imunokompromitovaných
- Malobuněčný karcinom plic: epidemiologie, diagnostika a léčba
