-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Současná koncepce analgosedace v intenzivní péči
Autoři: Herold Ivan
Působiště autorů: ARO, Nemocnice Mladá Boleslav
Vyšlo v časopise: Anest. intenziv. Med., 24, 2013, č. 4, s. 276-284
Kategorie: Postgraduální vzdělávání - Akuální téma v intenzivní péči
1. ÚVOD
Analgezie a sedace (A/S) patří dnes mezi základní algoritmy léčby kriticky nemocných v prostředí JIP. Jeden z nejpropracovanějších dokumentů současné intenzivní medicíny Surviving Sepsis Campaign [1] zahrnuje mezi první desítkou hlavních intervencí i strategii pro A/S a použití myorelaxancií (NMBA):
- Doporučení použití A/S při odpojování (1A).
- Minimalizaci A/S ( bolusy/kontinuální podávání) s přihlédnutím k individuálním cílům (1B).
- Varování před používáním NMBA u septických pacientů bez ARDS (1C).
- Časově omezené (max. 48 hod) použití NMBA u pacientů s časným a těžkým průběhem ARDS (2C).
Analgosedace, z etického pohledu nezbytná pro eliminaci bolesti a utrpení, zásadním způsobem ovlivňuje výsledek celé léčby kriticky nemocných. Dnes jsou k dispozici účinné a dobře řiditelné farmakologické prostředky A/S s osvědčenými protokoly k jejich použití: jejich použití zkracuje dobu pobytu na JIP, snižuje morbiditu a mortalitu. V praxi ale zůstává akviziční cena léků stále barierou při konfrontaci se systémem úhrad za péči a tradičním přístupem lékařů, jenž preferují „hlubokou/těžkou“ sedaci. Současný úhradový systém (bohužel) nezohledňuje včasné propuštění pacienta z JIP, lepší kvalitu života a širší farmako-ekonomické souvislosti vůbec.
2. PROMĚNY PŘÍSTUPU K ANALGOSEDACI
V posledním desetiletí jsme svědky i u nás zásadní proměny přístupu k analgosedaci. Jestliže ještě nedávno byla na resuscitačních odděleních běžná hluboká sedace (de facto TIVA) s preferencí pasivity pacienta, často i s opakovaným podáváním NMBA, dnes je ikonizován weaning (odvykání, snižování podpory), jak z ve smyslu ventilační podpory, tak i analgosedace. Prioritou je dostatečná (současně maximálně dosažitelná) analgezie a dobře řiditelná a relativně mělká sedace, umožňující zachování aktivní spolupráce pacienta a časnou mobilizaci a fyzioterapii. Používané algoritmy A/S sledují někdy i sekundární cíle (synchronizaci s ventilátorem, snížení spotřeby kyslíku při kritické dodávce kyslíku nebo ovlivnění nitrolební hypertenze), bezprostředně nesouvisející s eliminací bolesti, stresu a diskomfortu.
3. BOLEST A STRES NA JIP
Nemocní v kritickém stavu jsou na JIP vystaveni dlouhodobě extrémní akutní stresové situaci. Nečekaně a bez pochopení kauzality se probouzí v cizím prostředí, s amnézií na okolnosti hospitalizace, trpí absencí běžného zvyklého prostředí a rituálů, střídání světla a tmy, extrémním a nezvyklým hlukem (až 80 dB) [2], tepelným diskomfortem a prožívají úzkostné, fobické stavy a delirantní stavy, které nejsou schopni sdělit svému okolí. Trpí deprivací spánku, izolací z absence kontaktů s nejbližšími a frustrací z totální ztráty intimity. Prožívají akutní (procedurální, intervenční) i subakutní bolestivé situace, k nimž bývá ošetřující personál většinou netečný. V neposlední řadě často trpí i abstinenčními symptomy (nikotin, alkohol, sedativa, kofein, dnes i lehčí/těžší drogy), jejichž možná příčina zůstává ošetřujícím často skryta. Příčinou diskomfortu je i ošetřováni v nepřirozené supinační poloze (řada pacientů v domácím prostředí spí na boku nebo na břiše) a v poloze na zádech trpí dorzalgiemi nebo se dusí. V běžném spánku je zaznamenána fyziologická variabilita změny polohy ve spánku na lůžku po 11 minutách (v tradičních učebnicích ošetřovatelství), ve farmakologicky navozeném spánku přirozeně chybí. Architektonika spánku (zejména střídání REM a non REM fáze spánku) bývá u kriticky nemocných jak v důsledku základního onemocnění, tak i vlastní farmakologické sedace hluboce a dlouhodobě narušena, což se promítá do špatné psychomotorické kondice během následně vyšší denní aktivity. Diagnóze unikají delirantní stavy související s použitím sedace a průvodním patofyziologickým stavem, s delším odstupem i vznik posttraumatická stresové poruchy (PTSD – Post Traumatic Stress Disorder) a pozdní kognitivní dysfunkce (LTCD – Long-Term Cognitive Dysfunction), často se manifestující až po dimisi. Na vzniku poruch mají vliv jak používaná neurotropní farmaka, tak i základní onemocnění a fylogeneticky fixovaná neurohumorální reakcí na stres (včetně akutní zánětlivé odpovědi) s produkcí mediátorů, ovlivňujících funkci všech tělesných systémů včetně CNS.
4. VÝVOJ POSTUPŮ ANALGOSEDACE OD VZNIKU PRVNÍCH JIP
Anesteziologové, jako B. Ibsen v Kodani, kteří stáli počátkem 50. let minulého století u zrodu intenzivní péče, měli profesně kódovanou mimořádnou empatii vůči stresu a bolesti pacientů a používali pochopitelně extenzivně prostředky, které dobře znali (barbituráty, kurare, opiáty a neuroleptika). Jak trefně poznamenal o 10 let později T. Petty, systematizovaná péče na prvních JIP v 60. letech s distančním monitorováním ale paradoxně vzdálila sestry od lůžka nemocných. Sedovaný a relaxovaný pacient byl z ošetřovatelského hlediska snadněji zvládnutelný než dříve lehce tlumený a jen malými dávkami morfinu ad hoc sedovaný pacient, ovšem se sestrou sedící v těsné blízkosti lůžka.
Farmaka používaná k analgezii a sedaci na JIP mají řadu vedlejších účinků (tab. 1), které při jednorázovém podání během anestezie nejsou vždy zřejmé, ale které se projevují při jejich delším a opakovaném podávání. Analgosedace používaná u kriticky nemocných vždy odrážela standardní anesteziologickou praxi (barbituráty, morfin, neuroleptanalgezii a lytické směsi, diazepam a dlouhodobá NMBA). V minulosti bývali pacienti často řadu dnů zbytečně relaxovaní aminosteroidními NMBA s dlouhodobým účinkem (pankuroniem nebo pipekuroniem, s aktivními metabolity), někde i bez současné sedace. Prodloužené zotavování po jejich použití je v přímé souvislosti se vznikem infekčních komplikací, plicních komplikací a trombembolickou nemocí.
Tab. 1. Vedlejší účinky nejčastěji používaných farmak k A/S 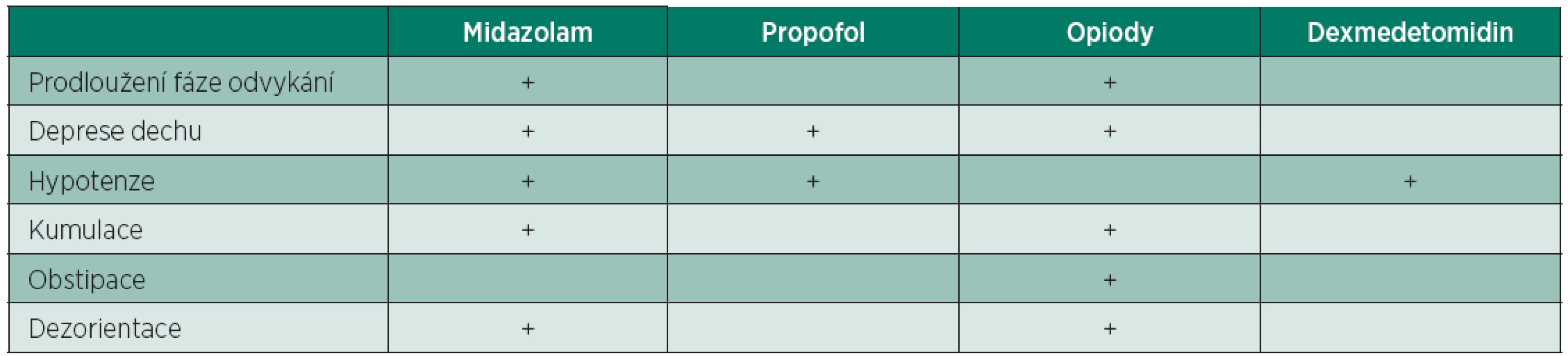
5. NOVÉ POSTUPY A DALŠÍ ZKLAMÁNÍ
70.–80. léta
Jedním z prvních pokusů koncem 70. let o krátkodobou a dobře řiditelnou sedaci v dnešním pojetí bylo krátkodobé (až 96 hod) použití účinného a dobře řiditelného steroidního anestetika (alphaxolon/alphadolon) podle dodnes používaného Ramsayho sedačního protokolu včetně cíleného přerušování sedace a selektivně indikovaného monitorování EEG (k určení hloubky dosažené sedace) [3].
Během 80. let byla postupně v intenzivní péči zaváděna nová farmaka používaná do té doby při anestezii (midazolam/lorazepam, fentanyl, neuroleptanalgezie) s lepším farmakokinetickým profilem a lepším zotavením. Přes jasné výhody přinesla ale i nové problémy, aniž by staré zcela eliminovala. Použití lorazepamu (USA) a midazolamu (v Evropě) je provázeno častějším výskytem deliria, kumulací metabolitů (u midazolamu), s vlivem na delší zotavení a negativním vlivem na svalovou výkonnost. Etomidát, oblíbený pro kardiovaskulární stabilitu při indukci do aneste-zie, vyvolává u kriticky nemocných útlum steroidogeneze v nadledvinkách i při jednorázové aplikaci a v intenzivní péči se historicky neprosadil (viz dále). Problémy s reziduální kurarizací po dlouhodobě působícím pankuroniu (u nás pipekuroniu) nezmizely jeho nahrazením opakovanými dávkami intermediárního vekuronia. Delší podávání atrakuria vede ke kumulaci potenciálně neurotoxického laudanosinu s křečovou EEG aktivitou a průnikem hematoencefalickou barierou. U cisatrakuria je produkce laudanozinu významně nižší a je pro delší použití v intenzivní péči dnes asi nejvhodnější.
90. léta
Jak se postupně rozšiřovaly zkušenosti anestezio-logů s novými opioidy (sufentanilem, remifentanilem) [4] a propofolem během celkové anestezie, začaly se během 90. let objevovat rovněž zprávy o jejich použití v intenzivní péči. Jejich snadnému „převzetí“ do intenzivistické praxe ale bránila nejprve počáteční vysoká cena, specifické galenické problémy (riziko bakteriální kontaminace a významná zátěž triglyceridy u 1% propofolu), později i další komplikace, provázející jejich prolongované podávání, které se dříve při časově limitované anestezii neprojevily (PRIS – Propofol Infusion Syndrome) [5]. Problém kumulace aktivních metabolitů v organismu při jejich delším podávání se týká všech benzodiazepinů (hlavně midazolamu) a většiny opioidů s výjimkou remifentanilu. U benzodiazepinů je riziko větší při jejich kontinuálním podání, které se proto dnes opouští. Naopak „před-procedurální“ bolusové podání benzodiazepinů je racionální, zejména pro jejich amnestické účinky. Kontinuální podání je naproti tomu dále nezbytné u propofolu a remifentanilu. S využitím TCI (Target Controlled Infusion) k aplikaci propofolu a remifentanilu jsou získávány první zkušenosti i v intezivní péči [6]. Použití antagonistů opioidů a benzodiazepinů se přes počáteční nadějné reference vzhledem k delšímu biologickému poločasu metabolitů v podmínkách intenzivní péče neosvědčilo (flumazenil, naloxon). Standardně se vyskytujícím vedlejším účinkem většiny farmak používaných k sedaci (ve větší či menší míře) bývá hypotenze. Ta je nejen nežádoucím důsledkem specifických farmakologických účinků použitého léku, ale i projevem dosažení klinického cíle (eliminace stresu). Někdy ovšem jen demaskuje hypotenzi nebo relativní hypovolémii. Je ovšem otázka, zda je úplná eliminace stresu nezbytná, nebo zda zachování stresu v malé míře není nakonec prospěšné.
Po roce 2000
Zásadní milník pro nový přístup k analgosedaci znamenala práce Kresse et al. z roku 2000 [8] prokazující, že denní přerušení kontinuální sedace zkracuje délku umělé plicní ventilace, respektive délku pobytu na JIP. Následná metaanalýza z roku 2011 [9] pěti kontrolovaných studií neprokázala vliv na zkrácení délky umělé plicní ventilace, ale potvrdila, že jde o bezpečnou praxi, vedoucí mj. ke snížení počtu indikovaných tracheostomií. Předmětem zájmu se staly možné negativné psychologické důsledky provázející vysazení sedace. Počátkem desetiletí se rozšířilo používání protokolizované sedace [10] s příznivým vlivem na délku UPV, délky hospitalizace na JIP/v nemocnici, zkrácení doby sedace a pokles indikací tracheostomií. Recentní kanadská studie [11] však nepotvrdila, že přerušování sedace je nutně prospěšné. Je paradoxně provázeno nutností podávat větší bolusy benzodiazepinů/opioidů, častěji dochází k extubacím, a z hlediska profesní zátěže jsou pak pacienti ošetřovatelsky náročnější.
V roce 2002 byla publikována doporučení SCCM (Society of Critical Care Medicine) [12] pro analgosedaci kriticky nemocných, akceptovaná v místních modifikacích i jinými společnostmi. V loňském roce byla doporučení SCCM aktualizována a odráží jak dostupnost moderních farmak s menším poč-tem vedlejších účinků, tak i změnu pohledu na autonomii pacienta, především odmítání používání fyzických omezovacích prostředků [13].
5. PŘEHLED ZÁKLADNÍCH FARMAKOLOGICKÝCH PROSTŘEDKŮ
a) Benzodiazepiny
Benzodiazepiny (midazolam, v USA i lorazepam) jsou celosvětově nejrozšířenější formou sedace díky nižší ceně, ačkoliv jejich používání je podle výsledků randomizovaných studií provázeno delší dobou intubace, UPV a hospitalizace na JIP, tedy vyššími provozními náklady. Delší infuzní podání lipofilních benzodiazepinů vede, zejména u obézních pacientů, ke kumulaci v tukové tkání; aktivní metabolity midazolamu se kumulují při renální insuficienci. Vyvolávají útlum dechové aktivity a jejich použití vede častěji než u jiných sedativ ke vzniku deliria.
b) Propofol
Propofol ve srovnání s benzodiazepiny zkracuje čas do extubace. U pacientů s objemovým deficitem vede jeho bolusové podání často k hypotenzi. Vzhledem k emulgaci v lipidovém nosiči je vhodné monitorovat 1–2krát týdně hladinu triglyceridůa s lipidovou náloží počítat při rozpisu parenterální výživy. Pro sedaci kriticky nemocných je k dispozici ve 2% lipidové emulzi s poloviční zátěží triglyceridů. Levnější generické formy (produkované výrobci lipidových emulzí) významně zvýšily jeho praktickou dostupnost. Omezením tak zůstávají hlavně jeho oběhové účinky. PRIS syndrom provázející jeho několikadenní podávání se projevuje srdečním selhání s náhlou bradykardií, metabolickou acidózou, hyperkalémií a rabdomyolýzou (sledování pH, laktátu a CK). Vzhledem k lipidovému nosiči je jeho použití spojeno s rizikem bakteriální kontaminace infuzních setů a je nutné dbát na jejich pravidelnou výměnu.
c) Opioidy
Syntetické opioidy – fentanyl/sufentanil, v posledních letech i remifentanil – nahrazují morfin, jehož aktivní metabolit se u pacientů s renální dysfunkcí v těle kumuluje. Ke kumulaci metabolitů fentanylu dochází při jaterním selhání. K řešení akutních bolestivých situací (procedurálních) je vhodné bolusové podání. Při zvyšování konti-nuální dávky je třeba postupovat opatrně.
Vynikající řiditelnost remifentanilu a jeho maximální analgetická potence umožnila použití v intenzivní péči a jeho použití se ukazuje v některých zemích jako racionální i v kontextu nákladové efektivity. Je vhodný pro „analgesia first strategy“, jejíž implementace ale vyžaduje změnu uvažování a čas na přijetí metody (!!!) – konečně nákladová efektivita v jedné zemi není jednoduše přenositelná do jiných zemí (s odlišným systém úhrady). Jeho okamžitý rozklad v krvi nespecifickými esterázami (EMO: Esterase-Metabolised Opioid) může při náhlém ukončení podání vyvolat náhlý návrat velkých bolestí (hyperalgezii).
d) Alfa2 agonisté
Předmětem intenzivního výzkumu a zájmu odborné komunity se v posledním desetiletí v ane-steziologii i v intenzivní péči staly alfa2 agonisté (nejprve off-label klonidin).
Dexmedetomidin (alfa2 A,B,C agonista) má ve srovnání s klonidinem (alfa2 A,C agonista) výrazně vyšší alfa 2/alfa 1 selektivitu (1300/220) [14].
Dexmedetomidin má vzhledem k vyváženému poměr sedativní a analgetické komponenty potenciál k využití v intenzivní péči. Na rozdíl od jiných sedativ nevyvolávají alfa2 agonisté depresi dechu. Ve srovnání s GABA agonisty (benzodiazepiny a propofolem) mají alfa2 agonisté příznivý aktivační vliv na endogenní dráhu NREM fáze spánku a vykazují i analgetické působení. V ane-steziologii se dexmedetomidin osvědčil k tzv. sedaci při vědomí u nejnáročnějších výkonů, spojených s rizikem útlumu dýchání nebo neprůchodnosti dýchacích cest (např. bronchoskopicky asistovaná intubaci při obtížné intubaci). Vyváženější poměr alfa2/alfa1 ve srovnání s klonidinem vedl k eliminaci některých problémů provázejících dříve použití klonidinu (např. vliv na motilitu GIT). Rozšíření SPC použití dexmedetomidinu (k sedaci delší než 24 hodin, liberalizace (zvýšení) dávky), spolu s poklesem akviziční ceny vedly k rozšíření jeho používání v oblasti intenzivní péče jak v USA, tak i Evropě. Ve srovnání s GABA agonisty (propofol, benzodiazepiny) dexmedetomidin zkracuje fázi odvykání od ventilátoru po delším období sedace a jeho použití je provázeno významně nižším výskytem delirantních stavů a z tohoto pohledu se jeví jako nákladově efektivní. Příznivý vliv dexmedetomidinu na zachování tzv. normální spánkové architektoniky (více připomínající fyziologický spánek) se promítá do snadnější probuditelnosti a intaktností kognitivních funkcí [15]. Vedlejším účinkem je hypotenze a bradykardie.
e) Neuroleptika
Oživení zájmu se dnes těší opět antipsychotika indikovaná ke zvládnutí stavů agitovanosti, dávaných do souvislosti s fenoménem tzv. JIP deliria. Nejčastěji požívaný je dnes ve světě stále haloperidol, ať už samotný nebo v kombinaci s ostatními farmaky. Retrospektivní data naznačují možnost jeho příznivého vlivu na mortalitu [16]. Vzhledem k riziku prodloužení QTc a především indukce arytmií typu torsade de pointes je haloperidol (spolu s droperidolem a thioridazinem) považován potenciálně za rizikový lék [17]. Data z kontrolovaných randomizovaných studií, jasněji definujících roli antipsychotik, ale zatím schází. Nová neuroleptika 2. generace (olanzapin) jsou srovnatelně účinná s haloperidolem při menším množství vedlejších účinků [18]
f) Ostatní
K úplnosti výčtu dnes (okrajově a spíše nouzově) používaných farmak patří zmínit, clomethiazol (Heminevrin), klasický levopromazin, eventuálně i ketamin (NMDA agonista).
Při volbě „na míru“ nastavené A/S je třeba si uvědomit konkrétní primární cíle v daném klinickém kontextu: analgezii (často jde o hlavní a jediný cíl), trankvilizaci, amnezii, noční spánek. Nebo sledujeme sekundární cíle, bezprostředně nesouvisející s analgosedací (antikonvulzní aktivita, synchronizace s ventilátorem)?
Při použití NMBA je posuzování kvality analgosedace problematické a doporučuje se objektivizace hloubky sedace, např. pomocí BIS nebo při výskytu křečové aktivity sledování EEG. Inovované technologie (AnaCondDa® – Anaesthetic Conserving Device) dnes umožňují netradiční aplikaci na JIP i inhalačních anestetik (isofluran), dříve striktně vyhrazených pro prostředí operačních sálů.
Srovnání vedlejších účinků nejpoužívanějších farmak uvádí tabulka1.
6. NOVÉ MYŠLENKY, NOVÁ PARADIGMATA
Přístup k A/S prošel v posledních letech zásadní proměnou v důsledku pochopení komplikací a rizik provázejících používání sedativní medikace a významu včasné mobilizace a fyzioterapie pro rychlé překonání kritického onemocnění s vlivem na eliminaci problému svalové slabosti kriticky nemocných. Nedostatečná A/S vede k asynchronii s ventilátorem, zvýšení kyslíkové spotřeby, zrušené katétrů, nechtěné extubaci, což zvyšuje náklady a je dáváno do souvislosti s posttraumatickou stresovou odpovědí. Nadměrné použití A/S prodlužuje délku umělé plicní ventilace, její použití je často provázeno nutností používat vazopresory a zvyšuje morbiditu ventilovaných (hypotenze a pneumonie), pravděpodobně v důsledku imunospuresivního vlivu. Některá pracoviště dnes prosazují postupy úplně eliminující sedaci za cenu zvýšeného dohledu většího počtu zdravotníků u lůžka.
- Protokolizace: Objektivizace hloubky A/S (Rich-mond Agitation – Sedation Scale (RASS), Ramsay Scale, Bloosmbury Scale, ATICE, Behavorial Pain Scale). Protokolární schémata A/S sledují minimalizaci vedlejších účinků sedativ a rizik jejich kumulace; osvědčila se i účast klinického farmakologa na tvorbě protokolu A/S [19]. RASS je nejrozšířenější a nejprověřenější. Ve většině případů je optimální hloubka sedace RASS -2 a méně. Hlubší sedaci (RASS -3 nebo -4) vyžadují pacienti např. s těžkým ARDS.
- Koordinace probouzení a spontánního dýchání (awake and breathe coordination): Obnovení vigility a kooperace umožňuje v odvykací fázi provedení testu spontánního dýchání. Denně se má sedace přerušit a obnovit v poloviční rychlosti při neklidu pacienta. Není provázena negativními psychologickými důsledky, naopak působí příznivě na výskyt posttraumatické stresové nemoci. Kombinace s každodenně prováděným T testem vedla v Girardově studii ke zkrácení délky umělé plicní ventilace a 1roční mortality [20]. Denní přerušení sedace nezpůsobuje psychogenní trauma, naopak spíše redukuje výskyt posttraumatické stresové nemoci (PTSD). V průběžném titrování sedace je klíčová úloha sester a co nejčastější, tj. alespoň každou hodinu, upravovaná dávka A/S. V praxi ale nebývá jednoduché dosáhnout optimální cílové sedace [21].
- Kooperativní sedace: Cílem A/S je dosažení tělesné pohody (komfortu), absence bolestí, spolupráce s ošetřujícími (kooperace) a snadná probuditelnost. Je-li analgezie dostatečná, nebývá další sedace vždy nezbytná. Zklidnění se zachováním vigility umožňuje dobře titrovatelný propofol, dexmedetomidin, opatrně podávaná neuroleptika nebo nízké dávky opiodů. Spánkový vzorec se blíží fyziologickém spánku (nejvíce u dexmedetomidinu), ale nevyrovná se mu. Přímým důsledkem zlepšené bdělosti a pohody je pokles spotřeby vazopresorů a menší imunosuprese. Klinickým důsledkem je zkrácení délky umělé plicní ventilace a pokles jejích komplikací.
- A1 (analgesia first – přístup), (pain-first treatment). Prožitek bolesti je u pacientů ošetřovaných na JIP velmi častý. Opoidy mají přednost při léčbě procedurální bolesti a v pooperačním období [22]. Výhodné je jejich pre-emptivní použití. Pro zvládnutí neuropatické bolesti jsou vhodné gabapentin nebo karbamazepiny. Dostatečná a adekvátní analgezie je prioritou. Při sedaci morfinem se dříve využívaly i jeho vedlejší sedativní vlastnosti. Významná sedativní komponenta se uplatňuje i při podání syntetického sufentanilu, v nízkých dávkách bez depresivních vlivů na dechové centrum. Poslední studie dokumentují nákladovou efektivitu analgetizace remifentanilem (eventuálně s propofolem), která není provázena kumulací metabolitů a reziduálním sedativním účinkem ve srovnání s benzodiazepiny (které mají nežádoucí centrální myorelaxační vlastnosti). Alfa2 agonisté se kombinací analgetického a mírného sedativního účinku velmi dobře hodí pro tyto situace
- ABCDE strategie kombinuje všechny výše zmíněné postupy [23]:
- Awake and Breathe coordination
- Choice of sedative/analgesics [individualizace A/S: A1 (remifentanil, remifentanil+propofol), alfa2 agonisté (dexmxedetomidin)], haloperidol
- Daily Delirium Monitoring: aktivně pátrat po projevech deliria (Confusion Asessment Method for ICU (CAM-ICU)
- Early Monitoring Excercise jako prevence syndromu získané svalové slabosti (ICU acquired muscle weakness)
- Hluboká sedace, vyžadující často kombinaci farmakologických postupů, zůstává indikována v situaci, kdy je žádoucí neuroptotekce a synchronizace s ventilátorem u agresivních ventilačních režimů (benzodiazepiny, propofol, opiáty) a NMBA.
- Krátkodobé použití NMBA při současné sedaci, zejména v iniciální fázi těžkých forem ARDS s excesivním inspiračním drivem, může mít protektivní vliv před vznikem ventilator-induced lung injury (VILI) [24].
- Alternativní nefarmakologické postupy šetří použití farmak (slovní a taktilní kontakt mezi pacientem a ošetřujícími, zajištění prostředí pro klidný spánek s eliminací hluku, falešných alarmů). Včasná mobilizace a přítomnost rodiny je součástí této strategie.
- Panuje všeobecná a stoupající averze k použití omezovacích prostředků, které jsou v v liberální společnosti vnímány velmi negativně [25].
- Protokol „bez sedace“ používající jen jako rescue medikaci haloperidol (zvýšený osobní dohled u lůžka vedl ve srovnání se sedací propofolem a midazolamem ke zkrácení délky umělé plicní ventilace), ale rovněž k nárůstu výskytu deliria. Aplikovatelnost podobných postupů je třeba prověřit v dalších multicentrických studiích [26].
7. DLOUHOBÉ DŮSLEDKY A/S
- PRIS (několikadenní podání propofolu): blokáda mitochondriálních systémů (metabolická acidóza, akutní renální insuficience, rhabdomyolýza, myoglobinurie, hyperpyrexie, hyperlaktatémie)
- Adrenální insuficence: důsledek podání etomidátu (v poslední době nebyl při jednorázovém podání tento vliv potvrzen) [27]
- Riziko posttraumatické stresové reakce (PTSD): kombinace anamnestických psychogenních faktorů, vliv sedativ a fyzických omezovacích prostředků na výskyt halucinací: benefit denního přerušení sedace )
- Delirium: jeho výskyt na JIP je častý, je provázen zvýšenou morbiditou (negativní vliv na orgánové funkce, kvalitu života a mortalitu). Vedle farmakologických prostředků jsou předmětem výzkumu omezujících jeho výskyt i nefarmakologické prostředky, mj. časná mobilizace. K objektivizaci jeho výskytu existují skórovací schémata (CAM-ICU a ICDS) [28, 29].
- Použití alfa2 agonistů je ve srovnání s benzodiazepiny provázeno nižším výskytem deliria.
- Srovnávací studie dexmedetomidin
MENDS: Dexmedetomidin vs. lorazepam [30]
SEDCOM: Dexmedetomidin vs. midazolam [31]
MIDEX/PRODEX:
Dexmedetomidin vs. midazolam/propofol: Dexmedetomidin zkracuje dobu umělé plicní ventilace (vs. midazolam), zkracuje dobu intubace (vs. midazolam), zlepšuje komunikaci s pacientem (vs. propofol i midazolam), ale jsou častější vedlejší oběhové účinky (hypotenze, bradykardie) [32]. - Okultní difuzní poškození mozku se signifikatním zhoršením kognitivních funkcí s delším odstupem po dimisi (zhoršení globální a regionální mozkové perfuze a oxidační stres)
- Strategie omezující výskyt kognitivní dysfunkce v souvislosti s kritickým onemocněním zahrnují: haloperidol, gabapentin, donezepil (acetylcholin), dexmedetomidin, rHuEPO, xenon (NMDA), NXY-059 (cyklosporin), hypotermie [33].
- Sedativní medikace ovlivňuje imunokompetenci (vrozená je podporovaná alfa2 agonisty, získaná je kompromitována opioidy) [34].
ZÁVĚR
Současný pohled na problematiku analgosedace u kriticky nemocných preferuje takové formy A/S, jejichž výsledkem je spokojený, klidný a spolupracující pacient, s dostatečnou adekvátní analgezií, jenž je schopný časné fyzioterapie a včasné mobilizace z lůžka. Použití hluboké sedace (eventuálně svalové relaxace) je dnes po překonání nejakutnější fáze onemocnění spíše na ústupu. Kromě eliminace bolesti a stresu (optimálně najednou) sleduje A/S i sekundární cíle, jako jsou snížení dechové práce, eliminace asynchronie s ventilátorem nebo snížení ICP.
- Prioritní je dosažení adekvátní míry analgezie (objektivní schémata a protokoly sledující její efektivitu, popř. tzv. self reporting) se používají nedostatečně.
- K dosažení tzv. kooperativní sedace je dexmedetomidin vhodnější než midazolam (nebo jiné benzodiazepiny) jednak pro duální efekt (sedace a analgezie), a jednak pro nižší výskyt delirií.
- Benzodiazepiny by měly být rezervovány pro hlubší sedaci, při požadavku na amnézii a v situacích, kdy oběhová nestabilita vylučuje použití propofolu nebo alfa2 agonistů; vhodnější je jejich bolusová aplikace.
- Pro kontinuální sedaci jsou vhodné propofol, opioidy, alfa2 agonisté.
- Odlišení potřeby analgezie, anixolýzy (s indikací sedace) a antipsychotik u delirantních stavů u pacientů na umělé plicní ventilací bývá v praxi obtížné.
- Za všech okolností je třeba usilovat o redukci jednotlivých komponent A/S, především její sedativní složky s vědomím, že dosavadní důkazy svědčí o vlivu redukce sedativní medikace na zkrácení doby léčby na JIP a rychlejším překonání kritického onemocnění [35].
V následující sérii edukačních článků věnovaných sedaci bude podán přehled problematiky analgosedace v kontextu současných doporučení publikovaných v odborném tisku:
- Protokoly pro sledování hloubky sedace, monitorování analgezie a deliria.
- Přehled farmak používaných k analgosedaci
- Dlouhodobé nežádoucí účinky sedace (delirium, kognitivní dysfunkce).
- Základní principy moderní analgosedace podle aktuálních doporučení.
Konflikt zájmů: Autor článku přednesl honorovanou přednášku Hledání optimálního protokolu sedace na sympoziu Orion Pharma v rámci 15. postgraduálního kurzu sepse a MODS, Ostrava 5.–8. února 2013, a získal grant Orion Pharma k účasti na ISICEM v březnu 2013. Publikace akutálního článku vznikla podporou společnosti Orion Pharma.
Adresa pro korespondenci:
Prim. MUDr. Ivan Herold
ARO, Klaudiánova nemocnice
V. Klementa 147/23
293 01 Mladá Boleslav
e-mail: ivan.herold@onmb.cz
Zdroje
1. Dellinger, R., Levy, M., Rhodes, A., Annane, D. et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012. Crit. Care Med., 2013, 41, 2, p. 580–637.
2. Christensen, M. Noise levels in a general intensive care unit: a descriptive study. Nurs. Crit. Care, 2007, 12, 4, p. 188–197.
3. Ramsay, M. A., Savege, T. M., Simpson, B. R., Goodwin, R. Controlled sedation with alphaxalone-alphadolone. Br. Med. J., 1974, 22, 2, 5920, p. 656–659.
4. Park, G. Remifentanil in the ICU: a new approach to patient care. Current Anaesthesia & Critical Care, 2002, 13, p. 313–320.
5. Fudickar, A., Bein, B. Propofol infusion syndrome: update of clinical manifestation and pathophysiology. Minerva Anestesiol., 2009, 75, 5, p. 339–344.
6. Crankshaw, D. P., Chan, C., Leslie, K., Bjorksten, A. R. Remifentanil concentration during target-controlled infusion of propofol. Anaesth. Intensive Care, 2002, 30, 5, p. 578–583.
7. Geller, E., Halpern, P., Barzelai, E., Sorkine, P., Lewis, M. C., Silbiger, A., Nevo, Y. Midazolam infusion and the benzodiazepine antagonist flumazenil for sedation of intensive care patients. Resuscitation, 1988, 16, Suppl: S31–S39.
8. Kress, J. et al. Daily interruption of sedative infusions in critically ill patients undergoing mechanical ventilation. N. Eng. J. Med., 2000, 18, 342, 20, p. 141–147.
9. Augustus, R., Ho, K. Meta-analysis of randomised controlled trialson daily sedation interrruption for critically ill adult patiens. Anaesth. Intensive Care, 2011, 39, 3, p. 401–409
10. Brook, A. D., Ahrens, T., Schaiff, R., Sherman, G., Shannpn, W., Kollef, M. Effects of a nursing implemented sedation protocol on the duration of mechanical ventilation. Crit. Care Med., 1999, 27, 12, p. 2609–2615.
11. Mehta, S., Burry, L., Cook, D., Fergusson, D. et al. Daily Sedation Interruption in Mechanically Ventilated Critically Ill Patients Cared for With a Sedation Protocol. A randomized controlled trial. JAMA, 2012, 308, 19, p. 1985–1992.
12. Jacobi, J., Fraser, L., Coursin, D., Riker, R. et al. Clinical practice guideliens for the sustained use of sedatives and anaglesics in the critically ill patiens. Critic. Care Med., 2002, 30, 1, p. 119–140.
13. Barr, J., Fraser, G., Puntillo, K., Ely, E. Clinical paractice guidelines for the management of pain, agitation, and delirium in adult patients in the intensive care unit. Crit. Care Med., 2013, 41, 1, p. 263–306.
14. Dexdor. Product Monograph. Orion Pharma 2012.
15. Jun, O., Katsunori Yamamoto, Shigefumi Koike, Mutsuo Onodera, Hideaki Imanaka, Masaji Nishimura Sleep quality of mechanically ventilated patients sedated with dexmedetomidine. Intensive Care Med., 2012, 38, p. 1982–1989.
16. Milbrandt, E. B., Kersten, A., Kong, L., Weissfeld, L. A., Clermont, G., Fink, M. P., Angus, D. Haloperidol use is associated with lower hospital mortality in mechanically ventilated patients. Crit. Care Med., 2005, 33, 1, p. 226–229.
17. Courlans, H. Breraking Neew: FDA issues new warning for Haldol: NYU Langone On Line Journal of Medicine. 2007, Sept 21.
18. Skrobik, Y. K., Bergeron, N., Dumont, M., Gottfried, S. Olanzapine vs haloperidol: treating delirium in a critical care setting. Intensive Care Med., 2004, 30, 3, p. 444–449.
19. Marshall, J., Finn, C., Theodore, A. Impact of a clinical pharmacist-enforced intensive care unit sedation protocol on duration of mechanical ventilation and hospital stay. Critical Care Medicine, 2008, 36, 2, p. 427–433.
20. Girard, T., Kress, J., Fuchs, B. et al. Efficacy and safety of a paired sedation and ventilator weaning protocol for mechanically ventilated patients in intensive care (Awakening and Breathing Controlled trial): a randomised controlled trial. Lancet, 2008, 371, p. 126–134.
21. O’Connor, M., Bucknall, T., Manias, E. Sedation management in Australian and New Zealand intensive care units: doctors’ and nurses’ practices and opinions. Am. J. Crit. Care, 2010, 19, 3, p. 285–295.
22. Muellejans, J., Matthey, T., Scholpp, J., Schill, M. Sedation in the intensive care unit with remifentanil/propofol versus midazolam/fentanyl: a randomised, open-label, pharmacoeconomic trial. Critical. Care, 2006, 10:R91.
23. Morandi, A., Brummel, N., Wesley, E. Sedation, delirium and mechanical ventilation: the ‘ABCDE’ approach. Current. Opinion in Critical. Care, 2011, 17, 1, p. 43–49.
24. Papazian, L., Forel, J., Gacouin, A., Penot-Ragon, C. et al. Neuromuscular blockers in early acute respiratory distress syndrome. N. Engl. J. Med., 2010, 363, 12, p. 1107–1116.
25. De Jonghe, B., Constantin, J. M., Chanques, G., Capdevila, X.,Lefrant, J. Y., Outin, H., Mantz, J. Physical restraint in mechanically ventilated ICU patients: a survey of French practice. Intensive Care Med., 2013, 39, 1, p. 31–37.
26. Strøm, T., Martinussen, T., Toft, P. A protocol of no sedation for critically ill patients receiving mechanical ventilation: a randomised trial. The Lancet, 2010, 375, 9713, p. 475–480.
27. McPhee, L., Badawi, O., Fraser, G. Single-dose etomidate is not associated with increased mortality in ICU patients with wepsis: Analysis of a large electronic ICU databáze. Critical Care Medicine, 2013, 41, 3, p. 774–783.
28. Ely, E. W., Inouye, S. K., Bernard, G. R., Gordon, S. et al. Delirium in mechanically ventilated patients: validity and reliability of the confusion assessment method for the intensive care unit (CAM-ICU). JAMA, 2001, 286, 21, p. 2703–2710.
29. Bergeron, N., Dubois, M. J., Dumont, M., Dial, S., Skrobik, Y. Intensive Care Delirium Screening Checklist: evaluation of a new screening tool. Intensive Care Med., 2001, 27, 5, p. 859–864.
30. Pandharipande, P., Pun, B., Herr, D., Maze, M. et al. Effect of sedation with dexmedetomidine vs lorazepam on acute brain dysfunction in mechanically ventilated patients: the MENDS randomized controlled trial. JAMA, 2007, Dec 12, 298, 22, p. 2644–2653.
31. Riker, R. R., Shehabi, Y., Bokesch, P. M., Ceraso, D. et al. Dexmedetomidine vs midazolam for sedation of critically ill patients: a randomized trial. JAMA, 2009, Feb 4, 301, 5, p. 489–499.
32. Jakob, S. M., Ruokonen, E., Grounds, R. M., Sarapohja, T. et al. Dexmedetomidine vs midazolam or propofol for sedation during prolonged mechanical ventilation: two randomized controlled trials. JAMA, 2012, Mar 21, 307, 11, p. 1151–1160.
33. Milbrandt, E., Angus, D. Bench-to-bedside review: Critical illness-associated cognitive dysfunction – mechanisms, markers, and emerging therapeutics. Critical Care, 2006, 10, p. 238.
34. Pandharipande, P., Girard, T., Sanders, R., Thompson, J., Maze, M., Ely, E. W. Comparison of sedation with dexmedetomidine versus lorazepam in septic ICU patiens. Critical Care, 2008, 12, Suppl 2, P275.
35. Patel, S., Kress, J. Sedation and Analgesia in the Mechanically Ventilated Patient. American Journal of Respiratory and Critical Care Medicine, 2012, 185, 5, p. 486–497.
Štítky
Anestéziológia a resuscitácia Intenzívna medicína
Článok vyšiel v časopiseAnesteziologie a intenzivní medicína
Najčítanejšie tento týždeň
2013 Číslo 4- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Metamizol v liečbe pooperačnej bolesti u opioid-tolerantnej pacientky – kazuistika
- e-Konzilium.cz — Masivní plicní embolie při tromboembolické nemoci
- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
-
Všetky články tohto čísla
- Historia magistra vitae…
- Quo vadis sepse?
- Anesteziologické aspekty ireverzibilní elektroporace karcinomu prostaty: antagonizace nervosvalové blokády sugammadexem vs. neostigminem – retrospektivní studie
- Desfluran umožňuje snadné provedení wake-up testu při operaci skoliózy u dětí – kazuistika
- EPOSS & SEPSIS-Q: návrh a popis řešení projektů pro sledování léčby, morbidity a mortality pacientůs těžkou sepsí v České republice
- Imunitní homeostáza (deregulace?) v sepsi a septickém šoku
- Ultrazvuk v zobrazení a kanylaci centrálního žilního systému
- Sarkoidóza plic
- Perioperační transfuzní léčba, management krvácivých stavů a velké krevní ztráty
- Co to je Anrepův efekt aneb Jak se srdeční sval vyrovnává s náhlým vzestupem afterloadu?
- Současná koncepce analgosedace v intenzivní péči
- Doporučený postup při výskytu maligní hypertermie
- Doporučený postup pro léčbu anafylaktické nebo anafylaktoidní reakce v průběhu anesteziologické péče
- Vývoj anesteziologie a resuscitace v kladenské nemocnici a vzpomínky primáře MUDr. Vladimíra Lemona
- Portréty Hugo Keszlera a Zdeňka Kalendy, průkopníků oboru
- Anesteziologie a intenzivní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Sarkoidóza plic
- Současná koncepce analgosedace v intenzivní péči
- Ultrazvuk v zobrazení a kanylaci centrálního žilního systému
- Perioperační transfuzní léčba, management krvácivých stavů a velké krevní ztráty
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



