-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Imunitní homeostáza (deregulace?) v sepsi a septickém šoku
Immune homeostasis (deregulation) in sepsis and septic shock
Sepsis and septic shock represent an important medical and socio-economic burden worldwide. The double-phased concept of significant immune homeostasis impairment in sepsis has generally been accepted. In this theory, the initial phase is characterized by enormous activation of immune system followed by the compen-satory phase resulting in profound immunosuppression. However, this paradigm has recently been challenged and the concept of simultaneous pro-inflammatory, anti-inflammatory and adaptive immunity suppressing response occurring early in sepsis has been introduced. These immune alterations leading to the failure to combat relatively avirulent, nosocomial and opportune pathogens, and prolonged multiorgan dysfunction seem to be a major cause of increased morbidity and mortality in critically ill patients. This review briefly summarizes the current concept of sepsis-induced immune deregulation and discusses diagnostic tools and emerging immune-based therapeutic interventions.
Keywords:
sepsis – immune response – immune deregulation – flow cytometry
Autoři: Karvunidis Thomas 1; Lysák Daniel 2; Chvojka Jiří 1; Ledvinová Lenka 1; Raděj Jaroslav 1; Novák Ivan 1; Matějovič Martin 1
Působiště autorů: JIP, I. interní klinika FN v Plzni a LF v Plzni, Univerzita Karlova v Praze 1; Hematologicko-onkologické oddělení, Fakultní nemocnice v Plzni 2
Vyšlo v časopise: Anest. intenziv. Med., 24, 2013, č. 4, s. 250-263
Kategorie: Intenzivní medicína - Původní práce
Souhrn
Sepse a septický šok představují celosvětově významný medicínský i socioekonomický problém. V současnosti je obecně přijímán dvoufázový koncept významného porušení imunitní homeostázy v sepsi s enormní aktivací imunitních mechanismů v jejím úvodu s následnou kompenzatorní reakcí, při níž je kompromitována většina funkcí na nejrůznějších úrovních vrozené i získané imunity. Aktuální poznatky však ukazují na simultánní aktivaci prozánětlivých a protizánětlivých pochodů již v samotném úvodu systémového zánětu. Tato sekundární alterace obranných mechanismů, vedoucí ke snížené rezistenci k primárně málo virulentním nozokomiálním a oportunním patogenům a ke „chronické“ multiorgánové dysfunkci, může být příčinou zvýšené morbiditya mortality kriticky nemocných. Tento přehledový článek se stručnou formou zabývá právě dysregulací imunitní odpovědi nemocných v sepsi/septickém šoku, jejími konsekvencemi, diagnostickými možnostmi a možnými terapeutickými intervencemi.
Klíčová slova:
sepse – imunitní odpověď – imunitní deregulace – průtoková cytometrieÚVODNÍ KAZUISTIKA
53letý hypertonik, diabetik na perorálních antidiabetikách, po ischemické cévní mozkové příhodě, s permanentní fibrilací síní a chronickou antikoagulační léčbou antagonisty vitaminu K, pracující jako ošetřovatel prasat byl přijat na jednotku intenzivní péče fakultní nemocnice pro přibližně čtyřhodinovou anamnézu zimnic, třesavek, ortostatické hypotenze a dušnosti. Již první vstupní klinické, grafické a laboratorní vyšetření svědčí pro plně rozvinutý hyperdynamický septický šok s akutním anurickým poškozením ledvin, akutní hepatopatií, koagulopatií, postupným rozvojem a progresí poruchy vědomí, výraznou laktátovou metabolickou acidózou. Během nezbytného úvodního zajištění nemocného bylo vyloučeno invazivní meningokokové onemocnění, perforace trávicí trubice a/nebo ischémie nitrobřišních orgánů. Infekčním agens byl Streptococcus suis (významný patogen vepřů – zoonóza), který byl detekován v hemokulturách odebraných bezprostředně při přijetí na JIP. Zdrojem a vstupní branou infekce bylo (per exclusionem) nejspíše trauma měkkých tkání nártu levé dolní končetiny způsobené kopnutím prasete s následnou bakteriémií. Komplexní resuscitace a léčba septického šoku s adekvátní antibiotickou (ATB) terapií vedla k rezoluci infekce a šoku v následujících pěti dnech. V dalším průběhu perzistovala renální dysfunkce, koagulopatie, mírná encefalopatie, polyneuromuskulopatie kriticky nemocných a potřeba umělé plicní ventilace.
Osmý den hospitalizace se náhle objevují febrilie, oběhová nestabilita, objevuje se výrazná produkce makroskopicky zánětlivého sputa. Byla provedena empirická změna ATB. Stav nemocného v dalších dvou dnech progredoval do recidivy septického šoku, opět s plně vyjádřeným multiorgánovým selháním. Kultivačně byl z bronchoalvelolární laváže izolován nozokomiální multirezistentní kmen Acinetobacter baumanii a současně byla prokázána endogenní reaktivace cytomegaloviru (CMV) se signifikantní virémií (RQ-PCR). Objevuje se významné krvácení do GIT při koagulopatii a trombocytopenii. I přes další, již cílenou změnu ATB strategie, virostatickou léčbu a extenzivní podpůrnou léčbu včetně náhrad funkcí orgánů stav nemocného dále progredoval. Pacient zemřel pod obrazem refrakterního hypodynamického septického šoku dvanáctý den hospitalizace.
ÚVOD DO PROBLEMATIKY
Sepse a septický šok jsou desátou nejčastější příčinou smrti všeobecně a nejčastější příčinou smrti na nekoronárních jednotkách intenzivní péče. Incidence sepse je 50–95 případů na 100 000 obyvatel a zvyšuje se cca o 10 % ročně [1, 2]. I přes značné pokroky v diagnostice a léčbě, dodržování všeobecně akceptovaných terapeutických algoritmů a doporučení a téměř dvacetiletý výzkum na poli sepse a protizánětlivých působků je mortalita těchto stavů víceméně stacionární (30–50%) a koreluje s počtem dysfunkčních orgánů/systémůa s délkou trvání těchto stavů [1, 2]. Absence efektu těchto opatření na zmírnění devastujícího průběhu systémového zánětu s multiorgánovým postižením vede k zamyšlení nad správností hypotéz týkajících se patofyziologie těchto stavů, zejména na subcelulární úrovni. Vzhledem k mimořádné heterogenitě, charakteristické pro populaci septických nemocných, může snaha o uniformní léčbu těchto nemocných jako jednolité skupiny vysvětlit tyto terapeutické neúspěchy. Ilustrativním příkladem je selhání drtivé většiny protizánětlivých agens a strategií [3, 4], jejichž užití bylo založeno na předpokladu „pouhé“ přehnané imunitníreakce organismu v odpovědi na invazivní infekci. Zjevně nelze očekávat terapeutický úspěch při snaze o izolované ovlivnění jediného mediátoru a/nebo funkce v celé řadě deregulovaných a dysfunkčních patofyziologických dějů a mechanismů. V současné době lze tedy spíše uvažovat o „imunitní deregulaci“ jako o velmi heterogenním stavu, který vede k progresi a udržování systémového zánětu, orgánovému poškození (multiple organ dysfunction syndrome, MODS), nozokomiálním infekcím a v řadě případů až k úmrtí nemocných.
Tento přehledový článek předkládá aktuální a velmi diskutovaný pohled na imunopatogenezi sepse. Zabývá se zejména jejím vývojem v čase a změnami ve smyslu imunitní deregulace v průběhu systémového zánětu. Stručně jsou diskutovány metody vhodné k detekci imunoalterace a analýzám imunologického profilu nemocných. Okrajově zmiňujeme rovněž možné nové perspektivy v imunomodulační léčbě sepse/septického šoku.
IMUNOLOGICKÉ ASPEKTY SEPSE: STARONOVÉ KONCEPTY A NOVÉ POZNATKY
K zachování integrity a homeostázy lidského organismu je nezbytné zabránit invazi patogenů do jeho tkání a orgánů a následnému rozšíření do celého organismu. Základním prostředkem bránícím průniku mikrobů jsou neporušené fyziologické epiteliální bariéry. Při jejich narušení slouží složky vrozeného imunitního systému (tab. 1.) jako druhá linie obrany [5]. Tato vrozená imunitní odpověď je společná všem vícebuněčným organismům. Je víceméně bezprostřední, nespecifická a je primárně určena k rychlé eradikaci patogenů a prevenci poškození tkání. Aktivace imunitní odpovědi se děje cestou tzv. motivy rozpoznávajících receptorů (pattern-recognition receptors, PRRs) – tabulka 2. Vzhledem ke komplexnosti a relativní dlouhověkosti savců včetně člověka je však potřeba další obranné linie organismu s imunologickou pamětí, mimořádnou specificitou a účinností a vývoj získané (adaptivní) imunity byl tedy logickým evolučním krokem umožňujícím přežití a vývoj vyšších živočišných forem. Její plné aktivace a funkce je dosaženo až po několika desítkách hodin až dnů. Systém získané imunity zahrnuje komponenty buněčné imunitní odpovědi (T-lymfocyty), primárně určené k reakci na intracelulární patogeny, a součásti humorální (protilátkové) imunitní odpovědi (B-lymfocyty a imunoglobuliny), primárně cílené na extracelulární mikroorganismy a toxiny. K interakcím T-lymfocytů s ostatními složkami imunitního systému a patogeny slouží tzv. T-buněčný receptor (T-cell receptor, TCR) exprimovaný na jejich povrchu. B-lymfocyty k těmto účelům užívají monoklonální imunoglobuliny vázané v buněčné membráně (B-cell receptor, BCR) – viz tab. 1. Povrchové struktury všech patogenů obsahují limitovaný počet unikátních a u vyšších živočichů se nevyskytujících molekul – tzv. patogen-associated molecular patterns (PAMPs) (viz tab. 2). Tyto struktury jsou rozpoznávány specifickými receptory buněčných elementů vrozené imunity (antigen-prezentující buňky, antigen-presenting cells, APC) a jinými buňkami (některé populace lymfocytů, endoteliální a epiteliální buňky) pomocí již zmíněných tzv. motivy-rozpoznávajících receptorů (pattern recognition receptors, PRR) [6, 7, 8, 9]. V současné době je popsáno celkem pět základních skupin PRR. Jejich stručný přehled s odpovídajícími ligandy (vazebnými protějšky) jsou zmíněny v tabulce 2 [6,7,9,10]. Obdobnými „alarminy“ aktivujícími imunitní systém jsou skupiny „endogenních“ specifických molekul uvolňovaných při tkáňovém poškození – tzv. damage-associated molecular patterns (DAMP) – viz tabulka 2. Uvolnění významného množství DAMP do cirkulace vede k zánětlivé odpovědi klinicky neodlišitelné od reakce na infekční agens [6]. DAMP jsou zřejmě také schopny udržovat systémovou zánětlivou odpověď a tedy i MODS i v době, kdy již došlo k úplné eliminaci primárního infekčního agens [11].
Tab. 1. Přehled vybraných základních elementů imunitní odpovědi, jejich základní charakteristika funkce v sepsi 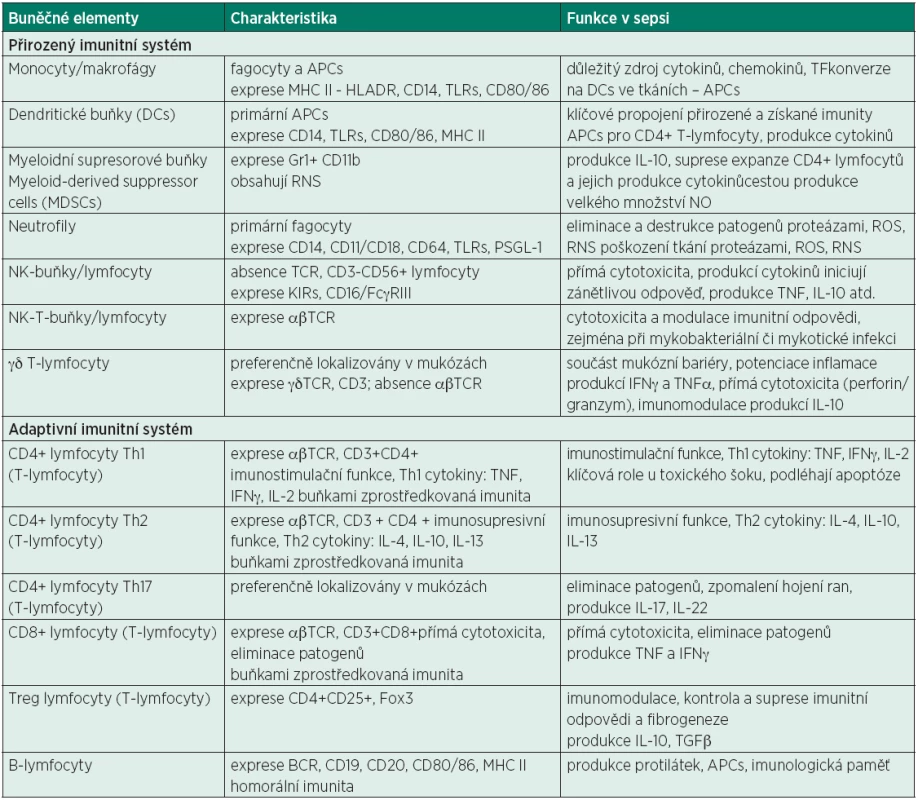
APCs – antigen presenting cells, MHC – major histocompatibility antigen, TF – tkáňový faktor, TCR – T-cell receptor, BCR – B-cell receptor, NK – natural killer cell, IL – interleukin, IFN – interferon, TNF – tumor necrosis factor, TGF – tissue growth factor, KIR – killer immunoglobulin receptor, RNS – reactive nitrogen species, ROS – reactive oxygen species, TLR – toll-like receptors, CD – cluster of differentiation/designation Tab. 2. PAMP, DAMP a jejich PRR 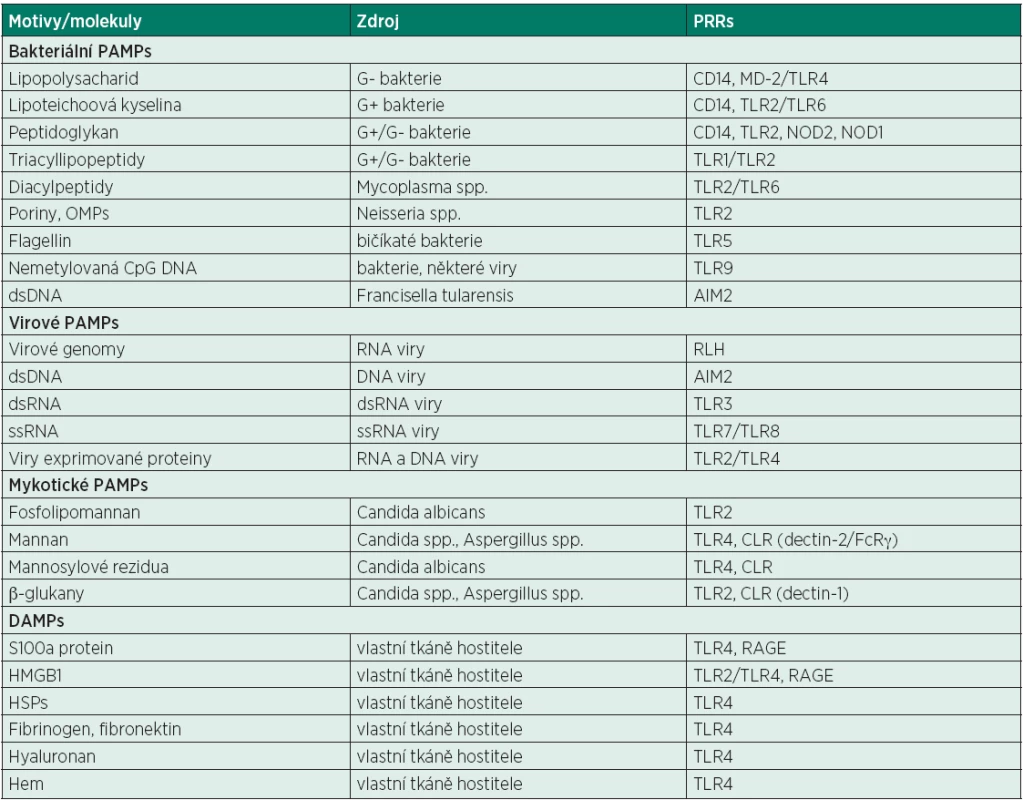
PRRs – pattern regognition receptors, PAMPs – pathogen-associated molecular patterns, DAMPs – danger-associated molecular patterns, OMPs – outer membrane protein, CpG – cytosine-phosphate-guanine, HMGB1 – high mobility group box 1, HSP – heat shock proteins, TLR – toll-like receptor, NOD – nucleotide-bindingoligomerization domain leucine-rich-repeat containing receptors, CLR – C-type lecitin receptor, RAGE – receptor for advanced glycation end products, RLH – retinoic acid-indicible gene-1-helicase, AIM2 – absent in melanoma protein Mechanismy vedoucí k úmrtí nemocných v septickém šoku se v průběhu vlastního onemocnění liší. Od refrakterního cirkulačního šoku v důsledku extenzivní aktivace imunitního systému s masivním uvolněním prozánětlivých mediátorů v úvodní časné fázi – systémová zánětlivá odpověď (Systemic Inflammatory Response Syndrome, SIRS), až po MODS, „syndrom přetrvávajícího zánětu, imunosuprese a katabolismu“ (Persistent Inflammation Immunosuppression and Catabolism Syndrome, PICS) a komplikující nozokomiální či oportunní/endogenní infekce při zapojení kompenzatorních imunitních mechanismů (negativní feedback), které mohou (i přes primárně protektivní efekt) paradoxně směřovat až k imunoparalýze/imunokompromitaci (compensatory anti-inflammatory response syndrome, CARS), ve fázi pozdní [12]. Z klinické praxe však víme, že většina nepřeživších (> 80 %) umírá až mnohem později po iniciální resuscitaci a léčbě primárního septického šoku s charakteristickými znaky imunosuprese (jak ilustruje i kazuistika v úvodu), zatímco skupina přeživších je zřejmě tvořena jedinci, kteří byli schopni spontánně upravit a balancovat imunitní funkce bez specifické imunomodulační léčby [13, 14].
Iniciální imunitní odpověď organismu na mikrobiální infekci, ale i na sterilní stimuly (trauma, popáleniny, hemoragický šok) je fenotypicky vysoce stereotypní a uniformní a v rámci zmíněných stavů navzájem v podstatě klinicky neodlišitelná. Studie genových expresí a transkripčních profilů cirkulujících leukocytů nemocných s tupými traumaty, popáleninami a infekcí (respektive zdravých dobrovolníků po aplikaci malé dávky endotoxinu – lipopolysacharidu, LPS – PAMP) dokládají globální změny v intracelulárních funkcích a signalizacích zaujímajících > 80 % genů [9, 14, 15]. Detekce těchto změn genových expresí umožňuje časné odlišení sepse od neinfekčního SIRS [14, 16, 17, 18]. Tato možnost včasného rozpoznání infekční etiologie není samoúčelná, jelikož smrtnost sepse je v porovnání s neinfekčním systémovým zánětem téměř dvojnásobná [19]. Dosavadní paradigma dvoufázového průběhu zánětlivé odpovědi organismu striktně časově oddělující iniciální prozánětlivou fázi (SIRS) a následující kompenzační protizánětlivou fázi (CARS) [20] lze na základě těchto poznatků chápat odlišně [14]. Uvedené práce ukazují, že alterace prozánětlivých a protizánětlivých genů je simultánní již v samotném úvodu onemocnění a že rozdíly v expresích genů mezi přeživšími a nepřeživšími nemocnými jsou kvantitativní, nikoliv kvalitativní. Právě míra a délka změny exprese příslušných genů, odpovídající imunitní deregulaci, zřejmě sehrává roli při morbiditě a mortalitě v akutní fázi systémového zánětu, ale i v rozvoji sekundárních komplikací, jakými jsou nozokomiální infekce či protrahované orgánové postižení [14, 21] – obrázek 1. Uvedené ukazuje, že nejen vlastní spontánní úprava, jak je zmíněno výše, ale také včasnost a rychlost normalizace adaptivní genové exprese v odpovědi na zánětlivé stimuly („genomic storm“) a tedy funkce imunitního systému jsou důležité pro nekomplikovaný průběh sepse.
Obr. 1. Imunitní homeostáza v sepsi – klasické vs. inovativní pojetí 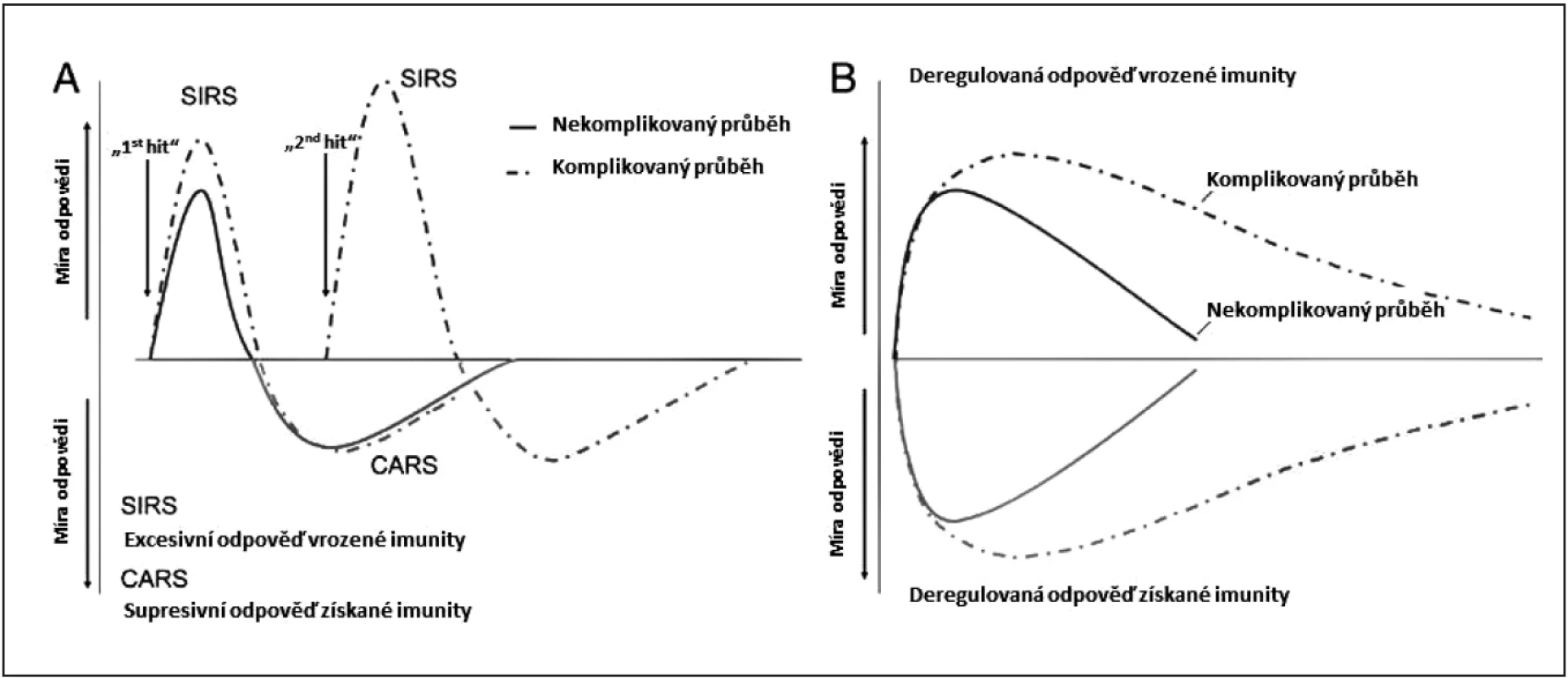
A – klasický dvoufázový koncept imunitní odpovědi; B – nové pojetí imunitní reakce a deregulace v sepsi. SIRS – syndrom systémové zánětlivé odpovědi; CARS – syndrom kompenzační protizánětlivé odpovědi (podle Xiao, W. J. Exp. Med., 2011 [14]) MOŽNOSTI ANALÝZY STAVU A FUNKCE IMUNITNÍHO SYSTÉMU A JEHO ODPOVĚDI
Imunologická odpověď v sepsi je komplexním a velmi dynamickým procesem zahrnujícím celou řadu vzájemně interagujících buněčných elementů s extrémně komplikovanou sítí cytokinů. Právě složitost systému a rychlé změny v čase znesnadňují samotná vyšetření jednotlivých komponent a zejména interpretaci výsledků. I přesto by žádná z dalších studií zabývající se prohlubováním znalostí a poznatků patofyziologie sepse neměla proběhnout bez alespoň bazální znalosti imunologického stavu a dynamiky změn jeho jednotlivých subjektů.
Molekulární genetika, proteomika, transkriptomika
Ucelený obraz změn při systémovém zánětu může podat posouzení exprese jednotlivých genů v cirkulujících leukocytech analýzou mRNA pomocí čipových metodik (gene-chip analysis, micro-arrays, transkriptomika) [14, 22, 23]. Další úrovní exprese genů je jejich translace do proteinů. Vzhledem k tomu, že v tomto procesu dochází k množství změn podstatných pro konečnou funkci proteinů – potranslačních modifikací, může stanovení skutečně produkovaných bílkovin a jejich funkce poskytnout přesnější obraz změn v odpovědi na systémovou infekci. Strukturální i funkční analýzou proteinů v konkrétním kompartmentu (plazma, leukocyty atd.) se zabývá proteomika [22, 24]. Přes velký potenciál a robustnost uvedených metod, jsou tyto vyhrazeny pouze experimentálním či univerzitním pracovištím a také interpretace a klinické použití velkého objemu dat, které produkují, jsou problematické a široce diskutované.
Analýza cirkulujících mediátorů imunitní odpovědi
Mnohem dostupnější jsou v dnešní době metody ke stanovení jednotlivých cytokinů či jiných molekul účastnících se procesu zánětu (např. tumor-necrosis factor, interleukiny, interferony, proliferační faktory atd.). Jejich hladiny lze stanovit jednotlivě/izolovaně, např. cestou ELISA metod (enzyme-linked immunosorbent assay) či chemiluminiscence, nebo pomocí multiplexových analýz jako např. luminex, tzv. protein arrays či metodou CBA (cytometric bead array – detekce solubilních mediátorů vazbou na částice s následnou analýzou průtokovou cytometrií). Velmi často jsou uvedená vyšetření prováděna formou komerčně dodávaných kitů. Zde však stejně jako v celé problematice imunitní odpovědi organismu v sepsi platí, že jedna izolovaná hodnota koncentrace konkrétního cytokinu není ani pro pochopení patofyziologie procesu, ani pro diagnostické či terapeutické rozvahy užitečná.
Analýza buněčných elementů imunitního systému
Všechny buněčné elementy jsou a mohou být charakterizovány, stejně jako jejich změny v čase, analýzou exprimovaných membránových či intracelulárních antigenů/molekul. S ohledem na logistiku vyšetření, flexibilitu, časovou náročnost a reprodukovatelnost je k tomuto účelu jednoznačně nejvhodnější metodou průtoková cytometrie (flow cytometry, FCM). Tato analytická modalita je pro rutinní klinickou praxi intenzivisty často velkou neznámou. Má však velký potenciál v časné diagnostice infekce a posouzení imunitního stavu, proto se o ní krátce zmíníme.
Obecně je FCM nedílnou součástí diagnostiky a vyšetřování pacientů v hematologii, onkologii i imunologii. Technologie FCM umožňuje velmi snadno kvantifikovat jednotlivé základní (nejen) buněčné elementy analyzovaného vzorku (cell counting, cell sorting) na základě jejich velikosti (forward scatter) a komplexnosti povrchové a vnitřní struktury (side scatter) – obrázky 2, 3, 4 a 5. Nejrůznější antigeny sledovaných buněk (receptory, adhezivní molekuly, strukturální proteiny atd.) mohou být zpravidla označeny monoklonálními protilátkami konjugovanými s různými fluorochromy, které jsou excitovány laserem a jejichž emisní signály jsou snímány a následně digitálně zpracovány. Jedná se o rychlou a přesnou metodu umožňující současné měření několika parametrů až na 10 000 buňkách za sekundu. Umožňuje identifikaci různých buněčných typů uvnitř smíšené populace i analýzu jednotlivých subpopulací v rámci jedné definované buněčné populace. Na druhou stranu je nezbytné uvést i některé důvody a nevýhody FCM, které dosud bránily širšímu a rutinnímu užití FCM (nejen) v intenzivní péči. FCM je otevřená metoda umožňující užití nepřeberného množství „homemade“ protokolů s nedostatečnou mírou mezilaboratorní standardizace, z čehož pramení v řadě případů diskutabilní reprodukovatelnost výsledků. V současné době je tato modalita ve většině případů rezervována pro užití specialisty v hematologii či imunologii. S ohledem na extrémně narůstající počet objevovaných a popsaných antigenů (cluster of differentiation, CD), „biomarkerů“ a s nimi souvisejících imunologických pochodů, je bez adekvátní interpretace výsledků jen obtížně uchopitelná a pro praxi/léčbu použitelná. Další omezení plyne z toho, že průtoková cytometrie není většinou, a to ani ve specializovaných centrech, metodou aplikovatelnou 24 hodin denně/7dní v týdnu. I přes všechny uvedené limitace nabízí FCM za určitých okolností (dostupnost, reprodukovatelnost, interpretovatelnost a interpretovanost) velký potenciál v dalším pokroku poznání patofyziologie, rutinní praxi včetně léčby kontinua sepse – septický šok a převážná většina poznatků diskutovaných dále u jednotlivých buněčných elementů čerpá právě s jejich FCM analýz.
Obr. 2. Schematický princip průtokové cytometrie 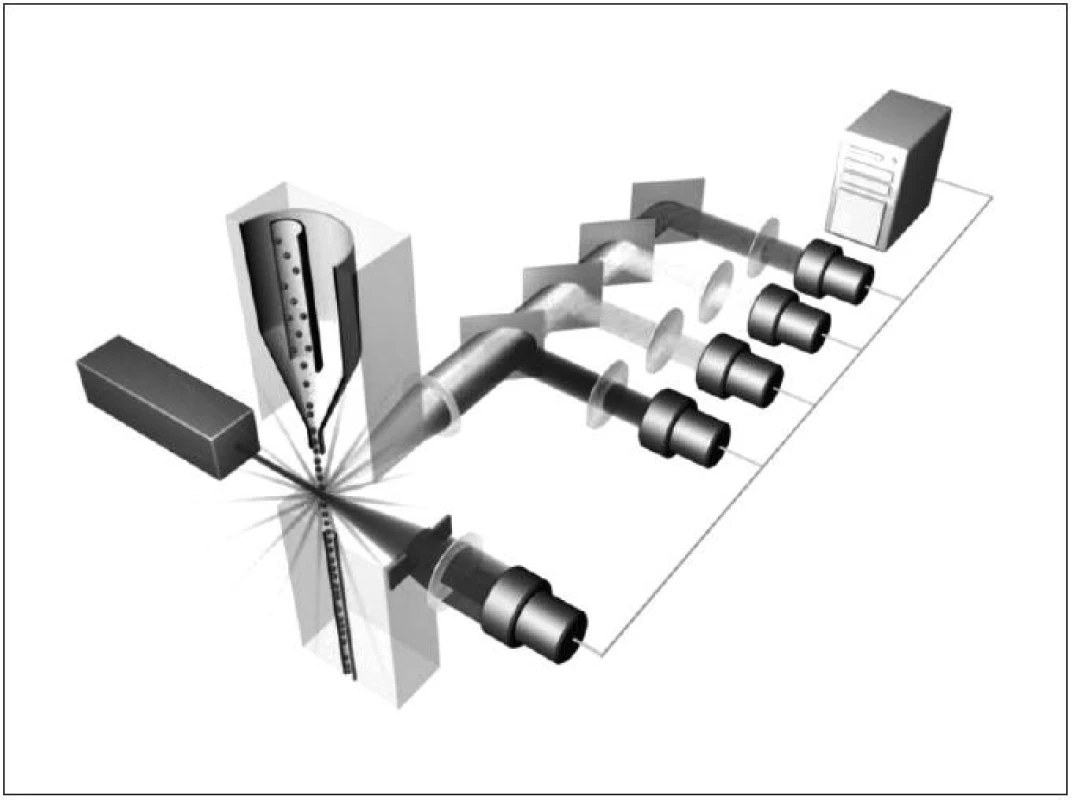
Obr. 3. Ilustrativní ukázka dvoudimenzionální kvantitativní FCM analýzy – „cell sorting“ 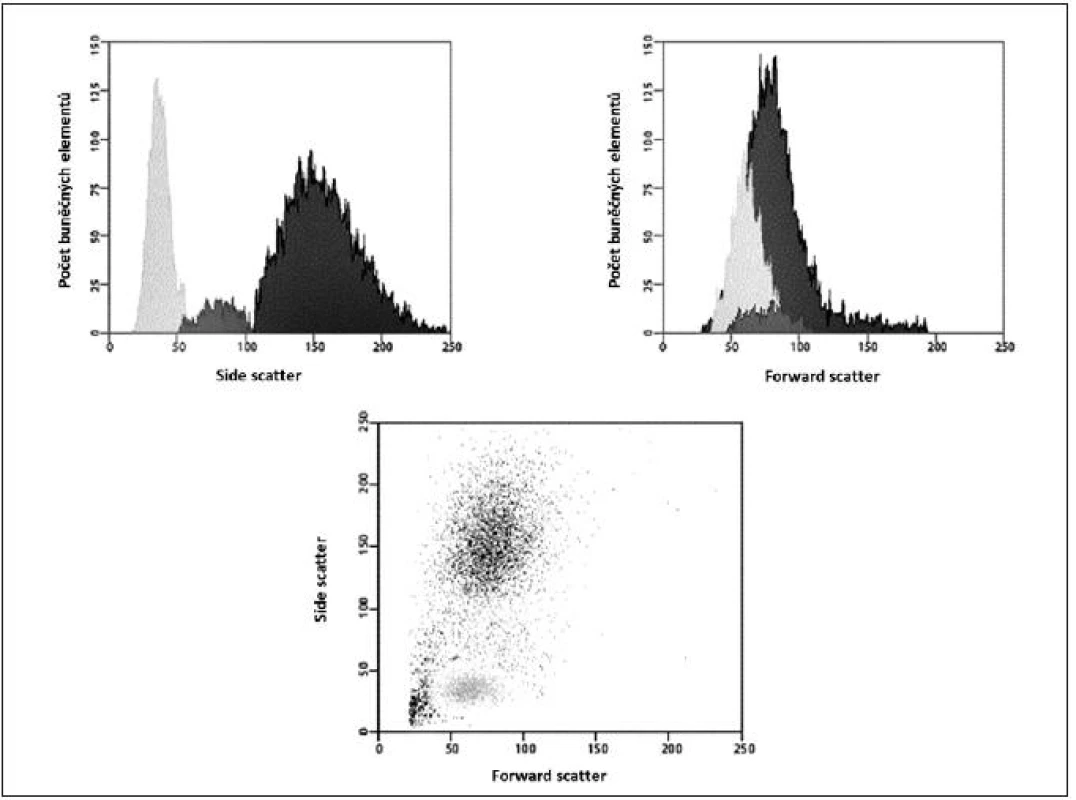
Obr. 4. Ilustrativní ukázka dvoudimenzionální kvantitativní FCM analýzy – „cell sorting“ 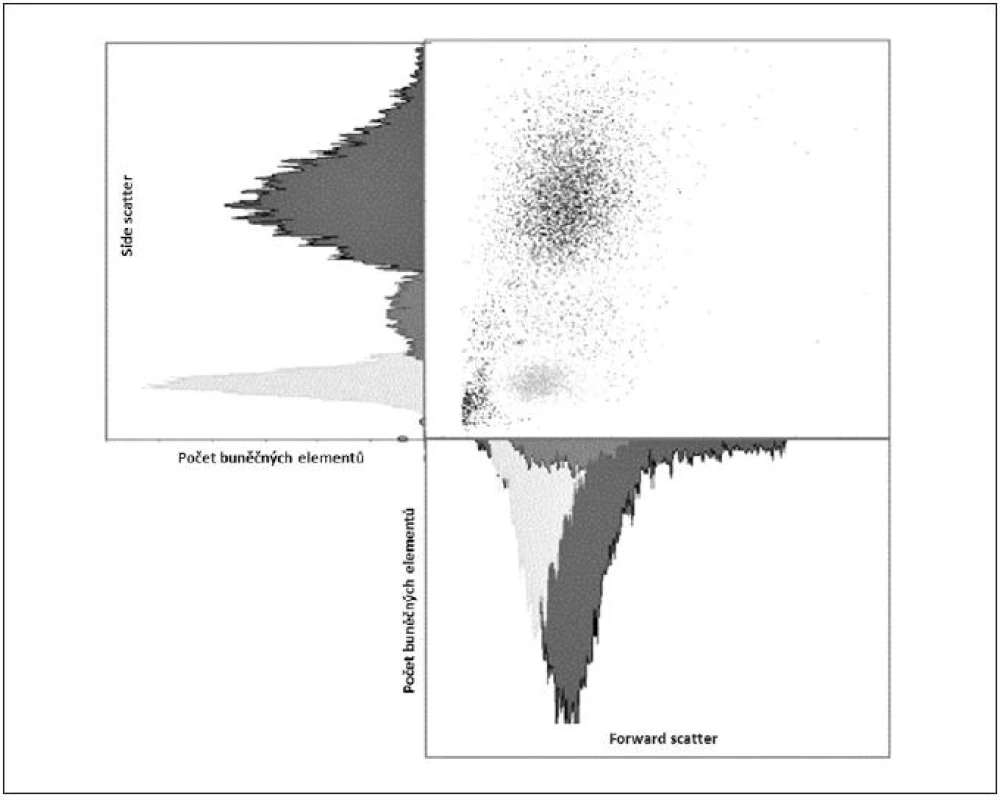
Obr. 5. Ilustrativní ukázka dvoudimenzionální kvantitativní FCM analýzy – „cell sorting“ 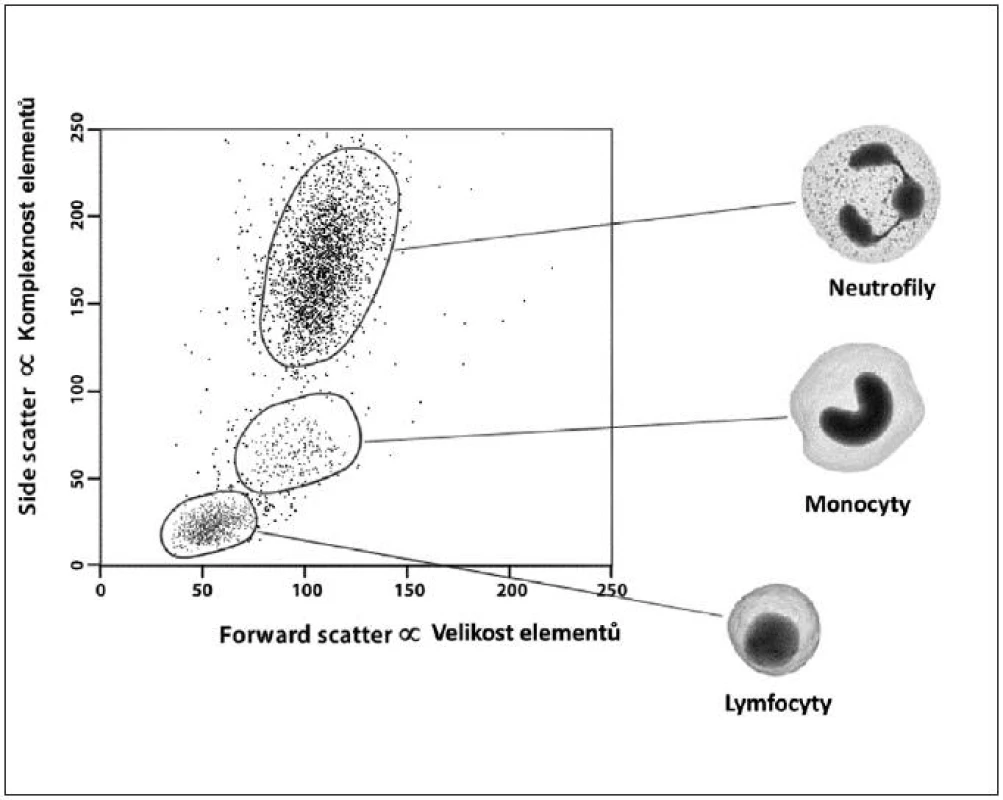
BUNĚČNÉ KOMPONENTY IMUNITNÍ ODPOVĚDI
Časná fáze sepse je charakterizována zejména uvolněním prozánětlivých cytokinů buňkami vrozené imunity jako makrofágy, granulocyty a NK-buňkami (natural-killer cells, NKC) [25]. Tato iniciální fáze je však provázena rychlou indukcí apoptózy imunitních buněk vrozené i adaptivní imunity cestou cysteinových proteáz (kaspáz) a poklesem jejich absolutních počtů [26, 27, 28, 29] – tabulka 3. Současně se objevuje porucha prezentace antigenů monocyty a dalšími antigen-prezentujícími buňkami [13, 30, 31]. Dále také dochází ke zvýšení počtu supresorových elementů, jako jsou Th2 subpopulace T-lymfocytů, regulační T-lymfocyty (Tregs), supresorové buňky myeloidního původu (myeloid-derived suppressor cells, MDSC) a populace granulocytů se supresorickým fenotypem [31]. Dysfunkce a apoptóza dendritických buněk (DC) se podle recentních poznatků také významnou měrou podílí na imunoparalýze v průběhu sepse [31, 32, 33, 34]. Všechny tyto buněčné elementy jsou součástí kontrolních mechanismů k udržení imunitní homeostázy a zabránění excesivní aktivace imunitního systému a následného poškození vzdálených orgánů (MODS) [9, 31, 34].
Neutrofilní granulocyty
Neutrofily jsou důležitými elementy vrozené imunity. Tradičně jsou považovány za esenciální komponenty rozvoje a progrese systémového zánětu. Jsou významným zdrojem prozánětlivých cytokinů, působí jako potentní fagocyty s přímou destrukcí patogenů a ve formě neutrofilních extracelulárních pastí (neutrophil extracellular traps, NET) usnadňují lokalizaci, izolaci, destrukci a eliminaci infekčních agens [35]. NET jsou intravaskulární komplexní struktury tvořené nukleárním chromatinem, histony, cytoplazmatickými proteiny neutrofilů a samotnými neutrofily [36, 37]. Neutrofilní granulocyty jsou schopny migrace do místa infekce, adheze a aktivace endotelu s následnou endoteliální dysfunkcí, iniciací a modulací lokální a systémové zánětlivé odpovědi, poruchou mikrocirkulace a tkáňovým/orgánovým poškozením. Na druhé straně ani významné snížení počtu granulocytů nevede k alteraci mikrocirkulace [38]. Probíhající systémový zánět vede k poruše funkce neutrofilů na mnoha úrovních a v důsledku toho k výrazné alteraci vrozené imunity a její interakce s mechanismy adaptivní imunitní odpovědi [37].
Antigen prezentující buňky
Antigen prezentující buňky (antigen-presenting cells, APC) jsou všechny buňky schopné pomocí PRR rozpoznat antigeny invadujících patogenů (PAMP) či endogenní „alarminy“ (DAMP) a předložit jejich epitopy (antigenní determinanty = klíčové antigen-specifické rozpoznávací znaky) v kombinaci s hostitelovými MHC antigeny II. třídy a dalšími kostimulačními molekulami efektorovým buňkám (T-lymfocyty, neutrofily aj.). Klasicky jsou APC rozdělovány na profesionální APC (dendritické buňky, makrofágy/monocyty a B-lymfocyty) a neprofesionální APC (fibroblasty, epiteliální a endoteliální buňky).
Dendritické buňky
Dendritické buňky (dendritic cells, DC) jsou kritickými elementy v indukci adaptivní imunitní odpovědi, tolerance a propojení imunity vrozené a získané. Zahrnují značně heterogenní buněčnou populaci vycházející z CD34 + kmenových buněk a jsou přítomny v řadě orgánů. Rozlišují se dvě základní subpopulace – nezralé a zralé DC. Právě maturace DC je klíčovým procesem propojujícím vrozenou a získanou imunitu [39, 40]. Nezralé cirkulující DC jsou schopny receptorovými (TLR) a nereceptorovými mechanismy rozpoznávat PAMP/DAMP, následně maturovat ve zralé DC, produkovat unikátní profil cytokinů a receptorů a stimulovat nativní T-lymfocyty (T-helper) [41]. Zralé DC pak ztrácejí schopnost fagocytózy, zpracování a prezentace antigenů a shromažďují se v sekundárních lymfatických orgánech (slezina, lymfatické uzliny). V závislosti na specifickém PAMP/DAMP vyzrávají DC do několika odlišných klonů s následnou specifickou aktivací odlišných klonů T-helper lymfocytů (Th1 vs. Th2 vs. Tregs – viz dále) [39, 41, 42]. Pokles počtu cirkulujících (tj. nezralých) DC, jakožto potentních iniciátorů a modulátorů systémového zánětu, byl popsán již v časné fázi u nemocných se septickým šokem [32]. Recentní práce navíc prokazují, že setrvalý pokles DC může být spojený s vyšší incidencí nozoko-miálních infekcí [43], což poukazuje na důležitou roli DC v postinfekční imunosurveillanci.
Monocyty
Monocyty jsou potentními profesionálními APC a významnými producenty cytokinů. V průběhu sepse jsou charakterizovány sníženou reaktivitou na aktivační stimuly i poruchou prezentace antigenů pravděpodobně v důsledku snížení exprese antigenů MHC (major histocompatibility complex) II. třídy. MHC antigen II. třídy, respektive HLA-DR, je spolu s CD86 klíčovou molekulou při prezentaci antigenů APC, jak již bylo diskutováno výše. Řada studií demonstrovala asociaci snížené exprese HLA-DR na monocytech (mHLA-DR) s jejich dysfunkcí. Tyto monocyty produkují menší množství prozánětlivých cytokinů jako TNFα a IL-1 v odpovědi na stimulaci bakteriálními PAMP [44]. Obdobně je prokazována snížená proliferace lymfocytů a produkce IFNγ u septických jedinců se snížením mHLA-DR jako konsekvence porušené prezentace antigenů [45, 46]. Snížená exprese mHLA-DR (< 40 % HLA-DR+ monocytů; norma > 90 %) je některými studiemi označována za relativně spolehlivý marker monocytární dysfunkce, odvozeně i imunosuprese/imunokompromitace kriticky nemocných a jejich morbidity a mortality [13, 30, 47, 48]. Při přesné kvantitativní detekci počtu molekul HLA-DR na monocytech pomocí FCM však bylo zjištěno, že ačkoliv jsou mediány denzit HLA-DR významně odlišné ve skupině přeživších a nepřeživších nemocných, nemusí být korelace s tíží, průběhem onemocnění a mortalitou zcela spolehlivá díky významné variabilitě těchto hodnot a lze obtížně stanovit hraniční (cut-off) hodnoty [49].
Dalším mechanismem vedoucím v průběhu sepse k imunosupresi může být zvýšená exprese negativně kostimulační molekuly PD-1 („programmed death“) na monocytech [50, 51, 52]. Monocyty s tímto fenotypem produkují klíčový protizánětlivý cytokin – IL-10 s následnou inhibicí proliferace T-lymfocytů a indukcí jejich apoptózy.
T-LYMFOCYTY A JEJICH SUBPOPULACE
T-lymfocyty
T-lymfocyty (T-cells, TC) představují další klíčovou úroveň imunitní odpovědi organismu, sehrávají jak roli efektorovou (CD3+CD8+ TC, cytotoxické TC), tak i regulační (CD3+CD4+ TC, helper TC) [53, 54, 55]. Aktivace a maturace TC probíhá cestou interakcí povrchových receptorů (TCR/CD3 komplex, kostimulační CD 28) přímo s PAMP/DAMP či APC. Aktivované TC vykazují několik uniformních profilů v produkci cytokinů (základní: prozánětlivý vs. protizánětlivý) [56]. Vedle funkčních změn (maturace, aktivace) dochází v průběhu sepse a po těžkém traumatu i ke snížení počtu cirkulujících TC [57, 58, 59] – tab. 3, a tíže této lymfocytopenie koreluje s rozvojem nozokomiálních infekcí [58]. Zvýšená ingesce apoptotických lymfocytů vede k přímé inaktivaci makrofágů a k zhoršení eliminace patogenů [59, 60]. Charakteristickým rysem imunitní deregulace je posun směrem k Th2 imunitní odpovědi s elevací plazmatických hladin Th2 cytokinů (zejména IL-4) a snížená produkce cytokinů Th1 odpovědi (TNFα, IFNγ, IL-2) [59, 61]. Dalším fenotypovým klonem helper TC jsou vedle Th1 a Th2 také Th17 lymfocyty [62, 63]. Produkcí IL-17 stimulují nepřímo neutrofilní granulocyty k eliminaci infekčních agens, a zajišťují tak pozitivní/potencující zpětnou vazbu imunity získané s mechanismy imunity vrozené [5, 59].
Tab. 3. Srovnání absolutních počtů lymfocytů zdravých dobrovolníků a septických nemocných 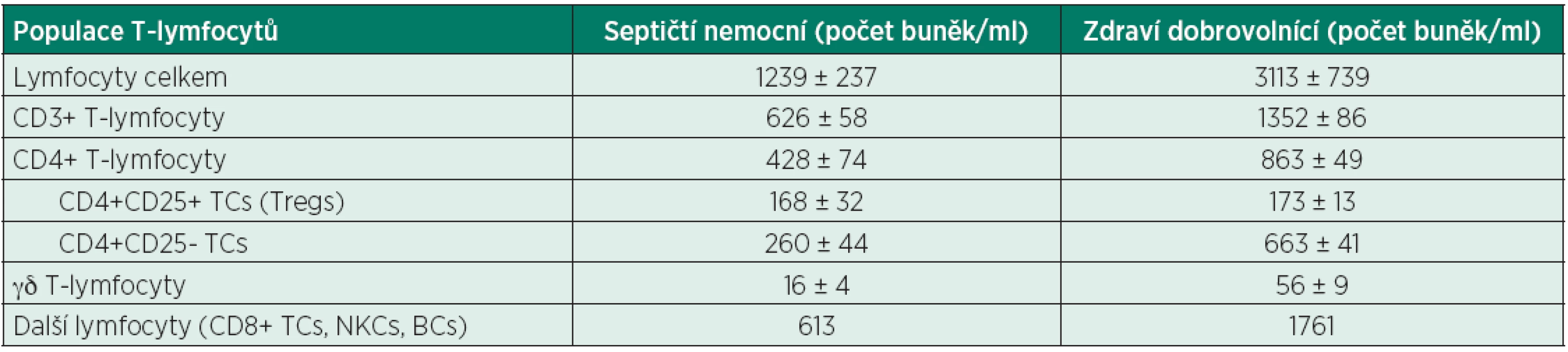
Adaptováno z Monneret G. Mol Med 2008 [84] Data, prezentována jako průměr ± směrodatná odchylka, jsou získána z plné krve zdravých dobrovolníků a nemocných v septickém šoku mezi 3-5 dnem onemocnění. Dalším charakteristickým rysem T-lymfocytární dysfunkce v sepsi je vzestup počtu subpopulace cirkulujících elementů s regulačními funkcemi. Tyto CD4+CD25+ regulační TC (Tregs) jsou potentními elementy kontrolujícími vrozenou i získanou imunitní odpověď organismu [5, 59, 64]. Zvýšení počtu je dáno zřejmě jejich sníženou senzitivitou k apoptotickým signálům, je popisováno již bezprostředně při diagnóze sepse. Mechanismy imunosupresivního působení Tregs nejsou zcela známy. Existují důkazy o přímém inhibičním vlivu na cytotoxické TC, NK-buňky i DC [5, 65]. Exprese ektonukleotidáz (CD39 a CD73) v membráně Tregs vede ke konverzi extracelulárně vysoce inflamatorní molekuly ATP na adenosin. Adenosin způsobuje vazbou na specifické receptory na lymfoidních a myeloidních buňkách jejich inaktivaci [66].
NK-buňky
NK-buňky (natural-killer cells, NKC) jsou subpopulací TC reprezentující 4–15% cirkulujících lymfocytů. Průtokovou cytometrií mohou být charakterizovány jako CD3-CD56+ lymfocyty [67,68]. Jako součást vrozené imunity se podílí na setrvalém imunologickém dohledu nad invazí patogenů a nádorovým bujením [67]. NKC jsou aktivovány cestou PRR (TLR a NOD) rozpoznávajících široké spektrum PAMP/DAMP, v aktivovaném stavu se stávají významným zdrojem IFNγ – klíčového prozánětlivého mediátoru a podílí se na přímé destrukci a eliminaci patogenů/cílových buněk [67, 69]. NKC úzce interagují s ostatními klíčovými elementy vrozené i adaptivní imunity, zejména DC, monocyty/makrofágy a neutrofily. Tyto interakce jsou zprostředkovány řadou cytokinů (IL-2, IL-12, IL-15 a IL-18).
NKC jsou ideálním příkladem toho, jak je pro nekomplikovaný průběh systémového zánětu nezbytná správná regulace imunitní odpovědi. Podle celé řady studií dochází v průběhu systémového zánětu/sepse k poklesu celkového počtu NKC [70, 71]. Mechanismy této deplece nejsou v současnosti zcela jasné, ale zřejmě se na ní podílí migrace do místa infekce a dalších (sekundárně) poškozených orgánů [72, 73, 74] a také apoptóza [71]. Nadměrný časný úbytek aktivovaných NKC může vést k nedostatečné eliminaci infekčního agens [70, 71]. Na druhou stranu, zvýšený počet aktivovaných NKC (respektive snížená deplece) může být spojován s významnějším orgánovým poškozením, komplikovaným průběhem sepse a vyšší mortalitou [75, 76, 77].
Detailní poznání funkcí NKC v sepsi zůstává stále relativně otevřenou otázkou. Pozitivní roli sehrávají v iniciaci a modulaci/potenciaci odpovědi vrozeného imunitního systému. Negativním rysem je jejich podíl na poškození tkání [67].
Gama-delta (γδ) T-lymfocyty
Gama-delta (γδ) T-lymfocyty jsou minoritní subpopulací TC exprimující T-lymfocytární receptor (T-cell receptor, TCR) sestávající se z γ a δ řetězců (v porovnání s TCR jiných TC, která je tvořen řetězci α a β). Jsou preferenčně lokalizovány (homing) v mukózách, slezině (5 % buněčnosti) a tvoří 1–10 % cirkulujících lymfocytů. Vzhledem k jejich preferenční epiteliální lokalizaci hrají rovněž nezastupitelnou roli v první linii obrany vůči invadujícím patogenům. Gama-delta T-lymfocyty jsou schopny časné iniciace zánětu prostřednictvím interakcí s dalšími centrálními buněčnými elementy imunitní odpovědi (dendritické buňky) cestou produkce IL-17 [78, 79]. Navíc jsou také potentními APC [79, 80] a vykazují přímou cytotoxickou aktivitu. Přesné mechanismy, postavení, role a možnosti terapeutických manipulací γδ T-lymfocytů v procesu systémového zánětu jsou předmětem současných studií. Také popisovaný pokles počtu těchto elementů v průběhu sepse je v současnosti spíše prostou deskripcí stavu s odvozovanými konsekvencemi v podobě potenciálního stavu imunosuprese. Problematická je již samotná relevance stanovení množství cirkulujících γδ T-lymfocytů jako aproximace skutečného počtu těchto preferenčně extravaskulárně lokalizovaných elementů.
DALŠÍ KLÍČOVÉ BUNĚČNÉ ELEMENTY HRAJÍCÍ VÝZNAMNOU ROLI V IMUNITNÍ ODPOVĚDI ORGANISMU
Supresorové buňky myeloidního původu
Supresorové buňky myeloidního původu (myeloid-derived suppressor cells, MDSC) jsou heterogenní populací expandující při systémovém zánětu s infekcí, mající významnou schopnost potlačovat funkce TC a modulovat produkci cytokinů makrofágy [81, 82]. Tvoří přibližně 0,5 % periferních cirkulujících mononukleárů a jsou charakterizovány expresí společného myeloidního znaku CD33, Gr1 a CD11b [83, 84]. Prozánětlivé cytokiny (INFγ, IL-13, IL-4, ligandy pro TLR) aktivují MDSC, které cestou produkce ROx, NOx, peroxinitritu a přímou indukcí Tregs vedou k imunoparalýze [82, 84, 85]. Výsledky některých experimentálních studií naznačují protektivní roli MDSCs u subjektů v septickém šoku [86].
Endoteliální a epiteliální buňky
Endoteliální buňky sehrávají důležitou úlohu v propagaci zánětu. Exprimují celou škálu adhezivních molekul, které umožňují a usnadňují adhezi imunokompetentních buněk a rozšíření zánětu. Fenomén endoteliální dysfunkce je považován za jeden z klíčových mechanismů průběhu systémového zánětu a geneze MODS [2].
V průběhu sepse dochází k poškození a zvýšené apoptóze endoteliálních a epiteliálních buněk. Do cirkulace se tak dostává množství DAMP (viz níže), které dále potencují a udržují systémový zánět [11, 87]. DAMP, jako například mitochondriální DNA (mtDNA), mohou být detekovány v plazmě i po kompletní eradikaci infekčního agens a charakterizují přetrvávající tkáňové poškození. Detekce mtDNA a bakteriální DNA (bDNA) může za určitých okolností sloužit k odlišení infekční a neinfekční etiologie systémového zánětu [11].
CIRKULUJÍCÍ MEDIÁTORY
Nepřeberné množství experimentálních i humánních studií se již zabývalo stanovením hladin, významem a možnostmi využití nejrůznějších inflamatorních mediátorů k popisu patofyziologie, diagnostice a/nebo léčbě nemocných v sepsi/septickém šoku. Vzhledem k jejich množství, komplexnosti jejich vzájemných interakcí, interakcí s imunokompetentními elementy a významně proměnlivým hladinám a biologickým poločasům nebylo a stále není možné jejich význam správně uchopit a využít [88]. Kontinuální studium systémového zánětu vede k identifikaci řady nových cytokinů, z nichž některé vykazují zajímavé a potenciálně terapeuticky využitelné funkce.
Interleukin 7 (IL-7) je jedním z klíčových mediá-torů udržujících homeostázu a přežívání TC (antiapoptotický efekt). Sekundárně vede k udržení či zvýšení produkce IFNγ a tedy k udržení či akcentaci zánětlivé odpovědi [89, 90]. Z těchto poznatků by mohl vyplývat potenciální terapeutický efekt aplikace IL-7 ve fázi imunodeprese. Efekt však není, i přes některé pozitivně vyznívající práce [86], zcela přímočarý a závisí na jedné straně na expresi a stavu receptoru pro IL-7 na lymfocytech (IL-7R/CD127), na další sekundární intra - a intercelulární signalizaci a na straně druhé na početním a funkčním stavu elementů imunitního systému.
Subpopulace regulačních TC – Th17 sehrává klíčovou roli v obraně hostitele před mikrobiální invazí [91]. Jako významná součást adaptivní imunity cestou produkce interleukinů 17, 21 a 22 moduluje a adaptuje odpověď složek vrozené imunitní odpovědi [91, 92, 93]. Pozornost současného výzkumu se soustřeďuje zejména na IL-17, který mimo jiné atrahuje neutrofily do dýchacích cest/plic v odpovědi na infekční podněty. Recentní práce navíc popisují i vliv genetických variací IL-17 v primární citlivosti jedinců ke grampozitivním patogenům a poukazují na možnou asociaci s mortalitou [93].
Dalším z relativně nově identifikovaných a popsaných chemokinů je interleukin 33 (IL-33) patřící do „cytokinové rodiny IL-1“. Sehrává důležitou úlohu v aktivaci vrozené imunity cestou stimulace DCs a makrofágů a tedy v antigenní prezentaci, propojení s adaptivní imunitní odpovědí a primární eliminaci patogenů. Významný vliv má také na indukci zánětu dýchacích cest s potenciací funkce eozinofilů při alergických postiženích a v neposlední řadě se účastní procesů mukózních (neinfekčních) zánětů (ulcerózní kolitida, Crohnova nemoc). Významná je úloha IL-33 i v indukci Th2 imunitní odpovědi, jakožto kontrolního a protektivního mechanismu v sepsi [94, 95, 96]. Souhrnně lze tedy IL-33 označit za homeostatický faktor, který stimuluje eliminaci patogenů, reparaci tkání a současně kontrolu rozsahu imunitní odpovědi a poškození tkání.
Zvláštní pozornost si zaslouží i klíčový DAMP a pozdní mediátor sepse high mobility group box 1 (HMGB-1). Tento nukleární protein je pasivně uvolňován při ztrátě integrity membrán nekrotických buněk. HMGB-1 stimuluje zánětlivou odpověď aktivací DC, atrahuje imunokompetentní elementy a podílí se na tkáňové regeneraci indukcí proliferace a diferenciace kmenových buněk [97]. Koncentrace HMGB-1 zůstává zvýšena i v době, kdy se hladiny jiných (TNFα, IL-6) již normalizovaly [97, 98] a zdá se nezbytná pro správnou maturaci DCs a následnou aktivací Th1 imunitní odpovědi.
Dalšími ubikvitárními potentními mediátory zánětlivé odpovědi ze skupiny DAMP jsou heat shock proteiny (HSP). Při tkáňovém poškození jsou HSP aktivně secernovány a cestou TLR indukují zánětlivou odpověď organismu [99]. Také proteiny skupiny S100 jsou schopny indukovat specifický zánět endotelu se zvýšenou vaskulární permeabilitou a protrombotickým stavem. Současně přímo aktivují buňky imunitního systému cestou jejich PRR (TLR, RAGE) [99].
ZÁVĚR A PERSPEKTIVY
I přes enormní pokroky posledních let jsou naše znalosti patofyziologie sepse značně nekompletní. Tato skutečnost a neznalost aktuálního imunologického profilu studovaných jedinců mohla stát za selháním většiny klinických studií s cílem ovlivnit prozánětlivé reakce organismu. Nadále zůstává řada nezodpovězených otázek: Známe opravdu dobře mechanismy vedoucí k sepsí indukované imunoparalýze? Podílí se i naše vlastní léčba na indukci a/nebo potenciaci této imunosuprese? Jsou to katecholaminy, sedativa, inzulin, antibiotika? Jakou roli má buněčná energetika/mitochondriální dysfunkce v imunitní homeostáze? Jakou roli mají neuroendokrinní mechanismy v imunitní odpovědi?
Jakkoliv významné se mohou zdát naše současné pokroky v porozumění systémovému zánětu a identifikaci nových mediátorů, nelze naše diagnostické a terapeutické úvahy opírat o izolovanou analýzu jakéhokoliv z nich, jelikož poskytují pouze částečný a relativně dost omezený pohled na aktuální stav imunitní homeostázy konkrétního subjektu. Přínosnější alternativou může být užití celého panelu markerů (solubilních i celulárních) k definování aktuálního individuálního imunitního profilu. V čase opakovaná (funkční) analýza imunologického profilu nemocných v iniciální fázi závažného systémového zánětu (septický šok) teoreticky umožňuje jejich „imunologickou stratifikaci“ a predikci rozvoje komplikací a/nebo mortality a také možné odpovědi na případnou imunointervenční terapii. Podstatnou limitaci však představuje schopnost naší interpretace a klinického využití těchto dat v současnosti.
Ve světle současných poznatků lze systémový zánět v přítomnosti infekčního agens považovat za přísně individuální a patogen a hostitel-specifický proces imunitní deregulace. Nejen v blokádě prozánětlivé odpovědi, nýbrž i ve stimulaci imunitní odpovědi se může nacházet slibná léčebná strategie. Příkladem může být:
- blokáda protizánětlivých mediátorů,
- obnova funkcí APC,
- obnova funkcí TC,
- blokáda apoptózy imunitních elementů.
Abychom se současně vyhnuli chybám předchozích studií, je potřeba mít na paměti, že cílení léčby na jediný patofyziologický pochod může být a zřejmě také i bude nedostatečné.
Imunomodulační/imunostimulační terapie představují možnou strategii v léčbě sepse/septického šoku, jejichž cílem by mělo být zlepšení eliminace patogenů, prevence rozvoje nozokomiálních infekcí a reaktivace dormantních virů. I přes slibné předběžné výsledky některých studií (IFNγ, GM-CSF, anti-IL-10) je aplikace těchto poznatků do klinické praxe ještě velmi vzdálena. Ke všem v textu výše uvedeným elementům zánětlivé odpovědi lze dokladovat řadu prací se snahou o pozitivní ovlivnění daného patofyziologického pochodu stimulací či inhibicí. Jejich výčet a komentování je však zcela nad rámec tohoto pojednání [9, 100].
Primárním a determinujícím cílem by mělo být klinicky aplikovatelné bližší porozumění patofyzio-logii imunitní regulace a odpovědi při systémové infekci a schopnost rychlého rutinního zhodnocení (v čase) imunologického stavu nemocných a identifikace jednotlivců, kteří by z výše zmíněných imunomodulačních/imunostimulačních terapií profitovali.
Seznam zkratek
APC – antigen prezentující buňky (antigen-presenting cells)
ATB – antibiotika
BC – B-lymfocyty (B-cells)
BCR – B-lymfocytární/buněčný receptor (B-cell receptor)
b-DNA – bakteriální DNA
CARS – syndrom kompenzační protizánětlivé odpovědi (compensatory antiinflammatory response syndrome)
CMV – cytomegalovirus
DAMP – molekulární motivy hostitele, endogenní alarminy (danger-associated molecular pattern)
DC – dendritické buňky (dendritic cells)
FCM – průtoková cytometrie (flow cytometry)
GIT – gastrointestinální trakt
GM-CSF – granulocytární a makrofágové kolonie stimulující faktor (granulocyte-macrophage colony-stimulating factor)
HMGB1 – high-mobility group box 1
HSP – heat shock protein
IL – interleukin
INF – interferon
JIP – jednotka intenzivní péče
MODS – syndrom dysfunkce/selhání více orgánů (multiple organ dysfunction syndrome)
mt-DNA – mitochondriální DNA
PAMP – molekulární motivy patogenů, exogenní alarminy (pathogen-associated molecular patterns)
PICS – syndrom přetrvávajícího zánětu, imunosuprese a katabolismu (persistent inflammation, immunosuppression and catabolism)
PRR – motivy-rozpoznávající receptory (pattern recognition receptors)
RQ-PCR – kvantitativní polymerázová řetězová reakce v reálném čase (real-time quantitative polymerase chain reaction)
SIRS – syndrom systémové zánětlivé odpovědi (systemic inflammatory response syndrome)
TC – T-lymfocyty (T-cells)
TCR – T-lymfocytární/buněčný receptor (T-cell receptor)
Th – pomocné T-lymfocyty (helper T-cells)
TLR – toll-like receptor
TNF – nádor nekrotizující faktor (tumor necrosis factor)
Tregs – regulační T-lymfocyty
Podpořeno projektem Ministerstva zdravotnictví koncepčního rozvoje výzkumné organizace 00669806 - FN Plzeň.
Do redakce došlo dne 11. 2. 2013.
Do tisku přijato dne 15. 5. 2013.
Adresa pro korespondenci:
Prof. MUDr. Martin Matějovič, PhD.
LF UK a FN Plzeň
Alej svobody 80
30406 Plzeň
e-mail: matejovic@fnplzen.cz
Zdroje
1. Martin, G. S., Mannino, D. M., Eaton, S. et al. The epidemiology of sepsis in the United States from 1979 through 2000. N. Engl. J. Med., 2003, 348, p. 1546–1554.
2. Annane, D., Bellissant, E., Cavaillon, J. M. Septic shock. Lancet, 2005, 365, p. 63–78.
3. Riedemann, N. C., Guo, R. F., Ward, P. A. Novel strategies for the treatment of sepsis. Nat. Med., 2003, 9, p. 517–524.
4. Boomer, J. S., To, K., Chang, K. C. et al. Immunosuppression in patients who die of sepsis and multiple organ failure. JAMA, 2011, 306, p. 2594–2605.
5. Littman, D. R., Rudensky, A. Y. Th17 and regulatory T cells in mediating and restraining inflammation. Cell, 2010, 140, p. 845–858.
6. Cinel, I., Opal, S. M. Molecular biology of inflammation and sepsis: a primer. Crit. Care Med., 2009, 37, p. 291–304.
7. Netea, M. G., van der Meer, J. W. Immunodeficiency and genetic defects of pattern-recognition receptors. N. Engl. J. Med., 2011, 364, p. 60–70.
8. Opal, S. M. New perspectives on immunomodulatory therapy for bacteraemia and sepsis. Int. J. Antimicrob. Agents, 2010, 36 Suppl 2, p. S70–S73.
9. Larosa, S. P., Opal, S. M. Immune aspects of sepsis and hope for new therapeutics. Curr. Infect. Dis. Rep., 2012, 14, p. 474–483.
10. Van der, P. T., Opal, S. M. Host-pathogen interactions in sepsis. Lancet Infect. Dis., 2008, 8, p. 32–43.
11. Sursal, T., Stearns-Kurosawa, D. J., Itagaki, K. et al. Plasma bacterial and mitochondrial DNA distinguish bacterial sepsis from sterile systemic inflammatory response syndrome and quantify inflammatory tissue injury in nonhuman primates. Shock, 2013, 39, p. 55–62.
12. Gentile, L. F., Cuenca, A. G., Efron, P. A. et al. Persistent inflammation and immunosuppression: a common syndrome and new horizon for surgical intensive care. J. Trauma Acute. Care Surg., 2012, 72, p. 1491–1501.
13. Monneret, G., Lepape, A., Voirin, N. et al. Persisting low monocyte human leukocyte antigen-DR expression predicts mortality in septic shock. Intensive Care Med., 2006, 32, p. 1175–1183.
14. Xiao, W., Mindrinos, M. N., Seok, J. et al. A genomic storm in critically injured humans. J. Exp. Med., 2011, 208, p. 2581–2590.
15. Calvano, S. E., Xiao, W., Richards, D. R. et al. A network-based analysis of systemic inflammation in humans. Nature, 2005, 437, p. 1032–1037.
16. Prucha, M., Ruryk, A., Boriss, H. et al. Expression profiling: toward an application in sepsis. Shock, 2004, 22, p. 29–33.
17. Johnson, S. B., Lissauer, M., Bochicchio, G. V. et al. Gene expression profiles differentiate between sterile SIRS and early sepsis. Ann. Surg., 2007, 245, p. 611–621.
18. Tang, B. M., McLean, A. S., Dawes, I. W. et al. Gene-expression profiling of peripheral blood mononuclear cells in sepsis. Crit. Care Med., 2009, 37, p. 882–888.
19. Sprung, C. L., Sakr, Y., Vincent, J. L. et al. An evaluation of systemic inflammatory response syndrome signs in the Sepsis Occurrence in Acutely ill Patients (SOAP) study. Intensive Care Med., 2006, 32, p. 421–427.
20. Hotchkiss, R. S., Karl, I. E. The pathophysiology and treatment of sepsis. N. Engl. J. Med., 2003, 348, p. 138–150.
21. Gentile, L. F., Moldawer, L. L. DAMPs, PAMPs, and the Origins of SIRS in Bacterial Sepsis. Shock, 2013, 39, p. 113–114.
22. Bauer, M., Reinhart, K. Molecular diagnostics of sepsis--where are we today? Int. J. Med. Microbiol., 2010, 300, p. 411–413.
23. Wong, H. R. Clinical review: sepsis and septic shock – the potential of gene arrays. Crit Care, 2012, 16, p. 204.
24. Karvunidis, T., Mares, J., Thongboonkerd, V. et al. Recent progress of proteomics in critical illness. Shock, 2009, 31, p. 545–552.
25. Cohen, J. The immunopathogenesis of sepsis. Nature, 2002, 420, p. 885–891.
26. Hotchkiss, R. S., Swanson, P. E., Freeman, B. D. et al. Apoptotic cell death in patients with sepsis, shock, and multiple organ dysfunction. Crit Care Med., 1999, 27, p. 1230–1251.
27. Hotchkiss, R. S., Chang, K. C., Swanson, P. E. et al. Caspase inhibitors improve survival in sepsis: a critical role of the lymphocyte. Nat. Immunol., 2000, 1, p. 496–501.
28. Hotchkiss, R. S., Tinsley, K. W., Swanson, P. E. et al. Sepsis-induced apoptosis causes progressive profound depletion of B and CD4+ T lymphocytes in humans. J. Immunol., 2001, 166, p. 6952–6963.
29. Hotchkiss, R. S., Tinsley, K. W., Swanson, P. E. et al. Depletion of dendritic cells, but not macrophages, in patients with sepsis. J. Immunol., 2002, 168, p. 2493–2500.
30. Nolan, A., Kobayashi, H., Naveed, B. et al. Differential role for CD80 and CD86 in the regulation of the innate immune response in murine polymicrobial sepsis. PLoS. One., 2009, 4, p. e6600.
31. Hotchkiss, R. S., Opal, S. Immunotherapy for sepsis–a new approach against an ancient foe. N. Engl. J. Med., 2010, 363, p. 87–89.
32. Guisset, O., Dilhuydy, M. S., Thiebaut, R. et al. Decrease in circulating dendritic cells predicts fatal outcome in septic shock. Intensive Care Med., 2007, 33, p. 148–152.
33. Faivre, V., Lukaszewicz, A. C., Alves, A. et al. Accelerated in vitro differentiation of blood monocytes into dendritic cells in human sepsis. Clin. Exp. Immunol., 2007, 147, p. 426–439.
34. Nathan, C., Ding, A. Nonresolving inflammation. Cell, 2010, 140, p. 871–882.
35. Mantovani, A., Cassatella, M. A., Costantini, C. et al. Neutrophilsin the activation and regulation of innate and adaptive immunity. Nat. Rev. Immunol., 2011, 11, p. 519–531.
36. Urban, C. F., Ermert, D., Schmid, M. et al. Neutrophil extracellular traps contain calprotectin, a cytosolic protein complex involved in host defense against Candida albicans. PLoS. Pathog., 2009, 5, p. e1000639.
37. Kovach, M. A., Standiford, T. J. The function of neutrophils in sepsis. Curr. Opin. Infect. Dis., 2012, 25, p. 321–327.
38. Karvunidis, T., Chvojka, J., Lysak, D. et al. Septic shock and chemotherapy – induced cytopenia: effects on microcirculation. Intensive Care Med., 2012, 38, p. 1336–1344.
39. Lipscomb, M. F., Masten, B. J. Dendritic cells: immune regulators in health and disease. Physiol Rev., 2002, 82, p. 97–130.
40. Zitvogel, L. Dendritic and natural killer cells cooperate in the control/switch of innate immunity. J. Exp. Med., 2002, 195, p. F9–14.
41. Pene, F., Mira, J. P., Chiche, J. D. Nobel Prize laureates pave the way for therapeutic advances in sepsis. Intensive Care Med., 2012, 38, p. 183–185.
42. Patterson, S. Flexibility and cooperation among dendritic cells. Nat. Immunol., 2000, 1, p. 273–274.
43. Grimaldi, D., Louis, S., Pene, F. et al. Profound and persistent decrease of circulating dendritic cells is associated with ICU-acquired infection in patients with septic shock. Intensive Care Med., 2011, 37, p. 1438–1446.
44. Astiz, M., Saha, D., Lustbader, D. et al. Monocyte response to bacterial toxins, expression of cell surface receptors, and release of anti-inflammatory cytokines during sepsis. J. Lab Clin. Med., 1996, 128, p. 594–600.
45. Manjuck, J., Saha, D. C., Astiz, M. et al. Decreased response to recall antigens is associated with depressed costimulatory receptor expression in septic critically ill patients. J. Lab. Clin. Med., 2000, 135, p. 153–160.
46. Wolk, K., Docke, W. D., Von, B., V. et al. Impaired antigen presentation by human monocytes during endotoxin tolerance. Blood, 2000, 96, p. 218–223.
47. Fumeaux, T., Pugin, J. Is the measurement of monocytesHLA-DR expression useful in patients with sepsis? Intensive Care Med., 2006, 32, p. 1106–1108.
48. Tschoeke, S. K., Moldawer, L. L. Human leukocyte antigen expression in sepsis: what have we learned? Crit. Care Med., 2005, 33, p. 236–237.
49. Trimmel, H., Luschin, U., Kohrer, K. et al. Clinical outcome of critically ill patients cannot be defined by cutoff values of monocyte human leukocyte antigen-DR expression. Shock, 2012, 37, p. 140–144.
50. Okazaki, T., Honjo, T. The PD-1-PD-L pathway in immunological tolerance. Trends Immunol., 2006, 27, p. 195–201.
51. Keir, M. E., Butte, M. J., Freeman, G. J. et al. PD-1 and its ligands in tolerance and immunity. Annu. Rev. Immunol., 2008, 26, p. 677–704.
52. Huang, X., Venet, F., Wang, Y. L. et al. PD-1 expression by macrophages plays a pathologic role in altering microbial clearance and the innate inflammatory response to sepsis. Proc. Natl. Acad. Sci. U. S. A, 2009, 106, p. 6303–6308.
53. Holub, M., Kluckova, Z., Beneda, B. et al. Changes in lymphocyte subpopulations and CD3+/DR+ expression in sepsis. Clin. Microbiol. Infect., 2000, 6, p. 657–660.
54. Holub, M., Kluckova, Z., Helcl, M. et al. Lymphocyte subset numbers depend on the bacterial origin of sepsis. Clin. Microbiol. Infect., 2003, 9, p. 202–211.
55. Ochoa, J. B., Makarenkova, V. T lymphocytes. Crit. Care Med., 2005, 33, p. S510–S513.
56. Curfs, J. H., Meis, J. F., Hoogkamp-Korstanje, J. A. A primer on cytokines: sources, receptors, effects, and inducers. Clin. Microbiol. Rev., 1997, 10, p. 742–780.
57. Hotchkiss, R. S., Osmon, S. B., Chang, K. C. et al. Accelerated lymphocyte death in sepsis occurs by both the death receptor and mitochondrial pathways. J. Immunol., 2005, 174, p. 5110–5118.
58. Felmet, K. A., Hall, M. W., Clark, R. S. et al. Prolonged lymphopenia, lymphoid depletion, and hypoprolactinemia in children with nosocomial sepsis and multiple organ failure. J. Immunol., 2005, 174, p. 3765–3772.
59. Kasten, K. R., Tschop, J., Adediran, S. G. et al. T cells are potent early mediators of the host response to sepsis. Shock, 2010, 34, p. 327–336.
60. Swan, R., Chung, C. S., Albina, J. et al. Polymicrobial sepsis enhances clearance of apoptotic immune cells by splenic macrophages. Surgery, 2007, 142, p. 253–261.
61. Pachot, A., Monneret, G., Voirin, N. et al. Longitudinal study of cytokine and immune transcription factor mRNA expression in septic shock. Clin. Immunol., 2005, 114, p. 61–69.
62. Korn, T., Bettelli, E., Oukka, M. et al. IL-17 and Th17 Cells. Annu. Rev. Immunol., 2009, 27, p. 485–517.
63. Zhu, J., Paul, W. E. Heterogeneity and plasticity of T helper cells. Cell Res., 2010, 20, p. 4–12.
64. Sakaguchi, S. Naturally arising CD4+ regulatory t cells for immunologic self-tolerance and negative control of immune responses. Annu. Rev. Immunol., 2004, 22, p. 531–562.
65. Feuerer, M., Shen, Y., Littman, D. R. et al. How punctual ablation of regulatory T cells unleashes an autoimmune lesion within the pancreatic islets. Immunity, 2009, 31, p. 654–664.
66. Sitkovsky, M. V. T regulatory cells: hypoxia-adenosinergic suppression and re-direction of the immune response. Trends Immunol., 2009, 30, p. 102–108.
67. Souza-Fonseca-Guimaraes, F., Dib-Conquy, M., Cavaillon, J. M.Natural killer (NK) cells in antibacterial innate immunity: angels or devils? Mol. Med., 2012, 18, p. 270–285.
68. Vivier, E., Raulet, D. H., Moretta, A. et al. Innate or adaptive immunity? The example of natural killer cells. Science, 2011, 331, p. 44–49.
69. Forel, J. M., Chiche, L., Thomas, G. et al. Phenotype and functions of natural killer cells in critically-ill septic patients. PLoS. One., 2012, 7, p. e50446.
70. Boomer, J. S., Shuherk-Shaffer, J., Hotchkiss, R. S. et al.A prospective analysis of lymphocyte phenotype and function over the course of acute sepsis. Crit. Care, 2012, 16, p. R112.
71. McDunn, J. E., Hotchkiss, R. S. Leukocyte phenotyping to stratify septic shock patients. Crit Care, 2009, 13, p. 127.
72. Gregoire, C., Chasson, L., Luci, C. et al. The trafficking of natural killer cells. Immunol. Rev., 2007, 220, p. 169–182.
73. Etogo, A. O., Nunez, J., Lin, C. Y. et al. NK but not CD1-restricted NKT cells facilitate systemic inflammation during polymicrobial intra-abdominal sepsis. J. Immunol., 2008, 180, p. 6334–6345.
74. Herzig, D. S., Driver, B. R., Fang, G. et al. Regulation of lymphocyte trafficking by CXC chemokine receptor 3 during septic shock. Am. J. Respir. Crit. Care Med., 2012, 185, p. 291–300.
75. Monserrat, J., de, P. R., Reyes, E. et al. Clinical relevance of the severe abnormalities of the T cell compartment in septic shock patients. Crit Care, 2009, 13, p. R26.
76. Andaluz-Ojeda, D., Iglesias, V., Bobillo, F. et al. Early natural killer cell counts in blood predict mortality in severe sepsis. Crit. Care, 2011, 15, p. R243.
77. de Pablo, R., Monserrat, J., Torrijos, C. et al. The predictive role of early activation of natural killer cells in septic shock. Crit Care, 2012, 16, p. 413.
78. Roark, C. L., French, J. D., Taylor, M. A. et al. Exacerbation of collagen-induced arthritis by oligoclonal, IL-17-producing gamma delta T cells. J. Immunol., 2007, 179, p. 5576–5583.
79. Han, G., Geng, S., Li, Y. et al. gammadeltaT-cell function in sepsis is modulated by C5a receptor signalling. Immunology, 2011, 133, p. 340–349.
80. Cheng, L., Cui, Y., Shao, H. et al. Mouse gammadelta T cells are capable of expressing MHC class II molecules, and of functioning as antigen-presenting cells. J. Neuroimmunol., 2008, 203, p. 3–11.
81. Sinha, P., Clements, V. K., Bunt, S. K. et al. Cross-talk between myeloid-derived suppressor cells and macrophages subverts tumor immunity toward a type 2 response. J. Immunol., 2007, 179, p. 977–983.
82. Gabrilovich, D. I., Nagaraj, S. Myeloid-derived suppressor cells as regulators of the immune system. Nat. Rev. Immunol., 2009, 9, p. 162–174.
83. Ochoa, A. C., Zea, A. H., Hernandez, C. et al. Arginase, prostaglandins, and myeloid-derived suppressor cells in renal cell carcinoma. Clin. Cancer Res., 2007, 13, p. 721s–726s.
84. Cuenca, A. G., Moldawer, L. L. Myeloid-derived suppressor cells in sepsis: friend or foe? Intensive Care Med., 2012, 38, p. 928–930.
85. Brudecki, L., Ferguson, D. A., McCall, C. E. et al. Myeloid-derived suppressor cells evolve during sepsis and can enhance or attenuate the systemic inflammatory response. Infect. Immun., 2012, 80, p. 2026–2034.
86. Derive, M., Bouazza, Y., Alauzet, C. et al. Myeloid-derived suppressor cells control microbial sepsis. Intensive Care Med., 2012, 38, p. 1040–1049.
87. Sansonetti, P. J. The innate signaling of dangers and the dangers of innate signaling. Nat. Immunol., 2006, 7, p. 1237–1242.
88. Monneret, G., Venet, F., Pachot, A. et al. Monitoring immune dysfunctions in the septic patient: a new skin for the old ceremony. Mol. Med., 2008, 14, p. 64–78.
89. Carrette, F., Surh, C. D. IL-7 signaling and CD127 receptor regulation in the control of T cell homeostasis. Semin. Immunol., 2012, 24, p. 209–217.
90. Kasten, K. R., Tschop, J., Goetzman, H. S. et al. T-cell activation differentially mediates the host response to sepsis. Shock, 2010, 34, p. 377–383.
91. Rendon, J. L., Choudhry, M. A. Th17 cells: critical mediators of host responses to burn injury and sepsis. J. Leukoc. Biol., 2012, 92, p. 529–538.
92. Iwakura, Y., Ishigame, H., Saijo, S. et al. Functional specialization of interleukin-17 family members. Immunity, 2011, 34, p. 149–162.
93. Nakada, T. A., Russell, J. A., Boyd, J. H. et al. IL17A genetic variation is associated with altered susceptibility to Gram-positive infection and mortality of severe sepsis. Crit. Care, 2011, 15, p. R254.
94. Oboki, K., Ohno, T., Kajiwara, N. et al. IL-33 is a crucial amplifier of innate rather than acquired immunity. Proc. Natl. Acad. Sci. U. S. A, 2010, 107, p. 18581–18586.
95. ves-Filho, J. C., Sonego, F., Souto, F. O. et al. Interleukin-33 attenuates sepsis by enhancing neutrophil influx to the site of infection. Nat. Med., 2010, 16, p. 708–712.
96. Mirchandani, A. S., Salmond, R. J., Liew, F. Y. Interleukin-33 and the function of innate lymphoid cells. Trends Immunol., 2012, 33, p. 389–396.
97. Bianchi, M. E., Manfredi, A. A. High-mobility group box 1 (HMGB1) protein at the crossroads between innate and adaptive immunity. Immunol. Rev., 2007, 220, p. 35–46.
98. Sunden-Cullberg, J., Norrby-Teglund, A., Rouhiainen, A. et al. Persistent elevation of high mobility group box-1 protein (HMGB1) in patients with severe sepsis and septic shock. Crit Care Med., 2005, 33, p. 564–573.
99. Bianchi, M. E. DAMPs, PAMPs and alarmins: all we need to know about danger. J. Leukoc. Biol., 2007, 81, p. 1–5.
100. Hotchkiss, R. S. Immunotherapy for Sepsis — A New Approach against an Ancient Foe. N. Engl. J. Med., 2010, 363, p. 87–89
Štítky
Anestéziológia a resuscitácia Intenzívna medicína
Článok vyšiel v časopiseAnesteziologie a intenzivní medicína
Najčítanejšie tento týždeň
2013 Číslo 4- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Metamizol v liečbe pooperačnej bolesti u opioid-tolerantnej pacientky – kazuistika
- e-Konzilium.cz — Masivní plicní embolie při tromboembolické nemoci
- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
-
Všetky články tohto čísla
- Historia magistra vitae…
- Quo vadis sepse?
- Anesteziologické aspekty ireverzibilní elektroporace karcinomu prostaty: antagonizace nervosvalové blokády sugammadexem vs. neostigminem – retrospektivní studie
- Desfluran umožňuje snadné provedení wake-up testu při operaci skoliózy u dětí – kazuistika
- EPOSS & SEPSIS-Q: návrh a popis řešení projektů pro sledování léčby, morbidity a mortality pacientůs těžkou sepsí v České republice
- Imunitní homeostáza (deregulace?) v sepsi a septickém šoku
- Ultrazvuk v zobrazení a kanylaci centrálního žilního systému
- Sarkoidóza plic
- Perioperační transfuzní léčba, management krvácivých stavů a velké krevní ztráty
- Co to je Anrepův efekt aneb Jak se srdeční sval vyrovnává s náhlým vzestupem afterloadu?
- Současná koncepce analgosedace v intenzivní péči
- Doporučený postup při výskytu maligní hypertermie
- Doporučený postup pro léčbu anafylaktické nebo anafylaktoidní reakce v průběhu anesteziologické péče
- Vývoj anesteziologie a resuscitace v kladenské nemocnici a vzpomínky primáře MUDr. Vladimíra Lemona
- Portréty Hugo Keszlera a Zdeňka Kalendy, průkopníků oboru
- Anesteziologie a intenzivní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Sarkoidóza plic
- Současná koncepce analgosedace v intenzivní péči
- Ultrazvuk v zobrazení a kanylaci centrálního žilního systému
- Perioperační transfuzní léčba, management krvácivých stavů a velké krevní ztráty
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



