-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Perioperační ischémiea infarkt myokardu
Perioperative myocardial ischaemia and myocardial infarction
Perioperative myocardial ischaemia and myocardial infarction have become a growing problem bringing an increase in mortality, hospital length of stay and financial costs. The incidence is higher postoperatively than in the immediate preoperative and perioperative period. There are two distinct patho-physiological mechanisms which may lead to perioperative myocardial infarction: myocardial injury related to the rupture, fissuring, erosion or dissection of an atherosclerotic plaque (myocardial infarction type 1) and prolonged imbalance in myocardial oxygen supply and demand (myocardial infarction type 2). The review article discusses the diagnostics (ECG, cardiac biomarkers, intraoperative ECHO), prevention (the question of preoperative myocardial revascularization) and management according to guidelines reflecting Evidence Based Medicine.
Keywords:
myocardial ischaemia – myocardial infarction – perioperative period
Autoři: Vaněk Tomáš 1; Špegár Ján 2
Působiště autorů: Kardiochirurgická klinika, 3. LF UK, Praha 1; Cardiothoracic Anaesthesia, Freeman Hospital, Newcastle upon Tyne, UK 2
Vyšlo v časopise: Anest. intenziv. Med., 25, 2014, č. 6, s. 418-426
Kategorie: Anesteziologie - Přehledový článek
Souhrn
Perioperační ischémie a infarkt myokardu jsou narůstajícím problémem zvyšujícím mortalitu, délku hospitalizace a související finanční náklady. Výskyt je častější v pooperačním období než bezprostředně před operací nebo během operace. K perioperačnímu infarktu myokardu mohou vést 2 odlišné patofyziologické mechanismy: poškození myokardu související s rupturou, ulcerací, fisurací, erozí nebo disekcí aterosklerotického plátu (infarkt myokardu typu 1) a déletrvající nepoměr mezi zásobením myokardu kyslíkem a jeho nároky (infarkt myokardu typu 2). Přehledový článek se zabývá diagnostikou (EKG, kardiospecifické enzymy, intraoperační ECHO), prevencí (otázka předoperační revaskularizace myokardu) a terapií dle doporučení, která reflektují medicínu založenou na důkazech.
Klíčová slova:
ischémie myokardu – infarkt myokardu – perioperační obdobíÚVOD
Světovou populaci tvoří v tuto chvíli asi 7,114 miliard obyvatel a tomuto počtu obyvatel Země je každoročně provedeno více než 230 milionů chirurgických výkonů, které jsou označovány jako „major surgery“ [1]. Třicetidenní mortalita u středně či vysoce rizikových pacientů přesahuje 2 %, avšak významně převyšuje 5 % v případě, že jsou u nemocných přítomny kardiovaskulární rizikové faktory [2, 3]. S tím, jak populace stárne, je operováno stále více pacientů ve vysokém nebezpečí kardiovaskulárních příhod, které jsou příčinou více než poloviny úmrtí [4]. Perioperační ischémie a infarkt myokardu jsou narůstajícím problémem zvyšujícím mortalitu, délku hospitalizace a finanční náklady související s léčbou.
U pacientů s ischemickou chorobou srdeční je udávaná incidence perioperační ischémie myokardu v rozmezí 20–63 %, přičemž výskyt je častější v pooperačním období než v době bezprostředně před operací a během operace (poměr přibližně 3 : 1 až 5 : 1) [5]. Mnoho ischemických příhod má svůj počátek na konci chirurgického výkonu ve fázi probouzení z anestezie, kdy mohou být zvýšeny srdeční frekvence, krevní tlak, tonus sympatiku a prokoagulační aktivita.
Ischémie myokardu je stav neadekvátní oxygenace myokardu spojený s hromaděním anaerobních metabolitů v případě, že spotřeba kyslíku převyšuje jeho nabídku. Akutní infarkt myokardu (AIM) je definován jako smrt srdečních myocytů způsobená déletrvající ischémií. Pojem by měl být užíván tehdy, je-li k dispozici průkaz myokardiální nekrózy v klinické situaci odpovídající akutní myokardiální ischémii [6, 7].
PATOFYZIOLOGIE
K perioperačnímu AIM mohou vést dva odlišné mechanismy:
- Jako infarkt myokardu typu 1 je označováno poškození myokardu související s rupturou, ulcerací, fisurací, erozí nebo disekcí aterosklerotického plátu a následným vznikem intraluminálního trombu v jedné nebo více koronárních tepnách. To vede ke snížení průtoku krve myokardem a trvá-li přerušení průtoku více než 20 až 30 minut, dojde k postupné nekróze srdečních myocytů. Situace může být dále ještě zhoršena distální embolizací mikrotrombů a koronární vazokonstrikcí, která je navozena systémovou aktivací sympatiku a lokálním uvolněním vazokonstrikčních mediátorů.
- Pojem infarkt myokardu typu 2 je užíván v souvislosti s poškozením myokardu při nerovnováze mezi zásobením myokardu kyslíkem a jeho nároky, ať již v přítomnosti či nepřítomnosti obstrukce koronárního řečiště.
V současné době je široce přijímáno, že klíčovou roli v procesu vzniku instability aterosklerotického plátu a následné intraluminální trombózy v koronární tepně hrají lokální zánětlivé mechanismy (obr. 1), avšak na vzniku perioperačního infarktu myokardu se nepochybně podílejí i následující faktory [8]:
- stresový stav, který zahrnuje zvýšené hladiny katecholaminů a kortizolu. Hladiny těchto hormonů vzrůstají v souvislosti s celkovou anestezií, ukončením anestezie s extubací, nedostatečnou analgezií, rozsahem chirurgického traumatu, anémií a hypotermií. Zvýšené hladiny stresových hormonů mají za důsledek hypertenzi, zvýšenou srdeční frekvenci, poruchu kvality krevního průtoku koronárním řečištěm (tzv. lokální „shear stress“ – tj. třecí síla aplikovaná pohybující se krví na povrch cévy, respektive na buňky endotelu), relativní inzulinovou deficienci a ovlivnění hladiny volných mastných kyselin. Koronární „shear stress“ může být spouštěčem ruptury aterosklerotického plátu a následné akutní koronární trombózy;
- hyperkoagulační stav, který je způsoben zvýšením hladiny fibrinogenu, faktoru VIII, von Willebrandova faktoru, α1-antitrypsinu spolu s aktivací krevních destiček a se snížením hladin přirozených antikoagulantů (protein C, antitrombin III, α2-makroglobulin). Současně může být také snížena fibrinolytická aktivita;
- zánětlivý stav zahrnuje zvýšení tumor necrosis faktoru α (TNF-α), interleukinů (IL)-1 a IL-6 a C-reaktivního proteinu. Je předpoklad, že tyto faktory mohou mít přímý vliv na počátek fisurace aterosklerotického plátu;
- hypoxický stav je důsledkem anémie, hypotermie s třesavkou a neadekvátní ventilace během celkové anestezie či analgosedace. V pooperačním období se může uplatnit vliv opioidních analgetik, nebo naopak snížená ventilace způsobená bolestí v operační ráně.
Obr. 1. Vznik, vývoj a komplikace koronárního aterosklerotického plátu 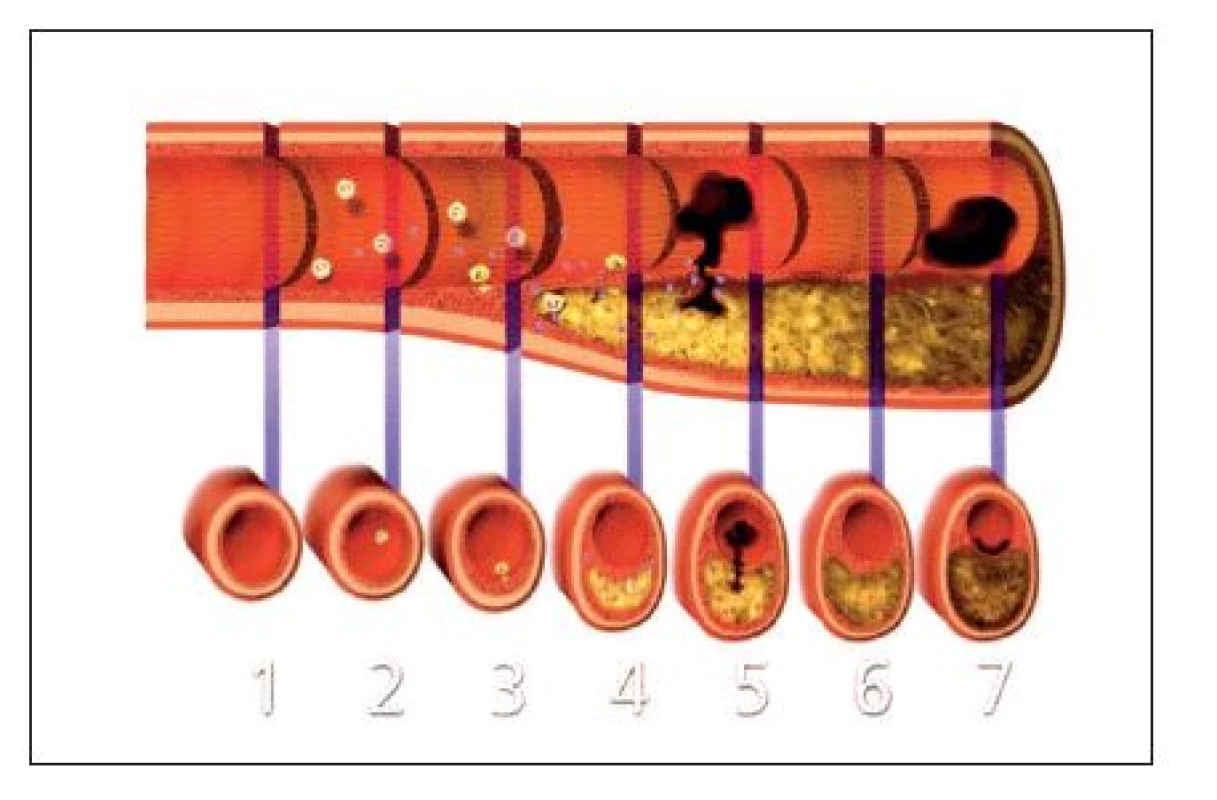
Nahoře: longitudinální řez tepnou zobrazující vývoj aterogeneze od normální arterie (1) k ateromu, který způsobuje klinickou manifestaci trombózy a koronární stenózu (5, 6, 7). Dole: příčný řez tepnou během různých vývojových stadií ateromu. 1. Normální arterie. 2. Aktivované buňky endotelu exprimují adhezivní a chemoatraktivní molekuly. Dochází k adhezi leukocytů (monocytů a T-lymfocytů) a v intimě k počátku akumulace extracelulárních lipidů. 3. Vývoj do fibroateromatózního stadia. Monocyty adherované na stěnu arterie se přeměňují na makrofágy a exprimují „scavengerové“ receptory, které váží modifikované lipoproteiny. Makrofágy se postupně transformují v pěnové buňky. Leukocyty a rezidentní buňky cévní stěny secernují prozánětlivé cytokiny a růstový faktor, které zesilují adhezi leukocytů a zapříčiňují migraci a proliferaci buněk hladkého svalstva. 4. Zánětlivé mediátory způsobují expresi tkáňového faktoru, potentního prokoagulantu a matrix-degradujících proteináz, které zeslabují fibrózní čepičku plátu. 5. Jestliže dojde k ruptuře zeslabené čepičky plátu, koagulační faktory krve získají přístup k trombogennímu lipidovému jádru obsahujícímu tkáňový faktor, což způsobuje neokluzivní trombózu aterosklerotického plátu. V případě porušené rovnováhy mezi protrombotickými a fibrinolytickými mechanismy může dojít ke vzniku okluzivního (obstrukčního) trombu, který může způsobit akutní koronární syndrom. 6. Resorpce trombu je spojena s uvolněním trombinu a mediátorů z degranulovaných krevních destiček (destičkový růstový faktor, růstový faktor β). To vede ke zvýšené akumulaci kolagenu a růstu buněk hladkého svalstva. Fibroateromatózní léze se může vyvinout ve zralý a často kalcifikovaný plát, který způsobuje stenózu a klinické příznaky stabilní anginy pectoris. 7. V některých případech okluzivní (obstrukční) tromby nevznikají rupturou fibrózní čepičky, ale povrchovou erozí endoteliální vrstvy. Výsledkem je trombus ve stěně cévy, jehož vznik je opět závislý na místní rovnováze mezi protrombotickými a fibrinolytickými mechanismy a který může způsobit akutní infarkt myokardu. Povrchové eroze často komplikují pokročilé stenotické léze. (Převzato z: Libby, P. Current concepts of the pathogenesis of the acute coronary syndromes. Circulation 2001;104:365–372. Práva k reprodukci v Anesteziologii a intenzivní medicíně jsou v držení autorů článku – T. V. a J. Š.) DIAGNOSTIKA
Diagnostika perioperační ischémie myokardu a AIM může být velmi svízelná. U pacienta v celkové anestezii samozřejmě scházejí subjektivní obtíže (bolest či diskomfort na hrudi, v horní končetině, v oblasti mandibuly nebo epigastria) a tato nepřítomnost subjektivních stesků může přetrvávat i do pooperačního období. Podezření na myokardiální ischémii a AIM je tedy nutno vyslovit při náhle vzniklé přítomnosti elektrokardiografických známek ischémie, hypotenzi, arytmiích a známkách městnavého srdečního selhání. Jak vyplývá z předchozího textu, „zlatým standardem“ při finální diagnostice poškození myokardu jsou srdeční biomarkery, především srdeční troponiny (cTn) I a T.
Elektrokardiografická (EKG) diagnostika
U nemocných s ischemickým poškozením myokardu může dojít k následujícím změnám ST úseků (> 1 mm) nejméně ve dvou sousedních svodech (12svodové monitorování) z jedné oblasti:
- depresi úseku ST, pak hovoříme (pokud došlo k následné elevaci biomarkerů) o infarktu myokardu bez elevací úseku ST (non-ST elevation IM, non-STEMI);
- elevaci úseku ST, pak situaci označujeme jako infarkt myokardu s elevacemi úseku ST (ST elevation IM, STEMI). Obecně lze říci, že prolongovaná elevace úseků ST je obrazem totální koronární okluze. U mnoha pacientů s infarktem myokardu se vyvinou kmity Q (Q-IM), zatímco u jiných nikoliv (non-Q-IM);
- změny vlny T (oploštění nebo inverze) představují časnou známku ischémie, která může předcházet elevaci nebo depresi úseku ST, avšak je nutno mít na paměti, že tyto abnormality vlny T mohou být způsobeny řadou příčin neischemického původu.
Počítačová automatická analýza změn úseků ST je více citlivá než vizuální hodnocení. Důležitý je správný výběr hodnocených svodů a přesné umístění elektrod. Současné monitorování a analýza svodů II a V5 je schopna odhalit 80 % změn úseků ST, avšak při kombinaci svodů II, V4 a V5 již vzrůstá senzitivita na 96 % [9, 10].
V perioperačním období je mnohem častější výskyt depresí úseků ST než četnost výskytu ST elevací a protrahovaná ischémie s depresemi je nejčastější příčinou rozvoje perioperačního AIM [11, 12]. Tato ischémie může být zpočátku jinak klinicky němá, což může být fatální zvláště pro nemocné ve vyšších věkových skupinách [13]. Nesnadná může být detekce perioperačního AIM u pacientů s blokem levého nebo pravého raménka Tawarova a také u infarktu pravé komory srdeční. Normální EKG nevylučuje diagnózu perioperačního AIM a v případě podezření myslíme na možnost přidání dalších svodů a na porovnání s předchozím EKG záznamem.
Hypotenze
Perioperační hypotenze je poměrně častým jevem, jehož souvislost a propojenost se vznikem ischemických příhod je zřejmá. Většina autorů definuje perioperační hypotenzi jako pokles systolického krevního tlaku pod 90 mm Hg nebo o 20 % výchozí hodnoty u jinak normotenzního pacienta [14]. Platí následující vztah:
BP = HR x SV x SVR
přičemž BP = krevní tlak (blood pressure),
HR = srdeční frekvence (heart rate), SV = tepový objem (stroke volume), SVR = systémová vaskulární rezistence (systemic vascular resistance).
Tepový objem je závislý na předtížení (preload), dotížení (afterload) a srdeční kontraktilitě. Krevní tlak je tedy závislý na tepové frekvenci, předtížení, dotížení, kontraktilitě a systémové vaskulární rezistenci. Velmi častou příčinou perioperační hypotenze je kombinace hypovolémie (např. při krvácení) a poklesu vaskulárního tonu. Srdce je schopno přechodně tuto situaci kompenzovat zvýšením své kontraktility, avšak při ischémii může být tato rezerva vyčerpána velmi záhy. Patofyziologické mechanismy vedoucí k perioperační hypotenzi jsou uvedeny v tabulce 1.
Tab. 1. Etiologické mechanismy hypotenze 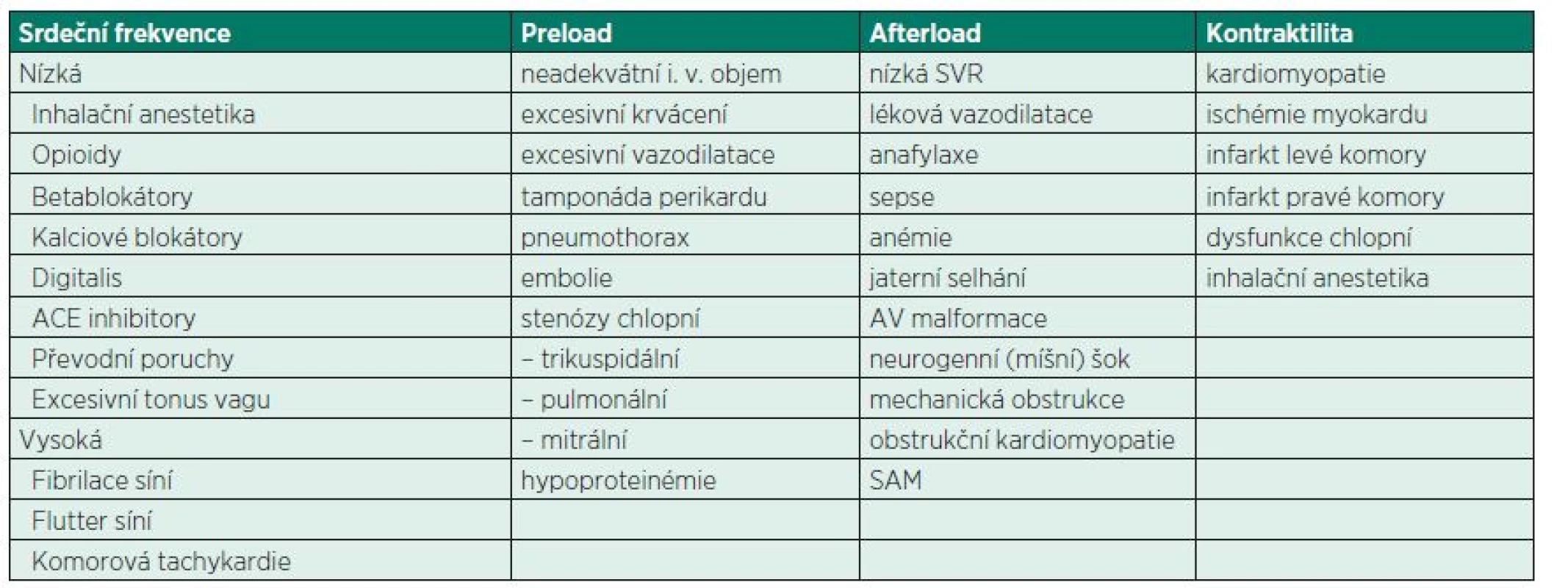
SAM (systolic anterior motion of mitral valve) (Převzato z: Singh, A., Antognini, J. F. Perioperative hypotension and myocardial ischemia: Diagnostic and therapeutic approaches. Ann. Card. Anaesth. 2011;14:127–132. S laskavým svolením Wolters Kluwer.) Biomarkery
Preferovanými biomarkery, prostřednictvím kterých je detekována nekróza myokardu, jsou srdeční troponiny I nebo T. Jsou vysoce specifické pro myokardiální tkáň a zároveň mají vysokou senzitivitu. Elevaci srdečních troponinů můžeme očekávat do 2–4 hodin od vzniku nekrózy, přičemž zvýšená koncentrace troponinů je definována jako hodnota vyšší než 99. percentil referenční populace zdravých osob (upper reference limit – URL). Pro stanovení diagnózy infarktu myokardu je zapotřebí vzestupu a následného poklesu hodnot, přičemž alespoň jedna musí přesahovat hodnotu URL. V případě nedostupnosti vyšetření srdečních troponinů je alternativou stanovení hmotnostní koncentrace MB frakce kreatinkinázy (CK-MB mass).
Nově je zaveden pojem „myocardial injury after noncardiac surgery – MINS“, který je definován jako „prognosticky závažné poškození myokardu v důsledku ischémie, ke kterému došlo v průběhu operace nebo do 30 dnů po ní“ [15]. Vyskytuje se u 8 % pacientů po nekardiochirurgických výkonech, přičemž 58 % z těchto nemocných nesplňuje kritéria podle „Třetí univerzální definice infarktu myokardu“ a 10 % pacientů s MINS zemře do 30 dnů po operaci [16]. Diagnóza MINS je postavena na zvýšené koncentraci troponinu a bez pooperačního monitorování koncentrace troponinu není MINS ve většině případů rozpoznáno. Z tohoto důvodu se doporučuje u vysoce rizikových pacientů podstupujících nekardiochirurgické operační výkony koncentrace troponinu v perioperačním období monitorovat.
Zvýšení koncentrace troponinu nemusí být vždy jen ischemického původu. V diferenciální diagnostice je třeba odlišit nekoronární a neischemické kardiální příčiny, které mohou způsobovat elevaci hodnot srdečních troponinů (např. kontuze srdce, kardiostimulace, defibrilace, myokarditida, rabdomyolýza s postižením srdce) a další nekardiální příčiny (např. sepse, selhání ledvin, těžká akutní neurologická onemocnění jako cévní mozková příhoda, respektive subarachnoidální krvácení) [6, 7].
Echokardiografické vyšetření
Echokardiografické vyšetření je doporučeno provést ke zhodnocení globální funkce levé komory srdeční, k detekci regionálních poruch kinetiky a k vyloučení některých dalších diagnóz onemocnění srdce. Upřednostňováno je jícnové echokardiografické vyšetření před transtorakálním, avšak vše závisí na konkrétní situaci a personálním a přístrojovém vybavení pracoviště.
PREVENCE
Z anesteziologického hlediska nás zajímá, který z pacientů je v perioperačním období bezprostředně ohrožen vznikem kardiovaskulární příhody. Od roku 1970 bylo vyvinuto několik algoritmů/skórovacích systémů odhadujících kardiovaskulární riziko u nekardiochirurgických výkonů, jako např. Goldmanův multifaktoriální index [17], klasifikace tělesného stavu pacienta podle Americké anesteziologické společnosti (ASA) [18], modifikovaný index podle Detského [19] a poměrně široce užívaný Leeho revidovaný srdeční rizikový index [20]. Zde je detekce vysoce rizikových pacientů založena na přítomnosti 6 nezávislých rizikových faktorů: ischemické choroby srdeční, městnavé choroby srdeční, cerebrovaskulární nemoci, vysoce rizikové operace, inzulin dependentního diabetu a před-operační hodnotě kreatininu > 177 µmol/l. Poměrně nedávno uveřejněný NSQIP MICA model zohledňuje chirurgický výkon, funkční stav pacienta, předoperační hodnotu kreatininu > 130 µmol/l, tělesný stav nemocného podle ASA a jeho věk [21].
U pacientů se známým onemocněním srdce nás zajímají následující otázky:
- Jaké množství myokardu je v ohrožení?
- Jaký je práh zátěže pro vznik ischémie?
- Jaké je pacientova funkce srdečních komor?
- Je nemocný na optimální medikamentózní terapii?
Pro pacienty s hypertenzní chorobou 3. stupně (systolický tlak krve ≥ 180 mm Hg a diastolický tlak ≥ 110 mm Hg) se zamýšlíme nad nezbytnou optimalizací a fortifikací antihypertenzní terapie.
Předoperační revaskularizační terapie (chirurgická revaskularizace myokardu, perkutánní koronární intervence)
Benefit profylaktické revaskularizační terapie před nekardiochirurgickym výkonem se snažilo zhodnotit několik studií. V roce 2004 pub-likoval McFalls studii CARP (Coronary Artery Revascularization Prophylaxis), do které zahrnul 510 nemocných [22]. Zjistil, že u pacientů se stabilní ICHS, kteří podstoupili nebo nepodstoupili revaskularizační terapii (chirurgickou revaskularizaci myokardu – CABG/perkutánní koronární angioplastiku – PCI) před cévním chirurgickým výkonem, se krátkodobé riziko vzniku náhle smrti nebo infarktu myokardu ani dlouhodobý výsledek přežití významně nelišily. Je však třeba uvést, že velká většina pacientů, kteří byli zahrnuti do studie, byli pacienti s onemocněním jedné nebo dvou srdečních tepen a se zachovalou funkcí levé komory srdeční.
Otázku, zda je u kardiálně vysoce rizikových nemocných prospěšná revaskularizační terapie před cévním výkonem, zkoumala pilotní studie DECREASE-V [23]. U 101 pacientů ze skupiny 430 identifikovaných vysoce rizikových nemocných autoři detekovali zátěží vyvolanou rozsáhlou ischémii myokardu. Z těchto nemocných poté 49 podstoupilo před cévní operací CABG (n = 17) nebo PCI (n = 32) a 52 nebylo revaskularizováno vůbec. Revaskularizační terapie nebyla spojena s lepším krátkodobým ani dlouhodobým efektem, avšak studie byla kritizována za malou velikost vzorku pacientů.
Vyvstává tedy otázka, zda je vždy nezbytné trvat na revaskularizaci před nekardiochirurgickou operací. Z pohledu současných „guidelines“ se zdá být jednoznačně doporučeno indikovat revaskularizační terapii před nekardiochirurgickým výkonem u pacientů se stabilní anginou pectoris a se signifikantní stenózou (> 50 %) kmene levé koronární arterie, proximální stenózou (> 50 %) ramus interventricularis anterior, při nemoci 2–3 věnčitých tepen a snížené ejekční frakci levé komory srdeční (EF LKS)/městnavém srdečním selhání nebo detekovanou ischémií (> 10 % LKS) na zátěžovém testu, u nestabilní anginy pectoris nebo non-STEMI a u akutního STEMI [24, 25].
Problémem k diskusi je též správně zvolená revaskularizační strategie: CABG nebo PCI s balonkovou angioplastikou, PCI s holým kovovým stentem (bare-metal stent) či PCI se stentem uvolňujícím léky? Přesto, že jsou terapeutické výsledky CABG a PCI před nekardiochirurgickým výkonem srovnatelné, dlouhodobě lepší efekt CABG je možné pozorovat u pacientů s cukrovkou a s mnohonásobným onemocněním věnčitých tepen [26, 27, 28].
Předoperační PCI
Balonková koronární angioplastika
Na základě dostupné literatury je vhodné odložit chirurgický výkon minimálně o 2–4 týdny po provedené angioplastice, aby byl ponechán dostatečný čas ke zhojení poškozené cévy v místě angioplastiky. Odložením operace o více jak 8 týdnu se zvyšuje možnost restenózy v dilatovaném místě a riziko perioperačního infarktu myokardu [29]. Nemocní jsou po balonkové koronární angioplastice bez implantace stentu léčeni pouze kyselinou acetylsalicylovou.
PCI s holým kovovým stentem
Volba u operací za více jak 4 týdny po implantaci stentu. Duální protidestičková terapie (kyselina acetylsalicylová + clopidogrel) je užívána 1 měsíc, poté bývá clopidogrel pacientům vysazen. Největší pravděpodobnost trombózy holého kovového stentu je v prvních 2 týdnech po implantaci. Více jak 4 týdny po implantaci je mimořádně vzácná [30].
PCI se stentem uvolňujícím léky
Volba postupu u plánovaných operací za více než 6–12 měsíců. Duální protidestičková terapie je ponechávána minimálně 6 měsíců po implantaci (u novějších generací těchto stentů – 1. generace: sirolimus, paclitaxel, 2. generace: everolimus, zotarolimus, 3. generace: biodegradabilní, bezpolymerové stenty), v individuálních případech je vysazována až za 9 či 12 měsíců, poté jsou nemocní ponecháváni na terapii kyselinou acetylsalicylovou [31].
Výše popsaná doporučení antiagregační/protidestičkové terapie se týkají perkutánních koronárních intervencí pro chronickou ischemickou chorobu srdeční, nikoliv akutních koronárních syndromů.
Na rozdíl od situace, kdy pacient podstoupil PCI, je správné a bezpečné načasování nekardiochirurgické operace u nemocného po CABG méně jasné. Lze usuzovat, že asymptomatický pacient, který podstoupil CABG, je v době do 6 let po revaskularizaci myokardu relativně dobře chráněn před vznikem kardiovaskulárních příhod tehdy, pokud má zachovanou dobrou funkci levé komory srdeční. V retrospektivní studii, která zahrnovala 211 nemocných operovaných do jednoho roku po CABG, autoři zjistili následující prediktory perioperační mortality: EF LKS < 45 %, systolický tlak v pravé komoře srdeční > 40 mm Hg a emergentní výkon [32]. Srdeční komplikace po nekardiochirurgických výkonech jsou závislé i na operační zátěži pro nemocného. Chirurgické intervence lze z tohoto pohledu dělit na výkony s nízkým (do 1 %), středním (1–5 %) a vysokým (> 5 %) rizikem [33].
Z patofyziologického hlediska bychom se měli zamýšlet nad klinickým významem tzv. „nesignifikantních stenóz“ koronárního řečiště. Tyto stenózy jsou náchylné k ruptuře plátu v období stresem indukovaného chirurgického zatížení. Jejich významnost potvrzují i nálezy z autopsií, ve kterých přispívají k více než polovině peri-operačních infarktů myokardu [34]. S tím souvisí správný peroperační management pacienta, který by měl vést ke snížení perioperačního stresu pa-cienta (úloha premedikace, dostatečné perioperační analgezie, ale též ponechání pacientů na betablokátorech a statinech).
TERAPIE
Předoperační nebo pooperační léčba ischémie nebo infarktu myokardu je zpravidla vedena kardiologem, v případě intraoperační ischémie/infarktu hraje klíčovou úlohu v terapeutickém procesu anesteziolog. Jsou-li ischémie/infarkt myokardu diagnostikovány před kožním řezem, měl by být chirurgický výkon odložen a nemocný by měl být podroben další příslušné léčbě podle svého stavu a rozhodnutí kardiologa. V případě, že již nelze chirurgický výkon zastavit, je nutno stav pacienta co nejvíce stabilizovat především zlepšením průtoku koronárním řečištěm a zvýšením nabídky/snížením spotřeby kyslíku. Další sled opatření se bude odvíjet od konkrétního stavu, ve kterém se nemocný nachází, a od rizika krvácení spojeného s operací. Obecný terapeutický algoritmus ukazuje obrázek 2, další léčebná opatření vycházejí především ze zde uvedených doporučení (2014 ESC/ESA Guidelines on non-cardiac surgery: cardiovascular assessment and management: The Joint Task Force on non-cardiac surgery: cardiovascular assessment of the European Society of Cardiology (ESC) and European Society of Cardiology (ESA) [35], 2014 ACC/AHA Guideline on Perioperative Cardiovascular Evaluation and Management of Patients Undergoing Noncardiac Surgery [36], 2013 ACCF/AHA Guideline for the Management of ST--Elevation Myocardial Infarction [37], ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation [38], ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation [39]).
Obr. 2. Základní algoritmus terapie perioperačního infarktu myokardu 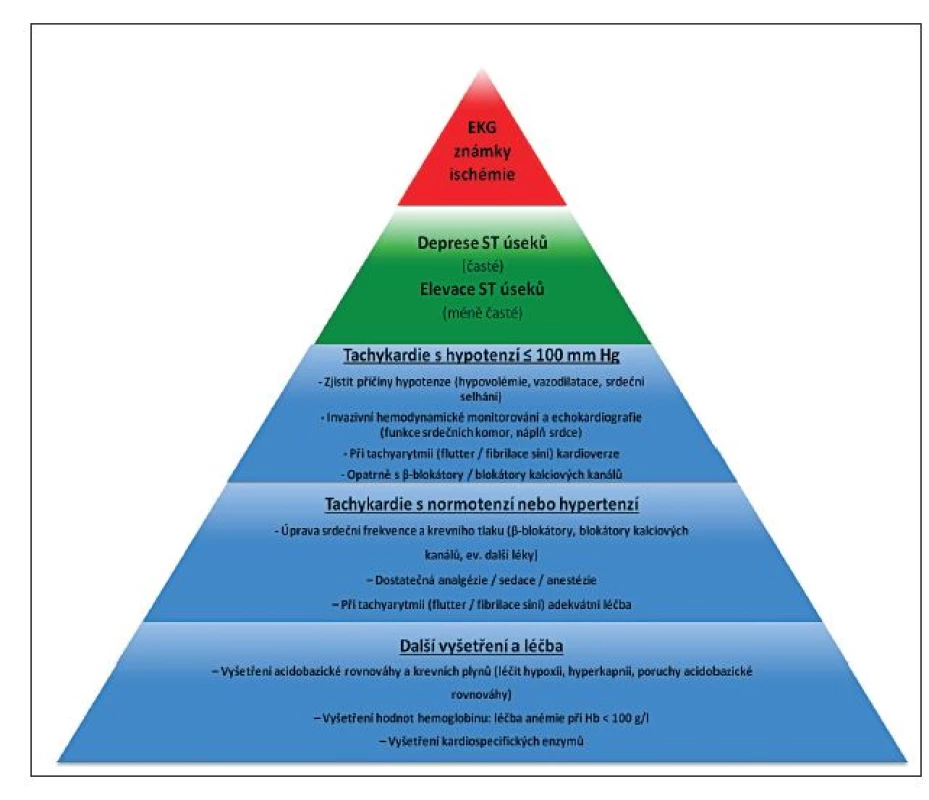
(Volně podle [8]: Landesberg, G., Beattie, W.S., Mosseri, M., Jaffe, A.S., Alpert, J. S. Perioperative myocardial infarction. Circulation 2009;119:2936–2944.) Po stanovení diagnózy perioperační ischémie nebo infarktu myokardu bychom měli bez odkladu přistoupit k pečlivému monitorování vitálních funkcí. Automatické neinvazivní sledování krevního tlaku je nepodkročitelným základem, při hemodynamické nestabilitě je preferováno přímé měření krevního tlaku kanylací tepenného řečiště. Je nezbytné, abychom přistoupili k agresivní léčbě hypotenze s cílem udržet dostatečně vysoký koronární perfuzní tlak:
CPP = DBP – LVEDP
přičemž CPP = koronární perfuzní tlak (coronary perfusion pressure), DBP = diastolický krevní tlak (diastolic blood pressure), LVDEP = tlak v levé komoře na konci diastoly (left ventricle end diastolic pressure).
Středně významná hypotenze často dobře zareaguje na intravenózní expanzi objemu 300–500 ml krystaloidního roztoku. Jestliže přes volumexpanzi hypotenze přetrvává (systolický krevní tlak 60–80 mm Hg), je třeba do terapie přidat kontinuální vazopresorickou a eventuálně i inotropní podporu. Nitráty je možno podat intravenózně pacientům s příznaky ischémie, kteří nemají hypotenzi (systolický krevní tlak < 90 mm Hg), bradykardii (srdeční frekvence < 50/min.), tachykardii (srdeční frekvence > 100/min.) a předpokládaný či potvrzený infarkt pravé komory srdeční. Mohou být prospěšné při srdečním selhávání (snížením předtížení levé komory srdeční) a při vazospasmu, avšak jejich preventivní užití není doporučeno (Třída III, Úroveň důkazů B) [36]. Při rozhodování, zda nemocnému s hraničním krevním tlakem podat nitrát nebo betablokátor, bychom měli volit účinnější a prospěšnější betablokátor (inhibice účinku cirkulujících katecholaminů na myokard, redukce spotřeby kyslíku snížením srdeční frekvence a kontraktility). Je vhodné titrovat intravenózní betablokátor, se kterým máme největší zkušenosti, případně zvolit betablokátor s krátkodobou účinností (esmolol).
V situaci perioperační či intraoperační oběhové nestability je doporučeno bez odkladu provést jícnové echokardiografické vyšetření (Třída I, Úroveň důkazů C) [35]. Při přítomnosti závažné dysfunkce levé komory srdeční nemusí být informace o hodnotě centrálního žilního tlaku pro další léčbu dostatečná, a proto je třeba zvážit zavedení plicnicového katétru. Jestliže je tlak v zaklínění nižší než 12 mm Hg, je třeba pokračovat v expanzi intravaskulárního objemu. Při vysokém tlaku v zaklínění je nutno uvažovat o kontinuální inotropní podpoře katecholaminy (dopamin, dobutamin, adrenalin). Výhodné je použití inhibitoru fosfodiesterázy III (milrinon), který má jak pozitivně inotropní, tak vazodilatační účinky. V případě neúspěchu výše uvedených postupů a rozvoji kardiogenního šoku je třeba zvážit perkutánní zavedení intraaortální balonkové kontrapulzace (Třída IIa, Úroveň důkazů B) či při její dostupnosti i jiné srdeční podpory (Třída IIb, Úroveň důkazů C) [37].
Protidestičková, antitrombotická a revaskularizační treapie
Bezprostředně po stanovení diagnózy ischémie nebo AIM je třeba pacientovi podat kyselinu acetylsalicylovou v dávce 162–325 mg (150–300 mg) (Třída I, Úroveň důkazů A) [37, 38, 39]. Po společném posouzení rizika krvácení spolu s operatérem je vhodné intravenózně aplikovat nefrakcionovaný heparin (bolus 60 IU/kg – maximálně 4000 IU, následovaný kontinuální infuzí 12 IU/kg/hod.) tak, aby aPTT ratio bylo v rozmezí 1,5–2,0 (aPTT 50–70 sec.) (Třída I, Úroveň důkazů C) [37, 38].
V případě STEMI může být namísto nefrakcio-novaného heparinu preferován nízkomolekulární heparin (LMWH – low molecular weight heparin) enoxaparin (Třída IIb, Úroveň důkazů B) [38]. Způsob jeho podání a dávka se liší podle věku nemocného (< 75 roků – 30 mg i. v. jako bolus následovaný po 15 minutách subkutánní dávkou1 mg/kg, která má být opakována 2krát denně,> 75 roků – bez intravenózního bolusu subkutánně 0,75 mg/kg 2krát denně). Alternativou je fondaparinux 2,5 mg i. v. jako bolus, následovaný subkutánní dávkou 2,5 mg 1krát denně.
V případě non-STEMI je též možno místo nefrakcionovaného heparinu aplikovat subkutánně LMWH (upřednostňován je fondaparinux 2,5 mg – Třída I, Úroveň důkazů A, při jeho nedostupnosti enoxaparin 1 mg/kg 2krát denně – Třída I, Úroveň důkazů B) [39].
Při užití LMWH intraoperačně anebo bezprostředně po operaci je třeba mít na mysli, že zatímco účinek nefrakcionovaného heparinu při závažném krvácení může být snadno zrušen podáním protaminu, antagonizace anti-Xa aktivity LMWH protaminem může být pouze částečná a klinicky obtížná [40].
Je vhodné zvážit, ve spolupráci s kardiologem a operatérem, též přínos/rizika podání intravenózních blokátorů destičkových receptorů GP IIb/IIIa (abciximab, tirofiban, eptifibatide) či, pokud je nemocný schopen přijímat perorální léčbu, dalších protidestičkových léků (např. ze skupiny inhibitorů receptoru P2Y12 – clopidogrel, prasugel, ticagrelor). Trombolytická terapie (optimálně do 4 hodin, nejpozději do 12 hodin po vzniku ischémie) je ve většině případů vzhledem k chirurgickému výkonu kontraindikována. Ve zdravotnickém zařízení, ve kterém je k dispozici katetrizační laboratoř, je třeba uvažovat o velmi časném transportu nemocného k provedení PCI.
ZÁVĚR
Ke vzniku perioperační ischémie myokardu mohou vést dva různé patofyziologické mechanismy, přičemž častější je infarkt myokardu typu 2, který je způsoben nerovnováhou mezi zásobením myokardu kyslíkem a jeho nároky, často již při předoperačně přítomné ischemické chorobě srdeční. Na tuto závažnou perioperační komplikaci je třeba myslet v situaci byť minimálních ischemických EKG změn, arytmií, tachykardie či jinak nevysvětlitelné hypotenze a časně zahájit adekvátní léčbu podle doporučení, která reflektují medicínu založenou na důkazech.
Třídy doporučení a úroveň důkazů
Třída I Existují důkazy a/nebo obecná shoda, že daný postup nebo léčba jsou prospěšné a účinné.
Třída II Rozporuplné důkazy a/nebo rozdílné názory na užitečnost a prospěšnost daného postupu nebo léčby.
Třída IIa Většina důkazů a poznatků ukazuje na užitečnost a účinnost postupu/léčby.
Třída IIb Užitečnost a účinnost daného postupu jsou méně přesvědčivě podloženy důkazy a poznatky.
Třída III Existují důkazy nebo obecná shoda, že daný postup nebo léčba nejsou užitečné a prospěšné a v některých případech mohou být škodlivé.
Úroveň důkazů A Data jsou odvozena z několika velkých randomizovaných klinických studií nebo z metaanalýzy.
Úroveň důkazů B Data jsou odvozena z jedné randomizované klinické studie nebo z velkých nerandomizovaných studií.
Úroveň důkazů C Existuje všeobecný souhlas odborníků založený na menších studiích, retrospektivních studiích a registrech.
Práce byla prezentována formou přednášky na XXI. kongresu ČSARIM v Olomouci.
Do redakce došlo dne 25. 8. 2014.
Do tisku přijato dne 12. 9. 2014.
Adresa pro korespondenci:
Prof. MUDr. Tomáš Vaněk, CSc.
Kardiochirurgická klinika 3. LF UK
Ruská 87
100 00 Praha 10
e-mail: tomas.vanek@fnkv.cz
MUDr. Ján Špegár, Ph.D.
Cardiothoracic Anaesthesia
Freeman Hospital
Freeman Rd.
Newcastle upon Tyne
Tyne on Wear NE7 7DN, UK
Zdroje
1. Weiser, T. G., Regenbogen, S. E., Thompson, K. D. et al. An estimation of the global volume of surgery: a modelling strategy based on available data. Lancet, 2008, 372, p. 139–144.
2. Lee, T. H., Marcantonio, E. R., Mangione, C. M. et al. Derivation and prospective validation of a simple index for prediction of cardiac risk of major non-cardiac surgery. Circulation, 1999, 100, p. 1043–1049.
3. Fleisher, L. A., Eagle, K. A., Shaffer, T., Anderson, G. F. Perioperative - and long-term mortality rates after major vascular surgery: the relationship to preoperative testing in the medicare population. Anesth. Analg., 1999, 89, p. 849–855.
4. Grobben, R. B., van Klei, W. A., Grobbee, D. E., Nathoe, H. M.The aetiology of myocardial injury after non-cardiac surgery. Neth. Heart J., 2013, 21, p. 380–388.
5. Mangano, D. T., Browner, W. S., Hollenberg, M., London, M. J., Tubau, J. F., Tateo, I. M. Association of perioperative myocardial ischemia with cardiac morbidity and mortality in men undergoing noncardiac surgery: the Study of Perioperative Ischemia Research Group. N. Engl. J. Med., 1990, 323, p. 1781–1788.
6. Thygesen, K., Alpert, J. S., Jaffe, A. S., Simoons, M. L., Chaitman, B. R., White, H. D., The Writing Group on behalf of the Joint ESC/ACCF/AHA/WHF Task Force for the Universal Definition of Myocardial Infarction. Third universal definition of myocardial infarction. Europ. Heart J., 2012, 33, p. 2551–2567.
7. Vojáček, J., Janský, P., Janota, T. Třetí univerzální definice infarktu myokardu. Cor. Vasa, 2013, 55, p. e228–e235.
8. Landesberg, G., Beattie, W. S., Mosseri, M., Jaffe, A. S., Alpert, J. S. Perioperative myocardial infarction. Circulation, 2009, 119, p. 2936–2944.
9. London, M. J., Hollenberg, M., Wong, M. G. et al. Intraoperative myocardial ischemia: Localization by continuous 12-lead electrocardiography. Anesthesiology, 1988, 69, p. 232–241.
10. Landesberg, G. Monitoring for myocardial ischemia. Best Pract. Res. Clin. Anaesthesiol. 2005, 19, p. 77–95.
11. Landesberg, G., Mosseri, M., Zahger, D. et al. Myocardial infarction following vascular surgery: the role of prolonged, stress-induced, ST-depression-type ischemia. J. Am. Coll. Cardiol., 2001, 37, p. 1839–1845.
12. Li, S. L., Wang, D. X., Wu, X. M., Li, N., Xie, Y. Q. Perioperative acute myocardial infarction increases mortality following noncardiac surgery. J. Cardiothorac. Vasc. Anesth. 2013, 27, p. 1277–1281.
13. Gupta, B. P., Huddleston, J. M., Kirkland, L. L. et al. Clinical presentation and outcome of perioperative myocardial infarction in the very elderly following hip fracture surgery. J. Hosp. Med., 2012, 7, p. 713–716.
14. Singh, A., Antognini, J. F. Perioperative hypotension and myocardial ischemia: Diagnostic and therapeutic approaches. Ann. Card. Anaesth., 2011, 14, p. 127–132.
15. Khan, J., Alonso-Coello, P., Devereaux, P. J. Myocardial injury after noncardiac surgery. Curr. Opin. Cardiol., 2014, 29, p. 307–311.
16. Vision Study Writing Group Myocardial injury after noncardiac surgery. A Large, International, Prospective Cohort Study Establishing Diagnostic Criteria, Characteristics, Predictors, and 30-day outcomes. Anesthesiology, 2014,120, p. 564–578.
17. Goldman, L., Caldera, D. L., Nussbaum, S. R. et al. Multifactorial index of cardiac risk in noncardiac surgical procedures. N. Engl. J. Med., 1977, 297, p. 845–850.
18. Owens, W. D., Felts, J. A., Spitznagel, E. L. ASA physical status classifications: a study of consistency of ratings. Anesthesiology, 1978, 49, p. 239–243.
19. Detsky, A. S., Abrams, H. B., McLaughlin, J. R. et al. Predicting cardiac complications in patients undergoing non-cardiac surgery. J. Gen. Intern. Med., 1986,1, p. 211–219.
20. Lee, T. H., Marcantonio, E. R., Mangione, C. M. et al. Derivation and prospective validation of a simple index for prediction of cardiac risk of major noncardiac surgery. Circulation, 1999, 100, p. 1043–1049.
21. Gupta, P. K., Gupta, H., Sundaram, A. et al. Development and validation of a risk calculator for prediction of cardiac risk after surgery. Circulation, 2011, 124, p. 381–387.
22. McFalls, E. O., Ward, H. B., Moritz, T. E. et al. Coronary-artery revascularization before elective major vascular surgery. N. Engl. J. Med., 2004, 351, p. 2795–2804.
23. Poldermans, D., Schouten, O., Vidakovic, R. et al. A clinical randomized trial to evaluate the safety of a noninvasive approach in high-risk patients undergoing major vascular surgery: the DECREASE-V Pilot Study. J. Am. Coll. Cardiol., 2007, 49, p. 1763–1769.
24. Wijns, W., Kohl, P., Danchin, N. et al. Guidelines on myocardial revascularization. Eur. Heart J., 2010, 31, p. 2501–2555.
25. Montalescot, G., Sechtem, U., Achenbach, S. et al. 2013 ESC guidelines on the management of stable coronary artery disease. Eur. Heart J., 2013, 34, p. 2949–3003.
26. Hassan, S. A., Hlatky, M. A., Boothroyd, D. B. et al. Outcomes of noncardiac surgery after coronary bypass surgery or coronary angioplasty in the Bypass Angioplasty Revascularization Investigation (BARI). Am. J. Med., 2001, 110, p. 260–266.
27. The Bypass Angioplasty Revascularization Investigation (BARI) Investigators Comparison of coronary bypass surgery with angioplasty in patients with multivessel disease. N. Engl. J. Med., 1996, 335, p. 217–225. [Erratum: N. Engl. J. Med., 1997, 336, p. 147.]
28. Hlatky, M. A., Boothroyd, D. B., Bravata, D. M. et al. Coronary artery bypass surgery compared with percutaneous coronary interventions for multivessel disease: a collaborative analysis of individual patient data from ten randomized trials. Lancet, 2009, 373, p. 1190–1197.
29. Brilakis, E. S., Orford, J. L., Fasseas, P. et al. Outcome of patients undergoing balloon angioplasty in the two months prior to noncardiac surgery. Am. J. Cardiol., 2005, 96, p. 512 – 514.
30. Wilson, S. H., Rihal, C. S., Bell, M. R., Velianou, J. L., Hol-mes, D. R. Jr., Berger, P. B. Timing of coronary stent thrombosis in patients treated with ticlopidine and aspirin. Am. J. Cardiol., 1999, 83, p. 1006–1011.
31. Widimský, P., Moťovská, Z., Vaněk, T., Línková, H., Kočka, V. Protocols of antithrombotic therapy in a University Cardiocenter. Cor. Vasa, 2013, 55, p. e201–e206.
32. Mookadam, F., Carpenter, S. D., Thota, V. R. et al. Risk of adverse events after coronary artery bypass graft and subsequent noncardiac surgery. Future Cardiol., 2011, 7, p. 69–75.
33. Glance, L. G., Lustik, S. J., Hannan, E. L. et al. The Surgical Mortality Probability Model: derivation and validation of a simple risk prediction rule for noncardiac surgery. Ann. Surg., 2012, 255, p. 696–702.
34. Cohen, M. C., Aretz, T. H. Histological analysis of coronary artery lesions in fatal postoperative myocardial infarction. Cardiovasc. Pathol., 1999, 8, p. 133–139.
35. Kristensen, S. D., Knuuti, J., Saraste, A. et al. 2014 ESC/ESA Guidelines on non-cardiac surgery: cardiovascular assessment and management: The Joint Task Force on non-cardiac surgery: cardiovascular assessment of the European Society of Cardiology (ESC) and European Society of Cardiology (ESA). Eur. Heart J., 2014 [Epub ahead of print] doi:10.1093/eurheartj/ehu282.
36. Fleisher, L. A., Fleischmann, K. E., Auerbach, A. D. et al. 2014 ACC/AHA Guideline on Perioperative Cardiovascular Evaluation and Management of Patients Undergoing Noncardiac Surgery. J. Am. Coll. Cardiol., 2014, [Epub ahead of print] doi:10.1016/j.jacc.2014.07.944.
37. O’Gara, P. T., Kushner, F. G., Ascheim, D. D. et al. 2013 ACCF/AHA Guideline for the Management of ST-Elevation Myocardial Infarction. J. Am. Coll. Cardiol., 2013, 61, p. e78–e140.
38. Task Force on the management of ST-segment elevationacute myocardial infarction of the European Society of Car-diology (ESC) ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur. Heart J., 2012, 33, p. 2569–2619.
39. Hamm, C. W., Bassand, J. P., Agewall, S. et al. ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: The Task Force for the management of acute coronary syndromes (ACS) in patients presenting without persistent ST-segment elevation of the European Society of Cardiology (ESC). Eur. Heart J., 2011, 32, p. 2999–3054.
40. van Veen, J. J., Maclean, R. M., Hampton, K. K. et al. Protamine reversal of low molecular weight heparin: clinically effective? Blood Coagul. Fibrinolysis, 2011, 22, p. 565–570.
Štítky
Anestéziológia a resuscitácia Intenzívna medicína
Článek Efekt klonidinu na spotřebu desfluranu u celkové anestezie s monitorováním bispektrálního indexuČlánek Umělá plicní ventilaceČlánek ResuscitaceČlánek 22. Hoderův denČlánek Ceny ČSARIM za rok 2013Článek Konference a kongresyČlánek RejstříkyČlánek Pokyny pro autory
Článok vyšiel v časopiseAnesteziologie a intenzivní medicína
Najčítanejšie tento týždeň
2014 Číslo 6- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Metamizol v liečbe pooperačnej bolesti u opioid-tolerantnej pacientky – kazuistika
- e-Konzilium.cz — Masivní plicní embolie při tromboembolické nemoci
- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
-
Všetky články tohto čísla
- Pohnuté loučení s peroperační beta-blokádou
- Efekt klonidinu na spotřebu desfluranu u celkové anestezie s monitorováním bispektrálního indexu
- Perioperační ischémiea infarkt myokardu
- Echokardiografické hodnocení funkce pravé komory
- Umělá plicní ventilace
- „Nejasná“ hyperglykémie u pacientů v intenzivní péči – nezapomínejme na farmaka
- Resuscitace
-
Praktická doporučení pro vyšetření kardiovaskulárních funkcí a perioperační péči u pacientů podstupujících nesrdeční operaci
(American College of Cardiology/American Heart Association 2014) - Stanovisko ČRR k používání metod mimotělní kardiopulmonální resuscitace u dospělých pacientů s náhlou zástavou oběhu
- Pravidla pro rozhodování pacientů o poskytování zdravotní péče
- 22. Hoderův den
- Re: Kandidová sepse jako komplikace u pacienta s polytraumatem
- Ceny ČSARIM za rok 2013
- Konference a kongresy
- Komise pro historii našeho oboru hledá nové členy či spolupracovníky
- Pokyny pro autory
- Rejstříky
- Anesteziologie a intenzivní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Echokardiografické hodnocení funkce pravé komory
- Perioperační ischémiea infarkt myokardu
- Umělá plicní ventilace
- Pravidla pro rozhodování pacientů o poskytování zdravotní péče
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



