-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Anestezie a analgezie plodu při intervencích in utero
Foetal anaesthesia and analgesia during intrauterine procedures: Review
The first internationally collaborating Centre of Foetal Medicine (CFM) in the Czech Republic was founded in 2012. It specialises in diagnostic procedures and treatment options of severe complications during foetal intrauterine development. The programme of CFM focuses mainly on the problematic issues of multiple pregnancies (including the twin-to-twin transfusion syndrome of monochorionic twins, selective intrauterine growth restriction, anaemia-polycythaemia syndrome etc.) and the area of in-utero treatments for congenital disorders and malformations (e.g. congenital diaphragmatic hernia, neural tube defects).
One of the inherent requirements of invasive foetal procedures in utero is the availability and cooperation of a multidisciplinary team, including the need for optimisation of super-specialized anaesthesiological approaches to both the mother and the foetus. Anaesthesiological care is an integral part to foetal medicine, as it plays a crucial role within the multidisciplinary approach to the complex care of critically ill foetuses, and has a major impact on the possible outcome of in-utero treatments.
We therefore aim to present to the reader an up-to-date overview of the possible approaches to anaesthesia and analgesia of the foetus during invasive in-utero treatments.Keywords:
foetus – foetal pain – foetal surgery – foetal anaesthesia – foetal analgesia
Autori: Berka I.a 1; Šebková S.a 1; Feyereislová S.a 1; Ščamburová J.b 1; Hašlík L.c 1; Straňák Z.a 1
Pôsobisko autorov: b Anesteziologie, Ústav pro péči o matku a dítě 1; c Centrum fetální medicíny, Ústav pro péči o matku a dítě 1; a Jednotka intenzivně-resuscitační péče o novorozence, Ústav pro péči o matku a dítě 1; 3. lékařská fakulta, Univerzita Karlova 2
Vyšlo v časopise: Anest. intenziv. Med., 28, 2017, č. 5, s. 275-281
Kategória: Přehledový článek
Súhrn
V roce 2012 bylo v České republice konstituováno první mezinárodně spolupracující Centrum fetální medicíny (CFM), které se specializuje na diagnostiku a léčbu závažných komplikací v průběhu intrauterinního vývoje plodu. Program CFM se koncentruje zvláště na problematiku vícečetných těhotenství (transfuzní syndrom u monochoriálních dvojčat, selektivní intrauterinní růstová restrikce, anémie-polycytemie syndrom apod.) a in utero operabilních vrozených vývojových vad (např. kongenitální diafragmatická hernie, rozštěpové vady neurální trubice).
Logickým požadavkem invazivní léčby plodu in utero je úzká multidisciplinární spolupráce včetně optimalizace superspecializovaných anesteziologických postupů u matky a plodu. Anesteziologické postupy fetální medicíny mohou zásadním způsobem ovlivnit úspěšnost intrauterinní léčby, a proto je anesteziologická péče nenahraditelnou integrální součástí komplexní péče o kriticky nemocné plody.
Cílem práce je prezentovat aktuální možnosti a postupy při anestezii/analgosedaci plodu v průběhu intrauterinních výkonů.Klíčová slova:
plod – bolest plodu – intrauterinní výkon – fetální anestezie – fetální analgezieÚvod
Fetální medicína je vysoce specializovanou multioborovou součástí perinatální medicíny a je považována za jeden z milníků moderní medicíny. První otevřené operace plodu byly provedeny již v 80. letech 20. století, ale s minimálními úspěchy. Kompletní řešení vrozených vad v děloze bylo historicky asociováno s vysokou úmrtností plodů, signifikantní neonatální mortalitou a závažnými komplikacemi u matek. Vzhledem k těmto alarmujícím výsledkům byl vytvořen nový koncept minimálně invazivní chirurgie plodu (snížení délky operačního zákroku, snížení radikality operace, zavedení postupů, které připravují lepší podmínky pro následnou definitivní korekci operabilních vad u novorozenců), byly zavedeny nové metody prenatální diagnostiky a nové anesteziologické postupy v průběhu intervence in utero [1].
S ohledem na analýzu potřeb a dosažené výsledky v oblasti reprodukčního zdraví v ČR [2] bylo v roce 2012 konstituováno Centrum fetální medicíny (CFM) v Ústavu pro péči o matku a dítě [3]. Cíli CFM jsou: 1. výzkum a aplikace nových metod prenatální diagnostiky (vyšetření poruch placentární cirkulace a detekce feto-fetálních spojek u vícečetných těhotenství, funkční dopplerovská vyšetření plodu k posouzení závažnosti poruch krevního oběhu plodu, třídimenzionální ultrasonografie zaměřená na velikost plic, eventuálně objemová měření malformací), 2. zavedení nových postupů fetální chirurgie a 3. vědecká spolupráce s centry fetální chirurgie v rámci Eurofoetus Foundation. Centrum fetální medicíny úzce spolupracuje při transferu know-how a zavádění nových metod prenatální diagnostiky a léčby s renomovaným zahraničním partnerem University Hospital Leuven (Belgie).
Hlavním cílem práce je prezentovat přehled aktuálních kontroverzí, možností a postupů anestezie a analgosedace plodu v průběhu intervence in utero s ohledem na momentálně používané kategorie intrauterinních intervencí.
PATOFYZIOLOGIE BOLESTI U PLODU
Podle definice Mezinárodní společnosti pro studium bolesti (International Association for the Study of Pain, IASP) je bolest „nepříjemný smyslový a pocitový zážitek multidimenzionálního rázu ve spojení se skutečným nebo potencionálním poškozením tkáně a/nebo je v termínech takového poškození popisován“ [4]. Bolest má dvě základní komponenty: nociceptivní a emoční složku. Klíčovou komponentou pro chápání fetální bolesti je nocicepce a její vývoj. Nocicepci je možné rozdělit do čtyř fází. První je transdukce, tedy převod bolestivého stimulu do akčního potenciálu. Druhá je transmise, tedy vedení vzruchu do prodloužené míchy a dále do centrálního nervového systému. Třetí a čtvrtou fázi představuje modulace a percepce. Struktury nutné pro bolestivý vjem na základě bolestivé stimulace jsou volná nervová zakončení (nociceptory), nervová vlákna, thalamus a kortex [5].
Volná nervová zakončení je možné detekovat v kůži plodu od 7.‒10. týdne gestace, ve vnitřních orgánech od 13. týdne, ve 20. týdnu gestace jsou přítomná v celém organismu. Transmise nocicepce, která předpokládá propojení periferie a prodloužené míchy, je ovšem možná až od 14.–16. týdne, plně vyvinutá je od 24.–26. týdne gestace. Spinothalamické dráhy se vyvíjejí mezi 16. a 20. týdnem a dráhy thalamokortikální mezi 17. a 24. týdnem těhotenství. Nocicepci je tedy možné u plodu očekávat po dosažení 18.–20. týdne gestace, přestože například inhibiční descendentní vlákna pro bolest, která uvolňují serotonin a zajišťují modulaci, jsou plně funkční až po narození [6].
Exaktní určení hranice gestačního stáří pro prožívání bolesti u plodu je nadále předmětem mnoha odborných diskusí, protože neexistuje žádné objektivní měření bolesti [7]. Jednou z nepřímých možností objektivizace bolesti je aktivace hypothalamo-hypofyzární osy a zvýšená hladina hormonů stresové reakce. U plodu byla po bolestivém stimulu detekována vyšší hladina kortizolu, beta-endorfinu, kortikotropinu a noradrenalinu. Vzhledem k nedostatečnému přenosu noradrenalinu placentou je tato reakce považována za autonomní reakci plodu a byla pozorována již od 18. týdne gestace. Rovněž byly zaznamenány zvýšené pohyby těla a končetin, ale i zvýšená frekvence dýchacích pohybů [8, 9]. Pro úplnost je korektní dodat, že stres sám o sobě jistě neznamená prožívání bolesti, na druhou stranu nepřítomnost stresové reakce bolest prakticky vylučuje.
Publikovaná data o možných dlouhodobých následcích časné bolestivé stimulace vycházejí z výzkumu bolesti u nezralých novorozenců. Těžce nedonošení novorozenci (narození ve 28. týdnu těhotenství) ošetřovaní první čtyři týdny na jednotce intenzivní péče reagovali po měsíci života na krevní odběr značně odlišně ve srovnání s pacienty narozenými ve 32. týdnu těhotenství. Spontánní behaviorální reakce byla méně vyjádřena oproti odpovědi kardiovaskulárního systému. Tudíž tyto časné bolestivé stimuly a stres mohou způsobovat abnormální reakce na bolest v dalším životě [10]. Experiment na zvířecím modelu potvrdil, že repetitivní bolestivá stimulace snižuje práh bolesti v průběhu dalšího vývoje [11], podobně jako u původně nezralých novorozenců hospitalizovaných na jednotce intenzivní péče v průběhu dětství [12]. Dobře je popsán fakt, že u dětí exponovaných v neonatálním období opakovaným bolestivým a stresujícím stimulům může dojít k permanentním funkčním a strukturálním změnám v centrálním nervovém systému, především v hippocampu a prelimbické prefrontální oblasti [13].
Nepochybně existuje řada důkazů, že již v průběhu druhého trimestru reagují plody na bolestivé stimuly a že bolestivé intervence mohou mít nepříznivé dlouhodobé následky. Kvantifikace těchto rizik a jejich přesný popis jsou nadále předmětem mezioborového výzkumu.
INTRAUTERINNÍ VÝKONY
První úspěšnou fetální intervencí byla intravenózní aplikace krevní transfuze podaná pro hemolytickou anémii plodu při Rh imunizaci v roce 1963 [14]. Prudký rozvoj fetální chirurgie nastal až po roce 2000, současně s všeobecnou dostupností moderní ultrazvukové diagnostiky a diagnostiky pomocí nukleární magnetické rezonance [1]. Intrauterinní výkony jsou v současnosti rozděleny do pěti kategorií s ohledem na invazivitu výkonu a specifické potřeby anestezie/analgosedace plodu nebo matky.
Kategorie I: otevřené chirurgické výkony, kdy se pro přístup k plodu provádí laparotomie, hysterotomie s amniotomií a následně částečná evakuace plodu ex utero. Plod je po skončení chirurgického výkonu vrácen zpět do dělohy. Příkladem otevřeného chirurgického výkonu je operace meningomyelokély, jejímž účelem je zabránit poškození centrálního nervového systému z prolongovaného působení tekutiny amnia a snížit nutnost zavádění ventrikulo-peritoneálního shuntu pro hydrocefalus, který je prakticky uniformě asociován s touto vývojovou vadou [15, 16].
Kategorie II: fetoskopické chirurgické výkony – např. tracheální okluze u pacientů s těžkou formou kongenitální diafragmatické hernie, jejímž účelem je zmírnění závažnosti plicní hypoplazie [17] nebo fetální valvuloplastika [18].
Kategorie III: fetoskopické výkony na placentě a/nebo pupečníku – např. laserová ablace placentárních cévních spojek u monochoriálních dvojčat s transfuzním syndromem [19].
Kategorie IV: metoda EXIT (ex utero intrapartum treatment), někdy popisována zkratkou OOPS (operation on placental support). K tomuto typu výkonu se přistupuje při vaginálním porodu nebo císařském řezu. Porozena bývá pouze část plodu se zachováním placentární perfuze. Metoda EXIT se provádí při nutnosti zprůchodnění a zajištění dýchacích cest nebo k zahájení extrakorporální membránové oxygenace (u pacientů s těžkou hypoplazií plic a plicní hypertenzí). Indikací pro metodu EXIT je obecně neprůchodnost dýchacích cest – např. při laryngeální atrézii, hygroma colli cysticum nebo při iatrogenní tracheální okluzi u pacientů s kongenitální diafragmatickou hernií [20].
Kategorie V: relativně vzácné pozdní přerušení těhotenství ve smyslu fetocidy, obvykle pro pozdní záchyt vrozených vývojových vad neslučitelných s postnatálním přežitím.
Hlavními komplikacemi intrauterinních výkonů jsou: intrauterinní úmrtí, předčasný porod, abrupce placenty a infekce. Riziko prenatálních komplikací se zvyšuje s rozsahem a délkou výkonu. Vzhledem k těmto rizikům musí indikace pro fetální intervenci splňovat čtyři základní kritéria [1]:
- pomocí prenatální diagnostiky by měla být vada co nejpřesněji určena a měly by být vyloučeny jiné letální vrozené vady,
- vrozená vada by měla plodu způsobovat progresivní a po porodu ireverzibilní poškození,
- korekce vady by měla zastavit progresi onemocnění nebo alespoň zmírnit závažnost postnatálních komplikací,
- chirurgický výkon musí být co nejméně rizikový pro matku a její další fertilitu.
Obr. 1. Placenta monochoriálních dvojčat po laserové ablaci cévních spojek (šipky) a provedeném barevném nástřiku arteriálních řečišť (foto archiv ÚPMD) 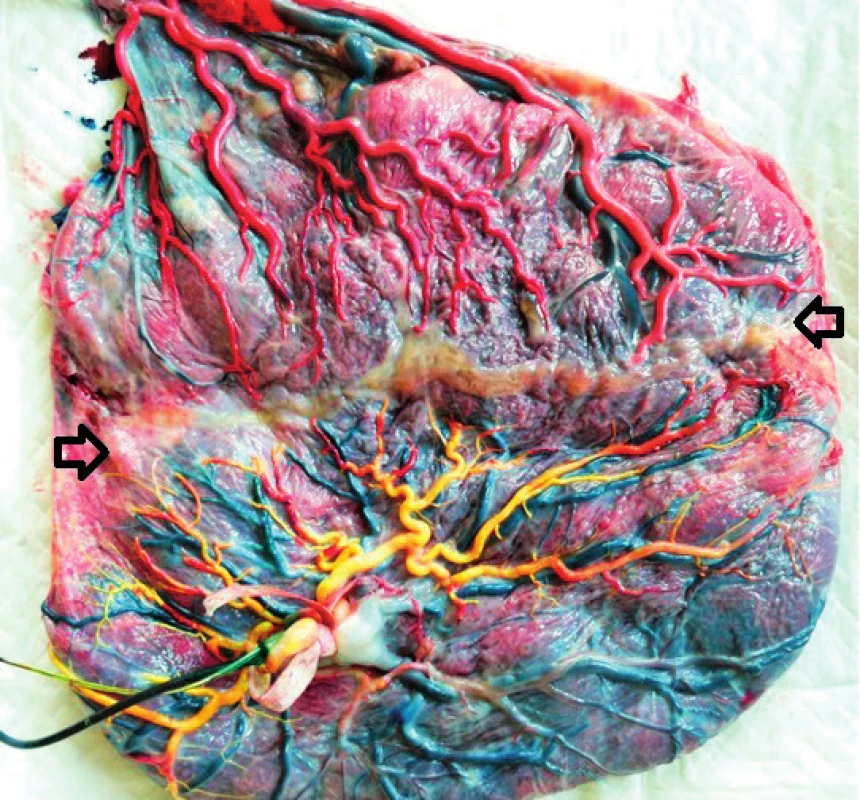
Obr. 2. Operace plodu s lumbo-sakrální meningomyelokélou (vlevo) s uzavřením defektu in utero (vpravo). Operace byla provedena v KU Hospital Leuven, prenatální, perinatální a neonatální péče poskytována v ÚPMD (foto archiv ÚPMD) 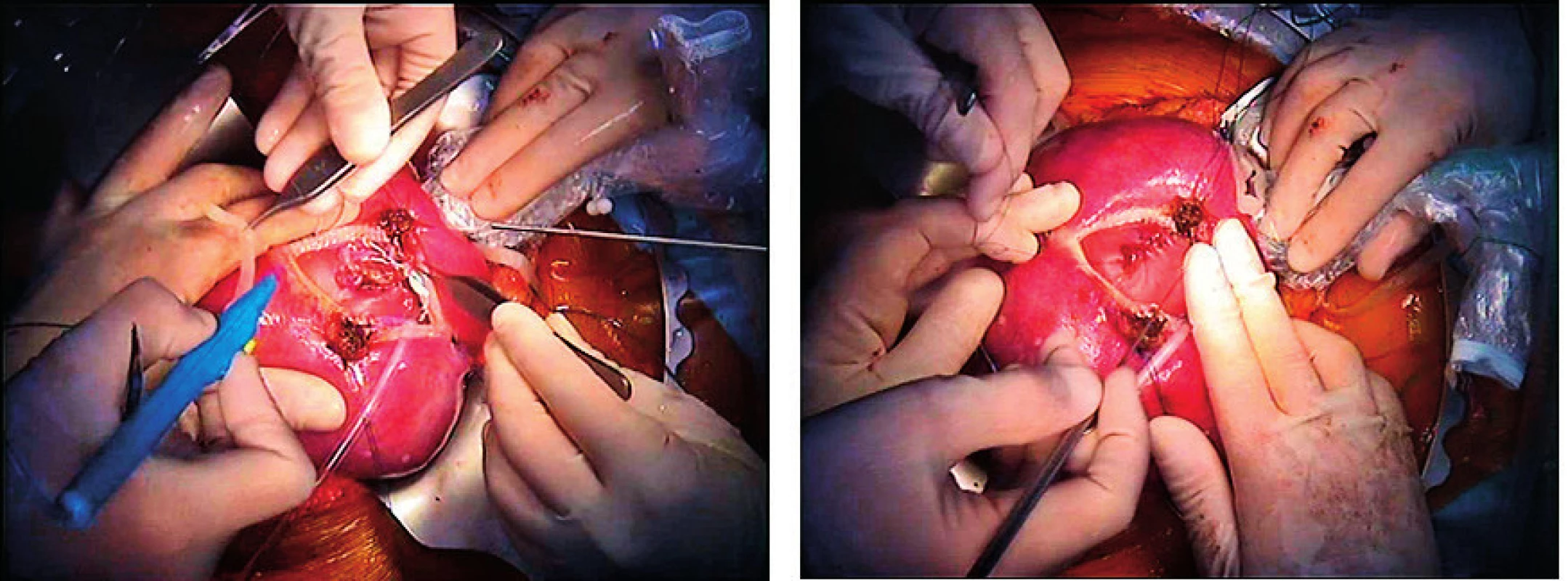
FETÁLNÍ ANESTEZIE/ANALGEZIE
Plánování a adekvátní provedení fetální anestezie/analgosedace musí vycházet z řady fyziologických odlišností plodu a charakteru samotného intrauterinního výkonu. Výběr vhodné farmakoterapie musí zohlednit nejenom cíle anestezie plodu, ale také bezpečnost farmakoterapie v dalším období intrauterinního a postnatálního vývoje plodu/novorozence. Přehled možné taktiky fetální anestezie a analgezie u intrauterinních výkonů uvádí tabulka 1. Volba konkrétních preparátů se v jednotlivých centrech značně liší.
SPECIFICKÉ PROBLÉMY VITÁLNÍCH FUNKCÍ U PLODŮ
Změny srdeční akce u plodu mají významný vliv na srdeční výdej, především pro neschopnost fetálního myokardu reagovat na zvýšený nebo snížený preload [21]. Významným změnám srdeční akce je tedy nezbytné věnovat zvýšenou pozornost. Prolongovaný pokles srdeční akce plodu pod100/min, případně peroperační změny v dynamických parametrech flowmetrie v arteria umbilicalis [22] signalizují oběhovou kompromitaci plodu s nutností neodkladné intervence, obvykle ve smyslu zvýšení děložní perfuze. Fetální cirkulující objem se zvyšuje v průběhu gestace a přibližně dvě třetiny feto-placentárního objemu jsou v placentě. V průběhu druhého trimestru je feto-placentární objem 120–160 ml/kg hmotnosti plodu. Fetální hemoglobin je u plodů mezi 18.–26. týdnem gestace 115–125 g/l. Krevní srážlivost plodu je oproti dospělému nižší. Termoregulace plodu je plně závislá na matce. Oxygenace plodu je závislá na adekvátní perfuzi dělohy a faktorech ovlivňujících přenos kyslíku (gradient parciálního tlaku kyslíku, hladina hemoglobinu matky a plodu, difuzní kapacita placenty, acidobazická rovnováha matky a plodu). Disociační křivka fetálního hemoglobinu je posunuta doleva [16].
ANESTEZIE U OTEVŘENÝCH CHIRURGICKÝCH VÝKONŮ
Fetální anestezie v průběhu otevřeného chirurgického výkonu je zprostředkována podáním volatilních anestetik matce a přímým intramuskulárním/intravenózním podáním opiátů plodu. Inhalační anestetika jsou ovšem spojena s řadou peroperačních i dlouhodobých rizik. Mají přímý depresivní účinek na kardiovaskulární systém plodu a při jejich vyšších koncentracích mohou způsobovat progredující acidózu plodu. Na zvířecím modelu bylo demonstrováno snížení srdečního výdeje u matky při koncentracích nutných k děložní relaxaci (2 MAC a více) s následným snížením děložní perfuze až o 30 %. Inhalační anestetika mohou způsobit zvýšení placentární a fetální vaskulární rezistence s následným zvýšením afterloadu plodu [23]. Retrospektivní analýza echokardiografických vyšetření při otevřených chirurgických výkonech a EXIT procedurách ukázala, že použití vysokých koncentrací desfluranu může způsobit středně těžkou, až těžkou systolickou dysfunkci levé komory plodu [24]. Dlouhodobým problémem u inhalačních anestetik je obava, že experimentálně způsobují u zvířat indukci neuronální apoptózy a narušení synaptogeneze v průběhu vývoje CNS [25]. Vliv expozice volatilními anestetiky na vývoj CNS u lidského plodu je nejasný. Jednorázová expozice je pravděpodobně bezpečná, naopak opakovaná expozice je asociována s poruchami vývoje a učení v dětském věku [26]. Na základě dostupných dat se změna stávající praxe u otevřených intrauterinních chirurgických výkonů nedoporučuje [27].
ANESTEZIE U FETOSKOPICKÝCH VÝKONŮ
Minimálně invazivní intrauterinní procedury jsou v současnosti nejčastěji prováděnými intrauterinními výkony s širokým indikačním spektrem [28], kromě již uvedených příkladů. Mezi ně patří i odběr fetální krve a podání transfuze plodu, resekce zadní chlopně uretry [29], zavádění shuntů z různých indikací (amnio-vezikální, amnio-peritoneální, amnio-torakální) a řada dalších, včetně výkonů původně prováděných cestou otevřené operace, jako např. resekce sacrococcygeálního teratomu [28] nebo operace spina bifida [15].
Celková anestezie matky u endoskopických výkonů není nutná, používá se lokální, případně regionální anestezie. U endoskopických výkonů na placentě a pupečníku často není nutná ani anestezie/analgosedace plodu kromě situací, kdy je nutné zamezit pohybům plodu, a tím výkon usnadnit [30]. Při endoskopickém fetálním výkonu se podávají opioidy intramuskulárně nebo intraumbilikálně. Někteří autoři doporučují podávání myorelaxancií a atropinu [23]. Alternativou při výkonech na pupečníku a placentě je podání opioidů matce v kontinuální infuzi (tab. 1) nebo podání benzodiazepinů. Efekt opioidů na snížení spontánní aktivity plodu ve srovnání s benzodiazepiny je výrazně vyšší [31].
Z animálních studií a dat z dlouhodobého sledování novorozenců plyne, že opioidy jsou z hlediska teratogenicity a dlouhodobého vlivu na vývoj CNS relativně bezpečné [32]. Benzodiazepiny zůstávají (po jejich spojení s vyšším výskytem rozštěpů patra po užívání diazepamu v prvním trimestru) kontroverzní, a to i přesto, že následné prospektivní studie tuto spojitost nepotvrdily. Jednorázové podání benzodiazepinů před operací by však nemělo plod a jeho vývoj ohrozit [33]. Při dodržení doporučeného dávkování je také bezpečné použití svalových relaxancií [34].
ANESTEZIE U METODY EXIT
Metoda EXIT se provádí v celkové anestezii podobně jako otevřené chirurgické výkony. Nároky na dávku inhalačních anestetik k zajištění děložní relaxace jsou vysoké (2 MAC) [35]. Dostatečná děložní relaxace je podmínkou prevence odlučování placenty a zachování uteroplacentární perfuze, která dále závisí na hemodynamické stabilitě matky. Invazivní monitoring tlaku matky je doporučován vzhledem k možné potřebě inotropní, vazopresorické nebo objemové podpory [36]. Je nutné počítat s možnou vysokou krevní ztrátou u matky i u plodu. V případě kontraindikace celkové anestezie je možná kontinuální spinální anestezie s infuzním podáním nitroglycerinu k zajištění děložní relaxace. Pokud je analgezie plodu nutná, pak především v případě spontánní pohybové aktivity (viz tab. 1). Monitorace plodu v průběhu procedury je obvykle zajištěna pulzní oxymetrií [37].
Tab. 1. Management anestezie matky a plodu (převzato z [23], Van de Velde et al.) ![Management anestezie matky a plodu (převzato z [23], Van de Velde et al.)](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/2a59bbb266566f21771edb3d37dcaa49.jpg)
ANESTEZIE U POZDNÍHO PŘERUŠENÍ TĚHOTENSTVÍ
Potřeba anestezie při pozdním přerušení těhotenství, případně pozdní selektivní fetocidě, je vysoce kontroverzní. Bouřlivou diskusi vyvolala změna legislativy ve státě Utah ve Spojených státech amerických v roce 2016, kde je fetální analgezie povinná při interrupci po 20. týdnu gestace. Praxe v Evropě je různá. Ve Velké Británii se pozdní přerušení těhotenství provádí v celkové anestezii, tedy i s ohledem na plod [38]. V Belgii se fetální analgezie rutinně nedoporučuje, ale je možné ji zvážit po 26. týdnu gestace [23].
ZÁVĚR
Fetální anestezie a analgezie jsou relativně novou výzvou pro anesteziology, která má řadu nejasností a kontroverzí. Je nutné sledovat výzkum v oblasti vlivu anestetik a analgetik na vyvíjející se fetální CNS s případnými důsledky pro kognitivní funkce postnatálně a jeho dopad do klinické praxe. Příkladem je recentní varování amerického Úřadu pro kontrolu potravin a léčiv (Food nad Drug Administration, FDA) před opakovanou a prolongovanou celkovou anestezií u dětí a těhotných [39]. Nepochybně jsou potřebná další data, ideálně z randomizovaných kontrolovaných studií, k vyhodnocení přínosů a rizik nejen fetální anestezie, ale rozšiřujícího se spektra fetálních výkonů obecně.
Práce je původní, nebyla publikována ani není zaslána k recenznímu řízení do jiného média.
Autoři prohlašují, že v souvislosti s tématem práce nemají střet zájmů.
Všichni autoři rukopis četli, souhlasí s jeho zněním a zasláním do redakce časopisu Anesteziologie a intenzivní medicína.
Podpořeno z projektu OPPK CZ.2.16/3.1.00/25015 – VYBUDOVÁNÍ CENTRA FETÁLNÍ MEDICÍNY.
Do redakce došlo dne 8. 3. 2017.
Do tisku přijato dne 15. 5. 2017.
Adresa pro korespondenci:
MUDr. Ivan Berka
ivan.berka@upmd.eu
Zdroje
1. Deprest JA, Flake AW, Gratacos E, Ville Y, Hecher K, Nicolaides K, Harrison MR. The making of fetal surgery. Prenat Diagn. 2010;30 : 653–667.
2. http://www.neonatology.cz/vysledky-pece-v-cr (25. 3. 2017)
3. http://www.fetalnicentrum.cz (25. 3. 2017)
4. Watt-Watson J, Hunter J, Pennefather P, Librach L, Raman-Wilms L, Schreiber M, et al. An integrated undergraduate pain curriculum, based on IASP curricula, for six health science faculties. Pain. 2004;110 : 140–148.
5. Konstantinidou AD, Silos-Santiago I, Flaris N, Snider WD. Development of the primary afferent projection in human spinal cord. J Comp Neurol. 1995; 354 : 11–12.
6. Fitzgerald M. The development of nociceptive circuits. Nat Rev Neurosci. 2005; 6 : 507–520.
7. Lee SJ, Ralston HJP, Drey EA, Partridge JC, Rosen MA. Fetal pain: a systematic multidisciplinary review of the evidence. JAMA. 2005;294 : 947–954.
8. Smith RP, Gitau R, Glover V, Fisk NM. Pain and stress in the human fetus. Eur J Obstet Gynecol Reprod Biol. 2000;92 : 161–165.
9. Fisk NM, Gitau R, Teixeira JM, Giannakoulopoulos X, Cameron AD, Glover VA. Effect of direct fetal opioid analgesia on fetal hormonal and hemodynamic stress response to intrauterine needling. Anesthesiology. 2001;95 : 828–835.
10. Anand KJ, Celeste Johnston C, Oberlander TF, Taddio A, Tutag Lehr V, Walco GA. Analgesia and local anesthesia during invasive procedures in the neonate. Clin Ther. 2005;27 : 844–876.
11. Anand KJ, Coskun V, Thrivikraman KV, Nemeroff CB, Plotsky PM. Long-term behavioral effects of repetitive pain in neonatal rat pups. Physiol Behav. 1999;66 : 627–637.
12. Anand KJ. Clinical importance of pain and stress in preterm neonates. Biol Neonate. 1998;73 : 1–9.
13. Porter FL, Grunau RE, Anand KJ. Long-term effects of pain in infants. J Dev Behav Pediatr. 1999;20 : 253–261.
14. Liley AW. Intrauterine Transfusion of Foetus in Haemolytic Disease. British Medical Journal. 1963;1107–1109.
15. Kohl T. Percutaneous minimally invasive fetoscopic surgery for spina bifida aperta. Part I: surgical technique and perioperative outcome. Ultrasound Obstet Gynecol. 2014;44 : 515–524.
16. Ferschl M, Lee H, Rollins MD. Anesthesia for in utero repair of myelomeningocele. Anesthesiology. 2013;118 : 1211–1223.
17. Ruano R, Ali RA, Patel P, Cass D, Olutoye O, Belfort MA. Fetal endoscopic tracheal occlusion for congenital diaphragmatic hernia: indications, outcomes, and future directions. Obstet Gynecol Surv. 2014;3 : 147–158.
18. Pedra SF, Peralta CF, Pedra CAC. Future directions of fetal interventions in congenital heart disease. Interv Cardiol Clin. 2013;2 : 1–10.
19. van Klink JM, Koopman HM, van Zwet EW. Cerebral injury and neurodevelopmental impairment after amnioreduction versus laser surgery in twin-twin transfusion syndrome: a systematic review and meta-analysis. Fetal Diagn Ther. 2013;33 : 81–89.
20. Taghavi K, Beasley S. The ex utero intrapartum treatment (EXIT) procedure: application of a new therapeutic paradigm. J Paediatr Child Health. 2013;420–427.
21. Rychik J. Fetal cardiovascular physiology. Pediatr Cardiol. 2004;25 : 201–209.
22. Alfirevic Z, Stampalija T, Gyte GM. Fetal and umbilical Doppler ultrasound in high-risk pregnancies. Cochrane Database Syst Rev. 2013;12:CD007529.
23. Van de Velde M, De Buck F. Fetal and maternal analgesia/anesthesia for fetal procedures. Fetal Diagn Ther. 2012;31 : 201–209.
24. Boat A, Mahmoud M, Michelfelder EC, Lin E, Ngamprasertwong P, Schnell B, Kurth CD, Crombleholme TM, Sadhasivam S. Supplementing desflurane with intravenous anesthesia reduces fetal cardiac dysfunction during open fetal surgery. Paediatr Anaesth. 2010;20 : 748–756.
25. Brambrink AM, Evers AS, Avidan MS, Farber NB, Smith DJ, Zhang X, Dissen GA, Creeley CE, Olney JW. Isoflurane-induced neuroapoptosis in the neonatal rhesus macaque brain. Anesthesiology. 2010;112 : 834–841.
26. Flick RP, Katusic SK, Colligan RC, Wilder RT, Voigt RG, Olson MD, Sprung J, Weaver AL, Schroeder DR, Warner DO. Cognitive and behavioral outcomes after early exposure to anesthesia and surgery. Pediatrics. 2011;128 : 1053–1061.
27. Stratmann G. Neurotoxicity of anesthetic drugs in the developing brain. Anesth Analg. 2011;113 : 1170–1179.
28. Sala P, Prefumo F, Pastorino D, Buffi D, Gaggero CR, Foppiano M, De Biasio P. Fetal surgery: an overview. Obstet Gynecol Surv. 2014;4 : 218–228.
29. Casella DP, Tomaszewski JJ, Ost MC.Posterior urethral valves: renal failure and prenatal treatment. Int J Nephrol. 2012;2012 : 351067.
30. Van de Velde M, De Buck F, Van Mieghem T, Gucciardo L, De Koninck P, Deprest J. Fetal anaesthesia: is this necessary for fetoscopic therapy? Fet Matern Med Rev. 2010;21 : 24–35.
31. Van de Velde M, Van Schoubroeck D, Lewi LE, Marcus MA, Jani JC, Missant C, et al. Remifentanil for fetal immobilization and maternal sedation during fetoscopic surgery: a randomized, double-blind comparison with diazepam. Anesth Analg. 2005; 101 : 251–258.
32. Schuurmans J, Benders M, Lemmers P, van Bel F. Neonatal morphine in extremely and very preterm neonates: its effect on the developing brain – a review. J Matern Fetal Neonatal Med. 2015;2 : 222–228.
33. Marinucci L, Balloni S, Carinci F, Locci P, Pezzetti F, Bodo M. Diazepam effects on non-syndromic cleft lip with or without palate: epidemiological studies, clinical findings,genes and extracellular matrix. Expert Opin Drug Saf. 2011;10 : 23–33.
34. Kampe S, Krombach JW, Diefenbach C. Muscle relaxants. Best Pract Res Clin Anaesthesiology. 2003;17 : 137–146.
35. Garcia PJ, Olutoye OO, Ivey RT, Olutoye OA. Case scenario: anesthesia for maternal-fetal surgery: the Ex Utero Intrapartum Therapy (EXIT) procedure. Anesthesiology. 2011;114 : 1446–1452.
36. Moldenhauer JS. Ex utero intrapartum therapy. Semin Pediatr Surg. 2013;22 : 44–49.
37. Marwan A, Crombleholme TM. The EXIT procedure: principles, pitfalls, and progress. Semin Pediatr Surg. 2006;15 : 107–115.
38. The Royal College of Obstetricians and Gynaecologists. The Care of Women Requesting Induced Abortion. Evidence-Based Clinical Guideline no. 7. RCOG Press. 2015.
39. https://www.fda.gov/Drugs/DrugSafety/ucm532356.htm (14. 12. 2016)
Štítky
Anestéziológia a resuscitácia Intenzívna medicína
Článek ARDS – historie i současnost
Článok vyšiel v časopiseAnesteziologie a intenzivní medicína
Najčítanejšie tento týždeň
2017 Číslo 5- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Metamizol v liečbe pooperačnej bolesti u opioid-tolerantnej pacientky – kazuistika
- e-Konzilium.cz — Masivní plicní embolie při tromboembolické nemoci
-
Všetky články tohto čísla
- Anestezie a analgezie plodu při intervencích in utero
- Buprenorfin a abstinenční syndrom novorozenců
- Neurotoxicita anestetik a dozrávající dětský mozek
- Endoteliální glykokalyx a tekutinová terapie v intenzivní a perioperační medicíně
- Kognitivní poruchy v perioperační a intenzivní péči
- Úspěšné použití methylenové modři u pacienta v refrakterním šoku na veno-arteriální extrakorporální membránové oxygenaci
- Koncepce použití mechanických podpor při léčbě pokročilého srdečního nebo plicního selhání v České republice
- Centra péče o nemocné po srdeční zástavě
- Echokardiografické vyšetření u akutního aortálního syndromu
- Patofyziologie tukové embolie − zatím nevíme vše
- Praktická doporučení pro předoperační lačnění a použití farmak k prevenci aspirace před plánovanými operačními výkony
- Nízké dávky kortikosteroidů v kritických stavech – současný metaanalytický pohled
-
Anestezie v Rakousko-Uhersku během I. světové války a po vzniku samostatného československého státu
Část II – Metody místní anestezie - Ohlédnutí za XI. kongresem České společnosti intenzivní medicíny 2017
- Abstrakty z kongresu ČSIM 2017
- Posttraumatická stresová porucha
- Virtuální realita v neurorehabilitaci pacientů v intenzivní péči
- ARDS – historie i současnost
- Anesteziologie a intenzivní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Úspěšné použití methylenové modři u pacienta v refrakterním šoku na veno-arteriální extrakorporální membránové oxygenaci
- Neurotoxicita anestetik a dozrávající dětský mozek
- Kognitivní poruchy v perioperační a intenzivní péči
- Praktická doporučení pro předoperační lačnění a použití farmak k prevenci aspirace před plánovanými operačními výkony
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



