-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Esenciálna hypertenzia ako syndróm alebo kompenzačný mechanizmus?
Essential Hypertension – Syndrome, or Compensatory Mechanism
Diagnosis of essential hypertension is created per exclusionem – with exclusion of all, so called secondary hypertensions (nephrogenic, endocrine conditioned etc). Idea and the name-essential hypertension are unclear. We have a lot of hypotheses about mechanisms of hypertension but no one is explaining satisfactorily the „fixation“ of hypertension. From this point of view essential hypertension looks more like a syndrome than disease sui generis. Authors analyzed all possible pathways of hypertension origin as well as compensatory mechanisms in peripheral circulation in effort to reach relevant tissue perfusion. If these mechanisms lead to salt and water retention the best mode of the treatment would be to influence volume and blood vessels lumen. It is clear that optimization of blood pressure is advantageous for prevention of vascular catastrophes (myocardial and cerebral infarction). Nevertheless inadequate lowering of the peripheral tissue perfusion (kidney, CNS) can lead to degenerative changes in tissues and to disturbances in centrally regulated processes of blood pressure.
Key words:
beneficial hypertension, holistic view, capillary flow, kidney, sodium, stress, sympathetic nervous system.
Autori: I. Hulín; I. Ďuriš; E. Sapáková; Ľ. Paulis; B. Mravec
Pôsobisko autorov: Ústav experimentálnej endokrinológie SAV, Bratislava, Slovenská republika ; I. interná klinika FN a LF UK, Bratislava, Slovenská republika ; Ústav patologickej fyziológie LF UK, Bratislava, Slovenská republika
Vyšlo v časopise: Čas. Lék. čes. 2008; 147: 14-24
Kategória: Přehledový článek
Súhrn
Diagnózu esenciálnej hypertenzie tvoríme per exclusionem – vylúčením tzv. sekundárnych hypertenzií (nefrogénnych, endokrinne podmienených a pod.). Pojem esenciálna hypertenzia je však nejasný. O mechanizmoch jej vzniku máme množstvo hypotéz, ale o príčinách jej „fixácie“ sa pohybujeme v neurčitosti. Esenciálna hypertenzia sa javí skôr ako syndróm a nie ochorenie sui generis. Autori analyzujú známe cesty ako aj kompenzačné mechanizmy, ktorých snahou je dobrá perfúzia tkanív. Ak komplikované mechanizmy vedú k retencii soli a vody najúčinnejšou terapiou bude ovplyvnenie lumenu ciev a objemu cirkulujúcej krvi. Optimalizácia krvného tlaku je výhodná pre zníženie cievnych katastrof (infarktu myokardu a mozgu). Neprimerané zníženie prietoku tkanivami môže však v určitej fáze vývoja esenciálnej hypertenzie vyvolať inadekvátne vyplavenie renínu. To môže spôsobiť v konečnom dôsledku degeneratívne zmeny v bunkách tkanív vrátane mozgu, čím sa jeho autoregulatívna funkcia ďalej zhorší. Je ešte stále veľa nejasností v oblasti racionálnej liečby hypertenzie.
Kľúčové slová:
benefitná hypertenzia, holistický pohľad, kapilárny prietok, obličky, sodík, stres, sympatikový nervový systém.Holistický pohľad na vznik a rozvoj hypertenzie
Pri holistickom pohľade sme všeobecne „povinní“ zmeniť pohľad na zložité pochody, ktoré v organizme vznikajú. Predchádzajúce obdobie vedeckého bádania a klinických pozorovaní charakterizovala analýza všetkého. To znamená rozklad zložitého celku alebo mechanizmov na jednotlivosti. Takýto analytický prístup bol plne opodstatnený. Výsledkom analýz bolo poznanie detailov, ktoré sa na poruche zúčastňujú. Analytický prístup však nedáva jednoznačnú odpoveď na otázku, prečo porucha vznikla. Analýza prináša informácie o izolovaných javoch, o súčastiach komplexného javu. Ide o mimoriadne cenné informácie o tom, ako vzniká porucha. Pri každej poruche sa usilujeme zistiť, ako a prečo porucha vzniká.
Ak analyzujeme jednotlivé súčasti mechanizmov, predpokladáme alebo prisudzujeme im rovnaký význam. V skutočnosti to tak nie je. V zložitom systéme, ktorý pozostáva z jednotlivostí, je ich úloha, význam a účasť hierarchizovaná. Niektoré jednotlivosti významom presahujú iné.
Zložité mechanizmy, ktoré sú uložené hlboko v bunkách obyčajne nevidíme. Neznamená to však, že by sme vôbec nemali predpokladať, že o mnohých javoch rozhodujú práve intracelulárne procesy. Ak pripustíme, že sme „následkom“ obrovskej evolúcie života, tak našou staršou podstatou sú bunky. Tie môžu byť „skrytým motorom“, ktorý núti organizmus „konať“ v zmysle uspokojenia ich potrieb. Z tohto pohľadu krvný tlak nemusí byť iba súčasťou fungujúcej cirkulácie.
Ak pripúšťame, že život vznikol vo vodnom prostredí, tak voda bola médiom, ktoré zabezpečovalo všetko, príjem energie a elimináciu nepotrebného. Pre jednoduché fungovanie sa mohli využívať zmeny tlaku. Ešte jednoduchšie sú však zmeny osmotickej koncentrácie vnútorného vodného prostredia. Nejde o fylogeneticky konzervovanú reguláciu? Ak sa zvýši krvný tlak v ľudskom organizme, tak sa zvýši vylučovanie vody a zvýši sa natriuréza. Preto si môžeme otázku regulácie tlaku položiť aj opačne. Doteraz sme zvykli hovoriť o tom, že krvný tlak ovplyvňujú definované faktory. Hovorili sme, že krvný tlak regulujú známe a menej známe mechanizmy. Nie je tu opačné „poradie“? Čo ak je krvný tlak nástrojom buniek pre optimalizáciu osmotických pomerov? Mechanizmus pre optimalizáciu osmotických pomerov nemôže byť izolovaný, nemôže to byť jeden mechanizmus. Ak je mechanizmov veľa, tak môžu vznikať mnohoraké odchýlky týchto mechanizmov. Preto môže existovať aj veľa porúch, ktoré sa môžu iba ťažko zaradiť do jednej schémy.
V dávnej minulosti, na začiatku evolúcie zložitých biologických systémov boli voda, osmotické a tlakové pomery na vrstvách oddeľujúcich dve prostredia mechanizmami, ktoré rozhodovali o všetkom. Nemali by sme teraz hľadať fylogenetické reziduum v tom, že aktivita organizmu môže byť spojená so zmenou týchto hodnôt na úrovni všetkých buniek? Potom by sa rôznym spôsobom, rôznymi cestami zabezpečovala nová situácia v každej bunke. Preferenčne vo vybraných bunkách. Aktivácia organizmu spojená s aktivitou sympatika zapája zložité mechanizmy, ktoré pri dlhodobom pôsobení môžu zosilniť niektorú cestu vedúcu k uplatneniu preferencie tlaku ako prostriedku pre zvýšenie natriurézy pri stresovej záťaži.
Biologické systémy, ktoré by sme mohli považovať za našich dávnych predkov, sa museli zdokonaľovať vo vývine smerom k „šetreniu sodíka“. Súčasne sa museli zdokonaľovať mechanizmy pre jednoduché „zbavenie sa“ nadbytku sodíka. Museli sa však vybudovať dokonalé systémy aj pre jeho získanie. Pri tomto pohľade môžeme „operovať“ s 3 skutočnosťami. Prvou je schopnosť šetriť sodík, druhou je schopnosť vylúčiť nadbytok a treťou je schopnosť „získať ho“.
Ak sa ľudia vyvíjali v teplých pásmach na Zemi, tak potrebovali sodík pre udržanie a obrat vody v tele. Neskoršie ochladenie a presun ľudí do mierneho pásma bolo novou situáciou, pri ktorej už nebolo potrebné tak úzkostlivo chrániť „zásobu sodíka“ v organizme. Mechanizmy pre jeho „získanie“ boli nadbytočné. Možno skutočnosť, že Afro-američania majú vyššiu senzitivitu pre sodík ako belosi, môže byť „odkazom z dávnej minulosti“. Dôkazom pre tento predpoklad by mohli byť polymorfizmy génu pre angiotenzinogén (ATG gén), génu pre β2 adrenergné receptory a génu pre epitelové sodíkové kanály v niektorých afrických populáciách. Potenie a infekčná diarrhea boli príčinou trvalých strát sodíka (1). Preto sa v dlhom vývine mohli preferovať typy s dokonalými mechanizmami pre šetrenie sodíka. Takáto predstava môže byť prijateľná, ale nemusí byť aj korektná. Treba sa ňou však nevyhnutne zaoberať aj vzhľadom na možné terapeutické implikácie. Viaceré štúdie poukázali na vyššiu účinnosť antihypertenzívnej terapie diuretikami u afroamerickej v porovnaní s kaukazoidnou populáciou. Požiadavka na individualizáciu terapie a jej ušití na mieru pohlaviu, životnému štýlu, veku, komorbidite a genetickému zázemiu konkrétneho pacienta bude stále rásť.
Dôslednou analýzou potenciálnych patomechanizmov hypertenzie je možné naznačiť ďalšie možnosti terapie, ktorá sa prekryje s prevenciou. Existuje pozitívna korelácia vývinu hypertenzie v závislosti na pôrodnej hmotnosti. Nízka pôrodná hmotnosť detí matiek žijúcich v zlých socioekonomických podmienkach je silnou predispozíciou pre vývin hypertenzie v dospelosti u týchto potomkov. Príčinou môže byť to, že počas intrauterinného života sa u takýchto jedincov vyvinie menej glomerulov a majú aj nižšiu filtračnú plochu. Nižšia filtrácia je potom „kompenzovaná“ vyšším tlakom, aby sa zabezpečila optimálna natriuréza „zabezpečovaná tlakom“. Keby sa tieto skutočnosti exaktne dokázali, bolo by potom možné zmeniť systém výživy detí s nízkou pôrodnou hmotnosťou tak, aby sa možné riziká vyplývajúce z intrauterinného vývinu obličiek neuplatnili.
Genetická determinácia sa uplatní vtedy, ak sú „vhodné podmienky“ alebo prítomné mechanizmy, ktoré majú úlohu spúšťačov. Z tohto vyplýva skôr predstava o tom, že hypertenzia nikdy nemôže vznikať z jednej príčiny. Naviac, pri všetkých biologických systémoch je vidieť ich veľkú plasticitu. Prípadná maladaptácia niektorých štruktúr môže pôsobiť ako faktor zodpovedný za následok smerujúci k hypertenzii.
Hypertenzia je mimoriadne zložitým patofyziologickým problémom. Veľmi často je príčinou devastujúcich následkov, ale často je asymptomatická až do vzniku akútnej krízy. Hypertenzia má za následok najmä tieto negatívne skutočnosti: poruchy koronárneho riečiska, cerebrovaskulárne príhody, hypertrofiu srdca, zlyhanie srdca, disekujúcu aneuryzmu aorty, zlyhanie obličiek, zmeny periférnych ciev končatín. Hypertenzia je a bude pravdepodobne najväčším rizikom predčasných úmrtí (2).
Vynára sa tu však základná otázka, alebo spochybnenie našich doterajších predstáv o vzniku a rozvoji hypertenzie. Mohli by sme si položiť otázku, či je hypertenzia skutočne iba následkom zmeny mechanizmov, molekúl, alebo niektorých štruktúr? Nemohlo by to byť aj tak, že hypertenzia je nevyhnutnosťou pre zabezpečenie adekvátnej oxygenácie tkanív, a teda že predstavuje prospešnú adaptačnú reakciu? Potom by optimalizácia krvného tlaku znamenala ochranu pred katastrofálnymi následkami, ale súčasne isté znevýhodnenie oxygenácie na úrovni mikrocirkulácie. Zabezpečí znížený tlak u hypertonika optimálnu oxygenáciu mozgu? Nemôže úspešná liečba hypertenzie odstrániť riziká katastrofy a súčasne akcelerovať chronické degeneratívne procesy (3)? Zvýšenie tlaku do určitej hranice by mohlo zlepšiť oxygenáciu tkanív. Výrazné zvýšenie tlaku má za následok zníženie perfúzie pre indukovanú vazokonstrikciu. Preto môže existovať pozitívna korelácia s neurodegeneratívnymi chorobami (4).
Všeobecne sa akceptuje, že hypertenzia je komplexnou multifaktoriálne podmienenou poruchou. Predpokladá sa, že je dôsledkom interakcie medzi genetickými predispozičnými faktormi pre rozvoj hypertenzie a faktormi vonkajšieho prostredia (diétne návyky, obezita, hyperlipidémia, fajčenie a stres).
Regulácia krvného tlaku z hľadiska jeho optimalizácie
Krvný tlak je variabilná a spojitá fyziologická veličina. Výška krvného tlaku si zasluhuje našu pozornosť preto, lebo sa zistilo, že skoro priamo úmerne zvyšuje kardiovaskulárne riziko. Keďže zvýšenie je kontinuálne, stanovili sa arbitrárne hodnoty krvného tlaku, pri ktorých možno považovať kardiovaskulárne riziko za chorobne zvýšené a hovoríme o artériovej hypertenzii (ďalej len hypertenzii). Týmito hodnotami sú v súčasnosti 90 mm Hg pre diastolický a 140 mm Hg pre systolický tlak krvi. Podľa tohto kritéria trpí hypertenziou 25 % populácie. Na celom svete žije asi 800 miliónov ľudí, ktorí majú hypertenziu. Zdá sa, že riziko komplikácií pritom závisí viac od zvýšenia systolického tlaku ako diastolického tlaku krvi a je vyššie u niektorých špecifických skupín, napr. Afroameričanov. Naopak zníženie krvného tlaku u hypertenzných pacientov výrazne zníži výskyt ischemickej choroby srdca, zlyhania srdca, mozgových príhod a incidencie letálnych prípadov.
Vedomosti o regulácii krvného tlaku a osobitne „o molekulových cestách regulácie“ sú potrebné pre pochopenie a pre terapeutické ovplyvnenie hypertenzie. Napriek úpornej snahe veľa mechanizmov doteraz v detailoch nepoznáme.
Etiológiu hypertenzie sa podarí stanoviť len u 5–15 % pacientov, v takom prípade hovoríme o sekundárnej hypertenzii. Najčastejšie to býva hypertenzia pri primárnom hyperaldosteronizme, pri Cushingovom syndróme, pri feochromocytóme, pri aterosklerotickom zúžení renálnej artérie (renovaskulárna hypertenzia) a pri ďalších poruchách.
U 85–95 % pacientov príčinu hypertenzie nepoznáme. Snahy nájsť faktor zodpovedný za vznik tejto „esenciálnej hypertenzie“ doteraz zlyhali. Jednotlivé fyziologické komponenty ako je srdcový výdaj, objem extracelulárnej tekutiny, či plazmatická renínová aktivita sa medzi pacientmi líšia, ukazujúc, že esenciálna hypertenzia nie je ochorením, ale skôr syndrómom spoločným pre viacero ochorení s rôznou etiológiou. Previazanie zložitých mechanizmov regulujúcich tlak krvi však vedie k tomu, že ak aj je jeden faktor prvotne zodpovedný za vznik hypertenzie, ostatné sú zodpovedné za jej udržanie. Ukazuje sa, že environmentálne faktory ako stres, zníženie pohybovej aktivity, fajčenie, alkohol, zvýšený príjem tukov a najmä nadmerný príjem sodíka v potrave musia nájsť dostatočne „úrodný“ genetický substrát.
Analytický pohľad na reguláciu tlaku krvi a faktory vedúce k hypertenzii
Analytický pohľad na akýkoľvek problém spočíva v rozklade systému, ktorý by bolo náročné postrehnúť v jeho komplexnosti, na jednotlivé časti celku. Tieto je potom možné ďalej rozkladať, až kým nedosiahneme zjednodušenie, primerané nášmu chápaniu. Tento prístup je plne oprávnený v procese vedeckého bádania. Treba však upozorniť, že po strate súvisu jednotlivostí s celkom, môže viesť do slepej uličky.
Z mechanistického pohľadu krvný tlak je proporcionálny minútovému srdcovému výdaju a periférnej rezistencii ciev. Preto všetky faktory v rámci vysvetľujúceho patomechanizmu musia ovplyvňovať tieto dve fyziologické veličiny.
U väčšiny pacientov s esenciálnou hypertenziou je na počiatku zvýšený srdcový výdaj, kým periférny odpor a objem extracelulárnej tekutiny sú normálne. Neskôr, so zvýšením krvného tlaku srdcový výdaj opäť klesá na fyziologické alebo ľahko zvýšené hodnoty a rovnako klesá aj objem extracelulárnej tekutiny (s výnimkou hypertenzie s poruchou renín-aldosterónového systému) ale periférny odpor sa zvyšuje. V pokročilejších štádiách ochorenia v dôsledku poškodenia cieľových orgánov klesá glomerulová filtrácia (zväčšuje sa extracelulárny objem), klesá mozgový a koronárný prietok. V tejto fáze je už udržanie vysokého krvného tlaku pre organizmus nevyhnutné na zabezpečenie dostatočnej perfúzie mozgu či obličiek (na udržanie glomerulovej filtrácie pri poklese filtračnej plochy). Hypertrofovaný srdcový sval bez adekvátneho zvýšenia koronárneho prietoku však nedokáže zabezpečiť dostatočný perfúzny tlak proti zvýšenému cievnemu odporu. Aktivácia renín-aldosterónového systému a retencia tekutiny teoreticky tento stav zlepšujú, v konečnom dôsledku však ale vedú len k ďalšiemu prehĺbeniu a fixácii hypertenzie. Pokles glomerulovej filtrácie v dôsledku progredujúceho poškodenia nefrónov nastáva až v pokročilejších štádiách ochorenia a ďalej prispieva k retencii sodíka a extracelulárnej tekutiny.
Na dôsledné pochopenie patomechanizmov hypertenzie treba teda vziať do úvahy možné poruchy regulácie jednotlivých fyziologických parametrov determinujúcich zvýšenie a udržanie vysokého krvného tlaku, srdcového výdaja a periférnej rezistencie.
Faktory určujúce srdcový výdaj a jeho úloha v regulácii tlaku krvi
Minútový srdcový výdaj je určený srdcovou frekvenciou a vývrhovým objemom. Vývrhový objem je objem krvi vyvrhnutej do cievneho riečiska v priebehu jednej systoly. Jedná sa o komplexný parameter závisiaci od troch hlavných faktorov: preloadu, afterloadu a kontraktility. Preload je v teoretickom poňatí určený dĺžkou sarkoméry na konci diastoly a do čerpacej funkcie srdca sa premieta aj prostredníctvom Frank-Starlingovho mechanizmu. Klinicky ho odráža koncovo-diastolický objem. Ten závisí od plniacej funkcie predsiení, poddajnosti komôr a objemu extracelulárnej tekutiny v kapacitnom riečisku. Zhoršené plnenie komôr v dôsledku fibrilácie predsiení, zvýšenej tuhosti komôr alebo objemovej deplécie, vývrhový objem znižuje a naopak preťaženie tekutinou ho zvyšuje. Afterload je daný najmä odporom cievneho riečiska proti ktorému pracuje srdcový sval. Nakoniec kontraktilita je daná „kvalitou“ myokardu a je ovplyvnená množstvom neurohumorálnych faktorov, ktoré ovplyvňujú aj srdcovú frekvenciu. Kontraktilitu zvyšuje najmä adrenergná stimulácia (ktorá zvyšuje aj frekvenciu), pôsobenie angiotenzínu II, aldosterónu a zmenené plazmatické koncentrácie sodíka a draslíka. Tieto látky sa zároveň podieľajú na prestavbe, remodelácii myokardu, ktorá mu má umožniť zvládnuť hemodynamické preťaženie.
Faktory určujúce periférnu rezistenciu a jej úloha v regulácii tlaku krvi
Periférna rezistencia je určená najmä priesvitom rezistentných arteriol, menej priesvitom stredných a veľkých artérií. Tento sa môže meniť buď aktívne kontrakciou hladkej svaloviny, alebo pasívne jej remodeláciou. Oboje je ovplyvnené hemodynamickým zaťažením, neurohumorálnou reguláciou (rovnováhou medzi vazokonstriktormi a vazodilatátormi) a tiež koncentráciou iónov sodíka a draslíka. Medzi vazokonstriktory patria tie isté látky, ktoré zvyšujú kontraktilitu myokardu a vedú k jeho remodelácii: angiotenzín II, katecholamíny, endotelín. Medzi vazodilatátory patria látky s negatívne inotropným účinkom a všeobecne pôsobiace antiproliferatívne: kiníny, prostaglandíny a najmä NO (obr. 1). Je zaujímavé, že vazokonstriktory pôsobia na cievne riečisko generalizovane, kým pôsobenie vazodilatátorov je skôr lokálne. Je to dané najmä úlohou vazokonstriktorov mobilizovať zdroje organizmu a vazodilatátorov, regulovať lokálny prietok podľa požiadaviek konkrétneho riečiska. Lokálnymi faktormi autoregulácie sú pH, hypoxia či adenozín. Perfúzia sa prispôsobuje regionálnej aktivite a požiadavkám buniek.
Obr. 1. Regulácia krvného tlaku 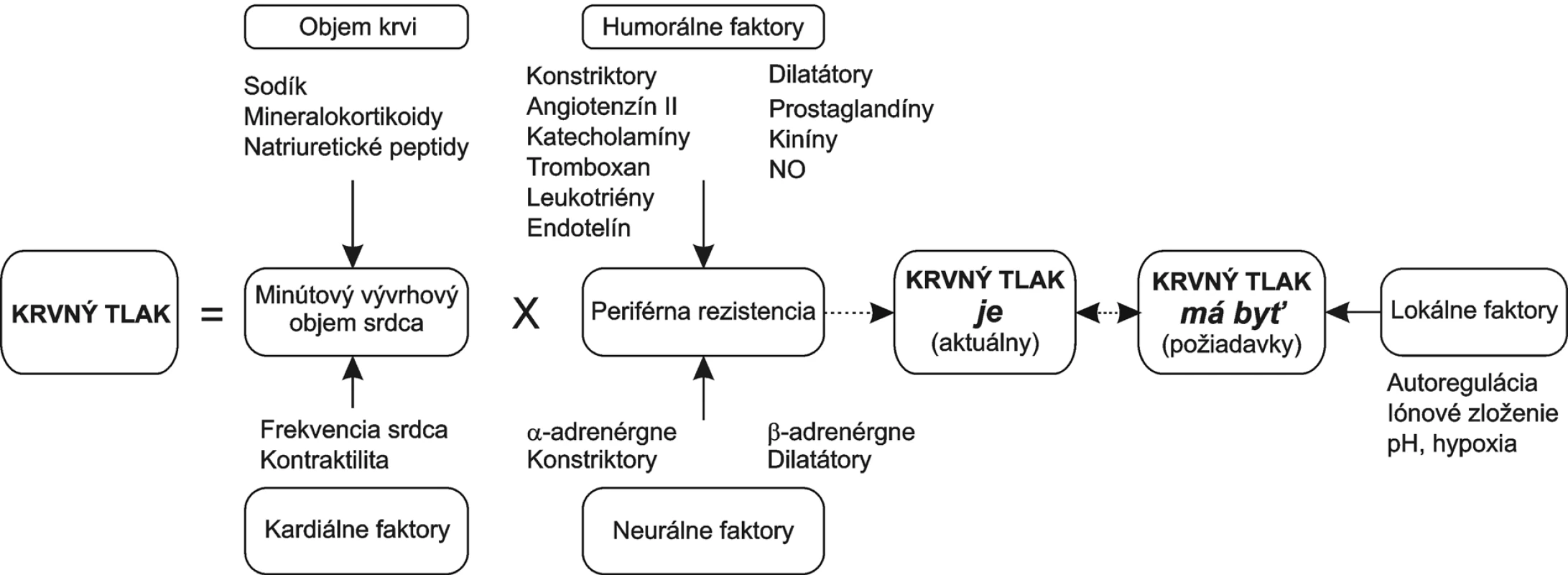
Z dlhodobého hľadiska je periférna rezistencia ovplyvnená aj remodeláciou ciev, spočívajúcou v generalizovanej arterioloskleróze a akcelerácii aterogenézy. Arterioloskleróza je charakterizovaná hyalínnou, hyperplastickou a hypertrofickou prestavbou ciev a postihuje stredné a malé artérie. V obličkách vedie k ich narovnaniu, čo zvyšuje účinnosť vazokonstrikcie a ďalej prispieva k fixácii hypertenzie.
Medzi ovplyvnením srdcového výdaja a periférnej rezistencie prebiehajú komplexné interakcie. Vazokonstrikcia sama o sebe zvyšuje afterload, a teda znižuje srdcový výdaj. Cirkulujúce vazokonstriktory však zároveň zvyšujú kontraktilitu myokardu a podporujú jeho hypertrofickú prestavbu. Tú podporuje aj samotná zvýšená hemodynamická záťaž zvýšením obratu intracelulárnych štruktúr kardiomyocytov. Podobne pôsobí hemodynamické preťaženie aj na arterioly a artérie podliehajúce hyperplastickej a hyalínnej arterioloskleróze. Hypertrofia srdca a remodelácia ciev majú teda nielen spoločné induktory (angiotenzín II, katecholamíny), ale sa aj samé o sebe sa navzájom podporujú. Ide o akési „pretláčanie“ medzi myokardom a cievami.
Ďalej si treba uvedomiť, že prietok krvným riečiskom je síce priamo úmerný tlakovej diferencii, ale je nepriamo úmerný periférnej cievnej rezistencii. Inými slovami, zvýšený krvný tlak pri zvýšenej periférnej rezistencii nemusí znamenať zlepšenie prietoku. Naopak, zvýšená periférna rezistencia znamená, že na udržanie toho istého prietoku treba zvýšený systémový tlak a teda väčšiu srdcovú prácu. Ak je zvýšenie tlaku krvi neprimerané zvýšeniu cievnej rezistencie, mikrocirkulácia môže byť dokonca zhoršená, vytvárajúc ďalšiu požiadavku na rast tlaku krvi. Vzniká tak bludný kruh, v rámci ktorého sa hypertenzia ďalej fixuje.
Homeostáza sodíka ovplyvňuje tlak krvi
Srdcový výdaj a periférna rezistencia sú ovplyvnené mnohými faktormi. Jedným z dôležitých, v súvislosti s patofyziológiou hypertenzie, je homeostáza sodíka. Hrá dôležitú úlohu v ovplyvnení extracelulárneho objemu, kontraktility srdca a ciev ale zrejme aj aktivity sympatického nervového systému.
Koncentrácia Na+ s príslušnými aniónmi určuje osmotický tlak extracelulárnej tekutiny. Zvýšenie koncentrácie Na+ vedie prechodne k stimulácii smädu, k zvýšenému príjmu vody, k sekrécii vazopresínu a nárastu objemu extracelulárnej tekutiny. Vzhľadom na túto autoreguláciu je koncentrácia Na+ stála aj napriek zmenám jeho obsahu. Tieto sa premietnu do zmien objemu extracelulárnej tekutiny. Osmolalita sa u zdravých jedincov udržiava na úkor objemu. Vplyvom na osmolalitu obsah sodíka podmieňuje objem extracelulárnej tekutiny. Ak zväčšenie objemu extracelulárnej tekutiny nie je kompenzované zvýšením poddajnosti kapacitného riečiska, vedie k zvýšeniu tlaku krvi.
Zmeny homeostázy sodíka však môžu ovplyvniť tlak krvi aj iným mechanizmom ako ovplyvnením extracelulárneho prostredia. Znížená aktivita Na+-K+ ATP-ázy alebo zvýšená priepustnosť membrány pre Na+ vedú k inhibícii Na+-Ca2+ pumpy a akumulácii Ca2+ v bunke. Naviac Na+-K+ pumpa je nevyhnutná pre reuptake noradrenalínu zo synaptickej štrbiny a pokles jej aktivity prispieva k periférnej sympatickej hyperaktivite. Zvýšená citlivosť na sympatické stimuly, alebo zvýšená intenzita týchto stimulov môžu prispievať k vzniku a udržaniu hypertenzie.
Experimentálne údaje naznačujú aj to, že problematika príjmu a vylučovania Na+ spojená s hypertenziou sa netýka iba obličiek a iných periférnych tkanív, ale aj centrálneho nervového systému (CNS). Poukazujú na to údaje zo štúdií využívajúcich genetický model Na+-senzitívnej hypertenzie. Predpokladá sa, že na vzniku tohto typu experimentálnej hypertenzie sa podieľajú abnormality transportu Na+ do likvoru, ktoré vyvolávajú neuronálnu reakciu prejavujúcu sa centrálnou sympatikovou hyperaktivitou (5, 6).
Kontrola sodíkovej bilancie
Kontrola sodíkovej bilancie sa uskutočňuje obličkami, ktoré sú schopné vylučovať sodík vo veľmi širokom rozpätí, od 1 do 500 mmol/24 hodín. Mechanicky je exkrécia sodíka závislá od arteriálneho tlaku, ktorý sa premieta do filtračného tlaku. Pri jeho zvýšení exkrécia Na+ stúpne a pri jeho poklese klesne. Keďže retencia Na+ vedie k zvýšeniu krvného tlaku, je prostredníctvom exkrécie sodíka regulovaný krvný tlak. Okrem priameho vplyvu tlaku krvi sa na kontrole sodíkovej bilancie podieľajú aj viaceré neurohumorálne mechanizmy ako natriuretické faktory, renín-angiotenzín-aldosterónový systém, či sympatický nervový systém.
Expanzia objemu krvi spôsobuje zároveň zvýšenú tvorbu natriuretických faktorov predsieňovým a komorovým myokardom. Tieto inhibujú reabsorpciu sodíka v distálnych tubuloch a ďalej tak prispievajú k vylučovaniu sodíka močom. Natriuretické peptidy zároveň indukujú vazodilatáciu, znižujú hladiny plazmatického renínu a aldosterónu a antagonizujú tak pôsobenie renín-angiotenzín-aldosterónového systému. Rekombinantný nátriuretický peptid sa opakovane používa pri akútnom zlyhaní srdca na zníženie hemodynamického preťaženia (7).
Lokálne prietok obličkami a diurézu významne ovplyvňujú aj vazodilatátory ako prostaglandíny (najmä PG2) inhibujúce transport sodíka v dreňovej oblasti širšej časti vzostupného ramienka Henleho slučky, bradykinín inhibujúci reabsorpciu sodíka v distálnych tubuloch a NO inhibujúci resorpciu sodíka v proximálnych tubuloch. Hypertenzia v prípade chronického obličkového ochorenia je kombináciou renín-dependentného a objemovo-dependentného mechanizmu. Obyčajne sa však nespája so zvýšenou renínovou plazmatickou aktivitou ale je senzitívna na soľno-vodnú rovnováhu.
Homeostáza sodíka je ďalej samozrejme ovplyvnená renín-angiotenzín-aldosterónovým systémom a sympatickým nervovým systémom.
Úloha vazodilatátorov v regulácii tlaku krvi a rozvoji hypertenzie
Za fyziologických okolností pôsobia vazodilatátory najmä lokálne, s úlohou regulovať najmä regionálny prietok. Napriek tomu je úloha deficitu vazodilatátorov v patogenéze hypertenzie pomerne nesporná. Je tomu tak najmä vďaka tomu, že dlhotrvajúce zvýšenie tlaku krvi a cirkulujúcich vazokonstriktorov vedie k prestavbe a poškodeniu artérií. Väčšina vazodilatátorov je produkovaná najmä endotelom (bradykinín, NO), vo väčšom množstve aj obličkou, niektoré aj myokardom (ANP). Generalizovaná endotelová dysfunkcia posúva rovnováhu medzi konstriktormi a dilatátormi na stranu konstriktorov. Skupina látok s vazodilatačným účinkom má aj účinok antifibrotický a antiproliferačný. Ich nedostatok podporuje hypertenznú remodeláciu kardiovaskulárneho systému, ktorá dodatočne vazokonstrikcii pomáha fixovať zvýšený tlak krvi (obr. 1).
Úloha renín-angiotenzín-aldosterónového systému v regulácii tlaku krvi a rozvoji hypertenzie
Renín-angiotenzín-aldosterónový systém ovplyvňuje komplexne mnoho faktorov vplývajúcich na výšku krvného tlaku: srdcový výdaj ovplyvnením kontraktility a vplyvom na retenciu sodíka, periférnu rezistenciu a remodeláciu srdca a ciev.
Renín je uvoľňovaný do cirkulácie bunkami juxtaglomerulárneho aparátu a macula densa. Jeho uvoľňovanie je ovplyvnené zmenami tlaku v aferentnej arteriole, sodíkovou náložou v distálnom tubule, cirkulujúcim angiotenzínom II a stimuláciou beta receptorov v obličke. Renín konvertuje angiotenzinogén na neaktívny angiotenzín I, ktorý je ďalej najmä v pľúcach, ale aj obličkách, srdci a mozgu premieňaný angiotenzín-konvertujúcim enzýmom (ale aj chymázou) na aktívny angiotenzín II. Angiotenzín II zvyšuje periférnu rezistenciu priamo ovplyvnením hladko-svalových buniek, stimuluje sympatické autonómne centrá a stimuluje tvorbu aldosterónu a vazopresínu. Pôsobením aldosterónu sa zvýši reabsorpcia sodíka v distálnych tubuloch a zvýši sa vylučovanie draslíka. Nízke hladiny draslíka prispievajú k vazokonstrikcii uzatváraním K+ kanálov. Vazopresín prispieva retenciou vody k zväčšeniu extracelulárneho objemu.
Úloha renín-angiotenzín-aldosterónového systému v patogenéze hypertenzie nie je úplne objasnená. Pravdepodobne sa významne podieľa na rozvoji renovaskulárnej hypertenzie. Zrejme prispieva aj k rozvoju esenciálnej hypertenzie u niektorých pacientov. Afroameričania a starší pacienti mávajú zvyčajne nízke hladiny renínu aj angiotenzínu II.
Neurohumorálne regulačné mechanizmy
Významné postavenie v regulácii krvného tlaku má CNS. Krátkodobo, akútne, sa podieľa CNS, konkrétne sympatický nervový systém, na regulácii krvného tlaku prostredníctvom baroreflexu. Príkladom pôsobenia tohto mechanizmu je prispôsobenie krvného tlaku – vyrovnanie poklesu krvného tlaku po vzpriamení prostredníctvom aktivácie sympatického nervového systému. O význame baroreflexu v dlhodobej regulácii krvného tlaku sa však polemizuje (8).
CNS sa však v kooperácii s ďalšími neurohumorálnymi systémami podieľa aj na dlhodobej regulácii tlaku krvi (9). Dlhodobá sympatická stimulácia prispieva k hypertrofickej prestavbe srdca a ciev, podporuje tvorbu renínu a aktiváciu renín-angiotenzín-aldosterónového systému a prispieva tak ďalej k remodelácii kardiovaskulárneho systému, ako aj k retencii sodíka.
Príspevok aktivity sympatického nervového systému k regulácii tlaku krvi je u hypertenzných ale aj prehypertenzných pacientov vyšší ako u normotenzných osôb (10). Je otázkou, či je táto zvýšená odpoveď daná vyššou aktivitou sympatického nervového systému, alebo zvýšenou odpoveďou periférnych tkanív na sympatickú stimuláciu. Mnohí prehypertenzní pacienti majú zvýšenú pokojovú pulzovú aktivitu a niektorí hypertenzní pacienti aj plazmatické koncentrácie katecholamínov. U veľkej skupiny prehypertenzných a hypertenzných pacientov bol preukázaný zvýšený kardiálny a renálny spillover (index aktivity sympatikových nervov v týchto orgánoch), vyššia aktivita sympatických nervov v svaloch, zvýšené plazmatické hladiny noradrenalínu, a spektrálnou analýzou variability krvného tlaku dokázaná zvýšená aktivita sympatického nervového systému pri hypertenzii (11).
Mechanizmus, ktorý tvorí základ aberantnej sympatikovej hyperaktivity, ktorá je pozorovaná pri esenciálnej hypertenzii, nie je objasnený. Môže byť výsledkom zmien v činnosti aferentných a eferentných neurálnych dráh a v centrálnej neurálnej integrácii informácií podieľajúcich sa na regulácii krvného tlaku (12). U pacientov s esenciálnou hypertenziou bolo zistené, že baroreflexové funkcie sú znížené, čo môže potencovať akékoľvek ďalšie presorické mechanizmy, ktoré sa môžu na vzniku hypertenzie ďalej podieľať. Predpokladá sa, že narušenie baroreceptorových funkcií môže zohrávať významnú úlohu v patogenéze hypertenzie napríklad u jedincov s aterosklerózou, alebo iným stavom spojeným so znížením arteriálnej poddajnosti v oblasti ciev, ktoré obsahujú baroreceptory. Uvažuje sa aj o narušení uvoľňovania a spätného vychytávania noradrenalínu sympatikovými nervovými zakončeniami, ale aj o centrálnom pôsobení hyperinzulinémie na sympatikovú aktivitu.
Medzi jednotlivými neurohumorálnymi mediátormi však prebiehajú veľmi komplexné interakcie. Koncentrácia Na+ , produkcia NO, či aktivita renín-angiotenzín-aldosterónového systému zrejme neovplyvňujú krvný tlak len priamo, účinkom na periférne tkanivá, ale asi aj nepriamo, prostredníctvom ovplyvnenia aktivity sympatického nervového systému. Predpokladá sa, že zníženie hladín NO súčasne so zvýšením hladín angiotenzínu II v mozgových oblastiach regulujúcich krvný tlak môže viesť k zvýšeniu aktivity sympatikového nervového systému (13).
Potenciálne najdôležitejšie mechanizmy, ktoré sa zúčastňujú na vzniku esenciálnej hypertenzie
Na patogenéze hypertenzie sa pravdepodobne podieľa komplexná interakcia environmentálnych a genetických faktorov (14).
Vplyv environmentálnych faktorov na patogenézu hypertenzie
Environmentálne faktory zahŕňajú najmä stres, obezita, fajčenie, nedostatok pohybovej aktivity a nadmerná konzumácia NaCl sú exogénne faktory s významnou úlohou pri vzniku a rozvoji hypertenzie. Ich excesívne pôsobenie má pri každej hypertenzii zosilňujúci účinok.
Komplexným faktorom prispievajúcim k rozvoju a prognóze temer každého ochorenia a osobitne hypertenzie je kvalita života. Najpodstatnejšou mierou kvalitu života vo vzťahu k zdraviu ovplyvňuje psychologický stres (15).
Akútna stresová reakcia umožňuje zvládnuť pôsobenie nepriaznivých faktorov a je preto pre organizmus prospešná. Stresová reakcia zahŕňa najmä aktiváciu sympatoadrenálneho systému a hypotalamo-hypofýzo-adrenokortikálnej osi. Nasleduje rýchly vzostup plazmatických hladín katecholamínov, ktoré modifikujú činnosť organizmu tak, aby mohol vykonať intenzívnu svalovú prácu. Je to starý adaptačný mechanizmus, ktorý umožňoval našim predkom zahájiť reakciu útoku alebo úteku. Neskoršie v dôsledku aktivácie hypotalamo-hypofyzárnej-adrenokortikálnej osi sa menia energetické pomery v organizme (ktoré boli narušené excesívnym vyplavením katecholamínov) s cieľom zvládnuť stresovú situáciu. U človeka sú však potenciálne stresory podrobené kognitívnemu posúdeniu, ktoré im prisúdi aj „fyziologickú“ významnosť. Miera reálnej a prisúdenej fyziologickej významnosti stresorov však môže byť odlišná a stresová odpoveď na zvládnutie danej situácie premrštená, alebo až zbytočná. V súčasnosti však človek zväčša na pôsobenie stresora nereaguje reakciou útoku alebo úteku. Dôjde síce k zvýšeniu bdelosti, skráteniu reakčného času, ale kostrové svaly nie sú adekvátne zaťažené, a preto nevyužívajú zvýšený prísun krvi, v ktorej sa nachádza zvýšené množstvo energetických substrátov. Časť hormonálnych a metabolických zmien pri stresovej reakcii preto prebehne bez toho, aby boli organizmom adekvátne využité. Výsledkom chronického, fyziologicky neodôvodneného stresu môže byť vznik metabolického syndrómu so všetkými jeho negatívnymi dôsledkami, ktoré okrem iného môžu viesť k zvýšenej aktivite sympatikového nervového systému či už následkom aterosklerotických zmien, ktoré môžu narušiť činnosť baroreceptorov, alebo v dôsledku pôsobenia zvýšených plazmatických hladín inzulínu (16). Chronický stres môže spôsobiť zvýšenie krvného tlaku aj v dôsledku zmien aktivity mozgových oblastí zapojených do stresovej reakcie, medzi ktoré patria oblasti hypotalamu (napr. nucleus paraventricularis), limbického systému (napr. amygdala) a mozgového kmeňa (napr. rostrálna ventrolaterálna predĺžená miecha, nucleus tractus solitarii). Všetky uvedené mozgové štruktúry modulujú činnosť kardiovaskulárneho systému. Príkladom môže byť amygdala. Okrem toho, že významne moduluje emočné reakcie na pôsobenie stresu, inervuje aj oblasti mozgového kmeňa podieľajúce sa na regulácii baroreflexu (nucleus tractus solitarii) a reguluje aktivitu štruktúr riadiacich činnosť sympatikového nervového systému (rostrálna ventrolaterálna predĺžená miecha). Zníženie senzitivity baroreflexu a zvýšenie aktivity sympatikového nervového systému, ako dôsledok dlhodobej aktivácie amygdaly a ďalších mozgových štruktúr, môže predstavovať jeden z mechanizmov, ktorým sa môže chronický stres podieľať na vzniku hypertenzie (17, 18).
Konzumácia alkoholu a fajčenie počas gravidity sú spojené s častejším výskytom hypertenzie u potomkov týchto matiek. Nízka pôrodná hmotnosť, zlé socioekonomické podmienky počas gravidity, fajčenie a abúzus alkoholu s veľkou pravdepodobnosťou súvisia nielen s častým výskytom hypertenzie, ale aj s častým výskytom aterosklerózy, diabetu, mozgových príhod, akútneho infarktu myokardu u týchto potomkov (19). Vplyv alkoholu na vznik hypertenzie je kontroverzný. WHO robila v roku 2000 komparatívnu analýzu na objasnenie protektívneho účinku červeného vína – a vzťahu hypertenzie a alkoholu. Je veľmi pravdepodobné, že pri alkohole ide o dvojaké pôsobenie. Preto neprekvapuje konfúzia medzi vzťahom alkoholu k hypertenzii a jeho protektívnym efektom pri koronárnych chorobách (20, 21).
Úloha príjmu soli v patogenéze hypertenzie je podložená mnohými epidemiologickými štúdiami z rôznych oblastí a krajín sveta, z ktorých vyplýva, že prevalencia hypertenzie je priamo úmerná množstvu prijímanej soli. Naopak, klinické štúdie poukazujú na to, že k poklesu tlaku krvi dochádza paralelne so zmenšením extracelulárneho vodného priestoru. Takýto účinok majú aj diéty obsahujúce výrazne znížený obsah soli a kontinuálna diuretická liečba. Zvýšený príjem soli zvyšuje objem extracelulárnej tekutiny a následne aj srdcový výdaj a periférny cievny odpor (obr. 2). Okrem toho primárne zvyšuje periférnu rezistenciu ciev. Pri nadmernom príjme nátria sa zvyšuje aj koncentrácia Na+ v svalových bunkách cievnej steny. Preto sa v nej prostredníctvom poklesu aktivity Na+/Ca+ výmenníka zadrží i viac kalciových iónov. Tým sa zvýši citlivosť cievnej steny na vazokonstrikčné podnety.
Význam genetických faktorov v patogenéze hypertenzie
Genetické faktory majú veľký význam pri nastavení úrovne krvného tlaku. Robili sa sledovania u monozygotných a dizygótnych dvojčiat a sledovali sa hodnoty krvného tlaku u adoptívnych detí. Odhaduje sa, že genetický podiel na variáciách krvného tlaku je okolo 30–50 % (22).
V súčinnosti so zvýšeným príjmom soli sa však na patogenéze hypertezie uplatňuje aj defekt v schopnosti obličiek vylúčiť nadkritické množstvo sodíka. Jedným z možných vysvetlení by mohli byť zmeny v transporte katiónov cez bunkové membrány. Aby bola udržaná konštantná nízka koncentrácia Na+ v bunke je sodík vypudzovaný aktívnymi transportnými mechanizmami (Na+-K+ - ATP-ázy a Na+-K+-kotransportu). Porucha týchto transportných mechanizmov môže znížiť aktívne vypudzovanie nátria z bunky. Zvýšenie intracelulárneho Na+ následne vedie k zvýšeniu obsahu voľného intracelulárneho Ca2+. Transportné systémy sú aj vo formovaných krvných elementoch (Er, Tr, Le), čo umožňuje študovať aktivitu týchto systémov pre Na+ aj u ľudí.
Medzi ďalšie potenciálne zodpovedné faktory môžu patriť zmeny aktivít ďalších prenášačov. Je dokázaná hyperaktivita Na+/H+ – výmenného mechanizmu u ľudí s hypertenziou, najmä v krvných elementoch a kostrovom svalstve. Aktivovaný sodíkovo-protónový antiporter zosilňuje tubulárnu reabsorpciu sodíka a posúva renálnu funkčnú krivku k vyšším tlakom. V cievnych myocytoch však zvýšenie intracelulárnej koncentrácie kalcia zvyšuje cievny tonus.
Zvýšená sekrécia endogénneho inhibítora Na+ - K+ - ATP-ázy indukovaná retenciou soli a zvýšením extracelulárneho objemu by mohla predstavovať mechanizmus zodpovedný za normalizáciu pôvodne zvýšeného srdcového výdaja ale aj za udržiavanie hypertenzie periférnou vazokonstrikciou.
Medzi gény sodíkového systému, ktorých polymorfizmus sa spája so zmenami krvného tlaku môžu patriť gény pre α adducín, β-adducín, α-podjednotka epitelového sodíkového kanála a atriálny natriuretický peptid. Liddleov syndróm spočíva v mutácii génu pre epitelové Na+ kanály (ENaCs). Tieto kanály sa podieľajú na spätnej resorpcii sodíka a ich expresiu a aktivitu zvyšuje aldosterón. Následkom ich mutácie je excesívna reabsorpcia Na+ inhibujúca tvorbu renínu a aldosterónu a vedúca k rozvoju „nízkorenínovej“ soľ-senzitívnej hypertenzie. Opakom Liddleovho syndrómu je pseudohypoaldosteronizmus typ 1, ktorý charakterizuje hyperkaliémia a „straty“ sodíka. Tieto majú za následok hyponatriémiu a zmenšenie objemu extracelulárnej tekutiny. Mutácia má za následok zníženú reabsorpciu Na+ (opačne ako pri Liddleovom syndróme).
Pri Bartterovom syndróme ide o poruchu transportu NaCl v dôsledku mutácie sodíkovo-káliového a chloridového kotransportéra, renálneho káliového kanála regulovaného ATP, renálnych špecifických bazolaterálnych chloridových kanálov alebo Bartin-proteínu. Je to podobný obraz, aký vzniká po aplikácii niektorých diuretík. Následkom porušenej reabsorpcie NaCl sa trvale znižuje objem cirkulujúcej krvi. Ten je príčinou aktivácie renín-angiotezín aldosterónového systému a vysokorenínovej hypertenzie. Pri Gitelmanovom syndróme ide o fenotypovú variantu Bartterovho syndrómu. Hypokaliémia, metabolická alkalóza, hypokalciúria a hypomagneziémia sú prítomné s normálnym krvným tlakom, ale so zvýšenou plazmatickou hladinou renínu a aldosterónu (obr. 2).
Obr. 2. Komplex faktorov ovplyvňujúcich krvný tlak 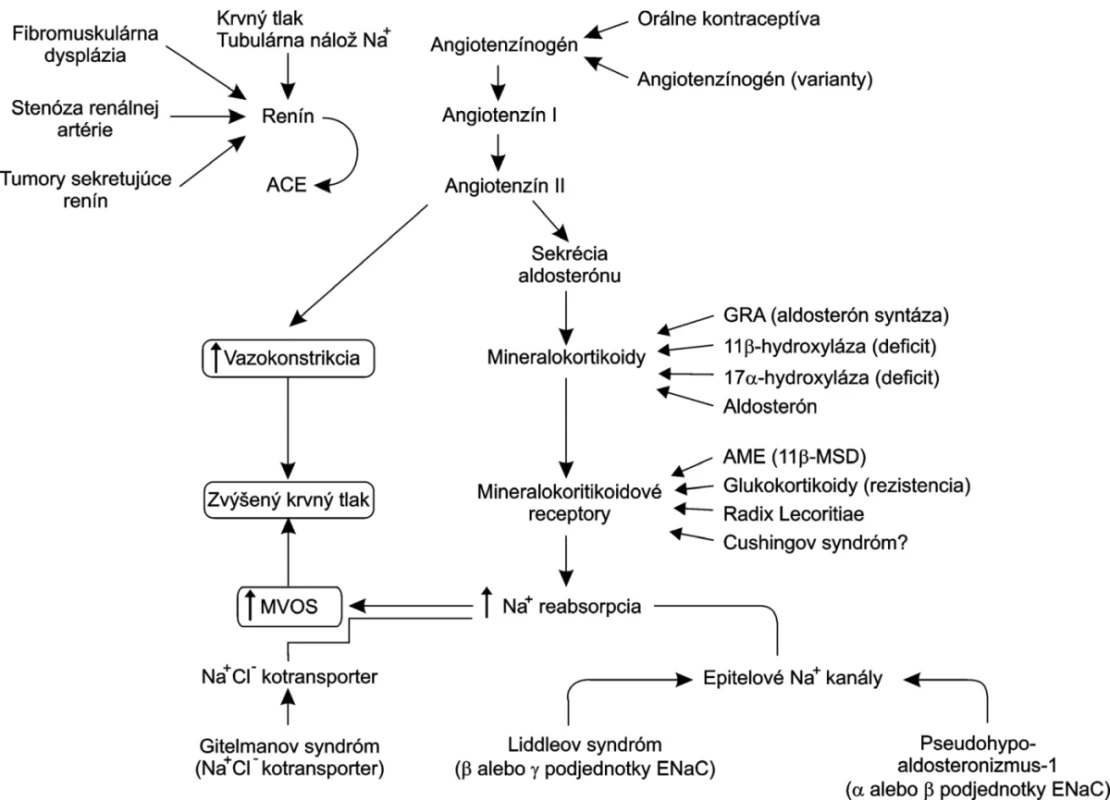
Medzi ďalšie systémy, ktoré môžu byť potenciálne genetické alterácie a môžu mať za následok rozvoj, alebo väčšiu náchylnosť k hypertenzii patrí renín-angiotenzín-aldosterónový systém. Spomedzi genetických štúdii sa teraz venuje veľká pozornosť angiotenzínogénu. Polymorfizmy génu pre angiotenzín sú skutočnosťou, s ktorou treba pri hypertenzii „rátať“ (23, 24). V štúdiách s vypnutím génov sa zistilo, že existujú situácie s vysokou expresiou prorenínu. Vysoká hladina prorenínu bola v cirkulujúcej krvi. Jeho účinok na kardiomyocyty závisí od prorenínového receptora (25). K hypertenzii môžu prispievať aj genetické defekty enzýmov, ktoré sa týkajú aldosterónového metabolizmu (aldosterónsyntáza, 11β-hydroxyláza, 17α-hydroxyláza). Tieto defekty spôsobujú adaptívne zvýšenie sekrécie aldosterónu, zvýšenie reabsorpcie vody a soli a zväčšenie objemu plazmy.
Medzi ďalšie gény, ktorých polymorfizmus sa skúma z hľadiska regulácie krvného tlaku, patria gény signálnych transdukčných dráh (kódujúce G-proteíny, adrenergické a glukagónové receptory, inzulínový rastový faktor 1), gény endotelínového systému (kódujúce endotelíny a ich receptory, NOS3) a gény pre apolipoproteíny a cytokíny.
Pri vzniku esenciálnej hypertenzie sa nemôže predpokladať jedna izolovaná porucha v regulácii krvného tlaku. Pravdepodobne ide o kombináciu porúch viacerých mechanizmov, ktoré regulujú výšku krvného tlaku (obr. 2).
Zmeny komplexných mechanizmov nemusia byť kvantitatívne nadlimitné. Ich dôsledkom môže byť mierne zvýšenie objemu cirkulujúcej krvi, ktoré sa stáva príčinou „prebudovania“ celej hemodynamiky. V experimente postačuje zvýšenie objemu plazmy o 2 % na to, aby sa po niekoľkých týždňoch vyvinula hypertenzia. Zistiť alebo „dokázať“ zvýšenie objemu plazmy o 2 % sa nepodarí ani pri exaktných experimentálnych alebo klinicko-fyziologických sledovaniach.
Zvýšenie objemu plazmy a „spustenie“ rozvoja hypertenzie môžu mať naraz na svedomí mutácie viacerých génov. Jednotlivé syndrómy sa pritom nemusia klinicky manifestovať ako samostatné ochorenie. Zmeny môžu byť veľmi diskrétne. Pri ich dlhodobom pretrvávaní v rámci komplexného deja akým je regulácia krvného tlaku môžu mať mimoriadne významnú úlohu.
Mikrocirkulácia a hypertenzia
Veľkým problémom je mikrocirkulácia. Prietok krvi cez kapilárna riečisko sa riadi fyzikálnymi zákonmi. V detailoch nedokážeme kvantifikovať myogénne napätie arteriól, ani transmurálny tlak v kapilárach (26–28).
Je veľmi pravdepodobné, že kapilárne riečisko funguje ako modulárny systém. Krv nepreteká stále cez všetky kapiláry. Striedanie prietoku a „neprietoku“ tvorí zložitý neprebádaný systém. Kapiláry majú priemer od 4 do 12 μm, erytrocyty 7,2 μm. Z uvedeného vyplýva, že prietok krvi cez kapiláry nemá analógiu v prietoku vody cez elastický systém. Asi by bolo veľmi iluzórne predstavovať si, že v kapilarizovanom tkanive prebiehajú veľmi blízko seba procesy filtrácie a reabsorpcie súčasne. Argument môžeme vidieť v štruktúre obličiek. Arteriálny koniec kapiláry s filtráciou predstavujú kapiláry v glomeruloch a venózny koniec kapilár predstavujú peritubulárne kapiláry.
Pri predstave modulárneho systému mikrocirkulácie určitý čas prebieha filtrácia a následne v tých istých kapilárach reabsorpcia. Striedanie filtrácie a reabsorpcie je asi zložitým systémom, ktorého zmeny si vynucujú prítok krvi pod vyšším tlakom.
Zmeny frekvencie akcie srdca v zmysle zvýšenia frekvencie predstavujú ďalší problém. Pulzové vlny narážajú na seba a výsledkom môže byť zníženie prietoku. Každé zvýšenie frekvencie akcie srdca spôsobí zvýšenie naplnenia systému, ale nie zvýšenie prietoku cez mikrocirkuláciu, cez kapiláry. Pri adrenergnej stimulácii by zvýšenie tlaku bez zvýšenia frekvencie akcie srdca bolo pre organizmus výhodnejšie. Všetko je však záležitosťou komplexného systému regulácie a účasti sympatika v adaptácii cirkulácie na najrôznejšie podnety.
Patofyziologické východisko pre možný terapeutický benefit
Esenciálna hypertenzia je následkom komplexných multifaktoriálnych porúch. V niektorých prípadoch to môže byť mutácia jedného génu vo veľkej populácii. S veľkou pravdepodobnosťou esenciálna hypertenzia je výsledkom kombinácie mutácií a polymorfizmov niektorých génov, ktoré ovplyvňujú krvný tlak v interakcii s rôznymi environmentálnymi faktormi. Environmentálne faktory, ako sú stres a nadmerný príjem soli, môžu mať u predisponujúcich osôb tlak zvyšujúci účinok. Pri „spustení hypertenzie“ sa do regulácie krvného tlaku „vtiahnu“ obličky, ktoré by mali zvýšiť elimináciu NaCl a vody. Hypertenzia bude pretrvávať ak sú v prípade jej spustenia zmenené mechanizmy:
- zodpovedné za elimináciu sodíka obličkami, alebo
- zodpovedné za hladiny presorických látok, alebo
- zodpovedné za reaktivitu hladkej svaloviny ciev, alebo
- zodpovedné za proliferáciu tejto svaloviny.
Zvýšenie objemu krvi a zvýšenie periférnej rezistencie sa „zúčastnia“ na udržiavaní hypertenzie. Hypertenzia akceleruje aterogenézu a vyvoláva degeneratívne zmeny v médii ciev. Degeneratívne zmeny sa často prejavujú ako disekujúca aneuryzma aorty alebo ako akútne cerebrovaskulárne „príhody“.
V iných prípadoch hypertenzia má za následok hyalínnu alebo hyperplastickú arteriosklerózu.
Pri hyalínnej arterioskleróze ide o hyalínne zhrubnutie stien arteriol. V mieste zhrubnutia nie sú prítomné normálne súčasti cievnej steny. Hyalínne zhrubnutie tvorí súvislú cirkulárnu vrstvu arteriol v ich celej dĺžke. Hyalínna arterioskleróza sa zisťuje u starších pacientov s hypertenziou. Býva však prítomná aj u normotonikov. U hypertonikov však býva výraznejšia a generalizujúca. Býva prítomná aj u diabetikov. Považuje sa za súčasť obrazu angiopatie. Homogénny materiál, ktorý tvorí obraz hyalínnej arteriosklerózy, sa tvorí zo zložiek plazmy, ktoré prechádzajú cez endotel a z extracelulárneho matrixu, ktorý produkujú hladké svalové bunky. Hyalínna arterioskleróza je hlavnou morfologickou charakteristikou benígnej nefrosklerózy. Hyalínna aterioskleróza zužuje lúmen ciev.
Pri hyperplastickej arterioskleróze ide o koncentrické laminárne zhrubnutie stien arteriol, ktoré veľmi výrazne zužuje lúmen ateriol. Lamely sú tvorené hladkými svalovými bunkami a reduplikovanými bazálnymi membránami. Pri malígnej hypertenzii lamely obsahujú fibrinoidné depozity a bývajú prítomné akútne nekrózy. V tomto prípade sa nález označuje ako nekrotizujúca arteriolitída. Hyperplastická arterioskleróza sa častejšie vyskytuje pri výraznejšom a rýchlo vznikajúcom zvýšenom krvnom tlaku. Výraznejšia býva pri vysokom diastolickom tlaku.
Remodelácia cievneho riečiska je skutočnosťou, ktorá „zafixuje“ hypertenziu. Remodelácia sa týka veľkých ciev a aj mikrocirkulácie. Vo veľkých cievach sa remodelácia môže kvantifikovať. Remodeláciu na úrovni mikrocirkulácie nedokážeme posúdiť. Môže to byť minimálna zmena v prúdení krvi cez kapiláry alebo minimálny „odklon“ priepustnosti kapilár. Postupne sa remodelácii cievneho riečiska „prispôsobia“ všetky orgány. Hypertenzia nemá za následok zlepšenie oxygenácie tkanív. Skôr naopak. Terapeutické zníženie tlaku môže na určitý čas, do vytvorenia novej rovnováhy a remodelácie, nepriaznivo ovplyvniť oxygenáciu tkanív (obr. 3).
Obr. 3. Hlavné faktory patogenézy esenciálnej hypertenzie 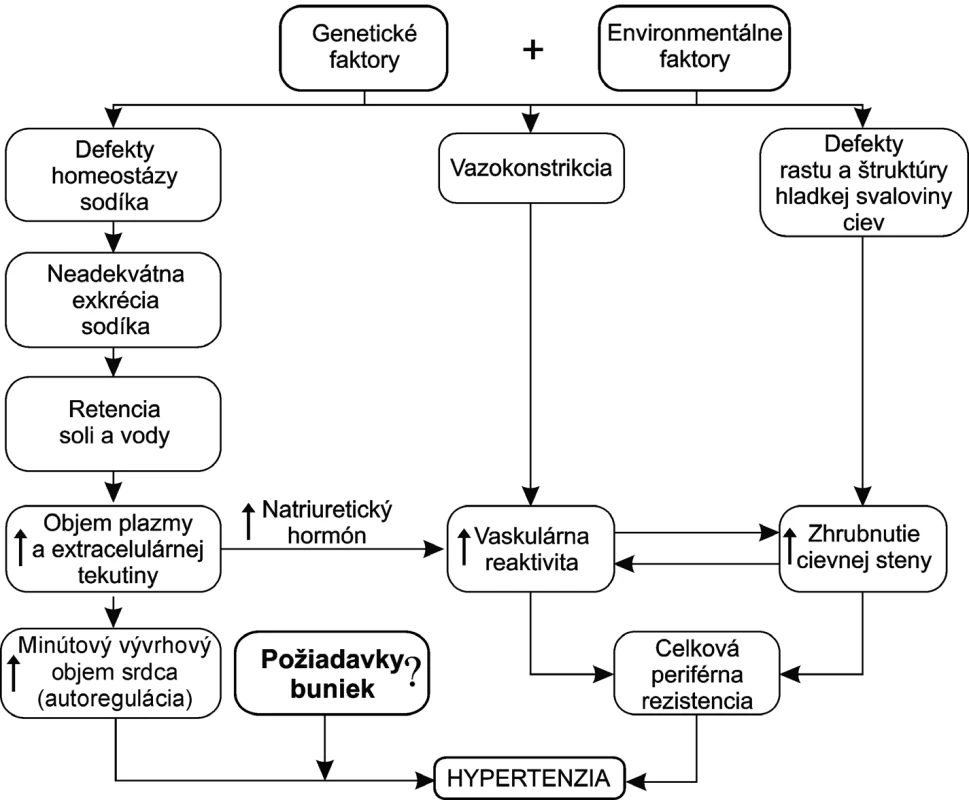
Ani v budúcnosti asi nebude možné určiť všetky polymorfizmy a zmenené molekulové mechanizmy zodpovedné za vznik hypertenzie. Pri presnom určení zmenených molekulových mechanizmov by bol vznik a rozvoj hypertenzie s veľkou pravdepodobnosťou ich následkom. V iných prípadoch vznik hypertenzie môže byť nevyhnutnosťou pre zabezpečenie prívodu kyslíka pod vyšším tlakom preto, že je to potrebné vzhľadom na odlišnosti štruktúry mikrocirkulácie.
Záver
Hypertenzia môže byť následnou zmenou porušenej regulácie cirkulácie a regulácie objemu cirkulujúcej krvi. V takomto prípade je hypertenzia pre organizmus „nepotrebná“. Je obrazom poruchy. Pre organizmus neprináša nijakú výhodu, alebo užitočnosť a jej liečba je plne opodstatnená. Liečbou sa odstráni záťaž srdca, obličiek, ciev a vo veľkej miere sa liečbou eliminuje nebezpečie mozgovej príhody, infarktu myokardu, preťaženia srdca a vývinu aterosklerózy.
Hypertenzia môže byť nevyhnutnou reakciou pre zabezpečenie adekvátneho prívodu krvi do kapilárneho riečiska. Mohli by sme povedať, že vzniká s cieľom zabezpečenia optimálnej dodávky kyslíka do tkanív. Preto by sme ju mohli označiť ako „potrebná“ hypertenzia. V takomto prípade terapeutické zníženie krvného tlaku môže mierne znížiť prívod kyslíka do tkanív. Je dobre známe, „čo dokáže urobiť“ hypoxická periféria pri šoku a pri kardiálnej dekompenzácii.
Optimalizácia krvného tlaku radikálnou liečbou nemusí byť v každom prípade „optimálna“ z hľadiska potrebného prietoku krvi tkanivami. Zníženie krvného tlaku odstráni hrozbu katastrof. Na druhej strane môže byť príčinou zhoršenia prietoku krvi tkanivami so všetkými dlhodobými následkami.
V dlhom časovom úseku môže mať zníženie krvného tlaku za následok „spustenie“ neželaných javov. Liečenie hypertenzie podľa „výšky krvného tlaku“ by mohlo byť tou skutočnosťou, ktorá by mohla byť v budúcnosti príčinou neželaných následkov z dlhodobej hypoxie. Liečenie hypertenzie eliminuje nebezpečenstvo vzniku mozgovej príhody, infarktu myokardu a srdcového zlyhania. Nateraz by sme mohli uvažovať aj o tom, že radikálna liečba hypertenzie by mohla podporovať alebo akcelerovať rozvoj Alzheimerovej choroby. Mierna dlhodobá hypoxia veľmi nepriaznivo ovplyvňuje aj karcinogenézu.
Skratky
ANP – atriálny natriuretický peptid
CNS – centrálny nervový systém
ENaCs – epitelové Na+ kanály
WHO – Světová zdravotnická organizace (World Health Organization)
Táto práca bola podporená grantom APVV-0045-06 and VEGA Grant 1/3422/06.
Dodatok
Podľa historických prameňov Časopis lékařů českých bol založený ako seriózny časopis s predstavou miernej irónie a opisu úsmevných situácií vo vtedajšej lekárskej praxi. Preto si dovoľujeme odcitovať niekoľko viet z korešpondencie Voskovca a Wericha o probléme liečby hypertenzie: „Už dávno jsem se ti chtěl zmínit o Hemingwayovi. Je to děsná škoda a tragédie, že se Hemingway zastřelil. Pepík Brumlík tvrdí, že to má na svědomí Mayo Clinic, blbý to t.zv. specialisté na hypertension, čili zvýšený krevní tlak. Američtí dogmatisté v tom oboru snižují lidem krevní tlak surovými drogami, které mají děsně depresivní „side-effects“. Hemingway se tomu podrobil a v nějaké takové depresi se bouchnul. Brumlík tvrdí, že nebejt toho blbýho léčení, moh’ bejt šťastnej a plodnej eště aspoň deset, patnáct let, tlak netlak. Relata medicinata referro.“ (Voskovec, J., Werich, J.: Korespondence 1. Praha, Akropolis, 2007, s. 343.)
Zdroje
1. Weder, A. B.: Evolution and hypertension. Hypertension 2007, 49, s. 260–265.
2. Kaplan, N. M.: Clinical trials for hypertension: expectations fulfilled and unfulfilled. Hypertension, 2007, 49, s. 257–259.
3. Vimo, A., Winblad, B., Angero-Torres, H., von Strauss, E.: The magnitude of dementia occurrence in the world. Alzheimer Dis. Assoc. Disord., 2003, 17, s. 63–67.
4. Staessen, J. A., Richart, T., Birkenhäger, V. H.: Less atherosclerosis and lower blood pressure for a meaningful life perspective with more brain. Hypertension, 2007, 49, s. 384–400.
5. Huang, B. S., Amin, M. S., Leenen, F. H.: The central role of the brain in salt-sensitive hypertension. Curr. Opin. Cardiol., 2006, 21, s. 295–304.
6. Leenen, F. H., Ruzicka, M., Huang, B. S.: The brain and salt-sensitive hypertension. Curr. Hypertens. Rep., 2002, 4, s. 129–135.
7. Gardner, D. G., Chen, S., Glenn, D. J., Grigsby, C. L.: Molecular biology of the natriuretic peptide system: implications for physiology and hypertension. Hypertension, 2007, 49, s. 419–426.
8. Thrasher, T. N.: Baroreceptors, baroreceptor unloading, and the long-term control of blood pressure. Am. J. Physiol. Regul. Integr. Comp. Physiol., 2005, 288, s. 819–827.
9. Osborn, J. W.: Hypothesis: set-points and long-term control of arterial pressure. A theoretical argument for a long-term arterial pressure control system in the brain rather than the kidney. Clin. Exp. Pharmacol. Physiol., 2005, 32, s. 384–393.
10. Chobanian, A. V.: Prehypertension revisited. Hypertension 2006, 48, s. 812–814.
11. Biaggioni, I.: Sympathetic control of the circulation in hypertension: lessons from autonomic disorders. Curr. Opin. Nephrol. Hypertens., 2003, 12, s. 175–180.
12. Hogarth, A. J., Mavkintosh, A. F., Marz, D. A. S. G.: The effect of gender on the sympathetic nerve hyperactivity of essential hypertension. J. Hum. Hypertension, 2007, 21, s. 239–245.
13. Ramchandra, R., Barrett, C. J., Malpas, S. C.: Nitric oxide and sympathetic nerve activity in the control of blood pressure. Clin. Exp. Pharmacol. Physiol., 2005, 32, s. 440–446.
14. Hall, J. E.: Hypertension update 2006. Hypertension, 2006, 48, s. 343–346.
15. Baune, B. T., Aljeesh, Y.: The association of psychological stress and health related quality of life among patients with stroke and hypertension in Gaza Strip. Ann. Gen. Psychiatry, 2006, 5, s. 1–8.
16. Vanitallie, T. B.: Stress: a risk factor for serious illness. Metabolism 2002, 51, s. 40–45.
17. Saha, S.: Role of the central nucleus of the amygdala in the control of blood pressure: descending pathways to medullary cardiovascular nuclei. Clin. Exp. Pharmacol. Physiol., 2005, 32, s. 450–456.
18. Lechin, F., van der Dijs, B.: Central nervous system circuitry and peripheral neural sympathetic activity responsible for essential hypertension. Currr. Neurovasc. Res., 2006, 3, s. 307–325.
19. Parker, D. J. P.: Birth weight and hypertension. Hypertension, 2006, 48, s. 357–358.
20. Beilin, L. J., Puddey, I. B.: Alcohol and hypertension: an update. Hypertension, 2006, 47, s. 1035–1038.
21. The WHOQOL Group. Development of the World Health Organization QHOQOL – BREF quality of life assessment. Psychol. Med. 1998, 28, s. 37–50.
22. Marteau, J. B., Zaiou, M., Siest, G., Visvikis-Siest, S.: Genetic determinants of blood pressure regulation. J. Hypertens., 2005, 23, s. 2127–2143.
23. Dickson, M. E., Sigmund, C. D.: Genetic basis of hypertension. Hypertension, 2006, 48, s. 14–20.
24. Lalouel, J. M., Rohrwasser, A.: Genetic susceptibility to essential hypertension. Insight from angiotensinogen. Hypertension, 2007, 49, s. 597–603.
25. Burchlé, C., Bader, M.: Prorenin and its ancient receptor. Hypertension, 2006, 48, s. 549–551.
26. Feihl, F., Liaudet, L., Waeber, B., Levy, B. I.: Hypertension. A disease of the microcirculation. Hypertension, 2006, 48, s. 1012–1017.
27. Jeong, J. H., Sugii, Y., Minamiyama, M., Okamoto, K.: Measurement of RBC deformation and velocity in capillaries in vivo. Microvasc. Research, 2006, 71, s. 212–217.
28. Williams, D. A.: Change in shear stress (∆@)/hydraulic conductivity (Lp) relationship after pronase treatment of individual capillaries in situ. Microvasc. Research, 2007, 73, s. 48–57.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Zima, T. et al.: Laboratorní diagnostika
- Esenciálna hypertenzia ako syndróm alebo kompenzačný mechanizmus?
- Krajíček, M., Peregrin, J. H., Roček, M. et al.: Chirurgická a intervenční léčba cévních onemocnění
- Zapojení mikroRNA do patogeneze nádorových onemocnění a možnosti jejich využití v diagnostické a prediktivní onkologii
- Předoperační příprava a vyšetření pacienta před plánovaným kardiochirurgickým výkonem
- Blok TXA2 v léčení svědivé dermatózy
- Neuropeptidové léčení pruritu (komentář)
- Vliv nízkokalorické diety na sérové koncentrace a expresi cytoadhezivních molekul v tukové tkáni u obézních žen
- Weiss, P. et al.: Sexuální zneužívání dětí
- Cyklosporín A verzus cyklofosfamid v liečbe detí s nefrotickým syndrómom
- Rudolf, G., Henningsen, P.: Psychotherapeutische Medizin und Psychosomatik
- Psychomotorické tempo a rychlost vyhledávání v sémantické paměti
- Fotodynamická terapie i viditelným světlem
- Migrační tendence u českých lékařů
- Politická korektnost a myšlení lékařů
- Historicko-medicínská výročí v roce 2008
- Celostátní sjezd Společnosti lékařské genetiky ČLS JEP a 40. výroční cytogenetická konference
- Obezitologie 200714. výroční kongres České obezitologické společnosti ČLS JEP
- Bohemica non legantur
- JIŽ POTŘETÍ BYLA UDĚLENA Cena časopisu lékařů českých
- K pětadevadesátinám farmakologické legendy prof. MUDr. Dr.h.c. Heleny Raškové, DrSc. (*2. ledna 1913)
- Prof. MUDr. Vladimír Bencko, DrSc. JUBILUJÍCÍ
- Výpověď biochemických markerů remodelace kosti při nádorovém postižení skeletu
- Laureáti Nobelovy ceny
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Esenciálna hypertenzia ako syndróm alebo kompenzačný mechanizmus?
- Předoperační příprava a vyšetření pacienta před plánovaným kardiochirurgickým výkonem
- Psychomotorické tempo a rychlost vyhledávání v sémantické paměti
- Zima, T. et al.: Laboratorní diagnostika
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



