-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Metabolický syndrom a deprese – klinické vztahy
Metabolic Syndrome and Depression – Clinical Relations
The occurrence of both obesity and type 2 diabetes mellitus is rapidly increasing; according to WHO data, this can be considered as a worldwide epidemic. The obesity is one of the components of metabolic syndrome, the cluster of several risk factors of atherosclerosis such as dyslipidemia, hypertension, impaired glucose homeostasis, pro-thrombotic state and subclinical inflammation. The importance of the metabolic syndrome is confirmed by findings of the several times increased risk of both the type 2 diabetes mellitus and cardiovascular disease. Similarly, as in the case of obesity and diabetes, the incidence and prevalence of depressive disorder are still increasing and depressive disorder belongs to the most important causes of disability. The interrelations between depressive disorder and diabetes are known for a long time. Diabetics very often suffer from depression and vice versa, the depressive disorder is a significant risk factor of type 2 diabetes mellitus development and worsens the survival of diabetics. Those relationships have been recently intensively studied. Our paper reviews genetic, nutritional, metabolic and hormonal factors, contributing to the above mentioned syndrome.
Key words:
metabolic syndrome, diabetes mellitus type 2, genetic polymorphisms, oxidative stress, hyperhomocysteinemia, n-3 polyunsaturated fatty acids.
Autoři: M. Zeman 1; R. Jirák 2; A. Žák 1; M. Jáchymová 1; M. Vecka 1; E. Tvrzická 1; B. Staňková 1; M. Dušejovská 1
Působiště autorů: IV. interní klinika 1. LF UK a VFN, Praha 1; Psychiatrická klinika, centrum pro Alzheimerovu chorobu a Katedra psychiatrie IPVZ, Praha 2
Vyšlo v časopise: Čas. Lék. čes. 2008; 147: 75-80
Kategorie: Přehledový článek
Souhrn
Na celém světě rychle roste výskyt obezity i diabetes mellitus 2. typu, údaje WHO hovoří o jejich celosvětové epidemii. Česká republika se s ohledem na prevalenci obezity řadí na jedno z předních míst v Evropě. Obezita je jednou z hlavních komponent metabolického syndromu, který označuje současný výskyt (cluster) rizikových faktorů kardiovaskulárních onemocnění, jako jsou dyslipidémie, arteriální hypertenze, porušená glukózová tolerance, případně diabetes mellitus 2. typu, prokoagulační stav a subklinický zánět. Význam metabolického syndromu spočívá zejména v tom, že několikanásobně zvyšuje riziko diabetes mellitus 2. typu i kardiovaskulárních onemocnění. Podobně jako u obezity a diabetes mellitus 2. typu je pozorován významný nárůst výskytu depresívních poruch, které patří na celém světě k nejvýznamnějším onemocněním z hlediska pracovní neschopnosti a invalidity. Vztahy mezi metabolickým syndromem, diabetem mellitem a depresí jsou známy již dlouho. Mezi nemocnými s diabetem se častěji vyskytuje deprese, která je zase rizikovým faktorem diabetes mellitus 2. typu a přítomnost deprese zvyšuje mortalitu diabetiků. V posledních létech jsou tyto vztahy intenzivně analyzovány. V práci je podán přehled možných společných genetických příčin i faktorů nutričních, metabolických i hormonálních, které by mohly odpovídat za uvedené nálezy.
Klíčová slova:
metabolický syndrom, diabetes mellitus 2. typu, genetické polymorfismy, oxidační stres, hyperhomocysteinémie, polyenové mastné kyseliny n-3.Pojem „metabolický syndrom“ vyjadřuje současný výskyt metabolických odchylek, jako jsou intraabdominální akumulace tuku, dyslipidémie, hypertenze a inzulínová rezistence (IR), která přechází do poruch glukózové homeostázy až diabetes mellitus 2. typu (DM2). Nověji je uváděn chronický subklinický zánět a protrombotický stav (1). Tyto poruchy současně představují rizikové faktory rozvoje aterosklerózy a kardiovaskulárních onemocnění (KVO). Kritéria pro diagnózu metabolického syndromu (MS) jsou uvedena v tabulce 1 (2). Mezinárodní diabetologická federace zdůrazňuje význam centrální obezity jako základního faktoru MS a definuje jej jako přítomnost centrální obezity (obvod pasu > 94 (resp. 80) cm u mužů (resp. žen)) a dalších 2 z následujících faktorů: triglyceridémie (TG) > 1,70 mmol/l, HDL-C < 1,0 (resp. 1,30) mmol/l u mužů (resp. žen), TK > 130/85 mm Hg (nebo antihypertenzivní léčba) a poruchou glykémie nalačno (glykémie > 5,6 mmol/l), nebo přítomností DM2. Prevalence MS v současné době na celém světě stoupá (1). Při použití definice, užívající kritéria ATP III, bylo ve Finsku zjištěno v populaci mezi 42 až 60 lety asi 14 % osob s MS, zatímco v USA v populaci 44–49 let činila 43,6 % (3). V Řecku byla podle kritérií ATP III klasifikována prevalence MS (adjustována na věk) asi 24 %, zatímco při použití kritérií IDF to bylo již asi 43 % (4). V posledních letech je na celém světě rovněž pozorován stálý vzestup výskytu depresívních poruch. V USA se odhaduje, že asi u 10–20 % žen a 5–12 % mužů dojde během života alespoň k jedné epizodě velké deprese, přičemž asi u poloviny z nich se bude opakovat (5). Deprese je komplexní heterogenní onemocnění, jehož patofyziologie dosud nebyla objasněna. Zvažuje se řada etiologických faktorů, jako deplece serotoninu, ale i jiných monoaminů v oblastech mozku, spojených s emocemi, spánkem, chutí k jídlu i v oblastech mozkové kůry, které se podílejí na vyšších nervových činnostech. Dalším faktorem je chronická aktivace osy hypothalamus-hypofýza-nadledvina (HHN) s následnou zvýšenou tvorbou kortikotrofního hormonu (corticotrophin-releasing-hormone – CRF). Deprese může vznikat také v důsledku nedostatečné plasticity neuronů v odpověď na různou zátěž, např. chronický stres (6). Základními příznaky deprese jsou stav hlubokého smutku a beznaděje (depresivní nálada) a ztráta zájmu o běžné životní aktivity. Dále může být přítomna řada obtíží, jako poruchy spánku, zejména nespavost, ale i hypersomnie, poruchy koncentrace myšlení a poruchy paměti, změny hmotnosti (většinou anorexie s úbytkem hmotnosti, ale i přejídání), únava, neklid, ztráta sexuálního zájmu, pocity provinění i myšlenky na smrt. V praxi se rozlišuje několik typů deprese:
- Velká depresivní porucha – je charakterizována trvalou smutnou náladou a neschopností se radovat a brání aktivním životním postojům. Často se objevují opakované epizody depresí během života.
- Atypická deprese – je podskupinou velké depresivní poruchy. Pozoruje se zde i krátké přechodné zlepšení nálady, častěji je přítomen hmotnostní přírůstek v důsledku přejídání a hypersomnie.
- Dysthymie – bývá označována za mírnější depresi („low-grade“ depression), která trvá alespoň dva roky. Nemocní mají mírně až středně depresivní náladu většinu dní, i když mohou mít i krátká období „normální“ nálady.
- Deprese u bipolární poruchy. U nemocných se střídají období deprese a mánie, přičemž někdy může před objevením se manické fáze proběhnout několik depresivních epizod nebo opačně několik manických fází před jednou fází deprese.
- Sezonní afektivní porucha (seasonal affective disorder – SAD) se objevuje většinou u mladších jedinců na podzim a v zimě v období nedostatku slunečního svitu.
- Poporodní deprese se manifestuje u žen po porodu zřejmě v důsledku hormonálních změn, provázejících porod. Organická deprese vzniká na podkladě organických změn mozku – např. při cerebrovaskulárním onemocnění nebo u neurodegenerativních poruch.
Tab. 1. Definice metabolického syndromu 
Vysvětlivky: NCEP, ATP III (National Cholesterol Education Program (NCEP) of High Blood Cholesterol in Adults (Adult Treatment Panel III), (třetí soubor doporučení Národního cholesterolového edukačního programu v USA pro léčbu dospělých, 2001; IFG (impaired fasting glycaemia), tj. glykémie na lačno ≥ 6,1 mmol, HOMA (homeostasis model assessment) – matematický model k určování inzulínové rezistence Úmrtnost nemocných s depresí je ve srovnání s běžnou populací významně vyšší zřejmě v důsledku vyšší prevalence KVO, zejména ischemické choroby srdeční (ICHS) a DM2. Deprese je považována za významný rizikový faktor ICHS (7) i DM2 (8). Přítomnost deprese u diabetiků zvyšuje jejich úmrtnost (9) (graf 1). Podle některých autorů je deprese i rizikovým faktorem rozvoje diabetických komplikací u DM2 (10). Je možné, že v pozadí pozorovaných souvislostí mezi depresí, ICHS a DM 2 je MS. Metabolický syndrom je významným rizikovým faktorem ICHS i DM2 (11). Asociace mezi příznaky deprese a MS byla prokázána ve studii sledující páry mužských dvojčat (12). V populaci sledované v NHANES III (Third National Health and Nutrition Examination Survey) byla prevalence MS mezi ženami s depresí dvojnásobná než u žen bez deprese (13). Na zvýšeném riziku ICHS u deprese se podílejí faktory behaviorální (vyšší výskyt kuřáctví u depresivních osob, sedavý způsob života, (resp. nedostatek fyzické aktivity), nesprávné stravovací návyky a s tím spojená obezita i špatná compliance k léčbě) i faktory biologické (endoteliální dysfunkce, zvýšený tonus sympatiku, snížená variabilita srdeční frekvence, subklinický zánětlivý stav, dysfunkce krevních destiček s jejich zvýšenou agregabilitou). Většina těchto biologických faktorů je současně charakteristická pro MS (1). Vztahy mezi depresí a diabetes mellitus jsou komplexní a dosud nebyly plně vysvětleny. Situace je zřejmě poněkud odlišná u diabetes mellitus 1. typu (DM1) a DM2. Podle většiny autorů je deprese u DM1 spíše jeho důsledkem (14).U DM2 deprese většinou předchází manifestaci diabetu a je v těchto případech pozorována častější návratnost epizod, které jsou delší než u osob bez diabetu(15). Některé biologické markery jsou společné pro nemocné s MS, DM2 i depresí. Patří sem například dysfunkce osy HHN se vzestupem kortisolémie a rezistence periferních tkání na působení inzulínu, která je považována za hlavní za jeden z hlavních faktorů rozvoje DM2 a za hlavní determinantu MS (1, 15, 16). Mechanismy, kterými může deprese ovlivnit manifestaci DM2, jsou uvedeny v tabulce 2.
Graf 1. Doba přežívání (v týdnech) v diabetické populaci (n = 558), sledované v USA v rámci NHANES (National Health and Nutrition Examination Survey) Epidemiologic Follow-up Study v letech 1982–1984, podle hodnot škály deprese (50). Dotazník deprese CES-D zahrnuje 20 položek, popisujících příznaky deprese (jako např. poruchy koncentrace, spánku, psychomotorické retardace atd.), hodnocených čtyřbodovou škálou 0–3. Osoby, jejichž celkové skóre je 16 a více, jsou považovány za depresivní. Upraveno podle (9). 
Tab. 2. Možné vlivy deprese na rozvoji diabetu 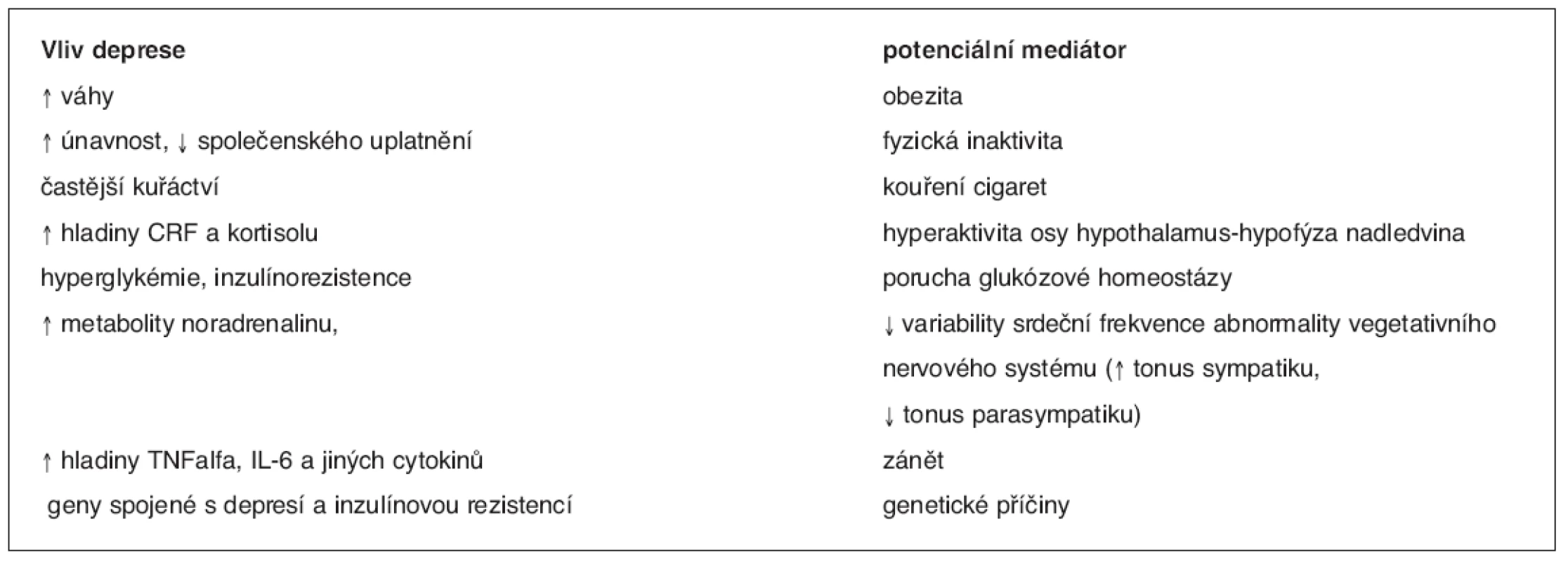
CRF – corticotropin releasing factor, TNF – tumor necrosis factor, IL – interleukin (dle 16)
Řada farmak, užívaných v léčbě deprese, vede k přírůstku hmotnosti a může tak zvyšovat riziko manifestace MS a DM2, v některých případech i nezávisle na hmotnostním přírůstku (17). Tricyklická antidepresiva a inhibitory monoaminooxidázy jsou obvykle spojena s větším hmotnostním nárůstem než selektivní inhibitory zpětného vychytávání serotoninu (selective serotonin reuptake inhibitors – SSRI). Ani účinek jednotlivých SSRI není stejný, udává se, že paroxetin, sertralin působí nárůst hmotnosti, zatímco fluoxetin může dokonce vést k poklesu. Jiný typ antidepresiva, bupropion, je v tomto ohledu považován za neutrální. Antidepresivum mirtazapin ze skupiny noradrenergeních a specificky serotoninergních antidepresiv vede rovněž k významnému vzestupu hmotnosti. U nemocných s bipolární poruchou je často užívána kombinační léčba, zahrnující také antipsychotika druhé generace. Jejich podávání vede často k hmotnostnímu nárůstu a k dalším vedlejším metabolickým účinkům, zejména k inzulínorezistenci, zvýšení hladiny TG a k poklesu HDL-cholesterolu v plazmě, a tak zvyšuje riziko vývoje MS i DM2. Hmotnostní nárůst bývá nejvyšší po podávání clozapinu a olanzapinu, v menší míře po risperidonu a quetiapinu a nejméně po aripiprazolu a ziprasidonu, hladiny lipidů jsou nejméně ovlivňovány ziprasidonem a amisulpridem (17, 18). Antipsychotika v různé míře nepříznivě ovlivňují homeostázu glukózy nezávisle na nárůstu hmotnosti přímou interferencí s účinky inzulínu s následnou inzulínorezistencí (17).
Cílem tohoto sdělení je podat přehled o faktorech, které mohou stát v pozadí asociací mezi MS a depresí.
Genetické faktory v patogeneze MS a deprese
Genetická determinace MS není přesně známá. Význam zde mají zřejmě různé geny v různých lokusech, které působí ve vzájemné interakci (interakce gen-gen). Dále se uplatňuje interakce genů s podmínkami zevního prostředí (výživa, fyzická aktivita, stres, kouření, infekce) i s činiteli metabolickými. Dnes je známa řada kandidátních genů, které jsou u různých etnických skupin asociovány s MS (19). Jde např. o geny pro dopaminový receptor D2 (DRD2), angiotensinogen (ANG), peroxizomálními proliferátory aktivované receptory gamma (PPARG), adiponektin (ADIPOQ), leptin (LEP), leptinový receptor (LEPR), protein vázající mastné kyseliny 2 (fatty acid binding protein 2, FABP2), C-reaktivní protein (CRP) a řadu dalších. Rovněž u deprese hraje významnou roli dědivost. Relativní riziko prvostupňových příbuzných je asi 2–3, ještě větší je v případě depresí manifestovaných před 30. rokem věku a s tendencí k rekurenci (20). Mezi kandidátní geny patří např. geny kódující serotoninový transportér (SLC6AR), serotoninový receptor 2A (5HTR2A), tyrozin-hydroxylázu (TH), což je enzym limitující syntézu dopaminu, tryptofan-hydroxylázu 1 (TPH1), katalyzující syntézu serotoninu i katechol-O-methyltransferázu (COMT), která odpovídá za katabolismus dopaminu (20). Jinou kandidátní molekulou je faktor BDNF (brain-derived neurotrophic factor), protein, který usnadňuje růst i homeostázu neuronů a moduluje neurotransmisi (6). Byly popsány dva polymorfismy ve vztahu k depresi: SNP (-281 C > A) na promotéru 1 a Val66Met. Vzhledem k popsaným vztahům mezi MS, DM2, KVO a depresivní poruchou jsou hledány genetické faktory, které by mohly stát v pozadí všech uvedených onemocnění. Gen pro angiotenzin-konvertující enzym (ACE), u kterého byly prokázány vztahy ke KVO, může být kandidátním genem pro depresi, jelikož ACE ovlivňuje aktivitu osy HHN. V pozadí deprese i KVO může stát polymorfismus genu pro angiotenzin konvertující enzym – ACE I/D, spočívající v absenci nebo přítomnosti sekvence 257-pp alu uvnitř intronu 16 genu pro ACE, kde alela D je spojena s vyšší koncentrací AT II. Byla popsána jeho interakce s polymorfismem C825T pro ß3 subjednotku proteinu G (21) s ovlivněním výskytu deprese i KVO. Byla také prokázána asociace varianty genu pro ACE (SNP rs4291) s unipolární depresí (22). Dalším možným kandidátním enzymem je tyrosin hydroxyláza, klíčový enzym biosyntézy katecholaminů, kde byla popsána asociace varianty HUMTH01 s inzulínorezistencí a depresí (23).
Význam CNS, neurohumorálních faktorů
U nemocných s depresí i MS je pozorována odlišná odpověď na stresující vlivy. Zpracování stresových podnětů v mozku vede k odpovědím autonomního systému, osy hypothalamus-hypofýza-nadledvina (HHN) i systému oběhového a imunitního. Funkční poruchy těchto funkcí jsou pozorovány u MS i u depresí a vztahy mezi depresí a inzulínovou rezistencí byly opakovaně publikovány (24). U nemocných s depresí je často zjišťována nadprodukce kortikotropního hormonu (CRF – corticotropin-releasing factor), zvýšená hladina kortisolu, porucha suprese jeho sekrece při dexametazonovém supresním testu a dysfunkce osy HHN s poruchou cirkadiánního rytmu (aktivace ve večerních hodinách) (25). Dalšími společnými rysy MS a deprese je porušená funkce autonomního nervového systému. Nesprávná životospráva (zejména nízká fyzická aktivita během dne a příjem potravy v pozdních nočních hodinách) vede k poruše rovnováhy v autonomním nervovém systému, s převahou sympatiku v oblasti hrudníku a v kosterním svalstvu s následným zvýšením krevního tlaku, inzulínové rezistenci ve svalstvu a naopak ke zvýšené aktivitě parasympatiku v břišní oblasti, která vede k hypersekreci inzulínu a akumulaci viscerální tukové tkáně a zvýšenému riziku MS, DM2, dyslipidémie, hypertenze a viscerální obezity (26).
Chronický zánětlivý stav, oxidační stres, hyperhomocysteinémie
V patogenezi inzulínové rezistence a MS se významně uplatňuje oxidační stres (27). Je prokazována zvýšená hladina zánětlivých cytokinů TNFalfa, interleukinu 6 (IL-6) a CRP, které korelují s obezitou, rizikem diabetu i KVO (28). Oxidační stres také může zřejmě v interakci se systémem BDNF ovlivňovat neuroplasticitu a kognitivní funkce, a tak se účastnit v patogenezi deprese (29). Nemocní s obsedantně kompulzivní poruchou (OKP) a současnou depresí měli ve srovnání s pacienty s OKP bez deprese zvýšenou hladinu lipoperoxidace (30). V jiné studii symptomy deprese korelovaly s hladinou lipoperoxidů v séru (31). Dalším faktorem, který má význam v patogenezi degenerativních onemocnění CNS i deprese, je homocystein (Hcy) (32). Hyperhomocysteinémie je považována za rizikový faktor KVO, působení Hcy zde zahrnuje poškození endoteliálních buněk, oxidační stres, změnu exprese transkripčních faktorů, cytoadhezních molekul a chemotaktických faktorů, reaktivitu krevních destiček, ovlivnění koagulace a fibrinolýzy a modifikaci lipoproteinů (33). Zvýšená hladina Hcy a nedostatek kyseliny listové v mozku negativně ovlivňují diferenciaci neuronů a gliálních buněk, tvorbu a funkci synapsí, vedou ke zvýšenému oxidačnímu stresu a k poškození DNA (34).
Deficience PUFA n-3 v patogeneze MS a deprese
PUFA n-3 tvoří podstatnou část lipidové složky mozku a hrají zde významnou strukturální a funkční roli (35). Byly prokázány negativní korelace mezi dietním příjmem PUFA n-3 a výskytem duševních onemocnění (36). U deprese byly nalezeny snížené koncentrace PUFA n-3 ve fosfolipidech a cholesterylesterech séra (37), v membránách erytrocytů (38) i v tukové tkáni (39). Koncentrace kyseliny eikosapentaenové (EPA) v erytrocytech korelovala negativně se závažností deprese, zatímco poměr AA/EPA pozitivně (40). Deficience PUFA n-3 vedla u krys ke změnám v metabolismu mozkových katecholaminů (41). PUFA n-3 snižují v mozku sekreci zánětlivých cytokinů, příznivě ovlivňují neurotransmisi a funkci osy HHN, ovlivňují fluiditu membrán a druhotně tak i jejich strukturu a funkci (42). Příčiny snížené koncentrace PUFA n-3 ve tkáních u nemocných s depresí i MS nejsou jasné. Jednou z možností je snížený dietní přísun v důsledku změněných dietních návyků (43), možná je také jejich zvýšená oxidace. Bylo provedeno několik studií, ve kterých podávání PUFA n-3 příznivě ovlivnilo depresi u bipolární poruchy (44) a zvýšilo účinnost terapie u depresí rezistentních na léčbu (45). U nemocných s depresí perzistující po standardní léčbě bylo úspěšné podávání samotné EPA (46). PUFA n-3 mohou depresi příznivě ovlivňovat také pozitivním působením na neoneurogenezi. Byla zjištěna asociace mezi depresí a defekty v neurogenezi ve specifických oblastech mozku (zejména gyrus dentatus, GD v hippocampu). Oblast GD je anatomicky spojena i s limbickým systémem, který se podílí na mechanismech emocí (47). Pokles objemu hippocampu byl pozorován u chronického stresu a byl nalezen i u depresivních osob. V experimentálních studiích byl opakovaně prokázán pozitivní efekt PUFA n-3 na neoneurogenezi, působený jejich pleiotropními účinky. PUFA n-3 v membránách neuronů ovlivňují prostorovou strukturu membránových proteinů včetně receptorů, transportérů, dále membránovou fluiditu s následným ovlivněním vazby neurotransmiterů a signalizace uvnitř buňky. Roli v působení PUFA n-3 hraje inhibice exprese prozánětlivých cytokinů jako interleukinu 1ß (IL-1ß) a tumor-nekrotizačního faktoru α (TNF-α), které rovněž působí negativně na neurogenezi (48). Podávání PUFA n-3 také příznivě ovlivňuje expresi neurotrofického faktoru BDNF (49), podobně jako podávání antidepresivních farmak.
Závěrem lze shrnout, že dnes je k dispozici řada klinických i experimentálních údajů, které ukazují na možné souvislosti mezi depresivní poruchou a přítomností rysů metabolického syndromu, který je mimořádně významným rizikovým faktorem rozvoje DM2 a KVO. Podstata těchto souvislostí však dosud není objasněna. Mohou se uplatňovat vlivy složení diety či stav chronického subklinického zánětu u obou poruch. V současné době je v popředí zájmu častý nález zmnožení viscerálního tuku u nemocných s depresivní poruchou a dysfunkce autonomního nervového systému, která patří mezi možné příčiny jak deprese, tak i MS. K objasnění těchto souvislostí by mohly přispět prospektivní studie, zabývající se vztahy mezi depresí a komponentami MS nebo intervenční studie, sledující možné současné příznivé ovlivnění MS, zejména inzulínové rezistence na jedné straně, i deprese na straně druhé. Nadějným prostředkem by mohly být přípravky, obsahující PUFA n-3, které příznivě ovlivňují většinu komponent MS a jejichž deficit je prokazován v tkáních depresivních osob.
Zkratky
AA – kyselina arachidonová, 20 : 4n-6
ACE – angiotenzin-konvertující enzym
BDNF – mozkový neurotrofický faktor (brain-derived neurotrophic factor)
DP – depresivní poruchy
EPA – kyselina eikosapentaenová, 20 : 5n-3
Hcy – homocystein
KVO – kardiovaskulární onemocnění
IDF – Mezinárodní diabetologická federace (International Diabetologic Federation)
IR – inzulínová rezistence
MS – metabolický syndrom
OKP – obsedantně kompulzivní porucha
PL – fosfolipidy
PUFA – vícenenasycené mastné kyseliny (polyunsaturated fatty acids)
TG – triglycerid
CES-D – (Center for Epidemiologic Studies-Depression)
Práce byla podporována grantem IGA MZ ČR, č. NR-8806-3.
Zdroje
1. Eckel, R. H., Grundy, S. M., Zimmet, P. Z.: The metabolic syndrome. Lancet, 2005, 365, s. 1415–1428.
2. Bloomgarden, Z. T.: Definitions of the insulin resistance syndrome. Diabetes Care, 2004, 27, s. 824–830.
3. Okosun, I. S., Liao, Y., Rotimi, C. N. et al.: Abdominal obesity and clustering of multiple factors in metabolic syndrome in White, Black and Hispanic Americans. Ann. Epidemiol., 2000, 10, s. 263–270.
4. Athyros, V. G., Ganotakis, E. S., Elisaf, M., Mikhailidis, D. P.: The prevalence of the metabolic syndrome using the National Cholesterol Educational Program and International Diabetes Federation definitions. Curr. Med. Res. Opin., 2005, 8, s. 1157–1159.
5. Nestler, E. J., Barrot, M., DiLeone, R. J. et al.: Neurobiology of depression. Neuron, 2002, 34, s. 13–25.
6. Vaidya V.A., Duman R. S.: Depression-emerging insights from neurobiology. Br. Med. Bull., 2001, 57, s. 61–79.
7. Rugulies R.: Depression as a predictor for coronary heart disease. A review and meta-analysis. Am. J. Prev. Med., 2002, 23, s. 51–61.
8. Eaton W. W., Armenian H., Gallo J. et al.: Depression and risk for onset of type II diabetes: a prospective population-based study. Diabetes Care. 1996, 19, s. 1097–1102.
9. Zhang, X., Norris, S. L., Gregg, E. W. et al.: Depressive symptoms and mortality among persons with and without diabetes. Am. J. Epidemiol., 2005, 161, s. 652–660.
10. De Groot M., Anderson R., Freedman K. E. et al.: Association of depression and diabetes complications: a meta‑analysis. Psychosom. Med., 2001, s. 619–630.
11. Wannamethee, S. G., Shaper, A. G., Lennon, L., Morris, R. W.: Metabolic syndrome vs Framingham risk score for prediction of coronary heart disease, stroke, and type 2 diabetes mellitus. Arch. Intern. Med., 2005, 165, s. 2644-2650.
12. McCaffery, J. M., Niaura, R., Todaro, J. F. et al.: Depressive symptoms and metabolic risk in adult male twins enrolled in the National Heart, Lung, and Blod Institute Twin Study. Psychosom. Med., 2003, 65, s. 490–497.
13. Kinder, L. S., Carnethon, M. R., Palaniappan, L. P. et al.: Depression and the metabolic syndrome in young adults: findings from the Third National Health and Nutrition Examination Survey. Psychosom. Med., 2004, 66, s. 316–322.
14. Eaton, W. W: Epidemiologic evidence on the comorbidity of depression and diabetes. J. Psychosom. Res., 2002, 53, s. 903–906.
15. Talbot, F., Nouwen, A.: A review of the relationship between depression and diabetes in adults. Is there a link? Diabetes Care, 2000, 23, s. 1556–1562.
16. Lustman, P. J., Clouse, R. E.: Depression: a potentially modifiable risk factor for diabetes and its complications. Diabetes Spectrum, 2004, 17, s. 147–148.
17. Tschoner, A., Engl, J., Laimer, M. et al.: Metabolic side-effects of antipsychotic medication. Int. J. Clin. Pract., 2007, 61, s. 1356–1370.
18. Nasrallah, H. A.: A review of the effect of atypical antipsychotics on weight. Psychoneuroendocrinology, 2003, 28, s. 83–96.
19. Snyder, E. E., Walts, B., Perusse, L. et al.: The human obesity gene map: the 2003 update. Obes Res., 2004, 12, s. 369–439.
20. Levinson, D. F.: The genetics of depression: a review. Biol. Psychiatry, 2006, 60, s. 84–92.
21. Bondy, B., Baghai, T. C., Zill P. et al.: Combined action of the ACE D-and G-protein beta3 T–allele in major depression: a possible link to cardiovascular disease? Mol. Psychiatry, 2002, 7, s. 1120–1126.
22. Baghai, T. C., Binder, E. B., Schule, C. et al.: Polymorphisms in the angiotensin–converting enzyme gene are associated with unipolar depression, ACE activity and hypercortisolism. Mol. Psychiatry, 2006, 11, s. 1003–1015.
23. Chiba, M., Suzuki, S., Hinokio, Y. et al.: Tyrosine hydroxylase gene microsatellite polymorphism associated with insulin resistance in depressive disorder. Metabolism, 2000, 49, s. 1145–1149.
24. Timonen, M., Laakso, M., Jokelainen, J. et al.: Insulin resistance and depression: cross sectional study. Brit. Med. J., 2005, 330, s. 17–18.
25. Gillespie, C. F., Nemeroff, C. N.: Hypercortisolaemia and depression. Psychosom. Med., 2005, 67 (Suppl.1), s. S26–S28.
26. Kreier, F., Yilmaz, A., Kalsbeek, A. et al.: Hypothesis: shifting the equilibrium from activity to food leads to autonomic unbalance and the metabolic syndrome. Diabetes, 2003, 52, s. 2652–2656.
27. Furukawa, S., Fujita, T., Shimabukuro, M. et al.: Increased oxidative stress in obesity and its impact on metabolic syndrome. J. Clin. Invest., 2004, 114, s. 1752–1761.
28. Sonnenberg, G. E., Krakower, G. R., Kissebah, A. H.: A novel pathway to the manifestation of metabolic syndrome. Obes. Res., 2004, 12, s. 180–186.
29. Wu, A., Ying, Z., Gomez-Pinilla, F.: The interplay between oxidative stress and brain–derived neurotrophic factor modulates the outcome of a saturated fat diet on synaptic plasticity and cognition. Eur. J. Neuroscience, 2004, 19, s. 1699–1707.
30. Kuloglu, M., Atmaca, M., Tezcan, E. et al.: Antioxidant enzyme activities and malondialdehyde levels in patients with obsessive-compulsive disorder. Neuropsychobiology, 2002, 46, s. 27–32.
31. Tsuboi, H., Shimoi, K., Kinae, N. et al.: Depressive symptoms are independently correlated with lipid peroxidation in a female population: comparison with vitamins and carotenoids. J Psychosom Res., 2004, 56, s. 53–58.
32. Bottiglieri, T., Laundy, M., Crellin, R. et al.: Homocysteine, folate, methylation and monoamine metabolism in depression. J. Neurol. Neurosurg. Psychiatry, 2000, 69, s. 228–232.
33. Bolander-Gouaille, C.: Focus on homocysteine and the vitamins involved in its metabolism. 2nd ed. Paris, Springer Verlag France, 2002, 262 s.
34. Mattson, M. P., Shea, T. B.: Folate and homocysteine metabolism in neural plasticity and neurodegenerative disorders. Trends Neurosci., 2003, 26, s. 137–148.
35. Bourre, J. M., Dumont, O., Durand, G.: Brain phospholipids as dietary source of (n-3) polyunsaturated fatty acids for nervous tissue in the rat. J. Neurochem., 1993, 60, s. 2018–2028.
36. Hibbeln, J. R.: Fish consumption and major depression. Lancet, 1998, 351, s. 1213.
37. Maes, M., Christophe, A., Delanghe, J. et al.: Lowered omega-3 polyunsaturated fatty acids in serum phospholipids and cholesteryl esters of depressed patients. Psychiatry Res., 1999, 85, s. 175–291.
38. Peet, M., Murphy, B., Shay, J., Horrobin, D.: Depletion of omega-3 fatty acid levels in red blood cell membranes of depressive patients. Biol. Psychiatry, 1998, 43, s. 315–319.
39. Mamalakis, G., Tornaritis, M., Kafatos, A.: Depression and adipose essential polyunsaturated fatty acids. Prostglandins Leukot. Essent. Fatty Acids, 2002, 67, s. 311–318.
40. Adams, P., Lawson, S., Ssanigorski, A., Sinclair, A.: Arachidonic acid to eicosapentaenoic acid ratio in blood correlates positively with clinical symptoms of depression. Lipids, 1996, 31, s. S157–S161.
41. Zimmer, L., Vancassel, S., Cantagrel, S. et al.: The dopamine mesocorticolimbic pathway is affected by deficiency in n–3 polyunsaturated fatty acids. Am. J. Clin. Nutr., 2002, 75, s. 662–667.
42. Hirashima, F., Parow, A. M., Stoll, A. L. et al.: Omega-3 fatty acid treatment and T(2) whole brain relaxation times in bipolar disorder. Am. J. Psychiatry, 2004, 161, s. 1922–1924.
43. Žák, A., Tvrzická, E., Zeman, M., Vecka, M.: Patofyziologie a klinický význam vícenenasycených mastných kyselin řady n-3. Čas. Lék. čes., 2005, 144 (Suppl. 1), s. 6–18.
44. Stoll, A. L., Severus, W. E., Freeman, M. P. et al.: Omega-3 fatty acids in bipolar disorder: a preliminary double-blind, placebo controlled trial. Arch. Gen. Psychiatry, 1999, 56, s. 407–412.
45. Nemets, B., Stahl, M., Belmaker, R.: Addition of omega-3 fatty acid to maintenance medication treatment for recurrent unipolar depressive disorder. Am. J. Psychiatry, 2002, 150, s. 477–479.
46. Peet, M., Horrobin, D.: A dose-ranging study of the effects of ethyleicosapentaenoate in patients with ongoing depression despite apparently adequate treatment with standard drugs. Arch. Gen. Psychiatry, 2002, 59, s. 913–919.
47. Jacobs B. L., van Praag H. , Gage F. H.: Adult brain neurogenesis and psychiatry: a novel theory of depression. Mol. Psychiatry, 2000 5, 262–269
48. Beltz, B. S., Tlusty, M. F., Benton, J. L., Sandeman, D. C.: Omega-3 fatty acids upregulate adult neurogenesis. Neurosci Lett., 2007, 26, s. 154–158.
49. Wu, A, Ying, Z, Gomez-Pinilla, F.: Dietary omega-3 fatty acids normalize BDNF levels, reduce oxidative damage, and counteract learning disability after traumatic brain injury in rats. J. Neurotrauma, 2004, 21, s. 1457–1467.
50. Radloff, L. S. The CES-D Scale: A Self–Report Depression Scale for Research in the General Population. Applied Psychological Measurement, 1977, 1, s. 385–401.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Spolek lékařů českých v Praze
- Komplikace v oblasti kapsy kardiostimulátoru
- Zkušenosti s podáváním časné enterální výživy kriticky nemocným na jednotce intenzivní metabolické péče
- Je současný rozsah vyšetření dárců krve dostatečný? Onemocnění zhoubným nádorem u aktivních dárců krve
- Lékařská etika
- Jaký je výskyt zhoubných nádorů mezi bývalými dárci krve?
- II. interní klinika Lékařské fakulty MU a FN u sv. Anny v Brně slaví 60. výročí svého vzniku
- CD69 upregulation on T cells as an in vitro marker for delayed-type drug hypersensitivity
- Frequency and severity of acute allergic-like reactions to gadolinium-containing i.v. contrast media in children and adults
- The preoperative detection of risk of anaphylaxis during anaesthesia
- Diagnosis of drug hypersensitivity: lymphocyte transformation test and cytokines
- 35th Annual Meeting of European Society for Dermatological Research Tübingen, 22.–24. září 2006
- MUDr. Otto Soyka – 90 let
- Laureáti Nobelovy ceny
- Metabolický syndrom a deprese – klinické vztahy
- Metabolické účinky endokanabinoidního systému
- Imunosupresorické vlastnosti CD3
- Rate control in permanent atrial fibrilation
- Kvalita spermatu plzeňských vysokoškolských studentů
- Mozgový natriuretický peptid môže predikovať zmenu geometrie srdca u detí s chronickou obličkovou chorobou
- Tracheální intubace bez podání svalového relaxancia – vliv odlišných dávek sufentanilu na kvalitu intubačních podmínek: prospektivní studie
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Jaký je výskyt zhoubných nádorů mezi bývalými dárci krve?
- Komplikace v oblasti kapsy kardiostimulátoru
- Tracheální intubace bez podání svalového relaxancia – vliv odlišných dávek sufentanilu na kvalitu intubačních podmínek: prospektivní studie
- Je současný rozsah vyšetření dárců krve dostatečný? Onemocnění zhoubným nádorem u aktivních dárců krve
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



