-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Personalizovaná medicína – genomická fáze Proč a zač
Personalized medicine – genomic phase
Personalized medicine has become declared to be a strategic goal of nearly all medical disciplines, a modern fashion of medicine, which corresponds to unexpected progress in knowledge of structure and sometimes also understanding the function of our genome. This was made possible by development of new technologies and methodological approaches, which led to improved and more detailed diagnostics and categorization of diseases Also pharmaceutical industry is producing many new drugs, but not all are effective as supposed, and sometimes also cause adverse reactions (ADR). To prevent uneffectiveness and ADR, preliminary genetic testing of patients seems to be necessary. Utility of personalized medicine is sometimes discussed from the point of view of supposed inevitable increase of cost and problems with its adoption by existing system of healthcare.
Key words:
molecular diagnostics, interindividual differences, rare diseases, breast cancer, favism, pharmacogenomics, targeted therapy, adverse reactions, economics.
Autoři: R. Brdička
Působiště autorů: Ústav hematologie a krevní transfuze a Ústav experimentální medicíny AV ČR, Praha
Vyšlo v časopise: Čas. Lék. čes. 2009; 148: 477-480
Kategorie: Aktuální téma
Souhrn
Ačkoliv pokroky v chápání podstaty chorobných procesů v poznání příčin a v diagnostice směřují medicínu k její stále podrobnější „personalizaci“, vznikají i pochybnosti o míře její únosnosti z hlediska nákladů na zdravotní péči a její v současnosti používané systémy. K zdůrazňování nezbytnosti přijmout individuálnost nemoci každého pacienta přispěly úspěchy v analýze sekvence lidského genomu, možnost současného sledování aktivity téměř všech jeho genů, kterých bylo dosaženo prudkým rozvojem nových technologií. Zlepšená diagnostika je provázena i účinnější terapií, zvláště v oblasti farmakogenomiky a vývojem léků s větší schopností zasáhnout jednotlivé konkrétní cíle patologického procesu.
Klíčová slova:
molekulární diagnostika, interindividuální rozdíly, vzácné choroby, karcinom prsu, favismus, farmakogenomika, cílená terapie, nepříznivé účinky, ekonomika.Úvod
Ač se to může zdát zcela novým moderním pojetím léčebné péče, nejde o nic jiného než o připomenutí snah uplatňovaných v medicíně snad odjakživa. Abychom se dopídili jádra příčin řady onemocnění, nezbývalo nám dříve nic jiného než vycházet z většího množství případů a hledat, co je spojuje, což v dnešním pojetí představují tzv. metaanalýzy.
Tam, kde počty hodnotitelných případů byly malé, pomáhala zkušenost vyplývající z případů, se kterými se kdo během své profesní kariéry setkal a dokázal je spojit pod společnou definici – tak byla ohraničena řada syndromů, které měly dostatek takových příznaků, jenž jednotlivé případy spojovaly. Vznikaly klinické jednotky s daným příznakoslovím tak, jak je většinou známe i dnes. Některé, pro danou jednotku typické příznaky měli všichni nemocní, jiné většina nebo jen část z nich.
Ohraničení některých chorob však zůstává stále mlhavé i dnes, mimo jiné protože v jejich průběhu se jejich vlastnosti mohou měnit. Někdy bylo možné podle výskytu příznaků vytvořit v rámci jedné klinické jednotky určité skupiny, což někdy vedlo k pochybnostem, zda se skutečně jedná o jednu, či spíše o více klinických jednotek. Podobná zjištění se vztahovala i na léčení, kdy bylo možné jeho úspěšnost přiřadit k příznakům jako jedno z kritérií použitelných pro klasifikaci. Díky stále rostoucímu počtu použitelných charakteristik se původní klinické jednotky začaly rozpadat a diferenciální diagnostika se stávala náročnější. O kvantitativní a svým způsobem i kvalitativní skok v tomto vývoji se postarala bezesporu genetika, zvláště její molekulární úroveň. Výsledky výzkumu na tomto poli pomohly najít podstatu mnoha chorob na molekulární úrovni a zároveň ukázaly, že klinická a molekulární kategorizace nemusí jít ruku v ruce, že pro jednu klinickou jednotku můžeme najít mnoho různých molekulárních podkladů, nebo naopak „stejný“molekulární podklad může stát v pozadí více klinických jednotek. V rámci molekulární genetiky bylo prvních úspěchů dosaženo při vyhledávání odpovědných genů pro různá převážně jednoduše dědičná onemocnění. A stejně jako kdysi všeobecně přijímaný teorém gen-enzym přijala medicína představu gen-choroba a skutečně se u mnoha dědičných chorob podařilo najít odpovědný gen, kdy příčinou choroby byla odchylka v jeho struktuře. U mnoha genů bylo postupně identifikováno velké množství těchto odchylek (patogenních mutací). Jejich vztah k dané chorobě nemusel být identický, naopak různé mutace modifikovaly chorobné projevy natolik, že někdy bylo možné je spojit se samostatnými klinickými jednotkami (Duchenneova a Beckerova muskulární dystrofie). Postupně se ukázalo, že o fenotypovém projevu nemusí rozhodovat daná mutace sama, ale ani gen, ale že do chorobného procesu zasahuje celý genom jako celek. V něm se mohou vyskytovat další odchylky (polymorfismy), které se samy o sobě mohou chovat „zdánlivě neutrálně“, nebo zjevně zasahovat do projevů daného fenotypu. I chápání neutrality je třeba přizpůsobit současnému informačnímu pojetí genu – například tak, že byť má informace smysl stejný, může být kopírování nebo její uvolňování k realizaci či sám proces realizace rychlejší nebo pomalejší. To, že většina genů je v genomu vyšších organismů v párovém vydání v podobě tzv. alel a na fenotypu se většinou podílejí obě alely, bylo známo již mendelovské genetice. Různých vztahů mezi genotypem a fenotypem – většinou popsaných již na počátku minulého století „klasickou genetikou“ – je velké množství a složitějšími se stávají zvláště tam, kde se na fenotypu podílí více genů a nestejnou měrou. Musíme si dokonce přiznat, že i dnes v období genomiky stále ještě objevujeme nové geny i nové vztahy a mezi poznaným a poznatelným je stále ještě dost prostoru pro další výzkumy. K polymorfismům na úrovni sekvenčních jednonukleotidových odchylek (SNP) dříve představovaných kategorií RFLP (polymorfismus restrikčních fragmentů) přibyly polymorfismy opakování krátkých sekvencí (VNTR a STR), různé typy roztroušených a stěhovavých sekvencí (Alu), posléze CNV (variabilita počtu kopií (genů)) a konečně i polymorfismus inverzí (1, 2). Tyto odchylky (polymorfismy) jsou podstatou genetické variability – interindividuálních rozdílů – genetické individuality každého z nás.
Vzhledem k relativní jednoduchosti své genetické determinace jsou bezesporu pro personální medicínu vhodným příkladem a polem působnosti vzácné choroby (RD – rare diseases), a to jak z hlediska diagnostiky, tak i terapie, při níž do jisté míry spoléháme také na genovou terapii.
Diagnostika
Ačkoliv historické pořadí by možná mohlo být obrácené, tj., nejdříve by přišla na řadu personalizace terapie a až pak diagnostika, dáme přednost logice, kdy nepochybně diagnostika by měla předcházet terapii. Naše diagnostické možnosti se stále posunují vpřed, v poslední době snad až příliš rychle, a v mnoha situacích dovolují identifikovat příčinu chorobného stavu do mnohem větších podrobností, než to bylo možné dříve. Použijeme-li jako příklad karcinom prsu, byly jeho genetické kořeny nejdříve spojeny s geny BRCA1 (3) a BRCA2 (4). Produkt BRCA1 je součástí proteinového komplexu, v jehož péči je údržba DNA. Součástí tohoto komplexu je více proteinů kontrolovaných svými geny (5), které se tak spolupodílejí na riziku vzniku nádorového bujení. Zjednodušenou mapu genových vztahů BRCA1 najdeme na adrese: http://www.sabiosciences.com/pathway.php?sn=BRCA1_Pathway.
Všechny dosud známé geny, které nějakým způsobem přispívají k riziku této kancerogeneze, je možné rozdělit do tří skupin (6, 7). Na geny vysoce penetrantní (především BRCA1 a BRCA2, ale i další), jejichž patogenní mutace nejsou příliš časté, ale odpovídají za téměř čtvrtinu genetické složky, dále na geny s mírnou penetrancí, které částečně zvyšují riziko. Z nich většina patří do skupiny opravných genů. A konečně některé alely velké skupiny genů s velmi nízkou penetrancí, které se podílejí na zvýšení rizika jen zcela nepatrně – jde vlastně o alely existující v rámci běžných polymorfismů. Všechny tyto dnes známé geny, podrobně uvedené ve výše jmenovaných publikacích, lze molekulárními metodami testovat nejen z hlediska jejich struktury, ale i transkripční aktivity. Jejich vyhledávání a analýzu svěříme genetickým pracovištím, která v rámci spolupráce laboratorní složky s klinickými genetiky mohou validovat příslušná vyšetření a ověřovat jejich užitečnost. Podstatnou otázkou vždy je, do jaké míry je molekulárně-genetická analýza účelná z hlediska péče o pacienta (případně jeho blízké příbuzné), zvláště s ohledem na možnosti poradenství a léčby.
Terapie
Nádory prsu nám nabízejí vhodný příklad i v tomto směru. Úspěšnost protinádorové léčby např. Taxolem nebo Tamoxifenem závisela na aktivitě genu HER2 (kódujícího EGFR – epidermal growth factor receptor). U některých pacientek byla nalezena zvýšená aktivita tohoto genu způsobená například jeho amplifikací a účinnou léčbou se stalo blokování aktivity této tyrosinkinázy monoklonální protilátkou – Herceptinem (8) a její modernější obdobou Trastuzumabem (9, 10). Inhibitory EGFR jsou účinné i u dalších nádorů, např. nemalobuněčného karcinomu (Ca) plic (11). Stejným směrem se pohybuje i výzkum vakcín – Stimuvax firmy Merck Serono. Blokování přenosu signálu kinázami (imatinib, dasatinib, nilotinib atd.) se ukázalo úspěšné i u řady dalších neoplazií (CML – chronická myeloidní leukémie) (12), Ca ledvin (13), Ca pankreatu (14). Tato oblast terapie se neustále rozvíjí – (Innovations in Protein Kinase Therapies: http://www.market-research-report.com/datamonitor/images/rbdd0029_rsm.pdf) jednak rozšířením působení na více druhů kináz, jednak účinností na více mutantních forem cílové kinázy. Princip blokace použitý již u imatinibu je vstup molekuly léku do tzv. „kapsy“ vyhrazené v molekule kinázy pro ATP (obr. 1).
Obr. 1. Schéma umístění molekuly inhibitoru (imatinib) do molekuly BCR_ABL kinázy (obrázek převzat z encyklopedie Wikipedia – http://en.wikipedia.org/wiki/File:Bcr_abl_STI_1IEP.png) 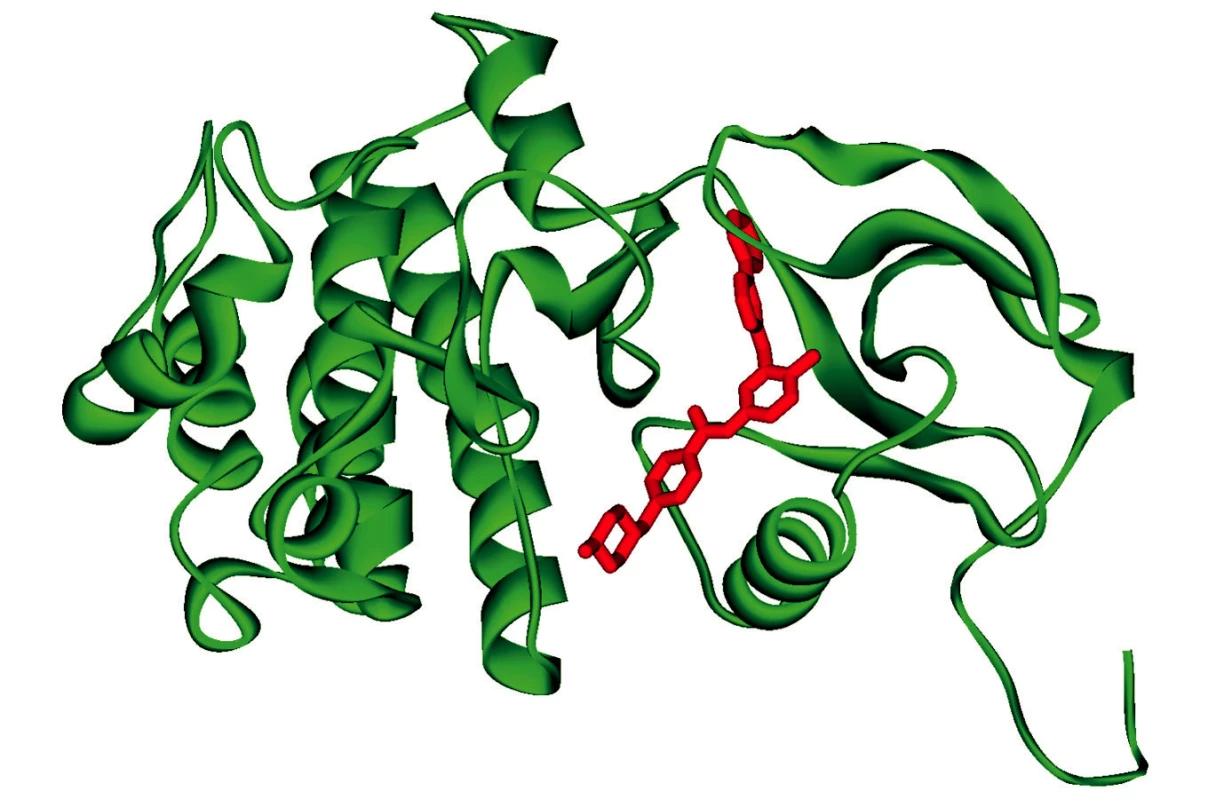
Vzhledem ke komplexnosti nádorového procesu budeme nepochybně nalézat další odpovědné geny, které se zatím nacházejí v pásmu „neidentifikovaných“ genetických příčin. I pro ně bude nutné najít účinné terapeutické agens. A pak se pravděpodobně bude opakovat známá situace: Některé budou vhodné jen pro určitý molekulární genotyp, který je na rozdíl od zárodečné výbavy u nádorových buněk mnohem proměnlivější.
Nezbytnost rozlišovat pacienty trpící „stejnou“ chorobou podle jejich reakce na léčení se stává stále naléhavější a vede k požadavku, aby určení druhu onemocnění bylo doplněno diagnostikou zaměřenou na odhalení případných „neběžných“ reakcí na podávané léky, a to pokud možno ještě před jejím zahájením. Systematickým testováním polymorfismů 22 genů u 450 chirurgických pacientů byla nalezena alespoň jedna odchylka v homozygotním stavu u většiny z nich (15). Dříve jsme byli zvyklí hledat ty stránky dané nemoci, které pacienty spojují, léky, které pomohou co největšímu počtu pacientů trpících danou nemocí (one drug fits all); personalizace medicíny upozorňuje a vyžaduje zohlednění těch projevů, v nichž se liší, čím jsou jednotliví pacienti jedineční (16). Nelékařským důvodem jsou problémy spojené s neúčinnou léčbou a někdy i fatálními reakcemi pacientů (17), což může vést až k nutnosti stažení léků z trhu (18, 19).
Toto poučení s výčtem nejrůznějších situací, kdy by bylo vhodné na ně dbát, je dnes samozřejmou součástí učebnic genetiky a farmakologie a dostává se i na informační letáky provázející distribuovaná léčiva. Týká se i oborů pojednávajících o xenogenetice – o individuálnosti reakcí lidského organismu na vlivy přicházející z vnějšku.
Ostatně jednou z dlouho známých kuriózních situací je reakce na pojídání syrových bobů (vicia fava) – tzv. favismus nejčastěji zaviněný nedostatečnou aktivitou G6PD (glukóza-6-fosfátdehydrogenázy) (20, 21), známý především z oblastí kolem Středozemního moře. Dědičná deficience G6PD je zřejmě i celosvětově nejčastějším enzymatickým defektem.
K úspěšnému propojování diagnostiky s terapií dochází již dlouho ve farmakogenetice, která nám vedle uvedeného favismu nabízí celou řadu dalších příkladů, o kterých se na rozdíl od favismu nedá tvrdit, že pro náš region prakticky nepřipadají v úvahu. Možná se nám podaří rozšířit novorozenecký screening dědičných poruch (22) a zavést jejich evidenci, aby bylo možné před podáním léku, o kterém je známo, že v reakci na něj existuje v populaci genetická variabilita, získat potřebné informace z příslušné databáze genotypů. V některých státech se již uvažuje o povinném testování genotypů, u kterých je riziko závažných (i smrtelných) komplikací vysoké (19). Pro někoho může být znalost genotypů, byť jen vybraných genů, jednotlivých osob děsivou vyhlídkou do budoucnosti, naplněnou obavami z diskriminace a zneužití při nejrůznějších typech konfliktů, a musíme připustit, že takové riziko skutečně existuje. Přesto lze doufat, že morální kvality lidstva se budou rovněž vyvíjet příznivým způsobem. Na jedné straně se zbavíme předsudků, přestaneme předstírat vzájemnou snášenlivost a nahradíme ji porozuměním, a na druhé straně budeme schopni zdravotní a sociální situace řešit etickým způsobem.
Farmakogenetika hraje významnou roli i ve veterinární medicíně, kde jistě dnes již nikdo nezpochybní potřebu znát genotypy chovaných zvířat. Analogie lidské „maligní hypertermie“, dříve často smrtelné komplikace celkové anestezie (23, 24), se vyskytuje například i u prasat (25) a při dovozu chovných zvířat dnes již rozhodně sledujeme, zda se v původním chovu taková dispozice nevyskytuje.
Odpůrci a příznivci
Nelze zastírat, že personalizovaná medicína může zvyšovat nároky na zdravotní péči, pokrok v lékařství tak činil ostatně vždy. A to nejen kvalitativní, ale i kvantitativní, což přeloženo do způsobu hodnocení světa používaného ekonomy, znamená zvyšování nákladů. Zdravotní péče tento problém způsobený pokrokem ve vědě a v technice a rovněž změnami ve struktuře obyvatelstva, jak zdravotní, tak věkové, řeší dlouhodobě (26). Výzkumu zabývajícímu se porovnáváním efektivity zdravotní péče je dlouhodobě věnována značná pozornost v USA a ten se pochopitelně zabývá i personalizací medicíny (27). Vývoj názorů na tuto problematiku lze sledovat i v americké legislativě, počínaje návrhem zákona podaného senátorem Obamou v roce 2006 a jeho proměnami v dalších letech (28).
Účelnost personalizace medicíny je zpochybňována nejen z hlediska zvládnutí zvýšených finančních nároků, ale i pro současnou a kritizovanou nedokonalost systému zdravotní péče zvláště například v USA (29), ať už jde o personál, jeho znalosti a schopnosti, nebo organizaci a technické vybavení zdravotnických zařízení (30). Pozornost je věnována i přístupu pacientů, kteří často posuzují preskripci léků podle toho, co dostávali jejich známí (31). Některé kritické připomínky by se zřejmě mohly stát bezpředmětnými (32) – současný vývoj molekulární diagnostiky, zvláště jeho technologický podklad, se vyvíjí směrem ke zpracování velkého množství vzorků souběžně se snížením nároků na množství vyšetřovaného materiálu, používaných chemikálií, omezení nezbytné lidské účasti a při urychlení procesu i získávání stále většího množství informací (33, 34). To z hlediska financí znamená, přestože ceny přístrojů stoupají, celkově výrazný pokles nákladů na jedno vyšetření. Lze to snadno demonstrovat na základní technice genetického testování – na určování nukleotidové sekvence. Zástupci výrobců se shodují v tom, že v nedaleké budoucnosti budou k dispozici přístroje, které sníží cenu osekvenování jednoho lidského genomu na 1000 $. Již dnes máme k dispozici přístroje – techniky a metody, které dokážou analyzovat strukturu našeho genomu na milionech míst a funkci prakticky všech genů současně (35). Je samozřejmé, že výzkum v této oblasti včetně automatického zpracovávání dat je hnán dopředu především komerčními zájmy (36) a využití získaných možností již často předbíhá jejich smysluplnost.
Zisky farmaceutických firem byly vždy srovnávány s náklady, které bylo nutné vynaložit na vývoj, výrobu, zkoušení a distribuci léku. V jejich případě platí, že náklady na léky, které bude užívat jen malý počet pacientů, by byly pro pacienty velice drahé, pokud by na ně výrobce neměl doplácet. To je také důvod, proč mnozí výrobci léků se vstupem na tento trh váhají.
Závažné reakce pacientů na léky vedou často k nezbytnosti ukončovat výrobu, nebo dokonce stahovat z trhu nemalé množství nově vyvinutých preparátů. Podle odhadů provedených v USA a Velké Británii dochází k nepříznivým reakcím na podané léky ve více než 5 % případů (19). A ne vždy se takové reakce, které mohou mít fatální průběh, daří zvládnout. Tento fakt, vedle zvýšení terapeutické úspěšnosti, je dalším z nejpádnějších argumentů ve prospěch personalizace medicíny. Tu bychom ovšem neměli omezovat na farmakogenetiku, na otázku, co se děje v lidském těle s léky, ale i na kontrolu vlivu všech zdraví ohrožujících látek – ekogenetiku (37), a nejen na ně.
Ať chceme, či nechceme personalizovanou medicínu nelze oddělit od problematiky, která v oblasti genetické determinace vyvolává spory mezi odpůrci a zastánci komerčního testování typu DTC (direct-to-consumer). I zde panují dva značně odlišné názory (38). Většina genetiků zpochybňuje smysluplnost a zdůrazňuje rizikovost takového testování a doporučuje, aby tyto aktivity byly přísně regulovány, případně i odmítnuty jako neodpovědné. Odlišné názory pocházející většinou od odborníků jiných profesí nacházejí řešení v tom, že by nešlo o genetické testování, ale o poskytování informací získaných vyšetřením genomu zákazníků, kteří o takové vyšetření projevili zájem. Ponecháme-li stranou tuto hru se slovíčky, jde v principu o to, zda provádět taková vyšetření již v době a v situaci, kdy jeho výsledky ještě neumíme dost spolehlivě interpretovat, a hlavně většinou nedokážeme zvážit význam těchto nálezů pro dotyčnou osobu. Jak se v poslední době děje často, naše technické možnosti předbíhají naše schopnosti duševní, naše morální a etické hodnocení důsledků (39) vyprodukovaných informací. Jestliže budeme souhlasit s Angelou Brandovou, že řešení je třeba nalézt co nejrychleji, neboť personalizace medicíny již vstupuje do genomické fáze, pak se zřejmě bez zavedení regulací do tohoto druhu podnikání, regulací, které budou platné pro jakékoliv subjekty provádějící vyšetření genomu, ať z lékařské indikace, nebo na přání jednotlivých osob (pacientů, zákazníků), neobejdeme. Neměli bychom rovněž dopustit, aby personalizace medicíny vedla k diskriminaci, a to ani tak k etnické jako k sociální.
Je možné, že některá z příštích generací lékařů se dočká toho, že algoritmus vyšetřování se změní a ošetřující lékař bude mít k dispozici kompletní genotypovou výbavu svého pacienta, její momentální stav a genovou aktivitu včetně interpretace výsledků a doporučení co podnikat. Protože je těžko představitelné, že by lidská mysl byla schopna zvládnout takové množství informací, se kterými bude třeba pracovat, budou budoucí lékaři stále více odkázáni na to, čemu dnes říkáme „výpočetní technika“.
Zkratky
Alu – roztroušená a stěhovavá sekvence
BRCA – od breast cancer, použito jako označení genů BRCA1 a BRCA2
Ca – karcinom
CML – chronická myeloidní leukémie
CNV – variabilita počtu kopií (genů)
DTC – direct-to-consumer
EGFR – epidermal growth factor receptor
G6PD – glukóza-6-fosfátdehydrogenázy
RD – rare diseases
RFLP – polymorfismus restrikčních fragmentů
SNP – sekvenční jednonukleotidová odchylka
STR – short tandem repeats, krátká tandemová opakování (sekvence nukleotidů)
VNTR – variable number of tandem repeats, variabilní počet tandemových opakování (sekvence nukleotidů)
Podpořeno grantem IGA 9804.
Adresa pro korespondenci:
prof. MUDr. Radim Brdička, DrSc.
Ústav hematologie a krevní transfuze
U Nemocnice 1, 128 08 Praha 2
fax: +420 221 977 196, e-mail: molgen@uhkt.cz
Zdroje
1. Sharp AJ. Emerging Themes and new challenges in defining the role of strctural variation in human disease. Human Mutation 2008; 30 : 1–10.
2. Antonacci F, et al. Characterization of six human disease–associated inversion polymorphisms. Hum Mol Genet. 2009; 18 : 2555–2663.
3. Miki Y, et al.: A strong candidate for the breast and ovarian cancer susceptibility gene BRCA1. Science 1994; 266 : 66–71.
4. Wooster R, et al. Localization of a breast cancer susceptibility gene, BRCA2, to chromosome 13q12-13. Science 1994; 265 : 2088–2090.
5. Wang B, et al. NBA1, a new player in the Brca1 A complex, is required for DNA damage resistance and checkpoint control. Genes Dev. 2009; 23 : 729–739.
6. Ripperger T, et al. Breast cancer susceptibility: current knowledge and implications for genetic counselling. Eur J Hum Genet 2009; 17 : 721–731.
7. Beggs AD, Hodgson SV. Genomics and breast cancer: The different levels of inherited susceptibility European Journal of Human Genetics 2009; 17 : 855–856.
8. Tan-Chiu E, Piccart M. Moving forward: Herceptin in the adjuvant setting. Oncology 2002; 63 (Suppl. 1): 57–63.
9. Baselga J, et al. Adjuvant trastuzumab: a milestone in the treatment of HER-2-positive early breast cancer. Oncologist. 2006; 11 (Suppl. 1): 4–12.
10. Grell P, et al. Trastuzumab in the breast cancer treatment: Efficacy and resistance mechanisms Klinická Onkologie 2009; 22 : 45–51.
11. Li Y, et al. Anti-tumor activity of a novel EGFR tyrosine kinase inhibitor against human NSCLC in vitro and in vivo Cancer Letters 2009; 279 : 213–220.
12. Grosso S, et al. Gene expression profiling of imatinib and PD166326-resistant CML cell lines identifies Fyn as a gene associated with resistance to BCR-ABL inhibitors. Mol Cancer Ther 2009; 8 : 1924–1933.
13. Atkins MB, et al. Everolimus. Nat Rev Drug Discov. 2009; 8 : 535–536.
14. Böck S, et al. Significance of monoclonal antibodies and oral tyrosine kinase inhibitors in the treatment of advanced pancreatic carcinoma Deutsche Zeitschrift fur Onkologie 2008; 40 : 100–105.
15. Hogan KJ, et al. Perioperative genomic profiles using structure-specific oligonucleotide probes. Clin Med Res 2009; PMID 19474452.
16. Zhou SF, et al. Clinical pharmacogenetics and potential application in personalized medicine. Curr Drug Metab 2008; 9 : 738–784.
17. Gurwitz D, et al. Pharmacogenomics education: International Society of Pharmacogenomics. Reccomendations for medical, pharmaceutical, and health schools deans of education. The Pharmacogenomics J 2005; 5 : 221–225.
18. Daar AS, Singer PA. Pharmacogenetics and geographical ancestry: implications for drug development and global health. Nature Rev.Genetics 2005; 6 : 241–246.
19. Becquemont L: Pharmacogenomics of adverse drug reactions: practical applications and perspectives. Pharmacogenomics 2009; 109 : 61–969.
20. Noori-Daloii MR, Daneshpajooh M. Molecular basisi of G6PD deficienty: current status and its perspektive. Acta medica Iranica 2008; 46 : 167–182.
21. Schuurman M, et al. Severe hemolysis and methemoglobinemia following fava beans ingestion in glukose-6-phosphate dehydrogenace deficienty – case report and literature review. Eur J Pediatr 2009; 168 : 779–782.
22. Votava F, Strnadová K. Novorozenecký screening v České republice a v Evropě. Čes-slov Pediatr 2008; 63 : 96–105.
23. Searle R, Hopkins PM. Pharmacogenomic variability and anaesthesia. Br J Anaesth 2009; 103 : 14–25.
24. Restrepo JG, et al. Polymorphic drug metabolism in anaesthesia Current Drug Metabolism 2009; 10 : 236–246.
25. Wimmers K. Inherited disorders in pigs: Status of molecular genetic characterisation and future directions (in German) Zuchtungskunde 2008; 80 : 35–42.
26. Leeder JS, Spielberg SP. Personalized medicine: Reality and reality checks. Annals of Pharmacotherapy 2009; 43 : 963–966.
27. Garber AM, Tunis SR. Does komparative-effectiveness research threaten personalized medicine? New England J Med 2009; 360 : 1925–1927.
28. Lee SS, Muduliar A. Racing forvard:The genomic and personalized medicíně act. Science 2009; 323 : 342.
29. Garrison LP. Will pharmacogenomics disrupt the U.S. health care systém? Public health genomics 2009; 12; 185–190.
30. Dean CE: Personalized medicine: Boon or budget-buster? Annals of Pharmacotherapy 2009; 43 : 958–962.
31. Issa AM, et al. Assessing patient readiness for the clinical adoption of personalized medicine. Public Health Gernomics 2009; 12 : 163–169.
32. Davis JC, et al. The microeconomics of personalized medicine: Today‘s challenge and tomorrow‘s promise. Nature Reviews Drug Discovery 2009; 8 : 279–286.
33. Lau K-C, et al. A fast modified protocol for random-access ultra-high density whole-genome scan: A tool for personalized genomic medicine, positional mapping, and cytogenetic analysis Clinica Chimica Acta 2009; 406 : 31–35.
34. Deeken J. The Affymetrix DMET platform and pharmacogenetics in drug development. Curr Opin Mol Ther 2009; 11 : 260–268.
35. Pospíšilová Š, et al. Sekvenování lidského geonomu – technologie nové generace aneb budeme rutinně sekvenovat lidské genomy? Čas Lék čes 2009; 148 : 296–302.
36. Russell J. Celera pushes boundaries with automated worlflow, http://www.bio-itworld.com/pb/2009/07/16/celera-pioneers-workflow-use.html
37. Robertson GR, Piquette-Miller M. Pharmacogenetics of pharmacoecology: Which route to personalized medicíne? Clin pharmacology and therapeutics 2009; 85 : 343–348.
38. Brand A. Integrative genomics, personal-genome tests and personalized healthcare: the future is being built today. Eur J Hum Gneter 2009; 17 : 977–978.
39. Hudson TJ. Personalized medicine: A transformative approach is needed. CMAJ 2009; 180 : 911–913.
Internetové adresy:
http://www.personalizedmedicinecoalition.org/
http://www.p3g.org/
http://www.p3gconsortium.org/
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
-
Všetky články tohto čísla
- Specializační vzdělávání lékařů v České republice
- Personalizovaná medicína – genomická fáze Proč a zač
- Nízko-molekulárne heparíny a ich neantitrombotické účinky na hojenie rán
- Spolek lékařů českých
- Kompliance v psychiatrii
- Možnosti léčby plazmou u pacientů s hereditární formou trombotické trombocytopenické purpury
- Podávání intravenózního železa v bezkrevní medicíně
- Oceněné vědecké práce za rok 2008
- Pomoc manželkám mužů závislých na alkoholu
- Historie a současnost registrace vrozených vad v České republice
- Popis a funkce lipidových raftů
- Průkaz lipidových raftů na buněčné membráně
- Žírné buňky v nádoru
- Výuka humanitních věd na lékařských fakultách v České republice IX. sympozium lékařských fakult ČR Praha, 18. února 2009
- VIII. setkání dětských alergologů a klinických imunologůKrahulčí u Telče, 19.–21. června 2009
- XX. kongres ČLS JEP pro lékaře v praxi s mezinárodní účastí Brno, 21. října 2009
- Regionální pracovní den pro management klinických laboratoří Olomouc, 10. září 2009
- Helsinská deklarace Světové lékařské asociace (WMA)
- Laureáti Nobelovy ceny
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Podávání intravenózního železa v bezkrevní medicíně
- Helsinská deklarace Světové lékařské asociace (WMA)
- Nízko-molekulárne heparíny a ich neantitrombotické účinky na hojenie rán
- Kompliance v psychiatrii
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



