-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Akutní selhání jater: současná doporučení
Acute liver failure: Present recommendations
Acute liver failure is a life threatening illness whose mortality rate remains high. For the survival an early diagnosis is crucial as well as the use of specific and supportive therapy and the determination of patient‘s need for urgent liver transplantation. At the first signs of the disease progression it is necessary to contact a transplantation centre. The patient with acute liver failure should be admitted to intensive care unit of a hospital capable to perform liver transplantation. Liver transplantation is limited by the availability of organs. It is possible to expand the time required for spontaneous liver regeneration or transplantation by using liver supporting systems. The therapy of the acute liver failure is multidisciplinary and should be performed in specialized centers.
Key words:
acute liver failure, intracranial hypertension, liver transplantation.
Autori: Eva Kieslichová 1; Milan Ročeň 1; Soňa Fraňková 2; Pavel Trunečka 3
Pôsobisko autorov: Institut klinické a experimentální medicíny v Praze, Transplantcentrum, Klinika anesteziologie, resuscitace a intenzivní péče 1; Institut klinické a experimentální medicíny v Praze, Transplantcentrum, Klinika hepatogastroenterologie 2; Institut klinické a experimentální medicíny v Praze, Transplantcentrum 3
Vyšlo v časopise: Čas. Lék. čes. 2011; 150: 24-30
Kategória: Přehledový článek
Súhrn
Akutní selhání jater je život ohrožující onemocnění zatížené vysokou mortalitou. Zásadní význam pro přežití pacienta má včasná diagnostika onemocnění, nasazení specifické a podpůrné terapie a provedení indikační rozvahy k transplantaci jater. Při prvních známkách progrese onemocnění je nutné kontaktovat transplantační centrum a pacienta přeložit na jednotku intenzivní péče pracoviště, kde je možné transplantaci provést. Transplantace jater je limitována dostupností orgánů. Dobu potřebnou pro spontánní regeneraci jater nebo pro provedení transplantace je možné prodloužit užitím podpůrné přístrojové terapie. Terapie akutního selhání jater je multidisciplinární záležitostí a měla by být prováděna ve specializovaných centrech.
Klíčová slova:
akutní selhání jater, nitrolební hypertenze, transplantace jater.Akutní selhání jater – charakteristika a definice
Akutní selhání jater (ASJ) je život ohrožující onemocnění charakterizované náhlým nástupem závažné jaterní dysfunkce u jedince bez předchozího onemocnění jater, rozvojem ikteru, encefalopatie a koagulopatie. Onemocnění vzniká náhle, rychle progreduje a o přežití pacienta nerozhodují dny, ale hodiny; zásadní význam pro prognózu pacienta má včasné stanovení diagnózy a zahájení terapie včetně zvážení indikace k ortotopické transplantaci jater (OLT). Vzhledem k vysoké regenerační schopnosti jater je onemocnění potenciálně reverzibilní, ale přes pokroky v intenzivní medicíně je ASJ spojeno s vysokou mortalitou, která dosahuje 50–90 %, není-li provedena OLT. K úmrtí dochází v časných stadiích v souvislosti s rozvojem nitrolební hypertenze, v dalším průběhu v důsledku sepse a multiorgánového selhání, přičemž sepse a syndrom multiorgánové dysfunkce (MODS) je v posledních letech hlavní příčinou smrti pacientů s ASJ (1).
Podle O’Gradyho klasifikace jsou rozlišovány tři kategorie ASJ podle intervalu mezi ikterem a nástupem encefalopatie: hyperakutní, akutní a subakutní. Ačkoliv hyperakutní selhání je běžně spojováno s rozvojem edému mozku, jeho prognóza je lepší než u akutního a subakutního typu (tab. 1) (2, 3).
Tab. 1. Klasifikace akutního selhání jater (O’Grady) 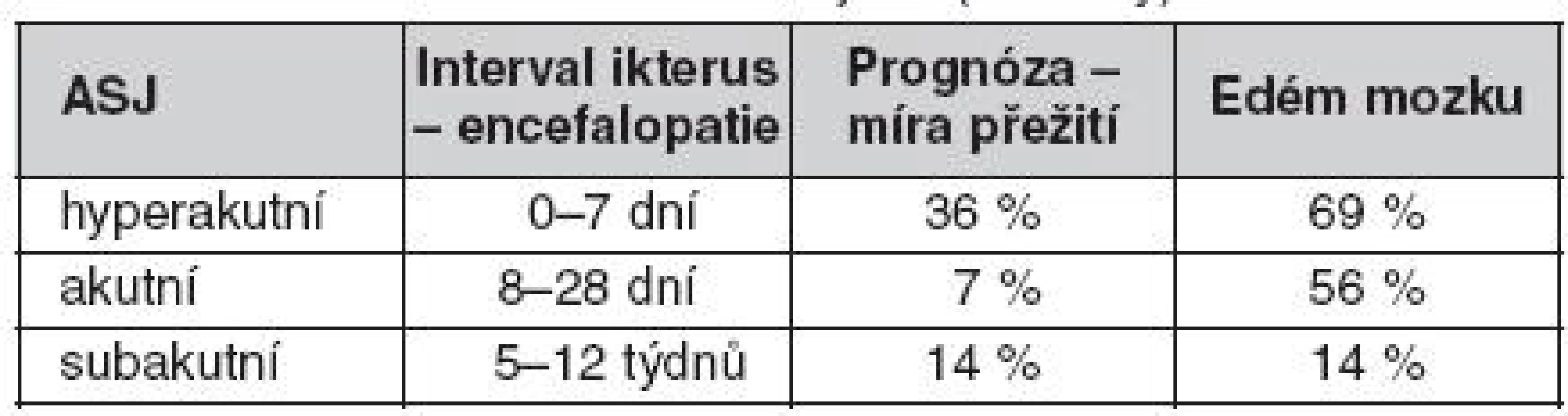
ASJ – akutní selhání jater Akutní selhání jater na chronickém podkladě
Akutní selhání jater na chronickém podkladě (acute on chronic liver failure – AoCLF) je charaterizováno náhlým zhoršením jaterních funkcí u pacienta s dosud stabilizovaným jaterním onemocněním v důsledku působení nového hepatotoxického inzultu. Nejedná se tedy o přirozenou progresi chronického onemocnění jater, přičemž přesná definice syndromu je důležitá vzhledem k dopadům na transplantační program. Asijsko-Pacifická společnost pro studium jater (APASL) i Evropská společnost pro studium jater (EASL) zveřejnila stanovisko k této problematice, přesto zůstává tento syndrom stále předmětem diskuzí (4, 5).
Etiologie akutního selhání jater
Celosvětově jsou nejčastější příčinou ASJ virové hepatitidy. Další častou příčinou jsou toxická a poléková poškození (tab. 2) (6). Etiologie onemocnění má vliv na jeho přirozený průběh a prognózu. Ne vždy se ji však podaří odhalit, u dospělých není známa u cca 14 % pacientů, u dětí až v 60 % případů (Acute Liver Failure Study Group database) (7). Jsou dokumentovány geografické rozdíly v etiologii ASJ. Zatímco intoxikace paracetamolem je hlavní příčinou ASJ ve Velké Británii (v roce 2009 60 % případů), v jiných evropských centrech je podíl této etiologie nižší (34 % případů) (Acute Liver Failure Studies in Europe) (8).
Tab. 2. Příčiny akutního selhání jater 
CMV – cytomegalovirus, HELLP – hemolýza, elevace jaterních enzymů, nízký počet trombocytů Patofyziologie akutního selhání jater
Pro ASJ je typická značná systémová a splanchnická vazodilatace, hyperkinetická cirkulace s vysokým srdečním výdejem a nízkou systémovou vaskulární rezistencí, nízká arteriovenózní diference obsahu kyslíku (9). Tkáňová hypoxie, která se může vyvinout navzdory vysokému srdečnímu výdeji a arteriální oxygenaci, přispívá k rozvoji multiorgánové dysfunkce. V patogenezi mikrocirkulační poruchy se uplatňují vazoaktivní látky uvolněné z nekrotických jater, cytokiny, produkované makrofágy, v reakci na systémovou endotoxinémii a poškození endotelu volnými kyslíkovými radikály. Kromě toho dochází k uzavírání kapilár mikrotromby, které vznikají v důsledku aktivace a konzumpce krevních destiček a zvýšené endoteliální adheze leukocytů. Některé léky a toxiny mohou mít i přímé toxické účinky na jiné orgány (srdce, ledviny, pankreas). Zánět a edém jater vedou k rozvoji akutní portální hypertenze a následné zvýšené translokaci střevních bakterií. Je rovněž prokázána adrenální dysfunkce (10).
Encefalopatie a nitrolební hypertenze při ASJ souvisí s alterací hematoencefalické bariéry, akumulací neurotoxických substancí v mozku, poruchou syntézy a metabolismu neurotransmiterů a poruchou energetického obratu v mozku (11). U pacientů s ASJ je poškozena nebo zcela vyřazena autoregulace průtoku krve mozkem. Průtok krve mozkem je redukován u většiny pacientů s III. a IV. stupněm encefalopatie, produkce laktátu v mozku je obvykle zvýšena, protože dodávka kyslíku nepokrývá metabolické požadavky mozku. Edém mozku, který se rozvíjí u 80 % pacientů s encefalopatií IV. stupně, je kombinací edému vazogenního a cytotoxického (12). Experimentální i klinické důkazy dávají hyperamonémii do spojitosti s patogenezí edému mozku. Arteriální hyperamonémie pacientů s ASJ nad 150 μmol/l, měřená během 24 hodin po dosažení III. stupně encefalopatie, je asociována s vyšší pravděpodobností vývoje mozkového edému, hyperamonémie nad 200 μmol/l je prediktorem herniace mozku (13). U pacientů s ASJ bývá zachycena subklinická epileptoformní aktivita, prokazatelná kontinuálním EEG.
S progresí encefalopatie souvisí i vývoj respirační dysfunkce, zvyšuje se riziko aspirace, může být přítomna hypoventilace i hyperventilace s dopady na acidobázickou rovnováhu. ARDS se vyskytuje cca u 30 % pacientů, narůstající hyperkapnie vede k elevaci ICP (intracranial pressure – nitrolební tlak). Akutní poškození a selhání ledvin se vyskytuje až u 70 % pacientů s ASJ, příčiny jsou prerenální i renální, a to relativní hypovolémie při vazodilataci, porucha mikrocirkulace i přímý toxický vliv některých agens (paracetamol, amanitiny), dochází k rozvoji akutní tubulární nekrózy (14).
Pro ASJ je typická porucha metabolismu glykogenu, snížení úrovně glukoneogeneze a zvýšené odbourávání svalové i tukové tkáně. V játrech klesá syntéza insulin-like růstového faktoru 1, který odpovídá za zvýšení syntézy proteinů a snížení jejich degradace v kosterních svalech. Hypoglykémie je výsledkem poruchy metabolismu glykogenu, snížení úrovně glukoneogeneze a zvýšené hladiny cirkulujícího inzulinu při jeho neadekvátní clearanci v poškozených jaterních buňkách, jedná se o prognosticky nepříznivý příznak selhání jater.
Běžně je zaznamenávána hypofosfatémie, hypomagnezémie a metabolická acidóza.
Koagulopatie při ASJ je dána sníženou syntézou koagulačních a antikoagulačních faktorů v játrech (faktory II, V, VII, IX, X, inhibitory koagulace, antitrombin III, protein C a S, fibrinogen, plazminogen a inhibitor plazminogenu), častým nálezem je aktivovaná fibrinolýza (15). Počet trombocytů klesá pro porušenou jaterní syntézu faktorů, nezbytných pro jejich dozrávání a uvolňování (trombopoetin), a také díky jejich konzumpci. Jsou prokázovány i morfologické anomálie destiček (16).
Je narušena fagocytární aktivita neutrofilů a Kupfferových buněk, snížena hladina komplementu. Charakteristická je vyšší vnímavost k infekcím včetně mykotických (17). Leukocytóza a febrilie nemusejí být přítomny. Hodnoty prokalcitoninu mohou být zvýšeny i bez jasného průkazu ložiska infekce nebo jednoznačného záchytu bakteriálního původce, což může souviset s reakcí na translokaci střevních bakterií. Významnou pomoc při diagnostice infekce představují metody molekulární biologie.
Závažnost a trvání klinických projevů ASJ u jednotlivých pacientů závisejí na stupni poškození syntetické, biotransformační a antiendotoxinové aktivity jater, vyplývajícího ze ztráty jejich funkční tkáně, na systémových účincích toxinů, uvolňovaných z nekrotických jater a na rozsahu a rychlosti regenerace jaterního parenchymu. Příčina selhání jater má vliv na rychlost progrese klinického obrazu a histologický typ jaterního poškození.
Diagnostika akutního selhání jater
K diagnóze ASJ by měl vést náhle vzniklý ikterus s rozvojem encefalopatie (tab. 3) bez předchozího onemocnění jater. Další příznaky jsou často nespecifické a mohou se lišit v souvislosti s etiologií onemocnění, bývá přítomna únava, nauzea, zvracení, bolesti břicha a průjmy. Krevní tlak v časných stadiích může být normální, později progreduje hypotenze, charakteristická je hyperventilace, rozvoj oligoanurie. Objevují se známky koagulopatie, může dojít ke krvácení z gastrointestinálního traktu.
Tab. 3. Encefalopatie při akutním selhání jater (Sanyal AJ, Starvitz RT. Hepatology 2003) 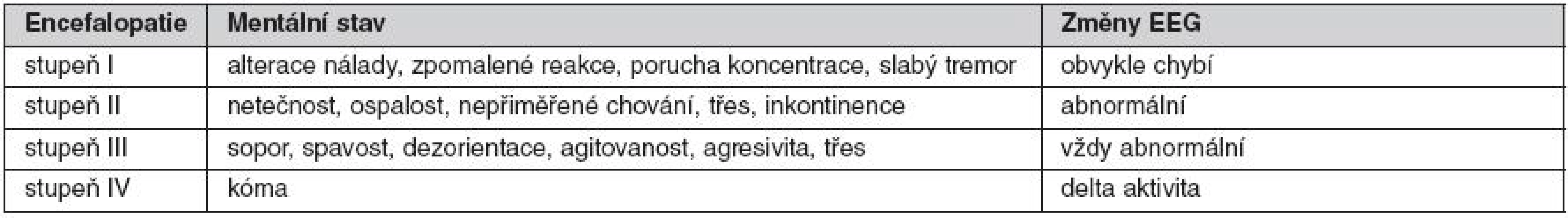
EEG – elektroencefalogram Je třeba pomýšlet vždy na možnost intoxikace a provést toxikologické vyšetření, v sezoně pátrat po požití hub (amanita, toxické houby), zajímat se o možnosti virových nákaz (pobyt v rizikových oblastech), užívání drog (extáze). Důsledkem náročného sportovního výkonu může být hypertermie a rhabdomyolýza. Důležité jsou údaje o průběhu gravidity. Především u mladých žen je nutné zvažovat diagnózu Wilsonovy choroby, která je potvrzena na základě obsahu mědi v sušině z jaterní biopsie a odpadu mědi v 24hodinovém sběru moče. Keyserův - Fleischerův prstenec není často prokazován, v pokročilém stadiu jaterního selhání je navíc vyšetření štěrbinovou lampou nemožné. Laboratorní obraz polycytémie může vést k diagnostice Buddova-Chiariho syndromu. Je nutné vyloučit venookluzivní nemoc pomocí zobrazovacích metod. Diagnostika virových hepatitid je založena na kompletním virologickém vyšetření, autoimunitní hepatitida na vyšetření imunologickém.
Pro otravu muchomůrkou zelenou (amanita phalloides) je typický průběh ve čtyřech stadiích: asymptomatická fáze, gastrointestinální příznaky, odeznění symptomatologie a stadium ASJ. Toxické houby mohou po požití vyvolat profuzní průjmy vedoucí k těžké dehydrataci a k ischémii splanchniku.
Laboratorně kromě hyperbilirubinémie jsou obecně přítomny vyšší hodnoty aminotransferáz, snížená aktivita cholinesterázy, prodloužený protrombinový čas a snížené hodnoty koagulačních faktorů II, V, VII, IX, X, aktivovaná fibrinolýza, snížená hodnota antitrombinu III a fibrinogenu. Dochází ke zvýšení hodnot urey a kreatininu, snížení glomerulární filtrace, charakteristické jsou vyšší hodnoty laktátu v arteriální krvi, hypoglykémie, hypo - nebo hyperkalémie, hyponatrémie, hyperamonémie, hypoalbuminémie. Častá je leukocytóza a trombocytopenie. K anemizaci dochází v rámci krevních ztrát při koagulační poruše, v důsledku hemolýzy (Wilsonova choroba) nebo i iatrogenně.
Při vyšetřování pacienta s ASJ mají důležitou roli zobrazovací techniky (ultrazvuk s Dopplerem, CT, MRI). V případě pochybností o etiologii onemocnění by měla být po úpravě koagulopatie provedena biopsie jater, a to preferenčně transjugulární cestou.
Oční vyšetření papily při diagnostice nitrolební hypertenze nemá význam, protože edém papily je až pozdním příznakem. CT vyšetření nemusí vzhledem k proměnlivosti stavu edém mozku prokázat, má ale význam v identifikaci jiné nitrolební patologie (hematom, tumor).
Terapie akutního selhání jater
Podpůrnou terapii ASJ je třeba zahájit co nejdříve u všech pacientů. V některých případech je možná cílená specifická terapie.
Specifická terapie akutního selhání jater
Při otravě paracetamolem je hlavním opatřením redukce vstřebávání paracetamolu (aktivní uhlí) a intravenózní podání antidota, kterým je N-acetylcystein (NAC). Jeho hlavním účinkem je zvýšení produkce glutationu v játrech, kdy NAC slouží jako zdroj cysteinu. Nejúčinnější je při podání do 8 hodin po intoxikaci. Jsou k dispozici různá dávkovací schémata, nejčastěji se doporučuje zahajovací dávka 150 mg/kg během 15–30 minut, poté 50 mg/kg během 4 hodin a následně 100 mg/kg v průběhu 16 hodin (celkově 300/mg/kg během 20 hodin). U pacientů přijímaných 10–24 hodin po ingesci je užíván 48hodinový režim s úvodní dávkou 140 mg/kg (1 hodina), se sérií 12 udržovacích dávek 70 mg/kg po 4 hodinách. V léčbě NAC je třeba pokračovat, dokud neklesne INR pod 2 (18, 19).
Při otravě muchomůrkou zelenou je třeba zamezit dalšímu vstřebávání amanitinu, podpořit vylučování močí a blokovat jeho enterohepatální cirkulaci (výplachy žaludku, opakovaně aktivní uhlí v dávce 1 g/kg, opakovaná vysoká klyzmata, hydratace). Do tří dnů po požití je při intoxikaci amanitou indikována plazmaferéza. Antidotem volby je silibinin, který zabraňuje vychytávání amanitinu játry a průniku do hepatocytů; podává se v dávce 20–50 mg/kg/den ve čtyřech dvouhodinových infuzích, doporučená doba podávání je 3–5 dní. Silibinin se kombinuje s NAC (bolus 150 mg/kg, dále 300 mg/ /kg/den). Podávání silibininu je na základě multicentrické studie asociováno s lepším přežíváním pacientů než dříve doporučované vysoké dávky krystalického penicilinu (20).
U pacientů s Buddovým-Chiariho syndromem je základem léčby obnovení průtoku krve z jater vytvořením portokavální spojky (transjugulární intrahepatální portosystémová spojka).
ASJ z kardiovaskulárních příčin vyžaduje léčbu srdeční dysfunkce a normalizaci parametrů hemodynamiky, při ASJ v graviditě je nezbytné ukončení těhotenství.
U virových infekcí je indikována antivirová terapie. Při akutní hepatitidě typu B je indikován lamivudin (100 mg/den), vhodnější variantou je entecavir (0,5 mg/den), který má vyšší protivirovou účinnost (21, 22). Při herpetické hepatitidě je indikováno podání acykloviru.
Ačkoliv je autoimunitní hepatitida chronické onemocnění, může se asi u 22 % pacientů akutně manifestovat jako ASJ; je doporučováno podávání kortikoidů (23).
Podpůrná terapie akutního selhání jater
Pacienti s vyšším než I. stupněm encefalopatie musejí být léčeni na specializované jednotce intenzivní péče. Podpůrné léčebné intervence jsou zaměřeny na udržení hemodynamické stability, adekvátní ventilace a oxygenace, kontrolu nitrolební hypertenze, podporu a náhradu renálních funkcí, úpravu metabolických odchylek, prevenci a terapii infekce, prevenci stresových žaludečních vředů a kontrolu koagulopatie (24).
V současné době je u všech pacientů s ASJ nezávisle na etiologii doporučováno podání NAC pro jeho antioxidační účinky, které mohou bránit zánětlivé reakci na oxidativní poškození, což má příznivý vliv na mikrocirkulaci (25, 26).
Respirační systém
U pacientů s progresí encefalopatie do stadia III je indikovaná tracheální intubace a umělá plicní ventilace. Pro intubaci není vhodné užití sukcinylcholinu, který vyvolává svalové kontrakce, což vede k elevaci nitrolebního tlaku. Doporučuje se protektivní ventilace s nízkými dechovými objemy (6 ml/kg) bez zvyšování PEEP nad 10 cm H2O. Důsledkem užití vysokých hodnot PEEP je městnání v játrech a další zhoršení jaterních funkcí.
Kardiovaskulární systém
Cílem terapie je udržení hemodynamické stability zajištěním adekvátní intravaskulární náplně, event. podáváním vazopresorů, a to především noradrenalinu v kontinuální infuzi (27). Při známkách kardiálního selhávání je indikován dobutamin. Vasopressin a jeho analoga potencují vazokonstrikční efekt noradrenalinu, což vede ke snížení jeho potřeby. Užití vasopressinu a terlipressinu u pacientů s ASJ je kontroverzní vzhledem k vzestupu nitrolebního tlaku, podmíněnému cerebrální vazodilatací (28). Adrenální insuficienci je doporučeno korigovat podáváním hydrokortisonu (200–300 mg i.v. denně).
Ledviny
V terapii pacientů s ASJ je extrémně žádoucí vyhnout se nefrotoxicky působícím inzultům, udržet náplň řečiště při extrémní vazodilataci a dostatečný perfuzní tlak. Eliminační metodu je třeba indikovat včas, indikací k jejímu zavedení je většinou těžké tekutinové přetížení, k minimalizaci výkyvů nitrolebního tlaku je volena metoda kontinuální (29). Indikací k zavedení eliminační metody je i hyperamonémie, a to i bez přítomnosti akutního poškození ledvin. Pokud dojde k úspěšné transplantaci jater, funkce ledvin se většinou obnoví bez nutnosti další dialyzační léčby.
Terapie nitrolební hypertenze
Při progresi encefalopatie je indikována intubace, umělá plicní ventilace, analgosedace a monitorace nitrolebního tlaku. Cílem terapie nitrolební hypertenze je udržování cerebrálního perfuzního tlaku (CPP) nad 50 mm Hg, a nitrolebního tlaku (ICP) pod 20 mm Hg. Neovlivnitelná nitrolební hypertenze je důvodem k vyřazení pacienta z čekací listiny k OLT. Monitorace ICP je sice kontroverzní pro svá rizika při zavedení čidla (krvácení, infekce), přínosem je však možnost včasných terapeutických intervencí při elevaci ICP a udržení pacienta v transplantabilním stavu (30). V centrech, která mají zkušenosti s invazivní monitorací ICP, je uváděna nízká incidence krvácivých i infekčních kompikací. Alternativní možnosti monitorace, jako je saturace v jugulárním bulbu a transkraniální Doppler, buď neposkytují dostatek potřebných informací o perfuzi mozku, nebo nejsou rutinně dostupné (mikrodialýza). Před zavedením nitrolebního čidla musí být podána antibiotická profylaxe a upravena koagulopatie včetně korekce trombocytopenie (INR pod 1,5, počet trombocytů nad 50 × 109/l). Přípravky užívané k léčbě hyperamonémie u chronického onemocnění jater nebyly formálně testovány u pacientů s ASJ. Teoreticky je očišťování od amoniaku v tračníku dosažitelné pomocí nevstřebatelných disacharidů mnohem nižší než rychlost, s jakou je amoniak, generovaný ve splanchnickém řečišti, odváděn do systémového oběhu. Dále tyto přípravky mohou vést k distenzi tračníku a komplikovat provedení neodkladné transplantace jater. Ukázalo se, že zvýšené odstraňování amoniaku ve svalech je mechanismem, jímž ornitin-aspartáza zabraňuje vývoji mozkového edému u potkanů po jaterní devaskularizaci. Směs aminokyselin navodila posttranslační zvýšení aktivity svalové glutamin-syntetázy s poklesem hladin amoniaku. Bezpečnost tohoto přístupu u lidí však nebyla hodnocena.
Preventivní opatření proti rozvoji edému mozku spočívají v elevaci hlavy 20–30o, přičemž nesmí dojít k blokádě venózního odtoku, v prevenci a terapii objemového přetížení. Je třeba eliminovat faktory, které mohou zapříčinit nárůst ICP, vhodná opatření představují šetrná manipulace, prohloubení sedace před odsáváním z dýchacích cest, udržování normotermie a terapie křečí. Je doporučována včasná léčba hyponatrémie a suplementace natria s cílovou koncentrací 145–155 mmol/l (31). Mírná hypotermie (32–34o C) snižuje metabolický obrat v mozku (32). Při náhlé elevaci ICP se podává bolusově manitol 0,5–1 g/kg, je-li osmolalita séra pod 320 mosmol/l. Udržuje se normoventilace, hyperventilace je indikována pouze krátkodobě při vzestupu ICP. Selžou-li uvedená opatření, je indikováno podání indometacinu (33) a další prohloubení sedace (barbituráty bolusově i v kontinuální infuzi).
Výživa
ASJ je katabolický stav, spojený s negativní dusíkovou bilancí; adekvátní dodávka živin slouží k podpoře regenerace hepatocytů. Doporučený přívod energie je 30–35 kcal/kg/den, dávka aminokyselin by měla být 0,8–1,2/kg/den, lipidů 0,8–1,2/kg/den a glukózy 2–3 g/kg/den (34). Vzhledem k riziku hypoglykémie je nutné kontinuální podávání glukózy a pečlivá monitorace glykémie. Dle aktuálního stavu pacienta může být výživa podávána perorálně, enterálně nebo parenterálně.
Korekce koagulopatie
Koagulopatie sama o sobě nevyžaduje léčbu, úprava je indikována při krvácení a v rámci přípravy na invazivní výkon (čerstvě zmrazená plazma, protrombinový komplex). Byly popsány trombotické komplikace v souvislosti s podáním rekombinantního aktivovaného faktoru VII (35). Je možné podávat vitamin K ro jeho případnou deficienci.
Profylaxe infekce
U pacientů s ASJ je nutný pečlivý screening infekce. Je vhodné podávat antibiotickou i antimykotickou profylaxi, zejména při progresi onemocnění. Včasná terapie sepse je nutná pro přežití pacienta (36).
V prevenci krvácení do horních partií gastrointestinálního traktu je účinná profylaxe H2-blokátory nebo inhibitory protonové pumpy.
Podpůrná přístrojová terapie akutního selhání jater
Hlavní indikací pro použití podpůrné přístrojové terapie jaterního selhání jsou stavy s náhlým selháním jaterních funkcí, u kterých lze předpokládat rychlé zlepšení nebo možnost radikální terapie, a to provedení OLT. Před zavedením OLT jako standardního postupu terapie jaterního selhání bylo učiněno mnoho pokusů o úspěšnou léčbu ASJ. Jejich cílem bylo odstranění nahromaděných metabolitů a toxinů uvolněných v souvislosti s nekrózou jater. Byla použita plazmaferéza, výměna plné krve, zkřížená cirkulace se zvířetem, kontinuální veno-venózní hemofiltrace nebo hemodialýza, hemoperfuze přes aktivní uhlí. Všechny uvedené metody přinesly pouze přechodné zlepšení neurologického stavu nemocných s ASJ, ale nebyly efektivní v ovlivnění mortality. V současné době jsou v různých fázích experimentálního a klinického užití systémy biologické (s užitím hepatocytů), nebiologické a hybridní (bioarteficiální) (37). Nejčastěji užívanými podpůrnými systémy v Evropě je Molecular Adsorbent Recirculating System (MARS) a systém frakcionované plazmatické separace a adsorpce (FPSA, přístroj Prometheus). MARS pracuje na principu albuminové dialýzy s vychytáváním látek vázaných na albumin ve filtrech (adsorbérech). Skládá se ze tří různých tekutinových kompartmentů: krevního okruhu, okruhu s lidským sérovým albuminem s adsorbéry, a z dialyzačního nebo hemofiltračního okruhu. Hlavním mechanismem odstraňování toxinů je tedy adsorpce látek vázaných na albumin na membráně v kombinaci s hemodialýzou (nebo hemofiltrací), kterou jsou odstraňovány látky rozpuštěné ve vodě. Přístrojem jsou odstraňovány současně jak látky rozpustné ve vodě (amoniak, urea, kreatinin), tak i látky silně vázané na albumin (bilirubin, žlučové kyseliny). Podle výsledků klinických studií zlepšuje MARS orgánové funkce a krátkodobé přežití pacientů s akutní dekompenzací chronického jaterního selhání. Jiné studie prokázaly terapeutický efekt MARS u pacientů s ASJ, kteří splňovali kritéria pro OLT. Užití této techniky vedlo ke zlepšení jejich neurologického stavu, poklesu ICP, vzestupu CPP, stabilizaci hemodynamických parametrů se snížením potřeby katecholaminů (38).
Při užití FPSA jsou odstraňovány substance vázané na albumin přímo pomocí adsorbérů. Přístroj Prometheus sestává z dialyzačního přístroje rozšířeného o modul pro frakcionovanou plazmatickou separaci s albuminovým filtrem a dvěma adsorbery. Přístroj pracuje bez nutnosti náplně albuminem. Součástí systému je Albu flow filtr s polysulfonovou membránou propouštějící molekuly do 250 kD včetně albuminu (68 kD). Ten propustí plazmatickou frakci obsahující albumin do dalšího okruhu, kde prochází přes neutrální pryskyřičný adsorbér Prometh 1 adsorbující žlučové kyseliny, aromatické aminokyseliny, fenolické substance a toxiny a iontový výměník Prometh 2 se styren-divinylbenzen kopolymerem s prostorovou sítí 100 μm, který vychytá negativně nabité ligandy (nekonjugovaný bilirubin). Tímto způsobem jsou z plazmy odstraněny toxiny vázané na albumin. Ve vodě rozpustné substance (amoniak) jsou odstraňovány dialýzou (39).
Většina dosavadních studií se zabývá terapií FPSA u pacientů s akutním selháním na chronickém podkladě (acute on chronic), nikoli u pacientů s ASJ. Multicentrická, randomizovaná studie HELIOS (10 center v sedmi evropských zemích), jejíž výsledky byly zveřejněny v dubnu 2010, hodnotila mortalitu pacientů s AoCLF nezávisle na transplantační terapii. Bylo prokázáno, že zavedení FPSA významně snížilo mortalitu u pacientů s AoCLF s hepatorenálním syndromem typu 1 a s MELD skóre nad 30 (40). Terapie přístrojem Prometheus je v Transplantcentru IKEM užívána od roku 2005, indikováni k této terapii jsou pacienti s ASJ zařazení na čekací listinu k OLT v urgentním pořadí a pacienti s primární afunkcí štěpu po transplantaci zařazení k retransplantaci jater. Bylo ověřeno, že tato metoda je bezpečná, je schopná účinně nahradit detoxikační funkci selhávajících jater. U pacientů s ASJ v IKEM vedla metoda FPSA k významnému zlepšení encefalopatie. Oproti historické skupině pacientů, kteří takto léčeni nebyli, se podařilo signifikantně prodloužit klíčovou dobu terapeutického okna, po kterou je pacient ve stabilním stavu schopen čekání na transplantaci jater, nebo dobu, která je potřebná k případné spontánní regeneraci selhávajících jater. Navíc bylo prokázáno statisticky významné snížení sérových koncentrací bilirubinu, urey, kreatininu, amoniaku, některých zánětlivých cytokinů – tumor necrosis factor alfa (TNF-α) a markerů zánětu jako jsou C-reaktivní protein (CRP) a prokalcitonin (PCT) během terapie. HGF (hepatocyte growth factor) nebyl ve statisticky významném měřítku odstraňován adsorpcí, terapie metodou FPSA vedla naopak ke zvýšení hodnot růstového faktoru hepatocytů (HGF), což by mohlo mít z hlediska regenerace jater pozitivní význam (41).
Bioarteficiální systémy s bioreaktorem s hepatocyty jsou v současné době rozvíjeny, hlavními problémy zůstávají otázky zdroje hepatocytů a udržení jejich viability v systému. Výsledky dosud provedených studií jsou jen obtížně srovnatelné a hodnotitelné vzhedem k velké variabilitě ohledně užitých systémů a designu jednotlivých studií. V IKEM byly tyto systémy zkoušeny zatím pouze experimentálně (42). Do budoucna zůstává rovněž otevřenou otázka transplantace hepatocytů.
Transplantace jater
Potenciálními kandidáty OLT jsou všichni pacienti s ASJ. Kontraindikací transplantace jater je nekontrolovaná sepse, nekontrolovaná nitrolební hypertenze, těžká extrahepatální komorbidita (malignity). Je třeba zohlednit i psychické a sociální faktory (opakované pokusy o sebevraždu pacientů se závažnými psychickými problémy, alkoholismus).
Selekční kritéria pro transplantaci jater jsou založena na ukazatelích, identifikujících nejhůře postižené s velmi špatnou prognózou při konzervativní terapii. Nejčastěji se užívá King’s College kritérií (tab. 4), která byla opakovaně validována pro euroatlantickou populaci, kdy predikce přežití je menší než 20 % při konzervativní léčbě (43, 44).
Tab. 4. King’s College kritéria 
INR – international normalized ratio, Skr – sérová koncentrace kreatininu, Sbili – sérová koncentrace bilirubinu Kritéria Clichy (tab. 5) jsou založena na kombinaci stupně encefalopatie, hodnoty faktoru V a věku (45). Nevýhodou obou těchto kritérií je vysoká pozitivní prediktivní hodnota, ale nízká negativní prediktivní hodnota. Existují tak pacienti, kteří nesplní kritéria, a přesto zemřou. Proto jsou hledány jiné postupy, jejich validita však zatím nebyla univerzálně prokázána (zmenšený objem jaterní tkáně, rozsah nekróz nad 50 %, vysoká koncentrace laktátu) (46, 47).
Celkové roční přežití pacientů po OLT pro ASJ je 50–80 %. Využití štěpů s vysokým rizikem umožňuje zvýšit počet příjemců transplantátu, ale nese s sebou riziko nutnosti retransplantace i vyšší mortalitu (48, 49). Alternativní techniky jako auxiliární transplantace a transplantace jater ze živého dárce, nejsou v České republice rozšířeny. V určitých případech je možno zvážit provedení transplantace ABO inkompatibilním štěpem.
ZÁVĚR
ASJ je náhle vzniklé onemocnění vyvolané různými příčinami, charakterizované rychlou progresí a nepříznivou prognózou. Osud pacientů ovlivňuje včasné stanovení diagnózy, zahájení terapie a zvážení indikace k transplantaci jater. Terapie ASJ je multidisciplinární záležitostí a měla by být prováděna ve specializovaných centrech.
Zkratky
- ABO – systém krevních skupin
- ASJ – akutní selhání jater
- AoCLF – akutní selhání jater na chronickém podkladě
- CMV – cytomegalovirus
- CPP – mozkový perfuzní tlak
- CRP – C-reaktivní protein
- CT – počítačová tomografie
- EEG – elektroencefalogram
- FPSA – frakcionovaná plazmatická separace a adsorpce
- HGF – růstový faktor hepatocytů (hepatocyte growth factor)
- ICP – nitrolební tlak
- INR – international normalized ratio
- MARS – molecular adsorbent recirculating system
- MODS – syndrom multiorgánové dysfunkce
- MRI – zobrazení pomocí magnetické rezonance
- NAC – N-acetylcystein
- OLT – ortotopická transplantace jater
- PCT – procalcitonin
- Sbili – sérová koncentrace bilirubinu
- Skr – sérová koncentrace kreatininu
- TNF-α – tumor necrosis factor alfa
Adresa pro korespondenci:
MUDr. Eva Kieslichová, Ph.D.
Klinika anesteziologie, resuscitace a intenzivní péče Transplantcentrum IKEM
Vídeňská 1958/9, 142 00 Praha 4
e-mail: evki@ikem.cz
Zdroje
1. Riordan SM, Williams R. Perspectives on liver failure: past and future. Semin Liver Dis 2008; 28 : 137–141.
2. O’Grady JG, Schalm SW, Williams R. Acute liver failure: redefining the symdromes. Lancet 1993; 31 : 273–275.
3. O’Grady JG. Acute liver failure. Postgrad Med J 2005; 81 : 148–154.
4. Sarin SK, Kumar A, Almeida JA, et al. Acute-on-chronic liver failure: consensus recommendations of the Asian Pacific Association for the study of the liver (APASL). Hepatol Int 2009; 3 : 269–282.
5. Jalan R, Williams R. Acute on Chronic liver failure: pathophysiological basis of therapeutic options. Blood Purif 2002; 20 : 252–261.
6. Lee WM. Etiologies of acute liver failure. Semin. Liver Dis 2008; 28 : 142–152.
7. Lee VM, Squires RH, Nyberg AL, et al. Acute liver failure: Summary of a Workshop. Hepatology 2008; 47 : 1401–1415.
8. Wendon J, Manns M, Alexander G, et al. Acute liver failure: Current european perspective. J Hepatol 2010; 52(Suppl 1): S13.
9. Rolando N, Wade J, Davalos M, et al. The systemic inflammatory response syndrome in acute liver failure. Hepatology 2000; 32 : 734–739.
10. Harry R, Auzinger G, Wendon J. The clinical importance of adrenal insufficiency in acute hepatic dysfunction. Hepatology 2002; 36 : 395–402.
11. Jalan R. Intracranial hypertension in acute liver failure: pathophysiological basis of rational management. Semin Liver Dis 2003; 23 : 271–282.
12. Ranjan P, Mishra AM, Kale R, et al. Cytotoxic edema is responsible for raised intracranial pressure in fulminant hepatic failure: In vivo demonstration using diffusion-weighted MRI in human subjects. Metab Brain Dis 2005; 20 : 181–192.
13. Bernal W, Hall C, Karvellas CJ, et al. Arterial ammonia and clinical risk factors for encephalopathy and intracranial hypertension in acute liver failure. Hepatology 2007; 46 : 1844–1852.
14. Leithead J A, et al. The systemic inflammatory response syndrome is predictive of renal dysfunction in patients with non-paracetamol-induced acute liver failure. Gut 2009; 58 : 443–449.
15. Munoz SJ, Stravitz RT, Gabriel DA. Coagulopathy of acute liver failure. Clin Liver Dis 2009; 13 : 95–107.
16. Hugenholtz GG, Porte R J, Lisman T. The platelet and platelet function testing in liver disease. Clin Liver Dis 2009; 13 : 11–20.
17. Vaquero J, Polson J, Chung C, et al. Infection and the progression of hepatic encephalopathy in acute liver failure. Gastroenterology 2003; 125 : 755–764.
18. Mazer M, Perrone J. Acetaminophen-induced nephrotoxicity: pathophysiology, clinical manifestations, and management. J Med Toxicol 2008; 4 : 2–6.
19. Makin A, Williams R. Acetaminophen-induced acute liver failure. In: Acute Liver Failure. First Edition. Lee WM, Williams R. (eds). Cambridge, UK: Cambridge University Press 1997; 32–42.
20. Enjalbert F, Rapior S, Nouguier-Soule J, et al. Treatment of amatoxin poisoning: 20 years retrospective analysis. Journal of Toxicology, Clinical Toxicology 2002; 6 : 715–757.
21. Tillmann HL, Hadem J, Leifeld L, et al. Safety and efficacy of lamivudine in patients with severe acute or fulminant hepatitis B, a multicenter experience. J Viral Hepat 2006; 13 : 256–263.
22. Lok AS, McMahon BJ. Chronic hepatitis B: update 2009. Hepatology 2009; 50 : 661–662.
23. Kessler WR, Cummings OW, Eckert G, et al. Fulminant hepatic failure as the initial presentation of acute autoimmune hepatitis. Clin Gastroenterol Hepatol 2004; 2 : 625–631.
24. Stravitz RS, Kramer AH, Davern T, et al. Intensive care of patients with acute liver failure: Recommendations of the US acute liver failure study group. Crit Care Med 2007; 35 : 2498–2508.
25. Walsh TS, Hopton P, Philips BJ, et al. The effect of N-acetylcystein on oxygen transport and uptake in patiens with fulminant hepatic failure. Crit Care Med 1998; 26 : 1200–1207.
26. Lee WM, Hynan LS, Rossaro L, el al. Intravenous N-acetylcysteine improves transplant-free survival in early stage non-acetaminophen acute liver silure. 2009; 137 : 856–864.
27. Bernal W, Auzinger G, Sizer E, Wendon J. Intensive care management of acute liver failure. Semin Liver Dis 2008; 28 : 188–200.
28. Shawcross DL, Davies NA, Mookerjee RP, et al. Worsening of cerebral hyperemia by the administrativ of terlipressin in acute liver failure with severe encephalopathy. Hepatology 2004; 39 : 471–475.
29. Mehta RL. Continuous renal replacement therapy in the critically ill patient. Kidney Int 2005; 67 : 781–795.
30. Vaquero J, Fontana RJ, Larson AM, et al. Complications and use of intracranial pressure monitoring in patients with acute liver failure and severe encephalopathy. Liver Transpl 2005; 11 : 1581–1589.
31. Murphy N, Auzinger G, Bernel W, et al. The effect of hypertonic sodium chloride on intracranial pressure in patients with acute liver failure. Hepatology 2004; 39 : 464–470.
32. Jalan R, Olde Damink SW, Deutz NE, et al. Moderate hypothermia prevents cerebral hyperemia and increase in intracranial pressure in patients undergoing liver transplantation for acute liver failure. Transplantation 2003; 75 : 2034–2039.
33. Clemmesen JO, Hansen BA, Larsen FS. Indomethacin normalizes intracranial pressure in acute liver failure: A twenty-three-year-old woman treated with indomethacin. Hepatology 1997; 26 : 1423–1425.
34. Plauth M, Cabre E, Campillo B, et al. Guidelines on Parenteral Nutrition: Hepatology. Clin Nutrition 2009; 28 : 436–444.
35. Pavese P, et al. FVIIa corrects the coagulopathy of fulminant hepatic failure but may be associated with thrombosis: a report of four cases. Can J Anaesth 2005; 52 : 26–29.
36. Canabal JM, Kramer D J. Management of sepsis in patients with liver failure. Curr Opin Crit Care 2008; 14 : 189–197.
37. McKenzie TJ, Lillegard JB, Nyberg SL. Artificial and bioartificial liver support. Semin Liver Dis 2008; 28 : 210–217.
38. Ironiemi H, et al. The effect of albumin dialysis on cytosine levels in acute liver silure and need for liver transplantation. Transpl Proc 2005; 37 : 1088–1090.
39. Rifai K, Ernst T, Kretschmer U, et al. Prometheus – new extracoporeal system for treatment of liver failure. J Hepatol 2003; 39 : 984–990.
40. Rifai K, Kribben A, Gerken G, et al. Extracorporeal liver support by fractionated plasma separation and adsorption (PROMETHEUS) in patiens with acute on chronic liver silure (HELIOS STUDY): A prospective randomized controlled multicenter study. J Hepatol 2010; 52: S3.
41. Rocen M, Kieslichova E, Merta D, et al. The effect of Prometheus device on laboratory markers of inflammation and tissue regeneration in acute liver failure management. Transpl Proc 2010; 42 : 3606 – 3611.
42. Ryska M, Kieslichová E, Pantoflíček T, et al. Bioeliminace v léčbě akutního selhání jater v experimentu na velkém laboratorním zvířeti. Česká a slovenská gastroenterologie a hepatologie 2006; 5 : 201–206.
43. O’Grady JG, Alexander GJ, Hayllar KM, et al. Early indicators of prognosis in fulminant hepatic failure. Gastroenterology 1989; 97 : 439–445.
44. McPhail MJW, Wendon J, Bernal W. Meta-analysis of performance of King’s College Hospital kriteria in prediction of outcome in non-paracetamol-induced acute liver failure. J Hepatol 2010 53 : 492–499.
45. Bernuau J, Goudeau A, Poynard T et al. Multivariate analysis of prognostic factors in fulmiant hepatitis B. Hepatology 1986; 6 : 648–651.
46. Bernal W, Donaldson N, Wyncoll D, et al. Blood lactate as an early predictor of outcome in paracetamol-induced acute liver failure: A cohort study. Lancet 2002; 359 : 558–563.
47. Shakil AO, Jones BC, Lee RG, et al. Prognostic Value of Abdominal CT scanning and Hepatic Histopathology in Patients with Acute Liver Failure. Dig Dis Sc 2000; 334–339.
48. Bernal W, Cross TJS, Auzinger G, et al. Outcome after wait-listing for emergency liver transplantation in acute liver failure: A single centre experience. J Hepatol 2009; 50 : 306–313.
49. Liou IW, Larson AM. Role of liver transplantation in acute liver failure. Semin Liver Dis 2009 28 : 201–209.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Katetrizační ablace fibrilace síní
- Hyperglykémie a její kontrola u dospělých pacientů v intenzivní péči
- Akutní selhání jater: současná doporučení
- IKEM – Institut klinické a experimentální medicíny – na prahu páté dekády úspěšné existence
- Plánované akce odborných složek ČLS JEP
- Specifika perioperační péče o pediatrické pacienty podstupující transplantaci jater
- Zemřelí dárci orgánů k transplantacím
- Imunohistochemická detekce glypicanu-3 zpřesňuje diagnózu hepatocelulárního karcinomu
- Everzní endarterektomie arterie carotis interna: hodnocení výsledků po změně operační techniky
- Přínos dlouhodobé pulzatilní mechanické srdeční podpory u multiorgánově selhávajících pacientů v terminálním srdečním selhání
- Léčba diabetu transplantací izolovaných Langerhansových ostrůvků
- IKEM – odborné, politické a další souvislosti vzniku a dosavadního vývoje
- Transplantace ledviny v IKEM
- Výsledky dlouhodobého sledování prvních 500 pacientů po transplantaci jater provedených v Institutu klinické a experimentální medicíny v Praze
- Stanovení obsahu jaterního tuku metodou 1H MR spektroskopie
- Molekulární diagnostika dědičných forem intrahepatální cholestázy a familiárních hyperbilirubinémií
- Transplantace jater u pacientů s trombózou v. portae
- Vliv chirurgických komplikací na funkci transplantované ledviny
-
Molecular Diagnostic Europe
Hannover, 4. až 7. října 2010 -
Konference Tabák a zdraví po jedenácté v Lékařském domě
Praha, 5. listopadu 2010 - Prof. MUDr. Václav Čepelák, DrSc. osmdesátníkem
- Spolek lékařů českých v Praze
-
Strouhal E, Vachala B, Vymazalová H.
Lékařství starých Egypťanů
I. staroegyptská chirurgie, Péče o ženu a dítě - CHARLES BRENTON HUGGINS
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Akutní selhání jater: současná doporučení
- Hyperglykémie a její kontrola u dospělých pacientů v intenzivní péči
- Prof. MUDr. Václav Čepelák, DrSc. osmdesátníkem
- Everzní endarterektomie arterie carotis interna: hodnocení výsledků po změně operační techniky
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




