-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Transplantace ledviny v IKEM
Kidney transplantation at the Institute for Clinical and Experimental Medicine
Background:
Kidney transplantation represents the method of choice of end stage renal disease.Methods and results:
The program of kidney transplantation was established in 1966 in our centre. In recent years, roughly 200 patients have undergone kidney transplantation annually, and 20–30 of them have received a graft from the living donor. Triple immunosuppressive regimen based on tacrolimus, MMF and steroids is given to majority of patients, in a case of high rejection risk; patients have received the induction protocols with polyclonal or monoclonal antilymphocyte globulins. Acute rejection is not a frequent finding in recent years and has occurred in 15% of cases in the first 3 months, the use of induction immunosuppression has decreased the rejection risk. Valgancyclovir has been used as prophylactic agent to prevent and treat cytomegalovirus infection. The usage of this strategy reduced the incidence of CMV infection below 10%. Kidney transplant recipients suffer from similar comorbidities as other renal patients in the long term, as cardiovascular complications, infections and malignancies. Anemia is a frequent complication in patients with graft dysfunction and erythropoesis stimulating agents have been used in its therapy. The median kidney graft survival is 8 years.Conclusions:
Kidney transplantation is associated with better long-term results when compared with dialysis therapy and thus this method should be offered to all of suitable end stage renal disease patients.Key words:
end stage renal disease, kidney transplantation, immunosuppression, complications.
Autoři: Ondřej Viklický; Janka Slatinská; Marcela Bürgelová; Štefan Vítko; Mariana Urbanová; Renáta Lažanská; Vladimír Hanzal; Štěpán Bandúr; Vladimír Teplan; Ivo Matl; Libor Janoušek; Eva Honsová; Monika Drastichová; Jan Malý
Působiště autorů: Institut klinické a experimentální medicíny Praha, Transplantační centrum, Klinika nefrologie
Vyšlo v časopise: Čas. Lék. čes. 2011; 150: 56-59
Kategorie: Původní práce
Souhrn
Východisko:
Transplantace ledviny představuje metodu volby léčby nezvratného selhání ledvin.Metody a výsledky:
Program transplantací ledvin byl v IKEM založen v roce 1966. V současné době v IKEM podstoupí transplantaci ledviny 200 nemocných ročně, z toho 20–30 obdrží orgán od žijícího dárce. Jako profylaxi rejekce je používána trojkombinace imunosupresiv založená na takrolimu, mykofenolát mofetilu a steroidech, v případě nemocných v riziku rejekce je používána indukční imunosuprese s antilymfocytárními polyklonálními nebo monoklonálními protilátkami. Akutní rejekce nepředstavuje již takový problém jako v minulosti, v prvních 3 měsících se vyskytuje u 15 % nemocných. Použití indukční imunosuprese výskyt rejekce signifikantně snižuje. Jako profylaxi cytomegalovirové infekce se u rizikových nemocných používá valganciklovir. Použití této profylaxe významně snížilo výskyt CMV infekce/nemoci u nemocných po transplantaci ledviny pod 10 %. V pozdním období po transplantaci trpí nemocní podobnými komplikacemi jako nemocní s chronickým selháním ledvin. Patří mezi ně kardiovaskulární komplikace, infekce a nádory. Anémie je častou komplikací u nemocných s dysfunkcí štěpu, která vyžaduje léčbu erytropoesu stimulujícími látkami. Střední doba funkce transplantované ledviny je 8 let.Závěry:
Oproti dialyzační léčbě je léčba transplantací ledviny spojena s lepšími dlouhodobými výsledky, a proto by měla být nabízena všem nemocným, kteří jsou tento výkon schopni podstoupit.Klíčová slova:
selhání ledviny, transplantace ledviny, imunosuprese, komplikace imunosuprese.Úvod
Transplantace ledviny představuje metodu volby léčby náhrady funkce ledvin. Je to proto, že je spojena s delším přežitím a lepší kvalitou života oproti nemocným léčených dialyzačními metodami (1). První úspěšná transplantace ledviny byla provedena v tehdejším Československu v roce 1966. Po pionýrských začátcích v sedmdesátých letech a pokusech o standardizaci metody v osmdesátých letech 20. století došlo se změnou politického systému k bouřlivému rozvoji programu orgánových transplantací. V současné době žije v České republice 3500 nemocných s funkční transplantovanou ledvinou, z nich více než 2000 je sledováno v IKEM (2). Tyto počty znamenají, že každý pátý pacient trpící nezvratným chronickým selháním ledvin v České republice je sledován v IKEM.
Transplantace ledviny je nabízena zdravější části populace nemocných léčených dialyzačními metodami. Zastoupení nemocných čekajících na transplantaci ze všech dialyzovaných činí v České republice 10 %, což není mnoho, protože v zahraničí je přístup nemocných k transplantaci vyšší (údaje kolísají od 15 do 20 %). Přitom průměrné přežití nemocných léčených dialyzačními metodami je 5 let, léčba dialýzou je spojena s horší kvalitou života a výskytem celé řady komorbidit (3). Na druhou stranu, transplantace ledviny znamená signifikantní prodloužení života nemocných. Transplantace ledviny má být nabízena všem nemocným, kteří jsou schopni tento výkon podstoupit a u kterých je možné dlouhodobě podávat imunosupresivní terapii. Proto jsou nemocní před zařazením do čekací listiny podrobeni podrobnému vyšetření s cílem eliminovat všechna rizika s transplantací ledviny spojená. Mezi tato vyšetření patří především screening kardiovaskulárních onemocnění, vyšetření funkce močového měchýře a mikce, vyšetření trombofilních stavů apod (4).
Mezi hlavní problémy, které řeší nefrologové pečující o nemocné po transplantaci ledviny, patří akutní rejekce a komorbidity, především infekce, kardiovaskulární komplikace a malignity. Cílem tohoto sdělení je na vlastním souboru nemocných ukázat výskyt, příčiny a způsoby řešení některých komplikací transplantací ledvin.
Akutní rejekce
Akutní rejekce představovala v minulosti hlavní komplikaci programu transplantací ledvin a byla odpovědná za většinu selhání funkce transplantovaných ledvin v prvním roce po transplantaci. Po zavedení cyklosporinu A v osmdesátých letech do imunosupresivních schémat došlo k signifikantnímu zlepšení jednoročních výsledků transplantací ledviny, převážně snížením výskytu závažných akutních rejekcí. Při používání indukční imunosuprese je výskyt akutních rejekcí u nemocných bez imunologického rizika do 15 % (5).
Nejčastější formou akutní rejekce je T-lymfocyty zprostředkovaná (celulární) rejekce, relativně vzácná je akutní protilátkami zprostředkovaná (humorální) rejekce, která se vyskytuje ve zhruba 5 % případů. Často se forma celulární a humorální rejekce kombinují. Nejčastěji jsou infiltrující T-lymfocyty pozorovatelné v intersticiu a tubulech, méně často v intimně arterií. Těžší formy této vaskulární rejekce představují vážnější prognózu i jinou léčebnou strategii.
Mezi rizikové faktory podílející se na vzniku akutní rejekce patří vysoké procento panel reaktivních (anti-HLA) protilátek, opožděný rozvoj funkce štěpu jako následek akutní tubulární nekrózy pro dlouhou dobu studené ischémie a horší kvalitu dárcovské ledviny, delší doba strávená na dialýze, výskyt předchozí rejekce. Diagnóza akutní rejekce by měla být vždy potvrzena histologicky. K tomuto účelu byla vytvořena banffská klasifikace histologických nálezů v transplantované ledvině (6).
Vlastní pozorování
Retrospektivně jsme po dobu 1 roku sledovali 204 konsekutivních pacientů, kteří podstoupili transplantaci ledviny od zemřelého dárce v období od 6/2007 do 10/2008 (tab. 1). Nemocní s PRA > 50 % byli léčeni indukcí s antithymocytárním globulinem (Thymoglobuline® – ATG) a kombinací imunosupresiv inhibitorů kalcineurinu (takrolimu nebo cyklosporinu A), mykofenolát mofetilu (MMF) s nízkou dávkou steroidů. Nemocní s PRA < 50 % byli léčeni stejnou kombinací, ale bez ATG. Akutní rejekce byla verifikována biopticky dle banffské klasifikace z roku 2005.
Tab. 1. Charakteristika nemocných s anamnézou rejekce 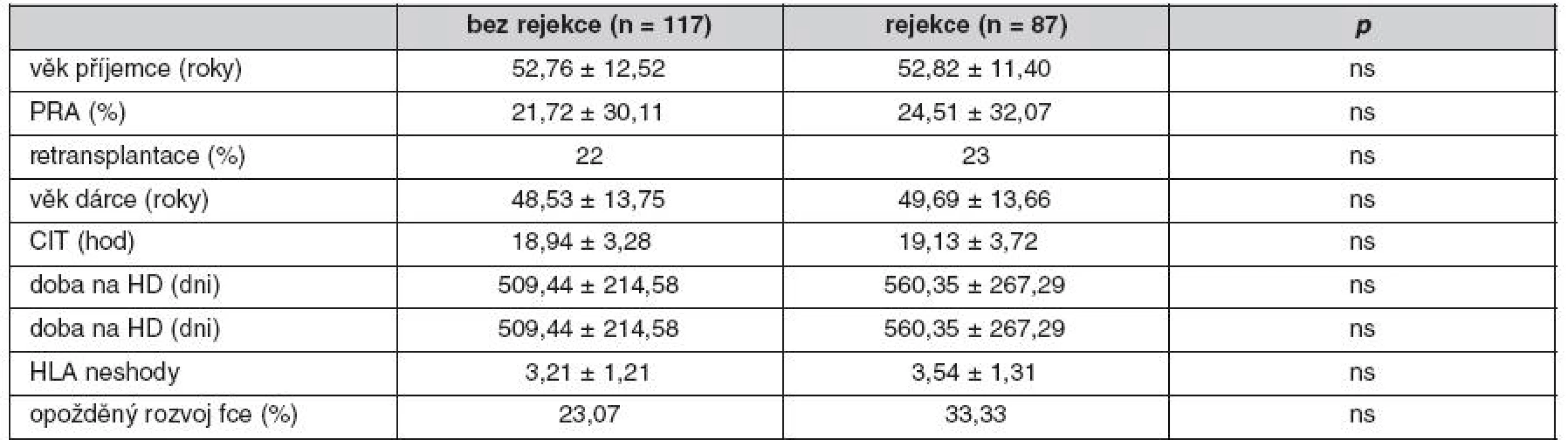
Pozn.: Mezi rejekce byli zařazeni nemocní s hraničními změnami v biopsiích. Incidence akutní rejekce ve sledovaném období činila 14,7 % (30/204). Nemocní s rejekcí Banff I a IIa byli léčeni steroidy, nemocní s rejekcí IIB a III pak antithymocytárním globulinem, z toho 3,44 % rejekcí bylo rezistentních k léčbě kortikoidy. Pokud jsme mezi rejekce zařadili i hraniční změny, byl výskyt nemocných léčených steroidy/ATG 42,65 % (87/204). Pozorovali jsme lepší renální funkci štěpů bez rejekce v 1., 2., 6. týdnu (p < 0,05), 3., 6. a 12. měsíci po transplantaci ledviny (p < 0,01) (tab. 2). Epizoda akutní rejekce neměla vliv na roční přežití štěpů. Ve sledovaném souboru jsme nenalezli rizikové faktory rejekce. Pozorovali jsme nižší incidenci AR u vysoce rizikových pacientů s indukcí s ATG (p < 0,05).
Tab. 2. Funkce štěpu u nemocných s rejekcí během 3 měsíců 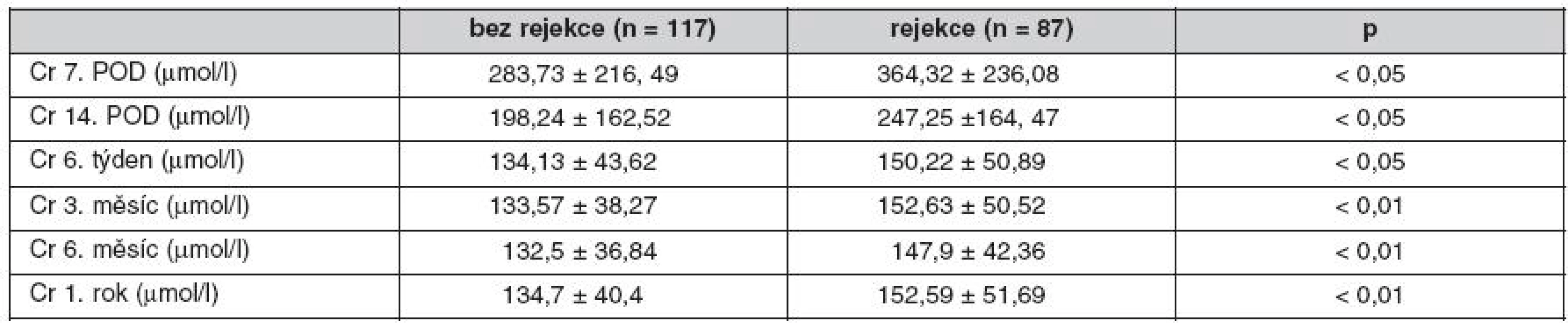
V multivariantní analýze podskupiny nemocných bez indukce ATG (n = 161) byly identifikovány nezávislé prediktory rejekce: redukce dávky mykofenolát mofetilu (OR 1,74, 95% CI 1,40–3,79), opožděný rozvoj funkce štěpu (OR 2,51, 95% CI 1,20–5,26) a více než čtyři neshody v HLA (OR 2,745, 95% CI 1,16–6,51). Rizikovými faktory opožděného rozvoje funkce štěpu byla transplantace ledviny od tzv. marginálního dárce (OR 2,56, 95% CI 1,01 – 6,51), vyšší věk příjemce (OR 1,03, 95% CI 1,02–1,07) a vyšší PRA (OR 1,04, 95% CI 1,02 – 1,07).
Cytomegalovirová infekce
V principu existují tři možnosti, jak se nemocný po transplantaci ledviny může setkat s infekcí tímto herpetickým virem:
- Primární infekce CMV proběhne většinou ještě v mládí a zanechává IgG protilátky. Sedmdesát až 80 % běžné populace se s infekcí setkává a je IgG CMV pozitivních. CMV po prodělání primoinfekce zůstává v organismu dlouhodobě latentní. U seronegativních příjemců se po implantaci orgánu od seropozitivního dárce ve většině případů vyskytne CMV primoinfekce.
- Reaktivace latentního viru při imunosupresivní terapii znamená oslabení získané specifické imunity proti cytomegaloviru. Nejčastěji k ní dochází u seropozitivních nemocných, kteří jsou léčeni indukční imunosupresí.
- Superinfekcí novým kmenem CMV u jinak seropozitivních nemocných (7).
Virová replikace může být zcela asymptomatická. V případě symptomatické infekce mluvíme o CMV nemoci, která může být CMV syndromem či invazivní CMV nemocí. CMV syndrom je charakteristický horečkou, únavou, leukopenií s nebo bez trombocytopenie a se zvýšeným titrem protilátek. Invazivní forma CMV nemoci je charakteristická invazí do tkání, tzn., že může být přítomna pneumonie, hepatitida, GIT postižení (ezofagitida, kolitida, enteritida) či postižení ledvinného štěpu.
Kromě výše uvedených přímých efektů je chronická infekce CMV spojena s imunomodulací a dysregulací T-buněk a může vyvrcholit jinou oportunní infekcí, poškozením štěpu rejekcí, lymfoproliferativmí nemocí (PTLD), kardiovaskulárními komplikacemi apod. Dlouhodobá infekce cytomegalovirem je spojena se snížením přežití transplantovaných ledvin (8).
Protože primoinfekce i sekundární infekce CMV představují významná rizika pro nemocného i pro štěp, je všem seronegativním nemocným, kteří obdrží ledvinu od seropozitivního dárce, podávána profylaxe gancyklovirem nebo valgancyklovirem. U této rizikové skupiny tato profylaxe trvá 6 měsíců (9). V případě profylaxe sekundární infekce u nemocných s indukční imunosupresí je tato léčba podávána kratší dobu (6–12 týdnů). Kromě paušální profylaxe CMV nemoci je možné použít tzv. preemptivní strategii léčby, tzn. podávat léčbu jenom těm nemocným, kteří mají prokázánu replikaci viru před tím, než se vyvine CMV nemoc. Tento systém ale předpokládá finančně náročné časté monitorování replikace viru.
Vlastní pozorování
V letech 2005–2008 jsme vyšetřili 611 nemocných, kteří podstoupili transplantaci ledviny v našem centru. CMV sérologický profil této skupiny je uveden v tabulce 3. Vyplývá z něj, že 13,7 % nemocných mělo vysoké riziko CMV nemoci, protože byli CMV seronegativní a byl jim transplantován štěp od CMV pozitivního dárce. Všichni tito nemocní byli profylakticky léčeni valgancyklovirem podle úrovně renální funkce 450–900 mg denně po dobu 100 dní. V kohortě 611 nemocných při uplatnění systému CMV profylaxe (riziková skupina D+/R-, R+ za předpokladu profylaxe nebo léčby antilymfocytárními globuliny) se vyskytla CMV infekce a nemoc u 57 (9,3 %) nemocných, tkáňově invazivní CMV nemoc pak u 32 nemocných (5,2 %). Potvrdili jsme také pozorování ostatních autorů o vyšším výskytu rejekcí u nemocných s CMV infekcí (obr. 1).
Tab. 3. CMV sérologický status dárce/příjemce v české populaci 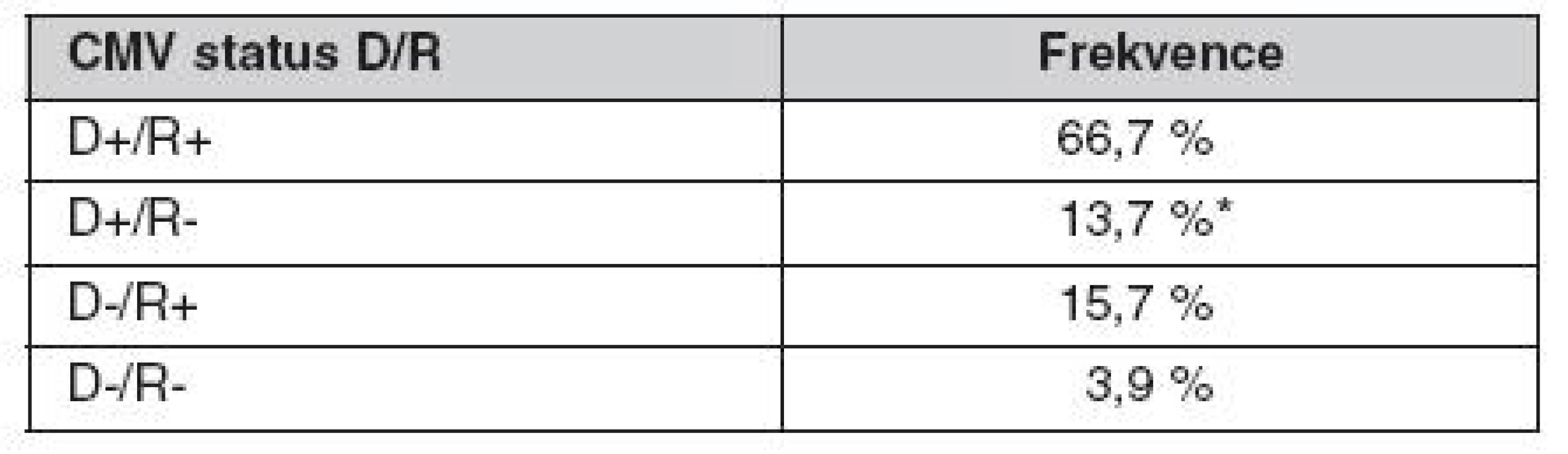
* riziková skupina vyžadující profylaxi CMV – cytomegalovirus Obr. 1. Výskyt akutních rejekcí v kohortě 611 nemocných Nemocní, kteří vyvinuli CMV infekci nebo nemoc, prodělali rovněž akutní rejekci transplantované ledviny (Kaplan-Meier, p < 0,05). 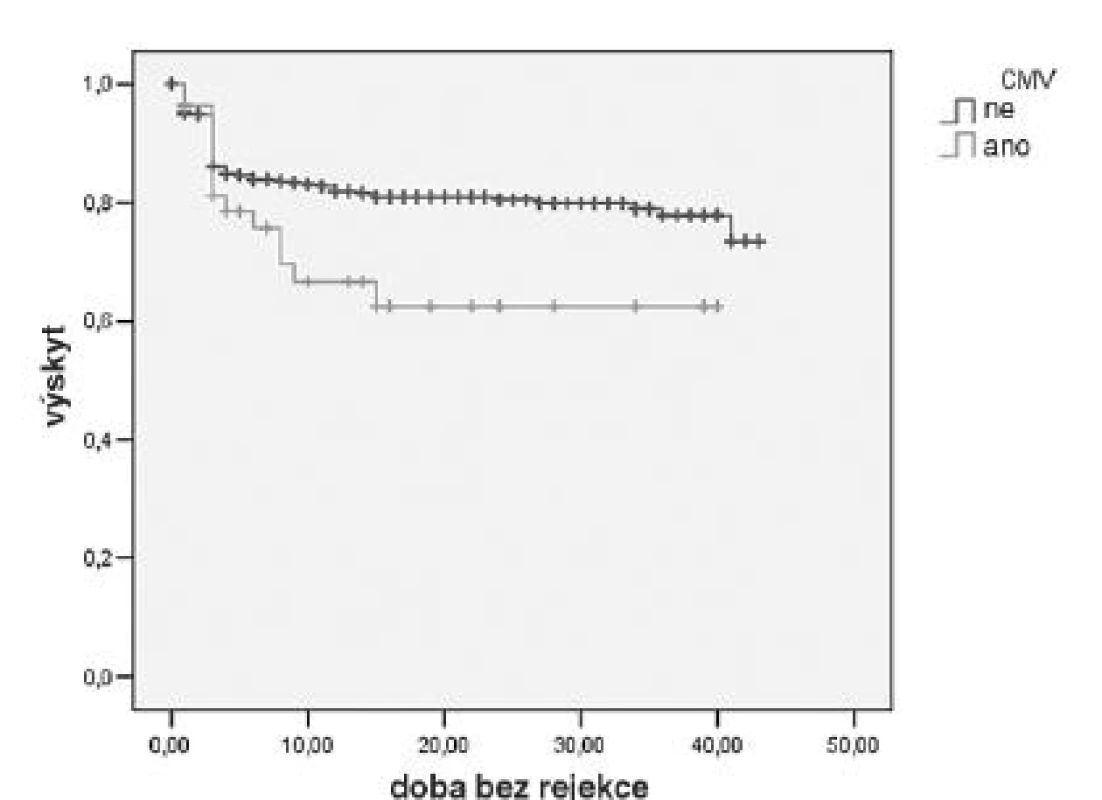
Anémie po transplantaci ledviny
Anémie je běžnou komplikací nemocných v nezvratném selhání funkce ledvin. Také po transplantaci ledviny představuje anémie relativně častou komplikaci (10). Má řadu příčin. Na prvním místě je v literatuře uváděna dysfunkce štěpu, imunosupresivní léčba, infekce a krevní ztráty. Anémie je spojena s rizikem ztráty štěpu i s úmrtím nemocných (11). Na druhou stranu je anémie adekvátně léčena pouze u 1/3 nemocných (12). Zajímalo nás proto, jaký je výskyt anémie u našich nemocných po transplantaci ledviny, jaké jsou její příčiny a jak je léčena.
Vlastní pozorování
Z velké skupiny 1523 pacientů po transplantaci ledviny vyšetřených v roce 2008 v IKEM jsme pomocí programu Zlatokop identifikovali nemocné splňující kritéria závažné anémie Hb < 100 g/l (147 nemocných) a porovnávali je s kontrolní skupinou, která byla definována stejnou dobou sledování a stejnou demografií. Dle očekávání jsme zjistili, že nemocní s anémií mají výrazně horší funkci štěpu (obr. 2). Dále jsme zjistili, že anémií trpěli častěji nemocní, kterým byla transplantována ledvina od staršího dárce, trpěli dysfunkcí štěpu a rovněž nemocní užívající takrolimus, sirolimus nebo azathioprin (tab. 4) V multivariantní analýze jsme potvrdili roli sirolimu a dysfunkce štěpu na vznik potransplantační anémie. Padesát procent nemocných s anémií bylo v době sledování léčeno erytropoézu stimulujícími látkami.
Obr. 2. Výskyt anémie u nemocných po transplantaci ledviny podle úrovně renální funkce 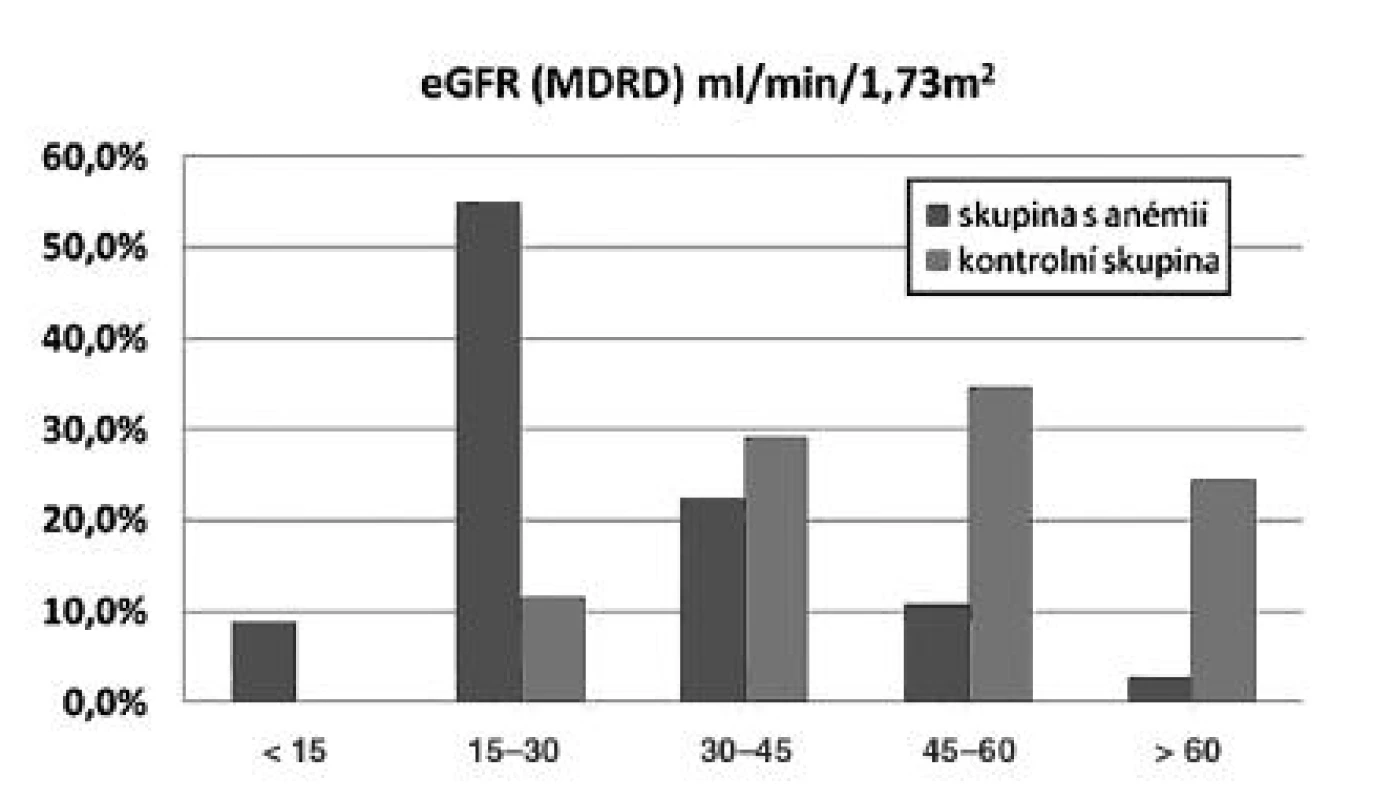
Pozn.: Anémie po transplantaci ledviny závisí především na funkci štěpu. Nejčastější je u nemocných s GFR < 45 ml/min. Tab. 4. Charakteristika nemocných s anémií po transplantaci ledviny 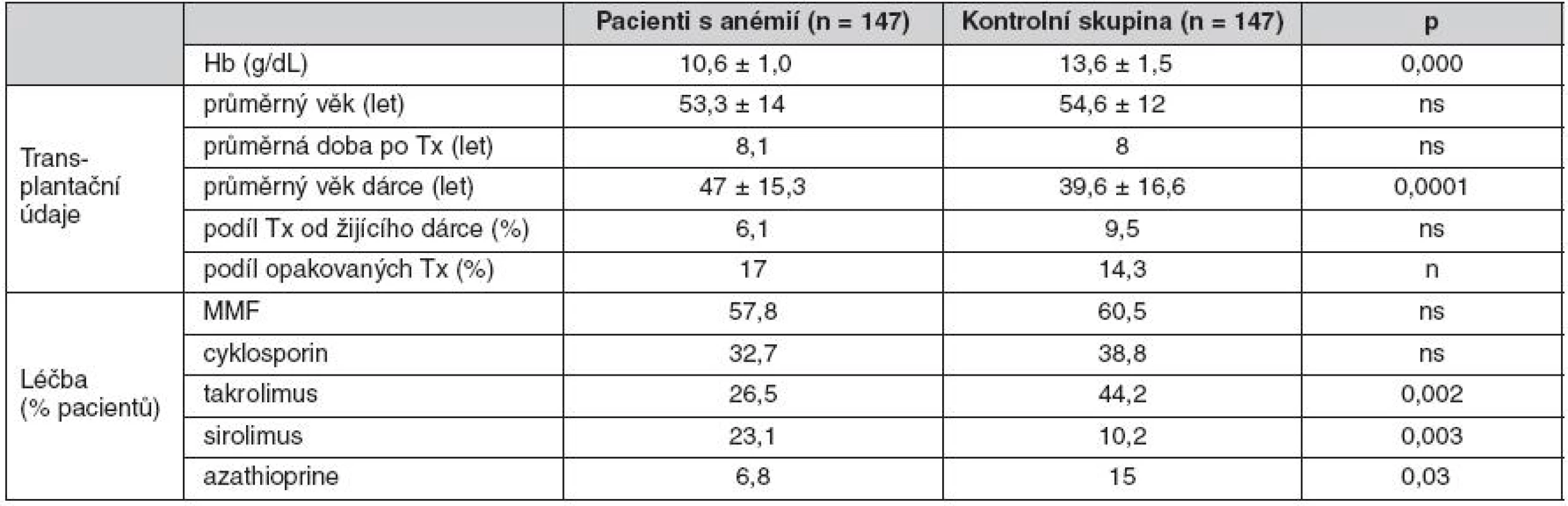
Anémie se po transplantaci ledviny vyskytuje u 10 % nemocných. Její adekvátní léčba může příznivě ovlivnit dlouhodobé výsledky.
Závěr
Úspěšná transplantace ledviny představuje pro nemocné šanci na výrazné prodloužení a zkvalitnění života. Transplantace ledviny představuje model chronických onemocnění ledvin, protože většina nemocných je ve stadiu 3T (GFR 0,99–0,50 ml/s). Proto je třeba nemocným po transplantaci ledviny věnovat v ambulancích stejnou pozornost jako ostatním nefrologickým nemocným.
Zkratky
- ATG – antithymocytární globulin
- CMV – cytomegalovirus
- GFR – glomerulární filtrace
- Hb – hemoglobin
- HLA – human leukocyte antigen
- MMF – mykofenolát mofetilu
- PTLD – lymfoproliferativmí nemoc
Podpořeno výzkumným záměrem MZd ČR MZO 00023001.
Adresa pro korespondenci:
prof. MUDr. Ondřej Viklický, CSc.
Klinika nefrologie TC IKEM
Vídeňská 1958, 142 00 Praha 4
e-mail: ondrej.viklicky@ikem.cz
Zdroje
1. Meier-Kriesche HU, Schold JD, Srinivas TR, Reed A, Kaplan B. Kidney transplantation halts cardiovascular disease progression in patients with end-stage renal disease. Am J Transplant 2004; 4(10): 1662–1668.
2. http://www.nefrol.cz
3. Oniscu GC, Brown H, Forsythe JL. Impact of cadaveric renal transplantation on survival in patients listed for transplantation. J Am Soc Nephrol 2005; 16(6): 1859–1865.
4. Danovitch GM, Hariharan S, Pirsch JD, Rush D, Roth D, Ramos E, Starling RC, Cangro C, Weir MR. Clinical Practice Guidelines Committee of the American Society of Transplantation. Management of the waiting list for cadaveric kidney transplants: report of a survey and recommendations by the Clinical Practice Guidelines Committee of the American Society of Transplantation. J Am Soc Nephrol 2002; 13(2): 528–535.
5. Womer KL, Kaplan B. Recent developments in kidney transplantation – a critical assessment. Am J Transplant 2009; 9(6): 1265–1271.
6. Solez K, Axelsen RA, Benediktsson H, Burdick JF, Cohen AH, Colvin RB, Croker BP, Droz D, Dunnill MS, Halloran PF, et al. International standardization of criteria for the histologic diagnosis of renal allograft rejection: the Banff working classification of kidney transplant pathology. Kidney Int 1993; 44(2): 411–422.
7. Rubin RH. Importance of CMV in the transplant population. Transpl Infect Dis 1999; 1 (Suppl 1): 3–7.
8. Sagedal S, Hartmann A, Nordal KP, Osnes K, Leivestad T, Foss A, Degré M, Fauchald P, Rollag H. Impact of early cytomegalovirus infection and disease on long-term recipient and kidney graft survival. Kidney Int 2004; 66(1): 329–337.
9. Humar A, Lebranchu Y, Vincenti F, Blumberg EA, Punch JD, Limaye AP, Abramowicz D, Jardine AG, Voulgari AT, Ives J, Hauser IA, Peeters P. The efficacy and safety of 200 days valganciclovir cytomegalovirus prophylaxis in high-risk kidney transplant recipients. Am J Transplant 2010; 10(5): 1228–1237.
10. Vanrenterghem Y, Ponticelli C, Morales JM, Abramowicz D, Baboolal K, Eklund B, Kliem V, Legendre C, Morais Sarmento AL, Vincenti F. Prevalence and management of anemia in renal transplant recipients: a European survey. Am J Transplant 2003; 3(7): 835–845.
11. Molnar MZ, Czira M, Ambrus C, Szeifert L, Szentkiralyi A, Beko G, Rosivall L, Remport A, Novak M, Mucsi I. Anemia is associated with mortality in kidney-transplanted patients—a prospective cohort study. Am J Transplant 2007; 7(4): 818–824.
12. Kamar N, Rostaing L. Negative impact of one-year anemia on long-term patient and graft survival in kidney transplant patients receiving calcineurin inhibitors and mycophenolate mofetil. Transplantation 2008; 85(8): 1120–1124.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Katetrizační ablace fibrilace síní
- Hyperglykémie a její kontrola u dospělých pacientů v intenzivní péči
- Akutní selhání jater: současná doporučení
- IKEM – Institut klinické a experimentální medicíny – na prahu páté dekády úspěšné existence
- Plánované akce odborných složek ČLS JEP
- Specifika perioperační péče o pediatrické pacienty podstupující transplantaci jater
- Zemřelí dárci orgánů k transplantacím
- Imunohistochemická detekce glypicanu-3 zpřesňuje diagnózu hepatocelulárního karcinomu
- Everzní endarterektomie arterie carotis interna: hodnocení výsledků po změně operační techniky
- Přínos dlouhodobé pulzatilní mechanické srdeční podpory u multiorgánově selhávajících pacientů v terminálním srdečním selhání
- Léčba diabetu transplantací izolovaných Langerhansových ostrůvků
- IKEM – odborné, politické a další souvislosti vzniku a dosavadního vývoje
- Transplantace ledviny v IKEM
- Výsledky dlouhodobého sledování prvních 500 pacientů po transplantaci jater provedených v Institutu klinické a experimentální medicíny v Praze
- Stanovení obsahu jaterního tuku metodou 1H MR spektroskopie
- Molekulární diagnostika dědičných forem intrahepatální cholestázy a familiárních hyperbilirubinémií
- Transplantace jater u pacientů s trombózou v. portae
- Vliv chirurgických komplikací na funkci transplantované ledviny
-
Molecular Diagnostic Europe
Hannover, 4. až 7. října 2010 -
Konference Tabák a zdraví po jedenácté v Lékařském domě
Praha, 5. listopadu 2010 - Prof. MUDr. Václav Čepelák, DrSc. osmdesátníkem
- Spolek lékařů českých v Praze
-
Strouhal E, Vachala B, Vymazalová H.
Lékařství starých Egypťanů
I. staroegyptská chirurgie, Péče o ženu a dítě - CHARLES BRENTON HUGGINS
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Akutní selhání jater: současná doporučení
- Hyperglykémie a její kontrola u dospělých pacientů v intenzivní péči
- Prof. MUDr. Václav Čepelák, DrSc. osmdesátníkem
- Everzní endarterektomie arterie carotis interna: hodnocení výsledků po změně operační techniky
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



