-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Cirkulující nádorové buňky a prognóza karcinomu prostaty
Circulating tumor cells and prostate cancer prognosis
Prostate cancer (PC) is the most common malignant disease in men. Prognosis of patients with metastatic PC is generally unfavourable; however there are significant differences in survival at this stage of the disease. The definition of prognosis is essential for the selection of therapy, respecting an individual risk. In recent years, the association between circulating tumor cells (CTC) detection and response to PC treatment has been widely investigated. Detection of CTC is based on a metastatic process theory and uses well-known tumor-specific antigens on the cell surface. Individual methods assess CTC with different sensitivity and are not yet efficient at the localised PC stage. Only the method of immunomagnetic separation and semi-automatic visualisation (CellSearchTM) has been validated and approved for the use in the PC management. Assessment of the CTC count directly correlates with the prognosis of patients with castration-resistant PC. Change in the CTC count during the therapy also considerably improves risk estimation and represents a marker of overall survival. New methods of CTC cultivation and gene profiling may contribute to individualisation of the treatment similarly to breast cancer. The authors present a review article about theory, methods of detection and clinical use of CTC in castration-resistant PC.
Keywords:
prostate cancer – circulating tumor cells – prognostic parameters – biomarker
Autoři: Otakar Čapoun 1; Viktor Soukup 1; Veronika Mikulová 2; Markéta Jančíková 2; Hana Honová 3; Katarína Kološtová 4; Tomáš Zima 2; Tomáš Hanuš 1
Působiště autorů: Univerzita Karlova v Praze, 1. lékařská fakulta a VFN, Urologická klinika 1; Univerzita Karlova v Praze, 1. lékařská fakulta a VFN, Ústav lékařské biochemie a laboratorní diagnostiky, Laboratoř klinické imunologie a alergologie 2; Univerzita Karlova v Praze, 1. lékařská fakulta a VFN, Onkologická klinika 3; Univerzita Karlova v Praze 3. lékařská fakulta, Oddělení nádorové biologie 4
Vyšlo v časopise: Čas. Lék. čes. 2014; 152: 72-77
Kategorie: Přehledový článek
Souhrn
Karcinom prostaty (KP) je nejčastější nádorové onemocnění u mužů. Prognóza pacientů s metastatickým onemocněním je nepříznivá, ačkoliv v tomto stadiu existují velké rozdíly v kvalitě života a době přežívání. Definice prognózy je nezbytná pro volbu léčebného postupu, který respektuje individuální riziko progrese onemocnění. Mezi základní prognostické parametry u metastatického onemocnění patří Gleasonovo skóre nádoru, hladina prostatického specifického antigenu (PSA), výkonnostní stav a další laboratorní markery. V posledních letech se v predikci odpovědi na protinádorovou léčbu uplatňuje detekce cirkulujících nádorových buněk (CTC), které jsou nezbytnou součástí metastatického procesu. Stanovení CTC využívá znalostí nádorově specifických antigenů na povrchu buněk. Jednotlivé metody stanovují CTC s různou citlivostí a zatím nejsou využitelné u lokalizovaného stadia KP. Pouze metoda imunomagnetické separace a semiautomatické vizualizace (CellSearchTM) byla validována a schválena FDA pro použití v diagnostice a léčbě metastatického KP. Stanovení počtu CTC přímo koreluje s prognózou pacientů s kastračně rezistentním KP a je dynamičtějším markerem celkového přežití než hladina PSA. Změna v hodnotách CTC v průběhu léčby také výrazně zpřesňuje odhad rizika úmrtí. Nové postupy kultivace a genového profilování CTC mohou přispět k individualizaci léčby podobně jako u karcinomu prsu. Autoři předkládají přehledné informace o teorii, metodách detekce a klinickém využití CTC u kastračně rezistentního KP.
Klíčová slova:
karcinom prostaty – cirkulující nádorové buňky – prognostické parametry – biomarkerÚVOD
Karcinom prostaty (KP) je nejčastějším nádorovým onemocněním u mužů a po karcinomu plic druhou nejčastější příčinou úmrtí z onkologických diagnóz (1). V rámci diagnostiky a sledování onemocnění se nejčastěji využívá stanovení hladiny prostatického specifického antigenu (PSA), vyšetření per rektum a v indikovaných případech také zobrazovací metody (počítačová tomografie, magnetická rezonance a scintigrafie). Podle dat z Národního onkologického registru dosáhla standardizovaná incidence KP v roce 2010 hodnoty 131/100 000 mužů, což představuje více než dvojnásobný nárůst za posledních 10 let. Zajímavý je fakt, že od počátku nového tisíciletí došlo k zastavení nárůstu mortality, která se nyní pohybuje kolem 28/100 000 mužů (obr. 1). Podle odhadů Institutu biostatiky a analýz Masarykovy univerzity v Brně bude v roce 2013 nově diagnostikováno s KP přibližně 8340 mužů, z toho více než 1000 (12,2 %) s primárně metastatickým postižením (2).
Obr. 1. Vývoj incidence a mortality karcinomu prostaty v České republice (2) 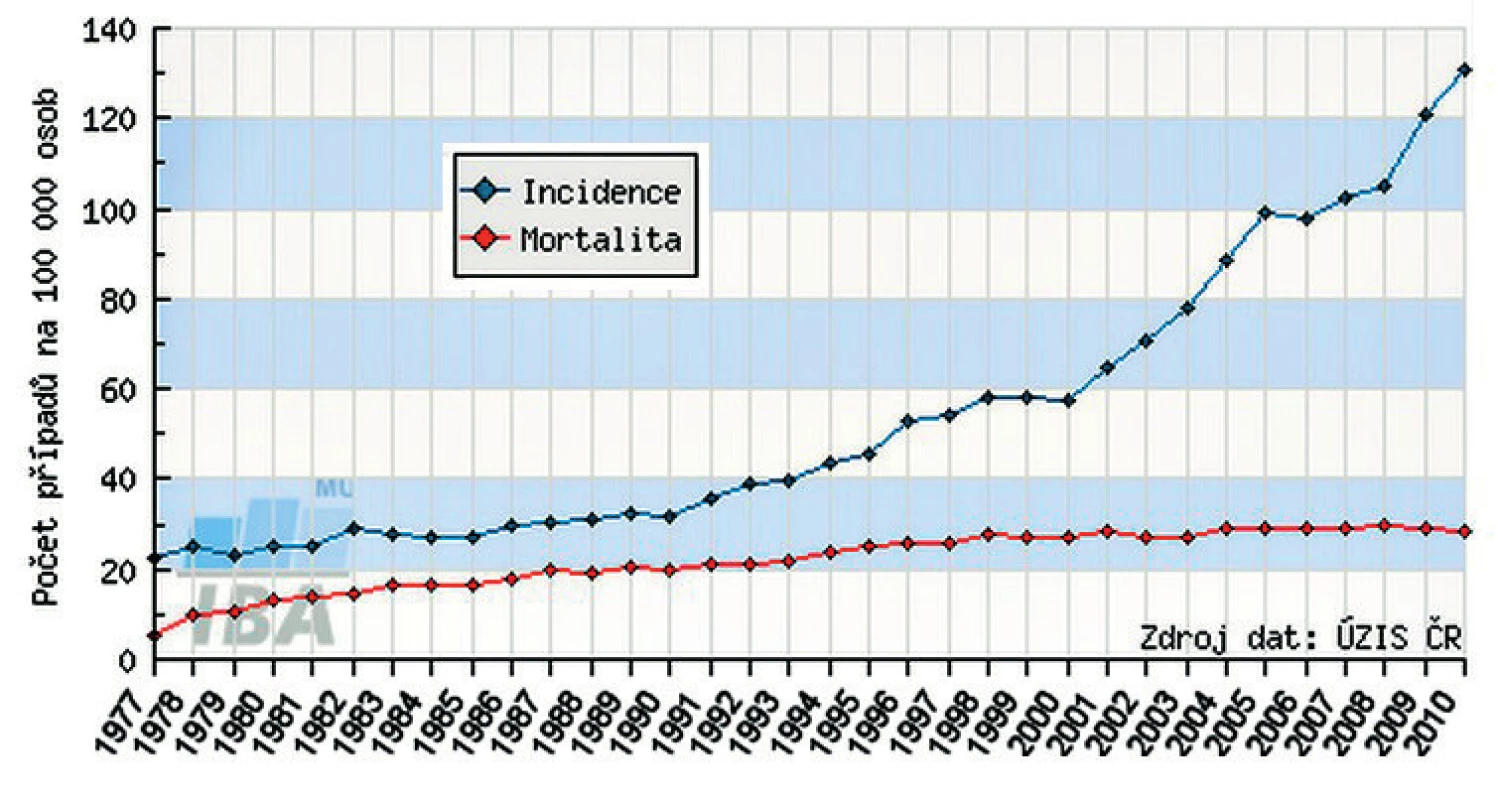
K posunu klinických stadií v posledních desetiletích došlo především na základě rozšíření PSA testování. Navzdory screeningu, rozvoji operačních metod a radioterapeutických protokolů dochází po radikální léčbě k relapsu onemocnění až u poloviny pacientů (3). Využití nových vyšetřovacích metod u KP sleduje několik cílů. V první řadě se jedná o zvýšení přesnosti PSA v předpovědi pozitivní biopsie prostaty. Další úroveň zahrnuje odhad patologické klasifikace po radikální prostatektomii (RP) a biochemického relapsu po radikální léčbě. Konečně nejvyšší zájem je věnován odhadu prognózy pacientů s primárně metastatickým KP nebo kastračně rezistentním KP (castration-resistant prostate cancer, CRPC). Jedním z nových biomarkerů, který je testován v řadě klinických studií, jsou cirkulující nádorové buňky (circulating tumor cells, CTC) v periferní krvi pacientů. Tento přehledový článek se věnuje teorii vzniku CTC, různým metodám detekce CTC a jejich klinickému využití.
TEORIE CIRKULUJÍCÍCH NÁDOROVÝCH BUNĚK
První dokumentovaná zmínka o nádorových buňkách v periferní krvi pochází z roku 1869, kdy australský lékař Thomas Ashworth vyslovil hypotézu, že buňky v krvi identické s buňkami primárního tumoru mohou souviset s metastatickým rozsevem u pacientů. Porovnal morfologii CTC u různých nádorů a uzavřel, že „pokud (CTC) pochází z existující nádorové masy, musely projít velkou částí oběhového systému, než dorazily do v. saphena zdravé končetiny“ (4). Patogeneze metastatického procesu zahrnuje několik kroků, které jsou ovlivněny jednak vlastnostmi nádorových buněk a jednak imunitní odpovědí organismu. V roce 1889 definoval anglický chirurg Stephen Paget interakci hostitel vs. nádorové buňky. Na základě pitevních výsledků více než 700 žen s metastatickým karcinomem prsu zpochybnil původní Virchowovu teorii embolizace částí nádorů, která měla být odpovědná za vznik metastáz. U pacientek totiž byly ve vyšší míře infiltrovány orgány, které mají relativně slabší krevní zásobení (skelet, vaječníky), zatímco například postižení sleziny bylo velmi vzácné. Paget tak přichází s teorií „seed and soil“ a přirovnal proces metastazování k rozsevu semen rostlin, který také probíhá všemi směry, ale nová rostlina vyroste pouze na příhodné půdě (5). V novém tisíciletí je tato teorie stále široce přijímána, ačkoliv termín „seed“ byl nahrazen progenitorovou nebo kmenovou buňkou a „soil“ je definováno jako stroma nebo orgánové mikroprostředí. V současnosti se uvažuje také o expresi tzv. „homing factors“ u CTC a v místě vzniku metastáz, které mohou předurčovat směrování CTC do jednotlivých metastatických lokací (6).
Po mnoha letech výzkumu je tak jisté, že proces metastazování je zahájen uvolněním subpopulace buněk primárního tumoru do krevního nebo lymfatického řečiště a migrací těchto buněk do tkání (obr. 2). Nádorové buňky podstupují změny známé jako epiteliálně mesenchymální transformace (EMT), umožňující přežití buněk blokováním apoptotického procesu a odpovědi na reakci imunitního systému (7). Koncept EMT vychází z in vitro studií, které zkoumaly embryonální vývoj, včetně změn fenotypu a chování buněk při invaginaci dovnitř embrya a tvorbě mesodermu. Pod vlivem různých růstových faktorů, cytokinů, proangiogenních a transkripčních látek dochází ke ztrátě vlastností epiteliálních buněk, tj. adhezivity a bazo-apikální polarizace. Na molekulární úrovni je nejdůležitějším krokem ztráta transmembránového glykoproteinu E-cadherinu. Současně buňka získává schopnost migrace přes bazální membránu a vstupu do krevního řečiště (8).
Obr. 2. Sekvenční proces vzniku nádorových metastáz. Metastatický proces probíhá v sekvenčních, propojených a selektivních úrovních s určitými stochastickými rysy. Výsledek každého kroku je ovlivněn interakcí buněčných populací a homeostatických faktorů. Každá úroveň procesu je potenciálně limitující pro rozvoj metastáz, protože nádorová buňka může nedokončením jednoho kroku zablokovat celý proces vzniku nového ložiska. Proto je vznik klinicky relevantních metastáz podmíněn přežitím a růstem vybraných subpopulací buněk v primárním tumoru (převzato se svolením z Talmadge et al. (7)) 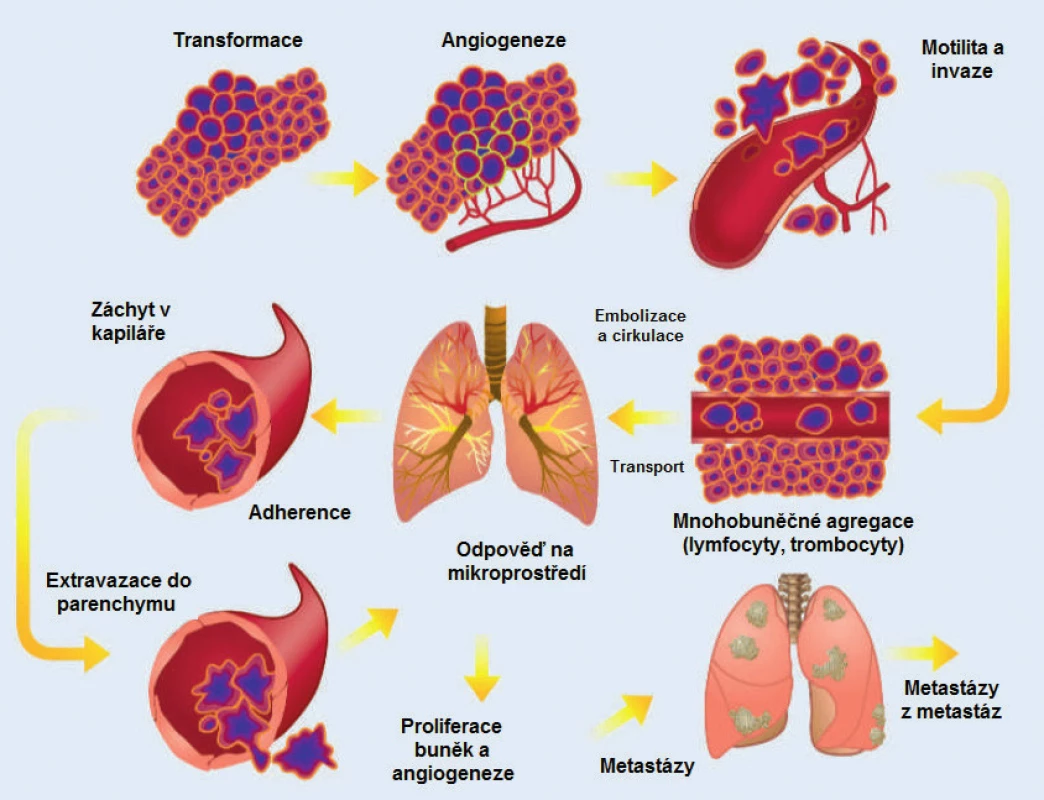
METODY DETEKCE CIRKULUJÍCÍCH NÁDOROVÝCH BUNĚK
Přítomnost CTC v periferní krvi je velmi vzácná, v současnosti se odhaduje v poměru jedna nádorová buňka na jednu miliardu dalších buněk s jádrem. Detekce CTC může být provedena několika různými metodami, které vždy začínají odběrem a zpracováním nesrážlivé periferní krve. Izolace CTC probíhá většinou pomocí imunomagnetické separace, která využívá vazby monoklonálních protilátek konjugovaných s ferromagnetickými částicemi na specifické antigeny na povrchu nádorových buněk. V magnetickém poli jsou tyto buňky poté odděleny od ostatních krevních elementů. Po této fázi se jednotlivé metody rozcházejí. Existuje velké množství různých postupů, které jsou shrnuty v tabulce 1. Největšího rozšíření doznala a povolení amerického úřadu Food and Drug Administration (FDA) získala metoda CellSearchTM společnosti Veridex LLC. Esej obohacuje CTC na základě vazby protilátky proti EpCAM (epithelial cell adhesion molecule) konjugované k magnetické kuličce. Buňky jsou dále klasifikovány jako CTC pomocí barvení cytokeratinu (CK-6, 8 a 18), zobrazení jádra diamidinofenylindolem (DAPI) a vyloučení leukocytů (barvení CD45). Buňky jsou v magnetické kazetě rozvrstveny, aby nedocházelo k jejich překrývání. Automatický systém CellTracks Analyzer® poté provede sken kazety, identifikuje možné nádorové buňky a obrázky nabídne laboratornímu technikovi (event. patologovi) ke konečné revizi na základě přísných morfologických kritérií. Výsledek je poskytnut jako počet CTC v 7,5 ml plné krve. Buňky u pacientů s CRPC detekované touto metodou mají řadu charakteristických znaků, jedná se hlavně o expresi PSA, alfa-metylacyl-CoA racemázy (AMACR) a další specifické genomické abnormality, především nárůst kopií genů pro androgenní receptor, deleci PTEN a fúzi TMPRSS2. Úskalím metody je fakt, že buňky zobrazené v kazetě představují pouze asi 1–10 % všech CTC (9). CellSearchTM totiž nedokáže identifikovat buněčné fragmenty ani bezjaderné nebo nekrotické buňky. Některé CTC navíc neexprimují EpCAM molekulu, a nejsou tak vychytávány. Významným problémem může být chyba v hodnocení, neboť ve sporných případech je označení CTC závislé na úsudku operátora (obr. 3). V současnosti se nicméně jedná o nejčastěji používanou metodu, která se díky své relativní jednoduchosti a semiautomatickému postupu stala rutinní součástí řady klinických studií u pacientů s CRPC.
Tab. 1. Metody detekce cirkulujících nádorových buněk (upraveno podle Danila et al. (9) a Mikulová et al. (19)) 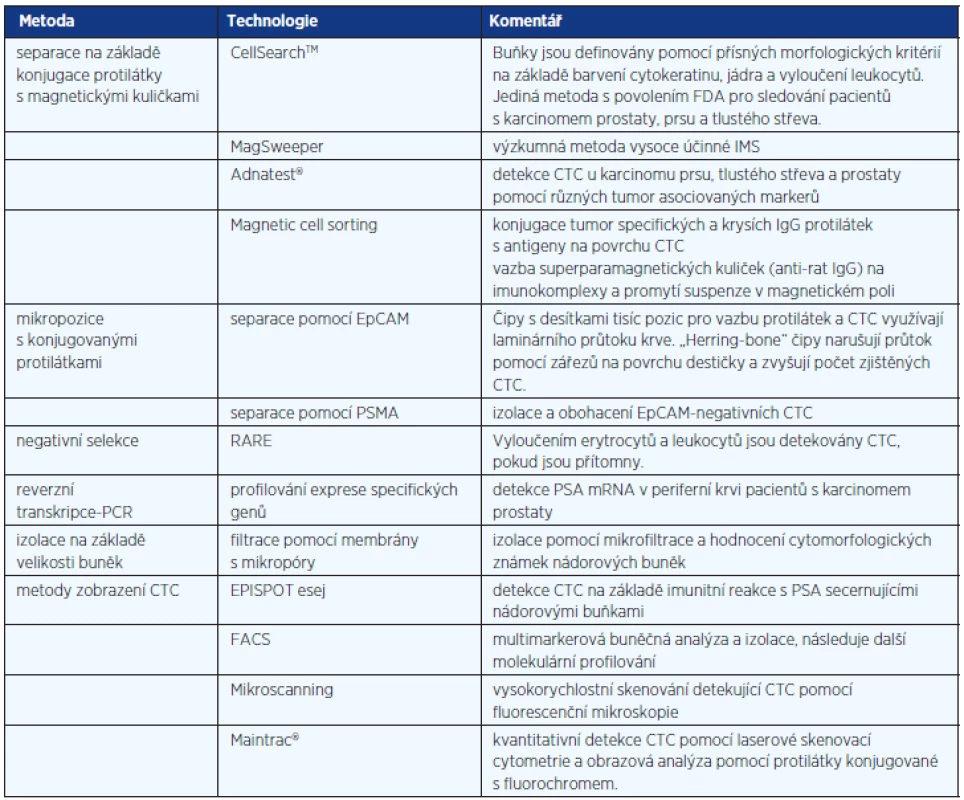
EpCAM – epithelial cell adhesion molecule, FDA – Food and Drug Administration, PSA – prostatický specifický antigen, PSMA – prostatický specifický membránový antigen, CTC – cirkulující nádorové buňky (circulating tumor cells), RARE – RosetteSep Applied Imaging Rare Event, mRNA – messenger ribonukleová kyselina, FACS – fluorescence-activated cell sorting, IMS – imunomagnetická separace Obr. 3. Zobrazení možných cirkulujících nádorových buněk pomocí semiautomatického systému CellTracks Analyzer II. Jasně pozitivní jsou č. 1–10 a 13–17, jasně negativní č. 20–24. U zbylých objektů nebyla při hodnocení šesti operátory absolutní shoda (převzato se svolením z Miller et al. (11)) 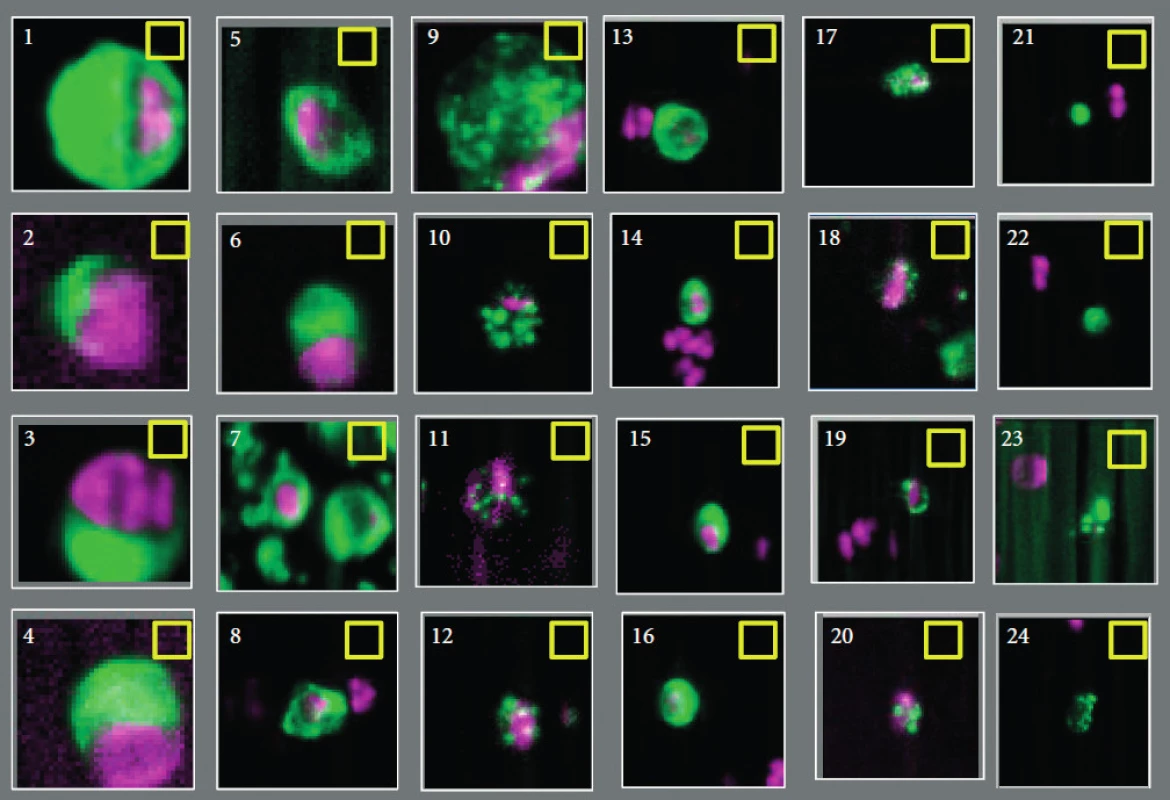
KLINICKÉ VYUŽITÍ CIRKULUJÍCÍCH NÁDOROVÝCH BUNĚK
Prognostické parametry pozitivní biopsie prostaty nebo výsledků radikální léčby byly v minulosti velmi dobře popsány a matematické modely jsou neustále zpřesňovány novými biomarkery nebo využitím zobrazovacích metod. V současnosti ale existuje velmi málo dat o prognóze pacientů s metastatickým nebo kastračně rezistentním KP. Mezi klasické parametry patří nepříznivé Gleasonovo skóre, vysoké hladiny PSA před zahájením léčby nebo rychlý čas zdvojení PSA (PSA doubling time). Patrně nejznámější nomogram připojuje ještě hladinu LDH, ALP a hemoglobinu, přítomnost viscerálních metastáz a špatný klinický stav pacientů. Na základě těchto dat je možné pacienty s CRPC rozdělit do několika rizikových skupin s velmi rozdílnou dobou celkového přežití (medián 8,8–22,8 měsíců) (10). Detekce CTC u pacientů s metastatickým nádorovým onemocněním může přispět ke zpřesnění jejich prognózy, nicméně klinické využití CTC je zatím pouze na teoretické úrovni.
Metoda CellSearchTM byla testována u pacientů s metastatickým kolorektálním karcinomem, karcinomem prostaty a u pacientek s karcinomem prsu ve třech multicentrických studiích, které byly publikovány souhrnně v roce 2010 (11). Na základě absolutního počtu CTC v 7,5 ml periferní krve jsou stanoveny dvě skupiny s rozdílnou prognózou (nepříznivá vs. příznivá). V případě CRPC a karcinomu prsu se za nepříznivý počet považuje pět a více CTC, u kolorektálního karcinomu se jedná o tři a více CTC. Vyšší počet CTC byl prokázán u pacientů s kostními a viscerálními metastázami proti samotnému uzlinovému postižení. Počet CTC před zahájením chemoterapie také jasně koreluje s prognózou pacientů (obr. 4). Celkem 231 pacientů s CRPC bylo hodnoceno před podáním chemoterapie a každý měsíc v průběhu léčby (12). U pacientů s pěti a více CTC byla střední doba přežití kratší než u pacientů s nižším počtem (11,5 vs. 21,7 měsíců). Počet CTC také dobře koreloval s prognózou ve všech následujících odběrech. Nejlepší prognózu pak měli pacienti s příznivou hodnotou CTC ve všech odběrech (přežití > 26 měsíců). Zajímavý je fakt, že změna z původně nepříznivého na příznivý počet CTC znamená prognózu prakticky srovnatelnou s předchozí skupinou (přežití 21,3 měsíců). Předpokládá se, že monitorování CTC v průběhu nákladné a rizikové chemoterapie pomůže identifikovat ty pacienty, pro které nemá tato léčba žádný přínos. V současnosti se k monitoraci pacientů s CRPC využívá hlavně změn hladiny PSA, biochemická odpověď je definována jako pokles PSA nejméně o 30 % původní hodnoty (3). Autoři předchozí studie zhodnotili nejen prediktivní význam poklesu CTC, ale porovnali jej i s poklesem PSA. Výhodou CTC je schopnost jasně definovat prognózu již po prvním měsíci léčby, zatímco PSA je informativní až po 3 měsících. Praktické využití těchto výsledků je ale stále nejasné.
Obr. 4. Celkové přežití pacientů s CRPC příznivým/nepříznivým počtem CTC před zahájením léčby (převzato se svolením z deBono et al. (12)) 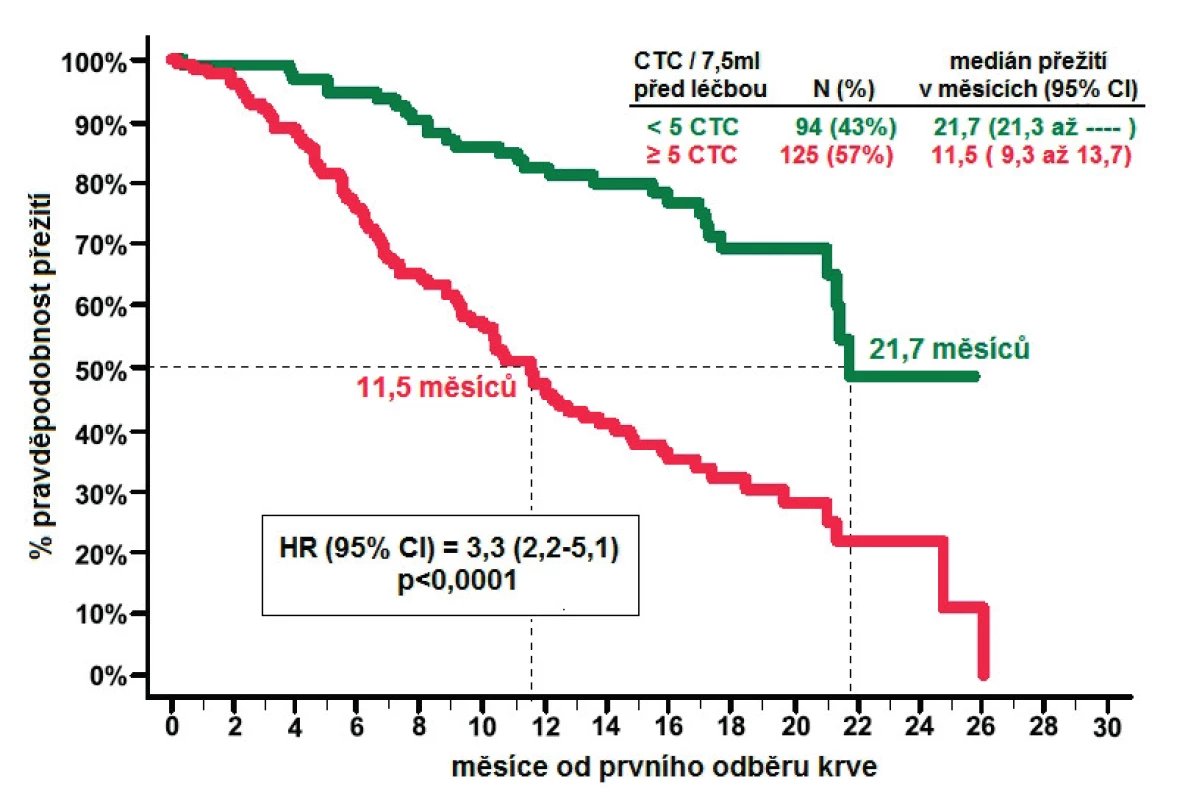
Hodnocení CTC bylo také využito v odhadu prognózy po radikální prostatektomii. V této oblasti bylo ale zatím provedeno velmi málo studií s nedostatečným počtem pa-cientů. Problém je také v detekci CTC metodou CellSearchTM, protože pozitivní nález je zjištěn u relativně malého procenta pacientů (cca 20 % případů). V jedné studii navíc nebyl rozdíl v detekci CTC mezi skupinou s KP a kontrolní skupinou s negativní biopsií prostaty (p = 0,946) a navíc nebyla prokázána korelace CTC s žádným klasickým prediktivním parametrem (13). Jako slibnější se jeví metoda RT-PCR, která dokáže detekovat transkripční produkty specifických genů v periferní krvi již od velmi malého množství. Touto metodou byla také prokázána korelace nálezů s patologickou klasifikací, Gleasonovým skóre, postižením lymfatických uzlin a pravděpodobně i s prognózou pacientů s biochemickým relapsem po radikálním výkonu (14, 15).
VLASTNÍ KLINICKÉ ZKUŠENOSTI
V roce 2011 jsme zahájili grantový projekt se zaměřením na detekci CTC a sledování exprese genů u CRPC jako součást individualizace systémové léčby. V rámci projektu testujeme novou metodu detekce CTC Adnatest Prostate Cancer Select/Detect (Adnagen, Německo). Pro potřeby analýzy odebíráme 5 ml periferní krve, ze které jsou nádorové buňky izolovány pomocí imunomagnetické separace obdobně jako u metody CellSearchTM (obr. 5A). Výsledná frakce je poté lyzována a pomocí magnetických oligo(dT)25-partikulí je izolována mRNA nádorových buněk. Následně je syntetizována cDNA, která je použita jako matrice pro detekci CTC pomocí multiplex-PCR. Je hodnocena amplifikace tumor asociovaných genů (PSMA, PSA, EGFR) a kontrolního genu aktinu. Test na přítomnost CTC je pozitivní, je-li jasně detekován PCR fragment alespoň jednoho tumor asociovaného transkriptu v koncentraci vyšší než 0,30 ng/µl (obr. 5B). Část obohacené leukocytární a CTC frakce získaná gradientovou centrifugací je použita pro výzkum metody kultivace CTC v prostředí různých růstových faktorů (obr. 5C) (16). V rámci projektu probíhá také profilování genové exprese buněk primárního nádoru (z histologických preparátů) a detekovaných CTC. Kritéria pro zařazení do protokolu jsou kastrační hladina testosteronu (< 1,75 nmol/l), vzestup PSA třikrát za sebou s konečnou hladinou PSA > 2 ng/ml, progrese PSA při vysazení antiandrogenů nebo při sekundární hormonální manipulaci a generalizace. U pacientů s CRPC před zahájením chemoterapie odebíráme žilní krev a stanovujeme hladinu transkriptů tumor specifických markerů CTC. Kontrolní odběr probíhá po 3.–4. cyklu chemoterapie.
Obr. 5. Detekce a kultivace cirkulujících nádorových buněk (16) A – imuno-magnetická separace (AdnaTest Prostate Cancer Select), B – kvantifikace exprese tumor-asociovaných genů PSA, PSMA a EGFR kapilární elektroforézou (Adnatest Prostate Cancer Detect), C – imunofluorescenční barvení pancytokeratinem (zeleně) a anti-CD45 (červeně) PSA – prostatický specifický antigen, PSMA – prostatický specifický membránový antigen, EGFR – epidermal growth factor receptor 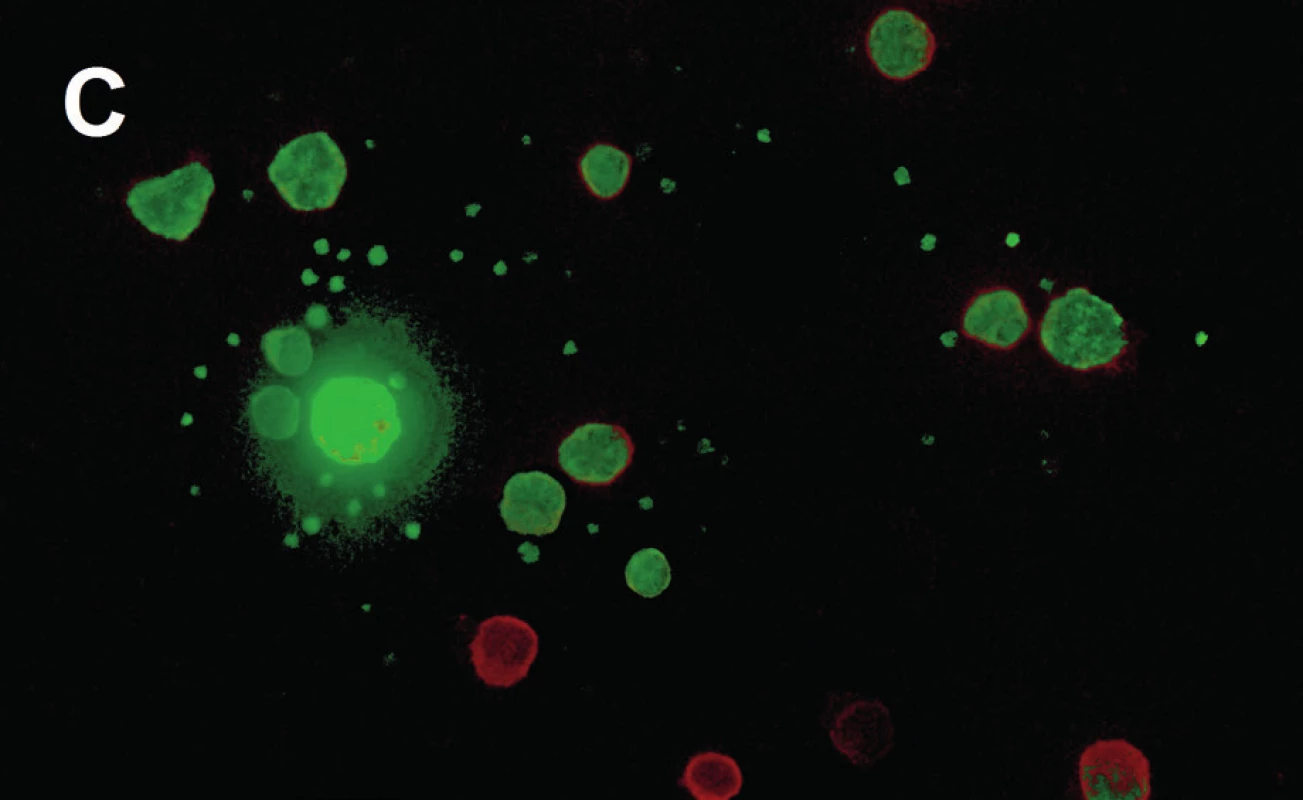
Metoda Adnatest byla zatím ověřena v souborech pacientek s metastatickým karcinomem prsu, v současnosti se také testuje detekce CTC u pacientů s pokročilým kolorektálním karcinomem. U tohoto onemocnění je hodnocena amplifikace tumor asociovaných genů GA733-2 (EpCAM), karcinoembryonálního antigenu (CEA) a EGFR. V jedné prospektivní studii českých autorů bylo zařazeno celkem 14 pacientů s jaterními metastázami indikovaných k chirurgickému řešení. Deset pacientů podstoupilo před výkonem chemoterapii. Odběr krve na CTC byl prováděn předoperačně, ve chvíli mobilizace jater během výkonu, těsně po výkonu a 2. a 7. pooperační den. Pouze u třech pacientů byly detekovány CTC, z toho u jednoho ve všech odběrech, u jednoho pouze v průběhu výkonu a u jednoho pouze předoperačně. Na tomto malém souboru autoři ukázali pouze ojedinělý záchyt CTC u pacientů s kolorektálním karcinomem, příčinou mohlo být podání chemoterapie před prvním odběrem u většiny případů nebo relativně malý rozsah onemocnění (17).
Zatím největší prospektivní multicentrická studie zaměřená na detekci CTC metodou AdnaTest u metastatického karcinomu prsu proběhla v Německu. Celkem 254 pacientek bylo zařazeno do protokolu DETECT, odběr periferní krve proběhl před zahájením jakékoliv léčby. V rámci této studie byl porovnán prognostický význam metod CellSearchTM a AdnaTest Breast Cancer Select/Detect. Tato metoda využívá amplifikace genů HER2, MUC1 a GA733-2. Celkem 116, resp. 88 z 221 (50 %, resp. 40 %) vzorků bylo hodnoceno jako CTC pozitivní při stanovení metodou CellSearchTM, resp. AdnaTest Breast Cancer. Pozitivita CTC při hodnocení metodou CellSearchTM byla nepříznivým nezávislým prediktorem celkového přežití (18,1 vs. 22,7; p < 0,001). Metoda AdnaTest Breast Cancer neprokázala statisticky významnou prediktivní schopnost ve vztahu k celkovému přežití (p = 0,278) (18).
Výhody této metody spočívají v rozpoznání jednotlivých tumor asociovaným markerů, a tím umožňují větší flexibilitu v konstrukci dalších testů pro detekci jiných nádorových buněk. Pomocí této metody je také možné detekovat kmenové buňky a markery EMT. Izolovaná mRNA může být dále použita pro stanovení profilu genové exprese CTC. Proces výběru CTC a následného stanovení tumor asociovaných genů může být prováděn odděleně. Metoda je relativně levná a není zatížena chybou v hodnocení, neboť výsledek je stanoven plně automatizovaným procesem. Mezi nevýhody patří nemožnost určit absolutní počet nádorových buněk a problém eventuální falešné pozitivity při expresi markerů nenádorovými buňkami. Hodnocení koncentrace fragmentů genů přináší možná méně informací než zjištění absolutního počtu CTC. Bohužel nevíme, zda získaný signál pochází z několika málo buněk, které ale silně transkribují dané geny, či z mnoha buněk, které je transkribují slabě, nebo z kombinace obou možností (19).
ZÁVĚR
Hodnocení prognózy u pacientů s KP je zcela zásadní pro správnou volbu diagnostických a léčebných postupů. Prognostické parametry lokalizovaného nádoru, pro který je první volbou radikální léčba, jsou dobře definovány, zatímco u pacientů s metastatickým onemocněním relevantní data chybí. Většina prognostických modelů u CRPC byla vytvořena na základě retrospektivních studií, které nereflektují rychlé změny ve výzkumu systémové léčby. Hodnocení CTC může pomoci určit prognózu pacientů s metastatickým KP během léčby rychleji než změny hladiny PSA nebo dalších biomarkerů. Předpokládá se, že CTC doplní PSA jako tzv. zástupný marker celkového nebo nádorově specifického přežití. Určení genového profilu CTC by mohlo přispět k další individualizaci léčby, včetně volby méně agresivních režimů u pacientů s nepříznivou prognózou.
Zkratky
ALP alkalická fosfatáza
AMACR alfa-metylacyl-CoA racemáza
cDNA komplementární deoxyribonukleová kyselina
CRPC kastračně rezistentní karcinom prostaty (castration-resistant prostate cancer)
CTC cirkulující nádorové buňky (circulating tumor cells)
DAPI 4’,6-diamidino-2-fenylindol
EGFR epidermal growth factor receptor
EMT epiteliálně mezenchymální transformace
EpCAM epithelial cell adhesion molecule
FACS fluorescence-activated cell sorting
FDA Food and Drug Administration
IMS imunomagnetická separace
KP karcinom prostaty
LDH laktátdehydrogenáza
mRNA messenger ribonukleová kyselina
PSA prostatický specifický antigen
PSMA prostatický specifický membránový antigen
PTEN phosphatase and tensin homolog
RARE RosetteSep-Applied Imaging Rare Event
RP radikální prostatektomie
RT-PCR reverse transcription-polymerase chain reaction
TMPRSS2 transmembrane protease, serine 2
Práce byla podpořena grantem IGA MZ ČR č. NT/12205-5.
ADRESA PRO KORESPONDENCI:
MUDr. Otakar Čapoun, FEBU
Urologická klinika 1. LF UK a VFN
Ke Karlovu 8, 128 08 Praha 2
e-mail: otakar.capoun@seznam.cz
Zdroje
1. Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2008. CA Cancer J Clin 2008; 58(2): 71–96.
2. Mužík J, Dušek L, Babjuk M, Kubásek M, Fínek J, Petruželka L. Uroweb – webový portál pro analýzu a vizualizaci epidemiologie, diagnostiky a léčby urologických malignit [online]. Masarykova univerzita, Brno, 2013 [cit. 2013-05-11]. Dostupný z: http //www.uroweb.cz. ISSN 1804-6371. Verze 1.6d.
3. Mottet N, Bellmunt J, Bolla M, et al. EAU guidelines on prostate cancer. Part II: Treatment of advanced, relapsing, and castration-resistant prostate cancer. Eur Urol. 2011; 59(4): 572–583.
4. Ashworth TR. A case of cancer in which cells similar to those in the tumours were seen in the blood after death, The Medical Journal of Australia 1869; 14 : 146–147.
5. Paget S. The distribution of secondary growths in cancer of the breast. Lancet 1889; 133 : 571–573.
6. Patel LR, Camacho DF, Shiozawa Y, et al. Mechanisms of cancer cell metastasis to the bone: a multistep process. Future Oncol 2011; 7(11): 1285–1297.
7. Talmadge JE, Fidler IJ. AACR centennial series: the biology of cancer metastasis: historical perspective. Cancer Res 2010; 70(14): 5649–5669.
8. Thiery JP, Acloque H, Huang RY, Nieto MA. Epithelial-mesenchymal transitions in development and disease. Cell 2009; 139(5): 871–890.
9. Danila DC, Fleisher M, Scher HI. Circulating tumor cells as biomarkers in prostate cancer. Clin Cancer Res 2011; 17(12): 3903–3912.
10. Halabi S, Small EJ, Kantoff PW, et al. Prognostic model for predicting survival in men with hormone-refractory metastatic prostate cancer. J Clin Oncol 2003; 21(7): 1232–1237.
11. Miller MC, Doyle GV, Terstappen LW. Significance of Circulating Tumor Cells Detected by the CellSearch System in Patients with Metastatic Breast Colorectal and Prostate Cancer. J Oncol 2010; Article ID 617421.
12. de Bono JS, Scher HI, Montgomery BR, et al. Circulating tumor cells predict survival benefi t from treatment in metastatic castration-resistant prostate cancer. Clin Cancer Res 2008; 14(19): 6302–6309.
13. Davis JW, Nakanishi H, Kumar VS, et al. Circulating tumor cells in peripheral blood samples from patients with increased serum prostate specific antigen: initial results in early prostate cancer. J Urol 2008; 179(6): 2187–2191.
14. Murray NP, Reyes E, Orellana N, et al. Secondary Circulating Prostate Cells Predict Biochemical Failure in Prostate Cancer Patients after Radical Prostatectomy and without Evidence of Disease. Scientific World Journal 2013; 762064.
15. Tombal B, Van Cangh PJ, Loric S, Gala JL. Prognostic value of circulating prostate cells in patients with a rising PSA after radical prostatectomy. Prostate 2003; 56(3): 163–170.
16. Mikulová V, Jančíková M, Čapoun O, et al. Cirkulující nádorové buňky u pacientů s kastračně rezistentním karcinomem prostaty jako součást individualizace systémové léčby. Onkologie B (2012): B34 (ročník 6.), 29. až 30. listopadu 2012.
17. Pesta M, Fichtl J, Kulda V, et al. Monitoring of circulating tumor cells in patients undergoing surgery for hepatic metastases from colorectal cancer. Anticancer Res 2013; 33(5): 2239–2243.
18. Müller V, Riethdorf S, Rack B, et al. Prognostic impact of circulating tumor cells assessed with the CellSearch System™ and AdnaTest Breast™ in metastatic breast cancer patients: the DETECT study. Breast Cancer Res 2012; 14(4): R118.
19. Mikulová V, Kološtová K, Zima T. Methods for detection of circulating tumour cells and their clinical value in cancer patients. Folia Biol (Praha) 2011; 57(4): 151–161.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Kolorektální karcinom (část 1)
- EPMA summit
- Diabetes mellitus – oční komplikace
- Již počtrnácté plný Lékařský dům na konferenci Tabák a zdraví
- Doc. MUDr. Ivo Přerovský, DrSc. 1924–2014
- Vzpomínka na prof. MUDr. Zdeňka Reiniše, DrSc.
- Erratum
- ROSALYN SUSSMAN YALOWOVÁ
- Potenciální interakce mezi léčivy a doplňky stravy rostlinného původu*
- Plánované akce složek ČLS JEP
- Cirkulující nádorové buňky a prognóza karcinomu prostaty
- Krevní destičky v patogenezia léčbě solidních nádorů
- Plánované akce složek ČLS JEP
- Imunologické vlastnosti ženských slin a jejich vliv na pohyblivost spermií
- CREATIVE DESTRUCTION OF MEDICINE
- Vztah rizikových faktorů mezi metabolickým syndromem a nealkoholickým ztučněním jater u dětí a dospívajících
- OMLUVA
- Porodnicko-gynekologicky orientované texty v díle Jana Černého
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Krevní destičky v patogenezia léčbě solidních nádorů
- Imunologické vlastnosti ženských slin a jejich vliv na pohyblivost spermií
- Potenciální interakce mezi léčivy a doplňky stravy rostlinného původu*
- Cirkulující nádorové buňky a prognóza karcinomu prostaty
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy





