-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Krevní destičky v patogenezia léčbě solidních nádorů
Platelets in the pathogenesis of solid tumors
Cancer cells trigger platelet aggregation. Reciprocally, platelet aggregation promotes tumor growth and metastasis. Within the tumor microenvironment, platelet regulates tumor growth via several mechanisms involving stimulation of angiogenesis, inflammation, coagulation, and stabilizing of vessel wall. In circulation, cancer cells coated by platelets can travel to metastatic site protected from intravascular shear forces and from immune surveillance. Finally, platelets facilitate adhesion of tumor cells and formation of the metastatic niche. Platelet-derived microparticles contain growth factors contributing to tumor angiogenesis. On the other hand, platelets can selectively release anti-angiogenic factors in a process connected to tumor dormancy. Therapeutical inhibition of platelet aggregation prevents tumor development in certain tumor types and may contribute to better cancer outcome.
Keywords:
blood platelets – neoplasms – angiogenesis – platelet aggregation – platelet aggregation inhibitors – tumor microenvironment – aspirin – coagulation
Autoři: Beatrix Bencsiková 1,2; Kristína Greplová 2*; Kateřina Pilátová 2,3; Zuzana Volejníková 2; Dalibor Valík 2,3; Giannoula Lakka Klement 3,4; Lenka Zdražilová-Dubská 2,3
Působiště autorů: Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno 1; Oddělení laboratorní medicíny, Masarykův onkologický ústav, Brno 2; Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno 3; Center of Cancer Systems Biology, Steward St. Elizabeth’s Medical Center Pediatric Hematology Oncology, Tufts University School of Medicine, Boston, MA, USA 4
Vyšlo v časopise: Čas. Lék. čes. 2014; 152: 78-85
Kategorie: Přehledový článek
* přispěly stejně
Souhrn
Krevní destičky v patogenezi a léčbě solidních nádorů. Nádorové buňky spouštějí agregaci krevních destiček. Agregace trombocytů zase přispívá k růstu nádoru a tvorbě metastáz. Na úrovni mikroprostředí tumoru regulují krevní destičky nádorový růst prostřednictvím různých mechanismů, jež souvisejí se stimulací angiogeneze, zánětu, koagulace a stabilizace cévní stěny. V krevním řečišti jsou nádorové buňky obalené trombocyty chráněny před mechanickými třecími silami a před imunitní obranou, což umožňuje tvorbu vzdálených metastáz. Krevní destičky také napomáhají adhezi nádorových buněk a založení metastatického niche. Destičkové mikropartikule obsahují růstové faktory přispívající k nádorové angiogenezi. Trombocyty však mohou selektivně uvolňovat také anti-angiogenní faktory a tento jev se uplatňuje například u maligních nádorů ve stadiu dormance. Terapeutická inhibice agregace krevních destiček přispívá k částečné prevenci vzniku určitých typů nádorů a může vést také k příznivějšímu průběhu onemocnění.
Klíčová slova:
krevní destičky – nádory – angiogeneze – agregace destiček – inhibitory agregace destiček – nádorové mikroprostředí – aspirin – koagulaceÚVOD
V posledních letech se potvrzuje úloha krevních destiček při progresi nádorových onemocnění (1). Již v šedesátých letech 19. století byla popsána agregace trombocytů navozená nádorovými buňkami, která je částečně odpovědná za protrombotické působení nádoru (2). Později bylo demonstrováno, že blokací tvorby agregátů destiček s nádorovými buňkami dojde k inhibici tvorby metastáz (3, 4) a že schopnost nádorových buněk aktivovat krevní destičky koreluje s metastatickým potenciálem nádorových buněk (5, 6).
Rozvoj poznatků o vztahu trombocytů a malignit je v posledních letech dán především faktem, že anti-angiogenní protinádorová terapie je často založená na inhibici VEGF a že destičky jsou hlavními transportéry VEGF; více než 80 % sérového VEGF se nachází v krevních destičkách (7, 8). Obecně se působení trombocytů považuje za pro-angiogenní a podporující růst a šíření nádoru. Nicméně destičky obsahují také anti-angiogenní faktory (9) a jejich funkční efekt na inhibici nádorové neovaskularizace byl popsán na myším modelu (10). Cílem této práce je podat přehled o vztahu nádorových onemocnění a hyperkoagulace, mechanismech agregace trombocytů indukované nádorovými buňkami a úloze destiček v mikroprostředí nádoru s důrazem na nádorovou angiogenezi.
NÁDOROVÁ ONEMOCNĚNÍ, TROMBOCYTY A HYPERKOAGULACE: KLINICKÁ POZOROVÁNÍ
Zvýšený výskyt tromboembolických příhod u pacientů s maligním onemocněním je v dnešní době všeobecně známý (11, 12). Protromboticky působí nejen protinádorová terapie, ale i nádor samotný a za jednu z příčin tromboembolie u onkologických pacientů je považována trombocytóza. Zvýšený počet krevních destiček u pacientů s malignitou byl popsán již v roce 1872 (13). Později byla trombocytóza popsána u karcinomu kolorekta, plic, prsu, žaludku, ledvin a u gynekologických malignit (ovarium, endometrium, cervix) jako negativní prognostický faktor (1, 14–20). Nádorové buňky a nádorové stroma (včetně krevních destiček) uvolňují řadu prozánětlivých cytokinů (IL-1, IL-6) a růstových faktorů (GM-CSF, G-CSF, VEGF), které stimulují proliferaci a zrání megakaryocytů, a tím přispívají ke zvýšenému počtu trombocytů v cirkulaci (21–26). Po odstranění nádoru klesá hladina krevních destiček, což potvrzuje, že nádor sám produkuje látky stimulující produkci destiček (1, 27). Prozánětlivé působení nádorového mikroprostředí vede ke zvýšení hladin reaktantů akutní fáze např. fibrinogenu (28), což dále usnadňuje vznik trombů. Na lokální úrovni nádoru přispívá zásadně k tromboembolii tzv. nádorem indukovaná agregace destiček (TCIPA, tumor cell-induced platelet aggregation) (3), které bude věnována následující kapitola. Protrombotické působení nádoru pak vede ke zvýšeným hladinám fibrin-degradačních produktů; např. u metastatického karcinomu prsu byla popsána asociace mezi zvýšenou hladinou D-dimerů, objemem nádoru a horší prognózou onemocnění (29) a byl popsán případ, kdy došetřování příčiny zvýšené hladiny D-dimerů u asymptomatické pacientky vedlo po vyloučení trombózy, zánětu, traumatu k detekci okultního kolorektálního karcinomu (30).
Pokusem na trombocytopenických myších s nádorem bylo odhaleno, že vlivem nedostatečného počtu krevních destiček dochází k poklesu proliferační aktivity nádorových buněk. Na tomto myším modelu byl také pozorován větší rozsah nekrózy nádoru v bezprostřední blízkosti místa krvácení v nádoru. Z toho vyplývá, že intratumorální krvácení je pro nádorové buňky nepříznivé a je potlačeno lokální degranulací destiček (31). Pozitivní vliv trombocytů na progresi nádoru byl prokázán působením acelulární frakce trombocytů na nádorové buněčné linie a na růst nádorů in vivo, kdy bylo potvrzeno, že růstové faktory uvolňované z krevních destiček podporují nádorovou angiogenezi, invazi nádoru a zhoršují prognózu. Bylo prokázáno, že VEGF je pro migraci buněk pankreatické nádorové buněčné linie důležitým, ale nikoliv jediným, faktorem (32).
MECHANISMY NÁDOREM INDUKOVANÉ AGREGACE TROMBOCYTŮ
Agregace trombocytů může být navozena řadou způsobů (obr. 1), z nichž se většina uplatňuje také v aktivaci krevních destiček navozené nádorovými buňkami:
Obr. 1. Základní fyziologické funkce krevních destiček (33–35). 1. Vazba receptoru GPIb-IX-V na von Willebrandův faktor (vWF) umožňuje adhezi krevních destiček na subendoteliální kolagenní fibrily a jejich rolování po endoteliu. 2. Vazba receptorů GPVI a α2β1 (GPIa/IIa) na kolagen vede k pevné adhezi, zastavení destičky na povrchu kolagenu a následné aktivaci trombocytů. Interakce se subendoteliem, tj. aktivace receptorů GPIb-IX-V a GPVI způsobuje aktivaci trombocytů: vylití obsahu denzních a α-granul, aktivaci integrinů, zejména receptoru αIIbβ3 (GPIIb/IIIa). 3. Po vazbě ADP na receptory P<sub>2</sub>Y<sub>1</sub> nebo P<sub>2</sub>Y<sub>12</sub> dochází k primární stimulaci agregace destiček a k aktivaci receptoru αIIbβ3. 4. P-selektin je skladován v α-granulích krevních destiček. Po jejich aktivaci destičkovými agonisty (tj. trombin, ADP, kolagen) je vystaven na povrch destičky (membrane flipping), kde zprostředkovává adhezi leukocytů na krevní destičky a vazbu krevních destiček navzájem. Interakce P-selektinu s povrchovými molekulami nádorových buněk se uplatňuje v procesu metastazování. 5. Krevní destičky jsou aktivovány také prostřednictví receptorů PAR-1 a PAR-4, jejichž ligandem je trombin. K přeměně protrombinu na trombin je nezbytný tkáňový faktor (TF, FIII). TF je glykoprotein přítomný na subendotelových buňkách, monocyty a makrofágy tkáňový faktor produkují po jejich aktivaci. TF zahajuje koagulační kaskádu vazbou FVII, aktivovaný FVIIa katalyzuje aktivaci FX na FXa, který dále katalyzuje přeměnu protrombinu (FII) na trombin (FIIa). 6. αIIbβ3 (GPIIb/IIIa) receptor zprostředkovává agregaci krevních destiček vazbou fibrinogenu a vWF. Vazba jiných ligandů, jako je vitronectin a fibrinogen, agregaci moduluje. 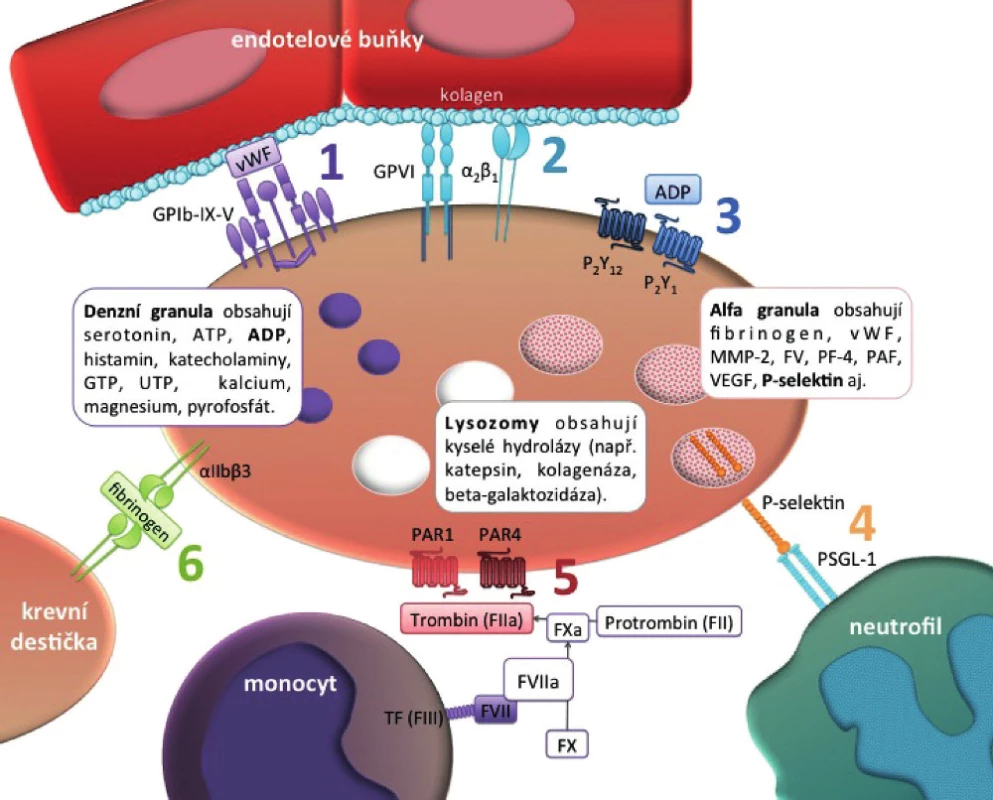
ADP – adenosindifosfát. In vitro byla schopnost produkovat ADP vedoucí ke vzniku trombocytárních agregátů popsána u buněčné linie MCF-7 (karcinom prsu) (36, 37), Caco-2 (kolorektální adenokarcinom) (38) a dalších (39).
Trombin – hraje v procesu hemostázy dvě zásadní role: 1. vede k přeměně solubilního figrinogenu na vláknitý fibrin a 2. vazbou na receptory PAR-1 a PAR-4 na povrchu destiček stimuluje jejich aktivaci. Schopnost produkovat trombin a aktivovat agregaci trombocytů byla popsána u různých typů nádorových buněk in vitro (39, 40). Nádorové buňky dále přispívají ke vzniku trombinu produkcí proteinázy EC 3.4.22.26 (41, 42) zvané „cancer procoagulant“ – nádorový prokoagulant, která vede k přeměně faktoru X na FXa štěpící protrombin na trombin.
Matrixové metaloproteinázy (MMPs) – jsou proteolytické enzymy, jejichž hlavním cílem jsou složky extracelulární matrix (43). MMP-2 má schopnost stimulovat agregaci krevních destiček (44). Aktivace MMP-2 nádorovými buňkami vedoucí k TCIPA byla popsána in vitro u několika buněčných modelů (36, 45) a tento poznatek byl podpořen pozorováním zvýšené aktivace trombocytů závislé na MMP 2 u pacientů s metastatickým karcinomem prostaty (46).
Katepsin B. Schopnost agregovat destičky prostřednictvím produkce proteináz katepsinu B a katepsinu B podobné (cathepsin B-like) byla popsána in vitro (47, 48).
GPIIb/IIIa (tj. αIIbβ3). Existuje interakce mezi nádorovými buňkami a trombocyty zprostředkovaná re-ceptorem GPIIb/IIIa, jež vede k TCIPA (49) a přispívá k nádorové angiogenezi (50, 51).
Tkáňový faktor (TF). Zdrojem TF v nádorovém mikroprostředí jsou buňky stromatu, tj. fibroblasty, monocyty/makrofágy, buňky endotelu, ale také nádorové buňky (52–54). Velmi vysoká exprese TF u metastatických buněk v porovnání s primárním ložiskem u melanomu je pravděpodobně spojena s metastatickým potenciálem těchto buněk (55). Hladina TF u nádorových buněk negativně koreluje s prognózou onemocnění a pozitivně s hyperkoagulací (56–58). V experimentech vedla inhibice nebo snížená exprese tkáňového faktoru u nádorových buněk k redukci metastazování (55, 56, 59–61).
P-selektin je adhezní molekula, která má význam v angiogenezi založené na krevních destičkách. Je syntetizován a skladován v endotelových buňkách a α-granulích destiček. Po vyloučení z aktivovaných endotelových buněk a destiček interaguje se svými ligandy, které jsou exprimovány nejen na bílých krvinkách, ale také na nádorových buňkách (62). Tato interakce umožňuje obalení nádorových buněk krevními destičkami, což usnadňuje jednak metastazování a také iniciuje koagulaci (63).
KREVNÍ DESTIČKY V NÁDOROVÉM MIKROPROSTŘEDÍ: ZÁNĚT, AKTIVACE ENDOTELU, NÁDOROVÁ ANGIOGENEZE
Agregace a aktivace trombocytů je navozena nejen nádorovými buňkami, ale i dalšími komponentami mikroprostředí nádoru. Do nádoru jsou atrahovány leukocyty s prozánětlivým efektem, které paradoxně některými svými vlastnostmi podporují růst nádoru. Z toho pohledu jsou významné především TAM (tumor-associated macrophages M2), které mohou tvořit podstatnou část nádorové masy a jejichž přítomnost v nádoru je spojena s progresí onemocnění (64, 65). Ve vztahu ke krevním destičkám a jejich aktivaci je podstatné značné množství tkáňového faktoru obsaženého v makrofázích. Dalším významným stimulátorem destiček v nádorovém mikroprostředí je povrch endotelových buněk nedokonalé nezralé nádorové vaskulatury, kde dochází k expozici makromolekul subendotelové extracelulární matrix, jako je kolagen a von Willebrandův faktor (vWF), jež jsou významným aktivátorem krevních destiček (66). Popsaná aktivace destiček v nádorovém mikroprostředí je autokrinně potencována působením trombocytárních proaktivačních a proagregačních faktorů.
Obr. 2. Jak krevní destičky přispívají k nádorovému růstu a angiogenezi. 1. Koagulace: stimul k aktivaci trombocytů přichází z endotelových buněk, ale i ze samotného nádoru nebo z buněk nádorového stromatu (exprese tkáňového faktoru, trombinu, ADP atd.). Po aktivaci trombocytů dochází ke změně jejich tvaru a k uvolnění mikropartikulí, obsahu α- a denzních granul a ke spuštění koagulační kaskády (35). 2. Zánět: chemokiny (IL-8, histamin atd.) uvolňované z trombocytů způsobují chemotaxi leukocytů a prekurzorových buněk z kostní dřeně. Tyto buňky mohou také přispívat k progresi nádoru uvolňováním různých růstových a angiogenních faktorů (64, 65). 3. Angiogeneze: trombocyty se uplatňují také při regulaci angiogeneze uvolňováním pro- a anti-angiogenních faktorů (VEGF, bFGF, PF-4 atd.), ale také jejich aktivním „sbíráním“ z cirkulace (66, 110). 4. Stabilizace cévy: trombocyty stabilizují cévu a udržují mezibuněčné spoje uvolňováním faktorů, jako je EGF, S1P, ang-1 atd., aby zabránily krvácení v místě angiogeneze a zánětu (31). 5. Cirkulace nádorových buněk: naadherované trombocyty chrání nádorové buňky před rozpoznáním imunitním systémem a před cytotoxickým působením TNF-α, což umožňuje jejich migraci do vzdálenějších míst (122–124). 6. Adheze/extravazace: tvorba agregátů nádorových buněk s leukocyty a trombocyty usnadňuje jejich adhezi na endotelium a následnou extravazaci na nové místo. Trombocyty dále uvolňují faktory podporující proliferaci nádorových buněk a zvyšující permeabilitu cévy (např. VEGF) (106, 120). 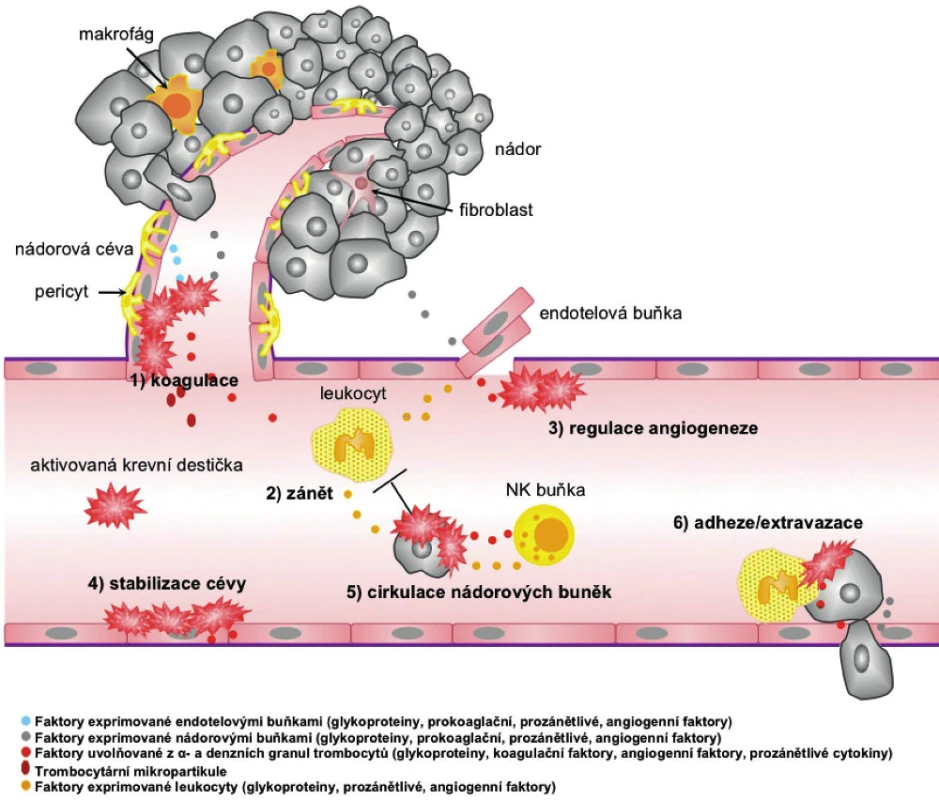
Během růstu primárního nádoru a metastáz dochází ke vzniku hypoxie v jeho vnitřních částech, kam se nedostává kyslík difuzí. Tato hypoxie stimuluje vznik vaskulatury v nádorové lézi. Zásadní úlohu v neovaskularizaci nádoru hraje VEGF, který je ve vysokých koncentracích obsažen v krevních destičkách, a jeho uvolnění z trombocytů po aktivaci podporuje angiogenezi (67, 68). Krevní destičky obsahují ale také další faktory ovlivňující fyziologickou a nádorovou angiogenezi (tab. 1). Obecně lze říci, že při hojení rány jsou v první fázi z trombocytů uvolněny pro-angiogenní faktory a ve druhé fázi je proces neovaskularizace potlačen anti-angiogenními působky krevních destiček a stromálních buněk. S tímto jevem souvisí kupříkladu různá odpověď na selektivní stimulaci trombinových receptorů. Po stimulaci PAR-1 dochází k uvolnění VEGF za současné inhibice sekrece endostatinu. Aktivací PAR-4 dochází k sekreci endostatinu s potlačením sekrece VEGF, a tím k inhibici nádorové angiogeneze (9, 66). Z trombocytů aktivovaných trombinem byl dále izolován destičkový faktor-4 (PF-4) neboli CXCL4, chemokin inhibující angiogenezi. Angiostatický účinek je zprostředkován například vazbou PF-4 na VEGF a bFGF a kompeticí s těmito růstovými faktory o vazbu na heparan sulfát, čímž inhibuje jejich vazbu na receptory, a brání tak angiogenezi (69–71). Odlišný efekt trombinu na uvolnění destičkových faktorů a fakt, že angiogenní a angiostatické proteiny jsou umístěny odděleně v různých subpopulacích α-granulí, poukazuje na selektivní regulaci angiogeneze prostřednictvím krevních destiček. V souvislosti s vysokým obsahem regulátorů angiogeneze v trombocytech a jejich v řadě případů anti-angiogenní úlohou se uvažuje také o potenciálu destiček zadržovat tyto látky a blokovat tak jejich dostupnost v místě procesu neovaskularizace. Trombocyty pacientů s kolorektálním karcinomem obsahují vyšší hladiny pro-angiogenního VEGF i anti-angiogenního endostatinu a trombospondinu-1 (72) a bylo pozorováno, že trombocyty preferenčně vychytávají faktory (GM-CSF, TPO, TNF-α, TGF-β1 a MCP-1) produkované nádorem oproti faktorům produkovaným zdravou tkání (73).
Tab. 1. Obsah krevních destiček a vztah k nádorové angiogenezi a progresi 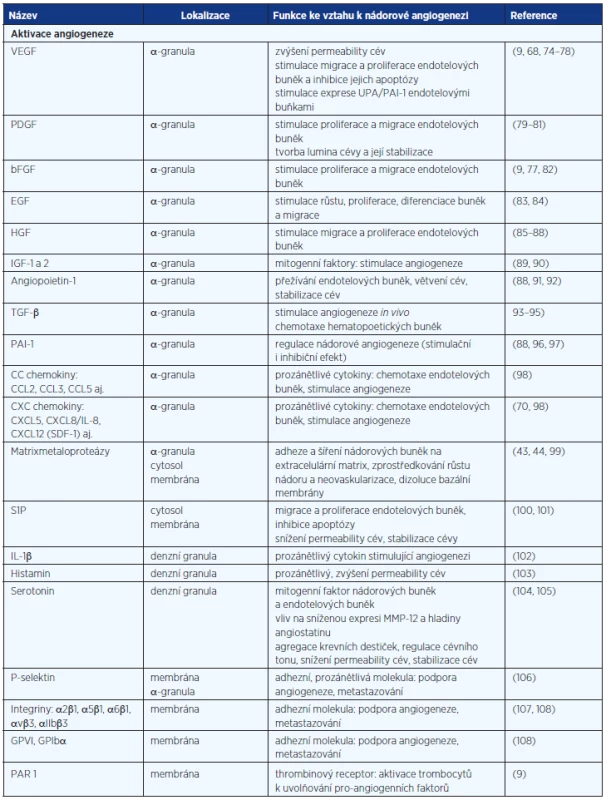

bFGF – basic fibroblast growth factor, EGF – epidermal growth factor, GPIbα – glycoprotein Ibα, GPVI – glycoprotein VI, HGF – hepatocyte growth factor, IGF-1, -2 – insulin-like growth factor 1, 2, IL – interleukin, MMP – matrix metalloproteinase, PAI-1 – plasminogen activator inhibitor 1, PDGF – platelet-derived growth factor, PF4 – platelet factor 4, S1P – sphingosine 1-phosphate, TGF-β – transforming growth factor-β, TIMP – tissue inhibitor of metalloproteinases, tPA – tissue plazminogen activator, uPA – urokinase plazminogen activator, VEGF – vascular endothelial growth factor KREVNÍ DESTIČKY A METASTAZOVÁNÍ
Vznik trombocytárních agregátů a uvolňování destičkových faktorů – např. matrixových metaloproteináz v místě primárního nádoru přispívá k porušení vrstvy endotelových buněk nebo degradaci subendoteliální matrix. To podporuje extravazaci nádorových buněk, a tím jejich šíření do sekundárních míst a vznik metastáz (120).
TCIPA vede nejen k tvorbě trombocytárních agregátů, ale také ke vzniku agregátů trombocytů a nádorových buněk. Destičky tak přispívají k metastazování nádorových buněk jejich ochranou před fyzikálními stresory v krevním řečišti (121). Agregáty mají také vyšší přilnavost k endotelovým buňkám a aktivované destičky uvolňují mediátory, které způsobují rozrušení extracelulární matrix a vazokonstrikci (serotonin) v místě vzniku nové metastázy. Nádorové buňky obalené trombocyty jsou také do určité míry chráněny před buňkami imunitního systému. Byl popsán protektivní účinek destiček před cytotoxickým působením TNF-α (122). Zásadní význam má ale pravděpodobně ochrana nádorových buněk krevními destičkami před cytolýzou navozenouNK-buňkami (123–125).
TROMBOCYTÁRNÍ MIKROPARTIKULE V PROGRESI SOLIDNÍCH NÁDORŮ
Z aktivovaných destiček se uvolňují destičkové mikropartikule (PMP), malé vezikuly, obsahující různé cytokiny a růstové faktory, např. VEGF a bFGF (126). Destičkové mikropartikule tvoří největší podíl cirkulujících mikropartikulí v krvi, přestavují 70–90 % (127, 128). Zvýšené hladiny destičkových mikropartikulí doprovází řadu onemocnění včetně karcinomu, aterosklerózy, sepse a diabetu (129). Role PMP ve vývoji nádoru není zcela známá, nicméně vysoké hladiny PMP korelují s agresivními nádory a špatným klinickým stavem (127). PMP mohou exprimovat a nést funkční receptory destičkových membrán, stimulovat expresi adhezních molekul na buňkách a uvolňování cytokinů, aktivovat nitrobuněčné signální dráhy, podporovat angiogenezi in vitro a podílet se na regeneraci tkáně a metastazovaní nádorů. PMP stimulují proliferaci a adhezi nádorových buněk (129). U karcinomu žaludku bylo prokázáno, že hladina PMP je lepším ukazatelem metastazování než VEGF, IL-6 nebo RANTES (130). U buněk nádorů prostaty indukují PMP sekreci MMP-2 usnadňující průchod kolagenem, který je hlavní složkou extracelulární matrix (131). PMP slouží jako chemoatraktans pro některé buněčné linie nádoru plic, aktivují fosforylaci signálních molekul a expresi membránové matrix metaloproteinázy typu 1 (127, 132). PMP regulují proliferaci a adhezi nádorových buněk k fibrinogenu a endoteliálním buňkám (132). Na buněčných liniích nádorů prsu bylo prokázáno, že PMP ovlivňují chemoinvazi bazální membránou (133).
ANTIKOAGULAČNÍ LÉČBA A TERAPEUTICKÁ INHIBICE AGREGACE KREVNÍCH DESTIČEK VE VZTAHU K PREVENCI A LÉČBĚ NÁDOROVÝCH ONEMOCNĚNÍ
Je otázkou, zda má antikoagulační léčba heparinem a nízkomolekulárními hepariny LMWH léčebný účinek u nádorů. Předpokládá se inhibiční efekt nízkomolekulárních heparinů na proces angiogeneze, zánětu a vliv na regulaci buněčné adheze, proliferace, mobility, růstových a koagulačních faktorů (134). Byl popsán pozitivní efekt heparinu na diferenciaci a apoptózu (135). LMWH může prodloužit přežívání pacientů s pokročilým maligním onemocněním (136). Využití protinádorového potenciálu heparinu/LMWH v praxi bude možné až po ověření v klinických studiích. Profylaktické nebo léčebné podání při venózní trombembolii u pacientů s nádorem vyžaduje pečlivou monitoraci nežádoucích účinků, vzniku heparinem indukované trombocytopenie (HIT), krvácivých komplikací nebo lékových interakcí.
Antitrombotická léčba ve smyslu antitrombocytárních přípravků zahrnuje inhibici cyklooxygenázy-2 (kyselina acetylsalicylová/aspirin), inhibici fosfodiesteráz (dipyridamol; mopidamol/RA-233), protilátky proti glykoproteinu IIb–IIIa (intravenózní Abciximab, perorální XV459), inhibici PAR-1 (vorapaxar, atopaxar), inhibici P2Y12 receptoru (klopidogrel, prasugrel, tiklopidin, elinogrel a další).
Nejběžnějším inhibitorem agregace krevních destiček je kyselina acetylsalicylová (aspirin). Metaanalýza čtyř randomizovaných studií zhodnotila efekt aspirinu versus placeba v primární a sekundární prevenci cévních příhod a rizika kolorektálního karcinomu v průběhu 20letého sledování 14 033 subjektů. Pětiletá léčba aspirinem snižuje riziko karcinomu proximální části tlustého střeva o 70 % a také snižuje riziko rektálního karcinomu. Vyšší dávky než 75 mg nepřináší větší benefit a velmi nízké dávky aspirinu (30 mg denně) neměly význam v prevenci kolorektálního karcinomu. Při pravidelném užívání 75 mg aspirinu/den došlo k téměř 20% snížení mortality na kolorektální karcinom, tento přínos se začal projevovat již po 5. roce užívání aspirinu (137). Snížení incidence i šíření adenokarcinomů v gastrointestinální oblasti je třeba ozřejmit v prospektivních studiích u onkologických onemocnění, také s ohledem na rizika dlouhodobého užívání aspirinu, zejména krvácení.
Výsledky klinických hodnocení vztahu anti-trombocytárních přípravků ve vztahu k prognóze onkologických onemocnění jsou shrnuty v tabulce 2.
Tab. 2. Klinické výsledky léčby inhibitory krevních destiček u pacientů s nádory 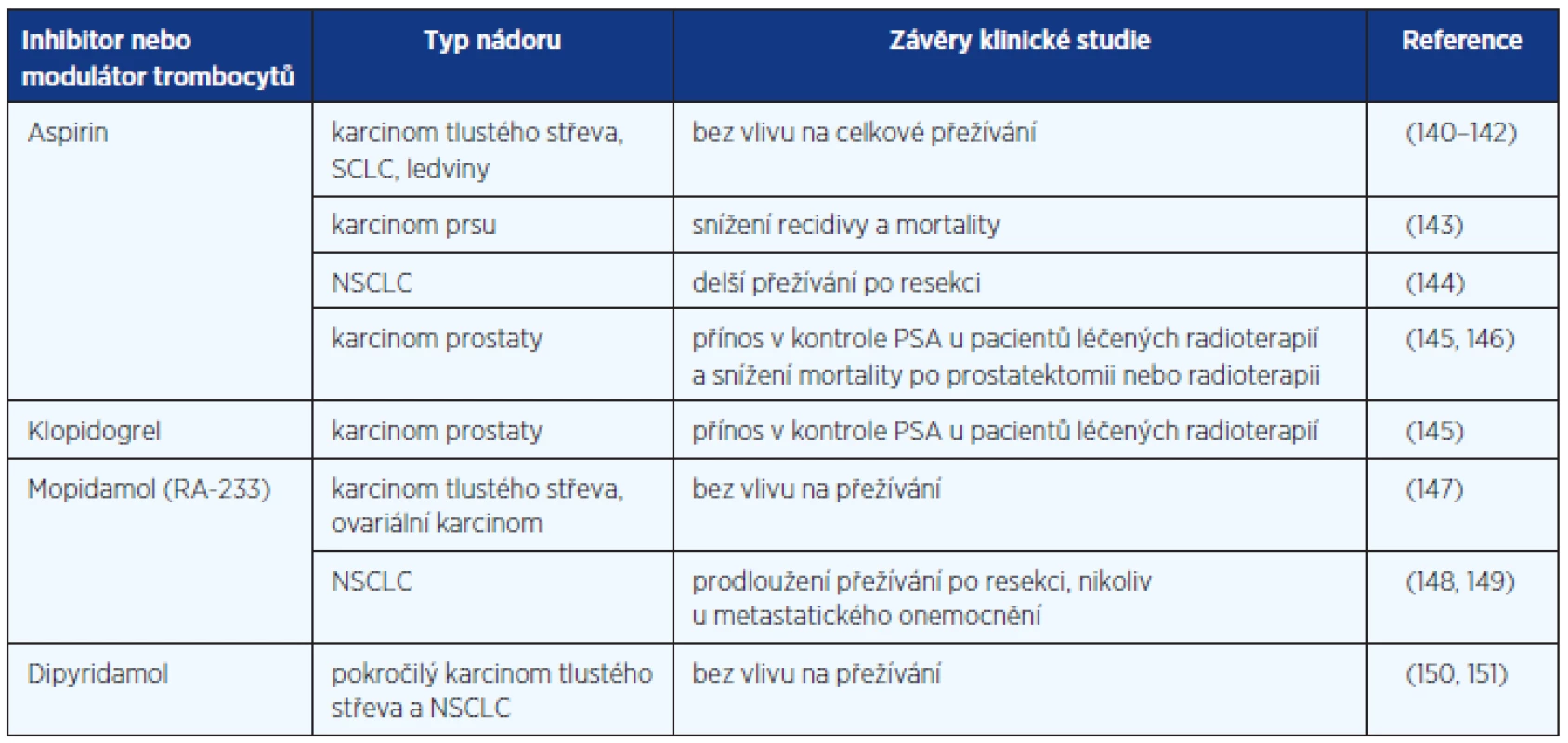
NSCLC – nemalobuněčný karcinom plic, SCLC – malobuněčný karcinom plic, PSA – prostatický specifický antigen Experiment na myším modelu ukázal, že inhibice agregace krevních destiček aspirinem a/nebo klopidogrelem potlačuje hepatokarcinogenezi po chronické infekci virem hepatitidy B (138). Abciximab inhibuje agregaci destiček a je indikován k prevenci kardiálních ischemických komplikací zejména po perkutánních intervencích (angioplastikách), u akutních koronárních syndromů. Předpokládá se anti-angiogenní a také protinádorový účinek abciximabu. Blokáda GPIIb/IIIa vede k ovlivnění adheze nádorových buněk, jejich metastatazování a invazi (51, 139).
ANTI-ANGIOGENNÍ LÉČBA A TROMBOTICKÉ KOMPLIKACE
Zajímavá je otázka vlivu monoklonální protilátky bevacizumabu na funkci krevních destiček. Systémová léčba bevacizumabem je spojena s vyšším výskytem arteriální a venózní trombembolie a hemoragií (152). Přesná příčina vzniku cévních příhod při léčbě bevacizumabem není známá. Teoreticky lze předpokládat změny endoteliálních buněk, jejich nefyziologickou apoptózu jako důsledek inhibice VEGF. Tato hypotéza je založena na vlivu VEGF v udržování fyziologických funkcí endotelií (153). Abnormální apoptóza endoteliálních buněk umožní expozici vysoce protrombotických fosfolipidů bazální membrány a současně vede ke ztrátě integrity endoteliální výstelky s následným krvácením (154). Protrombotický efekt anti-VEGF agens může souviset také s potlačením destičkových inhibitorů prostaglandinu I-2 a NO, jejichž nižší hladiny působí zvýšenou aktivaci destiček a zvýšenou incidenci trombembolie (155). U myšího modelu byl prokázán vznik imunokomplexů s bevacizumabem, jež aktivovaly krevní destičky a vedly k trombóze (156).
Analýza dat 1745 pacientů z pěti randomizovaných studií léčených bevacizumabem v kombinaci s chemoterapií prokázala zvýšené riziko vzniku arteriální, ale nikoliv venózní trombembolie u 3,8 % pacientů oproti 1,7 % v kontrolní skupině. Nejčastěji popsanou událostí byl infarkt myokardu a cerebrovaskulární příhody. Vznik arteriální trombembolie (ATE) souvisel s již předcházejícím výskytem ATE nebo s věkem nad 65 let včetně (157).
Metaanalýza 7956 pacientů z 15 klinických studií (léčených standardní chemoterapií s nebo bez bevacizumabu) prokázala výskyt všech stupňů závažnosti venózní trombembolie u 11,9 % a vysokého stupně závažnosti u 6,3 % případů (158).
Další metaanalýza 7441 pacientů ze 17 klinických studií byla provedena s cílem stanovení relativního rizika venózní trombembolické příhody u pacientů léčených VEGFR tyrozinkinázovými inhibitory (TKIs): sunitinib, sorafenib, pazopanib, vandetanib a axitinib. Relativní riziko všech stupňů a vysokého stupně venózní trombembolie v ramenech s TKI a bez TKI bylo 1,10 a 0,85 bez prokázané statistické významnosti. Metaanalýza nepotvrdila souvislost mezi léčbou VEGFR TKIs a rizikem vzniku venózní trombembolie (159).
ZÁVĚR
Krevní destičky přispívají k růstu nádoru a k jeho šíření na několika úrovních, jak je schematicky uvedeno na obrázku 2. Z pohledu neovaskularizace/angiogeneze i úlohy imunitního systému je možné progredující nádor považovat za nehojící se ránu (160). V prvních fázích hojení rány, podobně jako při progresi tumoru, dochází k aktivaci koagulace; trombocyty a leukocyty uvolňují cytokiny podporující prokrvení a začínají se tvořit nové cévy. Ve finální fázi hojení krevní destičky zajišťují potlačení angiogeneze, k čemuž při progresi nádoru zpravidla nedochází. Nádor se naopak chová spíše jako zanícená rána, ve které jsou cévní stěny propustné a leukocyty (neutrofily a monocyty) přispívají k angiogenezi a růstu nádorových buněk. Krevní destičky a destičkové mikropartukule přispívají ke vzniku hematogenních metastáz a konzistentně s tímto faktem vede protidestičková léčba v řadě případů k lepšímu průběhu či prevenci onkologických onemocnění.
Práce byla podpořena Evropským fondem pro regionální rozvoj a státním rozpočtem České republiky projektem OPVaVpI (reg. č. CZ.1.05/2.1.00/03.0101) pro Regionální centrum aplikované molekulární onkologie RECAMO.
ADRESA PRO KORESPONDENCI:
RNDr. Lenka Zdražilová-Dubská, Ph.D.
Oddělení laboratorní medicíny
Masarykův onkologický ústav
Žlutý kopec 7, 656 53 Brno
e-mail: dubska@mou.cz
Zdroje
1. Nash GF, Turner LF, Scully MF, Kakkar AK. Platelets and cancer. The Lancet Oncology 2002; 3(7): 425–430.
2. Trousseau A. Phlegmatia alba dolens. Clinique Medicale De L’Hotel-Dieu de Paris. 1865; 3 : 654–712.
3. Gasic GJ, Gasic TB, Stewart CC. Antimetastatic effects associated with platelet reduction. Proc Nat Acad Sci USA 1968; 61 : 46–52.
4. Jurasz P, Alonso-Escolano D, Radomski MW. Platelet-cancer interactions: mechanisms and pharmacology of tumour cell-induced platelet aggregation. Br J. Pharmacol 2004; 143(7): 819–826.
5. Karpatkin S, Pearlstein E, Ambrogio C, Coller BS. Role of adhesive proteins in platelet tumor interaction in vitro and metastasis formation in vivo. J Clin Invest 1988; 81(4): 1012–1019.
6. Karpatkin S, Ambrogio C, Pearlstein E. The role of tumor-induced platelet aggregation, platelet adhesion and adhesive proteins in tumor metastasis. Prog Clin Biol Res 1988; 283 : 585–606.
7. Holmes CE, Huang JC, Pace TR, Howard AB, Muss HB. Tamoxifen and aromatase inhibitors differentially affect vascular endothelial growth factor and endostatin levels in women with breast cancer. Clin Cancer Res 2008; 14(10): 3070–3076.
8. Peterson JE, Zurakowski D, Italiano JE Jr, Michel LV, Fox L, Klement GL, Folkman J. Normal ranges of angiogenesis regulatory proteins in human platelets. Am J Hematol 2010; 85(7): 487–493.
9. Italiano JE Jr, Richardson JL, Patel-Hett S, Battinelli E, Zaslavsky A, Short S, Ryeom S, Folkman J, Klement GL. Angiogenesis is regulated by a novel mechanism: pro - and antiangiogenic proteins are organized into separate platelet α-granules and differentially released. Blood 2008; 111(3): 1227–1233.
10. Manegold PC, Hutter J, Pahernik SA, Messmer K, Dellian M. Plate-let-endothelial interaction in tumor angiogenesis and microcirculation. Blood 2003; 101(5): 1970–1976.
11. Khorana AA, Connolly GC. Assessing risk of venous thromboembolism in the patient with cancer. J Clin Oncol 2009; 27(29): 4839–4847.
12. Lyman GH, Khorana AA. Cancer, clots and consensus: new understanding of an old problem. J Clin Oncol 2009; 27(29): 4821–4826.
13. Tranum BL, Haut A. Thrombocytosis: platelet kinetics in neoplasia.J Lab Clin Med 1974; 84(5): 615–619.
14. Ikeda M, Furukawa H, Imamura H, Shimizu J, Ishida H, Masutani S, Tatsuta M, Satomi T. Poor prognosis associated with thrombocytosis in patients with gastric cancer. Ann Surg Oncol 2002; 9(3): 287–291.
15. Monreal M, Fernandez-Llamazares J, Piñol M, Julian JF, Broggi M, Escola D, Abad A. Platelet count and survival in patients with colorectal cancer – a preliminary study. Thromb Haemost 1998; 79(5): 916–918.
16. Symbas NP, Townsend MF, El-Galley R, Keane TE, Graham SD, Petros JA. Poor prognosis associated with thrombocytosis in patients with renal cell carcinoma. BJU Int 2000; 86(3): 203–207.
17. Gücer F, Moser F, Tamussino K, Reich O, Haas J, Arikan G, Petru E, Winter R. Thrombocytosis as a prognostic factor in endometrial carcinoma. Gynecol Oncol 1998; 70(2): 210–214.
18. Menczer J, Schejter E, Geva D, Ginath S, Zakut H. Ovarian carcinoma associated thrombocytosis. Correlation with prognostic factors and with survival. Eur J Gynaecol Oncol 1998; 19(1): 82–84.
19. Lopes A, Daras V, Cross PA, Robertson G, Beynon G, Monaghan JM. Thrombocytosis as a prognostic factor in women with cervical cancer. Cancer 1994; 74(1): 90–92.
20. Zeimet AG, Marth C, Müller-Holzner E, Daxenbichler G, Dapunt O. Significance of thrombocytosis in patients with epithelial ovarian cancer. Am J Obstet Gynecol 1994; 170(2): 549–554.
21. Estrov Z, Talpaz M, Mavligit G, Pazdur R, Harris D, Greenberg SM, Kurzrock R. Elevated plasma thrombopoietic activity in patients with metastatic cancer-related thrombocytosis. Am J Med 1995; 98(6): 551–558.
22. Salgado R, Vermeulen PB, Benoy I, Weytjens R, Huget P, Van Marck E, Dirix LY. Platelet number and interleukin-6 correlate with VEGF but not with bFGF serum levels of advanced cancer patients. Br J Cancer 1999; 80(5–6): 892–897.
23. Gastl G, Plante M, Finstad CL, Wong GY, Federici MG, Bander NH, Rubin SC. High IL-6 levels in ascitic fluid correlate with reactive thrombocytosis in patiens with epithelial ovarian cancer. Br J Haematol 1993; 83(3): 433–441.
24. Kaser A, Brandacher G, Steurer W, Kaser S, Offner FA, Zoller H, Theurl I, Widder W, Molnar C, Ludwiczek O, Atkins MB, Mier JW, Tilg H.Interleukin-6 stimulates thrombopoiesis through thrombopoietin: role in inflammatory thrombocytosis. Blood 2001; 98(9): 2720–2725.
25. Suzuki A, Takahashi T, Nakamura K, Tsuyuoka R, Okuno Y, Enomoto T, Fukumoto M, Imura H. Thrombocytosis in patients with tumors producing colony-stimulating factor. Blood 1992; 80(8): 2052–2059.
26. Suzuki A, Takahashi T, Okuno Y, Tsuyuoka R, Fukumoto M, Nakamura K, Imura H. IL-1 production as a regulator of G-CSF and IL-6 production in CSF-producing cell lines. Br J Cancer 1992; 65(4): 515–518.
27. Dymicka-Piekarska V, Kemona H, Guzinska-Ustymowicz K. Does surgery affect certain mediators of thrombocytopoiesis in patients with colorectal cancer? Hepatogastroenterology 2007; 54(77): 1407–1411.
28. dos Santos Silva I, De Stavola BL, Pizzi C, Meade TW. Circulating levels of coagulation and inflammation markers and cancer risks: individual participant analysis of data from three long-term cohorts. Int J Epidemiol 2010; 39(3): 699–709.
29. Dirix LY, Salgado R, Weytjens R, Colpaert C, Benoy I, Huget P, van Dam P, Prové A, Lemmens J, Vermeulen P. Plasma fibrin D-dimer levels correlate with tumour volume, progression rate and survival in patients with metastatic breast cancer. Br J Cancer 2002; 86(3): 389–395.
30. Lippi G, Franchini M, Biasiutti C, Dellagiacoma G, Salvagno GL, Guidi GC. Increased D-dimer value and occult cancer in the absence of detectable thrombosis. Haematologica 2007; 92(4): 53–55.
Další citace u autorky.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Kolorektální karcinom (část 1)
- EPMA summit
- Diabetes mellitus – oční komplikace
- Již počtrnácté plný Lékařský dům na konferenci Tabák a zdraví
- Doc. MUDr. Ivo Přerovský, DrSc. 1924–2014
- Vzpomínka na prof. MUDr. Zdeňka Reiniše, DrSc.
- Erratum
- ROSALYN SUSSMAN YALOWOVÁ
- Potenciální interakce mezi léčivy a doplňky stravy rostlinného původu*
- Plánované akce složek ČLS JEP
- Cirkulující nádorové buňky a prognóza karcinomu prostaty
- Krevní destičky v patogenezia léčbě solidních nádorů
- Plánované akce složek ČLS JEP
- Imunologické vlastnosti ženských slin a jejich vliv na pohyblivost spermií
- CREATIVE DESTRUCTION OF MEDICINE
- Vztah rizikových faktorů mezi metabolickým syndromem a nealkoholickým ztučněním jater u dětí a dospívajících
- OMLUVA
- Porodnicko-gynekologicky orientované texty v díle Jana Černého
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Krevní destičky v patogenezia léčbě solidních nádorů
- Imunologické vlastnosti ženských slin a jejich vliv na pohyblivost spermií
- Potenciální interakce mezi léčivy a doplňky stravy rostlinného původu*
- Cirkulující nádorové buňky a prognóza karcinomu prostaty
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



