-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Stanovení RHD genotypu plodu z plazmy periferní krve těhotné ženy a posouzení citlivosti nových diagnostických postupů pro zavedení do klinické praxe
RHD genotyping from cell-free fetal DNA circulating in pregnant women peripheral blood and sensitivity assessment of innovated diagnostic approaches for introduction into the clinical practice
Objective:
Introduction of fetal RHD genotyping from cell-free fetal DNA circulating in the peripheral blood of pregnant women to clinical practice. Sensitivity assessment of innovated method using range of dilution series and internal control of amplification.Design:
Procedure creating of noninvasive determination of fetal RHD genotyping from blood plasma of pregnant women. Detection of limit of minority representation RHD+/ - sample in the RHD-/ - sample.Setting:
University Hospital Olomouc, Institute of Medical Genetics and Fetal Medicine, Clinic of Obstetrics and Gynecology, Transfusion Department.Methods:
- TaqMan Real-Time PCR without an internal amplification controls.
- Optimization and calibration of RHD genotyping using RHD multiplex by TaqMan Real-Time PCR with an internal amplification control and by minisequencing (Snapshot – multiplex) with an internal amplification controls.
Results:
- RHD positive or negative fetuses were determined by amplification curves from Real-Time PCR system that matches the parameters for the evaluation of the output data using series of amplification and contamination parallel controls.
- TaqMan based Real-Time PCR and minisequencing (SNaPshot) based quantification were able to detect 0.22% of artificial RHD+/ - sample diluted in RHD-/ - sample. In addition, SNaPshot assay is suitable for heterozygozity and homozygozity recognition.
Conclusion:
Current established and routinely used procedure is based on the detection of exon 7 of the RHD gene and on the series of parallel amplification and contamination controls. Both newly developed methods could be, after validation of the larger set of control samples, introduced into clinical practice.Keywords:
RHD genotyping – cell-free fetal DNA – maternal plasma – TaqMan Real-Time PCR – SNaPshot – minisequencing
Autoři: J. Böhmová 1; R. Vodička 1; M. Lubušký 1,2; M. Studničková 3
; I. Holusková 3; R. Vrtěl 1; R. Kratochvílová 1; M. Frydrychová 1; E. Krejčiříková 1; H. Filipová 1
Působiště autorů: Ústav lékařské genetiky a fetální medicíny FN a LF UP, Olomouc, přednosta prof. MUDr. J. Šantavý, Ph. D. 1; Porodnicko-gynekologická klinika FN a LF UP, Olomouc, přednosta prof. MUDr. R. Pilka, Ph. D. 2; Transfuzní oddělení FN a LF UP, Olomouc, vedoucí MUDr. D. Galuszková, Ph. D., MBA 3
Vyšlo v časopise: Ceska Gynekol 2013; 78(1): 32-40
Souhrn
Cíl studie:
Vytvoření a zavedení metodického postupu pro neinvazivní stanovení RHD genotypu plodu z volné fetální DNA cirkulující v periferní krvi těhotné ženy do klinické praxe. Posouzení citlivosti inovované metodiky pomocí ředící řady a vnitřní kontroly amplifikace. Zjištění detekčního limitu minoritního zastoupení RHD+/ - genotypu ve vzorku RHD-/-.Typ studie:
Prospektivní kohortová a metodologická studie.Název a sídlo pracoviště:
Fakultní nemocnice Olomouc: Ústav lékařské genetiky a fetální medicíny, Porodnicko-gynekologická klinika, transfuzní oddělení.Metodika:
- TaqMan real-time PCR bez vnitřní kontroly amplifikace.
- Stanovení prahu citlivosti a kalibrace RHD multiplexu TaqMan real-time PCR multiplexem s vnitřní kontrolou amplifikace a kapilární elektroforézou – minisekvenací (SNaPshot – multiplex) s vnitřní kontrolou amplifikace.
Výsledky:
- RHD pozitivní nebo RHD negativní plod byl určen na základě amplifikačních křivek z real-time PCR systému, které odpovídají stanoveným parametrům pro hodnocení výstupních dat s využitím série kontrol amplifikace a kontaminace.
- Metody TaqMan real-time PCR systém a minisekvenace byly schopny detekovat 0,22% zastoupení RHD+/ - ve vzorku RHD-/-. Minisekvenační systém je vhodný k rozlišení RHD pozitivních homozygotů a heterozygotů.
Závěr:
V současné době námi zavedený postup založený na detekci exonu 7 genu RHD a sérii paralelních kontrol kontaminace a amplifikace je využívaný v klinické praxi. Obě nově vypracované metody by měly být spolehlivější a po validaci na rozsáhlejším souboru mohou být zavedeny do klinické praxe.Klíčová slova:
RHD genotypizace – volná fetální DNA – maternální plazma – TaqMan real-time PCR – SNaPshot – minisekvenaceÚVOD
Rh systém je nejvíce polymorfní a imunogenní skupinový systém. Antigeny Rh systému jsou kódovány dvěma geny RHD a RHCE. Oba geny jsou lokalizovány na dlouhém raménku chromozomu 1. Jsou složeny z 10 kódujících exonů a vykazují 97% identitu. Identita genů je dána jejich evolučním vznikem tandemovou duplikací. Identifikace přítomnosti RHD genu u plodu je založena na detekci unikátních sekvencí genu RHD, především exonu 7 [3]. RHD negativní genotyp u bělošské populace, a tedy i nepřítomnost antigenu D v membráně erytrocytů je dána delecí RHD genu v homozygotním stavu.
Pro neinvazivní prenatální RHD genotypizaci plodu se využívá nebuněčná fragmentovaná fetální DNA přítomná v plazmě těhotných žen. Procentuální zastoupení volné fetální DNA v plazmě gravidních žen je velmi variabilní a pohybuje se nejčastěji v rozmezí 5–10 % v závislosti na délce gravidity, velikosti placenty, hmotnosti ženy i plodu, patologickém těhotenství apod. [7]. Snahou laboratoře je diagnostikovat RHD genotyp plodu již v raném stadiu těhotenství, proto je nutné použít citlivou metodu detekce, jakou je např. real-time polymerázová řetězová reakce (PCR) [6].
Do současnosti však nebyla v České republice provedena studie, která by posoudila citlivost metodiky se zavedením a využitím vnitřní kontroly amplifikace pro účely neinvazivního stanovení RHD genotypu plodu pomocí kalibrační řady arteficiálních genotypických směsí.
Cílem práce je vytvoření a zavedení metodického postupu pro neinvazivní stanovení RHD genotypu plodu z volné fetální DNA cirkulující v periferní krvi těhotné ženy do klinické praxe. Posouzení citlivosti inovované metodiky pomocí ředicí řady a vnitřní kontroly amplifikace. Zjištění detekčního limitu minoritního zastoupení RHD+/ - genotypu ve vzorku RHD-/-.
SOUBOR A METODIKA
Soubor vzorků
Periferní krev od RHD negativních těhotných žen byla odebrána ve spolupráci s klinickými pracovníky Ústavu lékařské genetiky a fetální medicíny, Porodnicko-gynekologické kliniky a transfuzního oddělení Fakultní nemocnice Olomouc (FNOL). Všechny ženy, které byly zařazeny do studie, podepisovaly informovaný souhlas, schválený etickou komisí FNOL.
Počty analyzovaných vzorků jsou uvedeny níže u jednotlivých postupů.
Zpracování a izolace DNA po odběru vzorků
Od každé RHD negativní těhotné ženy byla odebrána krev do dvou 9ml zkumavek s EDTA (kyselina etylendiamintetraoctová). Nesrážlivá krev byla ihned po odběru umístěna na led a max. do 4 hodin po odběru zpracována. Plazma byla oddělena od buněčné frakce krve dvojí centrifugací. První centrifugace byla provedena při 2700 g 10 minutách, poté byla provedena separace plazmy a následná recentrifugace dvacet minut při 3500 g v centrifuze IEC Multi RF, Thermo IEC. Vzorky byly do dalšího zpracování zamraženy na -28 °C. Plazmatická DNA byla izolována vždy ve dvou paralelních zkumavkách („A“ a „B“). Izolace DNA z 1 ml plazmy byla provedena kitem QiaAmp DNA Mini Kit (Qiagen). Izolace maternální DNA a kontrolního souboru mužů z leukocytů periferní krve byla provedna automatickým izolátorem Qiacube (Qiagene) s využitím kitu QiaAmp DNA mini kit (Qiagene) podle instrukcí v manuálu.
TaqMan real-time PCR bez vnitřní kontroly amplifikace
Celkem bylo testováno 38 vzorků od RHD negativních těhotných žen v různých stadiích těhotenství v rozmezí 13. – 27. týdne gravidity. Plazmatická DNA („A“ i „B“) a DNA z leukocytů periferní krve byly analyzovány ve dvou paralelních reakcích. Sekvence použitých primerů pro RHD exon 7 byly forward GGGTGTTGTAACCGAGTGCTG, reverse CCGGCTCCGACGGTATC. Sekvence a značení TaqMan sondy pro RHD exon 7 byla FAM-CCCACAGCTCCATCATGGGCTACAA-BHQ1.
PCR směs pro DNA izolovanou z plazmy RHD negativních těhotných žen o objemu 25 μl obsahovala 12,5 µl Mastermixu (DyNAmo Probe qPCR Kit, Finnzymes), 0,05 µl 50× ROX (DyNAmo Probe qPCR Kit, Finnzymes), 1,5 µl forward primeru (10pmol) (Sigma), 1,5 µl reverse primeru (10pmol) (Sigma), 1 µl TaqMan sondy (10pmol) (Sigma), 8,5 µl DNA.
PCR směs pro DNA izolovanou z leukocytů RHD negativních těhotných žen o objemu 25 μl obsahovala 12,5 µl Mastermixu (DyNAmo Probe qPCR Kit, Finnzymes), 0,05 µl 50x ROX (DyNAmo Probe qPCR Kit, Finnzymes), 7,5 µl PCR vody (Top-Bio), 1,5 µl forward primeru (10pmol) (Sigma), 1,5 µl reverse primeru (10pmol) (Sigma), 1 µl TaqMan sondy (10pmol) (Sigma), 1 µl DNA (100 ng/µl).
Jako kontroly amplifikace a kontaminace byly použity vzorky DNA izolované z RHD pozitivní krve, RHD pozitivní fetální DNA izolované z plazmy a PCR voda pro kontrolu kontaminace PCR reakčních mixů. PCR podmínky byly 95 °C 15 min, (95 °C 15 s, 60 °C 60 s) 55×. Amplifikace byla provedena real-time PCR systémem Mx3005P (Stratagene). Pro vyhodnocení byl využit software MxPro - Mx3005P v3.00 Build 311 (Stratagene). Pro každou skupinu vzorků byly stanoveny prahové hodnoty tzv. Ct hodnoty (počet cyklů, při kterém fluorescence přesáhne prahovou hodnotu). Před odečtením byla naměřená fluorescence logaritmována.
Stanovení citlivosti u RHD multiplexů pomocí kalibračních křivek TaqMan real-time PCR systémem a kapilární elektroforézou
Do testování bylo zařazeno 15 kontrolních vzorků od RHD pozitivních mužů a 35 kontrolních vzorků od RHD negativních mužů. Pro stanovení prahu citlivosti byly vytvořeny arteficiální směsi genotypů vzájemným ředěním vzorků DNA prokázaného RHD pozitivního heterozygota a RHD negativního homozygota o koncentraci 5 ng/µl (naměřené s využitím kitu Quantifiler Human DNA Quantification Kit, Applied Biosystems) v rozmezí 0,22 % – 100 %. Pro amplifikaci a kvantifikaci multiplexu s vnitřní kontrolou amplifikace TaqMan real-time PCR systémem byly použity primery z exonu 7, jejich sekvence jsou forward GGGTGTTGTAACCGAGTGCTG a reverse CCGGCTCCGACGGTATC. Sekvence a značení TaqMan sondy pro RHD exon 7 bylo FAM-CCCACAGCTCCATCATGGGCTACAA–BHQ1.
Sekvence použitých primerů pro RHD exon 10 byly forward CCTCTCACTGTTGCCTGCATT, reverseAGTGCCTGCGCGAACATT. Sekvence a značení TaqMan sondy pro RHD exon 10 bylo VIC-TACGTGAGAAACGCTCATGACAGCAAAGTCT–BHQ1.
Pro vnitřní kontrolu amplifikace byly použity primery a sondy z lokusu AMELX/Y s následujícími sekvencemi forward CTGCTTCTCTGGTTGGAGTCA, reverse GGTGGTGCAGCCATCCA, TaqMan sonda AMELX Cy3-AACCATAGGAAGGTACTG-BHQ2, TaqMan sonda AMELY Cy5-AACCATAGGAAGAGTACTG-BHQ3.
PCR multiplex o objemu 12,5 μl obsahoval 6,25 µl Mastermixu (DyNAmo Probe qPCR Kit, Finnzymes), 0,05 µl 50× ROX (DyNAmo Probe qPCR Kit, Finnzymes), 1,5 µl forward a reverse multiplexu primerů (koncentrace primerů pro RHD exon 7 a RHD exon 10 byla 10pmol, koncentrace primerů pro AMELX/Y byla 20pmol) (Sigma), 1 µl multiplexu TaqMan sond (koncentrace sond pro RHD exon 7, RHD exon 10 a AMELY byla 5pmol, koncentrace sondy pro AMELX byla 15pmol) (Sigma), 3,75 µl PCR vody (Top-Bio), 0,5 µl DNA arteficiální směsi genotypů (0,22% – 100%) nebo 0,5 µl DNA kontrolních vzorků (100 ng/µl) nebo 0,5 µl PCR vody (kontrola kontaminace PCR reakčních mixů). PCR probíhala za následujících podmínek 95 °C 15 min, (95 °C 15 s, 60 °C 60 s) 55×. Amplifikace byla provedena real-time PCR systémem Mx3005P (Stratagene). Pro vyhodnocení byl využit software MxPro – Mx3005P v3.00 Build 311 (Stratagene).
Kvantifikace kapilární elektroforézou byla provedena pomocí minisekvenace (SNaPshot) multiplexu s vnitřní kontrolou amplifikace.
Použity byly následující sekvence primerů pro RHD exonu 7 a vnitřní kontrolu amplifikace forward CACAGCTCCATCARGGGCTA, reverse CCGGCTCCGACGGTATC, AMELX/Y forward CACTGCTGCTTCTCTGGTTGGAGTCA, reverse CACGGGGATGATTTGGTGGTGCAGC.
PCR multiplex o objemu 12,5 μl obsahoval 6,25 µl Combi PPP Master Mixu (Top-Bio), 5,25 µl PCR vody (Top-Bio), 0,5 µl forward a reverse multiplexu primerů (koncentrace primerů pro RHD exon 7 a AMELX/Y byla 10pmol) (Sigma), 0,5 µl DNA arteficiální směsi genotypů (0,22 % – 100 %) nebo 0,5 µl DNA kontrolních vzorků (100 ng/µl). PCR probíhala za následujících podmínek 95 °C 10 min, (95 °C 30 s, 63 °C 60 s, 72 °C 60 s) 35×, 72 °C 10 min. Amplifikace byla provedena v termocykleru C1000 (BIO-RAD). Enzymatické přečištění PCR produktů bylo provedeno pomocí exonukleázy I (Exonuclease – Thermo Scientific, Fermentas) a alkalické fosfatázy (Termo Scientific FastAP Thermosensitive Alkaline Phosphatase – Thermo Scientific, Fermentas) podle manuálu. Byly použity tyto SNaPshot primery: 14T-AGCACCAGCAGCACAATGTAG (pro RHD exon 7), GGGCTCGTAACCATAGGAAG (pro vnitřní kontrolu amplifikace AMELX/Y). Amplifikace byla provedena kitem ABI PRISM SNaPshot Multiplex Kit (Applied Biosystems) v termocycleru C1000 (BIO-RAD).
Přečištění sekvenačních PCR produktů bylo provedeno enzymaticky alkalickou fosfatázou Thermo Scientific FastAP Thermosensitive Alkaline Phosphatase (Termo Scientific, Fermentas) podle protokolu ABI PRISM SNaPshot Multiplex Kit (Applied Biosystems). Vlastní detekce a snímání dat proběhla na kapilární elektroforéze ABI PRISM 3130 (Applied Biosystems) za standardních podmínek. Analýza byla provedena pomocí programu Gene Mapper (Applied Biosystems). Kvantifikace byla měřena podílem relativní fluorescence (RFU) pomocí výšky píku AMELX a RHD7.
VÝSLEDKY
Interpretace pozitivních a negativních signálů v klinické praxi TaqMan real-time PCR bez vnitřní kontroly amplifikace
DNA izolovaná z RHD pozitivní krve je detekována v rozmezí 25–30 PCR cyklů. Empiricky jsme nastavili přijatelné rozmezí výsledků vyšetření pro stanovení RHD genotypu plodu z volné fetální DNA na 35–45 cyklů v obou paralelních PCR (pro vzorek „A“ i „B“). Pokud je Ct detekováno pod 30. PCR cyklem, potom signál odpovídá 100% příspěvku RHD pozitivních buněk. Pokud je Ct detekováno nad 50. PCR cyklem nebo není detekováno vůbec, potom se jedná o RHD negativní plod (neodpovídá asi 5% příspěvku volné fetální DNA).
V systému paralelních kontrol musí mít DNA matky z leukocytů periferní krve negativní signál, případně velmi slabý pozitivní signál (nad 50 PCR cyklů). Dále rozmezí PCR cyklů pro kontrolní RHD pozitivní fetální DNA z maternální plazmy je 35–45 cyklů a kontrolní DNA izolovaná z RHD pozitivní krve má pozitivní signál (25–30 cyklů). PCR voda jako kontrola kontaminace PCR reakčních mixů připravených pro DNA izolovanou z maternální plazmy a pro DNA izolovanou z krve musí mít negativní signál. Následující varovné kritické hodnoty vedou k opakování vyšetření: testované vzorky „A“ i „B“ jsou detekovány mezi 30–35 PCR cykly nebo mezi 45–50 PCR cykly. Pozitivní signál je detekován pouze v jednom vzorku („A“ nebo „B“). Kontroly amplifikace mají negativní signál. Kontroly kontaminace mají pozitivní signál. Vzorek DNA z leukocytů matky má pozitivní signál v obou PCR.
Na základě výše uvedených hodnotících kritérií bylo stanoveno 34 RHD pozitivních a 4 RHD negativních plodů (obr. 1).
Obr. 1. Ukázka rozlišení <i>RHD</i> pozitivního a <i>RHD</i> negativního plodu pomocí real-time polymerázové řetězové reakce (PCR). Amplifikační křivky znázorňují fluorescenční intenzitu exonu 7 genu <i>RHD</i> v závislosti na počtu PCR cyklů (Ct). <i>RHD</i>+ kontrola z krve: <i>RHD</i>+ DNA izolovaná z leukocytů periferní krve. <i>RHD</i>+ kontrola z plazmy: <i>RHD</i>+ DNA izolovaná z krevní plazmy těhotné <i>RHD</i>- ženy. <i>RHD</i>+ plod: <i>RHD</i>+ vzorky („A“a „B“) DNA izolované z krevní plazmy těhotné <i>RHD</i>- ženy. <i>RHD</i>- plod: <i>RHD</i>- vzorek DNA izolované z krevní plazmy těhotné <i>RHD</i> negativní ženy. Kontroly kontaminace PCR <i>RHD</i>: PCR mix pro DNA izolovanou z leukocytů s PCR vodou a PCR mix pro DNA izolovanou z plazmy s PCR vodou. 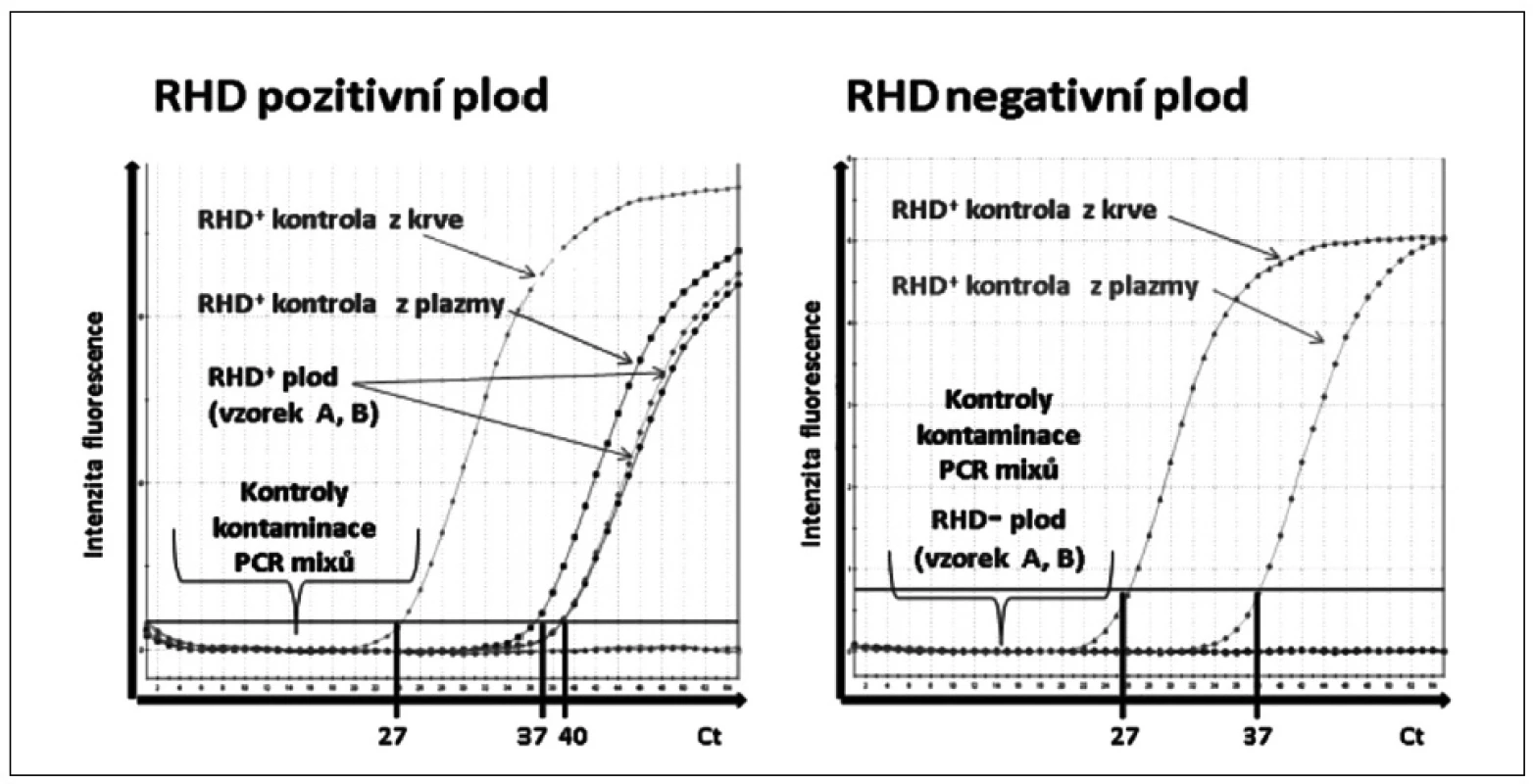
Stanovení citlivosti u RHD multiplexů pomocí kalibračních křivek
TaqMan real-time PCR multiplexový systém (AMELX, AMELY, RHD 7, RHD 10) byl schopen detekovat 0,22% arteficiální RHD+/ - směsi, přičemž 0,22% směsi odpovídal Ct signál z 48. PCR cyklu pro exon 7 (graf 1) a z 46. PCR cyklu pro exon 10 (graf 2). Směsím, které by mohly modelovat zastoupení fetálních molekul v plazmě (asi 5% – 10%), odpovídaly Ct signály od 39. – 41. PCR cyklu pro exon 7 (graf 1) a z 40. – 41. PCR cyklu pro exon 10 (graf 2). Kontrolní pozitivní vzorky byly detekovány v rozmezí PCR cyklů 33 – 35 (graf 1, 2).
Graf 1. Komparativní kvantifikace exonu 7 pomocí real-time polymerázové řetězové reakce. Komparativní kvantifikace kontrolních <i>RHD</i> pozitivních mužských DNA vzorků byla provedena pomocí standardní křivky exonu 7 z arteficiálních směsí <i>RHD</i> genotypů. ■ Arteficiální vzorky ředicí řady, ▲ <i>RHD</i> pozitivní mužské vzorky. 
Graf 2. Komparativní kvantifikace exonu 10 pomocí real-time polymerázové řetězové reakce (PCR). Komparativní kvantifikace kontrolních <i>RHD</i> pozitivních mužských DNA vzorků byla provedena pomocí standardní křivky exonu 10 z arteficiálních směsí <i>RHD</i> genotypů. ■ Arteficiální vzorky ředící řady, ▲ <i>RHD</i> pozitivní mužské vzorky. 
Kvantifikací založenou na minisekvenaci (SNaPshot) bylo možné detekovat 0,22 % arteficiál-ní RHD+/ - směsi (graf 3, obr. 2), přičemž podíl RFU hodnot AMELX/RHD7 byl 32,7.
Graf 3. Stanovení citlivosti detekce SNaPshot systémem. Stanovení citlivosti detekce s využitím minisekvenace (SNaPshot) pomocí <i>RHD</i> pozitivních vzorků arteficiálních genotypových směsí (<i>RHD</i>+/- mužské DNA a <i>RHD</i>-/- ženské DNA) kapilární elektroforézou. Osa y: kvantifikace byla provedena na základě podílu parametru RFU (relativní fluorescenční jednotka) <i>AMELX/RHD7</i>. RFU je vyjádřená výškou píku, od kterého je odečtena prahová fluorescence. Osa x: procentuální zastoupení <i>RHD</i>+/- genotypu v <i>RHD</i>-/- genotypu. 
Obr. 2. Ukázka citlivosti detekce SNaPshot systémem. Stanovení citlivosti detekce s využitím minisekvenace (SNaPshot) RHD pozitivních vzorků arteficiálních genotypových směsí (<i>RHD</i>+/- mužské DNA a <i>RHD</i>-/- ženské DNA) kapilární elektroforézou. V první až čtvrté řadě jsou ukázky 0,22%, 1,7%, 2,6% a 5,9% arteficiálních genotypových směsí. 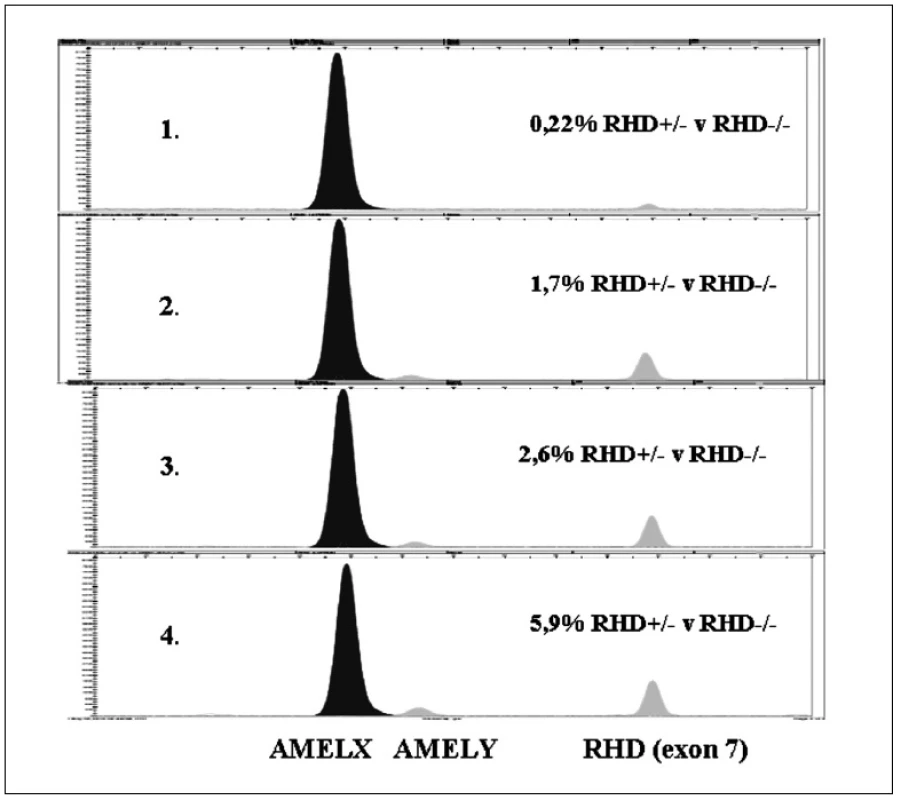
Směsím, které by mohly modelovat zastoupení fetálních molekul v plazmě (5 % – 10 %), odpovídaly podíly RFU hodnot 4,3 – 3,3. Pozitivní vzorky byly detekovány v rozmezí podílů RFU hodnot 2 – 1,8. Na základě podílů RFU hodnot RHD pozitivních vzorků bylo možno rozlišit RHD homozygoty a RHD heterozygoty (graf 4, obr. 3).
Graf 4. Rozlišení <i>RHD</i> pozitivního homozygota a heterozygota pomocí minisekvenace (SNaPshot). Rozlišení <i>RHD</i> pozitivního homozygota a heterozygota na základě podílů parametru RFU (relativní fluorescenční jednotka) <i>AMELX/RHD7</i>. 
Obr. 3. Ukázka rozlišení <i>RHD</i> genotypů pomocí minisekvenace (SNaPshot). 1. V první řadě je ukázka <i>RHD</i> pozitivního homozygota. 2. V druhé řadě je ukázka <i>RHD</i> heterozygota. 3. Ve třetí řadě je ukázka <i>RHD</i> negativního homozygota. 
DISKUSE
Stanovení RHD genotypu plodu (RHD+/RHD-) z krevní plazmy těhotných žen se v současnosti nejčastěji provádí metodou real-time PCR. Vzhledem k sekvenční unikátnosti je nejčastějším lokusem pro o určení RHD genotypu plodu exon 7 [5, 8, 9, 12]. Některé studie byly provedeny pouze na malém souboru vzorků [4, 12], nicméně výsledky na rozsáhlejších souborech prokázaly vysokou specificitu a senzitivitu. Müller a kol. testovali 1113 RHD negativních těhotných žen. Senzitivita stanovení RHD genotypu plodu byla 99,7 %, specificita 99,2 % [6].
Při izolaci a manipulaci s volnou fetální DNA hrozí riziko její kontaminace RHD pozitivní exogenní DNA. Tato kontaminace by vzhledem k malému množství volné fetální DNA mohla být interpretována jako falešně pozitivní výsledek při stanovení RHD genotypu plodu. Avšak falešná pozitivita nepředstavuje zvýšené riziko rozvoje erytrocytární aloimunizace u RHD negativní těhotné ženy ani nepředstavuje zvýšené riziko rozvoje hemolytické nemoci plodu a novorozence u již aloimunizované těhotné ženy. Zvýšené riziko chybného klinického managementu pro těhotnou ženu, plod i novorozence představuje jen falešná negativita. Z tohoto důvodu je nutné používat sérii kontrol amplifikace a kontaminace (obr. 1) a přesně nastavit hraniční a kritické parametry pro hodnocení výstupních dat. Použití vnitřní kontroly amplifikace (β-globin, SRY u plodů mužského pohlaví) pomáhá snížit riziko falešně negativního výsledku [6, 9].
Námi zvolený postup využívaný v klinické praxi je v současnosti založený na detekci signálu z exonu 7 a dále na řadě paralelních kontrol, které by měly zabezpečit, že vzorek není kontaminován a zároveň je DNA amplifikovatelná. Empiricky nastavené hodnoty jsou ve shodě s našimi výstupy z měření pomocí standardních kalibračních křivek.
Práce zabývající se neinvazivním stanovením RHD genotypu plodu se zaměřují na uniplexové [1, 4] nebo multiplexové systémy [2, 6, 9]. Použití multiplexového systému (např. exon 5, exon 7 a exon 10) je vhodné i zvýšení validity výsledku RHD genotypizace plodu. Dalším využívaným systémem pro detekci RHD genotypů je minisekvenace (SNaPshot). Metoda je založena na prodloužení primerů rozdílných délek o jednu bázi (fluorescenčně značeného dideoxynukleotidu). Kapilární elektroforézou je poté určena délka prodlouženého primeru a typ fluorescenční značky. Tato metoda je vhodná pro multiplexové reakce [10, 11].
Pro stanovení prahu citlivosti detekce TaqMan real-time PCR systémem a minisekvenací (SNaPshot) byla provedena RHD kalibrace pomocí ředicí řady vhodných RHD genotypů. Oběma metodami bylo možné zachytit 0,22% příměs RHD pozitivního heterozygota v RHD negativním homozygotovi (graf 1–3, obr. 2). V rámci optimalizací byla testována možnost detekovat RHD genotyp TaqMan real-time multiplexovým systémem pomocí různě značených sond pro RHD7/RHD10/AMELX/AMELY. Dále byla metodika rozšířena o analýzu RHD genotypu pomocí minisekvenace kapilární elektroforézou v rámci jedné multiplexové RHD7/AMELX/AMELY reakce. Obě metody správně a shodně stanovily všechny pozitivní a negativní kontrolní vzorky u sledovaného souboru.
Na základě minisekvenace bylo navíc možné rozlišit RHD pozitivní homozygoty od heterozygotů (graf 4, obr. 3).
ZÁVĚR
V současné době námi zavedený postup založený na detekci exonu 7 genu RHD a sérii paralelních kontrol kontaminace a amplifikace je využívaný v klinické praxi. Obě nově navržené metody budou dále posuzovány na reprezentativním souboru vzorků a kontrol (500 těhotných RHD negativních žen, 200 RHD pozitivních a 200 RHD negativních kontrolních vzorků) a plánujeme jejich využití v rutinní klinické praxi.
Podpořeno grantem IGA MZ ČRNT-11004-3/2010, NT-12225-4/2011.
Mgr. R. Vodička, Ph.D.
Ústav lékařské genetiky a fetální medicíny
Fakultní nemocnice Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: vodickar@fnol.cz
Zdroje
1. Gautier, E., Benachi, A., Giovangrandi, Y., et al. Fetal RhD genotyping by maternal serum analysis: a two-year experience. Am J Obstet Gynecol, 2005, 192, 3, p. 666–669.
2. Chinen, PA., Nardozza, LM., Martinhago, CD., et al. Noninvasive determination of fetal rh blood group, D antigen status by cell-free DNA analysis in maternal plasma: experience in a Brazilian population. Am J Perinatol, 2010, 27, 10, p. 759–762.
3. Innan, H. A two-locus gene conversion model with selection and its application to the human RHCE and RHD genes. Proc Natl Acad Sci U S A, 2003, 100, 15, p. 8793–8798.
4. Lázár, L., Nagy, B., Bán, Z., et al. Non invasive detection of fetal Rh using real-time PCR method. Orv Hetil, 2007, 148, 11, p. 497–500.
5. Macher, HC., Noguerol, P., Medrano-Campillo, P., et al. Standardization non-invasive fetal RHD and SRY determination into clinical routine using a new multiplex RT-PCR assay for fetal cell-free DNA in pregnant women plasma: results in clinical benefits and cost saving. Clin Chim Acta, 2012, 413, 3–4, p. 480–484.
6. Müller, SP., Bartels, I., Stein, W., et al. The determination of the fetal D status from maternal plasma for decision making on Rh prophylaxis is feasible. Transfusion, 2008, 48, 11, p. 2292–2301.
7. Palomaki, GE., Kloza, EM., Lambert-Messerlian, GM., et al. DNA sequencing of maternal plasma to detect Down syndrome: an international clinical validation study. Genet Med, 2011, 13, 11, p. 913–920.
8. Sedrak, M., Hashad, D., Adel, H., et al. Use of free fetal DNA in prenatal noninvasive detection of fetal RhD status and fetal gender by molecular analysis of maternal plasma. Genet Test Mol Biomarkers, 2011, 15, 9, p. 627–631.
9. Scheffer, PG., van der Schoot, CE., Page-Christiaens, GC., et al. Noninvasive fetal blood group genotyping of rhesus D, c, E and of K in alloimmunised pregnant women: evaluation of a 7-year clinical experience. BJOG, 2011, 118, 11, p. 1340–1348.
10. Silvy, M., Simon, S., Gouvitsos, J., et al. Weak D and DEL alleles detected by routine SNaPshot genotyping: identification of four novel RHD alleles. Transfusion, 2011, 51, 2, p. 401–411.
11. Silvy, M., Chapel-Fernandes, S., Callebaut, I., et al. Characterization of novel RHD alleles: relationship between phenotype, genotype, and trimeric architecture. Transfusion, 2012, elektronické verze před tiskem doi: 10.1111/j.1537-2995.2011.03544.x.
12. Wang, XD., Wang, BL., Ye, SL., et al. Non-invasive foetal RHD genotyping via real-time PCR of foetal DNA from Chinese RhD-negative maternal plasma. Eur J Clin Invest, 2009, 39, 7, p. 607–617.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článok vyšiel v časopiseČeská gynekologie
Najčítanejšie tento týždeň
2013 Číslo 1- Ne každé mimoděložní těhotenství musí končit salpingektomií
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Mýty a fakta ohledně doporučení v těhotenství
- Gynekologické potíže pomáhá účinně zvládat benzydamin
-
Všetky články tohto čísla
- Zápis ze schůze výboru Endoskopické sekce ČGPS
- Programové prohlášení výboru „Sekce gynekologické endoskopie ČGPS ČLS JEP“
- Pracovní skupina pro porodnictví Ministerstva zdravotnictví České republiky
- Vzpomínka na prof. MUDr. Františka Gazárka, CSc.
-
MUDr. Čeněk Born, CSc.
Krátké připomenutí životního jubilea - Olomouc má tu čest uspořádat jubilejní XXX. celostátní konferenci Sekce perinatální medicíny České gynekologické a porodnické společnosti ČLS JEP
- Udělení čestného členství České gynekologicko-porodnické společnosti ČLS JEP profesorovi MUDr. Miloši Mlynčekovi, CSc.
- Stav kostní minerální denzity po mnohaleté aplikaci antikoncepce Depo-Provery
- Robotem asistovaná radikální hysterektomie ve fázi „learning curve“ a její srovnání se standardní laparoskopicky asistovanou radikální vaginální a otevřenou radikální hysterektomií
- Sakrospinální fixace prolabovaného poševního pahýlu po hysterektomii sec. Miyazaki – dlouhodobé výsledky
- Editorial
- Stanovení RHD genotypu plodu z plazmy periferní krve těhotné ženy a posouzení citlivosti nových diagnostických postupů pro zavedení do klinické praxe
- Historie Porodnicko-gynekologické kliniky v Olomouci
- Porody dětí nízké a velmi nízké porodní hmotnosti ve Fakultní nemocnici v Olomouci (1993–2011)
- Incidence erytrocytární aloimunizace u těhotných žen v olomouckém regionu
- Epidemiologie a management poruch štítné žlázy v těhotenství
- Vliv délky kultivace embryí s pomalým nástupem dělení na úspěšnost IVF
- Výskyt vybraných geneticky podmíněných trombofilních markerů u pacientek podstupujících léčbu neplodnosti
- Možnosti objektivizace tkáňového traumatu u operací pro karcinom endometria
- Erytrocytární aloimunizace těhotných žen, klinický význam a laboratorní diagnostika
- Poruchy funkce štítné žlázy v těhotenství
- Česká gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Vliv délky kultivace embryí s pomalým nástupem dělení na úspěšnost IVF
- Sakrospinální fixace prolabovaného poševního pahýlu po hysterektomii sec. Miyazaki – dlouhodobé výsledky
- Erytrocytární aloimunizace těhotných žen, klinický význam a laboratorní diagnostika
- Robotem asistovaná radikální hysterektomie ve fázi „learning curve“ a její srovnání se standardní laparoskopicky asistovanou radikální vaginální a otevřenou radikální hysterektomií
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



