-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Stav kostní minerální denzity po mnohaleté aplikaci antikoncepce Depo-Provery
Status of bone mineral density after the long-standing application of contraception Depo-Provera
Objective:
The objective of this study was to assess bone mineral density (BMD) on a cohort of women who used depot medroxyprogesterone acetate (DMPA) (Depo-Provera) contraception uninterruptedly between 3 and 10 years.Design:
Retrospective study with review of the literature.Settings:
Office gynecology Velké Meziříčí; Osteocentrum Brno; Department of Obstetrics and Gynecology, Hospital Nové Město na Moravě.Methods:
The study included 21 healthy women aged between 26 and 43 years (the mean age 31 years) who started long-term continual application of depot medroxyprogesterone acetate (DMPA) in contraception (Depo-Provera) (the mean time of using 7 years, range 3–10 years). The women underwent lumbar spine, hip, femoral neck and forearm BMC (g) (bone mass content), BMD (g/cm2)(bone mass density), T-score, PR (%) (peak reference), Z-score, AM (%)(age matched) evaluation using Hologic dual-energy X-ray absorptiometry.
Age of women, time of application of Depo-Provera and body mass index (BMI) were collected.
Randomly from this cohort of users DMPA (n = 11) were determined levels of serum folicle stimulating hormone (FSH) and estradiol (E2), mostly shortly before next application of DMPA.Results:
At average 7 years of treatment, as compared to baseline, the mean BMD of DMPA users was in total lumbar spine AM (age matched) 96.48%, total hip AM 100%, femoral neck AM 97.62%, total forearm (radius+ulna) AM 99.81%.
Concentrations of serum estradiol varied from 94.3–294 pmol/l (25.7–80.1 pg/ml) with average level 190.3 pmol/l(51.9 pg/ml), seen in the early follicular phase.Conclusion:
There are probably several reasons, but not at least, why mean bone loss even after long use of DMPA is low.
The loss of BMD is more pronounced during the first 2 years of use DMPA and its fall subsequently gradually stabilises due to new balance between extrinsic and intrinsic factors that influence bone resorption and formation. After the two years bone loss in DMPA users nears under 1% per year and practically copies level of physiological bone loss.
Another hypothetical compensation mechanisms of bone remodelling in the hypoestrogenic time during DMPA use may be reason of higher levels of BMD 4–5 years after discontinuing the use of contraceptive injections than that of nonusers (rebound phenomenon).Keywords:
depot medroxyprogesterone acetate (DMPA) – bone mineral density (BMD) – long-term use – Depo-Provera – skeletal health – rebound phenomenon – contraception
Autoři: S. Zeman 1; P. Havlík 2; J. Zemanová 1; D. Němec 3
Působiště autorů: Gynekologická ambulance, Velké Meziříčí, MUDr. S. Zeman 1; Osteocentrum, Brno, MUDr. MVDr. J. Slesinger 2; Gynekologicko-porodnické oddělení, Nemocnice Nové Město na Moravě, přednosta prim. MUDr. J. Hrdina 3
Vyšlo v časopise: Ceska Gynekol 2013; 78(1): 116-124
Dynamika kostních změn před, po nasazení a po vysazení depotníhomedroxyprogesteron acetátu ve všech věkových skupinách. Rebound fenomén.
Recentní pohledy na preskripci tohoto generika.Souhrn
Cíl:
Vyhodnotit stav kostní minerální denzity (BMD)po 3-10leté kontinuální aplikaci antikoncepce depotního medroxyprogesteron acetátu (DMPA) (Depo-Provera).Typ studie:
Retrospektivní analýza, souhrnný přehled.Název a sídlo pracoviště:
Gynekologická ambulance, Velké Meziříčí; Osteocentrum Brno; Gynekologicko-porodnické oddělení, nemocnice Nové Město na Moravě.Metodika:
U zdravých žen (n = 21), které ve věkovém rozmezí 26 a 43 let (průměr 31 let) nastartovaly dlouhodobou kontinuální aplikaci antikoncepce depotní medroxyprogesteron acetát (Depo-Provera) (průměrná doba užívání 7 let, rozmezí 3–10 let), byly vyšetřeny na denzitometru Hologic (DXA scanner dual X-ray absorptiometry) BMC (g) (bone mass content), BMD (g/cm2) (bone mass density), T-score, PR (%) (peak reference), Z-score,AM (%) (age matched).
Byl vyhodnocen věk, délka aplikace Depo-Provery a body mass index (BMI).
U náhodně vybraných pacientek z této skupiny(n = 11) byly v průběhu aplikace DMPA nárazově stanoveny hladiny sérového estradiolu E2 (p/mol/l) a folikulostimulačního hormonu FSH (U/l), a to převážně krátce před další aplikací.Výsledky:
Během střední doby 7 let kontinuální aplikace Depo-Provery dosahovaly průměrné hodnoty BMD příslušící na normálové křivce referenční hodnotě k danému věku (AM – age matched) pro total lumbar spine 96,48 %, total hip 100,00 %, femoral neck 97,62 % a total předloktí (radius+ulna) 99,81 %.
Hladiny sérového estradiolu E2 dosahovaly průměru 190,3 pmol/l (rozmezí 94,3-294 pmol/l) odpovídající hodnotám časné folikulární fáze.Závěr:
Je pravděpodobně několik důvodů, proč je průměrná kostní ztráta, i po dlouhodobé aplikaci DMPA, nízká.
K největší ztrátě BMD dochází během prvních 1–2 let aplikace DMPA, následné poklesy hodnot BMD zpomalují v čase a stabilizují se, patrně dosažením jiné úrovně rovnováhy intrinsic a extrinsic faktorů, ovlivňujících resorpci a formaci kostní hmoty.
Kostní ztráta se v následujících letech u uživatelek DMPA hodnotou menší než 1 % ročně blíží hodnotě standardní fyziologické ztráty kostní hmoty a rok.
Přítomnost i jiných remodelačních kompenzačních mechanismů v hypoestrinním období aplikace DMPA mohou být důvodem vyšších hodnot BMD 4–5 let od vysazení DMPA ve srovnání s neuživatelkami (rebound fenomén).Klíčová slova:
depotní medroxyprogesteron acetát (DMPA) – kostní minerální denzita (BMD) – dlouhodobá aplikace – Depo-Provera – kostní zdraví – rebound fenomén – antikoncepceÚVOD
Depotní medroxyprogesteron acetát (DMPA) je běžně dostupnou jedinou formou injekční antikoncepce. Byla vyvinuta v roce 1960 farmaceutickou firmou The Upjohn Company jako čistě progestinová reverzibilní metoda antikoncepce. Do klinické praxe byla zavedena v roce 1967. Aktuálně je dostupná ve dvou formách: 150 mg/1 ml pro intramuskulární aplikaci (IM) (Depo-Provera) a 104 mg/0,65 ml pro subkutánní aplikaci (SC) (Sayana). Obě varianty jsou aplikovány v tříměsíčních intervalech.
Jedním z mechanismů kontracepčního účinku DMPA je inhibice sekrece gonadotropinů s následným zablokováním folikulárního vývoje a ovulace, která je u DMPA úplná. Žena se dostává do hypoestrinního stavu s následně nízkými hladinami progesteronu z důvodu potlačené ovulace [27].
Dlouhodobým kontroverzním tématem v odborné i laické veřejnosti, odborných společnostech, regulačních institucích a farmaceutických firem a ve svém důsledku zakotveným i v aktuálním Souhrnu údajů o přípravku, je diskutovaná problematika remodelace kostní hmoty po navozeném hypoestrogenismu u uživatelek DMPA s komentovanou nižší kostní minerální denzitou (BMD) a s tím spojenou nutností nebo vhodností restrikce doby užívání.
V tomto kontextu 17. 11. 2004 US FDA (The United States Food and Drug Administration) vydala oficiální stanovisko k možné kostní ztrátě v čase u uživatelek Depo-Provery včetně nejasnosti kolem reverzibility těchto změn, s akcentací období adolescence a časné dospělosti, s doporučením přehodnotit po dvou letech užívání indikaci další aplikace [53].
Situaci kolem DMPA po vyjádření US FDA i v kontextu doporučení World Health Organization (WHO) z 9/2005 [55] navíc zkomplikoval následný návrh firmy Pfizer, aby lékaři testovali po dvouleté aplikaci DMPA uživatelkám BMD.
Farmaceutická firma Pfizer písemně seznámila s příslušným vyjádřením i praktikující gynekology v České republice. Závěry US FDA jsou aktuálně součástí českého Souhrnu údajů o přípravku (Depo-Provera, datum revize textu 22. 7. 2009).
Výsledkem bylo znejistění a obava lékařů první linie a omezení preskripce DMPA.
Podle přehledu amerických porodníků a gynekologů vyjádření US FDA vedlo k restrikci v délce užívání DMPA a v indikování BMD vyšetření u uživatelek DMPA v reprodukčním věku [38]. Ve Spojeném království 16 % lékařů v první linii uvedlo, že by všem ženám rozmluvili užívání DMPA, další třetina lékařů by rozmluvila užívání DMPA mladým pacientkám a každý pátý lékař by omezil aplikaci DMPA na 2 roky [20].
Přestože nejsou k dispozici data o chování českých lékařů v indikaci DMPA antikoncepce, dá se předpokládat, že jejich reakce byla obdobná a je zřejmé, že obecné povědomí z obavy o kostní zdraví uživatelek v kontextu původního stanoviska US FDA přetrvává, včetně nejistoty délky aplikace a nutnosti testovat kostní minerální denzitu (BMD). Velmi konzervativní přístup přetrvává také v preskripci tohoto generika pro věkové skupiny adolescentů a mladých dospělých (12–18 let) [55] z obavy nevratného zásahu do fyziologického období nárůstu kostní hmoty a žen v preklimakteriu (po 45. roce věku) z obavy dlouhodobého nezvratného rizika nízké BMD po menopauze s příslušnými zdravotními konsekvencemi.
SOUBOR ŽEN A METODIKA
Do studie bylo zařazeno 21 zdravých dlouhodobých uživatelek antikoncepce i.m. formy depotního medroxyprogesteron acetátu (Depo-Provera), které po několikaleté aplikaci využily možnost neobligatorní kontrolní jednorázové denzitometrie. Výchozí stav BMD před nasazením DMPA nebyl vyšetřován. Průměrný věk při nasazení DMPA byl 31 let (rozmezí 26–43 let). Průměrná doba nepřerušované aplikace DMPA v době denzitometrie dosahovala 7 let (rozmezí 3–10 let). Věkový průměr v době denzitometrie dosahoval 38 let (rozmezí 33–51 let). Denzitometrická vyšetření byla provedena v rámci jednoho pracoviště (Osteocentrum, Hybešova, Brno) na denzitometru Hologic (DXA scanner dual X-ray absorptiometry), BMC (g) (bone mass content), BMD (g/cm2) (bone mass density), T-score, PR (%) (peak reference), Z-score, AM (%) (age matched), a to v pozicích lumbar spine (L1-L4), hip (neck, troch, inter, Ward´s) a forearm (1/3, mid, ud).
Kontrolovaná dokumentovaná aplikace DMPA byla prováděna autorkou studie.
Uživatelky DMPA neudávaly před nasazením ani během aplikace onemocnění kostí v souvislosti s kostní denzitou, před nasazením nebylo u žádné z žen zjištěno vysoké premenopauzální riziko osteo-porotických zlomenin (osteogenesis imperfecta, dlouhodobé užívání glukokortikoidů, chronický hypoestrogenismus). U žádné z žen nebyla prováděna v průběhu aplikace DMPA preventivní suplementace kalciem nebo vitaminem D, nebyla prováděna rutinní preskripce estrogenové suplementace nebo anti-osteoporotických léků (bifosfonáty). Všechny ženy byly a jsou v rámci zavedené ambulantní praxe při nasazení a při pravidelných ročních gynekologických prohlídkách opakovaně upozorňovány ošetřujícím lékařem na riziko snížení kostní minerální denzity při hypoestrogenismu navozeném dlouhodobou aplikací Depo-Provery a vhodnosti zaměření na stravu bohatou na vápník, udržování fyzické aktivity a expozici slunci.
U náhodně vybraných pacientek z této skupiny (n = 11) byly v průběhu aplikace DMPA nárazově stanoveny hladiny sérového estradiolu E2 (p/mol/l) a folikulostimulačního hormonu FSH (U/l), a to převážně krátce před další aplikací.
VÝSLEDKY
Výsledky měření jsou podrobně zachyceny na grafech 1–7 a v tabulce 1.
Graf 1. Estradiol E2 průměr 190,3 pmol/l (rozmezí 94,3–294 pmol/l) (n=11). Hladiny sérového estradiolu (E2) (pmol/l) u dlouhodobých uživatelek Depo-Provery na úrovni časné folikulární fáze (interval pro folikulární fázi 77–921 pmol/l). 
Graf 2. Folikulostimulační hormon (FSH) průměr 6,09 U/l (rozmezí 2,86–20,00 U/l) ( n= 11). Hladiny sérového folikulostimulačního hormonu (FSH) (U/l) u dlouhodobých uživatelek Depo-Provery (interval pro folikulární fázi 3,35–21,63 U/l) 
Graf 3. Rozložení kostní minerální denzity (BMD) u zdravých žen ve věku 30-40 let. Správná interpretace denzitometrických křivek vychází z Gaussova rozložení populace a jeho BMD. Střední křivka představuje hodnotu BMD, která přísluší vrcholu Gaussovy křivky, tzn. je to hodnota BMD, která byla získána statistickým zpracováním dat a je to hodnota, s kterou se dále pracuje při výpočtu T (Z)-score. Horní a dolní křivka v tomto grafu je potom v Gaussově rozložení interpretována jako +1SD resp. – 1 SD od Gaussova rozložení. V praxi to znamená, že pole, které je vymezeno horní a dolní křivkou pokrývá asi 68 % populace. Střední křivka potom reprezentuje optimální hodnotu BMD zdravého pacienta pro daný věk (tj. vrchol křivky Gaussova rozložení), který nemá BMD ani nadhodnocené, ani podhodnocené. Z-skore jsou definované jako hodnota standardních odchylek (SD) od průměrné BMD zdravých žen příslušného věku. 
Graf 4. AP Spine – Total BMD pro všechny sledované pacientky užívající antikoncepci Depo-Provera. T-score průměr: -0,54 (rozptyl +1,2–2,1) PR* BMD (%) průměr: 94,33 (rozptyl 82–112) Z-score průměr: -0,33 (rozptyl +1,2–1,7) AM* BMD (%) průměr: 96,48 (rozptyl 82–113) 
*AM (%) (age matched) (vztah BMD k referenční hodnotě daného věku na normálové křivce) *PR (%) (peak reference) (vztah k maximální hodnotě BMD na normálové křivce) Graf 5. Hip – Total BMD pro všechny sledované pacientky užívající antikoncepci Depo-Provera T-score průměr: -0,17 (rozptyl +0,9–2,4) PR BMD (%) průměr: 97,95 (rozptyl 76–114) Z-score průměr: 0,00 (rozptyl +1,3–1,9) AM BMD (%) průměr: 100,00 (rozptyl 78–119) 
Graf 6. Femoral Neck – BMD pro všechny sledované pacientky užívající antikoncepci Depo-Provera T-score průměr: -0,47 (rozptyl +1,2–2,1) PR BMD (%) průměr: 94,10 (rozptyl 76–111) Z-score průměr: -0,33 (rozptyl +0,9–2,4) AM BMD (%) průměr: 97,62 (rozptyl 85–114) 
Graf 7. Forearm – 1/3 Radius+Ulna– BMD pro všechny sledované pacientky užívající antikoncepci Depo-Provera T-score průměr: -0,40 (rozptyl +0,3–1,5) PR BMD (%) průměr: 96,81 (rozptyl 84–102) Z-score průměr: - 0,08 (rozptyl +1,0–1,2) AM BMD (%) průměr: 99,81 (rozptyl 87 – 107) 
Tab. 1. Úplný seznam, bez rozdílu BMI, všechny scany 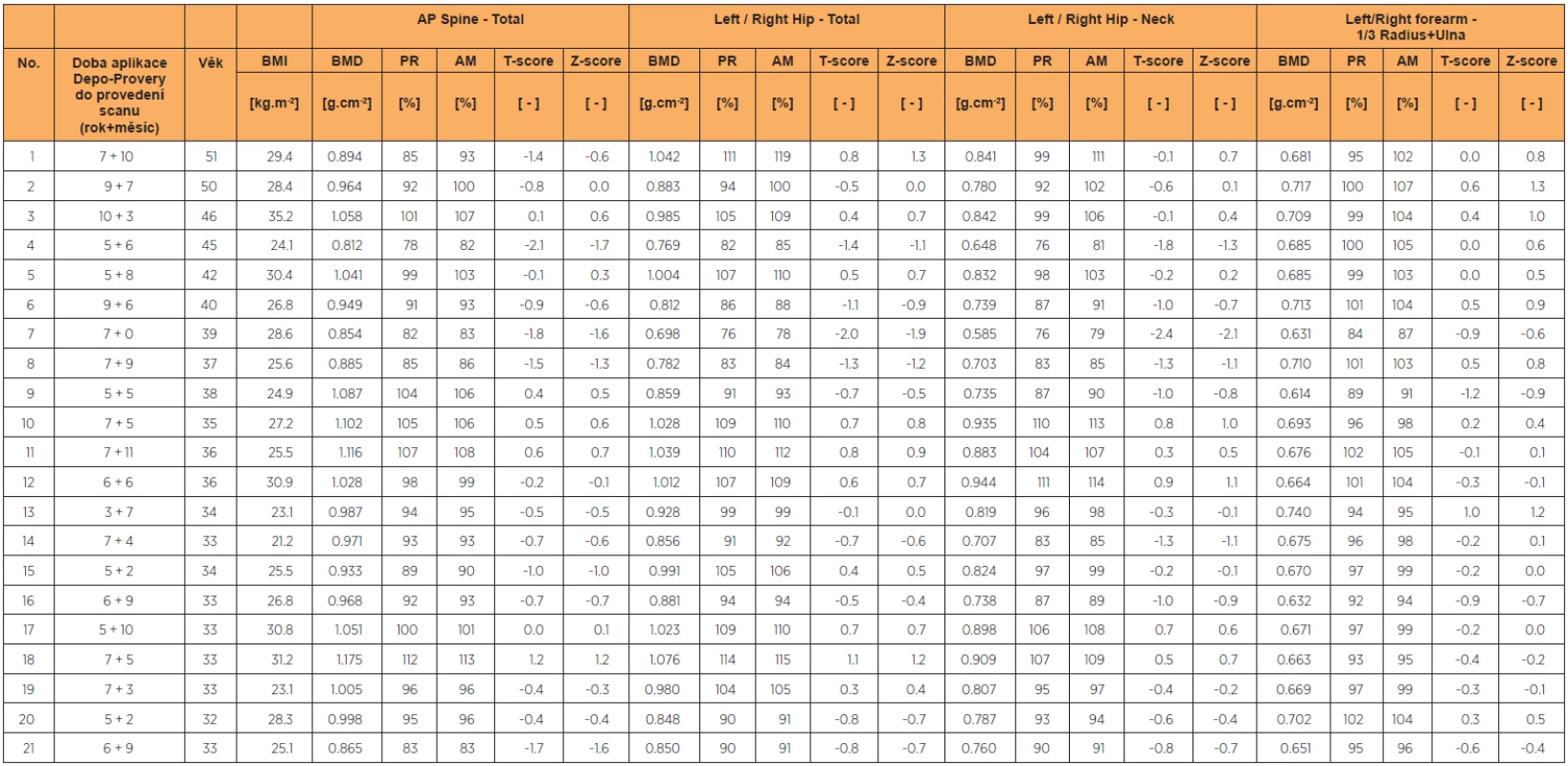
Věk. průměr v době denzitometrie 38+6/12 let (rozmezí 33–51 let) (n = 21) Délka kontinuální aplikace Depo-Provery průměr 7 let (rozmezí 3–10 let) (n = 21) Body mass index (BMI) průměr 27,24 kg/m2 (rozmezí 21,22–31,22 kg/m2) (n = 21) Studie souborně prezentuje především v průměrných hodnotách jednorázového denzitometrického vyšetření obecný status kostního zdraví u kohorty dlouhodobých uživatelek DMPA. Neumožňuje a nebylo smyslem popsat z důvodu absence dat o BMD před nasazením DMPA rozsah změn BMD po nasazení, ani důvody individuálního rozptylu hodnot u jednotlivých uživatelek.
DISKUSE
Kost je aktivní tkáň, která kontinuálně prochází remodelačním procesem zahrnujícím resorpci (osteoklastickou aktivitu) a novotvorbu kosti(osteoblastickou aktivitu). Kostní minerální denzita (BMD) v jakémkoliv časovém období reflektuje rovnováhu mezi osteoklastickou a osteoblastickou aktivitou [34].
Před menarche je skeletální růst ovlivněn růstovým hormonem, insulin-like růstovými faktory a dalšími faktory [13].
Během adolescence a časné dospělosti jsou po dobu asi 10 let zásadním faktorem pro stimulaci rychlého nárůstu kostní hmoty a skeletální růst estrogeny. V období 4 let od menarche získají ženy přibližně 1/3 celkového vrcholového objemu BMD, peak je dosažen v období mezi 25.–35. rokem věku [13]. Akumulace kostní hmoty je po 16. roku věku ale limitovaná [52] a minimálně 90 % vrcholu kostní hmoty je dosaženo do věku 18 let [3]. Dlouholetá studie z roku 2007 dokonce definovala dosažení plateau kostní hmoty u žen v 17 letech, u chlapců v 19 letech [4].
Jakmile je dosaženo vrcholu BMD, začíná pomalu převažovat kostní resorpce nad kostní novotvorbou a dochází k přibližné ztrátě 0,7 % kostní hmoty ročně. Tato ztráta akceleruje po menopauze, kdy nedostatek estrogenů vede k nevyvážené osteoklastické aktivitě a kostní resorpci – na skeletu dochází ke kostním ztrátám přibližně 1–1,5 % (ale i 6 % během 3 let časné postmenopauzy [18]) ročně z celkové kostní hmoty během prvních 5 let po menopauze [34, 48].
Celkem 70–80 % lidského peaku kostní hmoty je determinováno intrinsic faktory (pohlaví, geneticko/etnické vlivy, parathormon); zbylý podíl je ovlivněn extrinsic faktory, jako je příjem kalcia a stav vitaminu D, medikace, fyzická aktivita, tělesná hmotnost a chování alterující hormonální prostředí, a významně tak modifikují parametry kostního zdraví.
Navození hypoestrinního stavu po nastartování aplikace DMPA je významným zásahem do remodelačních procesů v kosti.
V prvním roce aplikace DMPA dochází k poklesu BMD v jednotlivých kostních lokacích o 0,4–4,0 % [1, 5, 9, 15, 16, 17, 19, 21, 30], ve druhém roce aplikace o 1,5 až 3,2 % [5, 16, 19, 21], ve třetím roce 0,5–2,0 % [41].
Rozsah celkových ztrát BMD po dvouleté aplikaci DMPA dosahuje 0,7–7,5 % [1, 5, 12, 16, 19, 21, 30, 41], po 2–4 letech aplikace 1,5–7,7 % [5, 6, 11, 12, 16, 32, 46, 47].
Číňanky ve věkovém rozmezí 37–49 let, užívajících DMPA více než 5 let, vykazovaly roční ztrátu BMD v LS 0,44 %, FN 0,40 % a 1,05 % ve Wardově trianglu [50].
V jiné studii u Číňanek s průměrným věkem 43 let a délkou užívání DMPA 5–15 let nebyly zjištěny signifikantně snížené BMD v páteři a pánvi ve srovnání s neuživatelkami [49]. V této kohortě byla dále prospektivně sledována kostní ztráta po dobu 3 let,kdy nebyl zjištěn vyšší podíl aktuální kostní ztráty.
Průměrná hodnota AM (%) (age matched) (hodnota BMD k referenční hodnotě daného věku na normálové křivce) v této studii po průměrné době užívání Depo-Provery 7 let se pohybovala ve všech sledovaných kostních lokacích v rozmezí 96,48–100 %.
Je mnoho důvodů, proč je tato kostní ztráta, i po dlouhodobé aplikaci DMPA, nízká.
K největší ztrátě BMD dochází během prvních 1–2 let aplikace DMPA [5, 16, 28, 30, 39, 47, 49], následně poklesy hodnot BMD zpomalují v čase [5, 12, 21, 47 ,49]. Rozsah nepříznivého vlivu navozeného chronického hypoestrinismu na BMD u uživatelek DMPA je tak patrně limitován. Po částečném ústupu estrogen dependentního podílu BMD [34] dochází ke stabilizaci [16, 28, 30, 45 ,47] nebo zpomalení [43] remodelačních procesů na jiné kvalitativní úrovni, patrně posunutím rolí jednotlivých intrinsic a extrinsic faktorů s převahou non-estrogen dependentních mechanismů [5]. Tento nový status mohou dokladovat nejednoznačné výsledky studia markrů resorpce a formace kosti [37, 43]. Nelze vyloučit ani přítomnost jiných kompenzačních mechanismů [43]. Průměrná ztráta BMD úměrně klesá s počtem let užívání DMPA [5, 47]. Pokles BMD se při mnohaleté aplikaci DMPA v následujících letech hodnotou menší než 1 % ročně [19] blíží hodnotě standardní fyziologické ztráty kostní hmoty a rok [30]. Ztráta BMD jak u dospělých, tak adolescentních uživatelek DMPA obecně nikdy nepřekročí 1 SD normálu [19], dokonce ani po 5 letech aplikace [23], a nepřesahuje 10 % [30, 47].
Subkutánní i intramuskulární aplikace DMPA vykazuje na kostní denzitu srovnatelný efekt [29].
Reverzibilita návratu BMD po vysazení startuje do 24 týdnů od poslední aplikace DMPA ve všech anatomických lokacích [23, 30, 47] a vrcholí v různém časovém sledu pro různé lokace v období 1–4,5 roku po vysazení [24, 28, 29, 36 ,44, 47], bez ohledu na věk při zahájení aplikace a na dobu aplikace [44]. Remodelace kosti a vzestup BMD po vysazení DMPA zrcadlově odpovídá rychlosti poklesu po nasazení DMPA. Přítomnost i jiných remodelačních kompenzačních mechanismů v době aplikace DMPA může vysvětlovat následný skokový přesah nárůstu BMD (rebound fenomén) sledovaný až 4–5 let od vysazení DMPA [2] nad průměrnou hladinu zdravé populace neuživatelek a je popisován jak u adolescentní populace uživatelek DMPA [24], tak i u žen uživatelek DMPA do biochemické menopauzy (datum prvního laboratorního výsledku hladiny FSH nad 40 U/l) [2, 18, 28, 54].
Navíc u uživatelek DMPA do období biochemické menopauzy nedochází z důvodu stabilizovaného hypoestrinismu ke strmému spádu BMD v postmenopauze [18] a paralelně vykazují redukci až absenci časných postmenopauzálních neurovegetativních obtíží z důvodu nezažitého skokového nástupu hypoestrinního stavu a méně agresivního vzestupu gonadotropinů. Otázkou je, zda užívání DMPA v perimenopauze neurychluje v řádech měsíců biochemický nástup menopauzy [54].
Významným pozitivním faktorem pro BMD je vyšší tělesná hmotnost, která je obecně dobrým prediktivním markrem kostní hmoty. Přímá korelace vyšší BMD s vyšší tělesnou hmotností není závislá na hladině sérového estradiolu [25] a je zaznamenatelná bez ohledu na typ užívané antikoncepce [8].
Roli u obezních může hrát zvýšená konverze androstendionu na estrogeny v tukové tkáni a zvýšené cirkulující koncentrace leptinu. Zároveň i uložení estrogenů v tukové tkáni a jejich následná dostupnost [31]. Dalším vysvětlením příznivé korelace tělesné hmotnosti a BMD je biomechanický vliv hmotnosti na kost [42]. Kost a sval utváří jednotku, která v případě zvýšené tělesné hmotnosti zažívá zvýšené mechanické zatížení, které je přenášeno přes svaly na kost, výsledkem je produkce cytokinů v okolním mikroprostředí. Tyto cytokiny jsou, přinejmenším částečně, obdobné těm produkovaným v přítomnosti estrogenů a slouží ke zvýšení kostní formace a k poklesu kostní ztráty [8]. Pozitivní vztah mezi tělesnou hmotností/BMI a BMC/BMD (bone mineral content/bone mineral density) může být v neposlední řadě odrazem adekvátní výživy [33]. Tělesná hmotnost (tělesný tuk a svalová hmota) může převážit nebo anulovat potenciálně nepříznivý efekt vliv na BMD spojený s užíváním DMPA [22, 33] a v menším rozsahu v souvislosti s nízkodávkovanými orálními kontraceptivy. Větší procentuální vzestup tukové tkáně má protektivní efekt před ztrátou kosti v páteři a kyčli. Ženy s vyšší bazální iniciální tukovou hmotou vykazují menší ztrátu kostní hmoty v čase [11].
Průměrné koncentrace sérového estradiolu dosahovaly u vyšetřovaných žen této studie minimálně v některých fázích aplikačního cyklu 190,3 pmol/l (51,9 pg/ml), tj. nad 50 pg/ml (184 pmol/l), hladinou považovanou za suficientní k zachování kostní hmoty u starších žen [35]. DMPA potlačuje hypofyzární gonadotropní sekreci a v této souvislosti většina žen vykazuje plazmatické hodnoty FSH a estradiolu [10, 26] podobné hodnotám časné folikulární fáze. K navození hypoestrogenismu způsobenému DMPA dochází bez ohledu na věk ženy nebo body mass index (BMI, kg/m2).
Nebyl prokázán vztah mezi hladinami sérového estradiolu a BMI [25]. Signifikantní sestup hladin sérového estradiolu nemusí korelovat s rozsahem poklesu BMD (cirkulující koncentrace estradiolu nemusí reflektovat hladiny tkáňového estrogenu) [25].
Po intramuskulárním podání se medroxyprogesteron acetát (MPA) uvolňuje pomalu, čímž se vytváří nízká, ale dlouho přetrvávající hladina přípravku. Po intramuskulární aplikaci dosahují hladiny maxima po 4 až 20 dnech. MPA je v krevním oběhu zjistitelný ještě 7–9 měsíců po intramuskulární injekci. Testování extrémního posunu sérové hladiny E2 a FSH by mělo respektovat období sérového maxima MPA, s ohledem ale na pomalé uvolňování MPA po intramuskulárním podání a dlouhodobě přetrvávající hladinu přípravku se vyšetřované hodnoty 12 týdnů po poslední aplikaci nemusí zásadně odlišovat.
ZÁVĚR
Průměrná hodnota AM (%) (age matched) (hodnota BMD k referenční hodnotě daného věku na normálové křivce) se v této studii po průměrné době užívání Depo-Provery 7 let pohybovalave všech sledovaných kostních lokacích v rozmezí 96,48–100,00%. Rozsah poklesu BMD v kontextu referenčních hodnot daného věku na normálové křivce, i po dlouholeté aplikaci Depo-Provery, se v zásadě neliší od počátečního propadu kostní denzity po dvouleté aplikaci a spíše nesvědčí o následném dalším iatrogenním propadu BMD v čase.
Průměrné koncentrace sérového estradiolu dosahovaly u vyšetřovaných žen této studie minimálně v některých fázích aplikačního cyklu 190,3 pmol/l (51,9 pg/ml)
Zajímavou literární informací je u dlouhodobě sledovaných bývalých uživatelek DMPA opakovaně popisovaný skokový přesah (rebound fenomén) BMD nad průměrnou hodnotu kostní denzity zdravých žen příslušného věku po 4–5 letech od vysazení. Tato zjištění pak mohou generovat provokativní závěry, že přechodný limitovaný pokles v kostní denzitě při navozeném hypoestrinismu během užívání DMPA může být již v době aplikace částečně kompenzován a nemusí být po vysazení dlouhodobým hendikepem, a je tak nejen reverzibilní, ale může být, na první pohled paradoxní, „cestou k lepší kosti“.
Relativně recentní závěry a doporučení US FDA ze 17. 11. 2004 obratem prošly kritickou diskusí a novými doporučeními na úrovni řady odborných společností [1, 7, 14, 40, 51, 55].
Obecný směr vývoje názorů na DMPA jako antikoncepci a vztah kosti poměrně aktuálně vystihlo společné prohlášení praktických lékařů, porodníků a gynekologů, reumatologů, ortopedů, fyzioterapeutů a endokrinologů v rámci Quebeck Canadian konsenzu z 15. 2. 2008: „DMPA je cost-efektivní antikoncepční metodou, jejíž nasazení musí být zváženo z pohledu kliniky a přání každé jednotlivé ženy. Budoucí uživatelky injekční kontracepce by měly být informovány, že užívání DMPA je spojené s lehkým poklesem kostní minerální denzity (BMD), které je z velké části, pokud ne plně, reverzibilní. Neměl by existovat jakýkoli časový limit pro dobu užívání DMPA za účelem antikoncepce, bez ohledu na věk ženy. Monitoring BMD u uživatelek DMPA z důvodu antikoncepce, se nedoporučuje. Vydané konsenzuální vyjádření deklarovalo, že ačkoliv suplementace kalciem nebo vitaminem D je výhodná pro skeletální zdraví ženy obecně, taková suplementace jen na základě pouhého užívání DMPA se nedoporučuje“ [23].
Čeští gynekologové mohou mít v klinické praxi řadu důvodů depotní medroxyprogesteron acetát v rámci antikoncepce doporučit nebo nedoporučit, neměla by se ale do jejich rozhodnutí promítat zásadní obava o kostní zdraví cílové uživatelky.
Předpokladem je v tomto směru i nová revize Souhrnu údajů o přípravku.
Prohlašuji, že v souvislosti se vznikem této práce jsme nespolupracovali s žádnou farmaceutickou firmou.
MUDr. Stanislav Zeman
Gynekologická ambulance
Vrchovecká 1
594 01 Velké Meziříčí
e-mail: dr.szeman@seznam.cz
Zdroje
1. American College of Obstetricians and Gynecologists. ACOG Committee Opinion No. 415: depot medroxyprogesterone acetate and bone effects. Obstet Gynecol, 2008, 112, p. 727–730.
2. Bahamondes, L., Trevisan, M., Andrade, L., et al. The effect upon the human vaginal histology of the long-term use of the injectable contraceptive Depo-Provera. Contraception, 2000, 62, p. 23–27.
3. Bailey, DA., McKay, HA., Mirwald, RL., et al. A six-year longitudinal study of the relationship of physical activity to bone mineral accrual in growing children: the university of Saskatchewan bone mineral accrual study. J Bone Miner Res, 1999, 14, p. 1672–1679.
4. Baxter-Jones, AD., Faulkner, RA., Mirwald, RL., et al. Bone mineral accrual and age of attainment of adult bone mass: a 15-year longitudinal study from pre-adolescence into adulthood [Abstract, 4th International Conference on Children‘s Bone Health, Montreal, 2007. Bone, 2007, 40, S25.
5. Berenson, AB., Breitkopf, CR., Grady, JJ., et al. Effects of hormonal contraception on bone mineral density after 24 months of use. Obstet Gynecol, 2004, 103, p. 899–906.
6. Berenson, AB., Rahman, M., Breitkopf, CR., Bi, LX. Effects of depot medroxyprogesterone acetate and 20-microgram oral contraceptives on bone mineral density. Obstet Gynecol, 2008, 112, p.788–799.
7. Black, A. Ad Hoc DMPA Committee of the Society of Obstetricians and Gynaecologists of Canada. Canadian contraception consensus—update on depot medroxyprogesterone acetate (DMPA). J Obstet Gynaecol Can, 2006, 28, p. 305–313.
8. Bonny, AE., Secic, M. Cromer, BA. Relationship between weight and bone mineral density in adolescents on hormonal contraception. J Pediatr Adolesc Gynecol, 24, 2011, 24, p. 35–38.
9. Busen, NH., Britt, RB., Dianin, N. Bone mineral density in a cohort of adolescent women using depot medroxprogesterone acetate for one to two years. J Adolesc Health, 2003, 32, p. 257–259.
10. Clark, MK., Sowers, M., Levy, BT., et al. Magnitude and variability of sequential estradiol and progesteron concentrations in women using depot medroxyprogesterone acetate for contraception. Fertil Steril, 2001, 75, p. 871–877.
11. Clark, MK., Sowers, M., Levy, B., Nichols, S. Bone mineral density loss and recovery during 48 months in first-time users of depot medroxyprogesterone acetate. Fertil Steril, 2006, 86, p. 1466–1474.
12. Clark, MK., Sowers, MR., Nichols, S., Levy, B. Bone mineral density changes over two years in first-time users of depot medroxyprogesterone acetate. Fertil Steril, 2004, 82, p. 1580–1586.
13. Clarke, BL, Khola, S. Female reproductive system and bone. Arch Biochem Biophys, 2010, 503, p. 118–128.
14. Cromer, AC., Scholes, D., Berenson, A., et al. Depot medroxyprogesterone acetate and bone mineral density in adolescents – the black box warning: A position paper of the Society for Adolescent Medicine. J Adol Health, 2006, 39, p. 296–301.
15. Cromer, BA., Blair, JM., Mahan, JD., et al. A prospective comparison of bone density in adolescent girls receiving depot medroxyprogesterone acetate (Depo-Provera), levonorgestrel (Norplant), or oral contraceptives. J Pediatr, 1996, 129, p. 671–676.
16. Cromer, BA., Bonny, AE., Stager, M., et al. Bone mineral density in adolescent females using injectable or oral contraceptives: a 24-month prospective study. Fertil Steril, 2008, 90, p. 2060–2067.
17. Cromer, BA., Stager, M., Bonny, A., et al. Depot medroxyprogesterone acetate, oral contraceptives and bone mineral density in a cohort of adolescent girls. J Adolesc Health, 2004, 35, p. 434–441.
18. Cundy, T., Cornish, J., Roberts, H., et al. Menopausal bone loss in long-term users of depot medroxyprogesterone acetate contraception. Am J Obstet Gynecol, 2002, 186, p. 978–983.
19. Curtis, KM., Martins, SL. Progestogen-only contraception and bone mineral density: a systematic review. Contraception, 2006, 73, p. 470–487.
20. Glasier, A., Yan, Y., Wellings, K. How do health care professionals respond to advice on adverse side effects of contraceptive methods? The case of Depo Provera. Contraception, 2007, 76, p. 18–22.
21. Gai, L., Zhang, J., Zhang, H., et al. The effect of depot medroxyprogesterone acetate (DMPA) on bone mineral density (BMD) and evaluating changes in BMD after discontinuation of DMPA in Chinese women of reproductive age. Contraception, 2011, 83, p. 218–222.
22. Gomez-Ambrosi, J., Rodriguez, A., Catalan, V., et al. The bone-adipose axis in obesity and weight loss. Obes Surg, 2008, 18, p. 1134.
23. Guilbert, ER., Brown, JP., Kaunitz, AM., et al. The use of depot medroxyprogesterone acetate in contraception and its potential impact on skeletal health. Contraception, 2009, 79, p. 167–177.
24. Harel, Z., Johnson, CC., Gold, MA., et al. Recovery of bone mineral density in adolescents following the use of depot medroxyprogesterone acetate contraceptive injections. Contraception, 2010, 81, p. 281–291.
25. Harel, Z., Wolter, K., Gold, AM., et al. Biopsychosocial variables associated with substantial bone mineral density loss during the use of depot medroxyprogesterone acetate in adolescents: adolescents who lost 5% or more from baseline vs. those who lost less than 5%. Contraception, 2010, 82, p. 503–512.
26. Jeppsson, S., Gershagen, S., Johansson, EDB., Rannevik, G. Serum medroxyprogesterone (MPA), sex hormone binding globulin, gonadal steroids, gonadotrophins and prolactin in women during long-term use of depo-MPA as a contraceptive. Acta Endocrinol, 1982, 99, p. 339–343.
27. Kaunitz, AM. Long-acting injectable contraception with depot medroxyprogesterone acetate. Am J Obstet Gynecol, 1994, 170(5Pt2), p. 154–159.
28. Kaunitz, AM., Arias, R., McClung, MR. Bone density recovery after depot medroxyprogesterone acetate injectable contraception use. Contraception, 2008, 77, p. 67–76.
29. Kaunitz, AM., Darney, PD., Ross, D., et al. Subcutaneous DMPA vs. intramuscular DMPA: a 2-year randomized study of contraceptive efficacy and bone mineral density. Contraception, 2009, 80, p. 7–17.
30. Kaunitz, AM., Miller, PD., Rice, VM., et al. Bone mineral density in women aged 25-35 years receiving depot medroxyprogesterone acetate recovery following discontinuation. Contraception, 2006, 74, p. 90–99.
31. Klein, KO., Larmore, KA., de Lancey, E., et al. Effect of obesity on estradiol level, and its relationship to leptin, bone maturation, and bone mineral density in children. J Clin Endocrinol Metab, 1998, 83, p.3469–3475.
32. Lara-Torre, E., Edwards, CP., Perlman, S., Hertweck, SP. Bone mineral density in adolescent females using depot medroxyprogesterone acetate. J Pediatr Adolesc Gynecol, 2004, 17, p. 17–21.
33. Leopard, MB., Shults, J., Wilson, BA., et al. Obesity during child-hood and adolescence augments bone mass and bone dimensions. Am J Clin Nutr, 2004, 80, p. 514–523.
34. Manolagas, SC. Birth and death of bone cells: basic regulatory mechanism and implication for the pathogenesis and treatment of osteoporosis. Endocr Rev, 2000, 21, p. 115–137.
35. Marcus, R. New perspectives on the skeletal role of estrogen.J Clin Endocrinol Metab, 1998, 83, p. 2236–2238.
36. Marshall, D., Johnell, O., Wedel, H. Meta-analysis of how well measures of bone mineral density predict occurrence of osteoporotic fractures. BMJ, 1996, 312, p. 1254–1259.
37. Ott, SM., Scholes, D., LaCroix, AZ., et al. Effects of contraceptive use on bone biochemical markers in young women. J Clin Endocrinol Metanol, 2001, 86, p. 179.
38. Paschall, S., Kaunitz, AM. Depo-Provera and skeletal health: a survey of Florida obstetrics and gynecologist physicians. Contraception, 2008, 78, p. 370–376.
39. Petitti, DB., Piaggio, G., Mehta, S., et al. Steroid hormone contraception and bone mineral density: a cross-sectional study in an international population. The WHO Study of Hormonal Contraception and Bone Health. Obstet Gynecol, 2000, 95, p. 736–744.
40. Planning, California Department of Health Services. Family PACT Clinical Practice Alert. http://www.familypact.org/_ Resources/Documents/CPA_Depo - provera_and_Bone_Density_ Aug_2005. Accessed June 22, 2011.
41. Rahman, M., Berenson, AB. Predictors of higher bone mineral density loss and use of depot medroxyprogesterone acetate. Obstet Gynecol, 2010, 115, p. 35–40.
42. Reid, IR. Relationships between fat and bone. Osteoporos Int, 2008, 19, p. 595.
43. Rome, E., Ziegler, J., Secic, M., et al. Bone biochemical markers in adolescent girls using either depot medroxyprogesterone acetate or an oral contraceptive. J Pediatr Adolesc Gynecol, 2004, 17, p. 373.
44. Rosenberg, L., Zhang, Y., Konstant, D., et al. Bone status after cessation of use of injectable progestin contraceptives. Contraception, 2007, 76, p. 425–431.
45. Shaarawy, M., El-Mallah, SY., Scoudi, S., et al. Effects of the long-term use of depot medroxyprogesterone acetate as hormonal contraceptive on bone mineral density and biochemical markers of bone remodeling. Contraception, 2006, 74, p. 297–302.
46. Scholes, D., LaCroix, AZ., Ichikawa, LE., et al. Change in bone mineral density among adolescent women using and discontinuing depot medroxyprogesterone acetate contraception. Arch Pediatr Adolesc Med, 2005, 159, p. 139–144.
47. Scholes, D., LaCroix, AZ., Ichikawa, LE., et al. Injectable hormone contraception and bone density: results from a prospective study. Epidemiology, 2002, 13, p. 581–587.
48. Sirola, J., Kroger, H., Honkanen, R., et al. Factors affecting bone loss around menopause in women without HRT: a prospective study. Maturitas, 2003, 45, p. 159–167.
49. Tang, OS., Tang, G., Yip, P., et al. Long-term depot medroxyprogesterone acetate and bone mineral density. Contraception, 1999, 59, p. 25–29.
50. Tang, OS., Tang, G., Yip, PS., Li, B. Further evaluation on long-term depot-medroxyprogesterone acetate use and bone mineral density: a longitudinal cohort study. Contraception, 2000, 62, p. 161–164.
51. The National Collaborating Centre for Women’s and Children’s Health. Long-Acting Reversible Contraception—Clinical Guideline 30. London, United Kingdom: National Institute for Health and Clinical Excellence, 2005, p. 1–176.
52. Theintz, G., Buchs, B., Rizzoli, R., et al. Longitudinal monitoring of bone mass accumulation in healthy adolescents: evidence for a marked reduction after 16 years of age at the levels of lumbar spine and femoral neck in female subjects. J Clin Endocrinol Metab, 1992, 75, p. 1060–1065.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článok vyšiel v časopiseČeská gynekologie
Najčítanejšie tento týždeň
2013 Číslo 1- Ne každé mimoděložní těhotenství musí končit salpingektomií
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Mýty a fakta ohledně doporučení v těhotenství
- Gynekologické potíže pomáhá účinně zvládat benzydamin
-
Všetky články tohto čísla
- Zápis ze schůze výboru Endoskopické sekce ČGPS
- Programové prohlášení výboru „Sekce gynekologické endoskopie ČGPS ČLS JEP“
- Pracovní skupina pro porodnictví Ministerstva zdravotnictví České republiky
- Vzpomínka na prof. MUDr. Františka Gazárka, CSc.
-
MUDr. Čeněk Born, CSc.
Krátké připomenutí životního jubilea - Olomouc má tu čest uspořádat jubilejní XXX. celostátní konferenci Sekce perinatální medicíny České gynekologické a porodnické společnosti ČLS JEP
- Udělení čestného členství České gynekologicko-porodnické společnosti ČLS JEP profesorovi MUDr. Miloši Mlynčekovi, CSc.
- Stav kostní minerální denzity po mnohaleté aplikaci antikoncepce Depo-Provery
- Robotem asistovaná radikální hysterektomie ve fázi „learning curve“ a její srovnání se standardní laparoskopicky asistovanou radikální vaginální a otevřenou radikální hysterektomií
- Sakrospinální fixace prolabovaného poševního pahýlu po hysterektomii sec. Miyazaki – dlouhodobé výsledky
- Editorial
- Stanovení RHD genotypu plodu z plazmy periferní krve těhotné ženy a posouzení citlivosti nových diagnostických postupů pro zavedení do klinické praxe
- Historie Porodnicko-gynekologické kliniky v Olomouci
- Porody dětí nízké a velmi nízké porodní hmotnosti ve Fakultní nemocnici v Olomouci (1993–2011)
- Incidence erytrocytární aloimunizace u těhotných žen v olomouckém regionu
- Epidemiologie a management poruch štítné žlázy v těhotenství
- Vliv délky kultivace embryí s pomalým nástupem dělení na úspěšnost IVF
- Výskyt vybraných geneticky podmíněných trombofilních markerů u pacientek podstupujících léčbu neplodnosti
- Možnosti objektivizace tkáňového traumatu u operací pro karcinom endometria
- Erytrocytární aloimunizace těhotných žen, klinický význam a laboratorní diagnostika
- Poruchy funkce štítné žlázy v těhotenství
- Česká gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Vliv délky kultivace embryí s pomalým nástupem dělení na úspěšnost IVF
- Sakrospinální fixace prolabovaného poševního pahýlu po hysterektomii sec. Miyazaki – dlouhodobé výsledky
- Erytrocytární aloimunizace těhotných žen, klinický význam a laboratorní diagnostika
- Robotem asistovaná radikální hysterektomie ve fázi „learning curve“ a její srovnání se standardní laparoskopicky asistovanou radikální vaginální a otevřenou radikální hysterektomií
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



