-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Funkce mitochondrií ve spermii u mužů s normozoospermií a astenozoospermií
Sperm mitochondrial function in men with normozoospermia and asthenozoospermia
Objective:
One of causes of male infertility is reduced sperm motility. It turns out that the reduced efficiency of the mitochondrial respiratory activity may play a role in the development of this disorder. The aim of our study was to comprehensively determine mitochondrial respiratory activity of sperm with normal and reduced motility.Design:
Prospective study.Setting:
Department of Histology and Embryology, Faculty of Medicine in Pilsen, Charles University in Prague; Department of Physiology, Faculty of Medicine in Pilsen, Charles University in Prague; Institute of Reproductive Medicine and Endocrinology, IVF Centers Prof. Zech, Plzeň.Methods:
Ejaculates of 14 men were obtained from IVF Center Prof. Zech, Pilsen. According to the World Health Organization classification, samples were divided into normozoospermatic (n = 7) and asthenozoospermatic(n = 7) groups. Respiratory activity of sperm was measured on two-chamber oxygraph Oroboros.Results:
In asthenozoospermatic samples, significantly reduced activity of complex I (p = 0.007) and increased respiration after application of ATP-synthase inhibitor oligomycin (showing increased uncoupled oxidation and phosphorylation, p = 0.046) were found. Inhibition of complex I by rotenone showed that complex I contribution to the total capacity of oxidative phosphorylation of healthy sperm was relatively lower than it is typical for somatic cells.Conclusion:
In our study, we measured mitochondrial respiratory activity of human sperm, permeabilized by digitonin, by high-resolution oxygraphy, which allows the determination of oxygen consumption from the smallest possible number of germ cells. The study results confirm reduced activity of complex I in asthenozoospermatics and suggest that increased leakage of protons from the mitochondrial matrix, which leads to reduced efficiency of phosphorylating process, could participate in the reduced sperm motility.
Better characterization of male germ cells, either completely healthy or with affected motility, will help us to understand better the physiological process of fertilization and also to choose the most viable sperm for infertility treatment by methods of assisted reproduction.Keywords:
infertility – sperm – respirometry
Autoři: M. Čedíková 1,2; M. Miklíková 1; M. Grundmanová 3; N. H. Zech 4; M. Králíčková 1,2,5; J. Kuncová 2,3
Působiště autorů: Ústav histologie a embryologie LF UK, Plzeň, přednostka doc. MUDr. M. Králíčková, Ph. D. 1; Biomedicínské centrum LF UK, Plzeň, vědecký ředitel doc. MUDr. M. Štengl, Ph. D. 2; Ústav fyziologie LF UK, Plzeň, přednosta doc. MUDr. M. Štengl, Ph. D. 3; Institut reprodukční medicíny a endokrinologie, IVF Centrum Prof. Zecha, Plzeň, přednosta Univ. Doz. Dr. med. Nicolas H. Zech 4; Gynekologicko-porodnická klinika LF UK a FN, Plzeň, přednosta doc. MUDr. Z. Novotný, CSc. 5
Vyšlo v časopise: Ceska Gynekol 2014; 79(1): 22-28
Souhrn
Cíl studie:
Jednou z příčin mužské neplodnosti je snížená motilita spermií. Ukazuje se, že ve vývoji této poruchy může hrát roli snížená efektivita respirační aktivity mitochondrií. Cílem naší studie bylo komplexní stanovení respirační aktivity mitochondrií spermií s normální a sníženou pohyblivostí.Typ studie:
Prospektivní studie.Název a sídlo pracoviště:
Ústav histologie a embryologie, LF UK, Plzeň; Ústav fyziologie, LF UK, Plzeň; Institut reprodukční medicíny a endokrinologie, IVF Centrum Prof. Zecha, Plzeň.Metodika:
Ejakuláty byly získány od 14 mužů z IVF Centra Prof. Zecha v Plzni. Podle klasifikace World Health Organization byli muži rozděleni do skupiny normozoospermatiků (n = 7) a astenozoospermatiků (n = 7). Respirační aktivitu spermií jsme měřili na dvoukanálovém oxygrafu Oroboros.Výsledky:
V astenozoospermatických vzorcích byla nalezena signifikantně snížená aktivita komplexu I(p = 0,007), zvýšená respirace po aplikaci inhibitoru ATP-syntázy oligomycinu (ukazující na zvýšené rozpřažení oxidace a fosforylace; p = 0,046). Inhibice komplexu I rotenonem ukázala, že příspěvek komplexu I k celkové kapacitě oxidační fosforylace byl i u zdravých spermií relativně nižší, než je tomu typicky v somatických buňkách.Závěr:
V naší studii jsme měřili respirační aktivitu mitochondrií lidských spermií permeabilizovaných digitoninem vysokoúčinnou oxygrafií, která umožňuje stanovení spotřeby kyslíku z nejmenšího možného množství zárodečných buněk. Výsledky studie potvrzují sníženou aktivitu komplexu I u astenozoospermatiků a naznačují, že na snížené pohyblivosti spermií by se mohl podílet i zvýšený únik protonů z mitochondriální matrix, který vede ke snížené efektivitě fosforylačního procesu. Lepší charakterizace mužských zárodečných buněk, ať zcela zdravých, či s postiženou motilitou, nám pomůže lépe pochopit proces fyziologického oplodnění a zároveň pomůže i ve výběru té nejvíce životaschopné spermie pro léčbu neplodnosti metodami asistované reprodukce.Klíčová slova:
neplodnost – spermie – respirometrieÚVOD
Snížená plodnost je rostoucím problémem mužské populace ve fertilním věku. Androgenní faktor je zodpovědný přibližně za 50 % případů infertility [32], z 25 % jsou příčiny stále neznámé.
Jednou z častých příčin mužské neplodnosti je snížená motilita spermií – astenozoospermie [13, 14, 30, 32, 38]. Astenozoospermie je podle definice Světové zdravotnické organizace (WHO) definována jako: méně než 40 % spermií s progresivní a neprogresivní motilitou nebo méně než 32 % spermií s progresivní motilitou [39]. U spermie můžeme pozorovat dva druhy fyziologického pohybu – symetrický s nízkou amplitudou, kdy spermie udržuje rovný směr. Tento druh pohybu je viditelný v čerstvém ejakulátu a nazývá se aktivovanou motilitou. Druhým typem je tzv. hyperaktivovaná motilita, kdy se spermie pohybuje asymetricky s vysokou amplitudou a její pohyb je cirkulární [15, 35, 36, 37]. Oba druhy pohybů jsou závislé na dodávce energie ve formě ATP, který je získáván procesem oxidační fosforylace v mitochondriích nebo glykolýzou [9, 32].
Mitochondrie se ve zralé spermii nacházejí po dvojicích helikálně uspořádaných ve spojovacím oddílu, jedné ze tří zřetelných částí bičíku – spojovací (střední) oddíl, hlavní část a terminální konec [12]. Celkový počet mitochondrií v jedné spermii je jen 72 až 80 [2, 32]. Umístění mitochondrií je znázorněno na obrázku 1.
Obr. 1. Schéma uložení mitochondrií ve spermii 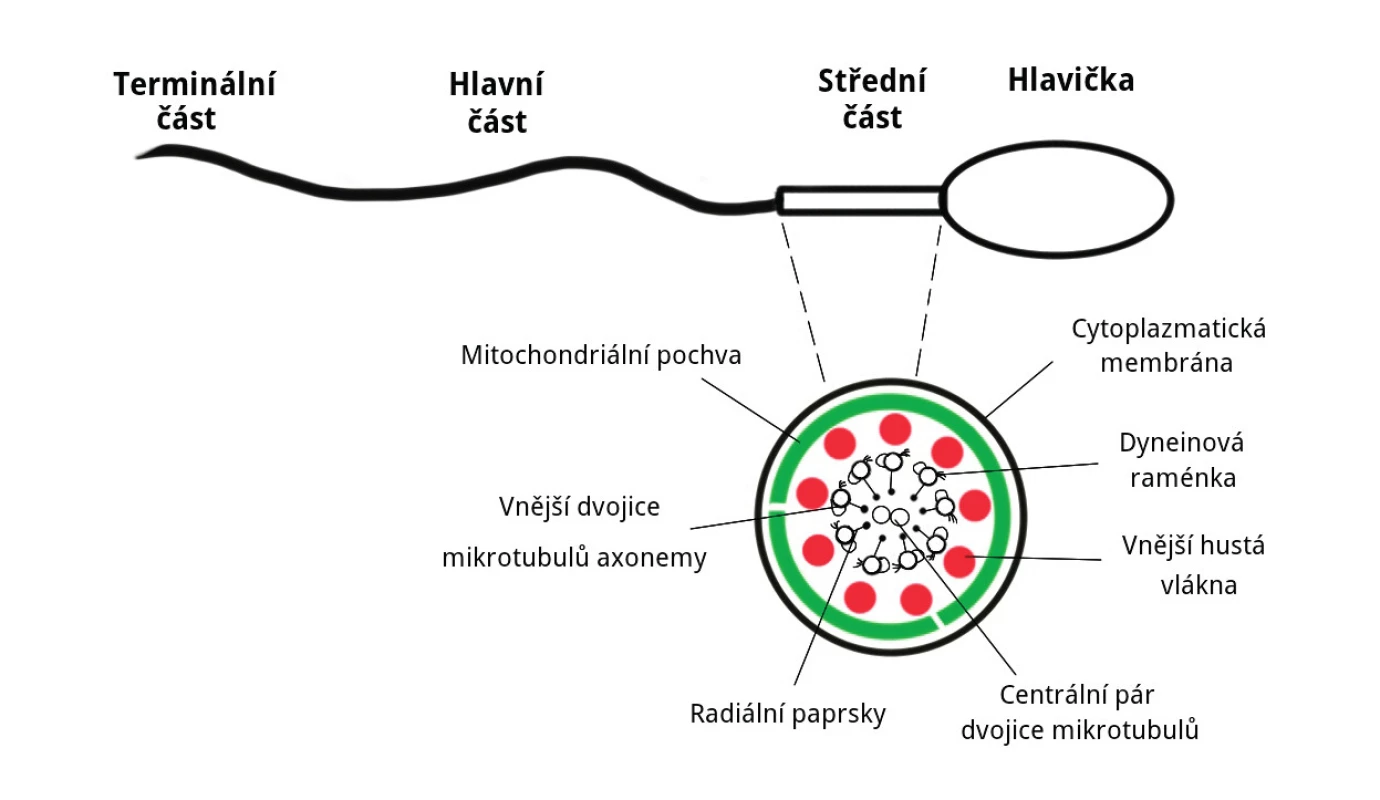
V somatických buňkách hrají mitochondrie ústřední roli v metabolických procesech a stanovení jejich aktivity je klíčové pro analýzu, diagnózu a případnou léčbu četných patologických stavů, které mitochondriální dysfunkce provázejí (např. neurodegenerativní, metabolická a zánětlivá onemocnění). Mitochondriální dýchací řetězec přenáší elektrony systémem proteinových komplexů (CI – CIV) umístěných na vnitřní mitochondriální membráně z NADH a FADH2 na O2 (oxidace). Činností některých komplexů dochází k pumpování protonů z mitochondriální matrix do intermembránového prostoru. Protonový gradient je pak využit k syntéze ATP (fosforylace). V modernějším pojetí jde o konvergentní systém přenašečů elektronů, kde uzlovým bodem je koenzym Q (obr. 2) [22].
Obr. 2. Současná představa elektrontrasportního konvergentního systému na vnitřní mitochondriální membráně GpDH – glukóza-6-fosfát dehydrogenáza; komplex I – NADH-Q reduktáza; komplex II – sukcinát-Q reduktáza; komplex III – cytochrom reduktáza; komplex IV – cytochrom oxidáza; ETF – electron-transporting flavoprotein 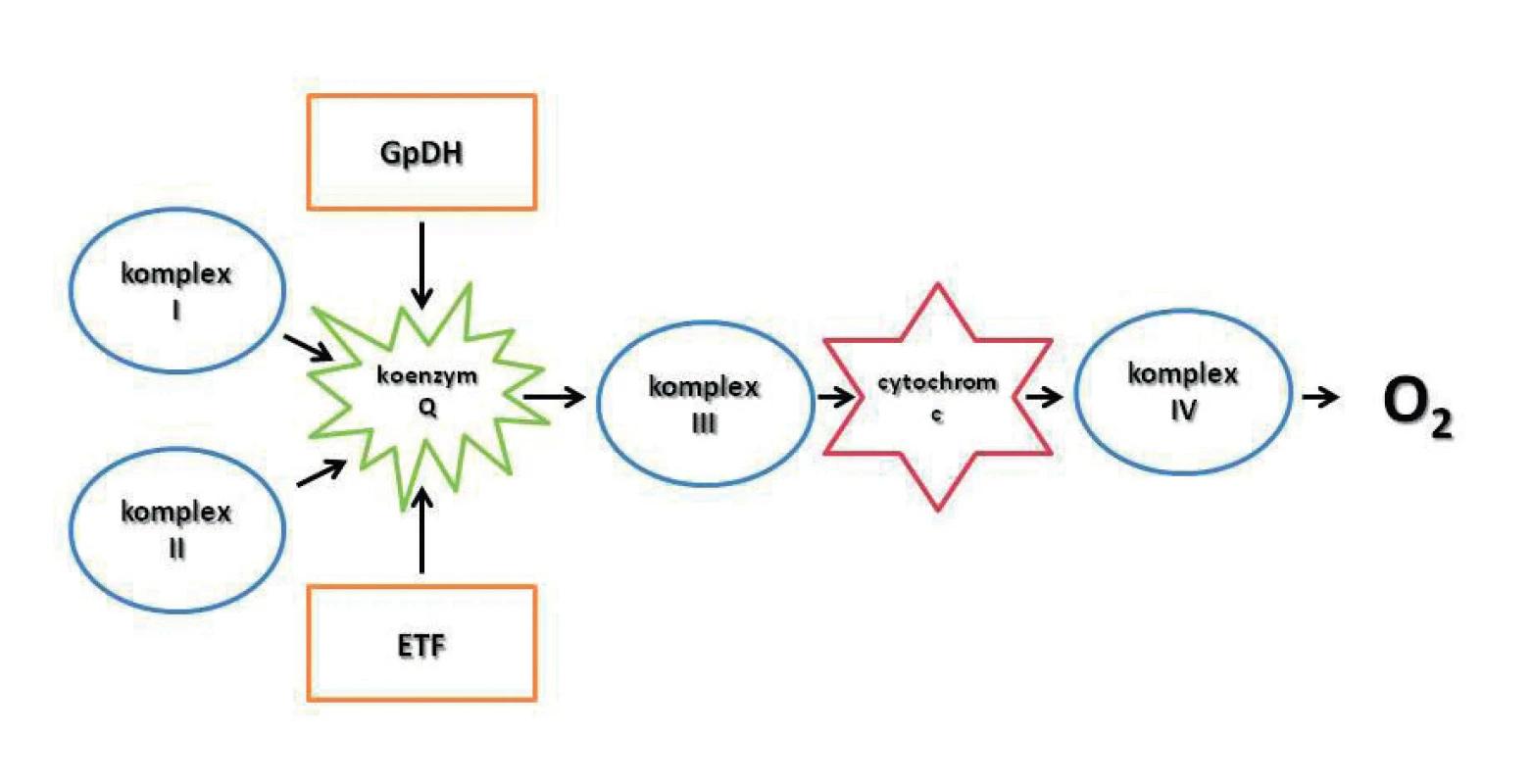
Ve spermii byla mitochondrie dlouho opomíjenou organelou, nyní je však doloženo, že má klíčovou roli v mnohých fyziologických a patologických procesech [21, 25, 26]. Kromě produkce ATP nutného pro zajištění pohyblivosti spermie hrají mitochondrie významnou úlohu v regulaci zrání a životnosti spermií a regulaci osmotické a vápníkové homeostázy [21].
Mezi možné příčiny astenozoospermie z pohledu mitochondriální problematiky patří jednak jejich strukturální anomálie [19, 23], ale také jejich funkční porucha [6, 7]. Ukazuje se, že určitou roli u astenozoospermatických mužů by mohla hrát právě snížená účinnost respirační aktivity. Publikací na toto téma je zatím velice málo [7, 31], a proto také v současnosti není žádné polarografické vyšetření spotřeby kyslíku rutinně využíváno.
V naší studii jsme měřili mitochondriální respiraci celých permeabilizovaných spermií vysokoúčinnou oxygrafií, která umožňuje stanovení aktivity jednotlivých komplexů dýchacího systému postupně na témže vzorku. Ověřili jsme sníženou aktivitu komplexu I u astenozoospermatických vzorků [8]. Novým nálezem je zvýšená spotřeba kyslíku nutná především pro kompenzaci úniku protonů a udržení mitochondriálního membránového potenciálu, která může být důvodem nižší účinnosti produkce energie v méně pohyblivých spermiích.
METODIKA
Příprava vzorku
Ejakuláty byly získány od 14 mužů z IVF Centra Prof. Zecha v Plzni. Podle klasifikace World Health Organization byli muži rozděleni do skupiny normozoospermatiků (n = 7, průměrný věk 33,1 let) a astenozoospermatiků (n = 7, průměrný věk 36,7 let). Vzorek je vždy odebírán přímo v IVF centru, aby bylo pokud možno zcela eliminováno znehodnocení vzorku skladováním a transportem. Po zkapalnění (30 minut) je stanoven nativní spermiogram (podle kritérií WHO 2010). Dalším krokem je kapacitace vzorku pomocí gradientu roztoku médií Sperm Filter Medium (SFM, CRYOS, Německo) a Quinn´s Sperm Washing Medium (QSWM, SAGE, USA). Sperm filter medium je naředěno na 90 % (0,15 ml QSWM: 1,35 ml SFM), 70 % (0,09 ml QSWM: 0,21 ml SFM) a 50 % (0,15 ml QSWM: 0,15 ml SFM). Do kónické zkumavky je na sebe postupně navrstveno 1,5 ml 90%, 0,3 ml 70% a 0,3 ml 50% gradientu médií. Poté je přidán plný ejakulát a vzorek je centrifugován 20 minut při 2000 otáčkách. Po odstranění supernatantu je přidáno 8 ml Quinn´s Sperm Washing Media a opět je vzorek centrifugován 8 minut při 2000 otáčkách. Po odstranění supernatantu je vzorek připraven k aplikaci do přístroje Oroboros (Oroboros, Innsbruck, Rakousko).
Oxygrafie
Respirační aktivitu spermií jsme měřili na dvoukanálovém oxygrafu Oroboros (Oroboros, Innsbruck, Rakousko) při 36 oC v komůrkách o objemu 2 ml. Po 40–50minutové ekvilibraci odpovídala koncentrace kyslíku v respiračním médiu jeho aktuální koncentraci v atmosférickém vzduchu a rozpustnosti v respiračním médiu (0,92), které mělo následující složení: EGTA 0,5 mm l/l; MgCl2.6H2O 3 mmol/l; laktobionát draselný 60 mmol/l; taurin 20 mmol/l; KH2P04 10 mmol/l; HEPES 20 mmol/l; sacharóza 110 mmol/l, hovězí albumin 1 g/l [11]. Následně byly komůrky uzavřeny a dávkovací stříkačkou Hamilton do nich byl aplikován vzorek spermií. Nejprve byla buněčná membrána spermií permeabilizována digitoninem a změřena respirace vzorku před přidáním substrátů a ADP. Sekvenční titrační protokol aplikace substrátů a inhibitorů jednotlivých komplexů respiračního systému byl zvolen následovně:a) rychlost respirace za klidových podmínek (stav S2 nebo LEAK) byla stanovena pomocí substrátů komplexu I glutamátu (10 mmol/l), malátu (2 mmol/l) a pyruvátu (5 mmol/l); b) aktivní respirace (stav S3 nebo OXPHOS) byla stimulována ADP (2,5 mmol/l); c) spotřeba kyslíku byla dále zvýšena aplikací sukcinátu (10 mmol/l), substrátu komplexu II; d) integrita vnitřní mitochondriální membrány byla ověřena pomocí cytochromu c (10 µmol/l); e) stav OXPHOS při stimulaci komplexu II byl navozen inhibitorem komplexu I rotenonem (0,5 µmol/l); f) inhibitor ATP-syntázy oligomycin (2 µg/ml) opět navodil stav LEAK (S4) nutný k udržení mitochondriál-ního membránového potenciálu; g) pomocí rozpřahovače oxidace a fosforylace karbonylkyanid-p-trifluoromethoxyfenylhydrazonu (FCCP; 0,05–0,25 µmol/l) jsme indukovali stav S3u nebo ETS charakterizující maximální kapacitu elektrontransportního systému; h) inhibitorem komplexu III antimycinem A (2,5 µmol/l ) jsme navodili stav reziduální spotřeby kyslíku (ROX), tj. spotřebu kyslíku způsobenou převážně nemitochondriální oxidací.
V úvodní sérii experimentů jsme testovali dávku digitoninu (5 µg/ml) nutnou pro permeabilizaci buněčné membrány spermií: K vzorku spermií byl přidán sukcinát, rotenon a ADP a postupně byl aplikován digitonin tak dlouho, dokud se respirace zvyšovala. Vyšší dávka digitoninu vedla k poškození mitochondriální membrány a úniku cytochromu c.
Analýza dat a statistika
Spotřeba kyslíku permeabilizovanými spermiemi byla vypočtena on-line pomocí softwaru DatLab (Oroboros Instruments, Innsbruck, Rakousko) jako záporně vzatá časová derivace poklesu koncentrace kyslíku v komůrce a vyjádřená v pmol O2/(s.106) buněk. Ke statistickému porovnání jednotlivých hodnot spotřeby kyslíku v obou skupinách jsme použili Mannova-Whitneyova pořadového testu pomocí programu STATISTICA Cz, (StatSoft CR, Praha, Česká republika). Výsledky jsou prezentovány jako průměry ± střední chyby průměru (SEM); hladina pravděpodobnosti < 0,05 byla považována za signifikantní.
VÝSLEDKY
Typická křivka spotřeby kyslíku permeabilizovanými spermiemi je na obrázku 3.
Obr. 3. Typická křivka spotřeby kyslíku permeabilizovanými spermiemi Plná čára znázorňuje spotřebu kyslíku, tečkovaná koncentraci kyslíku v komůrce. Šipky ukazují aplikaci jednotlivých chemikálií: G – glutamát; M – malát; Pyr – pyruvát; D – ADP; S – sukcinát; c – cytochrom c; Rot – rotenon; Omy – oligomycin; FCCP – karbonylkyanid-p-trifluorometoxyfenylhydrazon; Ama – antimycin A. 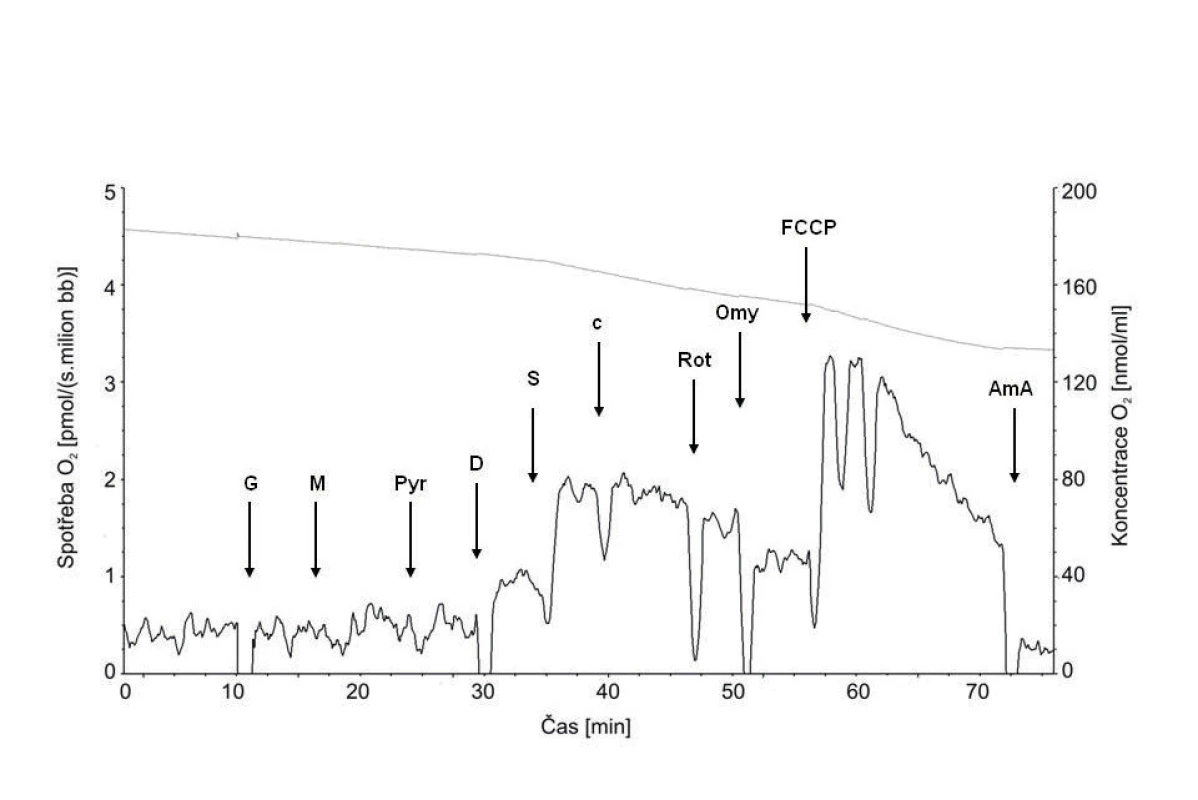
Minimální počet spermií nutný pro detekci spotřeby kyslíku byl 5 x 106 buněk v 1 ml média. Po aplikaci glutamátu, malátu a pyruvátu, substrátů pro komplex I, byla spotřeba kyslíku srovnatelná se stavem bez substrátů, což ukazuje na dobrou permeabilizaci buněčné membrány, která vedla k úniku ADP z buňky. Po přidání ADP došlo ke stimulaci respirace a indukci stavu S3, tj. maximální spotřebě kyslíku při fosforylaci ADP na ATP (OXPHOSI). U astenozoospermie byla aktivita komplexu I signifikantně nižší než u kontrol (tab. 1). Aplikací sukcinátu dodávajícího do systému elektrony prostřednictvím komplexu II došlo k dalšímu zvýšení spotřeby kyslíku (OXPHOSI+II), která se mezi oběma skupinami významně nelišila. Následná inhibice komplexu I rotenonem ukázala, že příspěvek komplexu I k celkové kapacitě oxidační fosforylace byl i u zdravých spermií relativně nižší, než je tomu typicky v somatických buňkách, např. jaterních nebo svalových [4, 29]. Inhibice ATP-syntázy oligomycinem snížila spotřebu kyslíku na úroveň nutnou především pro pumpování protonů do intermembránového prostoru. Tato hodnota byla signifikantně vyšší u astenozoospermatických vzorků. Rozpřažení fosforylace a oxidace pomocí FCCP ukázalo, že ve zdravých i astenozoospermatických vzorcích je kapacita elektrontransportního systému přenášet elektrony vyšší než maximální spotřeba kyslíku při zachované fosforylaci. Reziduální spotřeba kyslíku, na kterou byly ostatní respirační parametry korigovány, byla u zdravých spermií 0,14 ± 0,05 pmol O2/(s.106 buněk) a u spermií s poruchou pohyblivosti 0,15 ± 0,05 pmol O2/(s.106 buněk).
Tab. 1. Spotřeba kyslíku permeabilizovanými spermiemi 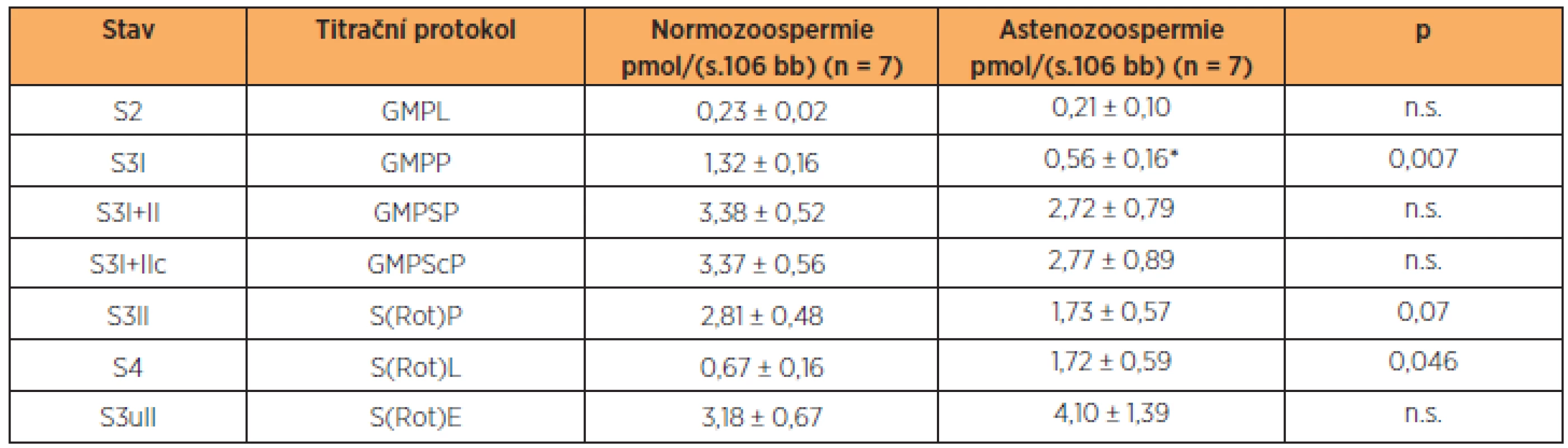
Spotřeba kyslíku v jednotlivých stavech je korigována na ROX. Zkratky: G – glutamát, M – malát, P – pyruvát, D – ADP, S – sukcinát, c – cytochrom c, Rot – rotenon, Omy – oligomycin, F – FCCP; L – LEAK, P – OXPHOS, E – ETS; I a II – komplexy I a II. DISKUSE
Literární údaje o respirační aktivitě mitochondrií ve spermiích jsou relativně chudé, nicméně již první studie ukazují, že poruchy mitochondrií mají vliv na motilitu spermií [8]. Důvodem je zejména malé množství mitochondrií obsažených v jednotlivých zárodečných buňkách a jejich obtížná izolace [25]. Proto je nutné stanovit mitochondriální respiraci na celých buňkách, ideálně tak, aby buněčná membrána byla permeabilizována a umožnila přestup substrátů Krebsova cyklu a adenosindifosfátu k mitochondriím. Dosud používaná metoda byla založena na inkubaci spermií v hypotonickém roztoku, která vedla k narušení buněčné membrány bez poškození membrány mitochondrií [24]. V somatických buňkách však inkubace v hypotonických médiích způsobuje stimulaci mnoha membránových iontových kanálů a receptorů, což vede ke změnám ve složení intracelulární tekutiny a aktivaci intracelulárních procesů včetně uvolňování řady biologicky účinných látek a apoptózy [3, 20]. Proto jsme v naší studii využili permeabilizace membrány spermií digitoninem, detergentem často využívaným ve výzkumu mitochondriální funkce na celých buňkách [22]. V naší práci jsme měřili respirační aktivitu mitochondrií lidských spermií permeabilizovaných digitoninem vysokoúčinnou oxygrafií, která umožňuje stanovení spotřeby kyslíku z nejmenšího možného množství zárodečných buněk.
Oxidativní fosforylaci jakožto zdroji tvorby energie pro pohyb spermií byla dávána nezastupitelná role, proto se také předpokládalo, že poruchy mitochondriální morfologie a funkce jsou hlavním faktorem odpovídajícím za sníženou motilitu spermií [38]. Studie na myších ale ukázaly, že při poškozené oxidativní fosforylaci nedochází k zániku motility u spermií [5] a zdrojem ATP je zejména přeměna glukózy na pyruvát [17]; také spermie králíků pravděpodobně využívají jako hlavní zdroj energie glykolýzu [33]. Spermie některých živočišných druhů dokonce dokážou vytvářet glykogen [10]. Samčí zárodečné buňky dalších živočišných druhů (beran, býk, kanec, primáti) včetně člověka však pro pohyb využívají ve významné míře ATP získaný v mitochondriích oxidativní fosforylací [1, 18, 25]. Otázka primárního zdroje energie pro pohyb spermií ještě není zcela zodpovězena ani u člověka; všeobecně uznávaným pohledem je jejich všestrannost v možnosti získávání ATP, která je ovlivněna přítomností a dostupností substrátů v ženském reprodukčním ústrojí [28, 34].
Některé mitochondriální parametry, např. mitochondriální membránový potenciál měřený pomocí průtokové cytometrie, přímo korelují s výsledky léčby neplodnosti pomocí metod asistované reprodukce [16]. Další výzkum a detailnější stu-dium této problematiky tak slibuje přínos pro další pokrok v diagnostice i terapii neplodnosti.
Naše studie potvrzuje nález snížené aktivity komplexu I v mitochondriálním respiračním systému astenozoospermatických vzorků. Aktivita komplexu II však nebyla astenozoospermií narušena a celková kapacita transportu elektronů při stimulaci komplexů I a II a zachované fosforylaci (stav S3I+II) se mezi oběma skupinami nelišila. Zajímavým nálezem je také pravděpodobná zpětná kontrola přenosu elektronů fosforylací ADPu astenozoospermie, jak ukazuje poměr E/P, který byl u méně pohyblivých spermií signifikantně vyšší (tab. 2). Důvodem pro snížení aktivity komplexu I tedy patrně není jeho snížená exprese. U astenozoospermatických vzorků byl také prokázán signifikantně zvýšený stav LEAK (S4), který vyjadřuje stupeň mitochondriální oxidace nutné zejména pro kompenzaci úniku protonů z mitochondriální matrix, ale podílí se na něm i obrat kationtů přes vnitřní mitochondriální membránu [22]. Známým příkladem rozpřažení respirace a fosforylace ADP je rozpřahovací protein hnědé tukové tkáně (UCP1), který je zodpovědný za tvorbu tepla v mitochondriích [27]. V lidských spermiích byla prokázána mRNA pro další rozpřahovací protein – UCP2, jehož role by mohla spočívat v ochraně před kyslíkovými radikály [40], ale jehož vztah k mitochondriální respiraci spermií nebyl dosud zkoumán.
Tab. 2. Respirační kontrolní indexy 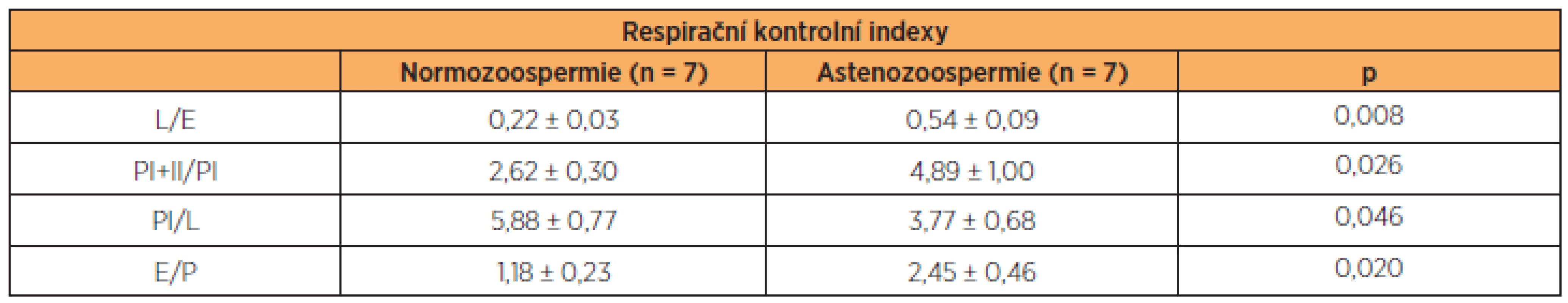
L/E – LEAK/ETS, poměr ukazující stupeň rozpřažení oxidace a fosforylace; PI+II/PI – OXPHOS při stimulaci komplexů I a II/OXPHOS při stimulaci komplexu I; PI/L – OXPHOS/LEAK, vzestup respirace po aplikaci substrátů komplexu I (glutamátu, malátu a pyruvátu) a ADP, E/P – poměr rovnováhy mezi kapacitou elektrontransportního systému a oxidační fosforylací, hodnoty výrazně vyšší než 1 ukazují na kontrolu respirace fosforylací. ZÁVĚR
Lepší charakterizace mužských zárodečných buněk, ať zcela zdravých, či s postiženou motilitou, nám umožní lépe pochopit proces fyziologického oplodnění a zároveň pomůže i ve výběru té nejvhodnější spermie pro léčbu neplodnosti asistovanou reprodukcí.
Tento projekt byl podpořen Programem rozvoje vědních oborů Karlovy univerzity (projekt P36), projektem OP VaVpI PO 2 Biomedicínské centrum ED2.1.00/03.0076, projektem specifického vysokoškolského výzkumu SVV 266 802 a grantem GA UK 696212.
MUDr. Miroslava Čedíková
Ústav histologie a embryologie LF UK
Karlovarská 48
301 00 Plzeň
e-mail: miroslava.cedikova@lfp.cuni.cz
Zdroje
1. Aitken, RJ., Ryan, AL., Baker, MA., et al. Redox activity associated with the maturation and capacitation of mammalian spermatozoa. Free Radic Biol Med, 2004, 36, 8, p. 994–1010.
2. Ankel-Simons, F., Cummins, JM. Misconceptions about mitochondria and mammalian fertilization: implications for theories on human evolution. Proc Natl Acad Sci U S A, 1996, 93, 24, p. 13859–13863.
3. Blum, AE., Walsh, BC., Dubyak, GR. Extracellular osmolarity modulates G protein-coupled receptor-dependent ATP release from 1321N1 astrocytoma cells. Am J Physiol Cell Physiol, 2010, 298, 2, p. 386–396.
4. El-Mir, MY., Nogueira, V., Fontaine, E., et al. Dimethylbiguanide inhibits cell respiration via an indirect effect targeted on the respiratory chain complex I. J Biol Chem, 2000, 7, 275, 1, p. 223–228.
5. Escalier, D. Knockout mouse models of sperm flagellum anomalies. Hum Reprod Update, 2006, 12, 4, p. 449–461.
6. Evenson, DP., Darzynkiewicz, Z., Melamed, MR. Simultaneous measurement by flow cytometry of sperm cell viability and mitochondrial membrane potential related to cell motility. J Histochem Cytochem, 1982, 30, 3, p. 279–280.
7. Ferramosca, A., Focarelli, R., Piomboni, P., et al. Oxygen uptake by mitochondria in demembranated human spermatozoa: a reliable tool for the evaluation of sperm respiratory efficiency. Int J Androl, 2008, 31, 3, p. 337–345.
8. Ferramosca, A., Provenzano, SP., Coppola, L., Zara, V. Mitochondrial respiratory efficiency is positively correlated with human sperm motility. Urology, 2012, 79, 4, p. 809–814.
9. Folgerø, T., Bertheussen, K., Lindal, S., et al. Mitochondrial disease and reduced sperm motility. Hum Reprod, 1993, 8, 11, p. 1863–1868.
10. Ford, WC. Glycolysis and sperm motility: does a spoonful of sugar help the flagellum go round? Hum Reprod Update, 2006, 12, 3, p. 269–274.
11. Gnaiger, E., Kuznetsov, AV., Schneeberger, S., et al. Mitochondria in the cold. In: Life in the Cold. In Heldmaier G, Klingenspor M. Heidelberg, Berlin, New York: Springer, 2000, p. 431–442.
12. Inaba, K. Sperm flagella: comparative and phylogenetic perspectives of protein components. Mol Hum Reprod, 2011, 17, 8, p. 524–538.
13. Jansen, RP., Burton, GJ. Mitochondrial dysfunction in reproduction. Mitochondrion, 2004, 4, 5–6, p. 577–600.
14. Kao, SH., Chao, HT., Wei, YH. Multiple deletions of mitochondrial DNA are associated with the decline of motility and fertility of human spermatozoa. Mol Hum Reprod, 1998, 4, 7, p. 657–666.
15. Katz, DF., Vanagimachi, R. Movement characteristics of hamster spermatozoa within the oviduct. Biol Reprod, 1980, 22, 4, p. 759–764.
16. Marchetti, P., Ballot, C., Jouy, N., et al. Influence of mitochondrial membrane potential of spermatozoa on in vitro fertilisation outcome. Andrologia, 2012, 44, 2, p. 136–141.
17. Marin, S., Chiang, K., Bassilian, S., et al. Metabolic strategy of boar spermatozoa revealed by a metabolomic characterization. FEBS Lett, 2003, 554, 3, p. 342–346.
18. Mukai, C., Okuno, M. Glycolysis plays a major role for adenosine triphosphate supplementation in mouse sperm flagellar movement. Biol Reprod, 2004, 71, 2, p. 540–547.
19. Mundy, AJ., Ryder, TA., Edmonds, DK. Asthenozoospermia and the human sperm mid-piece. Hum Reprod, 1995, 10, 1, p. 116–119.
20. Okada, Y., Maeno, E. Apoptosis, cell volume regulation and volume-regulatory chloride channels. Comp Biochem Physiol A Mol Integr Physiol, 2001, 130, 3, p. 377–383.
21. Peña, FJ., Rodríguez Martínez, H., Tapia, JA., et al. Mitochondria in mammalian sperm physiology and pathology: a review. Reprod Domest Anim, 2009, 44, 2, p. 345–349.
22. Pesta, D., Gnaiger, E. High-resolution respirometry: OXPHOS protocols for human cells and permeabilized fibers from small biopsies of human muscle. Methods Mol Biol, 2012, 810, p. 25–58.
23. Piasecka, M., Kawiak, J. Sperm mitochondria of patients with normal sperm motility and with asthenozoospermia: morphological and functional study. Folia Histochem Cytobiol, 2003, 41, 3, p. 125–139.
24. Piasecka, M., Gaczarzewicz, D., Laszczyńska, M., et al. Flow cytometry application in the assessment of sperm DNA integrity of men with asthenozoospermia. Folia Histochem Cytobiol, 2007, 45, Suppl. 1, p. 127–136.
25. Piomboni, P., Focarelli, R., Stendardi, A., et al. The role of mitochondria in energy production for human sperm motility. Int J Androl, 2012, 35, 2, p. 109–124.
26. Rajender, S., Rahul, P., Mahdi, AA. Mitochondria, spermatogenesis and male infertility. Mitochondrion, 2010, 10, 5, p. 419–428.
27. Rousset, S., Alves-Guerra, MC., Mozo, J., et al. The biology of mitochondrial uncoupling proteins. Diabetes, 2004, 53, Suppl. 1, p. 130–135.
28. Ruiz-Pesini, E., Díez-Sánchez, C., López-Pérez, MJ. The role of the mitochondrion in sperm function: is there a place for oxidative phosphorylation or is this a purely glycolytic process? Curr Top Dev Biol, 2007, 77, p. 3–19.
29. Scheibye-Knudsen, M., Quistorff, B. Regulation of mitochondrial respiration by inorganic phosphate; comparing permeabilized muscle fibers and isolated mitochondria prepared from type-1 and type-2 rat skeletal muscle. Eur J Appl Physiol, 2009, 105, 2, p. 279–287.
30. Spiropoulos, J., Turnbull, DM., Chinnery, PF. Can mitochondrial DNA mutations cause sperm dysfunction? Mol Hum Reprod, 2002, 8, 8, p. 719–721.
31. Stendardi, A., Focarelli, R., Piomboni, P., et al. Evaluation of mitochondrial respiratory efficiency during in vitro capacitation of human spermatozoa. Int J Androl, 2011, 34, 3, p. 247–255.
32. St. John, JC., Sakkas, D., Barratt, CL. A role for mitochondrial DNA and sperm survival. J Androl, 2000, 21, 2, p. 189–199.
33. Storey, BT., Kayne, FJ. Properties of pyruvate kinase and flagellar ATPase in rabbit spermatozoa: relation to metabolic strategy of the sperm cell. J Exp Zool, 1980, 211, 3, p. 361–367.
34. Storey, BT. Mammalian sperm metabolism: oxygen and sugar, friend and foe. Int J Dev Biol, 2008, 52, 5–6, p. 427–437.
35. Suarez, SS., Osman, RA. Initiation of hyperactivated flagellar bending in mouse sperm within the female reproductive tract. Biol Reprod, 1987, 36, 5, p. 1191–1198.
36. Suarez, SS., Ho, HC. Hyperactivation of mammalian sperm. Cell Mol Biol (Noisy-le-grand), 2003, 49, 3, p. 351–356.
37. Suarez, SS. Control of hyperactivation in sperm. Hum Reprod Update, 2008, 14, 6, p. 647–657.
38. Turner, RM. Moving to the beat: a review of mammalian sperm motility regulation. Reprod Fertil Dev, 2006, 18, 1–2, p. 25–38.
39. World Health Organization. WHO laboratory manual for the examination and processing of human semen. 5th ed. Geneva: World Health Organization, 2010, 287 p.
40. Zhang, K., Shang, Y., Liao, S., et al. Uncoupling protein 2 protects testicular germ cells from hyperthermia-induced apo-ptosis. Biochem Biophys Res Commun, 2007, 360, 2, p. 327–332.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článok vyšiel v časopiseČeská gynekologie
Najčítanejšie tento týždeň
2014 Číslo 1- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Ne každé mimoděložní těhotenství musí končit salpingektomií
- Gynekologické potíže pomáhá účinně zvládat benzydamin
- Mýty a fakta ohledně doporučení v těhotenství
-
Všetky články tohto čísla
- Stav vývoje kontracepčního vakcinogenu
- Vliv nadváhy na úspěšnost technik asistované reprodukce u neplodných žen
- Funkce mitochondrií ve spermii u mužů s normozoospermií a astenozoospermií
- Stav orálního zdraví u žen s fyziologickým a rizikovým těhotenstvím
- Závažné pooperační krvácení po operaci prolapsu pochvy po hysterektomii s užitím systému Total Prolift – kazuistika
- Syndrom úplné androgenní insenzitivity – kazuistika
- Výsledky perinatální péče o těhotné s diabetem v západních Čechách
- Vyšetření bodových mutací v genu pro interleukin-11 v populaci neplodných žen a plodných kontrol
- Národní registr komplikací gynekologické laparoskopie ČR –první zkušenosti s elektronickým sběrem dat a vize do budoucna
- Nenádorové epiteliální změny vulvy – lichen sclerosus
- Ritgenův manévr a jeho modifikace
- Porovnání technik hysterektomie v souboru jedinců operovaných z indikace transsexualismu femaleto male
- Detekce nádorových kmenových buněk karcinomu ovaria
- Máme v našej praxi monitorovať hladiny leukocytov, alebo nie?
- Odpověd na dopis redakci od MUDr. Petera Kaščáka, PhD.
- Odpověd na dopis redakci od MUDr. Petera Kaščáka, PhD.
- Vzpomínka 100. výročí narození prof. MUDr. Miloslava Uhra, CSc.
- Česká gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Nenádorové epiteliální změny vulvy – lichen sclerosus
- Syndrom úplné androgenní insenzitivity – kazuistika
- Závažné pooperační krvácení po operaci prolapsu pochvy po hysterektomii s užitím systému Total Prolift – kazuistika
- Porovnání technik hysterektomie v souboru jedinců operovaných z indikace transsexualismu femaleto male
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



