-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
CMV kolitida po orgánových transplantacích
Cytomegaloviral colitis in organ transplant recipients
Purpose of the study:
A cytomegaloviral infection causes significant morbidity in organ transplant recipients. The most frequent type of impairment of immunosuppressed patients is CMV colitis. The definitive diagnosis of CMV colitis requires the immunohistochemical examination of tissue from affected parts of the colon. It is our aim to describe our experiences with such patients in our institute and evaluate the diagnostic and therapeutic options for CMV colitis.Methods:
A total of 20 patients were identified in the electronic database of the Institute for Clinical and Experimental Medicine who had undergone organ transplantation and been hospitalised in IKEM with immunohistochemically confirmed CMV colitis in the period from January 2001 to December 2008. A retrospective evaluation was then made of the relevant data for these patients.Results:
The group of 20 patients consisted of 8 men and 12 women with an average age of ±57.4 years, standard deviation 6.1 years, range 40–67 years. 12 patients had undergone a kidney transplantation, 5 a liver transplantation and 3 a heart transplantation. The average interval between the transplantation and endoscopic examination was 38.1 months (in the range 1–140 months, median 7 months). All patients were treated with immunosuppressants – corticoids and/or various combinations of mycophenolate mofetil, cyclosporine, tacrolimus or sirolimus. 15 patients showed acute diarrhoea, 3 patients had chronic diarrhoea, one patient presented with isolated hematochezia and the other with abdominal pain only. Four of nine patients who were evaluated were found to be positive for anti-CMV-IgM. All 20 patients were tested for the presence of an early CMV antigen or CMV DNA using the blood PCR method, with 11 positive cases. Endoscopic tests showed 4 types of impairment: erythema and edema (eleven patients), multiple isolated ulcers (2 patients), erythema and edema together with ulcers (5 patients) and the image of pseudomembanous colitis (2 patients). Histological examinations of lesions showed normal inflammatory changes with dominating mononuclear cellulisation. 13 patients showed typical inclusions. All 20 patients with CMV colitis were treated with glanciclovir and/or valganciclovir. 19 patients survived, one patient died from causes unrelated to CMV colitis.Conclusion:
The diagnosis of CMV colitis in the recipients of organ transplants relies on an active diagnostic approach, including total colonoscopy, with biopsies of affected sections of the colon and their histological and immunohistochemical examination. This strategy provides early and definitive diagnosis and allows specific therapy of CMV colitis with highly effective antiviral agents in a timely manner.Key words:
cytomegalovirus – colitis – ganciclovir – immunosuppresants – organ transplantation – valganciclovir
Autoři: D. Kamenář; P. Drastich
; H. Gottfriedová; J. Malušková; J. Šperl
; P. Štirand; P. Trunečka; J. Špičák
Působiště autorů: Institut klinické a experimentální medicíny IKEM
Vyšlo v časopise: Gastroent Hepatol 2011; 65(1): 26-29
Kategorie: Klinická a experimentální gastroenterologie: původní práce
Souhrn
Účel studie:
Cytomegalovirová infekce je významnou příčinou morbidity pacientů po orgánových transplantacích. Nejčastějším typem postižení imunosuprimovaných pacientů je CMV kolitida. Definitivní diagnóza CMV kolitidy vyžaduje imunohistochemické vyšetření tkáně z postižených úseků colon. Naším cílem je popsat zkušenosti s takovými pacienty v našem institutu a zhodnotit diagnostické a terapeutické možnosti CMV kolitidy.Metody:
V elektronické databázi pacientů Institutu klinické a experimentální medicíny (IKEM) bylo identifikováno celkem 20 pacientů po orgánové transplantaci s imunohistochemicky potvrzenou CMV kolitidou v období od ledna 2001 do prosince 2008. Retrospektivně pak byla zhodnocena relevantní data těchto pacientů.Výsledky:
Ve skupině 20 pacientů bylo 8 mužů a 12 žen průměrného věku 57,4 let ± směrodatná odchylka 6,1 let, v rozmezí 40–67 let. 12 pacientů bylo po transplantaci ledviny, 5 po transplantaci jater a 3 po transplantaci srdce. Průměrná doba od transplantace k endoskopickému vyšetření byla 38,1 měsíce (v rozmezí 1–140 měsíců, medián 7 měsíců). Všichni pacienti byli léčeni imunosupresivy – kortikoidy a/nebo různými kombinacemi mykofenolát mofetilu, cyklosporinu, takrolimu nebo sirolimu. 15 pacientů udávalo akutní průjem, chronický průjem měli 3 pacienti, u jednoho pacienta se onemocnění manifestovalo pouze enteroragií a u dalšího pouze bolestmi břicha. CMV IgM byl vyšetřen u 9 pacientů a pozitivní byl u 4 z nich. Přítomnost CMV časného antigenu nebo CMV DNA metodou PCR v krvi byla vyšetřena u všech 20 pacientů s pozitivním nálezem v 11 případech. Endoskopicky jsme zaznamenali 4 typy postižení: erytém a edém (11 pacientů), vícečetné izolované vředy (2 pacienti), erytém a edém společně s vředy (5 pacientů) a obraz pseudomembranózní kolitidy (2 pacienti). Histologické vyšetření z lézí odhalilo obvyklé zánětlivé změny s dominující mononukleární celulizací. Typické inkluze byly nalezeny u 13 pacientů. Všech 20 pacientů s CMV kolitidou bylo léčeno ganciklovirem a/nebo valganciklovirem. Přežilo 19 pacientů, jeden pacient zemřel z jiné příčiny.Závěr:
Diagnóza CMV kolitidy u příjemců orgánových transplantací se opírá o aktivní diagnostický přístup zahrnující provedení totální koloskopie s biopsiemi postižených úseků colon a jejich histologickým a imunohistochemickým vyšetřením. Takto stanovená definitivní časná diagnóza umožňuje včasné zahájení specifické léčby CMV kolitidy účinnými virostatiky.Klíčová slova:
cytomegalovirus – ganciklovir – imunosupresiva – kolitida – orgánová transplantace – valganciklovirÚvod
Cytomegalovirová infekce zůstává významnou příčinou morbidity pacientů po orgánových transplantacích i v době účinných profylaktických opatření. Cytomegalovirus je členem rodiny herpetických virů a jeho seroprevalence u dospělých se pohybuje celosvětově mezi 80–90 % [1]. Cytomegalovirus má schopnost latentní infekce stejně jako ostatní herpetické viry. Ačkoli manifestní CMV onemocnění může postihnout i imunokompetentní jedince, nejčastěji se rozvíjí u imunosuprimovaných osob. CMV infekce je nejběžnější (60–70 %) infekční komplikací po orgánové transplantaci [2] a způsobuje široké spektrum klinických syndromů. Rozmanitá postižení gastrointestinálního traktu (místem, rozsahem a stupněm poškození) se vyskytují u 10–30 % příjemců se symptomy zahrnujícími bolesti břicha, nechutenství, malátnost, nauzeu, zvracení, průjem, krvácení. I když může být zasažena kterákoli část gastrointestinálního traktu, je nejčastějším typem postižení imunosuprimovaných pacientů CMV kolitida. Cílem tohoto článku je popsat zkušenosti s takovými pacienty v našem institutu a zhodnotit diagnostické a terapeutické možnosti.
Metody
V elektronické databázi pacientů Institutu klinické a experimentální medicíny bylo v období od ledna 2001 do prosince 2008 identifikováno 20 pacientů po orgánové transplantaci s diagnózou CMV kolitidy založenou na histologickém a imunohistochemickém vyšetření biopsií z postižených úseků tlustého střeva. Zároveň byly hodnoceny následující údaje: věk, pohlaví, transplantovaný orgán, doba od transplantace k endoskopickému vyšetření, typ imunosuprese, symptomy, výsledky laboratorních vyšetření – CMV sérologie, stanovení CMV DNA metodou PCR, vyšetření CMV časného antigenu, dále endoskopický nález – umístění a vzhled postižení a výsledek histologického a imunohistochemického vyšetření.
Obr. 1. Histologický obraz CMV kolitidy: vlevo – v barvení hematoxylin-eosinem, vpravo – imunohistochemický průkaz CMV (immediate early antigen CMV). Šipky označují typické „megalocyty“ s inkluzemi. Fig. 1. Histological depiction of CMV colitis: left – coloured haematoxylin-eosin, right – immunohistochemical CMV mark (immediate early antigen CMV). Arrows indicate typical ‘megalocytes’ with inclusions. 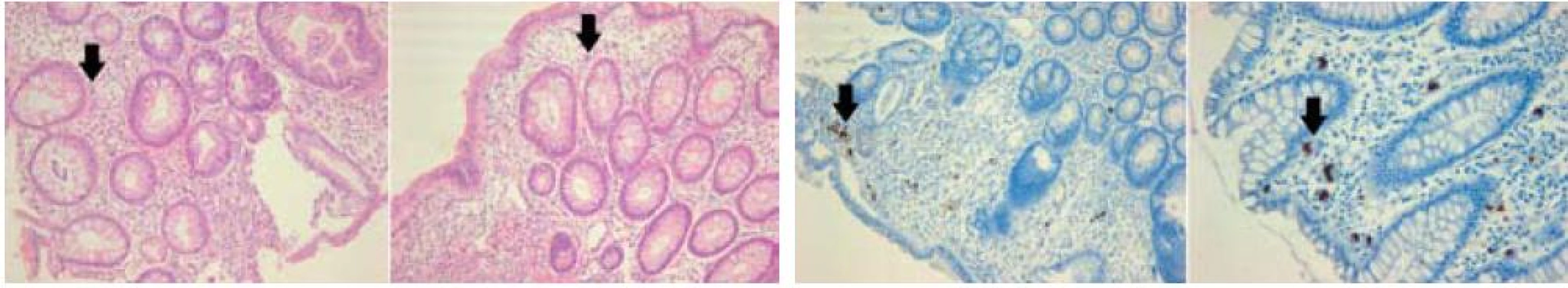
Výsledky
Ve skupině 20 pacientů bylo 8 mužů a 12 žen průměrného věku 57,4 let ± směrodatná odchylka 6,1 let, v rozmezí 40–67 let. 12 pacientů bylo po transplantaci ledviny, 5 po transplantaci jater a 3 po transplantaci srdce. Průměrná doba od transplantace k endoskopickému vyšetření byla 38,1 měsíce (v rozmezí 1–140 měsíců, medián 7 měsíců). Všichni pacienti byli léčeni imunosupresivy – kortikoidy a/nebo různými kombinacemi mykofenolát mofetilu, cyklosporinu, takrolimu nebo sirolimu.
Klinický obraz nebyl uniformní. 15 pacientů udávalo akutní průjem (více než 2 stolice denně kašovité či vodnaté konzistence trvající méně než 6 týdnů), 6 z nich spolu s febriliemi, jeden s enteroragií. Na chronický průjem (trvající déle než 6 týdnů) si stěžovali 3 pacienti, u žádného z nich se nevyskytly ani febrilie ani enteroragie. U jednoho pacienta se onemocnění manifestovalo pouze enteroragií a u dalšího pouze bolestmi břicha. CMV IgM byl vyšetřen u 9 pacientů a pozitivní byl u 4 z nich. Přítomnost CMV časného antigenu nebo CMV DNA metodou PCR v krvi byla vyšetřena u všech 20 pacientů s pozitivním nálezem v 11 případech. Endoskopicky patrné změny na sliznici colon se různily od mírného erytému k hlubokým vředům. Zaznamenali jsme 4 odlišné typy postižení: erytém a edém (11 pacientů), vícečetné izolované vředy (2 pacienti), erytém a edém společně s vředy (5 pacientů) a obraz pseudomembranozní kolitidy (2 pacienti). U 3 pacientů se jednalo o rektosigmoideální postižení, u 4 pacientů o levostranné, u 2 pacientů o pravostranné a u 11 pacientů bylo postiženo colon v celém rozsahu. Histologické vyšetření z lézí odhalilo obvyklé zánětlivé změny s dominující mononukleární celulizací. Typické inkluze byly nalezeny u 13 pacientů. Všech 20 pacientů s CMV kolitidou bylo léčeno ganciklovirem a/nebo valganciklovirem. Přežilo 19 pacientů, jeden pacient zemřel z jiné příčiny.
Tab. 1. Základní charakteristiky pacientů. Tab. 1. Basic patient characteristics. 
Diskuze
Lidský CMV je obalený virus s dvouvláknovou DNA patřící do rodiny herpetických virů. Lineární dvouvláknová DNA o velikosti asi 240 kB kóduje přibližně 230 proteinů [3]. Vedle genových produktů nutných pro replikaci viru dává vzniknout četným a rozmanitým imunomodulačním proteinům, které umožňují tomuto viru způsobit latentní nebo perzistentní infekci.
Tyto imunomodulační proteiny alterují různými způsoby imunitní odpověď organizmu. Některé z nich ovlivňují expresi molekul hlavního histokompatibilního systému (MHC) I. a II. třídy. Jiné interferují s buňkami zprostředkovanou imunitou, nebo fungují jako homologa chemokinů a cytokinů [3].
Latentní CMV je přítomen v nereplikujícím nebo pomalu replikujícím stavu v celé řadě buněk včetně polymorfonukleárů, T-lymfocytů, buněk cévního endotelu, renálních epiteliálních buněk a epiteliálních buněk slinných žláz. K sekundární infekci dochází po reaktivaci latentního viru nebo infekcí dalším CMV kmenem. Sekundární infekce je typicky provázena nižší virovou replikací a lehčím průběhem onemocnění než infekce primární [1].
Klíčový mechanizmus obrany organizmu proti CMV infekci je zprostředkován MHC restringovanými CMV specifickými cytotoxickými T-lymfocyty, tedy právě tou složkou imunitního systému nejvíce zasaženou v současnosti používanými imunosupresivy [4].
Výskyt CMV nemoci mezi příjemci orgánových transplantací se odhaduje na 8–39 %. Seronegativní příjemci, kteří obdrželi orgán od seropozitivního dárce (D+/R-) jsou v nejvyšším riziku; bez profylaxe vyvine asi 85 % z nich primární CMV infekci [5]. Před érou CMV profylaxe se CMV nemoc obvykle vyskytovala v období maximální imunosuprese, prvních 6 měsíců po transplantaci nebo po léčbě akutní rejekce. Zavedení profylaxe virostatiky po transplantaci zredukovalo celkovou incidenci CMV nemoci, avšak stoupá prevalence tzv. pozdní CMV nemoci (po ukončení profylaxe). Nejrizikovější skupinou zůstávají D+/R - pacienti, s kumulativní incidencí 30 % v 36 měsících po ukončení profylaxe [6]. V naší skupině byly pouze 3 seronegativní příjemci orgánu od seropozitivního dárce, převažujícím mechanizmem CMV nemoci v naší studii tedy byla sekundární infekce.
Existují 2 přístupy k prevenci CMV nemoci virostatiky. Jednak paušální profylaxe všech pacientů v riziku, jednak tzv. preemptivní léčba pacientů v době zvýšení CMV viremie, tedy ještě před rozvojem manifestního onemocnění. Diskuze na toto téma není uzavřena, různá pracoviště používají různá preventivní schémata. K dispozici je málo komparativních randomizovaných studií (u nemocných po transplantaci ledviny). Ačkoli obě strategie byly srovnatelně efektivní v prevenci CMV nemoci [14], univerzální profylaxe vedla k lepšímu přežití renálních štěpů [15]. Nejvhodnější délka profylaxe je pravděpodobně 6 měsíců [16].
Patogeneze CMV nemoci je iniciována tumor nekrotizujícím faktorem (TNF), který reaktivuje latentní infekci v seropozitivních tkáních. Jakýkoli proces, který vyústí v uvolnění TNF, podněcuje reaktivaci CMV, včetně tak odlišných stavů, jako je sepse, rejekce, EBV asociovaná lymfoproliferace, selhání jater, infuze amfotericinu B, alergická rekace nebo léčba antilymfocytárními protilátkami [4].
Onemocnění může propuknout kdekoli v gastrointestinálním traktu, ale nejčastjěším místem CMV infekce u příjemců orgánových transplantací je colon [1]. Mezi hlavní symptomy patří febrilie, průjem a enteroragie. Převažujícím klinickým obrazem byl v naší malé skupině akutní průjem (trvající méně než 6 týdnů) s febriliemi, nebo bez nich.
Předchozí studie uvádějí široké spektrum endoskopicky patrných změn, od skvrnitého erytému a mikroerozí k edematozní sliznici, mnohočetným erozím až hlubokým vředům a pseudotumorům [7]. Dále existuje několik kazuistických sdělení o pseudomembranózní kolitidě vyvolané cytomegalovirem [8]. V endoskopických nálezech našich pacientů dominují nespecifické zánětlivé změny sliznice. Výskyt ulcerací, ať už izolovaných, nebo v terénu zánětlivé sliznice, byl proti očekávání méně častý. Neobvyklý je endoskopický obraz pseudomembranózní kolitidy identický s clostridiovou kolitidou u dvou našich pacientů.
Diagnóza CMV kolitidy u všech studovaných pacientů byla založena na histologickém průkazu typických inkluzí a/nebo pozitivním imunohistochemickém vyšetření. Důležité je zjištění, že pouze 11 z 20 pacientů mělo pozitivní průkaz CMV viremie buď vyšetřením CMV časného antigenu, nebo stanovením CMV DNA metodou PCR. Toto pozorování je v souladu s výsledky předchozích studií a podtrhuje význam časného provedení endoskopického vyšetření s biopsiemi [2,4,9].
V naší skupině mělo 7 pacientů levostranné nebo rektosigmoideální postižení colon a 11 pacientů postižení colon v celém rozsahu. Nicméně 2 pacienti měli postižení limitované na colon proximálně od lienální flexury, nedetekovatelné sigmoideoskopicky.
Neléčená CMV kolitida u trvale imunosuprimovaného pacienta je progresivní onemocnění s vysokou mortalitou [10]. Naštěstí je specifická protivirová léčba vysoce efektivní [11–13]. V naší studii bylo ganciklovirem a/nebo valganciklovirem úspěšně léčeno 19 pacientů.
Závěrem můžeme shrnout, že diagnóza CMV kolitidy u příjemců orgánových transplantací se i nadále opírá o aktivní diagnostický přístup zahrnující provedení totální koloskopie s biopsiemi postižených úseků colon a jejich histologickým a imunohistochemickým vyšetřením. Současně je nutné vyloučit jiné typy kolitidy, které připadají v úvahu: ulcerózní, ischemická a pseudomembranózní, vyžadující jinou léčbu. Tato strategie poskytuje časnou a definitivní diagnózu, a umožňuje tak včasné zahájení specifické léčby CMV kolitidy účinnými virostatiky.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.MUDr. David Kamenář
Klinika hepatogastroenterologie IKEM
Vídeňská 1958/9
Praha 4
david.kamenar@ikem.cz
Zdroje
1. Baroco AL, Oldfield EC. Gastrointestinal cytomegalovirus disease in the immunocompromised patient. Curr Gastroenterol Rep 2008; 10(4): 409–416.
2. Korkmaz M, Kunefeci G, Selcuk H et al. The role of early colonoscopy in CMV colitis of transplant recipients. Transplant Proc 2005; 37 : 3059–3060.
3. Bobak DA. Gastrointestinal Infections Caused by Cytomegalovirus. Curr Infect Dis Rep 2003; 5(2): 101–107.
4. Rubin RH. The pathogenesis and clinical management of cytomegalovirus infection in the organ transplant recipient: the end of the ‚silo hypothesis‘. Curr Opin Infect Dis 2007; 20(4): 399–407.
5. Paya CV, Razonable RR. Cytomegalovirus infection after Solid organ transplantation. In Transplant Infectious Diseases, edn 2. Edited by Bowden RA, Ljungman P, Paya CV. Philadelphia: Lippincott Williams & Wilkins; 2003 : 298–325.
6. Arthurs SK, Eid AJ, Pederson RA et al. Delayed-onset primary cytomegalovirus disease and the risk of allograft failure and mortality after kidney transplantation. Clin Infect Dis 2008, 46(6): 840–846.
7. Ljungeman P, Griffiths P, Paya C. Definitions of cytomegalovirus infection and disease in transplant recipients. Clin Infect Dis 2002; 34(8): 1094–1097.
8. Olofinlade O, Chiang C. Cytomegalovirus infection as a cause of pseudomembrane colitis: a report of four cases. J Clin Gastroenterol 2001; 32(1): 82–84.
9. Torres HA, Kontoyiannis DP, Bodey GP et al. Gastrointestinal cytomegalovirus disease in patients with cancer: a two decade experience in a tertiary care cancer center. Eur J Cancer 2005; 41(15): 2268–2279.
10. Toogood GJ, Gillespie PH, Gujral S et al. Cytomegalovirus infection and colonic perforation in renal transplant patients. Transpl Int 1996; 9(3): 248–251.
11. Paya CV, Hermans PE, Smith TF et al. Efficacy of ganciclovir in liver and kidney transplant recipients with severe cytomegalovirus infection. Transplantation 1988; 46(2): 229–234.
12. Len O, Gavaldá J, Aguado JM et al. Valganciclovir as treatment for cytomegalovirus disease in solid organ transplant recipients. Clin Infect Dis 2008; 46(1): 20–27.
13. Asberg A, Humar A, Rollag H et al. Oral valganciclovir is noninferior to intravenous ganciclovir for the treatment of cytomegalovirus disease in solid organ transplant recipients. Am J Transplant 2007; 7(9): 2106–2113.
14. Khoury JA, Storch GA, Bohl DL et al. Prophylactic versus preemptive oral valganciclovir for the management of cytomegalovirus infection in adult renal transplant recipients. Am J Transplant 2006; 6(9): 2134–2143.
15. Kliem V, Fricke L, Wollbrink T et al. Improvement in long-term renal graft survival due to CMV prophylaxis with oral ganciclovir: Results of a randomized clinical trial. Am J Transplant 2008; 8(5): 975–983.
16. Luan FL, Stuckey LJ, Park JM et al. Six-month prophylaxis is cost effective in transplant patients at high risk for cytomegalovirus infection. J Am Soc Nephrol 2009; 20(11): 2449–2458.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článek Tahle země není pro mladýČlánek Nejen NOTESy v Barceloně
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2011 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Dynamická scintigrafie jícnu v diagnostice refluxní choroby jícnu
- Autoimunní forma chronické pankreatitidy a IgG4 pozitivní mastitida
- CMV kolitida po orgánových transplantacích
- Úspěšné použití klipu OTSC® (Over-The-Scope Clip) při léčbě iatrogenní perforace tračníku
- Je možný návrat k pôvodnej biologickej liečbe u pacienta s Crohnovou chorobou?
- Jak postupovat při ztrátě odpovědi na biologickou léčbu u nemocných s idiopatickými střevními záněty?
- Úvodník vedoucího redaktora časopisu
- Nejen NOTESy v Barceloně
- Kalendář gastroenterologických akcí 2011
- Tahle země není pro mladý
- Akútna mezenteriálna ischemia
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- CMV kolitida po orgánových transplantacích
- Je možný návrat k pôvodnej biologickej liečbe u pacienta s Crohnovou chorobou?
- Akútna mezenteriálna ischemia
- Autoimunní forma chronické pankreatitidy a IgG4 pozitivní mastitida
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



