-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Eozinofilní ezofagitida
Eosinophilic esophagitis
The article summarizes the “state of the art” concerning eosinophilic esophagitis and describes the results of our own prospective study. Eosinophilic esophagitis (EoE) is a rare and not very often diagnosed esophageal disorder. It is caused by chronic infiltration of the esophageal mucosa by eosinophils and it has typical clinical, endoscopic and histopathologic manifestations. EoE was firstly described in 1978. Traditionally, the definition of EoE has been set on the basis of an arbitrary limit of eosinophils (usually ≥ 15 eosinophils / high power field) in patients with typical symptomatology and without pathological gastroesophageal reflux (defined as negative pH-metry or by the absence of a clinical improvement during treatment with a proton pump inhibitor). Now, a new definition of EoE is being proposed where patients with gastroesophageal reflux and eosinophilic infiltration of the esophagus should also get a diagnosis of EoE. Furthermore, patients with EoE must not have eosinophilic infiltration in any of the remaining parts of the GIT. Patients with EoE usually complain about dysphagia and food impaction. The etiology and the prognosis are not clearly established. EoE’s course is usually chronic. Long lasting inflammation in the esophagus leads to changes of the esophageal wall and mucosa which become rigid as well as fragile. Therefore, mucosal lacerations or even perforations can easily occur. A risk of malignancy in patients with EoE has not yet been described and seems unlikely. EoE is detected in patients of all ages, including children with males predominating. An association with different kinds of allergies is typical. As an initial treatment option, a proton pump inhibitor is administered, and if necessary, corticosteroids (locally or systemic administration) are given. Other treatment modalities are rather experimental and are being tested in clinical trials (e.g. biologic therapy). Endoscopic dilatation is a treatment option for symptomatic patients with narrow or stenotic esophageal lumen. The prevalence of esophageal eosinophilia was 5.6% among patients referred for upper GI endoscopy. A majority of patients with eosinophils (> 15/HPF) were diagnosed with EoE. However, a high number of eosinophils was also observed in two patients with achalasia and in one patient with Barrett’s esophagus. In accordance with other authors, we confirmed the majority of patients with EoE presents with dysphagia/food impaction (90%), while an allergy was present in 50% of our patients. Almost all patients responded favourably to treatment with a proton pump inhibitor.
Key words:
eosinophilic esophagitis – dysphagia – reflux esophagitis – esophageal perforation
Autoři: A. Štrosová 1; J. Martínek 1; Š. Suchánek 1; F. Závada 1; M. Stefanová 1; B. Bunganič 1; I. Tučková 2; P. Hrabal 2; M. Zavoral 1
Působiště autorů: Interní klinika 1. LF UK a ÚVN Praha 1; Oddělení patologie, ÚVN Praha 2
Vyšlo v časopise: Gastroent Hepatol 2011; 65(5): 272-278
Kategorie: Klinická a experimentální gastroenterologie: přehledová práce
Souhrn
Článek shrnuje dosavadní znalosti o eozinofilní ezofagitidě (EoE) a představuje výsledky vlastní prospektivní studie. Eozinofilní ezofagitida (EoE) je poměrně vzácná a dosud málo diagnostikovaná choroba. Jedná se o chronické zánětlivé onemocnění jícnu s typickými klinickými, endoskopickými a histopatologickými znaky. Poprvé byla popsána v r. 1978. EoE byla tradičně definována jako onemocnění, při kterém je sliznice jícnu infiltrována zvýšeným počtem eozinofilních leukocytů (arbitrárně stanoveným 15 a více eozinofilů / zorné pole) u pacientů s typickými příznaky a absencí gastroezofageálního refluxu (normální výsledek pH-metrie nebo klinická neodpovídavost na antisekreční léčbu). V současnosti je navržena nová definice onemocnění, při které se do této nozologické jednotky zahrnují také pacienti s patologickou infiltrací jícnové sliznice eozinofily a zároveň pozitivním výsledkem pH-metrie nebo s příznivou odpovědí na antisekreční léčbu. Nutnou podmínkou diagnózy EoE je nepřítomnost eozinofilní infiltrace sliznice v jiných částech GIT. Klinicky se EoE projevuje nejčastěji dysfagií. Etiologie ani dlouhodobá prognóza nejsou známy, průběh je chronický. Protrahovaný zánět vyvolává strukturální změny ve stěně jícnu, která se stává „tužší“ a fragilní, díky čemuž je náchylná ke vzniku slizničních lacerací, perforaci a ruptuře. Dosud nebyl prokázán maligní potenciál. EoE postihuje všechny věkové skupiny, vyskytuje se velice často u dětí, bývá zde převaha mužského pohlaví. Častá je asociace s různými typy alergií. Léčba se zahajuje inhibitory protonové pumpy (PPI), v případě nutnosti se přechází na kortikoidy (lokální či systémově podávané), jiné léčebné modality jsou zkoušeny v klinických studiích (např. biologická léčba). V péči o pacienty EoE se uplatňuje také endoskopická dilatace. V naší prospektivní studii jsme prokázali prevalenci jícnové eozinofilie 5,6 % u pacientů, kteří byli referováni k endoskopii horní části trávicího traktu. Většina pacientů s počtem eozinofilů nad 15/HPF mělo diagnostikovánu EoE, nicméně vysoký počet eozinofilů se objevil i u dvou pacientů s achalázií a u jednoho s Barrettovým jícnem. V souhlasu se zkušenostmi ostatních autorů jsme potvrdili přítomnost dysfagie/váznutí sousta u většiny pacientů s EoE (90 %) a výskyt alergického onemocnění jsme pozorovali u 50 % nemocných. Většina našich pacientů s EoE pozitivně odpověděla na léčbu inhibitory protonové pumpy.
Klíčová slova:
eozinofilní ezofagitida – dysfagie – refluxní choroba jícnu – perforace jícnuCílem následujícího článku je shrnout základní poznatky o relativně vzácné nozologické jednotce – eozinofilní ezofagitidě (EoE). Zdůrazněna bude aktuální snaha o změnu definice diagnostických kritérií, kterou považujeme pro další vývoj za klíčovou. Současně autoři předkládají některé z vlastních výsledků včetně příkladů endoskopického a histologického obrazu.
Definice EoE
EoE je chronické zánětlivé onemocnění jícnu, při kterém nacházíme izolovanou infiltraci jícnové sliznice eozinofilními leukocyty, které se jinak v jícnu vůbec nevyskytují [1,2]. Podle původní definice nalézáme následující trias: typické jícnové příznaky, jícnová eozinofilie, tj. přítomnost eozinofilů ve sliznici jícnu v počtu > 15 eozinofilů /HPF (High Power Filed, 1 HPF = 0,24 mm2) bez průkazu eozinofilní infiltrace ostatních částí GIT a vyloučený patologický gastroesofageální reflux (negativní pH-metrie či absence klinického zlepšení při léčbě protonovými inhibitory).
Nicméně je známou zkušeností, že mnoho pacientů s předpokládanou EoE či významnou jícnovou eozinofilií mělo výborný klinický efekt antisekreční léčby (až 39 %), popřípadě pozitivní pH-metrii [3]. Jícnová eozinofilie je přitom přítomna jen u velice malé části pacientů s refluxní ezofagitidou (z naší zkušenosti max. 5,5 %, přičemž většinou se jedná o nízké počty eozinofilů, cca 1–5/HPF).
Podle nového návrhu [4] se EoE rozděluje dvě skupiny: na „EoE s odpovědí na PPI“ a „EoE bez odpovědi na PPI“ (obr. 1). Jinými slovy, v nové definici již nebude platit poslední podmínka, tj. absence patologického gastroezofageálního refluxu.
Obr. 1. Nový návrh definice a diagnostického postupu u pacienta se suspektní EoE [4]. Fig. 1. Newly proposed definition and diagnostic procedure in a patient with suspected EoE [4]. ![Nový návrh definice a diagnostického postupu u pacienta se suspektní EoE [4].
Fig. 1. Newly proposed definition and diagnostic procedure in a patient with suspected EoE [4].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/09c17f487547271de7ef98cbf3cdd059.jpg)
Charakteristika EoE
Epidemiologie
EoE je hlášena s rostoucí frekvencí ze všech kontinentů s výjimkou Afriky. Vyskytuje se ve všech věkových skupinách, ale významně převažují mladí muži do 30 let. Poměr mužů a žen je 3 : 1. Údaje o incidenci a prevalenci se různí, nejčastěji udávaná incidence je 1/100 tis., prevalence 20–30/100 tis. [5].
Jedna ze studií ukázala, že prevalence EoE stoupá a jde ruku v ruce s nárůstem atopických a alergických onemocnění ve stejném časovém období. V r. 1995 byla prevalence EoE jen 0,5/100 tis., přičemž v 2004 již téměř 8,9/100 tis [6]. Rovněž bývá popisován rodinný výskyt: cca u 7 % pacientů má EoE jeden z rodičů a u 5 % sourozenec [6,7].
Podle publikovaných studií je prevalence EoE mezi endoskopovanými 1,1 % u pacientů bez jícnových symptomů, 6,5 % u pacientů s horní dyspepsií, 10 % u pacientů s neobstruktivní dysfagií a 50 % u pacientů se zaklíněným soustem v jícnu [8].
Patofyziologie
Není zcela jasné, čím je patologická infiltrace především hlubších vrstev stěny jícnu způsobena. Zcela jistě jde o onemocnění multifaktoriální, na kterém se podílí genetické faktory, imunitní systém a faktory prostředí (alergeny). V etiopatogenezi hraje roli jak IgE, tak i „non-IgE“ zprostředkovaná reakce [9].
Významnou roli při rozvoji imunitní reakce mají chemokiny, tj. látky, které indukují chemotaxi a uvolňování histaminu a leukotrienů, a mají tak úlohu při alergiích. V polovině 90. let byl objeven jeden z nich – tzv. eotaxin, který je specifickým chemotaktickým faktorem pro eozinofily. Receptor pro eotaxin (CCR3) se nachází jak na eozinofilech, tak i na bazofilech a Th2 lymfocytech [10]. Zdá se, že u pacientů s EoE je klíčové „nasměrování“ eozinofilních leukocytů po antigenním podnětu do stěny jícnu pomocí eotaxinu [10]. IL-4, IL-5 a další cytokiny pak aktivují ostatní efektorové buňky imunitní odpovědi [11].
Při rozvoji EoE zřejmě dochází u geneticky predisponovaného hypersenzitivního jedince po specifickém podnětu (potravinový alergen, aeroalergen) k imunologicky podmíněné reakci, na které se podílí především aktivované Th2 lymfocyty, žírné buňky a B-lymfocyty. Dochází ke zvýšené produkci cytokinů (IL-4, IL-5, IL-13) a IgE a migraci eozinofilů do stěny jícnu s následným uvolněním kationických toxických proteinů z eozinofilních granul a rozvoji zánětu [12]. Následkem dlouhotrvajícího eozinofilního zánětu dochází k remodelaci stěny jícnu, která se stává méně elastickou a je více fragilní.
Možný model vzniku EoE s možnými léčebnými zásahy je zobrazen na obr. 2.
Obr. 2. Patofyziologické schéma vzniku EoE. Hlavní úlohu hrají alergeny u geneticky predisponovaného jedince a Th2 indukovaná imunitní odpověď. Klíčovou úlohu při chemotaxi eozinofilů mají jednak IL-13 a chemokin eotaxin. Ve schématu naznačena i místa terapeutického zásahu (steroidy, dieta, anti IL-5). Fig. 2. Pathophysiological diagram of EoE origin. The main role is played by allergens in genetically predisposed individuals and Th2-induced immunity response. In the chemotaxis of eosinophils, both IL-13 and chemokine eotaxin play a crucial role. The diagram also indicated sites of therapeutical intervention (steroids, diet, anti IL-5). 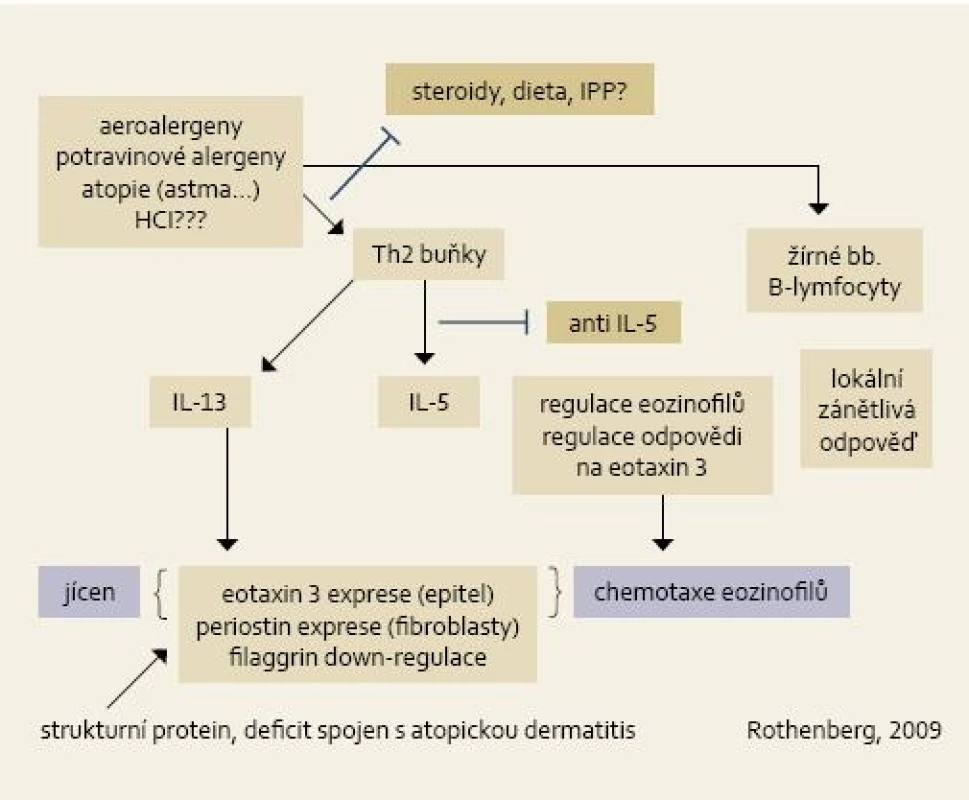
Důležitou otázkou etiopatiopatogeneze EoE je role gastroezofageálního refluxu – může tento být příčinou nebo následkem EoE? Při první hypotéze, tj. že reflux je u některých pacientů příčinou EoE, je úloha žaludeční HCl, která sama o sobě nemůže být alergenem, spekulativní. Lze předpokládat, že v žaludeční šťávě je mimo HCl i mnoho alergenů – např. zbytky potravy, proteiny apod., které při refluxu mohou působit jako vyvolávající faktor. Pro tuto hypotézu (alespoň u části nemocných) hovoří vysoké procento pacientů, kteří mají úplnou nebo téměř úplnou symptomatickou odpověď na léčbu inhibitorory protonové pumpy. Naopak při druhé hypotéze, tj. že reflux je následkem EoE, se uplatňuje myšlenka, že stěna jícnu včetně distální části je patologicky změněna v důsledku zánětu, klesá tonus, zhoršuje se funkce dolního svěrače jícnu, a tím dochází k refluxu. Proti této druhé hypotéze však hovoří naprosto mizivé procento pacientů s refluxní ezofagitidou, kteří mají zároveň jícnovou eozinofilii.
EoE a vztah s RCHJ – vlastní pozorování
Studie provedené v posledních letech dokazují, že EoE a RCHJ jsou dvě nozologické jednotky, které se zčásti vyskytují společně, a zatím není jasné, jak je tento průnik velký. Jisté je, že většina pacientů s RCHJ nemá eozinofilii [4,13]. I v naší prospektivní studii jsme detekovali eozinofily jen vzácně v jícnových biopsiích u pacientů s refluxní ezofagitidou (5,5 % a většinou ve velmi nízkém počtu 1–5 eoz. /HPF). Naopak u našich pacientů s prokázanou EoE byl gastroezofageální reflux prokazatelný u 12 pacientů z 20 (60 %) a léčebný efekt PPI byl přítomný u většiny pacientů (více než 90 %) (tab. 1) [14].
Tab. 1. Symptomatologie pacientů s E oE – vlastní výsledky (n = 20). Tab. 1. Symptomatology in patients with EoE – our own results (n = 20). 
Klinické příznaky
Příznaky u dospělých pacientů bývají letité, nejtypičtější je intermitentní dysfagie, bývá popisována i nekardiální bolest na hrudi a refluxní symptomatologie [15,16]. Vysoké procento (nad 50 %) pacientů má různé druhy alergií (potravinové alergie, astma, atopický ekzém apod.). Právě asociace alergie a jícnových příznaků je pro diagnózu EoE typická, byť ne u všech pacientů musí být alergické onemocnění přítomno.
U dětí bývají příznaky méně specifické, nejčastěji jde o nauzeu, zvracení, bolesti břicha a neprospívání, dále pyrózu, dysfagii či regurgitaci. Dlouhodobá prognóza onemocnění není známa a maligní zvrat dosud nebyl popsán. Průběh EoE je variabilní a závisí na léčbě. Většinou uplyne od prvních klinických příznaků do stanovení správné diagnózy několik let [7,16].
Souvislost s alergiemi
Stoupající počet pacientů s EoE má pravděpodobně souvislost s nárůstem počtu alergií obecně ve vyspělých zemích [17]. Např. Penfield et al zjišťovali výskyt alergií u pacientů s EoE: u 50 % byla alergie na potraviny, u 93 % aeroalergie a celkem 81 % pacientů mělo jednu či více alergií [17]. Mezi nejčastější alergické potraviny patří arašídy, vaječný bílek, sója, kravské mléko a ořechy. V naší studii jsme prokázali výskyt alergie u 50 % pacientů (tab. 1) [14].
Diagnostika, endoskopický obraz
Základní úlohu má pečlivě provedená anamnéza, kdy nás typická kombinace příznaků (dysfagie a alergie) nutí na tuto diagnózu přímo pomýšlet.
Endoskopické vyšetření s odběrem biopsií je však jediná metoda, která může diagnózu jednoznačně stanovit. Zde je třeba zdůraznit, že u každého pacienta s dysfagií nebo váznutím sousta, pokud endoskopické vyšetření nezjistí jednoznačné vysvětlení (např. nádor), je namístě odběr biopsií z distálního a proximálního jícnu k histologickému vyšetření. Vhodné je patologovi zdůraznit, že nás zajímá nejen přítomnost, ale i počet eozinofilů na zorné pole.
Endoskopický obraz může být velice různorodý, může být i zcela normální [1,14]. Poměrně typicky se vyskytují následující nálezy, které by měly být vždy podrobněji popsány v endoskopické zprávě:
- „Krepování“, tzv. rings – jedná se o cirkulární náznaky prstenců, sliznice jícnu má charakter „krepovaného papíru“ (obr. 3).
- Lineární rýhy či brázdy, tzv. furrows (obr. 4).
- Bělavé tečkovité plaky (makroskopický ekvivalent eozinofilních abscesů).
- Zúžení lumen (obr. 5).
Obr. 3. Endoskopický obraz výrazného krepování (rings) sliznice jícnu u pacienta s dg. EoE. Fig. 3. Endoscopic image of significant rings of the esophageal mucosa in a patient with EoE. 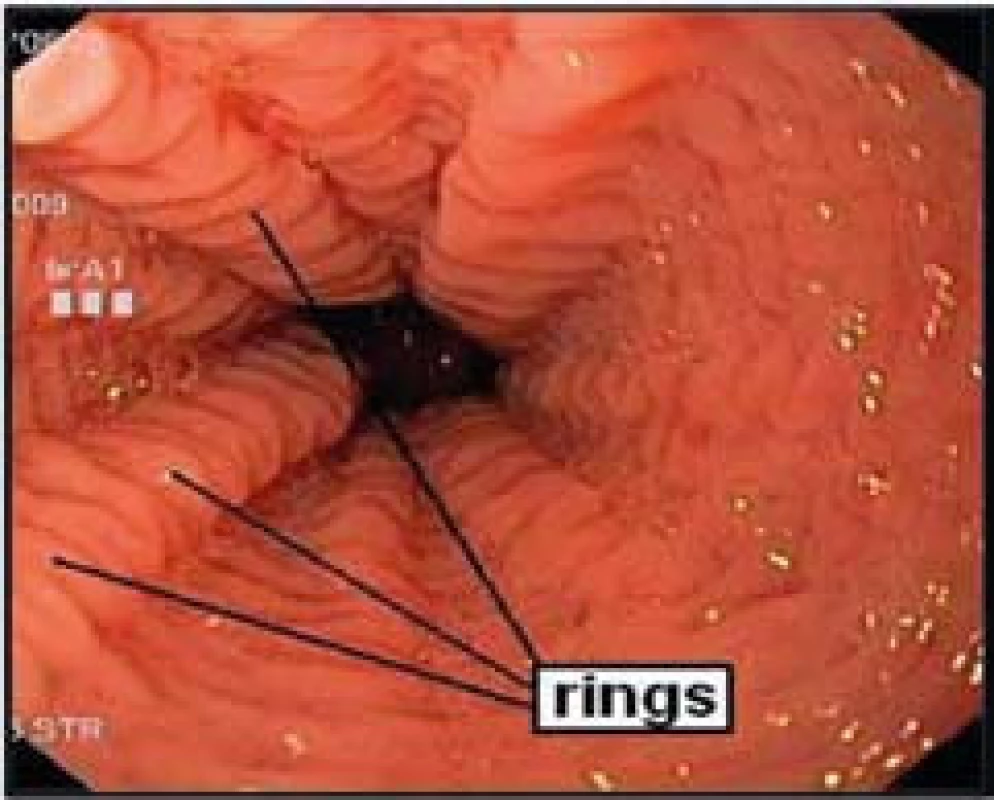
Obr. 4. Endoskopický obraz typických podélných rýh (furrows) u pacienta s dg. EoE. Fig. 4. Endoscopic image of typical longitudinal furrows in a patient with EoE. 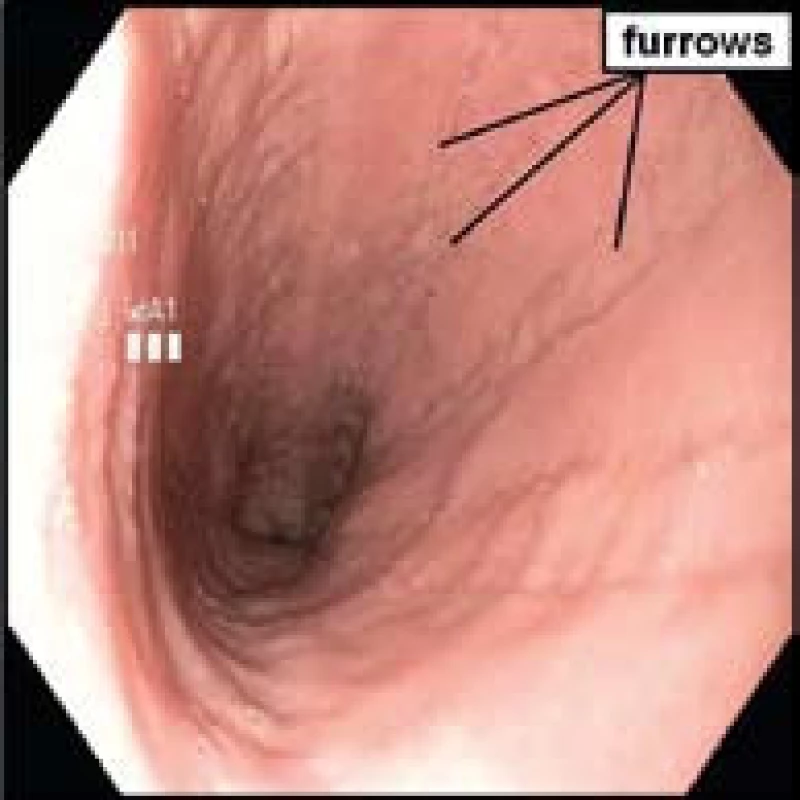
Obr. 5. Endoskopický obraz zúženého lumen jícnu s podélnými rýhami u pacienta s dg. EoE. Fig. 5. Endoscopic image of narrow esophageal lumen with longitudinal furrows in a patient with EoE. 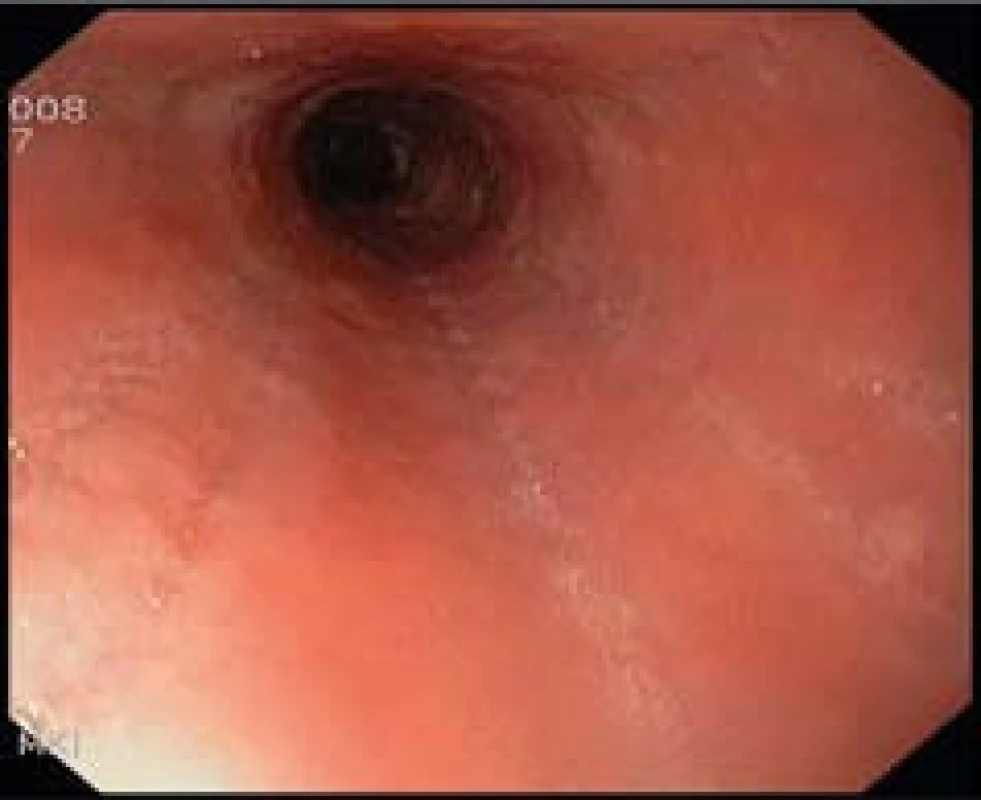
Histologicky je EoE charakterizována přítomností eozinofilů ve sliznici jícnu v počtu ≥ 15 eozinofilů /HPF (obr. 6). Biopsie ze žaludku a duodena musí být bez průkazu eozinofilů. Typickým histologickým nálezem je i tzv. eozinofilní mikroabsces (obr. 7).
Obr. 6. Histologický obraz infiltrace sliznice jícnu eozinofily. Fig. 6. Histological image of esophageal infiltration by eosinophils. 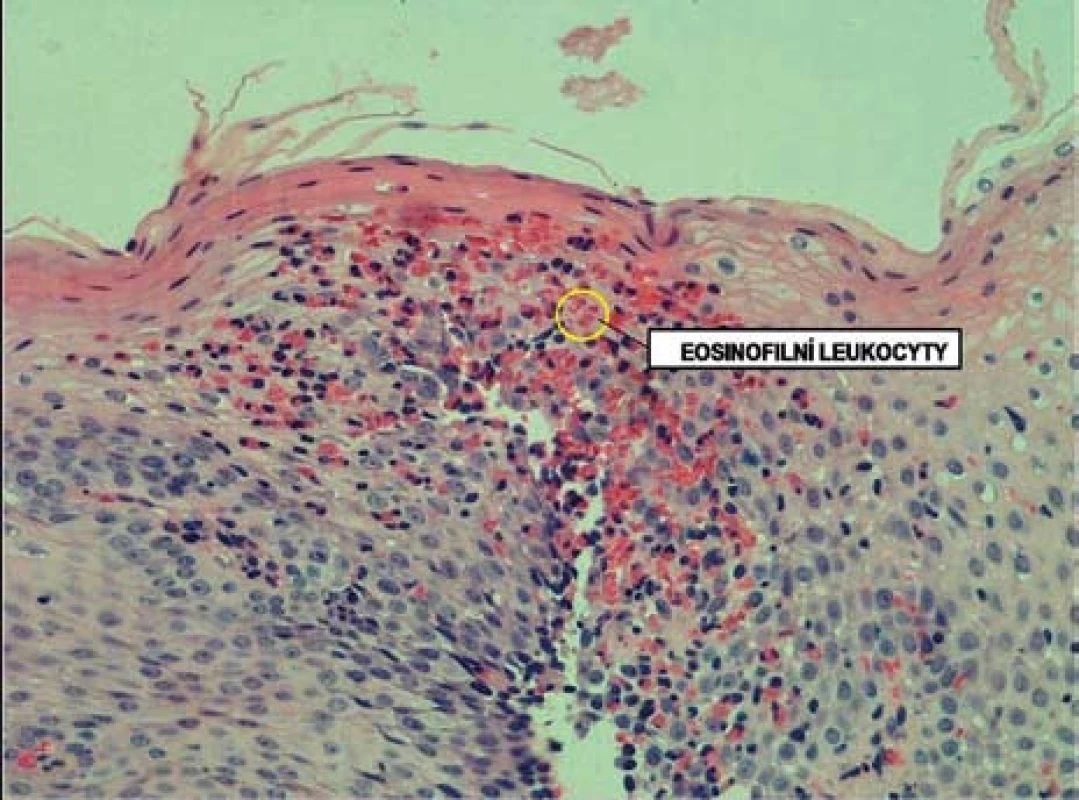
Obr. 7. Histologický obraz eozinofilního mikroabscesu. Fig. 7. Histological image of eosinophilic microabscess. 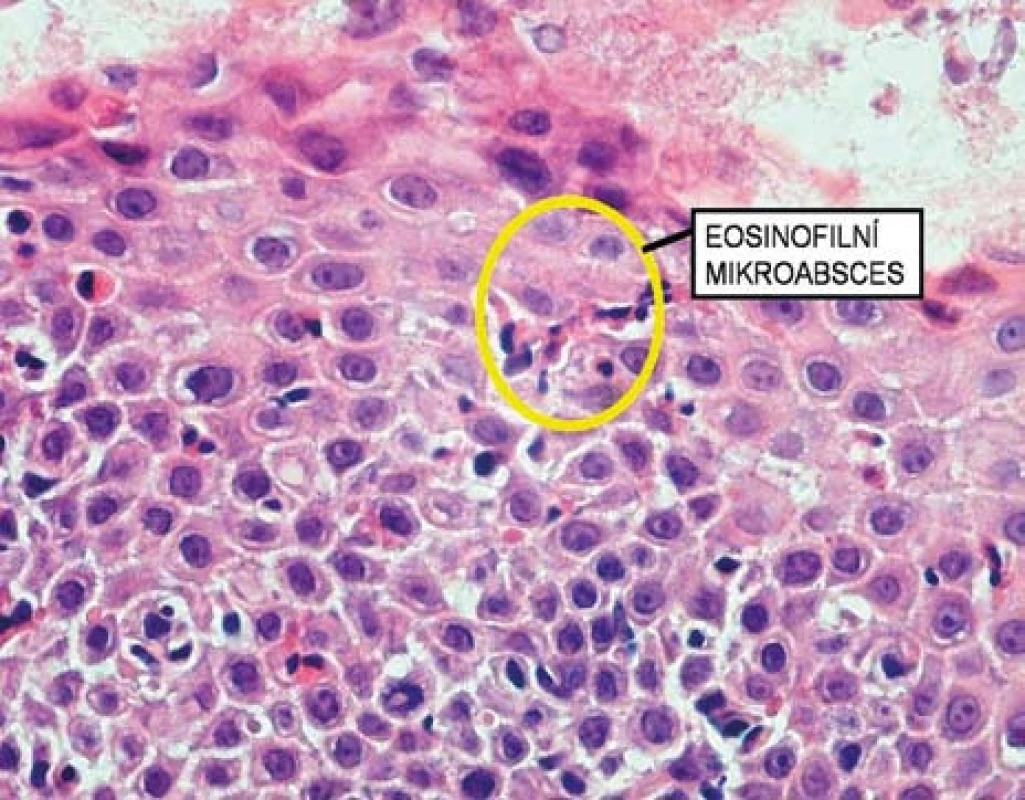
K diagnostickému postupu by dále mělo patřit vyšetření hladiny IgE (většinou zvýšené), v případě výskytu alergie kompletní alergologické vyšetření a v případě závažnější dysfagie lze event. doplnit rentgenologické vyšetření (polykací akt), event. manometrické vyšetření a scintigrafii jícnu.
Diferenciální diagnóza
V diferenciální diagnóze musíme zvážit i jiné příčiny dysfagie, především nádory jícnu, těžkou refluxní nebo mykotickou ezofagitidu, peptické stenózy, Schatzkiho prstenec a velké hiátové hernie.
V případě nálezu jícnové eozinofilie je nutné zvážit, zda se opravdu jedná o EoE nebo o průvodní infiltraci při jiné chorobě. S eozinofilií mohou být spojeny např. mykózy jícnu. Refluxní choroba jícnu a refluxní ezofagitida, pokud nalezneme eozinofily v počtu 14 a méně / zorné pole, do diferenciální diagnózy patří také, zde se totiž o EoE nejedná. Sami jsme zjistili vysoký počet eozinofilů u dvou pacientů s Barrettovým jícnem a u jednoho s achalázií (nejspíše při sekundárním zánětu při stagnaci stravy) [14]. Tedy i při nálezu eozinofilů v jícnu v počtu více než 15 na zorné pole se vždy nemusí bezpodmínečně jednat o diagnózu EoE a je třeba zvážit i ostatní možnosti.
Léčba
Při průkazu alergie se vždy zavádí eliminační dieta.
Léčba se zahajuje PPI ve vyšší dávce, která vede u většiny pacientů k odstranění klinických příznaků [18]. Dle posledních údajů mají PPI i protizánětlivé, na inhibici sekrece HCl nezávislé účinky, jelikož omeprazol blokuje sekreci eotaxinu [19]. Tím by se dal vysvětlit dobrý efekt u pacientů EoE bez přítomnosti refluxu.
Většina pacientů s EoE (75 %) odpovídá příznivě na podávání PPI. Tito pacienti nemívají typickou refluxní symptomatologii a mají fyziologickou míru refluxu při 24hodinové monitoraci pH. Podle současné definice jde o „EoE s odpovědí na PPI“ (obr. 1).
Pacienti, kteří neodpoví na léčbu PPI (čili „EoE bez odpovědi na PPI“), jsou léčeni jinými způsoby. Mezi ně patří v první řadě podávání kortikoidů – lokální (flutikason propionát 250 μg 2× denně) nebo systémové, kdy dochází jak ke zlepšení symptomatologie, tak i poklesu jícnové eozinofilie a hladiny IgE [20].
U některých pacientů je možné léčbu kortikoidy po čtyřech týdnech vysadit, avšak pravidlem je recidiva příznaků, většina pacientů by proto měla být léčena (což platí i pro léčbu s PPI) dlouhodobě.
Jeden z průkopníků a nejuznávanějších specialistů v oblasti EoE, švýcarský gastroenterolog Alex Straumann, publikoval v letech 2010 a 2011 studie o efektu léčby s lokálně působícím budesonidem (supenze, 2 mg/den) [20,21]. Budesonid vedl jak v krátkodobém, tak dlouhodobém horizontu ke zlepšení symptomatologie, poklesu počtu eozinofilů a zlepšení endoskopického nálezu u většiny pacientů.
Ve studiích byl též zkoušen efekt antagonistů leukotrienových receptorů (montelukast), anti-IL5 (mepolizumab), purinových analog (azathioprin, 6-merkaptopurin) či anti-TNF [22–25]. Užití antihistaminik má minimální účinek.
U pacientů se zúžením lumen či u pacientů s rezistentní symptomatologií je indikována léčba endoskopickou dilatací, většinou bužiemi [26]. Při dilatacích je nutno postupovat nanejvýš opatrně vzhledem k riziku snadného vzniku slizničních ragád či trhlin (obr. 8 a,b). Efekt dilatační léčby bývá dlouhodobý, nicméně recidivy nejsou překvapením [27].
Obr. 8a. Endoskopický obraz zúženého lumen jícnu před dilatací bužiemi u pacienta s významnou dysfagií a opakovaným zaklíněním sousta při dg. EoE. Fig. 8a. Endoscopic image of narrow esophageal lumen before bougie dilatation in a patient with serious dysphagia and repeated food impaction diagnosed with EoE. 
Obr. 8b. Endoskopický obraz slizniční ragády u téhož pacienta po dilataci bužiemi. Fig. 8b. Endoscopic image of mucosal fissures in the same patient after bougie dilatation. 
Obr. 8. Zaklíněné tuhé sousto u pacienta s dg. EoE ve zúženém distálním jícnu. Fig. 9. Impacted solid food in a patient with EoE in the narrow distal esophageal. 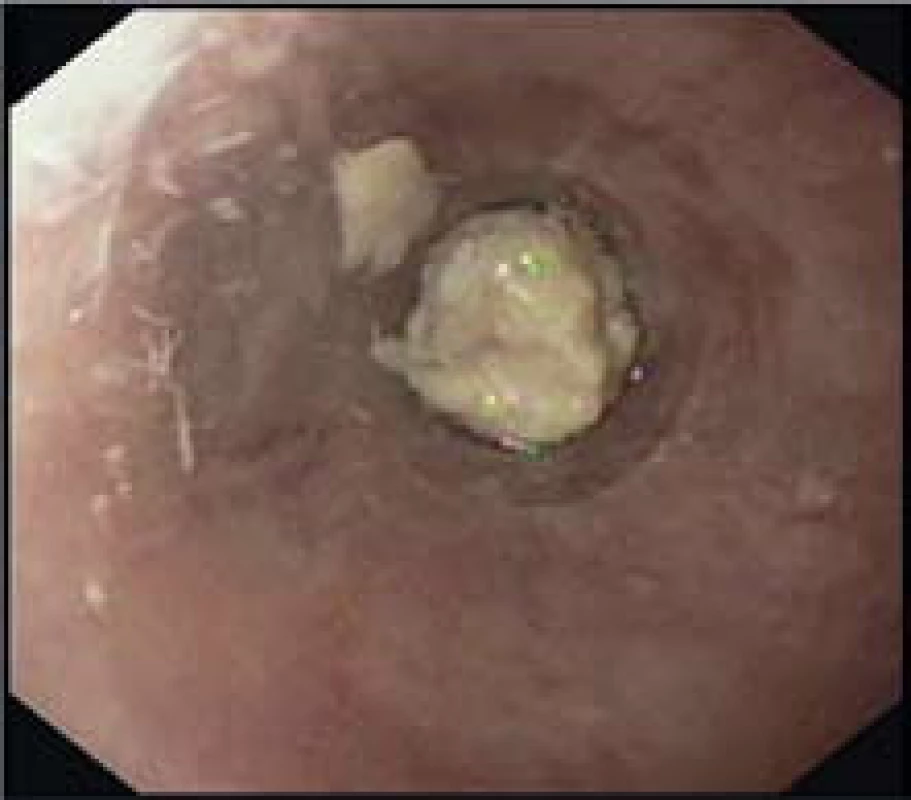
Vlastní zkušenosti
Do naší prospektivní monocentrické studie byli zařazeni pacienti po podpisu informovaného souhlasu a bez kontraindikací (pacienti nespolupracující, těžce komorbidní či onkologičtí, s jaterní cirhózou s projevy portální hypertenze), kteří na našem pracovišti od června do prosince 2009 podstoupili endoskopické vyšetření horní části trávicího traktu [14]. Všem jsme odebrali po čtyřech biopsiích z distálního a proximálního jícnu. Přítomnost a počet eozinofilů v biopsiích hodnotili dva zkušení patologové. Celkem bylo vyhodnoceno 3 384 biopsií od 514 pacientů. Při průkazu jícnové eozinofilie byli pacienti vyšetřováni dle protokolu (odebrána anamnéza včetně alergické, provedena 24hodinová jícnová pH-metrie a stacionární manometrie jícnu, stanoveno sérové IgG, provedeny kontrolní endoskopie s rebiopsiemi v intervalech 3, 6, 12 a 24 měsíců).
Zjistili jsme prevalenci jakékoli jícnové eozinofilie u 5,6 % pacientů (29 pacientů z 514), z toho 20 pacientů mělo ≥ 15 eozinofilů/HPF. Z těchto 20 pacientů mělo 17 diagnózu EoE (85 %) a 3 pacienti jiné diagnózy (15 %) jako např. pokročilou achalázii s mykotickou ezofagitidou či Barrettův jícen. Průměrný počet eozinofilů byl v souboru pacientů s EoE distálně 24 ± 17/1 HPF, proximálně 22 ± 21/1 HPF.
Většina pacientů měla klasické příznaky (tab. 1) i zvýšenou hladinu IgE.
Tab. 2. Eozinofilie u různých diagnóz – vlastní výsledky. Tab. 2. Eosinophilia with various diagnoses – our own results. 
Analyzovali jsme též přítomnost eozinofilů u jiných diagnóz. Potvrdili jsme vzácný výskyt jícnové eozinofilie u pacientů s normálním jícnem, Barrettovým jícnem, refluxní ezofagitidou či achalázií jícnu (tab. 2).
V našem souboru pacientů s EoE jsme pro typické endoskopické znaky (tj. rings/furrows) zjistili 94% senzitivitu a 70% specificitu (pozitivní prediktivní hodnota byla 31,8 % a negativní prediktivní hodnota byla 98,8 %) [14].
Doporučení pro diagnostiku a léčbu EoE
Eozinofilní ezofagitida je méně časté a lékaři dosud spíše opomíjené onemocnění. Zásadní pro diagnózu je histologický průkaz eozinofilní infiltrace jícnu, kdy počet eozinofilů na zorné pole při velkém zvětšení má být ≥ 15. Klinicky se onemocnění manifestuje váznutím sousta, dysfagií a event. nekardiální bolestí na hrudi. Velmi častá je asociace s různými alergickými onemocněními. Při podezření na EoE je nutné odebrat biopsie z jícnu (žádost o odběr takových biopsií by měl odesílající lékař uvést do žádanky). Patologa pak musíme požádat i o spočítání eozinofilů v biopsiích.
Pacienti s EoE mají často, ale ne vždy, typický endoskopický obraz, kdy nalézáme krepování sliznice jícnu, podélné nehluboké rýhy, bělavé tečkovité plaky či zúžení lumen.
V léčbě se uplatňují inhibitory protonové pumpy, topické i systémové steroidy a endoskopické dilatace bužiemi. U rezistentních případů lze volit další léčebné, byť dosud neověřené způsoby.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Doručeno/Submitted: 25. 9. 2011
Přijato/Accepted: 1. 10. 2011
MUDr. Alice Štrosová
Interní klinika 1. LF UK a ÚVN Praha
U Vojenské nemocnice 1200
169 02 Praha 6
alice.strosova@uvn.cz
Zdroje
1. Remedios M, Campbell C, Jones DM et al. Eosinophilic esophagitis in adults: clinical, endoscopic, histologic findings, and response to treatment with fluticasone propionáte. Gastrointestinal Endoscopy 2006; 63(1): 3–12.
2. Liacouras CA, Furuta GT, Hirano I et al. Eosinophilic esophagitis: updated consensus recommendations for children and adults. J Allergy Clin Immunol 2011; 128(1): 3–20.
3. Dranove JE, Horn DS, Davis MA et al. Predictors of response to proton pump inhibitor therapy among children with significant esophageal eosinophilia. J Pediatr 2009; 154(1): 96–100.
4. Hirano I. Eosinophilic esophagitis and gastroesophageal reflux disease: there and back again. Clin Gastroenterol Hepatol 2011; 9(2): 99–101.
5. Remedios M, Jones D, Kerlin P. Eosinophilic oesophagitis: epidemiology, pathogenesis and management. Drugs 2011; 71(5): 527–540.
6. Chehade M. Epidemiology and etiology of eosinophilic esophagitis. Gastrointest Endosc Clin N Am 2008; 18(1): 33–44.
7. Straumann A, Spichtin HP, Grize L et al. Natural history of primary eosinophilic esophagitis: A follow-up of 30 adult patients for up to 11.5 years. Gastroenterology 2003; 125(6): 1660–1669.
8. Veerappan GR, Perry JL, Baker TP et al. Prevalence of Eosinophilic Esophagitis in an Adult Population Undergoing Upper Endoscopy: A Prospective Study. Clin Gastroenterol Hepatol 2010; 7(4): 420–426.
9. Gutierrez-Ramos JC, Lloyd C, Gonzalo JA et al. Eotaxin: from an eosinophilic chemokine to a major regulator of allergic reactions. Immunology Today 1999 : 20(11): 500–504.
10. Blanchard C, Wang N, Stringer KF et al. Eotaxin-3 and a uniquely conserved gene-expression profile in eosinophilic esophagitis. J Clin Invest 2006; 116 : 536–547.
11. Baggiolini M. Chemokines and leukocyte traffic. Nature 1998; 392(6676): 565–568.
12. Mishra A. Mechanism of eosinophilic esophagitis. Immunol Allergy Clin North Am 2009; 29(1): 29–40.
13. Dellon ES, Chen X, Miller CR et al. Tryptase staining of mast cells may differentiate eosinophilic esophagitis from gastroesophageal reflux disease. Am J Gastroenterol 2011; 106(2): 264–271.
14. Martinek J, Strosova A, Kostalova K et al. Significant Esophageal Eosinophilia and Typical Endoscopic Features are Highly but Not Exclusively Specific for Eosinofilic Esophagitis. Gastroenterology 2010; 138(5); Suppl 1: S177–178.
15. Furuta GT, Liacouras CA, Collins MH et al. Eosinophilic esophagitis in children and adults : a systematic review and konsensus recommendatins for diagnosis and treatement. Gastroenterology 2007; 133(4): 1342–1363.
16. Straumann A. The natural history and complications of eosinophilic esophagitis. Gastrointest Endosc Clin N Am 2008; 18(1): 99–118.
17. Penfield JD, Lang DM, Goldblum JR et al. The role of allergy evaluation in adults with eosinophilic esophagitis. J Clin Gastroenterol 2010; 44(1): 22–27.
18. Molina-Infante J, Ferrando-Lamana L, Ripoll C et al. Esophageal Eosinofilic Infiltration Respons to Proton Pump Inhibition in Most Adults. Clin Gastroenterol Hepatol 2011; 9(2): 110–117.
19. Zhang X, Cheng E, Huo X et al. In esophageal squamous epithelial cell lines from patients with eosinophilic esophagitis (EoE), omeprazole blocks the stimulated secretion of eotaxin-3: a potential anti-inflammatory effect of omeprazole in EoE that is independent of acid inhibition. Gastroenterology 2010; 138 (Suppl 1): S122.
20. Straumann A, Degen L, Felder S et al. Budesonide as induction treatment for active eosinophilic esophagitis in adolescents and adults: a randomized, doubleblind, placebo-controlled study (Bee-I trial). Gastroenterology 2008; 134: A104.
21. Straumann A, Conus S, Degen L et al. Budesonide Is Effective in Adolescent and Adult Patients With Active Eosinophilic Esophagitis. Gastroenterology 2010; 139(5): 1526–1537.
22. Remedios M, Jones D, Kerlin P. Eosinophilic oesophagitis: epidemiology, pathogenesis and management. Drugs 2011; 71(5): 527–540.
23. Straumann A, Conus S, Grzonka P et al. Anti-interleukin-5 antibody treatment (mepolizumab) in active eosinophilic oesophagitis: a randomised, placebo-controlled, double-blind trial. Gut 2010; 59(1): 21–30.
24. Lucendo AJ, De Rezende LC, Jiménez-Contreras S et al. Montelukast Was Inefficient in Maintaining Steroid-Induced Remission in Adult Eosinophilic Esophagitis. Dig Dis Sci 2011; [Epub ahead of print].
25. Assa'ad AH, Gupta SK, Collins MH et al. An Antibody Against IL-5 Reduces Numbers of Esophageal Intraepithelial Eosinophils in Children With Eosinophilic Esophagitis. Gastroenterology 2011; [Epub ahead of print].
26. Hirano I. Dilation in eosinophilic esophagitis: to do or not to do? Gastrointest Endosc 2010; 71(4): 713–714.
27. Jacobs JW Jr., Spechler SJ. A systematic review of the risk of perforation during esophageal dilation for patients with eosinophilic esophagitis. Dig Dis Sci 2010; 55(6): 1512–1515.
28. Landres RT, Kuster GGR, Strum WB. Eosinophilic esophagitis in a patient with vigorous achalasia. Gastroenterology 1978; 74(6): 1298–1301.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2011 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Tento štát nie je pre lekárov
- Společnost gastrointestinální onkologie vás zve na I. národní kongres o kolorektálním karcinomu
-
Kvíz – Případ z klinické praxe
Stenóza terminálního ilea: věk, komorbidity a koincidující medikace jsou významné pro diferenciální diagnózu - Bude naše cesta bez vizí?
- Vítejte na palubě
- Přínos autofluorescence v diagnostice lehké intraepiteliální neoplazie u pacientů s Barrettovým jícnem
- Dvojí tvář rakoviny jícnu – epidemiologie a etiologie
- Natural Orifice Transluminal Endoscopic Surgery (NOTES) – současný stav, vlastní zkušenosti
- Eozinofilní ezofagitida
- Radiofrekvenční ablace v gastrointestinálním traktu – aktuální stav ve světě a v ČR
- Prognostické faktory a načasovanie endoskopie u akútneho nevarikózneho krvácania z horného gastrointestinálneho traktu
- Spontánní retroperitoneální perforace vzestupného tračníku a trombóza portálního řečiště u pacienta s ulcerózní kolitidou
- Za profesorkou MUDr. Dagmar Hauftovou, CSc.(2. 6. 1927–18. 7. 2011)
- Správná odpověď na kvíz
- Globální problémy s financováním zdravotní péče
- Biologická léčba IBD 2011
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Eozinofilní ezofagitida
- Dvojí tvář rakoviny jícnu – epidemiologie a etiologie
- Radiofrekvenční ablace v gastrointestinálním traktu – aktuální stav ve světě a v ČR
- Prognostické faktory a načasovanie endoskopie u akútneho nevarikózneho krvácania z horného gastrointestinálneho traktu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



