-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Doporučený postup pro léčbu a diagnostiku hepatocelulárního karcinomu
Autori: R. Brůha 1; J. Šperl 1
; P. Urbánek 1; J. Špičák 2; I. Kiss 3
; V. Válek4 ,6; V. Mejzlík 5; M. Oliverius 5; E. Honsová 7; P. Husa Za Pracovní Skupinu Hcc 8 2011
Pôsobisko autorov: Česká hepatologická společnost ČLS JEP 1; Česká gastroenterologická společnost ČLS JEP 2; Česká onkologická společnost ČLS JEP 3; Česká společnost intervenční radiologie ČLS JEP 4; Česká transplantační společnost 5; Radiologická společnost ČLS JEP 6; Společnost českých patologů ČLS JEP 7; Společnost infekčního lékařství ČLS JEP 8
Vyšlo v časopise: Gastroent Hepatol 2012; 66(2): 83-92
Kategória: Hepatologie: doporučené postupy
Hepatocelulární karcinom jater (HCC) je pátým nejčastějším nádorem v celosvětovém měřítku. Je to důsledek vysoké prevalence chronické hepatitidy B mezi obyvateli rozvojových zemí [1,2]. V našich podmínkách se jedná o nádorové onemocnění vzácnější, v ČR se objeví za rok přibližně u 500 obyvatel a téměř výlučně se týká pacientů s jaterní cirhózou. Význam HCC v našich podmínkách není tedy v četnosti, ale v možnosti screeningu, časné diagnostiky, a tím i účinné léčby.
Screening
Je známo, že pacienti s HCC, který se projeví klinickými symptomy, mají velmi špatnou prognózu (pětileté přežití se pohybuje mezi 0 a 10 %); naproti tomu pacienti s asymptomatickým HCC diagnostikovaným v rámci screeningu přežívají díky radikální léčbě více než v 50 % pětileté období [3].
Smyslem screeningových vyšetření je včasné odhalení HCC a s tím spojené prodloužení přežití pacientů v cílové skupině. Literární data prokazující tento požadavek jsou velmi sporá, neboť k vyloučení vlivu různých statistických chyb je jediným přijatelným důkazem výsledek randomizované kontrolované studie. V oblasti HCC existuje jedna randomizovaná kontrolovaná studie hodnotící účinnost screeningu pomocí vyšetření alfa-fetoproteinu (AFP) a ultrasonografie v šestiměsíčních intervalech u pacientů s chronickou HBV infekcí [4]. Tato studie prokázala snížení mortality na HCC o 37 % ve skupině pacientů zařazených do screeningového programu oproti pacientům, kteří nebyli pravidelně vyšetřováni. Této studii je vytýkána především nízká compliance pacientů, a získaný výsledek tak představuje nejspíše minimální pozitivní výsledek, který lze od screeningu očekávat.
K dispozici je i mnoho nekontrolovaných studií, které ukazují, že při screeningu lze skutečně diagnostikovat HCC v časnější fázi, a dosáhnout tak delšího přežití pacientů. Největším nedostatkem nekontrolovaných studií je existence chyby způsobené faktem, že HCC se zachytí dříve, než se projeví symptomaticky, a tím se automaticky prodlouží doba sledování hodnocená jako přežití.
Cílová skupina
Na rozdíl od plošných programů prevence různých jiných nádorových onemocnění se screening HCC týká úzce vymezené skupiny pacientů se zvýšeným rizikem [5,6]. Předpokládá se, že screening HCC přinese významné prodloužení přežití ve skupinách pacientů s roční incidencí HCC alespoň 1,5 %. Roční incidence HCC se u pacientů s cirhózou při HBV či HCV infekci pohybuje mezi 3 a 8 %, u hereditární hemochromatózy 3 a 4 %, u primární biliární cirhózy je pravděpodobně podobná jako u HCV cirhózy. U alkoholické cirhózy či NAFLD není přesně známa, předpokládá se však, že riziko HCC je dostatečně prokázané a screening je nutný. Nejednoznačné je zařazení pacientů s chronickou HCV infekcí bez cirhózy. Je známo, že pětileté riziko vzniku HCC u necirhotických pacientů s HCV infekcí je necelých 5 %. Z praktických důvodů nejsou zmiňována specifika rizik HCC u asijské či černošské populace.
Do screeningového programu HCC musí být v podmínkách ČR zařazeny následující skupiny pacientů:
- Pacienti s jaterní cirhózou jakékoli etiologie.
- Pacienti s chronickou HBV infekcí (HBsAg pozitivní jedinci).
- Pacienti s chronickou HCV infekcí a významnou fibrózou (stadium 3) či pacienti s fibrózou při nealkoholové steatohepatitidě. Důvodem zařazení těchto skupin pacientů může být skutečnost, že nelze přesně určit okamžik přechodu do jaterní cirhózy, a tím i zvýšení rizika HCC.
Tato doporučení vychází z mnoha „cost-effective“ studií a modelů, které shodně prokazují u těchto skupin pacientů větší či menší „cost benefit“ při screeningu HCC. Není však známo, jaký „cost-benefit“ má screening aplikovaný v podmínkách ČR.
Metoda screeningu
Po mnoho let se ke screeningu HCC využívala kombinace vyšetření alfa-fetoproteinu a ultrazvukového vyšetření jater. Po přehodnocení výsledků dostupných studií [8] bylo v roce 2010 panelem expertů AASLD (American Association for the Study of Liver Diseases) doporučeno vyšetření alfa-fetoproteinu ze screeningu vyřadit a provádět jej pouze pomocí ultrazvuku. Důvodem je především nízká šance na odhalení malého ložiska HCC pomocí AFP. Jednou ze studií ukazující nízkou výtěžnost AFP byla HALT-C studie [9].
Interval mezi jednotlivými screeningovými vyšetřeními ultrazvukem je šest měsíců. Dle dostupných údajů nemá význam tuto periodu zkracovat. Postup při zjištění ložiska v rámci screeningového vyšetření je uveden na obr. 1.
Obr. 1. Postup u pacienta s nálezem ložiska v játrech v rámci sonografického screeningu HCC. Fig. 1. Diagnostic algorithm in patient with liver nodule detected due to ultrasound screening for HCC. 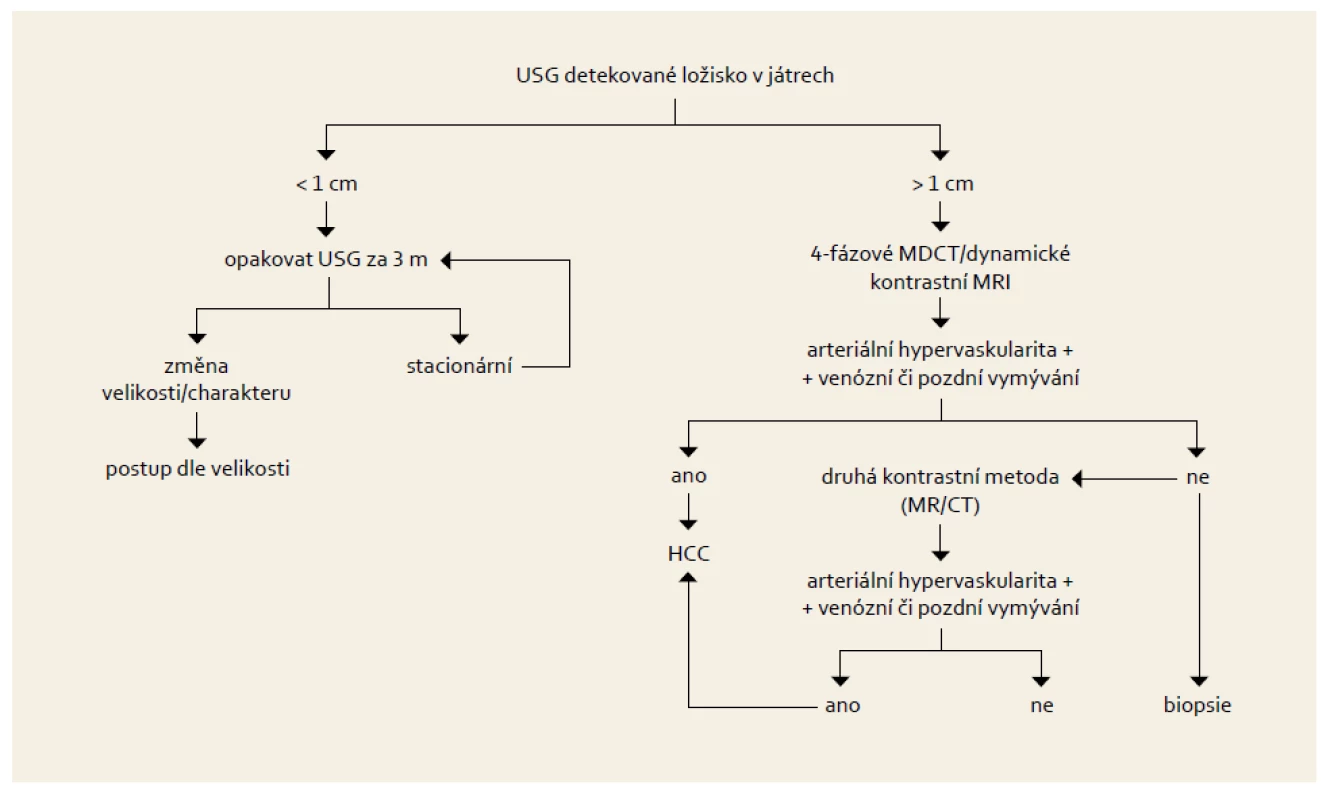
Diagnóza
Diagnóza HCC může být stanovena buď na základě histologie, nebo na základě neinvazivních vyšetření.
Histopatologická diagnóza
(MUDr. E. Honsová)
Spolu s rozvojem v oblasti radiologické diagnostiky se během posledního desetiletí změnila i kritéria pro histologickou diagnostiku HCC. V cirhóze u uzlů menších než 2 cm s netypickými charakteristikami v zobrazovacích metodách je biopsie další metodou umožňující určit biologickou povahu ložiska. Základní problém v histopatologické diagnostice časných HCC představuje přímo struktura jaterní tkáně. Hepatocyty fyziologicky nemají bazální membránu, jejíž překročení v jiných orgánech je považováno za kritérium invazivního růstu. Proto posuzování malých ložisek, která by byla ekvivalentem carcinoma in situ, bylo velmi komplikované a do nedávné doby také silně „expert-dependentní“. Navíc dlouhodobě existovaly rozdíly v interpretaci morfologie časných HCC mezi patology z Evropy a Severní Ameriky na jedné straně a patology z Asie na straně druhé. Několik jednání mezinárodní pracovní skupiny pro hepatocelulární neoplazie z obou geografických oblastí vedlo v roce 2009 k formulaci histologických diagnostických kritérií pro dysplastické noduly a především pro časný dobře diferencovaný HCC (a).
Tato klasifikace zpřesnila definice některých znaků a přidala do diagnostických postupů imunohistochemické markery, a tím významně snížila počet problematických případů hodnocených v bioptickém provozu.
Základní znaky, které zlepšují histopatologickou diagnózu HCC, jsou:
- Stromální invaze: tj. stav, kdy trámce nádorových hepatocytů pronikají do stromatu původních portálních polí nebo vazivových sept. Představuje jednoznačný průkaz malignity. Bohužel stromální invaze je vždy fokální a nemusí být v jehlové biopsii zastižena.
- Nepárové arterie: tj. arterie, které jsou mimo portální pole, lokalizované izolovaně mezi hepatocyty. Jsou korelátem neovaskularizace. Nepárové arterie se na rozdíl od stromální invaze mohou vyskytovat i v benigních lezích.
- Pozitivní průkaz glypicanu-3: glypican-3 je onkofetální protein, který ovlivňuje morfogenezi a reguluje růst. V normálních játrech u dospělých ani v benigních jaterních neoplastických lezích (včetně adenomů) není exprimován. Jeho exprese se objevuje v buňkách HCC a může být cytoplazmatická, membránová nebo kanalikulární. Prakticky vždy je fokální a má různou intenzitu.
Další imunohistochemické markery uplatňující se v diagnostice HCC:
- Glutamin syntetáza (GS) katalyzuje syntézu glutaminu, který je hlavním zdrojem energie pro nádorové buňky. Pozitivní průkaz je zaznamenáván v tumorech s mutací β-cateninu (GS je cílovým genem β-cateninu), tj. cca ve 20 % adenomů a 20–30 % HCC.
- Heat shock protein 70 (HSP70) se účastní v procesech tumorigeneze ovlivněním regulace buněčného cyklu a apoptózy a představuje významný antiapoptotický faktor. Pozitivní imunohistochemický průkaz HSP70 (obvykle jaderný i cytoplazmatický) je fokální a vyskytuje se u časných i plně vyvinutých HCC.
Genetické/proteomické studie se dosud v praktické diagnostice HCC neuplatňují. Identifikace jednoduchého obecně použitelného testu je zatím věcí budoucího výzkumu.
Diagnóza pomocí neinvazivních vyšetření
Mnoho let byla pro diagnózu HCC používána hodnota AFP v kombinaci s typickým CT, MR či CEUS nálezem či kombinace dvou zobrazovacích metod. Při přehodnocení dostupných údajů bylo panelem expertů AASLD v r. 2010 doporučeno vyřadit z diagnostických kritérií hodnotu AFP. Toto doporučení je podloženo jednak údaji o nespecifičnosti AFP (může být vyšší u pacientů s cholangiogenním karcinomem i jaterními metastázami kolorektálního karcinomu) a dále skutečností, že k diagnóze HCC v cirhotických játrech stačí dle dostupných údajů jasný nález pouze jedné ze zobrazovacích metod (dříve to bývala kombinace jedné zobrazovací metody a AFP nebo dvou zobrazovacích metod). V současné době má stanovení hladiny AFP význam pro další sledování efektu prováděné léčby, nikoli diagnostický. Za jasný průkaz HCC se považuje nález hypervaskulárního uzlu v cirhotických játrech, většího než 1 cm, s typickým vymýváním ve venózní či pozdní fázi, patrný buď na CT, nebo MR [12,13]. CT musí být prováděno ve čtyřech fázích (nativní, arteriální, venózní, pozdní), MR musí být prováděno jako dynamické s použitím kontrastu. Z diagnostického algoritmu vypadlo CEUS (ultrazvukové vyšetření s pomocí kontrastní látky) z důvodu nižší specificity. Tato neinvazivní kritéria neplatí u pacientů, kteří nemají jaterní cirhózu.
Staging
Staging by měl sloužit ke stratifikaci pacientů pro různé léčebné postupy. HCC je jedním z mála nádorů, u kterých se v běžné praxi ke stagingu využívají i jiné systémy než TNM klasifikace [14] (tab. 1). Je to dáno především přítomností jaterní cirhózy, jejíž pokročilost ovlivňuje prognózu i léčebné postupy u pacientů s HCC. Pokročilost jaterní cirhózy se hodnotí pomocí tzv. Child-Pughovy klasifikace [15] (tab. 2) či MELD skóre [16]. Z mnoha klasifikačních systémů se výše uvedeným požadavkům nejvíce blíží systém vypracovaný barcelonskou skupinou – tzv. BCLC kritéria [17]. Tato klasifikace jasně definuje léčebný postup nejen na základě rozsahu primárního postižení, ale i podle pokročilosti jaterní choroby a celkového stavu pacienta. Tento systém rozděluje pacienty s HCC a jaterní cirhózou do pěti skupin dle charakteristik uvedených v tab. 3.
Tab. 1. TNM klasifikace HCC, 7. vydání. Tab. 1. TNM classification of HCC, 7th edition. 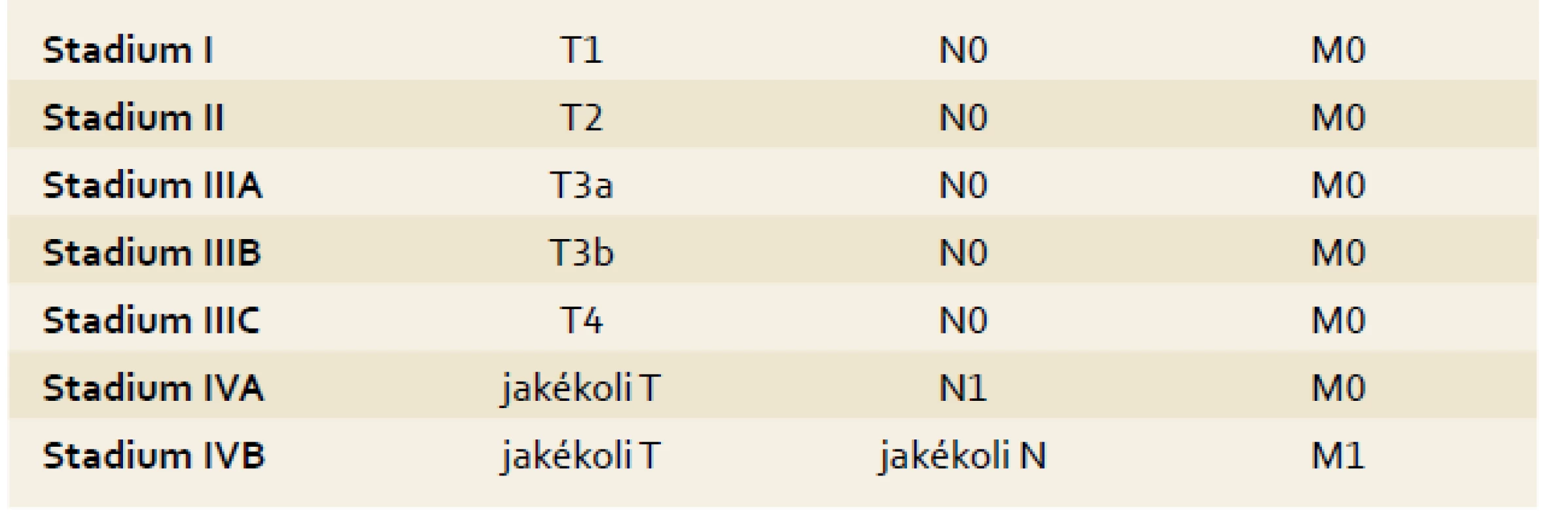
Oproti předcházející klasifikaci jsou pacienti s metastázou začleněni do stadia IV (IVA, pokud je metastáza v regionální uzlině, nebo IVB, jde-li o vzdálenou metastázu). Tab. 2. Child-Pugh klasifikace pokročilosti jaterní cirhózy. Tab. 2. Child-Pugh classification of severity of liver disease. 
Zhodnocení: třída A: 5–6 bodů / třída B: 7–9 bodů / třída C: 10–15 bodů. Tab. 3. Barcelonská klasifikace (staging) pacientů s HCC v terénu jaterní cirhózy. Tab. 3. Barcelona classification (staging) in HCC patients in the cirrhosis area. 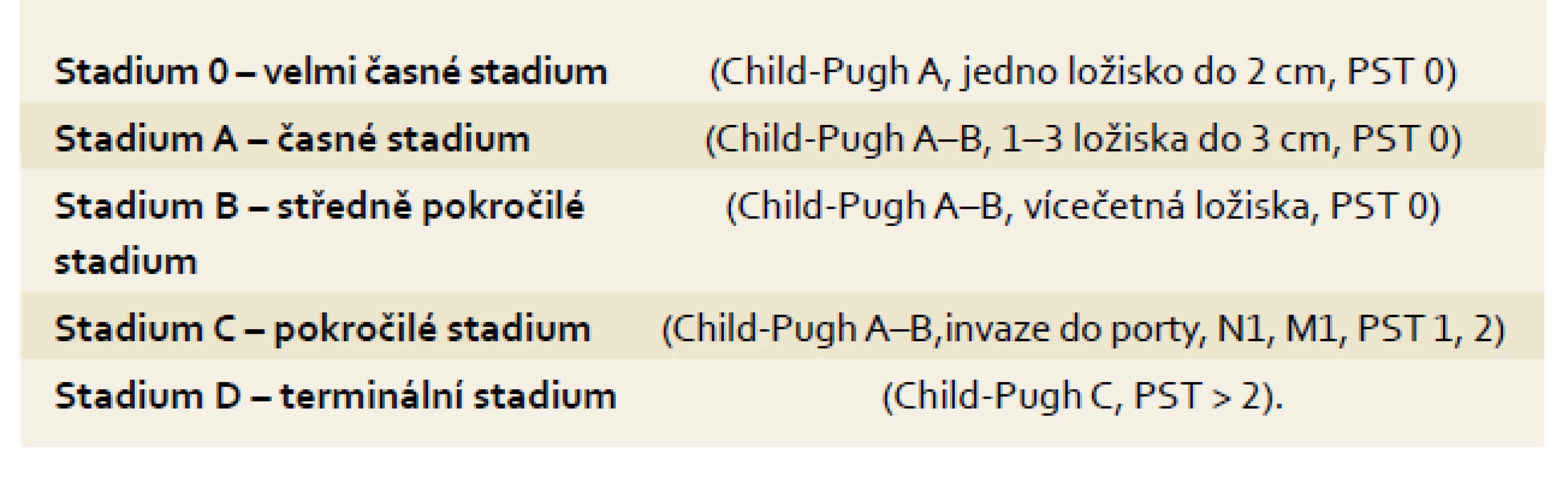
Krom jednoduchosti a komplexnosti BCLC klasifikace je dalším faktem upřednostňujícím tuto klasifikaci skutečnost, že většina studií hodnotících nové léčebné postupy HCC používá tento systém jako referenční.
Chirurgická léčba HCC
(MUDr. M. Oliverius)
Chirurgická léčba představuje jedinou dosud známou potenciálně kurabilní metodu léčby HCC, která dává nemocným naději na vyléčení, event. významné prodloužení bezpříznakového období – Disease Free Survival (DSF). Jako potenciálně kurabilní metoda je udávána i radiofrekvenční ablace (RFA) u velmi malých ložisek a pečlivě selektovaných nemocných. Ta může být prováděna neoperačně pod navigací zobrazovacích metod nebo otevřenou chirurgickou cestou.
Chirurgické metody léčby jsou spojeny s určitou morbiditou a mortalitou, která vychází zejména z rozsahu základního onemocnění, kterým je u 95 % nemocných cirhóza jater. Indikace k chirurgické léčbě je založena na znalosti prognostických kriterií, která nemocnému dávají naději na vyléčení nebo prodloužené přežití, a vyvažují tak rizika operace.
Základní dva způsoby chirurgické léčby představují resekce jater (JR) [18] – otevřená nebo laparoskopická a transplantace jater (TxJ) [19]. Indikace k jejich použití vychází z několika základních faktorů:
- počet a velikost nádorových ložisek
- jejich uložení v játrech
- rozsah postižení jaterního parenchymu
- přítomnost, nebo nepřítomnost mimojaterního onemocnění
- celkový stav nemocného – performance status (PST)
- dostupnost léčebného postupu v dané zemi a čase
Indikační kritéria k transplantaci jater pro HCC
Nejrozšířenějšími a zároveň nejvíce studiemi verifikovanými jsou kritéria představená Mazzaferrem v Miláně roku 1996 – Milánská kritéria (MK). Podle těchto kritérií je k transplantaci indikován nemocný, který má jaterní cirhózu s jedním ložiskem nádoru do 5 cm nebo maximálně třemi ložisky do 3 cm. Základním předpokladem je nepřítomnost vaskulární invaze. Nemocní, kteří jsou indikováni k transplantaci v rámci těchto kritérií (obr. 2), mají z dlouhodobého hlediska naději na pětileté přežívání podobnou jako pacienti indikovaní z nenádorových příčin [20].
Obr. 2. Indikační schéma pro zařazení nemocného na „waiting list“ s HCC v IKEM. Fig. 2. Indication criteria for including a patient on the HCC „waiting list“ in IKEM. 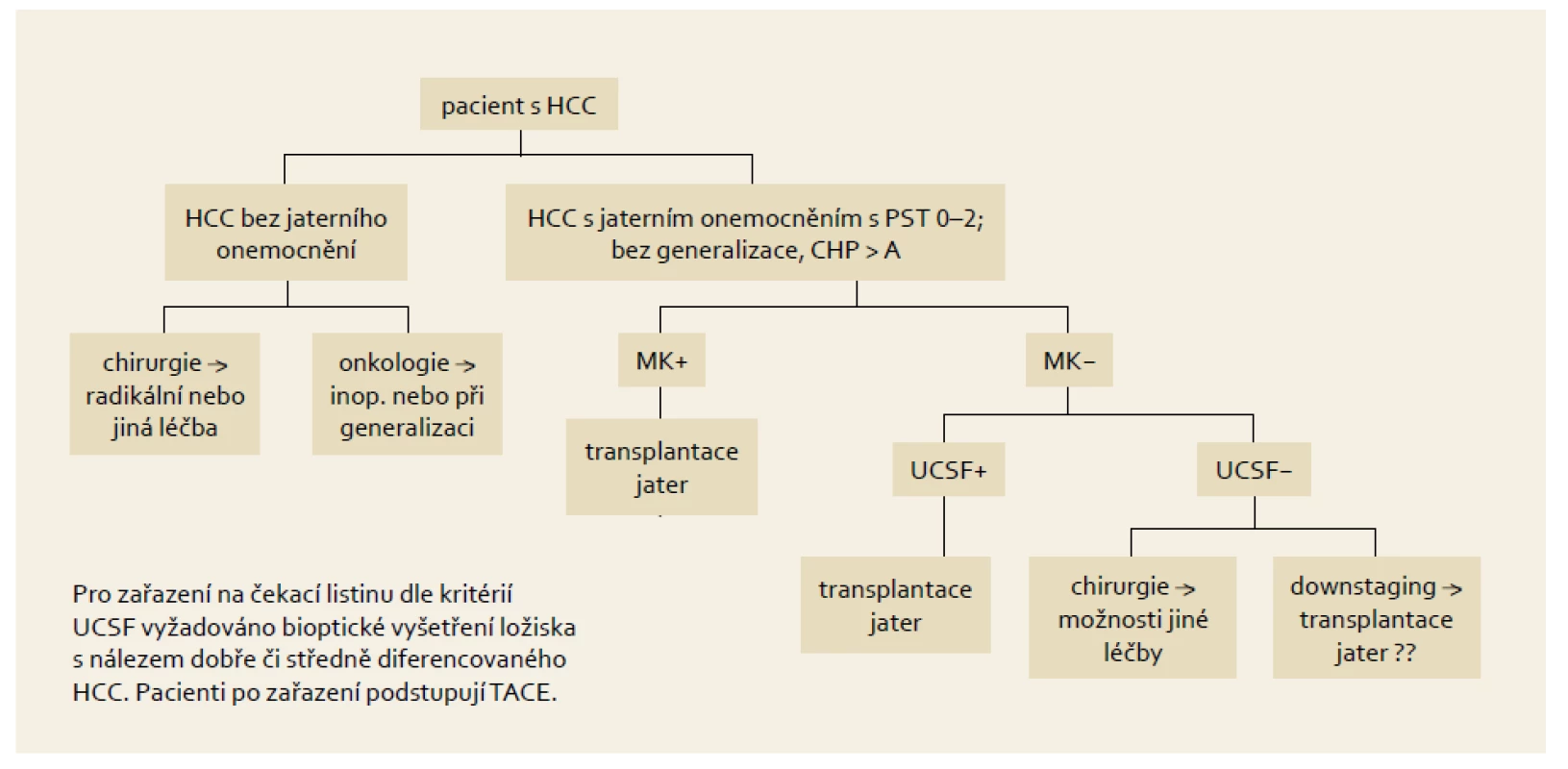
Zavedení tohoto indikačního schématu vedlo k dramatickému zlepšení výsledků transplantace. Již záhy se ale ukázalo, že díky diskrepanci mezi předtransplantačním stagingem v porovnání s definitivní histologií explantátu byla transplantace provedena i u nemocných mimo tato kritéria. Přesto někteří z nich z této léčby profitovali a jejich přežívání bylo uspokojivé. To vedlo k expanzi Milánských kritérií. Průkopníkem byl Yao z univerzity v San Francisku, USA. Ten definoval nová expandovaná kritéria obecně známá jako UCSF kritéria (University of California San Francisco). Podle těchto kritérií lze indikovat k transplantaci nemocné s jedním uzlem do 6,5 cm nebo s maximálně třemi uzly z nichž největší do velikosti 4,5 cm a zároveň součet velikostí všech je menší než 8 cm, pochopitelně bez vaskulární invaze. Obě tato indikační kritéria jsou všeobecně celosvětově přijatá a výsledky transplantací u nemocných v rámci těchto omezení dobře dokumentovány. Mazzaferro následně vytvořil mezinárodní platformu shromažďující informace o transplantovaných pacientech s HCC, kterou nazval metroticket concept (www.hcc--olt-metroticket.org). V rámci této platformy vytvořil kalkulační model, který je schopen spočítat pravděpodobnou délku přežívání v závislosti na rozsahu překročení Milánských kritérií. Celá koncepce vychází z jednoduchého pravidla: „čím dále chci dojet, tím více za to zaplatím…“ Jinými slovy, každá expanze mimo Milánská kritéria je vykoupena vyšším počtem recidiv onemocnění a nižším pětiletým přežíváním nemocných. Na základě retrospektivně získaných dat od 1 556 nemocných z 36 transplantačních center pak představil před dvěma roky nový indikační koncept, který nazval „up-to-seven criteria“. Jakákoli kombinace velikosti nádoru s počtem ložisek při nepřítomností vaskulární invaze do čísla sedm vykazovala pravděpodobnost pětiletého přežívání 70 %. V této skupině bylo celkem 283 pacientů a jejich předpokládané pětileté přežívání činilo 71,2 % (95% CI 64,3–77,0). Tato skupina dosahovala podobné výsledky jako skupina uvnitř MK.
Radiologická léčba HCC
(prof. MUDr. V. Válek)
Perkutánní ablace
Jednou z hlavních oblastí pokroku v léčbě jaterních malignit je vývoj perkutánních metod lokální ablace karcinomů. Z těchto metod je v současnosti jako primární ablační modalita ve většině institucí zavedena radiofrekvenční (RF) ablace. RF ablace je považována za nejlepší způsob léčby pacientů s HCC v časném stadiu, kdy transplantace jater ani chirurgická resekce nepředstavují vhodné řešení [21].
Účinnost metody
Při léčbě malého HCC zajišťuje RF ablace uspokojivou kontrolu lokálního nádoru, přičemž zobrazovací metody ukazují častost kompletní ablace přibližně v 90 % u nádorů menších než 3 cm. Histologické údaje z explantovaných vzorků jater pacientů, u nichž byla provedena RF ablace, prokazují, že velikost nádoru a přítomnost velkých (3 mm nebo více) cév naléhajících na nádor lokální účinek léčby významně ovlivňuje. Úplná nekróza nádoru byla při pitvě zjištěna u 83 % nádorů < 3 cm a 88 % nádorů mimo perivaskulární lokalizaci. Srovnání perkutánní injekční aplikace etanolu (PEI) v pěti randomizovaných studiích prokázalo, že RF ablace má vyšší místní protinádorový účinek než PEI, s výslednou lepší kontrolou onemocnění. Použití PEI proto nemá v léčbě HCC, pokud lze provést RFA, v současné době místo [22].
Přežití
Pět randomizovaných studií srovnávalo RF ablaci s PEI z hlediska lokální ablace HCC v časném stadiu. Dvě evropské studie neprokázaly statisticky významný rozdíl v celkovém přežití mezi pacienty s RF ablací a PEI. Lepší hodnoty přežití však uvedly tři studie z Asie. Tyto údaje byly sloučeny ve dvou nezávislých metaanalýzách; příznivé ovlivnění přežití bylo potvrzeno u pacientů s malým HCC, u nichž byla provedena RF ablace. RF ablaci se tak dává přednost jako perkutánní léčebné modalitě u pacientů s časným HCC vzhledem k častější úspěšné lokální léčbě nádoru a lepšímu mediánu přežití [23].
Dlouhodobé výsledky přežití pacientů léčených RF ablací byly již publikované. U nemocných, kteří podstoupili RF ablaci, záviselo přežití na závažnosti cirhózy a stagingu nádoru. U pacientů s jaterní cirhózou ve funkční klasifikací Child-Pugh A, s HCC v časném stadiu, dosahovalo pětileté přežití 61–77 %; u nemocných s jediným nádorem ≤ 2 cm byla hodnota pětiletého přežití 68 %.
Indikace
HCC: Podle klasifikace BCLC je RF ablace metodou volby u velmi časných a časných HCC (tab. 3, obr. 3), kdy pacienti nejsou kandidáty resekce nebo transplantace jater. Je třeba, aby pacienti měli buď jeden menší nádor, nebo až tři noduly, každý menší než 3 cm, žádný průkaz invaze cév nebo extrahepatálního šíření, vysoký Karnofsky index a cirhózu jater stupně A nebo B podle skóre Child-Pugh.
Obr. 3. Základní léčebné postupy HCC dle „Barcelonské“ klasifikace. Fig. 3. Basic treatment procedures for HCC according to the „Barcelona“ classification. 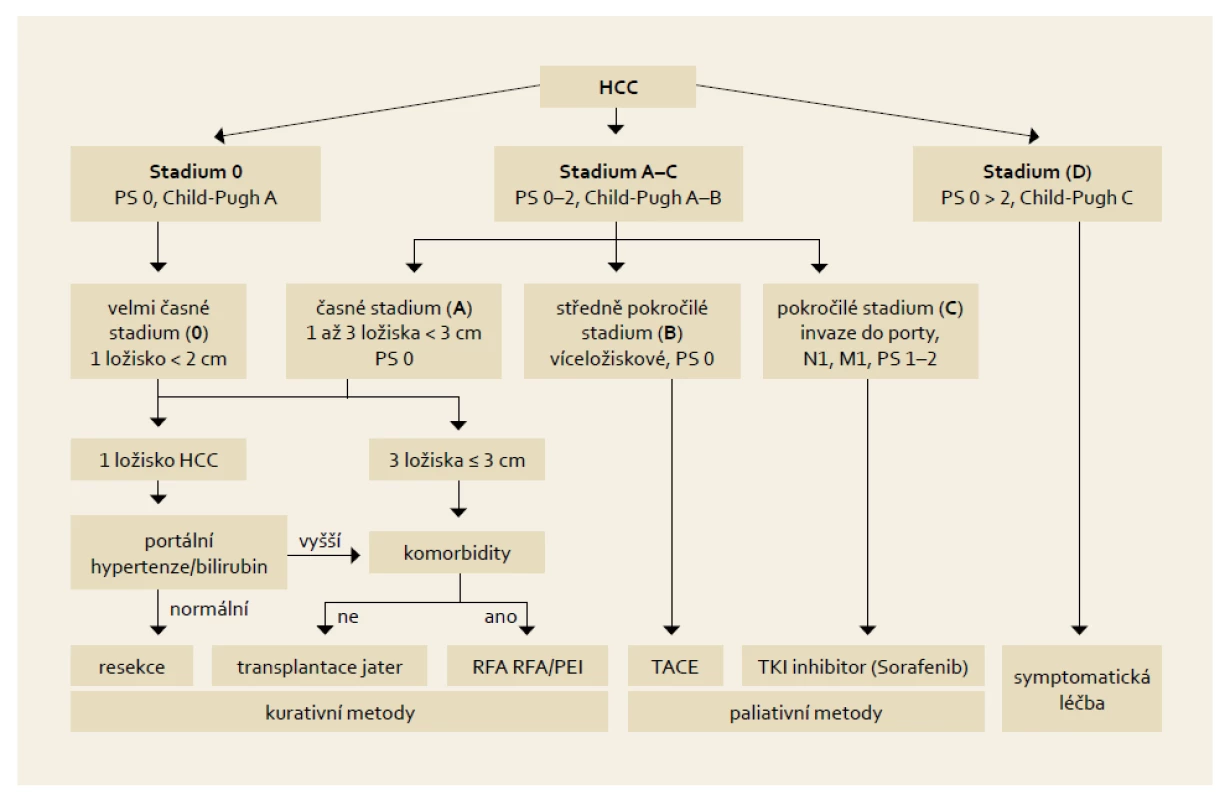
Uložení nádoru
Vyšetření zobrazovací metodou ještě před léčbou musí důkladně definovat uložení každé léze vůči okolním strukturám:
- Léze uložené na povrchu jater lze považovat za vhodné k RF ablaci, i když jejich léčba vyžaduje dostatečné odborné znalosti a zkušenosti a může být spojena s vyšším rizikem komplikací.
- Termální ablace povrchních lézí přilehlých k jakékoli části gastrointestinálního traktu se nesmí provádět vzhledem ke zvýšenému riziku tepelného poranění stěny žaludku nebo střev (popálení stěny těchto orgánů). Větší riziko popálení a následné perforace hrozí u tlustého střeva než u žaludku nebo tenkého střeva. Komplikace v oblasti žaludku se vyskytují vzácně, nejspíše díky poměrně tlusté stěně žaludku nebo vzácnému výskytu chirurgických srůstů podél gastrohepatálního vaziva. Mobilita tenkého střeva může rovněž zajistit jeho lepší ochranu ve srovnání s poměrně fixovaným tlustým střevem. V takových případech lze uvažovat o použití speciálních metod, jako je intraperitoneální injekční aplikace dextrózy.
- Léčba lézí přilehlých k jaternímu hilu zvyšuje riziko tepelného poranění žlučovodů a žlučníku. Toto uložení nádoru představuje relativní kontraindikaci RF ablace. Termální ablace nádorů v blízkosti žlučníku je proveditelná, i když by měla být vyhrazena pracovištím s dostatečnými zkušenostmi. Ve většině případů je spojena s rozvojem iatrogenní cholecystitidy, která spontánně odezní.
- Termální ablace lézí přilehlých k hepatálním cévám je možná, protože protékající krev obvykle chrání cévní stěnu před tepelným poraněním: v těchto případech se však riziko neúplného ošetření neoplastické tkáně v blízkosti cévy může vzhledem k tepelným ztrátám zvýšit.
Kontraindikace RFA
- nádor uložený < 1 cm od hlavního žlučovodu; kvůli riziku popálení žlučovodu a vzniku stenózy
- intrahepatální dilatace žlučovodu
- výrazně vaskularizovaný, exofyticky lokalizovaný nádor; kvůli riziku rozsevu nádoru
- bilioenterální anastomóza
- neléčitelná/nezvládnutelná koagulopatie
Vyšetření a sledování pacientů po léčbě
CT nebo MR s podáním kontrastní látky jsou považovány za standardní způsoby vyšetření a zhodnocení výsledného stavu pacienta. Na snímcích CT a MR získaných 4–6 týdnů po léčbě lze vidět místa úspěšné ablace jako oblasti bez sycení s periferním sycením, nebo bez něj. Okraj sycení, který lze pozorovat po obvodu ablační zóny, vypadá jako poměrně koncentrický, symetrický a jednotný útvar v oblasti s hladkými vnitřními okraji. Jedná se o přechodný jev, který je důsledkem benigní fyziologické odpovědi na tepelné poranění (nejdříve reaktivní hyperemie, následně fibróza a obrovskobuněčná reakce). Benigní sycení v okolí místa ablace je nutno odlišit od nepravidelného periferního sycení v důsledku reziduálního nádoru; toto sycení se objevuje na okraji místa léčby. Na rozdíl od benigního sycení v okolí místa ablace má reziduální nádor postkontrastně jiný charakter. Po výkonu lze provést vyšetření ultrazvukem s intravenózním podáním kontrastu, které by mohlo umožnit počáteční zhodnocení účinku léčby. Pozdější kontrolní vyšetření je třeba zaměřit na pátrání po lokální progresi nádoru, vzniku nových hepatálních lézí nebo objevení extrahepatálního onemocnění. Doporučený kontrolní protokol zahrnuje CT nebo MR vyšetření za 3, 6, 9 a 12 měsíců po léčbě a následně v šestiměsíčních intervalech po dobu následujících tří let.
Chemoembolizace
V průběhu růstu se HCC stává závislým na cévním zásobení z arterie. Tento fakt umožňuje jednak neinvazivní diagnostiku pomocí CT/MR a též vysvětluje účinnost arteriální okluze v léčbě HCC. Uzávěr tepny zásobující nádor se provádí angiograficky (TAE – transarteriální embolizace). Většinou se kombinuje s podáním cytostatika do jaterní tepny těsně před samotnou embolizací (TACE – transarteriální chemoembolizace). Cytostatikum se většinou rozpouští v Lipiodolu, který se selektivně vychytává v nádorové tkáni. Nejvíce zkušeností je s použitím cisplatiny nebo adriamycinu [24].
TACE se používá u pacientů s chirurgicky či perkutánně neřešitelným HCC, kteří nemají známky mimojaterního šíření.
Hlavní kontraindikací TACE je nedostatečný průtok portální žilou (trombóza v. portae, významné kolaterály nebo obrácený (hepatofugální) tok krve ve v. portae). Stejně tak by k TACE neměli být indikováni pacienti s pokročilou jaterní insuficiencí (Child-Pugh B a C) a/nebo s klinickými symptomy, jelikož mají zvýšené riziko jaterního selhání a úmrtí po zákroku.
TACE (případně i samotná TAE) způsobí nekrózu nádorové tkáně u více než 50 % pacientů. Odpověď na léčbu lze hodnotit buď poklesem nádorových markerů (AFP), nebo pomocí CT/MR. Kompletní odpovědi dosáhnou 2 % pacientů. Znovuobjevení se ložiska s arteriálním sycením může být důvodem k opakování TACE. Několik studií z poslední doby prokázalo, že tato metoda prodlouží přežití pacientů s HCC (přežití pacientů s HCC léčených TACE se ve dvouletém intervalu pohybuje od 20–60 %) [25].
Onkologická systémová léčba HCC
(prim. MUDr. I. Kiss)
Pro pacienty s HCC v dobrém stavu (performance status) PS 0–2, Child Pugh A–B: podle mezinárodních doporučení NCCN 2011 (National Comprehensive Cancer Network), ESMO 2010 (European Society for Medical Oncology) a AASLD 2010 (The American Association for the Study of Liver Diseases) je jako systémová standardní možnost indikovaná léčba sorafenibem, jako alternativu uvádí léčbu symptomatickou. I když v rámci žádné klinické studie fáze III nebyl prokázán benefit chemoterapie (intravenózní či systémové) na prodloužení mediánu přežití, připouští doporučení ESMO z roku 2010 pro případ nedostupnosti léčby sorafenibem paliativní chemoterapii (cisplatina nebo doxorubicin v monoterapii či kombinovanou chemoterapie GEMOX).V léčbě pokročilého inoperabilního hepatocelulárního karcinomu u pacientů v celkově dobrém stavu (PS 0–1) je indikován sorafenib v dávce 800 mg/den. V rámci systémové léčby hepatocelulárního karcinomu na prvním místě používáme sorafenib. Zmiňujeme příklady historicky používaných režimů CHT, jejichž faktická účinnost je malá (tab. 4).
Tab. 4. Onkologická systémová léčba HCC. Tab. 4. HCC systemic therapy. 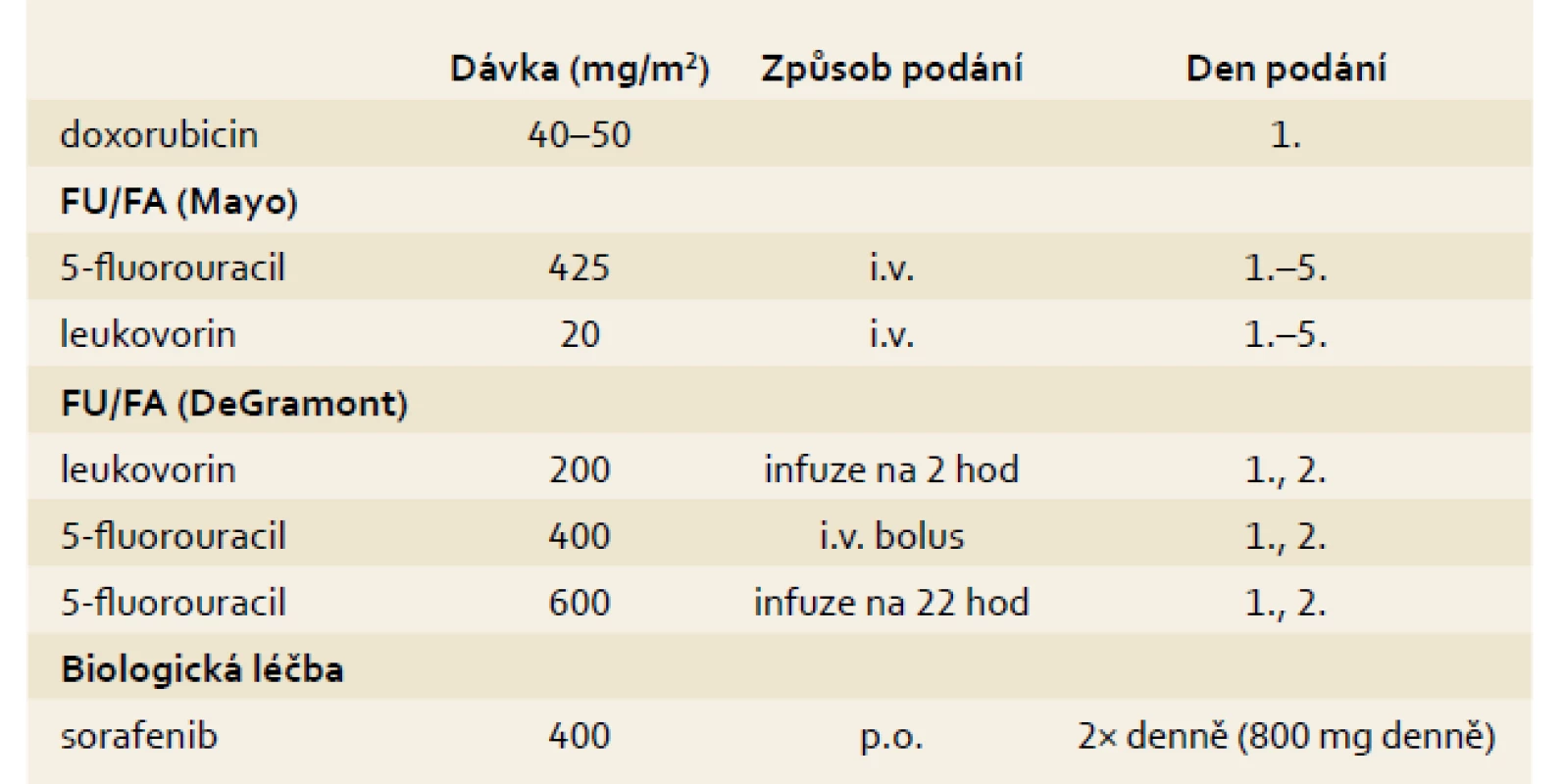
Chemoterapie
Vybrané informace k biologické léčbě. Sorafenib v léčbě hepatocelulárního karcinomu
Indikace: Sorafenib je indikován jako terapie první volby v léčbě inoperabilního nebo metastazujícího hepatocelulárního karcinomu s omezením na Child--Pugh třídu A a B.
Kontraindikace: Hypersenzitivita na léčivou látku nebo kteroukoli pomocnou látku obsaženou v přípravku.
Lékové interakce: Nepodávat s preparáty snižujícími aciditu, induktory metabolických enzymů.
Nežádoucí účinky: Dermatologická toxicita – kožní reakce na dlaních a chodidlech, hypertenze, krvácení, srdeční ischemie nebo infarkt, zhoršené hojení ran – přechodné přerušení léčby sorafenibem je doporučováno z preventivních důvodů u pacientů podstupujících vážný chirurgický zákrok, zhoršená funkce jater – nejsou k dispozici žádné údaje o podání přípravku u pacientů s těžkým (Child-Pugh C) poškozením jater.
Dávkování: 2 tablety po 200 mg 2× denně ve stejném denním čase (800 mg denní dávka) bez jídla nebo s nízkotučným jídlem.
Léčba by měla pokračovat tak dlouho, dokud je pozorován klinický benefit nebo dokud nenastane neakceptovatelná toxicita.
Symptomatická léčba pacientů s HCC
Symptomatická léčba se podstatně neliší od péče o pacienta s pokročilou jaterní cirhózou bez HCC. V rámci stagingu jaterní choroby je nezbytné provést ezofagogastroskopické vyšetření tak, aby mohla být zavedena případná preventivní léčba krvácení z jícnových varixů. V případě indikace k TIPS (při krvácení z varixů či gastropatie nereagující na standardní léčbu) nemusí být přítomnost HCC zásadní kontraindikací tohoto výkonu. Ke každému pacientovi je však třeba přistupovat individuálně, především s ohledem na jeho další prognózu.
V literatuře není dostatek údajů o nutnosti a způsobu úpravy prodloužené koagulace pacientů s jaterní cirhózou. Většina doporučení je dána klinickými pozorováními a osobními zkušenostmi, které nesplňují kritéria medicíny založené na důkazech. V odborné literatuře existují i názory, že úprava koagulačních parametrů před případným invazivním zákrokem není nutná a zahajuje se až při skutečné krvácivé komplikaci. Není ani jasné, zda velmi často podávaný vitamin K zlepšuje prognózu pacienta s jaterní cirhózou či brání krvácivým komplikacím. Nelze proto dát jednoznačné doporučení, zda a na jaké cílové hodnoty koagulaci před invazivními zákroky upravit.
Léčba ascitu či dalších komplikací jaterní cirhózy se též podstatně neliší od postupu u pacienta bez HCC.
Doporučené sledování
Po resekci pro hepatocelulární karcinom: první dva roky sonografické vyšetření jater každých 3–6 měsíců. Pokud byla předoperačně elevace AFP, pak je po operaci doporučeno vyšetření jeho hladiny každé tři měsíce první dva roky, později jednou za šest měsíců. Pokud je zjištěna recidiva onemocnění, pak následuje vyšetřovací proces podobně jako u primárně zjištěného onemocnění.
V běžné klinické praxi musí být proveden staging každého pacienta s HCC a na základě zařazení do určitého stadia rozhodnuto o léčbě. Nejvhodnější hodnocení je tzv. Barcelonská klasifikace (obr. 3).
- Pacienti s časným stadiem HCC jsou kandidáti resekce, transplantace nebo perkutánní ablace. Resekce je zvažována u pacientů s jedním ložiskem, bez klinicky významné portální hypertenze a bez ikteru. Transplantace je vhodnou metodou u pacientů s maximálním počtem 3 ložisek menších než 3 cm nebo jedním ložiskem do 5 cm. Perkutánní ablace je vhodná pro malé, resekčně či transplantací neřešitelné HCC.
- TACE je indikována u asymptomatických pacientů s vícečetnými ložisky, bez známek cévní invaze a mimojaterního šíření. V případě pozitivní odpovědi na léčbu TACE mají tito pacienti prodloužené přežití.
- Pacienti s pokročilejším HCC anebo ti, kteří neodpoví na TACE, ale se zachovalými jaterními funkcemi, jsou kandidáti onkologické systémové léčby.
- U pacientů s projevy jaterní insuficience a/nebo v celkově nedobrém stavu (performance status > 2) a/nebo masivním šířením tumoru mimo játra není prokázán efekt žádné léčebné metody a měli by být léčeni symptomaticky.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 2. 3. 2012
Přijato: 14. 3. 2012
doc. MUDr. Brůha Radan, CSc.
IV. interní klinika 1. LF UK a VFN v Praze
U Nemocnice 2, 128 08 Praha 2
bruha@cesnet.cz
Zdroje
1. International Agency for Cancer Reseach. GLOBOCAN 2002: http://www-dep.iarc.fr Bosch FX, Ribes J, Diaz M, Cleries R. Primary liver cancer: worldwide incidence and trends. Gastroenterology 2004; 127 (5 Suppl 1): S5–S16.
2. AASLD guidelines for HCC. http://www.aasld.org/practiceguidelines/Documents//Bookmarked%20Practice%20Guidelines//HCCUpdate2010.pdf.
3. Zhang BH, Yang BH, Tang ZY. Randomized controlled trial of screening for hepatocellular carcinoma. J Cancer Res Clin Oncol 2004; 130(7): 417–422.
4. Yuen MF, Tanaka Y, Fong DY et al. Independent risk factors and predictive score for the development of hepatocellular carcinoma in chronic hepatitis B. J Hepatol 2009; 50(1): 80–88.
5. Lok AS, Seeff LB, Morgan TR et al. Incidence of hepatocellular carcinoma and associated risk factors in hepatitis C-related advanced liver disease. Gastroenterology 2009; 136(1): 138–148.
6. Guyatt GH, Oxman AD, Vist GE et al. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ 2008; 336(7650): 924–926.
7. Singal A, Volk ML, Waljee A et al. Meta-analysis: surveillance with ultrasound for early-stage hepatocellular carcinoma in patients with cirrhosis. Aliment Pharmacol Ther 2009; 30(1): 37–47.
8. Lok AS, Sterling RK, Everhart JE et al. HALT-C Trial Group. Des-gamma-carboxy prothrombin and alpha-fetoprotein as biomarkers for the early detection of hepatocellular carcinoma. Gastroenterology 2010; 138(2): 493–502.
9. Bruix J, Sherman M. Management of Hepatocellular Carcinoma: An Update. Hepatology 2011; 53(3): 1020–1022.
10. International Consensus group for hepatocellular neoplasia. Pathologic diagnosis of early hepatocellular carcinoma: a report of the international consensus group for hepatocellular neoplasia. Hepatology 2009; 49(2): 658–664.
11. Forner A, Vilana R, Ayuso C et al. Diagnosis of hepatic nodules 20 mm or smaller in cirrhosis: prospective validation of the noninvasive diagnostic criteria for hepatocellular carcinoma. Hepatology 2008; 47(1): 97–104.
12. Sangiovanni A, Manini MA, Iavarone M et al. The diagnostic and economic impact of contrast paging techniques in the diagnosis of small hepatocellular carcinoma in cirrhosis. Gut 2010; 59(5): 638–644.
13. Edge SB, Byrd DR, Compton CC et al. AJCC Cancer Staging Manual 7th edition. Springer, 2010.
14. Pugh RNH, Murray-Lyon IM, Dawson JL et al. Transection of the oesophagus for bleeding oesophageal varices. Br J Surg 1973; 60(8): 646–664.
15. Kamath PS, Wiesner RH, Malinchoc M et al. A model to predict survival in patients with end-stage liver disease. Hepatology 2001; 33(2): 464–470.
16. Forner A, Reig ME, de Lope CR et al. Current strategy for staging and treatment: the BCLC update and future prospects. Semin Liver Dis 2010; 30(1): 61–74.
17. Llovet, JM, Schwartz M, Mazzaferro V. Resection and liver transplantation for hepatocellular carcinoma. Semin Liver Dis 2005; 25(2): 181–200.
18. Schwartz M. Liver transplantation for hepatocellular carcinoma. Gastroenterology 2004; 127 (Suppl 1): S268–276.
19. Mazzaferro V, Regalia E, Doci R et al. Liver transplantation for the treatment of small hepatocellular carcinomas in patients with cirrhosis. N Engl J Med 1996; 334(11): 693–699.
20. Livraghi T, Meloni F, Di Stasi M et al. Sustained complete response and complications rates after radiofrequency ablation of very early hepatocellular carcinoma in cirrhosis: Is resection still the treatment of choice? Hepatology 2008; 47(1): 82–89.
21. Lin SM, Lin CJ, Lin CC et al. Radiofrequency ablation improves prognosis compared with ethanol injection for hepatocellular carcinoma < or = 4 cm. Gastroenterology 2004; 127 : 1714–1723.
22. Cho YK, Kim JK, Kim MY et al. Systematic review of randomized trials for hepatocellular carcinoma treated with percutaneous ablation therapies. Hepatology 2009; 49(2): 453–459.
23. Bruix J, Sala M, Llovet JM. Chemoembolization for hepatocellular carcinoma. Gastroenterology 2004; 127 (5 Suppl 1): S179–188.
24. Llovet JM, Bruix J. Systematic review of randomized trials for unresectable hepatocellular carcinoma: Chemoembolization improves survival. Hepatology 2003; 37(2): 429–442.
25. Llovet JM, Ricci S, Mazzaferro V et al. Sorafenib in advanced hepatocellular carcinoma. N Engl J Med 2008; 359(4): 378–390.
26. Cheng AL, Kang YK, Chen Z et al. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase III randomised, doubleblind, placebo-controlled trial. Lancet Oncol 2009; 10(1): 25–34.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článek Dobré zprávyČlánek Správná odpověď na kvíz
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2012 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
-
Všetky články tohto čísla
- Hepatorenálny syndróm u pacientov s akútnou alkoholovou hepatitídou
- Správná odpověď na kvíz
- Graft vs host disease jako neobvyklá komplikace po transplantaci jater
- Liečba achalázie – súčasný prístup a vlastné skúsenosti
- Analýza těkavých plynů ve vydechovaném vzduchu u nemocných s idiopatickými střevními záněty
- Súčasný prístup k anémii u pacientov s nešpecifickými črevnými zápalmi
- Mezinárodní konsenzus ke sledování aktivity nemoci u pacientů s Crohnovou chorobou: Výsledky projektu IBD AHEAD 2011
- XVIst Hradec days of gastroenterology and hepatology
- Prof. Jiří Nevoral on the occasion of his 70th birthday
- 20 let členem výboru České gastroenterologické společnosti (ČGS)
- Esomeprazol – první inhibitor protonové pumpy „druhé“ generace
- Dobré zprávy
- Doporučený postup pro léčbu a diagnostiku hepatocelulárního karcinomu
- Histopatologická diagnóza hepatocelulárního karcinomu
- Nález v distálnom duodene, ktorý by nemal prekvapiť
- Rotorův syndrom podmiňuje porucha jaterního vychytávání konjugovaného bilirubinu
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Hepatorenálny syndróm u pacientov s akútnou alkoholovou hepatitídou
- Súčasný prístup k anémii u pacientov s nešpecifickými črevnými zápalmi
- Liečba achalázie – súčasný prístup a vlastné skúsenosti
- Prof. Jiří Nevoral on the occasion of his 70th birthday
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy














