-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Doporučené postupy pro podávání aminosalicylátů u nemocných s idiopatickými střevními záněty
Guidelines for the administration of aminosalicylatesin patients with inflammatory bowel diseases
The author declares he has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
8. 8. 2012Accepted:
15. 10. 2012
Autoři: L. Prokopová 1; D. Ďuricová 2,3
; M. Bortlík 2,5; V. Zbořil 1; M. Lukáš 2,4
; Pracovní Skupina Pro Idiopatické Střevní Záněty Čgs Čls Jep
Působiště autorů: Interní-gastroenterologická klinika LF MU a FN Brno 1; Klinické a výzkumné centrum pro střevní záněty, ISCARE Lighthouse a 1. LF UK v Praze 2; Farmakologický ústav 1. LF UK v Praze 3; Ústav klinické biochemie a laboratorní diagnostiky 1. LF UK v Praze 4; Interní klinika 1. LF UK a ÚVN v Praze 5
Vyšlo v časopise: Gastroent Hepatol 2012; 66(5): 391-400
Kategorie: IBD: doporučené postupy
Konsenzus Pracovní skupiny pro idiopatické střevní záněty ČGS ČLS JEP
Souhrn
The author declares he has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
8. 8. 2012Accepted:
15. 10. 20121. Úvod
Aminosalicyláty byly zavedeny do terapie idiopatických střevních zánětů (IBD) a především ulcerózní kolitidy (UC) na přelomu 40. a 50. let minulého století [1]. Jejich syntéza vycházela z tehdejší představy, že revmatoidní artritida (RA) i UC mají původ v nepoznané (nejspíše streptokokové) infekci, která indukuje další nekontrolovatelný a autoimunitní zánětlivý proces v pojivové tkáni. Cílem tedy bylo vytvořit léčivo s antimikrobiálním i obecně protizánětlivým efektem určené primárně pro nemocné s RA. V roce 1938 tak vznikla molekula salicyl-azo-sulfapyridinu (sulfasalazin, SASP), která se v dalších letech prosadila nejen v léčebném armamentariu u revmatologických pacientů, ale na mnoho desetiletí se stala základem léčby UC a Crohnovy nemoci (CN). Do roku 1976 však nebylo známo, která část kombinované molekuly, spojující sulfonamid s kyselinou 5-aminosalicylovou (5-ASA), je odpovědná za příznivý klinický efekt u nemocných s UC. Až studie Azad Khana [2] v polovině 70. let minulého století ukázala, že touto složkou je u pacientů s UC 5-ASA. Vzhledem k četným nežádoucím účinkům sulfasalazinu, které se objevují zejména při vyšších dávkách, bylo dalším úkolem farmaceutického průmyslu připravit lékové formy obsahující samotnou 5-ASA [3,4]. Tyto nové léky se objevily v 80. letech minulého století a opět znamenaly zásadní pokrok v léčbě IBD a zejména UC. V současné době je mesalazin základním léčivem u nemocných s lehkou a středně těžkou formou UC [5]. Postavení aminosalicylátů v léčbě CN bylo v posledních deseti letech v Evropě sice silně otřeseno, nicméně i v této indikaci se léčba aminosalicyláty v běžné klinické praxi široce užívá. Narozdíl od mezinárodních doporučení tento konsenzus Pracovní skupiny pro idiopatické střevní záněty (PS IBD) zohledňuje i tato specifika léčebné praxe, která jsou navíc podpořena i recentními důkazy z klinického výzkumu.
Názory na klinické využití aminosalicylátů v terapii UC a CN se pochopitelně v průběhu let mění a neustále vyvíjí. Od poslední publikace, která byla vytvořena Pracovní skupinou pro IBD, uplynulo téměř deset let, a proto byl v červnu 2012 vytvořen nový konsenzus členů PS IBD, kteří se problematikou střevních zánětů dlouhodobě zabývají. V českém doporučení pro podávání aminosalicylátů jsou využita mezinárodní doporučení (zejména doporučení ECCO – European Crohn and Colitis Organisation), navíc jsou zde pochopitelně zohledněny i individuální zkušenosti jednotlivých odborníků. Příprava a tvorba předložených doporučení probíhaly již zavedeným způsobem: v první fázi byly definovány základní kapitoly, následovalo vytvoření přehledu literatury jednotlivými členy pracovní skupiny a příprava odpovědí na jednotlivé otázky. Nakonec byla během dvoudenního jednání PS IBD ve dnech 7.–8. června 2012 jednotlivá doporučení diskutována a případně upravována do následující podoby. Konsenzuální stanovisko vyžadovalo shodu nejméně 80 % účastníků jednání.
2. Mechanizmus účinku aminosalicylátů
Za účinnou látku aminosalicylátu odpovědnou za protizánětlivý efekt u nemocných s IBD je považována 5-aminosalicylová kyselina (5-ASA, mesalazin) [2,3]. Předpokládá se, že protizánětlivý efekt orálních i lokálních forem 5-ASA je závislý na koncentraci léčiva ve střevní sliznici a nezávisí na jeho systémových hladinách [6,7]. Přesný mechanizmus účinku aminosalicylátů není znám, pravděpodobně je komplexní povahy a podílí se na něm několik složek. Nicméně za hlavní mechanizmus se v současné době považuje přímý agonistický efekt 5-ASA na „Peroxisome Proliferator-Activated Receptor-Gamma“ (PPAR-γ) [8,9]. PPAR-γ je transkripční faktor patřící do skupiny jaderných receptorů, který se podílí na přenosu různých metabolických a nutričních signálů do buněčného jádra. Je exprimován ve vysokých koncentracích v epiteliálních buňkách sliznice tlustého střeva a zdá se, že hraje klíčovou roli v bakteriemi indukovaném zánětu [8,10]. Mezi další mechanizmy protizánětlivého účinku 5-ASA patří snížení aktivity jaderného faktoru kapa-B (NFκB), jenž je odpovědný za tvorbu prozánětlivých cytokinů (např. TNFα), dále přímé ovlivnění lokální tvorby prozánětlivých působků a potlačení produkce prozánětlivých prostaglandinů a leukotrienů ovlivněním metabolizmu kyseliny arachidonové [8]. Navíc, 5-ASA působí jako antioxidant volných kyslíkových radikálů [8].
3. Klinická farmakologie
Samotný mesalazin se po perorálním podání velmi rychle vstřebává v orálních částech tenkého střeva [11]. V epiteliálních buňkách střevní sliznice je následně degradován na neúčinný N-acetyl-mesalazin, který vstupuje do portální krve a následně v játrech probíhá jeho druhá acetylace. Z větší části je poté metabolit vyloučen ledvinami. Na rozdíl od tenkého střeva se v tračníku 5-ASA vstřebává jen minimálně [7,12]. Vzhledem k vysoké absorpci 5-ASA v tenkém střevě, která by znemožňovala distribuci léčiva do tlustého střeva a potenciálnímu riziku toxického efektu vysokých systémových koncentrací 5-ASA, byly připraveny různé lékové formule s cílem zabránit vstřebání léčiva v proximálním tenkém střevě a naopak zabezpečit postupné nebo řízené uvolnění účinné látky v distálním tenkém střevě nebo až v tračníku [7]. Podle této farmakologické úpravy mohou být 5-ASA preparáty rozděleny do několika následujících skupin:
3.1 Aminosalicyláty vázané di-azo-vazbou
Salicyl-azo-sulfapyridin (sulfasalazin, salazopyrin) obsahuje sulfonamidový nosič sulfapyridin, který brání uvolnění a úplnému vstřebávání 5-ASA v tenkém střevě. Samotný sulfapyridin má rovněž slabé antimikrobiální účinky a předpokládá se, že je zodpovědný také za pozitivní účinek na kloubní mimostřevní projevy [1]. Po perorálním podání dosahuje salicyl-azo-sulfapyridin tlustého střeva z větší části nezměněn a až zde je vlivem bakteriálních azo-reduktáz rozštěpena diazo vazba, a tím uvolněn mesalazin [1,7]. Na rozdíl od mesalazinu, který se v tlustém střevě prakticky nevstřebává, je sulfapyridin absorbován i v tračníku a dostává se portální krví do jater, kde je acetylován a následně vyloučen ledvinami [1]. U osob s vrozenou nízkou aktivitou acetyláz, u tzv. „pomalých acetylátorů“, je snížené odbourávání a kumulace sulfapyridinu v séru příčinou některých nežádoucích účinků [4]. Účinnost stejné dávky sulfasalazinu je ve srovnání s mesalazinem nižší a k dosažení srovnatelného efektu je potřeba podat přibližně dvojnásobnou dávku sulfasalazinu [13]. Ostatní diazo sloučeniny, které obsahují mesalazin vázaný na inertní nosič beta-alanin – balsalazid, nebo dvě molekuly 5-ASA spojené diazo vazbou – olsalazin, nejsou v ČR dostupné.
3.2 Aminosalicyláty s pH dependentním uvolňováním
V těchto preparátech je 5-ASA chráněna obalem ze speciální pryskyřice, která je rozpustná pouze při pH > 6 (Eudragit L; Salofalk tbl., Claversal tbl.), resp. pH > 7 (Eudragit S; Asacol tbl.). Systém opožděného uvolnění mesalazinu je založen na proximo-distální změně pH intraluminálního obsahu trávicí trubice, při kterém nejnižší pH v žaludku (pH 1–2) vlivem alkalizujícího efektu střevní šťávy, pankreatické sekrece, žluče a bakteriálního metabolizmu postupně narůstá a v oblasti distálního ilea dosahuje hodnoty kolem 6–7, v céku a ascendentu pak až lehce alkalických hodnot (pH 8). Mesalazin je z těchto preparátů uvolněn až při rozpuštění pryskyřicového obalu (Eudragit S, L, L-100) při dosažení hodnoty pH > 6, resp. > 7. Tím je zajištěna dostupnost léčiva v distálním ileu a tlustém střevě, kam se dostane kolem 80 % podané dávky. Nicméně tento ideální model změn pH intraluminálního střevního obsahu pozorovaný u zdravých osob může být u pacientů s IBD ovlivněn řadou faktorů, jako je aktivita nemoci, předcházející chirurgické výkony nebo současně podávané léky, proto uvolnění účinné látky a její terapeutický efekt může být u různých pacientů odlišný.
3.3 Aminosalicyláty s řízeným uvolňováním
Léčiva obsahují mikrogranule (mikropelety) mesalazinu velikosti do 1 mm, které jsou obaleny etylcelulózou (Pentasa SR tbl.) [7]. Po rozpuštění obalu každé mikropelety, jež není vázáno na hodnotu pH, ale probíhá konstantní a pomalou disolucí obalu, dojde k uvolnění účinné látky do střevního lumen. K uvolnění mesalazinu dochází již v proximální části trávicí trubice (tenké střevo – jejunum), kde se uvolní cca 50 % podané dávky léku a zbytek se dostává do distální části trávicího traktu. Množství uvolněné aktivní látky je přímo úměrné době tranzitu léčiva trávicí trubicí [7].
3.4 MMX mesalazin
V multi-matrix mesalazinu (tzv. „MMX-koncept“) jsou mikrogranule 5-ASA obaleny polyakrylátovou pryskyřicí (Eudragit S) a zality do hydrofilní a lipofilní matrix [14]. Při průchodu trávicí trubicí se tableta rozpouští tak, že vytváří vazký gel, ze kterého se pomalu, ale kontinuálně uvolňuje mesalazin. Tato léková forma umožňuje dosažení vysokých koncentrací účinné látky především na sliznici levé poloviny tlustého střeva a současně minimalizuje uvolnění a vstřebání léčiva v proximálních partiích trávicí trubice [14]. Perorální podávání MMX mesalazinu pouze v jedné nebo dvou denních dávkách významně zvyšuje adherenci nemocných k léčbě [15]. Preparáty obsahující MMX mesalazin Lialda tbl. a Mezavant tbl. nejsou v ČR zatím registrovány.
3.5 Aminosalicyláty ve formě granulátu (sachet)
Princip uvolnění léčiva je shodný s konceptem využívajícím změnu pH střevního obsahu, (Salofalk granule) nebo postupné uvolňování 5-ASA z granulí, do nichž jsou vlisovány mikropelety (cca 1 mm) obalené v etylcelulóze (Pentasa granulát) [7]. Výhodou granulátů ve srovnání s výše uvedenými tabletovými preparáty je vyšší koncentrace účinné látky v jednotlivé dávce léčiva a s tím související redukce počtu denních dávek pro pacienta při zachování celkové denní dávky 5-ASA, což obdobně jako u MMX preparátu může zvyšovat adherenci pacientů k léčbě.
Protizánětlivý efekt všech typů mesalazinů dostupných v klinické praxi se zdá být srovnatelný a je při perorálním podávání závislý na velikosti denní dávky [5]. Aplikace denní dávky v jednorázovém podání se zdá být výhodnější ve srovnání s několika dílčími dávkami denně. Při jednorázovém dávkování byla pozorována nejen lepší adherence pacientů k medikaci [16,17], ale i vyšší účinnost léčby, pravděpodobně v důsledku vyšší koncentrace aktivního mesalazinu v lumen tlustého střeva [18,19]. Nejnovější lékové formule aminosalicylátů – MMX nebo granuláty – umožňují, vzhledem k vysokému obsahu léčiva v jednotlivé dávce, aplikaci denní dávky 5-ASA v jednorázovém podání. Přehled jednotlivých typů 5-ASA preparátů je uveden v tab. 1.
Tab. 1. Přehled perorálních preparátů 5-ASA. Tab. 1. The overview of the mesalazine (5-ASA) containing drugs for oral administration. 
3.6 Aminosalicyláty k lokálnímu podávání
K lokální intrarektální aplikaci jsou vhodná pouze ta léčiva, která obsahují samotný mesalazin. Mesalazin k lokální aplikaci je podáván ve formě čípků, rektálních nálevů nebo pěn (u nás nedostupných). Rozsah distribuce podaného léčiva po aplikaci je závislý na typu preparátu: čípky vedou k uvolnění léčiva v rozsahu 12–15 cm od análního okraje, při aplikaci rektální pěny je distribuce léčiva maximálně do vzdálenosti 30–40 cm a při podání klyzmatu o obvyklém obsahu 60 ml nebo 100 ml do oblasti sestupného tračníku nebo až do slezinného ohbí [6]. Lokálně aplikovaný mesalazin je většinou dobře tolerován, resorpce a případné nežádoucí účinky jsou minimální. Přehled lokálně působících 5-ASA preparátu je uveden v tab. 2.
Tab. 2. Přehled lokálně působících preparátů 5-ASA dostupných v ČR. Tab. 2. The overview of the mesalazine (5-ASA) containing drugs for topical administration available on the Czech market. 
4. Adherence k medikamentózní terapii
Nezbytnou podmínkou efektivity dlouhodobé (udržovací nebo chemoprofylaktické) terapie mesalazinem je dobrá adherence pacientů k léčbě. Data z klinické praxe ovšem dokumentují závažnou míru tzv. nonadherence, která je detekována při systematickém studiu až u 2/3 (21–69 %) nemocných s IBD [20]. Nonadherence je definována jako stav, kdy nemocný užívá doporučenou léčbu ve sledovaném období méně než z 80 %. Rizikovou skupinou jsou především muži mladšího středního věku (< 40 let), kteří jsou svobodní a pracovně značně vytížení. Mezi významné rizikové faktory, které lze v klinické praxi ovlivnit, patří počet užívaných léků, počet denních dávek, v nichž je lék podáván, a v neposlední řadě úroveň vzájemného vztahu mezi lékařem a pacientem [20,21]. Fenomén nonadherence je spojen s až pětinásobným rizikem relapsu choroby, častějšími komplikacemi a také nepříznivými ekonomickými důsledky následné záchranné terapie [22]. Vedle edukace nemocných, vysvětlení podstaty nemoci a léčebné strategie a také dobrého (partnerského) vztahu mezi lékařem a pacientem je zásadním faktorem způsob podávání dlouhodobé léčby. Řada studií ukazuje, že adherenci nemocných k dlouhodobé udržovací terapii podávané ve fázi remise (tedy v situaci, kdy je nemocný zcela asymptomatický) významně zvyšuje aplikace léčiva v jedné denní dávce, snadná cesta podání (perorálně >> intrarektálně) a nepřítomnost nežádoucích účinků terapie [19–21]. V roce 2009 byly publikovány výsledky studie PODIUM [16,17], která monitorovala účinnost granulátu mesalazinu (Pentasa sachet) v jedné denní dávce 2 g proti rozděleným dávkám 2 × 1 g denně v udržovací léčbě UC. V této studii se jedna denní dávka 2 g ukázala být efektivnější v počtu udržených remisí v průběhu jednoho roku léčby. Na konci prvního roku studie bylo v remisi 70,9 % nemocných léčených jednou dávkou denně, stejný preparát podávaný ve dvou denních dávkách udržel remisi pouze u 58,9 % pacientů. Při jednorázovém podání účinné látky byla významně prodloužena doba do vzniku dalšího relapsu UC (medián 220 dnů oproti kontrolní skupině 148 dnů). Nonadherenci přiznalo ve skupině s jednorázovým dávkováním pouze 26 % nemocných, v případě dvou denních dávek to bylo 45 % nemocných [16,17].
5. Indikace k léčbě aminosalicyláty
5.1 Ulcerózní kolitida
5.1.1 Indukční léčba
Při volbě léčiva, způsobu jeho podání a stanovení dávky musíme u pacienta s UC přihlížet k následujícím faktorům:
- a) aktivitě zánětu, kterou určujeme podle závažnosti klinických obtíží a tíže endoskopického nálezu
- b) rozsahu postižení tlustého střeva
- c) předcházejícímu průběh choroby a odpovědi na podávanou terapii
- d) počtu denních dávek léčiva a finanční nákladnosti léčby
Tab. 3. Index aktivity UC, modifikováno podle Truelova a Wittse. Tab. 3. Modified Truelove and Witts UC activity index. 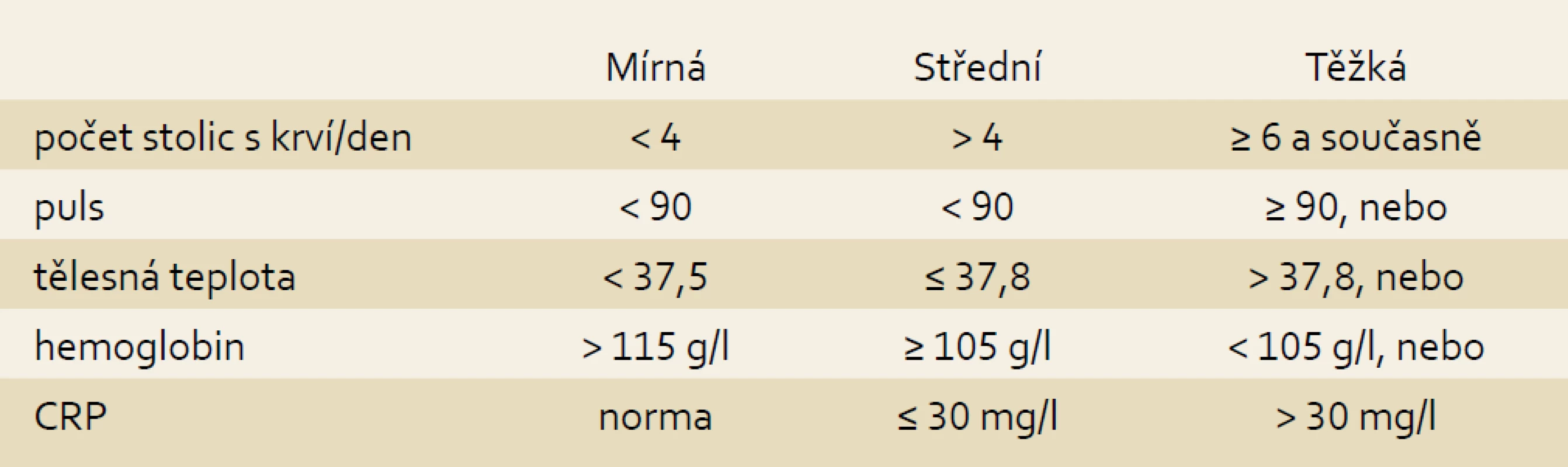
Endoskopický nález erytému a redukované cévní kresby charakterizuje mírnou aktivitu. Difuzní erytém s úplnou absencí cévní kresby, zvýšenou krvácivostí na dotyk a ojedinělými erozemi je typický pro střední aktivitu UC a spontánní krvácivost s difuzním prosáknutím a přítomností vředů potvrzuje vysokou aktivitu ulcerózní kolitidy.
Cílem indukční terapie je rychlé zvládnutí a odstranění symptomů vyplývajících z aktivity onemocnění (krvácení, tenesmy, bolesti břicha, průjmy) a navození kompletní remise potvrzené klinicky, laboratorně a endoskopicky. Výsledky klinických studií a zkušenosti z letité klinické praxe ukázaly, že mesalazin příznivě ovlivní průběh přibližně 50 % případů s ohraničenými formami UC s mírnou nebo středně těžkou aktivitou [24].
Na základě výsledků metaanalýz provedených studií platí, že počet pacientů s aktivní UC, které je nutno léčit k dosažení jedné remise (NNT – Number Needed to Treat) je 10 (95% CI 7–21); pro dosažení zlepšení stavu (terapeutická odpověď) nebo remise je hodnota NNT 4 (95% CI 3–6) [5]. Nejsou žádné přesvědčivé signály podporující jednoznačné výhody jednoho typu preparátu před ostatními [5]. Nebyl zjištěn významný rozdíl v účinnosti v navození klinické remise nebo dosažení klinické odpovědi mezi různými formami mesalazinu a sulfasalazinem (OR = 0,83; 95% CI: 0,60–1,13) [25].
Klinickou odpověď hodnocenou na základě zmírnění symptomů (rektální krvácení) bychom měli posuzovat nejpozději dva týdny od zahájení léčby. Slizniční hojení hodnotíme nejpozději v šestém týdnu od zahájení léčby. Celková doba útočné léčby aminosalicyláty by neměla být kratší než 6–8 týdnů, protože předčasné ukončení léčby zvyšuje riziko časného relapsu, event. zhoršení průběhu UC a extenze zánětlivých změn do vyšších etáží tračníku.
5.1.1.1 Proktitida
Základem terapie UC postihující rektum, a tedy léčbou první volby, je podávání lokálních forem mesalazinu v podobě čípků. Efektivní denní dávkou je 1 g mesalazinu v rozdělných dávkách nebo v jednorázovém podání (výhodnější z důvodu vyšší adherence k terapii), s vyšší dávkou již nestoupá účinnost léčby. V případě, že nemocný neakceptuje lokální terapii, přichází v úvahu celková léčba aminosalicyláty, ta je však méně efektivní. Metaanalýza výsledků lokální terapie proktitidy potvrdila, že medián remisí byl v průběhu čtyřtýdenní terapie 67 % (31–80 %) v porovnání s pouhými 11 % remisí dosaženými při podávání placeba [24]. Narozdíl od relativně vysoké účinnosti lokální léčby mesalazinem je efektivita lokální terapie glukokortikoidy významně nižší.
Při postižení rekta jsou vhodnější čípky než klyzmata, protože jsou snáze zaváděny a lépe tolerovány. Navíc při podání čípku je množství účinné látky v rektu vyšší než při aplikaci nálevu nebo pěny obsahující mesalazin. Při nedostatečné účinnosti samotné lokální terapie mesalazinem je vhodné podat kombinaci 5-ASA ve formě lokální (čípky, pěna, klyzma) a celkové (perorální). Selhání této kombinované léčby je obvykle indikací k podání topických kortikosteroidů v kombinaci s topickým preparátem 5-ASA.
Jestliže uvedená léčba nevede k žádným známkám zlepšení po čtyřech týdnech terapie, označujeme tento stav jako refrakterní proktitidu. V takovém případě je nutno:
- a) ověřit adherenci k léčbě zejména s ohledem na případný dyskomfort pacienta při aplikaci lokálních forem léčiva (dráždivý konečník, snížená elasticita rektální stěny)
- b) zajistit podávání léků do vyprázdněného konečníku
- c) vyloučit nasedající infekci (CMV, Cl. difficile)
Přetrvává-li aktivita i po vyloučení uvedených příčin, je nutno léčbu intenzifikovat s využitím systémových kortikosteroidů (včetně i.v. aplikace) nebo anti-TNF terapie.
Doporučení:
- Topické preparáty 5-ASA zajišťují vyšší koncentraci účinné látky na sliznici rekta, než je tomu při perorálním podávání 5-ASA.
- 5-ASA v perorálním podání je méně efektivní.
- Účinná dávka 5-ASA je 1 g denně ve formě čípků nebo klyzmat, vyšší dávka nezvyšuje efektivitu lokální léčby.
- 5-ASA čípky jsou lépe tolerovány než 5 ASA-klyzmata.
- Alternativou 5-ASA čípků jsou tzv. rektální pěny obsahující 5-ASA (nedostupné v ČR).
- Topické 5-ASA vykazují dvojnásobně vyšší efektivitu oproti topickým glukokortikoidům.
5.1.1.2 Ohraničené tvary UC (proktosigmoiditida a levostranná kolitida)
Základem terapie u nemocných s ohraničenými tvary UC na esovitou kličku a(nebo) levou polovinu tlustého střeva (do lienální flexury) s mírnou a střední aktivitou je podávání perorálního mesalazinu v celkové denní dávce nejméně 2 g současně s lokální terapií mesalazinem. Kombinovaná terapie je účinnější než monoterapie lokální nebo perorální. Metaanalýza účinnosti mesalazinu u levostranné UC potvrdila, že terapie mesalazinem je více než dvakrát efektivnější v dosažení remise než podávání placeba. Nebyl zjištěn rozdíl mezi účinností mesalazinu a sulfasalazinu. U nemocných se středně těžkou UC (nikoli však lehkou formou UC) byla potvrzena závislost mezi velikostí dávky mesalazinu a dosažením protizánětlivého efektu charakterizovaného počtem klinických odpovědí: při podávání 4,8 g mesalazinu denně byla pozitivní klinická odpověď zjištěna u 71,8 % nemocných v porovnání s dávkou 2,4 g denně, při které byla klinická odpověď zaznamenána u 59,2 % (p = 0,036) [26]. Na rozdíl od sulfasalazinu se u mesalazinu podávaného v útočné fázi nezvyšuje frekvence nežádoucích účinků při navýšení denní dávky, proto je u nemocných se středním stupněm zánětlivé aktivity na místě podávat maximální dávku mesalazinu s cílem co nejrychleji dosáhnout příznivého protizánětlivého efektu a ústupu obtíží.
Subanalýza randomizované studie prokázala, že u nemocných s ohraničeným tvarem UC na rektum a sigma je účinnost granulátu mesalazinu podávaného v dávce 3 g jednou denně vyšší oproti dávce 1 g aplikované třikrát denně [18].
Doporučení:
- Základem terapie je kombinované podávání 5-ASA klyzmat nebo čípků v dávce 1–4 g denně (nejlépe na noc) s perorální léčbou 5-ASA > 2 g/den.
- Perorální nebo lokální monoterapie aminosalicyláty je méně efektivní.
- Efekt perorálního mesalazinu stoupá s dávkou, vhodná je iniciální dávka 5-ASA ≥ 4 g/den, zejména u pacientů se středně těžkou UC.
- Při nedostatečné toleranci nebo inefektivitě lokální terapie by měla být zvážena lokální léčba rektální pěnou se současně podávaným perorálním mesalazinem.
- Terapie sulfasalazinem je vzhledem k významně častějším projevům intolerance a nežádoucím účinkům doporučena jako léčba druhé volby; sulfasalazin je preferován před mesalazinem pouze u nemocných s enteropatickou artritidou II. typu.
5.1.1.3 Extenzivní forma UC
Indukční terapie mírně a středně těžké UC extenzivně postihující tlusté střevo se zásadně neliší od způsobu léčby levostranné UC. Základem je aplikace perorálního mesalazinu ve vysoké dávce (≥ 4 g/den) v kombinaci s aplikací lokálních forem, především nálevů. Studie PINCE potvrdila, že celková léčba mesalazinem 4 g denně po dobu dvou měsíců se současnou aplikací lokální terapie 5-ASA 1 g denně po dobu jednoho měsíce vedla k navození remise u 64 % nemocných s mírnou až střední aktivitou oproti 43 % léčených pouze perorálním mesalazinem v dávce 4 g/den (p = 0,03). U nemocných s extenzivní formou UC je třeba pečlivě monitorovat klinický stav a průběh terapie a v případě, že nedojde ke zlepšení stavu do dvou týdnů od zahájení terapie, by měla být zvážena léčba glukokortikoidy nebo zavedení biologické terapie.
Doporučení:
- Extenzivní forma UC s mírnou až střední aktivitou by měla být léčena kombinovaně mesalazinem: maximální perorální dávkou (≥ 4 g/den) doplněnou o lokální terapii klyzmaty (1 nebo 4 g denně) nebo rektální pěnou s budesonidem.
- Nedojde-li během dvou týdnů ke zlepšení stavu, je na místě zvážit zahájení terapie glukokortikoidy nebo biologickou léčbou.
5.1.2 Udržovací terapie UC
Cílem udržovací terapie UC je minimalizace rizika vzplanutí aktivity nemoci, prevence komplikací a udržení vysoké kvality života bez nutnosti podávat glukokortikoidy. Důvodem pro udržovací léčbu je fakt, že během jednoho roku od propuknutí první ataky UC dochází k exacerbaci zánětu u více než poloviny pacientů [5]. Asi 15–29 % nemocných si v dalším průběhu nemoci vyžádá nutnost provedení prokto-kolektomie. Příznivý průběh UC bez následného relapsu nemoci v dalších pěti letech od stanovení diagnózy lze očekávat jen u 13 % nemocných (tzv. „indolentní forma“ UC) [5]. Výsledky metaanalýzy potvrzují relativně vysokou efektivitu aminosalicylátů v udržení remise při délce sledování 6–12 měsíců [27,28]. Poměr pacientů, kteří vykazovali známky relapsu, byl při terapii aminosalicyláty 40 % v porovnání s pacienty na terapii placebem, kde počet exacerbace postihuje 63 % pacientů [27]. Nebyly nalezeny žádné rozdíly ve schopnosti udržet remisi mezi jednotlivými typy léčiv obsahující 5-ASA. Při sledování efektivity různých dávek perorálního mesalazinu (4 g vs 2 g denně) v období 6–12 měsíců udržovací léčby bylo zjištěno, že existuje rozdíl mezi účinností mesalazinu v dávce pod a nad 2 g denně [27]. Denní dávka nad 2 g je účinnější než dávky pod 2 g denně [27]. Tento rozdíl je obzvláště patrný u nemocných s extenzivní kolitidou a u pacientů s frekventními relapsy UC [5]. Minimální efektivní dávka orálního mesalazinu v udržovací léčbě UC se pohybuje kolem 1 g denně [5]. U pacientů s ohraničenými tvary UC na rektum a rektosigma je vhodné podání udržovací terapie v podobě čípků nebo rektálních nálevů. Udržovací dávka lokálně podávané terapie aminosalicyláty by se měla pohybovat kolem 3 g týdně, v závislosti na toleranci a efektivitě může být individuálně upravena [5].
Vyšší denní udržovací dávky mesalazinu jsou vhodné u nemocných s vysokým rizikem relapsu choroby. Jde o pacienty s difuzním postižením tlustého střeva, s frekventními relapsy během posledního roku, pacienty se závažnými strukturálními změnami na tlustém střevě, jako jsou četné zánětlivé polypy, zkrácení tlustého střeva a tubulizace střevního lumen. U pacientů, u kterých navození remise choroby vyžadovalo podávání intravenózních glukokortikosteroidů, cyklosporinu A nebo biologickou léčbu, není udržovací terapie aminosalicyláty efektivní.
Ukončení dlouhodobé udržovací terapie aminosalicyláty by mělo být zváženo u každého pacienta individuálně, na základě předcházejícího průběhu nemoci, odpovědi na léčbu, event. přítomnosti komplikací. Důležité je zohlednit také pacientovy preference a adherenci k podávané léčbě. U nekomplikovaných nemocných s nízkým rizikem relapsu choroby je možné uvažovat po jednom - až dvouletém trvání udržovací léčby nízkými dávkami aminosalicylátů (< 2 g denně) o ukončení léčby.
Doporučení:
- Udržovací terapie aminosalicyláty je léčbou první volby u pacientů s UC, u nichž byla remise navozena orální nebo lokální terapií 5-ASA nebo kortikosteroidy.
- Doporučená denní dávka je 2 g mesalazinu denně; minimální účinná udržovací perorální denní dávka mesalazinu u nemocných s nízkým rizikem relapsu je kolem 1 g denně.
- Vyšší denní dávky mesalazinu (> 2,4 g denně) jsou indikovány u nemocných s vysokým rizikem relapsu.
- U nemocných s nízkým rizikem relapsu je možno zvážit ukončení léčby aminosalicyláty po 1–2 letech trvání kompletní remise.
- Udržovací terapie v podobě lokálních forem mesalazinu (čípky, nálevy, pěna) je vhodná u ohraničených forem UC, účinná dávka je 3 g týdně.
5.2 Crohnova choroba
Od počátku tohoto milénia se přístup k terapii aminosalicyláty u CN značně změnil. Mezinárodní doporučení jsou k použití aminosalicylátů v indukční i udržovací léčbě CN víceméně odmítavá [29]. Nicméně data přicházející z klinické praxe a z některých retrospektivních kohortových studií poukazují na relativně dobrou efektivitu této léčby u malé skupiny nemocných s „indolentním“ průběhem nemoci, navíc s akceptovatelnou ekonomickou náročností a s minimálními vedlejšími účinky [30,31]. I přes evropská doporučení se u nás, ale i v některých jiných zemích Evropy, mesalazin stále široce používá v terapii CN, a naše doporučení proto reflektují tuto všeobecně prováděnou léčbu.
5.2.1 Aminosalicyláty v indukční a udržovací terapii
Aminosalicyláty lze použít pro indukci remise u mírně aktivní CN v ileokolické lokalizaci (mírná aktivita klinicky, laboratorně a nepřítomnost hlubokých vředů v endoskopickém nálezu). V praxi je vhodné podávat vyšší dávky mesalazinu (≥ 3 g denně), nebyl prokázán rozdíl v efektu jednotlivých lékových forem mesalazinových preparátů [32,33]. Sulfasalazin je vhodný pouze u kolické formy CN [29], nicméně vzhledem k vyššímu riziku nežádoucích účinků jde o léčbu druhé volby. Efektivitu léčby je doporučeno hodnotit časně, a to v průběhu 2–4 týdnů od zahájení léčby. Při dosažení pozitivní odpovědi je vhodné v této terapii pokračovat dlouhodobě ve stejné dávce. Není-li účinnost monoterapie mesalazinem dostatečná, je na místě zvážit jinou medikamentózní léčbu (budesonid, glukokortikoidy se systémovým účinkem). Podávání aminosalicylátů v kombinaci s jinými protizánětlivými léky (kortikoidy, imunosupresiva, biologická léčba) nemá opodstatnění, a není proto doporučeno. Výjimkou je rozsáhlé postižení tlustého střeva, kde lze mesalazin podávat z důvodu chemoprofylaxe kolorektální dysplazie. Topické preparáty 5-ASA nejsou, na rozdíl od UC, vhodné k léčbě CN z důvodu nízké efektivity [34].
Doporučení:
- Terapie aminosalicyláty je indikována u nemocných s nízkou aktivitou Crohnovy nemoci v ileokolické lokalizaci (mírná klinická symptomatologie, nízká laboratorní aktivita a nepřítomnost vředů v endoskopickém nálezu).
- Doporučená denní dávka mesalazinu pro léčbu aktivní CN je ≥ 3 g.
- Dlouhodobá udržovací léčba je doporučena v případě příznivé odpovědi na terapii aktivní CN.
- Doporučená denní udržovací dávka mesalazinu pro udržovací léčbu CN je ≥ 3 g.
5.2.2 Profylaxe rekurence CN po ileokolické resekci
Všechny pacienty po ileokolické resekci je potřeba stratifikovat k další terapii podle míry rizika rekurence CN [35]. Profylaktickou terapii mesalazinem je možné zvážit jen u nemocných s nízkým rizikem, a to v dávce ≥ 3 g denně [35–37]. I přesto je účinnost profylaktické terapie mesalazinem pouze mírná, NNT se pohybuje v rozmezí 10–13 [36]. Při neúčinnosti mesalazinu v monoterapii není vhodné pokračovat v podávání aminosalicylátů v kombinaci s jinými léky.
Pacienti s nízkým rizikem pooperační rekurence CN jsou charakterizováni absencí následujících rizikových faktorů [35]:
- a) časný začátek CN < 17 let
- b) kouření
- c) perianální projevy CN
- d) perforující typ CN
- e) ≥ 1 resekční operace
- f) extenzivní nebo multifokální postižení tenkého střeva
- g) přítomnost hlubokých vředů
Doporučení:
- Podávaní mesalazinu jako profylaktické terapie po ileokolické resekci lze zvážit u nemocných s CN s nízkým rizikem rekurence nemoci.
- Doporučená denní dávka mesalazinu při profylaktickém podání je ≥ 3 g denně.
6. Bezpečnost a nežádoucí účinky terapie aminosalicyláty
Zatímco podávání sulfasalazinu je spojeno s vysokým rizikem nežádoucích účinků, mesalazin patří k nejbezpečnějším lékům používaným v terapii IBD [5]. Nežádoucí účinky obou léčiv mají buď charakter idiosynkratické či alergické reakce, nebo jde o přímý toxický efekt látky či jejích metabolitů. Zatímco v prvním případě obvykle není efekt závislý na dávce, přímá toxicita zpravidla stoupá s dávkou léčiva nebo jeho metabolitů v organizmu.
6.1 Sulfasalazin
Výskyt intolerance a(nebo) nežádoucích účinků je poměrně častý (10–45 % léčených) [38]. Nejčastější jsou poruchy v oblasti gastrointestinálního traktu (nauzea, zvracení, nadýmání, průjem), zvýšená teplota, bolesti hlavy, erytém, pruritus a fotosenzitivita. Většina nežádoucích účinků sulfasalazinu závisí na dávce – s rostoucí dávkou jejich výskyt stoupá [38]. Platí to zejména u tzv. pomalých acetylátorů, u nichž je degradace léku zpomalena a hladina sulfapyridinu v séru narůstá [4]. Zejména při dávkách vyšších než 4 g denně se může vyskytnout krevní dyskrazie (hemolytická anémie, leukopenie, trombocytopenie), poruchy centrálního nervového systému (vertigo, tinitus, ataxie, halucinace) a renální komplikace (nedostatečnost, proteinurie, hematurie, krystalurie a intersticiální nefritida). Naopak, na velikosti dávky nezávisí výskyt dalších nežádoucích reakcí jako např. agranulocytózy, aplastické anémie, hepatitidy, pankreatitidy, periferní neuropatie, urtikarie, exfoliativní dermatitidy, Stevens-Johnsonova syndrom nebo fibrotizující alveolitidy. Může též dojít k přechodné oligospermii a infertilitě, které vymizí po přerušení terapie. Při léčbě sulfasalzinem mohou vzrůstat hodnoty sérové amylázy, bilirubinu, alkalické fosfatázy a jaterních transamináz. V klinické praxi je proto nutno monitorovat především krevní obraz a jaterní testy, zpočátku měsíčně, později jednou za šest měsíců.
6.2 Mesalazin
Mesalazin má vynikající bezpečnostní profil, výskyt NÚ je srovnatelný s frekvencí nežádoucích účinků po placebu [39]. Intolerance a idiosynkratické reakce jsou vzácné. Jde především o nauzeu, průjem, kožní eflorescence a bolesti hlavy [5]. Všechny výše uvedené charakterizuje promptní ústup obtíží po vysazení léku. Mezi idiosynkratické reakce patří intersticiální nefritida, hepatitida, pankreatitida, pneumonitida, perikarditida a myokarditida, některé hematologické změny (trombocytopenie), kožní raš a alopecie. Pro klinickou praxi je důležité zmínit, že vzácně může dojít ke zhoršení aktivity UC po celkové nebo lokální aplikaci mesalazinu nejspíše v rámci alergické reakce (eozinofilie v periferní krvi) [5]. Rutinní kontroly krevního obrazu ani hodnot jaterních testů při léčbě preparáty 5-ASA nejsou doporučovány.
Nejzávažnějším nežádoucím účinkem mesalazinu je indukce intersticiální nefritidy na podkladě idiosynkratické reakce (není závislost na dávce) [40,41]. Její frekvence je odhadována na jeden případ na 500 léčených pacientů [40]. Poškození ledvin může být ireverzibilní již při minimální symptomatologii, bývá často maskované současným užíváním jiných léků, zejména kortikosteroidů. Nejčastěji byla intersticiální nefritida pozorována v průběhu prvního roku léčby, může se však objevit kdykoli během podávání mesalazinu [40]. Vyšší riziko nefrotoxicity musíme očekávat u pacientů s dalšími závažnými komorbiditami (renální insuficiencí, diabetem mellitus, hypertenzí) a těžším průběhem UC. U všech nemocných léčených aminosalicyláty je doporučeno monitorování hladiny kreatininu před zahájením léčby a v intervalu šest měsíců po celou dobu léčby. Při známkách nefrotoxicity je nutno podávání mesalazinu ukončit.
Doporučení:
- Sulfasalazin má relativně vysoký výskyt nežádoucích účinků, které limituji jeho použití v klinické praxi.
- Výskyt nežádoucích účinků při podávání mesalazinu je minimální.
- Nejzávažnějším nežádoucím účinkem aminosalicylátu je intersticiální nefritida, u nemocných je proto doporučeno kontrolovat hladinu kreatininu v intervalu šest měsíců po celou dobu terapie.
7. Speciální situace
7.1 Aminosalicyláty v chemoprofylaxi dysplázie a kolorektálního karcinomu
Riziko vzniku dysplazie a kolorektálního karcinomu (CRC) je u nemocných s UC zvýšeno, stejně tak je tomu u nemocných s CN postihující tračník a rektum [42,43]. Hlavními rizikovými faktory pro vznik CRC u UC jsou: délka trvání ulcerózní kolitidy (> 8 let), rozsah a aktivita střevního zánětu, pozitivní rodinná anamnéza CRC a přítomnost primární sklerózující cholangitidy (PSC) [44]. Samotná proktitida riziko dysplazie a CRC nezvyšuje [44]. Hrubé strukturální změny, které jsou důsledkem těžce a dlouho probíhajícího zánětu, jako jsou zánětlivé polypy, tubulizace lumen střeva, zkrácení délky střeva a především vznik stenózy tlustého střeva představují významná rizika pro neoplastickou přeměnu [44]. Největšímu riziku vzniku této komplikace jsou vystaveni nemocní s PSC, a to bez ohledu na délku trvání choroby a rozsah postižení tlustého střeva [44].
Základem péče o nemocné s UC se zvýšeným rizikem je zařazení těchto pacientů do dispenzárních koloskopických programů a trvalé profylaktické podávání mesalazinu [44]. Mechanizmy, kterými 5-ASA potlačuje vznik neoplazie, nejsou zcela jasné. Pravděpodobně zasahuje do procesu karcinogeneze na různých úrovních; některé z nich jsou společné s protizánětlivým působením mesalazinu, jiné mohou mít výlučně efekt protinádorový [45]. Mezi společné mechanizmy potlačující zánětlivou aktivitu i nádorové bujení patří: inhibice cyklooxygenázy (COX) a inducibilní NO syntázy, blokáda NF-κB a aktivace PPAR-γ [45]. Studie in vitro prokazují, že aminosalicyláty mají schopnost blokovat tzv. Wnt/β-katenin signální dráhu, která je klíčovým mechanizmem v procesu karcinogeneze CRC, zpomalují replikaci chromozomů aktivací kontrolních bodů buněčného cyklu v S fázi a jsou nadány schopností demetylace promotorových částí tumor supresorových genů.
Profylaktický vliv mesalazinu je prokazatelný při dlouhodobém podávání léku v dávce nejméně 1,2 g denně, nižší dávky mesalazinu nebyly shledány v profylaxi jako efektivní [46]. Redukce rizika vzniku CRC je podle rozsáhlé metaanalýzy při dlouhodobém užívání mesalazinu přibližně 50 %. Sulfasalazin nesnižuje riziko dysplazie a CRC, důvodem může být jeho schopnost inhibovat resorpci a utilizaci kyseliny listové.
7.2 Gravidita a laktace
Terapie aminosalicyláty (včetně sulfasalazinu) v graviditě i při kojení je považována za bezpečnou [35,47]. 5-ASA jsou léky kategorie B dle FDA (při zkouškách na zvířatech nebylo prokázáno riziko pro plod, dostatečné a kontrolované studie u těhotných žen nebyly provedeny). Podle ECCO klasifikace patří perorální i lokálně aplikovaný mesalazin a sulfasalazin mezi prokazatelně bezpečné léky a mohou se v graviditě a při kojení podávat bez omezení [35,47]. Těhotné pacientky na terapii aminosalicyláty mají srovnatelný výskyt komplikací gravidity jako běžná populace [35,47]. Nicméně sulfasalazin zvyšuje riziko folátové deficience s následnou možnou poruchou vývoje centrálního nervového systému plodu, a proto je po celou dobu gravidity potřeba suplementovat kyselinou listovou v dávce 20 mg denně [47]. V klinické praxi v ČR upřednostňujeme v graviditě léčbu mesalazinem, který má na rozdíl od sulfasalazinu lepší bezpečností profil.
7.3 Aminosalicyláty u dětských pacientů
Útočná dávka mesalazinu se pohybuje od 50–100 mg/kg tělesné hmotnosti, s maximální denní dávkou 3–4 g. V případě sulfasalazinu je to 40–60 mg/kg (maximálně 3 g denně), při dobré toleranci výjimečně až 100 mg/kg denně. U dětských pacientů s UC je mesalazin považován za lék první volby u mírné a střední aktivity UC. Lokální monoterapie je využívána méně často, i když může být efektivní u lokalizované proktitidy, která je však u dětských pacientů spíše vzácná. Preferována je kombinovaná terapie perorálními a lokální preparáty (klyzmata), pakliže ji děti snáší. U Crohnovy nemoci je doporučen mesalazin pouze jako adjuvantní terapie u levostranné kolitidy. Podrobnější informace o použití 5-ASA preparátů u dětských pacientů je uvedena v doporučeních Pracovní skupiny dětské gastroenterologie a výživy ČPS pro diagnostiku a léčbu IBD u dětí [48].
Doporučení:
- Mesalazin v dávce ≥ 1,2 g je vhodný k chemoprofylaxi CRC u nemocných s UC a CN tlustého střeva.
- Podávání sulfasalazinu v této indikace není účinné.
- Aminosalicyláty jsou bezpečné v graviditě, mesalazin je preferován před sulfasalazinem.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 8. 8. 2012
Přijato: 15. 10. 2012
prof. MUDr. Milan Lukáš, CSc.
ISCARE Lighthouse, a. s.
Jankovcova 1569/2c
Praha 7, 170 00
milan.lukas@email.cz
Zdroje
1. Caprilli R, Cesarini M, Angelucci E et al. The long journey of salicylates in ulcerative colitis: The past and the future. J Crohns Colitis 2009; 3(3): 149–156.
2. Azad Khan AK, Piris J, Truelove SC. An experiment to determine the active therapeutic moiety of sulphasalazine. Lancet 1977; 2(8044): 892–895.
3. Klotz U, Maier K, Fischer C et al. Therapeutic efficacy of sulfasalazine and its metabolites in patients with ulcerative colitis and Crohn's disease. N Engl J Med 1980; 303(26): 1499–1502.
4. Schroder H, Evans DA. Acetylator phenotype and adverse effects of sulphasalazine in healthy subjects. Gut 1972; 13(4): 278–284.
5. Travis SPL, Stange EF, Lemann M et al. European evidence-based Consensus on the management of ulcerative colitis: Current management. J Crohns Colitis 2008; 2(1): 24–62.
6. Harris MS, Lichtenstein GR. Review article: delivery and efficacy of topical 5-aminosalicylic acid (mesalazine) therapy in the treatment of ulcerative colitis. Aliment Pharmacol Ther 2011; 33(9): 996–1009.
7. Lichtenstein GR, Kamm MA. Review article: 5-aminosalicylate formulations for the treatment of ulcerative colitis – methods of comparing release rates and delivery of 5-aminosalicylate to the colonic mucosa. Aliment Pharmacol Ther 2008; 28(6): 663–673.
8. Desreumaux P, Ghosh S. Review article: mode of action and delivery of 5-aminosalicylic acid – new evidence. Aliment Pharmacol Ther 2006; 24 (Suppl 1): 2–9.
9. Rousseaux C, Lefebvre B, Dubuquoy L et al. Intestinal antiinflammatory effect of 5-aminosalicylic acid is dependent on peroxisome proliferator-activated receptor-gamma. J Exp Med 2005; 201(8): 1205–1215.
10. Dubuquoy L, Dharancy S, Nutten S et al. Role of peroxisome proliferator-activated receptor gamma and retinoid X receptor heterodimer in hepatogastroenterological diseases. Lancet 2002; 360(9343): 1410–1418.
11. Myers B, Evans DN, Rhodes J et al. Metabolism and urinary excretion of 5-amino salicylic acid in healthy volunteers when given intravenously or released for absorption at different sites in the gastrointestinal tract. Gut 1987; 28(2): 196–200.
12. Sandborn WJ, Hanauer SB. Systematic review: the pharmacokinetic profiles of oral mesalazine formulations and mesalazine pro-drugs used in the management of ulcerative colitis. Aliment Pharmacol Ther 2003; 17(1): 29–42.
13. Rachmilewitz D. Coated mesalazine (5-aminosalicylic acid) versus sulphasalazine in the treatment of active ulcerative colitis: a randomised trial. BMJ 1989; 298(6666): 82–86.
14. Schreiber S, Kamm MA, Lichtenstein GR. Mesalamine with MMX technology for the treatment of ulcerative colitis. Expert Rev Gastroenterol Hepatol 2008; 2(3): 299–314.
15. Prantera C, Rizzi M. 5-ASA in ulcerative colitis: improving treatment compliance. World J Gastroenterol 2009; 15(35): 4353–4355.
16. Lukáš M. Účinnost udržovací terapie u ulcerózni kolitidy je ovlivněna farmakokinetikou mesalazinu a adherencí k medikamentózní lecbe. Komentář ke studii PODIUM. Čes a Slov Gastroent a Hepatol 2010; 64(5): 26–29.
17. Dignass AU, Bokemeyer B, Adamek H et al. Mesalamine once daily is more effective than twice daily in patients with quiescent ulcerative colitis. Clin Gastroenterol Hepatol 2009; 7(7): 762–769.
18. Kruis W, Kiudelis G, Racz I et al. Once daily versus three times daily mesalazine granules in active ulcerative colitis: a double-blind, double-dummy, randomised, non-inferiority trial. Gut 2009; 58(2): 233–240.
19. Flourie B. Once-Daily versus Twice-daily Mesalazine (Pentasa) for Active Ulcerative Colitis: Efficacy Results from MOTUS, a Multicentre, Controlled, Randomised, Investigator-Blinded Study. Gut 2011.
20. Cerveny P, Bortlik M, Kubena A et al. Nonadherence in inflammatory bowel disease: results of factor analysis. Inflamm Bowel Dis 2007; 13(10): 1244–1249.
21. Kane SV, Cohen RD, Aikens JE et al. Prevalence of nonadherence with maintenance mesalamine in quiescent ulcerative colitis. Am J Gastroenterol 2001; 96(10): 2929–2933.
22. Kane S, Huo D, Aikens J et al. Medication nonadherence and the outcomes of patients with quiescent ulcerative colitis. Am J Med 2003; 114(1): 39–43.
23. Truelove SC, Witts LJ. Cortisone in ulcerative colitis; final report on a therapeutic trial. Br Med J 1955; 2(4947): 1041–1048.
24. Marshall JK, Irvine EJ. Rectal aminosalicylate therapy for distal ulcerative colitis: a meta-analysis. Aliment Pharmacol Ther 1995; 9(3): 293–300.
25. Sutherland L, Macdonald JK. Oral 5-aminosalicylic acid for induction of remission in ulcerative colitis. Cochrane Database Syst Rev 2006; CD000543.
26. Hanauer SB, Sandborn WJ, Kornbluth A et al. Delayed-release oral mesalamine at 4.8 g/day (800 mg tablet) for the treatment of moderately active ulcerative colitis: the ASCEND II trial. Am J Gastroenterol 2005; 100(11): 2478–2485.
27. Ford AC, Achkar JP, Khan KJ et al. Efficacy of 5-aminosalicylates in ulcerative colitis: systematic review and meta-analysis. Am J Gastroenterol 2011; 106(4): 601–616.
28. Sutherland L, Macdonald JK. Oral 5-aminosalicylic acid for maintenance of remission in ulcerative colitis. Cochrane Database Syst Rev 2006; CD000544.
29. Dignass A, Van Assche G, Lindsay JO et al. The second European evidence-based consensus on the diagnosis and management of Crohn´s disease: Current management. J Crohns Colitis 2010; 4(1): 28–62.
30. Bokemeyer B, Katalinic A, Klugmann T et al. Predictive factors for a mild course of Crohn´s disease. J Crohns Colitis 2009; 3: S82–S83.
31. Duricova D, Pedersen N, Elkjaer M et al. 5-Aminosalicylic acid dependency in Crohn´s disease: A Danish Crohn Colitis Database study. J Crohns Colitis 2010; 4(5): 575–581.
32. Ford AC, Kane SV, Khan KJ et al. Efficacy of 5-aminosalicylates in Crohn's disease: systematic review and meta-analysis. Am J Gastroenterol 2011; 106(4): 617–629.
33. Lim WC, Hanauer S. Aminosalicylates for induction of remission or response in Crohn’s disease. Cochrane Database Syst Rev 2010; CD008870.
34. Travis SP, Stange EF, Lemann M et al. European evidence based consensus on the diagnosis and management of Crohn’s disease: current management. Gut 2006; 55 (Suppl 1): i16–i35.
35. Van AG, Dignass A, Reinisch W et al. The second European evidence-based Consensus on the diagnosis and management of Crohn’s disease: Special situations. J Crohns Colitis 2010; 4(1): 63–101.
36. Ford AC, Khan KJ, Talley NJ et al. 5-aminosalicylates prevent relapse of Crohn’s disease after surgically induced remission: systematic review and meta-analysis. Am J Gastroenterol 2011; 106(3): 413–420.
37. Gordon M, Naidoo K, Thomas AG et al. Oral 5-aminosalicylic acid for maintenance of surgically-induced remission in Crohn’s disease. Cochrane Database Syst Rev 2011; CD008414.
38. Mowat C, Cole A, Windsor A et al. Guidelines for the management of inflammatory bowel disease in adults. Gut 2011; 60(5): 571–607.
39. Loftus EV Jr., Kane SV, Bjorkman D. Systematic review: short-term adverse effects of 5-aminosalicylic acid agents in the treatment of ulcerative colitis. Aliment Pharmacol Ther 2004; 19(2): 179–189.
40. Gisbert JP, Gonzalez-Lama Y, Mate J. 5-Aminosalicylates and renal function in inflammatory bowel disease: a systematic review. Inflamm Bowel Dis 2007; 13(5): 629–638.
41. Van Staa TP, Travis S, Leufkens HG et al. 5-aminosalicylic acids and the risk of renal disease: a large British epidemiologic study. Gastroenterology 2004; 126(7): 1733–1739.
42. Jess T, Gamborg M, Matzen P et al. Increased risk of intestinal cancer in Crohn’s disease: a meta-analysis of population-based cohort studies. Am J Gastroenterol 2005; 100(12): 2724–2729.
43. Jess T, Rungoe C, Peyrin-Biroulet L. Risk of colorectal cancer in patients with ulcerative colitis: a meta-analysis of population-based cohort studies. Clin Gastroenterol Hepatol 2012; 10(6): 639–645.
44. Biancone L, Michetti P, Travis S et al. European evidence-based Consensus on the management of ulcerative colitis: Special situations. J Crohns Colitis 2008; 2(1): 63–92.
45. Rubin DT, Cruz-Correa MR, Gasche C et al. Colorectal cancer prevention in inflammatory bowel disease and the role of 5-aminosalicylic acid: a clinical review and update. Inflamm Bowel Dis 2008; 14(2): 265–274.
46. Eaden JA, Abrams KR, Mayberry JF. The risk of colorectal cancer in ulcerative colitis: a meta-analysis. Gut 2001; 48(4): 526–535.
47. van der Woude CJ, Kolacek S, Dotan I et al. European evidenced-based consensus on reproduction in inflammatory bowel disease. J Crohns Colitis 2010; 4(5): 493–510.
48. Adamcová M, Bajer M, Bajerová K et al. Doporučení Pracovní skupiny dětské gastroenterologie a výživy ČPS pro diagnostiku a léčbu nespecifických střevních zánětů u dětí. Cesko-Slovenska Pediatrie 2012; 67: 5–47.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2012 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Gastrointestinální onkologie – realita blízké budoucnosti?
- Epidemiologie zhoubných nádorů trávicího traktu v České republice – současný stav a predikce
- Zamyšlení nad finančními aspekty péče o nemocné s kolorektálním karcinomem
- Národní program screeningu kolorektálního karcinomu v České republice – minulost, přítomnost a budoucnost
- Karcinom pankreatu
- Endoskopická ablatívna liečba rektosigmoideálnych prekanceróz – pilotná štúdia
- Karcinom jícnu a rizikové faktory podle histologických typů
- Diagnostika a liečba celiakie: dnes a zajtra
- Nealkoholická steatohepatitida (NASH) – týká se nás všech
- Nález v podkoží v periumbilikální krajině by neměl být přehlédnut
- Endoskopie u nemocných s antikoagulační a antiagregační terapií
- Doporučené postupy pro podávání aminosalicylátů u nemocných s idiopatickými střevními záněty
- Diskuzní fórum
- Komentář ke třídění funkčních dyspepsií podle kritérií „ROME I, II, III“
- Diagnóza nízkého stupně dysplazie u pacientů s Barrettovým jícen – pravděpodobně „overdiagnosed“
- Komentář k domácím publikacím o neoplaziích v Barrettově jícnu
- Odpověď na komentář prof. Špičáka
- Jak zlepšit screening kolorektálního karcinomu?
- Správná odpověď na kvíz
- XXI. jarní setkání Loket – pokroky v léčbě nemocných s karcinomem pankreatu
- Prague Hepatology Meeting 2012
- Prof. MUDr. Aleš Hep, CSc., šedesátiletý
- Budenofalk 2 mg rektální pěna představuje významné rozšíření našich terapeutických možností u nemocných s ulcerózní kolitidou
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Budenofalk 2 mg rektální pěna představuje významné rozšíření našich terapeutických možností u nemocných s ulcerózní kolitidou
- Epidemiologie zhoubných nádorů trávicího traktu v České republice – současný stav a predikce
- Karcinom pankreatu
- Prof. MUDr. Aleš Hep, CSc., šedesátiletý
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




