-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Endoskopie u nemocných s antikoagulační a antiagregační terapií
Endoscopy in patients with anticoagulant and antiplatelet therapy
The author declares he has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
15. 4. 2012Accepted:
24. 6. 2012
Autoři: Z. Zádorová
Působiště autorů: II. interní klinika FNKV, 3. LF UK v Praze
Vyšlo v časopise: Gastroent Hepatol 2012; 66(5): 384-389
Kategorie: Digestivní endoskopie: doporučené postupy
Souhrn
The author declares he has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
15. 4. 2012Accepted:
24. 6. 2012V současné době široce používaná antikoagulační a antiagregační léčba k redukci rizika tromboembolických příhod v určitých kardiologických případech, u hlubokých žilních trombóz, u hyperkoagulačních stavů a u koronárních stentů může nejen způsobit gastrointestinální krvácení, ale i zkomplikovat endoskopickou léčbu. Přerušení této terapie je tedy pro nemocné žádoucí, ale může být z hlediska základního onemocnění současně velmi nebezpečné [1,2,6].
Mezi zásady bezpečné digestivní endoskopie patří identifikace skupin rizikových nemocných zahrnující také nemocné s poruchami hemokoagulace. Na základě studií a závěrů expertů vznikají doporučené postupy, jak minimalizovat rizika invazivních a terapeutických endoskopických metod zejména u nemocných, kteří mají antikoagulační a antiagregační terapii. U vysoce rizikových nemocných je třeba konzultovat postup s kardiology, hematology a dalšími odborníky [1,6,18,20,31,46].
Je nezbytné případ od případu zvažovat endoskopický výkon a jeho rizika, nutnost hospitalizace, parenterální antikoagulační terapii a laboratorní vyšetření nutná k monitoraci a průkazu úpravy antikoagulační terapie [18,20,35]. Nová data dovolují lépe posoudit tato rizika, nezbytnou dobu přerušení antikoagulační a antiagregační léčby před endoskopií, použití alternativních procedur (např. pro ERCP) k prevenci krvácení.
Riziko tromboembolických a trombotických příhod
Pravděpodobnost tromboembolické komplikace závisí na předchozí antikoagulační terapii. Riziko závažné embolie (způsobující smrt, reziduální neurologické poškození nebo periferní ischemii vyžadující chirurgické řešení) při absenci antikoagulační terapie u nemocných s mechanickými náhradami chlopně dosahuje až 4/100 nemocných za rok. Antiagregační léčba toto riziko snižuje na 2,2/100 nemocných za rok a warfarinizace na 1/100 nemocných za rok. U pacientů s fibrilací síní bez antikoagulační terapie dochází k cévní příhodě až v 4,5 % [2,5,7]. Více ohroženi jsou nemocní starší, s hypertenzí, s hyperlipidemií a rodinnou anamnézou cévní příhody. Trvalými následky či smrtí v důsledku tromboembolické komplikace nebo krvácení jsou nemocní ohroženi v 70–75 % u tepenné tromboembolie, ve 4–10 % u žilní tromboembolie a v 1–6 % u krvácení po výkonu [2,43]. Velkým rizikem trombózy při vysazení terapie jsou ohrožení nemocní s koronárními stenty, kteří potřebují duální antitrombotickou léčbu (aspirin + clopidogrel), trvající 12 měsíců. Jedná se o stenty uvolňující farmaka „Drug Eluting Stent“ (DES), na rozdíl od metalických holých (Bare Stent), kde stačí jeden měsíc antitrombotické terapie [2,6,17,26,28,46,48]. Je zřejmé, kterými klinickými situacemi jsou nemocní ohroženi nejvíce, proto je nutné zajistit účinnou antitrombotickou prevenci, ale i hemostázu pro daný výkon.
Nutnost antikoagulační terapie se liší podle míry rizika vzniku tromboembolických příhod (tab. 1), na které závisí i příprava nemocných před výkonem. Skupiny s nízkým rizikem zahrnují hlubokou žilní trombózu, chronickou nebo paroxysmální fibrilaci síní bez onemocnění chlopní, bioprotézy chlopní a mechanickou náhradu aortální chlopně.
Tab. 1. Riziko tromboembolické komplikace. Tab. 1. Risk of thromboembolic complication. 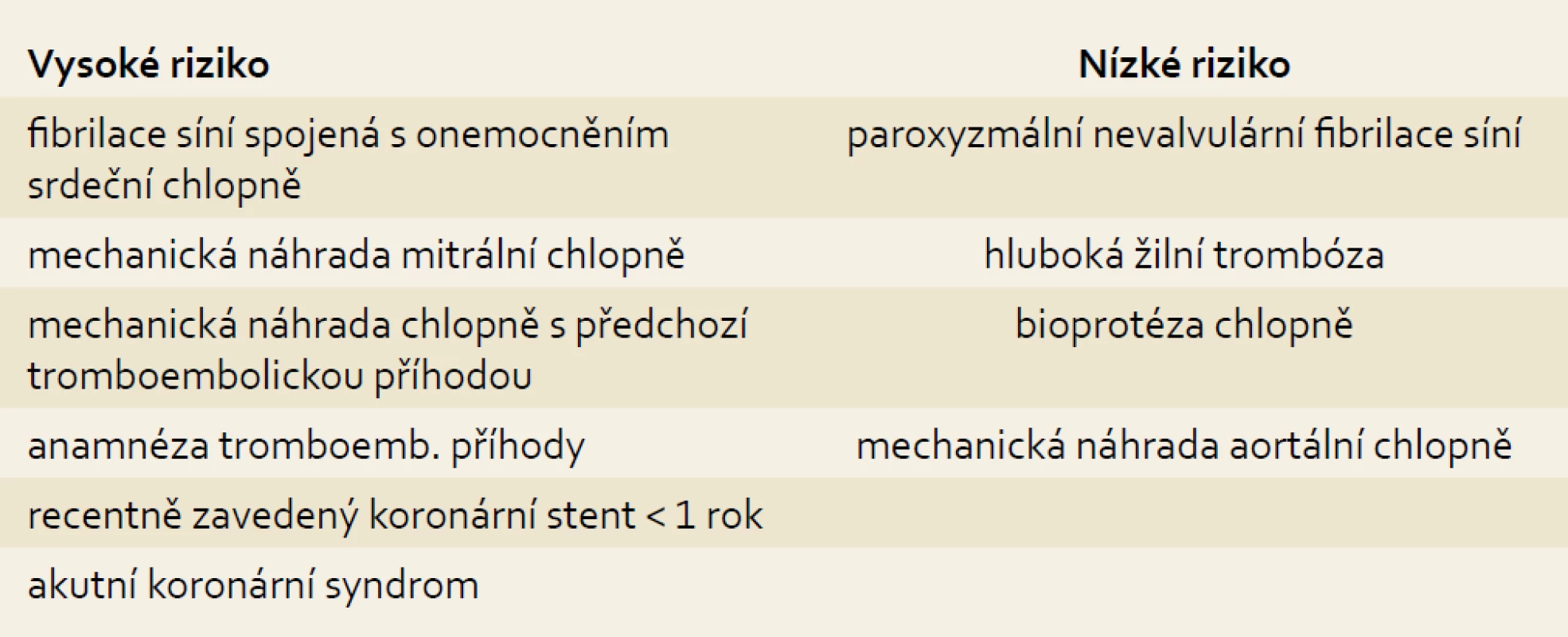
Absolutní riziko embolické příhody u nemocných v nízkorizikové skupině, u kterých je antikoagulace přerušena na 4–7 dnů, je odhadováno na 1–2/1 000 nemocných [1,2,6,18, 20,43,46].
Vysocerizikové skupiny představuje fibrilace síní s onemocněním srdečních chlopní včetně přítomnosti mechanické náhrady chlopně, mechanické náhrady mitrální chlopně, mechanické náhrady u nemocných, kteří mají v anamnéze tromboembolickou příhodu a akutní koronární syndrom [1,2,6,7,20,43]. Nemocní s recentně zavedenými koronárními stenty, zvláště DES, musí podle Guidelines American Heart Association (AHA) užívat duální antitrombotickou terapii 12 měsíců po zavedení stentu, jinak jsou ohroženi vysokým rizikem trombózy [28]. U nemocných s přechodnou antikoagulační terapií (hluboká žilní trombóza) se všeobecně doporučuje odložení elektivních výkonů (pokud je to možné) po ukončení této léčby.
Antiagregační terapie
Aspirin a thienopyridiny (clopidogrel a prasugrel) jsou nejčastěji používané antitrombocytové preparáty, někdy jsou podávány společně. Aspirin inhibuje destičkovou cyklooxygenázu způsobující supresi tromboxanu A2 v trombocytech, čímž je ovlivněna jedna z hlavních cest aktivace destiček. Clopidogrel a prasugrel, užívané stále častěji u kardiologických nemocných, inhibují fosfolipázu C a blokují membránové receptory pro ADP s následnou inhibicí adheze a degranulace destiček [36,46]. Minimální doba pro přerušení terapie k normalizaci destiček je 5–7 dnů pro aspirin a clopidogrel a 7 dnů pro prasugrel. Účinnost aspirinu a clopidogrelu výrazně kolísá mezi jednotlivci v závislosti na schopnosti aktivace destiček a genetických faktorech. Vždy je rozhodující počet trombocytů (kompletní obnova trvá 9 dnů). Např. při hodnotě 500 000 trombocytů stačí vysazení aspirinu na 2,5 dne, při hodnotě 120 000 trombocytů je třeba vysadit aspirin na alespoň 7 dnů před výkonem [1,2,4,6,18,20]. V mnohých případech nemohou být perorální antikoagulancia nebo heparin použity jako substituce po vysazení antitrombocytové terapie. Např. heparin (nefrakcionovaný nebo nízkomolekulární) není doporučen jako prevence trombózy u koronárních stentů. Riziko spontánní okluze stentů při vysazení terapie s následným akutním koronárním syndromem a infarktem myokardu je až 50 % [17,26,28,46]. Pacient, který potřebuje kombinaci dvou antiagregačních léků pro vysoké riziko trombózy, by neměl nikdy vysazovat aspirin a nepodání thienopyridinů by mělo být nejprve konzultováno s kardiology. Nemocným užívajícím samotný clopidogrel může být jako substituce podáván aspirin během endoskopického výkonu, který je vysoce rizikový pro pravděpodobnost krvácení. S antiagregační terapií by mělo být pokračováno ne později než za 24–48 hod po endoskopickém výkonu, ale může být i prodloužena případ od případu při nebezpečí těžkého krvácení [1,2,6,28,46].
Rizika endoskopických výkonů (tab. 2)
Tab. 2. Rizika krvácení u endoskopických výkonů. Tab. 2. Risk of bleeding with endoscopic procedures. 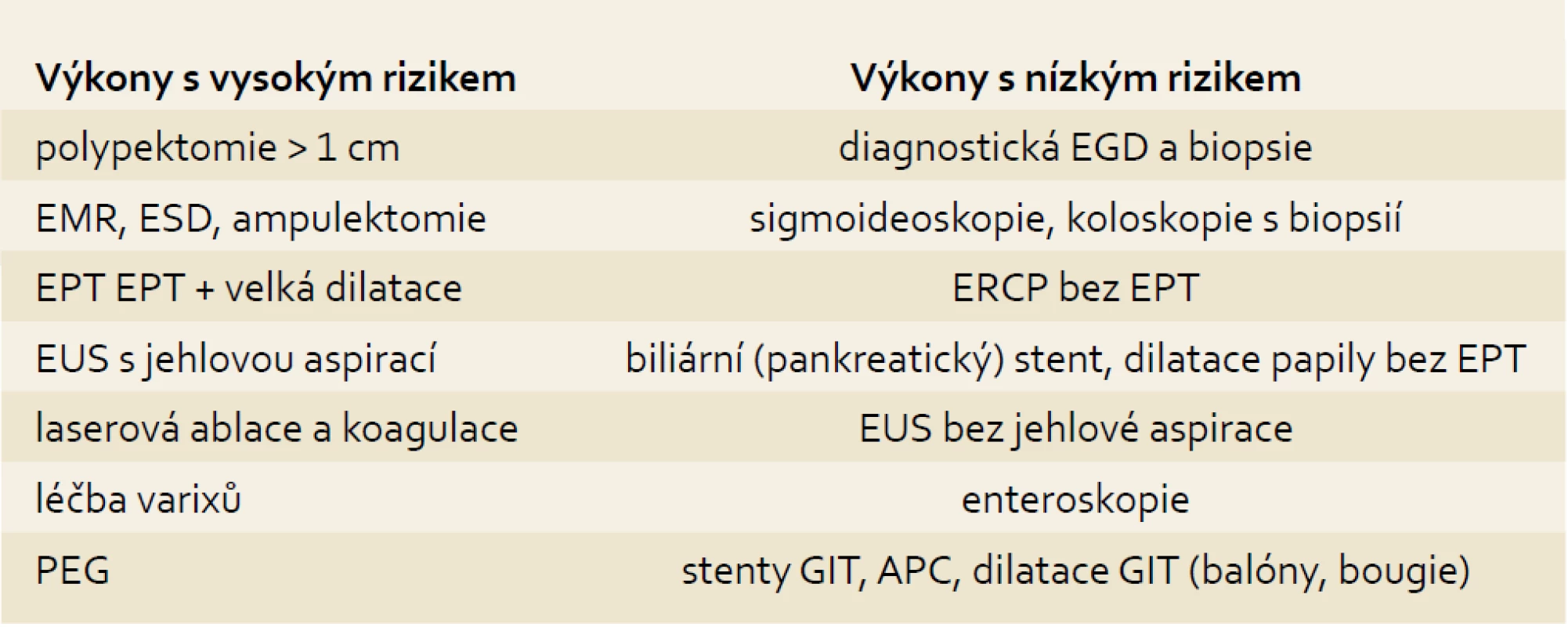
Endoskopické výkony se liší v míře rizika způsobit významné nebo nezvladatelné krvácení.
A. Výkony s nízkým rizikem krvácení zahrnují diagnostickou ezofagogastroduodenoskopii (EGD), sigmoideoskopii a koloskopii, diagnostickou endoskopickou retrográdní cholangiopankreatografii (ERCP), zavedení stentů do GIT, kartáčkovou cytologii, zavedení biliárního stentu bez papilosfinkterotomie (EPT), endosonografii (EUS) a enteroskopii, argonovou plazmatickou koagulaci (APC). Pro tyto výkony není třeba vysazovat antiagregační terapii [1,2,6,18,20,46]. Slizniční biopsie je spojena s velmi nízkým rizikem krvácení, které není zvýšeno u nemocných užívajících aspirin nebo clopidogrel, takže je není nutno vysazovat. Zatím není dost informací o riziku krvácení po endoskopické biopsii u nemocných užívajících prasugrel, předpokládá se podobné riziko jako u clopidogrelu [1,2,6,20,42]. U nemocných s kombinovanou antitrombotickou terapií je vhodnější provádět EGD transorální cestou než transnazální pro zvýšené riziko epistaxe.
B. Mezi výkony spojené se zvýšeným rizikem krvácení patří: polypektomie při koloskopii (1–2,5 %), polypektomie při gastroskopii (4 %), endoskopická mukózní resekce (EMR až 22 %), endoskopická submukózní disekce (ESD), laserová ablace a koagulace (do 6 %), EPT (2,5–5 %), ampulektomie (8 %), sklerotizace a ligace varixů jícnu a žaludku (6 %). V případě, že antikoagulační terapie je dočasná a endoskopický terapeutický výkon je spojen s vysokým rizikem, je doporučeno jej odložit po ukončení terapie. U naléhavých případů, kde není možno přerušit antikoagulační léčbu, je vhodné použít endoskopickou techniku k maximálnímu snížení rizika krvácení například endoloop, hemostatické klipy, zavedení pankreatobiliární drenáže bez papilosfinkterotomie, dilatace papily bez EPT aj. [1,2,6,18,20,31,46].
Krvácení po polypektomii je častější při použití čistého řezacího proudu ve srovnání se smíšeným nebo koagulačním proudem [6,9,39]. Rizikové faktory pro krvácení po PE zahrnují věk nad 65 let, antikoagulační terapii, kardiovaskulární onemocnění, polyp ≥ 1 cm. Aspirin nezvyšuje riziko krvácení po PE bez ohledu na velikost polypu, není jej nutno vysazovat. Relativně bezpečná se jeví i PE malého polypu (≤ 1cm) s následnou aplikací endoklipu (rutinně nebo v případech krvácení během výkonu) u nemocných užívajících clopidogrel, který není nutno vysazovat. Jinak je tomu v případě konkomitantní léčby clopidogrel a aspirin/NSAID, kde je nutno clopidogrel i prasugrel vysadit. V případě, že není možno pro riziko tromboembolické komplikace vysadit clopidogrel nebo prasugrel, je nutno riziko krvácení po PE snížit aplikací endoloopu u velkého stopkatého polypu nebo submukózní injekcí zředěného adrenalinu u přisedlého polypu. U velkého polypu v těchto případech by měl být zvážen odklad PE [2,6,14,23,29,39,41,46,49].
Endoskopická submukózní disekce (ESD) polypů má dvojnásobné riziko krvácení ve srovnání s endoskopickou mukózní resekcí (EMR). Obě techniky by měly být použity po vysazení všech antiagregačních léků včetně aspirinu u pacientů, kteří nemají vysoké riziko tromboembolické příhody [2,6,8,10,22,33,34,46]. Ampulární resekce má podobná rizika krvácení (5,6 %) jako EMR a doporučuje se stejný postup. Aspirin by měl být vysazen tři dny před výkonem a znovu nasazen po výkonu [6,27,46].
Endoskopická papilosfinkterotomie (EPT) není provázena větším rizikem krvácení (0,3–2 %) při užívání aspirinu, proto jej není nutno vysazovat na rozdíl od clopidogrelu a prasugrelu, kde chybí dostatečné údaje o riziku při jejich podávání. Při EPT je bezpečnější používat koagulační než čistý řezací proud. Pro nemocné užívající aspirin je pro extrakci objemných konkrementů vhodné použít po EPT mechanickou litotripsi anebo balonkovou dilataci. Alternativou EPT k snížení rizika krvácení je balonková dilatace s použitím balonku do 10 mm a u obturujícího biliárního konkrementu zavedení stentu bez EPT. Nevýhodou této metody je vysoké riziko postERCP pankreatitidy a rozvoj cholangitidy při dlouho zavedeném stentu. U mladých nemocných po dilataci papily je doporučeno zavést pankreatický stent jako prevenci pankreatitidy [2,6,15,20,24,25].
Endoskopická ultrasonografie s jehlovou aspirací (EUS-FNA) není zatížena podle literárních údajů větším rizikem krvácení u osob užívajících aspirin. Pouze je vhodné jej vysadit u EUS-kartáčové biopsie pankreatických cyst (1,5–5,5 % krvácení) u nemocných s nízkým rizikem tromboembolické příhody. Recentní prospektivní studie sledující krvácení po EUS-FNA prokázaly 1% riziko u neselektovaných nemocných. Nebyl nalezen signifikantní rozdíl v krvácení mezi nemocnými užívajícími aspirin/NSAID a kontrolními skupinami. Thienopyridiny je doporučeno před výkonem vysadit, není dostatek informací o jejich riziku [2,3,6,40,44,46].
Endoskopická dilatace stenóz GIT a zavedení stentu nevyžaduje vysazení aspirinu kromě dilatace achalázie velkým balonem. Podávat clopidogrel a prasugrel není podle ESGE doporučeno (málo dat). Podle amerických guidelines není považována inzerce stentu do GIT za metodu se zvýšeným rizikem a není třeba vysazovat žádná antiagregancia [2,6,20,32,46,47].
Perkutánní endoskopická gastrostomie (PEG) není podle recentních studií zvýšeně riziková pro pacienty užívající aspirin, pro ostatní antiagregancia chybí dost studií [2,6,12,20,37,38,46].
U enteroskopie (jedno - nebo dvoubalonková nebo spirální) není třeba vysazovat aspirin, thienopyridiny nejsou doporučeny [2,6,19,20,46].
Endoskopická ligace a sklerotizace varixů je zatížena stejným rizikem krvácení u pacientů užívajících aspirin i bez aspirinu. Riziko krvácení u ligace se pohybuje kolem 2,4–5,7 %, u sklerotizace 4–25 %. Thienopyridiny nejsou doporučeny [2,6,9,11,20,46].
Hemostatická terapie s použitím argonové plazmatické koagulace (APC) není zvýšeně riziková u nemocných užívajících aspirin nebo thienopyridiny. Pro nedostatek studií se nedoporučuje při APC kombinace aspirinu a thienopyridinů [2,6,30,46].
Rizika krvácení u antikoagulační terapie (tab. 3)
Tab. 3. Rizika krvácení u antikoagulační terapie. Tab. 3. Risk of bleeding with anticoagulation therapy. 
Se zvýšeným rizikem gastrointestinálního krvácení např. během terapie warfarinem je třeba počítat u nemocných s anamnestickým údajem o předchozím krvácení do GIT (30 vs 5 %, kteří neudávají krvácení v anamnéze), ale ne u výskytu peptického vředu samotného. Riziko gastrointestinálního krvácení je rovněž zvýšeno, když se INR pohybuje nad normální hodnotou a při současném podávání aspirinu. Gastrointestinální krvácení většinou vzniká z endoskopicky identifikovatelného krvácejícího místa nejběžněji duodenálního nebo žaludečního vředu [1,6,9,11,23,46].
Postup u těchto nemocných
- Nízkorizikové výkony: antikoagulační léčbu není nutné upravovat. Elektivním výkonům je třeba se vyhnout, jestliže je hodnota INR zvýšena nad 1,5 [1,2,6,20].
- Vysocerizikové výkony u nemocných s nízkým rizikem tromboembolie: terapie warfarinem by měla být přerušena na 3–5 dnů před plánovaným výkonem za účelem dosažení INR blízko normálním hodnotám. Po výkonu můžeme pokračovat v terapii warfarinem.
- Vysocerizikové výkony u nemocných s vysokým rizikem tromboembolie: terapie warfarinem by měla být přerušena na 3–5 dnů před výkonem k normalizaci hodnot INR. Je třeba individuálně posoudit vhodnost podání intravenózního nefrakcionovaného heparinu. Případné podávání heparinu by mělo být přerušeno 4–6 hod před plánovaným výkonem, heparin může být znovu podán 2–6 hod po jeho ukončení a následně je možné se k warfarinu vrátit večer po výkonu. Heparin a warfarin by se měly překrývat na dobu 4–5 dnů nebo do doby, kdy INR dosáhne plánovaných terapeutických hodnot (během 2–3 dnů). Vzhledem k riziku významného krvácení do tří dnů po EPT (10–15 %) v případě obnovení antikoagulační léčby by měl být tento postup individuálně zvažován a doporučen jen u situací, kde riziko tromboembolické příhody signifikantně přesahuje riziko krvácení [1,2,4,6,16,18,20,35].
Jak přerušit antikoagulační léčbu
Při rozhodnutí zrušit antikoagulaci, a riskovat tak tromboembolické následky, je třeba zvažovat:
- je-li nutné pokračovat v antikoagulační léčbě
- je-li nutné antikoagulační terapii přerušit nebo změnit
- je-li výkon naléhavý, nebo je možné jej odložit
Všeobecně je doporučeno provádět terapeutické endoskopické výkony u nemocných s hodnotami INR do 1,3–1,5. K rychlé korekci INR by měla být použita mražená plazma nebo plazmatické deriváty. Na rozdíl od mražené plazmy podání vitaminu K oddálí začátek endoskopického zákroku, protože nástup jeho účinku (tj. obnovení koagulační aktivity) trvá v průměru 4–6 hod, přičemž následná blokáda antikoagulačního účinku přetrvává delší dobu, a tím prodlužuje čas potřebný k obnovení terapeutické antikoagulace [4,35,36]. Po provedené endoskopické léčbě je možno opět zavést terapii warfarinem. Jestliže je nutné rychlé zavedení antikoagulace, měl by být podán heparin [1,2,4,6,18,20].
Role nízkomolekulárního heparinu (LMWH) v endoskopii
Nízkomolekulární hepariny inaktivují zejména faktor Xa a jen méně trombin (f.II). Ve srovnání s přirozeným (nefragmentovaným) heparinem tak prakticky neovlivňují celkovou koagulaci. Společnou vlastností je výrazně prodloužený antikoagulační účinek bez současného zvýšení rizika krvácení. Za normálních okolností neprodlužují testy hemostázy (aPTT, trombinový čas) [6,35,36]. Výhodou je možnost levnější ambulantní léčby bez nutnosti provádění příslušných laboratorních kontrol. Relevantní údaje o použití LMWH v souvislosti s endoskopickou terapií dosud chybí. LMWH může nahradit nefrakcionovaný heparin při přerušení warfarinizace. V případě potřeby může být antikoagulační terapie nefrakcionovaným heparinem znovu nasazena za 2–6 hod po terapeutickém výkonu [1,2,4,6,20,35,36].
Akutní krvácení a LMWH
Při akutním krvácení do GIT u nemocného na terapii LMWH je třeba zvážit přerušení léčby a rizika vzniku nežádoucí ischemické příhody nebo tromboembolické komplikace s rizikem kontinuálního krvácení při pokračující antikoagulační léčbě. Protože poločas LMWH je krátký, antikoagulační účinek za 8 hod po poslední dávce mizí. Jestliže je nutný rychlý zásah, je možno eliminovat účinek LMWH intravenózním podáním protamin sulfátu (s nebezpečím hypotenze a anafylaktické reakce) [1,2,6,9,11,20,46].
Elektivní endoskopické výkony a LMWH
Podle rizika endoskopických výkonů je třeba individuálně zvážit přerušení terapie LMWH vzhledem k riziku krvácení po výkonu a zhodnotit pravděpodobnost nežádoucích účinků vysazení antikoagulace. Před výkony s malým rizikem není úprava antikoagulace nutná. U výkonů s vysokým rizikem se doporučuje přerušit podávání LMWH nejméně 8 hod před plánovanou terapeutickou endoskopií a individuálně pak rozhodnout o znovunasazení antikoagulační terapie [2,6,20].
Elektivní endoskopické výkony u nemocných léčených warfarinem s potřebou překrývající léčby
LMWH může nahradit dřívější standardní „heparinové okno“ u vysocerizikových nemocných, což léčbu zjednodušuje (není třeba laboratorní monitorování a hospitalizace), a snižuje tím náklady. U výkonů s nízkým rizikem se antikoagulační léčba neupravuje. U vysocerizikových výkonů se s přerušením warfarinu 3–5 dnů před výkonem (k dosažení normalizace INR) doporučuje zahájit profylaktické podávání LMWH dva dny před výkonem a tuto léčbu přerušit nejméně 8 hod před terapeutickou endoskopií. O návratu k antikoagulační terapii se rozhoduje individuálně [6,21,31,46].
Elektivní endoskopie u nemocných s cévními stenty a akutním koronárním syndromem
Nemocní s vaskulárními stenty, cerebrovaskulárním onemocněním a akutním koronárním syndromem obvykle dlouhodobě užívají duální terapii (aspirin + thienopyridiny). Tato terapie je doporučena na dobu minimálně jednoho měsíce (Bare Stent) až 12 měsíců (DES). Použití duální terapie je třikrát více rizikové pro krvácení do trávicí trubice než léčba jedním lékem. Přerušení této terapie znamená až 50% riziko okluze stentu a vzniku akutního infarktu myokardu. Elektivní výkony v těchto případech je proto doporučeno (je-li to možné) odložit až na dobu po vysazení duální terapie nebo použít metalický holý stent, u kterého je kombinovaná terapie kratší (jeden měsíc) [6,17,20,26,28,46].
Závěr
Na základě prospektivních kontrolovaných studií, pozorování a názorů expertů lze shrnout určitá doporučení.
Antikoagulační léčbu lze přerušit v závislosti na nebezpečí krvácení, rizikovosti endoskopického výkonu a při zvážení rizika tromboembolické příhody.
Warfarin i heparin mohou způsobit krvácení do GIT a zvyšují riziko terapeutických endoskopických výkonů.
LMWH a neaspirinové antiagregační léky jsou spojeny se zvýšeným rizikem krvácení (kromě dipyridamolu). Měly by být přerušeny u akutního krvácení GIT. U nízkorizikových výkonů může terapie těmito preparáty pokračovat. U vysocerizikových výkonů by měl být LMWH vysazen nejméně 8 hod před výkonem.
U nemocných bez anamnézy krvácení do GIT je možno provést určité endoskopické výkony při podávání aspirinu a dalších NSAID ve standardních dávkách.
Clopidogrel a prasugrel by měly být vysazeny u většiny terapeutických endoskopických výkonů.
Pacient, který potřebuje kombinaci dvou antiagregačních léků pro vysoké riziko trombózy, by neměl nikdy vysazovat aspirin. U kardiologických nemocných se známým rizikem časné nekardiální operace (např. nádory) by měl být použit metalický Bare Stent, který vyžaduje duální antiagregační terapii jen jeden měsíc.
LMWH je možno použít jako přemosťující terapii před endoskopií u nemocných, u kterých nemůže být warfarin vysazen.
V případě jakýchkoli pochybností je nutná konzultace s hematologem, kardiologem a případně s anesteziologem [1,2,6,46].
Autorka deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 15. 4. 2012
Přijato: 24. 6. 2012
doc. MUDr. Zdena Zádorová, Ph.D.
II. interní klinika FNKV
Šrobárova 50, 100 00 Praha 10
zadorova@post.cz
Zdroje
1. Anderson MA, Ben-Menachem T, Gan SI et al. Management of antithrombotic agents for endoscopic procedures. Gastrointest Endosc 2009; 70(6): 1060–1070.
2. American Society for Gastrointestinal endoscopy. ASGE Standards of Practice Committee. (www.asge.org).
3. Al-Haddad M, Gill KR, Raimondo M et al. Safety and efficacy of cytology brushings versus standard fine-needle aspiration in evaluating cystic pancreatic lesions: a controlled study. Endoscopy 2010; 42(2): 127–132.
4. Ansell J, Hirsch J, Poller L et al. The pharmacology and management of the vitamin K antagonists: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest 2004; 126 (Suppl 3): 204S–233S.
5. Blacker DJ, Wijdicks EFM, McClelland RL. Stroke risk in anticoagulated patients with atrial fibrillation undergoing endoscopy. Neurology 2003; 61(7): 964–968.
6. Boustiere C, Veitch A, Vanbiervliet G et al. Endoscopy and antiplatelet agents. European Society of Gastrointestinal Endoscopy (ESGE) guideline. Endoscopy 2011; 43(5): 445–458.
7. Cannegieter SC, Rosendaal FR, Briet E. Thromboembolic and bleeding complications in patients with mechanical heart valve prosthesis. Circulation 1994; 89(2): 635–641.
8. Cao Y, Liao C, Tan A et al. Meta-analysis of endoscopic submucosal dissection versus endoscopic mucosal resection for tumors of the gastrointestinal tract. Endoscopy 2009; 41(9): 751–757.
9. Cappell MS, Abdullah M. Management of gastrointestinal bleeding induced by gastrointestinal endoscopy. Gastroenterol Clin North Am 2000; 29(1): 125–167.
10. Cho-S-J, Choi IJ, Kim CG et al. Aspirin use and bleeding riskafter endoscopic submucosal dissection in patients with gastric neoplasms. Endoscopy 2012; 44(2): 114–121.
11. Choudari CP, Rajgopal C, Palmer KR. Acute gastrointestinal haemorrhage in anticoagulated patiens: diagnosis and response to Endoscopic treatment. Gut 1994; 35(4): 464–466.
12. Coronel M, Banner K, Nannegari V et al. Does aspirin increase the risk of bleeding for percutaneous endoscopic gastrostomy procedure? Gastrointest Endosc 2006; 63: AB113.
13. Cotton PB, Lehman G, Vennes J et al. Endoscopic sphincterotomy complications and their management: an attempt at consensus. Gastrointest Endosc 1991; 37(3): 383–393.
14. Friedland S, Sedehi D, Soetikno R. Colonoscopic polypectomy in anticoagulated patients. World J Gastroenterol 2009; 15(16): 1973–1976.
15. Dumonceau J-M, Andriulli A, Deviere J et al. European Society of Gastrointestinal Endoscopy (ESGE) Guideline: prophylaxis of post-ERCP pancreatitis. Endoscopy 2010; 42(6): 503–515.
16. Garcia DA, Regan S, Henault LE et al. Risk of thromboembolism with short-term interruption of warfarin therapy. Arch Intern Med 2008; 168(1): 63–69.
17. Gershlick AH, Richardson G. Drug eluting stents. BMJ 2006; 333(7581): 1233–1234.
18. Gerson LB, Gage BF, Owens DK et al. Effect and outcomes of the ASGE guidelines on the periendoscopic management of patients who take anticoagulants. Am J Gastroenterol 2000; 95(7): 1717–1724.
19. Gerson LB, Tokar J, Chiorean M et al. Complications associated with double balloon enteroscopy at nine US centers. Clin Gastroenterol Hepatol 2009; 7(11): 1177–1182.
20. Guidelines of the French Society for Digestive Endoscopy (SFED). Management of Patients on Anticoagulants or Antiplatelet Agents before Digestive Endoscopy. Endoscopy 2006; 38 : 632–638.
21. Harrison RW, Ortel TL, Becker RC. To bridge or not to bridge: these are the questions. J Tromb Trombolysis; DOI 10.1007//s11239-012-0732-8.
22. Heresbach D, Kornhauser R, Seyrig JA et al. A national survey of endoscopic mucosal resection for superficial gastrointestinal neoplasia. Endoscopy 2010; 42(10): 806–813.
23. Hui AJ, Wong RM, Ching JY et al. Risk of colonoscopic polypectomy bleeding with anticoagulants and antiplatelet agents: analysis of 1657 cases. Gastrointest Endosc 2004; 59(1): 44–48.
24. Hui CK, Lai KC, Yuen MF et al. Does withholding aspirin for one week reduce the risk of post-sphincterotomy bleeding? Aliment Pharmacol Ther 2002; 16(5): 929–936.
25. Hussain N, Alsulaiman R, Burtin P et al. The safety of endoscopic sphincterotomy in patients receiving antiplatelet agents: a case-control study. Aliment Pharmacol Ther 2007; 25(5): 579–584.
26. Iakovou I, Schmidt T, Bonizzoni E et al. Incidence, predictors, and outcome of thrombosis after successful implantation of drug-eluting stents. JAMA 2005; 293(17): 2126–2130.
27. Irani S, Arai A, Ayub K et al. Papillectomy for ampullary neoplasm: results of a single referral center over a 10-year period. Gastrointest Endosc 2009; 70(5): 923–932.
28. King SB 3rd, Smith SC Jr, Hirshfeld JW Jr et al. 2007 focused update of the ACC//AHA/SCAI 2005 guideline update for percutaneous coronary intervention: a report of the American College of Cardiology/American Heart Association Task Force on Practice guidelines. J Am Coll Cardiol 2008; 51(2): 172–209.
29. Kouklakis G, Mpoumponaris A, Gatopoulou A et al. Endoscopic resection of large pedunculated colonic polyps and risk of postpolypectomy bleeding with adrenaline injection versus endoloop and hemoclip: a prospective, randomized study. Surg Endosc 2009; 23(12): 2732–2737.
30. Kwan V, Bourke MJ, Williams SJ et al. Argon plasma coagulation in the management of symptomatic gastrointestinal vascular lesions: experience in 100 consecutive patients with long-term follow-up. Am J Gastroenterol 2006; 101(1): 58–63.
31. Malik P, Yamashita B, Larson L et al. Comparison of various periprocedure anticoagulation approaches for elective colonoscopy: a cost modeling study. Gastrointest Endosc 1999; 49: AB197.
32. Metman EH, Lagasse JP, d’Alteroche L et al. Risk factors for immediate complications after progressive pneumatic dilation for achalasia. Am J Gastroenterol 1999; 94(5): 1179–1185.
33. Okada K, Yamamoto Y, Kasuga A et al. Risk factors for delayed bleeding after endoscopic submucosal dissection for gastric neoplasm. Surg Endosc 2011; 25(1): 98–107.
34. Ono S, Fujishiro M, Niimi K et al. Technical feasibility of endoscopic submucosal dissection for early gastric cancer in patients taking anti-coagulants or anti-platelet agents. Dig Liver Dis 2009; 41(10): 725–728.
35. Penka M, Gumulec J, Bulíková A et al. Monitorování perorální antikoagulační léčby v ambulantní praxi. Kardiol Rev 2007; 9(3): 159–164.
36. Remedia Compendium. Panax 1999. www.panax.cz.
37. Richter J, Patrie J, Richter R et al. Use of high-dose aspirin or clopidogrel before or after percutaneous endoscopic gastrostomy is not associated with post-procedural bleeding. Gastrointest Endosc 2010; 71: AB114.
38. Ruthmann O, Seitz A, Richter S et al. Percutaneous endoscopic gastrostomy. Complications with and without anticoagulation. Chirurg 2010; 81(3): 247–254.
39. Sawhney MS, Salfiti N, Nelson DB et al. Risk factors for severe delayed postpolypectomy bleeding. Endoscopy 2008; 40(2): 115–119.
40. Sendino O, Fernández-Esparrach G, Solé M et al. Endoscopic ultrasonography - guided brushing increases cellular diagnosis of pancreatic cysts: A prospective study. Dig Liver Dis 2010; 42(12): 877–881.
41. Singh M, Mehta N, Murthy UK et al. Postpolypectomy bleeding in patients undergoing colonoscopy on uninterrupted clopidogrel therapy. Gastrointest Endosc 2010; 71(6): 998–1005.
42. Shiftman ML, Farrel MT, Yee YS. Risk of bleeding after endoscopic biopsy or polypectomy in patiens taking aspirin or other NSAIDs. Gastrointest Endosc 1994; 40(4): 458–462.
43. Stein RD, Alpert IS, Copeland J et al. Antithrombotic therapy in patients with mechanical and biological prosthetic heart valves. Chest 1992; 102 (4 Suppl): 445s–455s.
44. Thomas T, Bebb J, Mannath J et al. EUS-guided pancreatic cyst brushing: a comparative study in a tertiary referral centre. JOP 2010; 11(2): 163–169.
45. Tsuji Y, Ohata K, Ito T et al. Risk factors for bleeding after endoscopic submucosal dissection for gastric lesions. World J Gastroenterol 2010; 16(23): 2913–2917.
46. Veitch AM, Baglin TP, Gershlick AH et al. Guidelines for the management of anticoagulant and antiplatelet therapy in patients undergoing endoscopic procedures. Gut 2008; 57(9): 1322–1329.
47. Wang MQ, Sze DY, Wang ZP et al. Delayed complications after esophageal stent placement for treatment of malignant esophageal obstructions and esophagorespiratory fistulas. J Vasc Interv Radiol 2001; 12(4): 465–474.
48. Williams DO, Abbott JD, Kip KE. DEScover Investigators. Outcomes of 6906 patients undergoing percutaneous coronary intervention in the era of drug-eluting stents: report of the DEScover Registry. Circulation 2006; 114(20): 2154–2162.
49. Yousfi M, Gostout CJ, Baron TH et al. Postpolypectomy lower gastrointestinal bleeding: potential role of aspirin. Am J Gastroenterol 2004; 99(9): 1785–1789.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2012 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Gastrointestinální onkologie – realita blízké budoucnosti?
- Epidemiologie zhoubných nádorů trávicího traktu v České republice – současný stav a predikce
- Zamyšlení nad finančními aspekty péče o nemocné s kolorektálním karcinomem
- Národní program screeningu kolorektálního karcinomu v České republice – minulost, přítomnost a budoucnost
- Karcinom pankreatu
- Endoskopická ablatívna liečba rektosigmoideálnych prekanceróz – pilotná štúdia
- Karcinom jícnu a rizikové faktory podle histologických typů
- Diagnostika a liečba celiakie: dnes a zajtra
- Nealkoholická steatohepatitida (NASH) – týká se nás všech
- Nález v podkoží v periumbilikální krajině by neměl být přehlédnut
- Endoskopie u nemocných s antikoagulační a antiagregační terapií
- Doporučené postupy pro podávání aminosalicylátů u nemocných s idiopatickými střevními záněty
- Diskuzní fórum
- Komentář ke třídění funkčních dyspepsií podle kritérií „ROME I, II, III“
- Diagnóza nízkého stupně dysplazie u pacientů s Barrettovým jícen – pravděpodobně „overdiagnosed“
- Komentář k domácím publikacím o neoplaziích v Barrettově jícnu
- Odpověď na komentář prof. Špičáka
- Jak zlepšit screening kolorektálního karcinomu?
- Správná odpověď na kvíz
- XXI. jarní setkání Loket – pokroky v léčbě nemocných s karcinomem pankreatu
- Prague Hepatology Meeting 2012
- Prof. MUDr. Aleš Hep, CSc., šedesátiletý
- Budenofalk 2 mg rektální pěna představuje významné rozšíření našich terapeutických možností u nemocných s ulcerózní kolitidou
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Budenofalk 2 mg rektální pěna představuje významné rozšíření našich terapeutických možností u nemocných s ulcerózní kolitidou
- Epidemiologie zhoubných nádorů trávicího traktu v České republice – současný stav a predikce
- Karcinom pankreatu
- Prof. MUDr. Aleš Hep, CSc., šedesátiletý
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



