-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Doporučený postup diagnostiky a léčby chronické hepatitidy B
Recommended procedure for diagnosis and treatment of chronic hepatitis B
The new recommendations reflect the growth in knowledge that has been reported since the release of the previous Czech guidelines in April 2009. According to qualified estimates, there are 350–400 million people with chronic hepatitis B (HBV) infection worldwide. The Czech Republic is one of the countries with a low prevalence of HBV infection. According to latest seroprevalence study, 0.56% of Czech citizens were chronically infected with HBV in 2001. HBV infection can lead to serious life-threatening liver damage (fulminant hepatitis), liver cirrhosis and hepatocellular carcinoma (HCC). The goal of the treatment is to prolong the length of life and improve quality of life by preventing the progression of chronic hepatitis to cirrhosis, cirrhosis decompensation and development of HCC. This goal can be achieved if HBV replication can be suppressed in a sustained manner. The subsequent reduction in histological activity reduces the risk of cirrhosis and HCC, particularly in non-cirrhotic patients. Currently, there are two different strategies of chronic hepatitis B therapy available – time-limited or long-term treatment. The time-limited therapy can be done using pegylated interferon (PEG-IFN), entecavir (ETV), or tenofovir (TDV). A 48-week course of PEG-IFN is mainly recommended for HBeAg-positive patients with the best chance of anti-HBe seroconversion. Limited ETV or TDV treatment is achievable for HBeAg-positive patients who seroconvert to anti-HBe upon treatment. However, the treatment duration cannot be predicted prior to the therapy as it depends on the timing of anti-HBe seroconversion and the treatment continuation post anti-HBe seroconversion (therapy should be continued for another 12 months after anti-HBe seroconversion). Long-term ETV or TDV therapy is necessary for HBeAg-positive patients who do not develop anti-HBe seroconversion and for HBeAg-negative patients. This strategy is also recommended for patients with cirrhosis, irrespective of the initial HBeAg status or anti-HBe seroconversion on treatment. The advantages of ETV and TDV are their high potency and optimal resistance profile.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
30. 9. 2014Accepted:
20. 10. 2014
Autori: P. Husa 1; J. Šperl 2
; P. Urbánek 3; S. Plíšek 4; P. Kümpel 5; L. Rožnovský 6
Pôsobisko autorov: Společnost infekčního lékařství ČLS JEP ; Česká hepatologická společnost ČLS JEP ; Slezská nemocnice Opava6 Klinika infekčního lékařství LF OU a FN Ostrava
Vyšlo v časopise: Gastroent Hepatol 2014; 68(6): 514-526
Kategória: Hepatologie: doporučené postupy
doi: https://doi.org/10.14735/amgh2014514Společnost infekčního lékařství ČLS JEP Česká hepatologická společnost ČLS JEP
Súhrn
Nová doporučení odrážejí nárůst poznatků, které byly publikovány od vydání předchozího českého doporučeného postupu v dubnu 2009. Podle kvalifikovaných odhadů je celosvětově chronicky infikováno virem hepatitidy B (HBV) 350–400 milionů lidí. Česká republika patří mezi státy s nízkou prevalencí infekce HBV. Podle posledních sérologických přehledů z roku 2001 bylo 0,56 % našich občanů chronicky infikováno HBV. Infekce HBV může vyvolat závažná, život ohrožující poškození jater – fulminantní hepatitidu, jaterní cirhózu a hepatocelulární karcinom (HCC). Cílem léčby je prodloužit délku života a zlepšit jeho kvalitu zabráněním progrese chronické hepatitidy do jaterní cirhózy, dekompenzace cirhózy a vzniku HCC. Předpokladem pro dosažení tohoto cíle je trvalá suprese virové replikace spojená s redukcí histologické aktivity, což snižuje riziko vzniku cirhózy a HCC, a to zejména u pacientů bez jaterní cirhózy. V současnosti jsou možné dvě strategie léčby chronické hepatitidy B – časově omezená a časově neomezená (dlouhodobá) léčba. Pro časově omezenou léčbu lze obecně použít pegylovaný interferon alfa (PEG-IFN), entecavir (ETV) nebo tenofovir (TDV). Léčba PEG-IFN v délce 48 týdnů je hlavně doporučena pro HBeAg pozitivní pacienty s nejlepšími předpoklady dosažení sérokonverze HBeAg/anti-HBe. Časově omezená léčba ETV nebo TDV je možná, pokud během léčby dojde k sérokonverzi HBeAg/anti-HBe. Potřebnou dobu léčby nelze před léčbou stanovit, závisí to na tom, zda a kdy se podaří v průběhu léčby dosáhnout sérokonverze HBeAg/anti-HBe (je nutné pokračovat v antivirové léčbě ještě 12 měsíců po této sérokonverzi). Pokud nedojde během léčby ETV či TDV k sérokonverzi HBeAg/anti-HBe nebo u HBeAg negativních pacientů, je nutná dlouhodobá (časově neomezená) léčba. Tato strategie je doporučována cirhotikům bez ohledu na iniciální stav HBeAg nebo dosažení HBeAg/anti-HBe sérokonverze během léčby. Výhodami ETV a TDV jsou jejich vysoká účinnost a optimální rezistenční profil.
Preambule
Níže uvedená doporučení pro diagnostiku a terapii infekce virem hepatitidy B (HBV) byla vytvořena členy pracovních skupin pro virové hepatitidy České hepatologické společnosti (ČHS) České lékařské společnosti Jana Evangelisty Purkyně (ČLS JEP) a Společnosti infekčního lékařství (SIL) ČLS JEP. Nová doporučení odrážejí nárůst poznatků, které byly publikovány od vydání předchozího doporučeného postupu ČHS a SIL v dubnu 2009 [1,2]. Základem pro napsání tohoto doporučeného postupu byla doporučení Evropské asociace pro studium jater (EASL) z roku 2012 [3]. Maximální možné dodržování odborných doporučení je podmínkou dosažení efektivní péče o nemocné s virovou hepatitidou B v celostátním měřítku. Předkládaný dokument je oporou při jednání obou odborných společností se státními orgány a s plátci zdravotní péče.
V textu je na řadě míst uvedena kvalita důkazů a síla doporučení, která vychází ze systému GRADE. Kvalita důkazů je hodnocena od A (vysoká) přes B (střední) až po C (nízká). Síly doporučení potom 1 (silné doporučení) nebo 2 (slabší doporučení) [3].
1. Proč léčit chronickou infekci virem hepatitidy B?
Podle kvalifikovaných odhadů je celosvětově chronicky infikováno HBV 350–400 milionů lidí. Česká republika patří mezi státy s nízkou prevalencí infekce HBV. Podle posledních sérologických přehledů z roku 2001 bylo 0,56 % našich občanů chronicky infikováno HBV. Novější výsledky sérologických studií nejsou k dispozici. Ročně je hlášeno 150–250 případů akutních virových hepatitid B. Do chronického stadia přejde méně než 5 % akutních hepatitid B u dospělých imunokompetentních pacientů. Imunokompromitovaní nemocní (pacienti v chronickém hemodialyzačním programu, pacienti podstupující protinádorovou či imunosupresivní léčbu, koinfikovaní virem lidského imunodeficitu – HIV) mají sníženou schopnost rozeznat a/nebo eliminovat infekci HBV, a proto u nich přechází infekce HBV do chronicity ve více než 50 %. Pravděpodobnost chronicity u novorozenců infikovaných HBV vertikálně od matky je vyšší než 90 %, při infikování dětí mladších pět let je pravděpodobnost vzniku chronické infekce HBV 25–50 %. Infekce novorozenců a malých dětí jsou v současné době v České republice naprosto výjimečné díky screeningu všech těhotných žen na přítomnost HBsAg a následné pasivní a aktivní imunizaci novorozenců HBsAg pozitivních matek. Navíc od roku 2001 je v naší republice prováděna plošná vakcinace dětí proti HBV – nyní od 9. týdne věku a u 12letých dětí, pokud nebyly očkovány již v kojeneckém věku proti HBV.
Infekce HBV může vyvolat závažná, život ohrožující poškození jater – fulminantní hepatitidu, jaterní cirhózu a prokázaný je i příčinný vztah mezi HBV infekcí a hepatocelulárním karcinomem (HCC) – primárním karcinomem jater. Akutní jaterní selhání, jaterní cirhóza nebo HCC vyvolané infekcí HBV patří mezi obecně uznávané indikace pro provedení transplantace jater. V celosvětovém měřítku ročně umírá 0,5–1 milion osob na dekompenzovanou jaterní cirhózu a/nebo HCC a tato konečná stadia infekce HBV reprezentují indikaci pro 5–10 % transplantací jater. Morbidita a mortalita spojená s chronickou infekcí HBV závisí na výši virové replikace a vývoji jaterní cirhózy nebo HCC. Podle výsledků longitudinálních studií kolísá v době stanovení diagnózy chronické hepatitidy B pětiletá pravděpodobnost vzniku jaterní cirhózy mezi 8 a 20 %. Pět let přežije 80–86 % původně kompenzovaných cirhotiků, ale zhruba u 20 % z nich dojde v tomto období k dekompenzaci cirhózy. Naproti tomu prognóza nemocných s dekompenzovanou jaterní cirhózou je špatná – pravděpodobnost pětiletého přežívání bez transplantace jater je pouze 14–35 %. Celosvětově narůstá incidence HCC. V současnosti se jedná o pátý nejčastější karcinom, který představuje kolem 5 % všech karcinomů. Roční incidence vzniku HCC je u pacientů s cirhózou vzniklou na podkladě chronické infekce HBV mezi 2 a 5 %.
V současnosti dostupné terapeutické možnosti mají jak krátkodobý, tak dlouhodobý přínos. Léčba jednoznačně zvyšuje kvalitu života a je „cost effective“, tj. při splnění indikačních kritérií a při použití standardních postupů je terapie levnější, než léčba komplikací pokročilé jaterní cirhózy.
2. Přirozený průběh a klinický obraz HBV infekce
Infekce HBV je spojena s velmi heterogenním spektrem jaterních onemocnění:
I. Akutní hepatitida B – převážně benigní onemocnění končící ve většině případů spontánním uzdravením, v 0,1–1 % případů probíhá onemocnění fulminantně s vysokou mortalitou.
II. Chronická hepatitida B – infekce trvající déle než šest měsíců. Jde o nesourodou skupinu nemocných, kterou lze rozdělit z hlediska přirozeného vývoje chronické HBV infekce na následující podskupiny:
- Fáze imunotolerance HBV. Přechodná fáze imunotolerance, trvající i roky, bývá v počáteční fázi vývoje chronické hepatitidy B. Toto období, trvající zpravidla 15–25 let, je typické pro nemocné, infikované vertikálně od matky. Pacienti ve fázi imunotolerance jsou charakterizováni pozitivitou HBeAg, vysokou úrovní replikace HBV, jejímž odrazem je vysoká hladina HBV DNA v séru, normální nebo nízkou aktivitou ALT, mírnou nebo žádnou zánětlivě-nekrotickou aktivitou a žádnou nebo pomalou progresí jaterní fibrózy. Během této fáze je pravděpodobnost vzniku HBeAg/anti-HBe sérokonverze velmi nízká. Mechanizmus poškození jater virem hepatitidy B je imunitně zprostředkovaný, replikace HBV sama nevede k destrukci hepatocytu. Vzhledem k vysoké viremii jsou pacienti během této fáze vysoce kontaginózní.
- Chronická hepatitida B ve fázi replikační (imunoreaktivní), HBeAg pozitivní forma. Jedná se o infekci tzv. „wild“ typem HBV, tj. nemutovaným virem. Jde o HBsAg i HBeAg pozitivní pacienty s vysokou viremií (HBV DNA v séru > 20 000 IU/ml, což odpovídá přibližně 105 kopiím/ml dle staršího způsobu vyjadřování viremie), aktivita ALT je obvykle zvýšena, často fluktující, může však být i normální. V jaterní biopsii jsou prokazatelné středně nebo vysoce závažné zánětlivě-nekrotické změny a rychlejší progrese fibrózy. Tato fáze může vzniknout po několika letech trvání imunotolerance, je častější u osob infikovaných v dospělosti a může trvat od několika týdnů do několika let. Pravděpodobnost vzniku spontánní sérokonverze HBeAg/anti-HBe je ve srovnání s předchozí fází zvýšena.
- Chronická hepatitida B, HBeAg negativní forma. Tato fáze může následovat po HBeAg/anti-HBe sérokonverzi, ke které došlo během imunoreaktivní fáze chronické hepatitidy B, a představuje pozdní stadium přirozeného vývoje chronické hepatitidy B. Jedná se o HBsAg pozitivní, ale i HBeAg negativní pacienty, s relativně vysokou viremií (HBV DNA v séru je většinou mezi 2 000 a 20 000 IU/ml, což odpovídá 104–105 kopií/ml), menší část nemocných má HBV DNA v séru >> 20 000 IU/ml (105 kopií/ml). Negativita HBeAg je podmíněna mutací v tzv. pre-core nebo v basal core promotor (BCP) oblasti genomu viru. Aktivita ALT je obvykle alespoň intermitentně zvýšena, může však být i trvale normální. Typické je kolísání hladiny HBV DNA a aktivity ALT. V jaterní biopsii jsou často prokazatelné středně nebo vysoce závažné zánětlivě-nekrotické změny. Pacienti jsou ve vysokém riziku progrese jaterního procesu do pokročilé fibrózy, jaterní cirhózy a HCC. K odlišení této závažné fáze chronické hepatitidy B od mnohem příznivějšího inaktivního nosičství HBsAg je nutné minimálně po dobu jednoho roku kontrolovat aktivitu ALT a hladinu HBV DNA v séru, a to v tříměsíčních intervalech.
- Chronická hepatitida B ve fázi nízké replikace, tzv. inaktivní nosiči HBV. HBsAg pozitivní a HBeAg negativní pacienti s velmi nízkou (< 2 000 IU/ml, tj. 104 kopií/ml) nebo nedetekovatelnou hladinou HBV DNA v séru a s normální aktivitou ALT. Někteří inaktivní nosiči HBV mohou mít HBV DNA v séru > 2 000 IU/ml (zpravidla < 20 000 IU/ml) ve spojení s trvale normální aktivitou ALT. V jaterní biopsii nelze prokázat významné zánětlivé změny. Tento stav svědčí pro imunologickou kontrolu HBV infekce a má dobrou prognózu s velmi nízkým rizikem vzniku jaterní cirhózy nebo HCC u většiny pacientů. K sérokonverzi HBsAg/anti-HBs dochází spontánně u 1–3 % případů ročně, obvykle po několika letech trvale nedetekovatelné HBV DNA v séru. Na druhé straně může dojít i k progresi do chronické hepatitidy B, převážně HBeAg negativní formy.
- HBsAg negativní fáze infekce HBV. Po ztrátě HBsAg může replikace HBV na nízké úrovni přetrvávat. HBsAg je negativní, celkové anti-HBc protilátky jsou pozitivní, anti-HBs protilátky mohou být detekovatelné, ale nemusí. Perzistence HBV v organizmu i po dosažení HBsAg negativity je trvalá, u některých HBsAg negativních jedinců s izolovanou pozitivitou anti-HBc lze prokázat nízkou úroveň virémie (HBV DNA < 200 IU/ml, tedy 102 kopií/ml), u jiných nelze HBV DNA v séru prokázat ani nejcitlivější polymerázovou řetězovou reakcí (PCR) v reálném čase. I u nich však lze většinou prokázat nízkou koncentraci HBV DNA v jaterní tkáni. Klinický význam této „okultní“ infekce HBV je nejasný, ale imunosuprese může vést k reaktivaci infekce HBV. Ztráta HBsAg je spojena se snížením rizika vzniku jaterní cirhózy, její dekompenzace a vývoje HCC. Pokud dojde ke vzniku cirhózy ještě před ztrátou HBsAg, zůstává pacient v riziku HCC a je nutná celoživotní surveillance HCC.
3. Diagnostika infekce HBV
Přehled sérologických a molekulárně genetických nálezů u infekce HBV a jejich význam je uveden v tab. 1. Uvedené nálezy představují nejčastější a nejjednodušší možné varianty. V případech různých mutací virového genomu se mohou sérologické nálezy významně lišit. Při nejasnostech je proto vhodné konzultovat specializované pracoviště.
Tab. 1. Typické sérologické a molekulárně genetické nálezy jednotlivých stadií přirozeného vývoje infekce HBV. Tab. 1. A typical serological and molecular-genetic findings at each stage of the natural development of HBV infection. 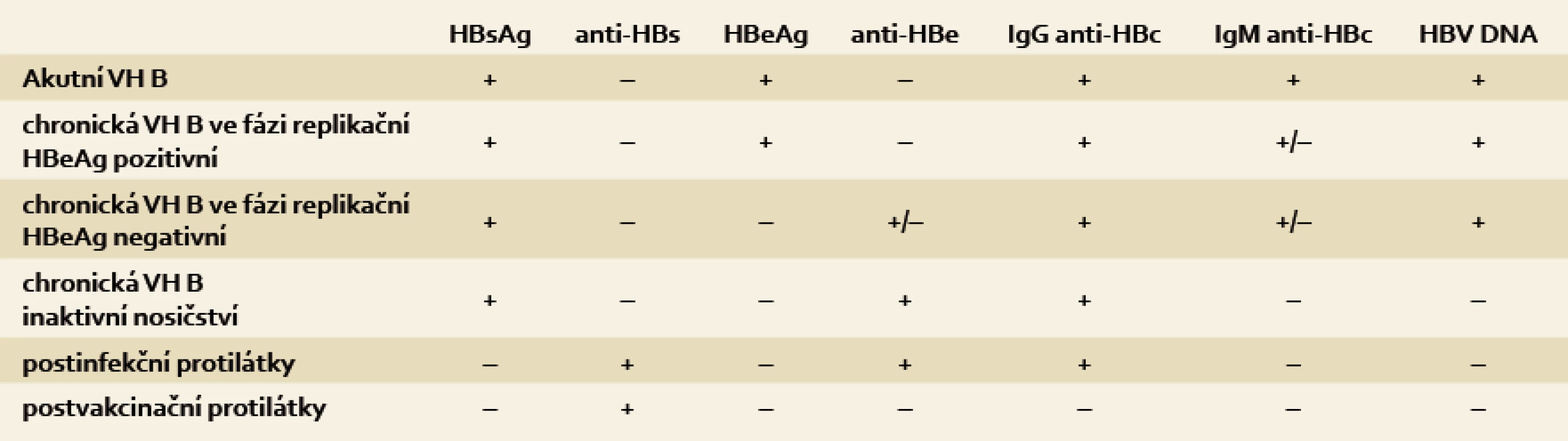
VH B – virová hepatitida B K průkazu HBV DNA v séru se používá vysoce senzitivní PCR v reálném čase. Výsledky získané touto metodou jsou udávány v mezinárodních jednotkách na mililitr (IU/ml). Dolní detekční limit této metody je 10–15 IU/ml. Hladinu HBV DNA vyjádřenou v IU/ml lze orientačně přepočítat na kopie na mililitr pomocí vzorce: HBV DNA (IU/ml) × 5 = HBV DNA (kopie/ml). Jako klinicky významná úroveň replikace HBV se uvádí hladina > 20 000 IU/ml (105 kopií/ml) u HBeAg pozitivní chronické hepatitidy B. U HBeAg negativní chronické hepatitidy B se jako významná bere většinou hladina HBV DNA v séru > 2 000 IU/ml (104 kopií/ml), s přihlédnutím k aktivitě ALT, histologickému nálezu, věku a přítomnosti rizikových faktorů HCC.
Indikace kvantitativního stanovení HBV DNA v séru metodou PCR v reálném čase jsou uvedeny v kapitole 14.
4. Cíle léčby chronické infekce virem hepatitidy B
Cílem léčby je prodloužit délku života a zlepšit jeho kvalitu zabráněním progrese chronické hepatitidy do jaterní cirhózy, dekompenzace cirhózy a vzniku HCC. Předpokladem pro dosažení tohoto cíle je trvalá suprese virové replikace spojená s redukcí histologické aktivity, což snižuje riziko vzniku cirhózy a HCC u pacientů bez jaterní cirhózy a pravděpodobně i u cirhotiků, i když na nižší úrovni (B1). Infekce HBV nemůže být trvale eradikována vzhledem k perzistenci kovalentně vázané cirkulární deoxyribonukleové kyseliny (cccDNA) viru v jádrech infikovaných hepatocytů. Perzistence cccDNA je vysvětlením rekurence HBV u imunosuprimovaných pacientů. Navíc genom HBV integruje do hostitelského genomu a může vést ke vzniku HCC.
5. Klíčové body úspěšné léčby chronické infekce HBV
Léčba musí redukovat hladinu HBV DNA v séru na co nejnižší úroveň, ideálně pod dolní limit citlivosti PCR v reálném čase (10–15 IU/ml). Tato virologická suprese vede k biochemické remisi (normalizaci aktivity ALT), zlepšení histologického nálezu a prevenci vzniku komplikací. Tohoto cíle je v současnosti dostupnou léčbou dosaženo jen výjimečně. Realističtějšími cílovými body léčby jsou virologická remise setrvalá nebo udržovaná během antivirové léčby.
- Ideální výsledek léčby představuje u pacientů HBeAg pozitivních i negativních setrvalé vymizení HBsAg se sérokonverzí do anti-HBs, nebo bez ní. Tím dochází ke kompletní a definitivní remisi chronické hepatitidy B a zlepšení dlouhodobé prognózy (A1).
- U HBeAg pozitivních pacientů se za uspokojivý výsledek léčby považuje dosažení trvalé sérokonverze HBeAg/anti-HBe, což je spojeno s trvalou virologickou a biochemickou remisí trvající i po skončení antivirové léčby a zlepšením prognózy onemocnění (A1).
- Pokud se léčbou nepodaří dosáhnout sérokonverze HBeAg/anti-HBe, považuje se během léčby nukleosidovými či nukleotidovými analogy za úspěch pokles hladiny HBV DNA v séru pod hranici detekovatelnosti metodou PCR v reálném čase (virologická remise během léčby). Dosažení tohoto stavu je známkou úspěšné léčby i u pacientů s HBeAg negativní chronickou hepatitidou B (A1).
6. Definice odpovědi na antivirovou léčbu
6.1. Léčba pegylovaným či konvenčním interferonem (IFN) alfa
- Primární rezistence (non-response) nebyla dosud jasně prokázána.
- Virologická odpověď je definována jako HBV DNA v séru < 2 000 IU/ml. Obvykle se hodnotí po šesti měsících léčby, v době ukončení léčby a šest a 12 měsíců po skončení léčby.
- Setrvalá virologická odpověď po skončení léčby je definována jako HBV DNA v séru < 2 000 IU/ml nejméně 12 měsíců po skončení léčby.
6.2. Léčba nukleosidovými či nukleotidovými analogy (NA)
- Primární rezistence (non-response) – je definována jako pokles HBV DNA v séru o méně než 1 dekadický logaritmus během prvních 3 měsíců léčby.
- Parciální virologická odpověď – jedná se o pokles HBV DNA v séru o více než 1 dekadický logaritmus, ale ne pod hranici detekovatelnosti (metodou PCR v reálném čase), po nejméně 6 měsících léčby NA u pacientů s dobrou adherencí k léčbě.
- Virologická odpověď – HBV DNA je pod hranicí detekovatelnosti metodou PCR v reálném čase.
- Virologický break-through – potvrzený vzestup HBV DNA nejméně o 1 dekadický logaritmus od nejnižší dosažené hodnoty (nadir) během léčby NA.
- HBV rezistence na NA – selekce variant HBV, u kterých substituce aminokyselin vede ke snížené citlivosti na podávaný NA. Vznik těchto variant je příčinou primární rezistence nebo virologického breakthrough.
- Histologická odpověď – je definovaná jako pokles nekroinflamatorní aktivity oproti výchozí hodnotě nejméně o 2 body při použití HAI (histology aktivity indexu) nebo Ishakova skórovacího systému, bez zhoršení fibrózy.
- Kompletní odpověď – dosažení setrvalé virologické odpovědi a současně i ztráta HBsAg.
7. Obecné indikace k léčbě chronické hepatitidy B
Pro HBeAg pozitivní i HBeAg negativní formu chronické hepatitidy jsou obecně platné stejné indikace. O léčbě by mělo být uvažováno, pokud je hladina HBV DNA v séru > 2 000 IU/ml, ALT > horní hranice normy (upper limit of normal – ULN) a výsledek jaterní biopsie (nebo neinvazivního vyšetření) ukazuje na střední až těžký zánětlivě-nekrotický proces a/nebo přinejmenším střední fibrózu při použití standardního skórovacího systému (např. aktivita ≥ A2 nebo fibróza ≥ F2 dle systému METAVIR) (A1). V případě splnění výše uvedených virologických a histologických kritérií má být léčba zahájena i při normální aktivitě ALT (A1). Při rozhodování o léčbě je nutné vzít také do úvahy věk, zdravotní stav, rodinný výskyt jaterní cirhózy, HCC a extrahepatálních komplikací.
8. Indikace k léčbě chronické hepatitidy B u zvláštních skupin pacientů
8.1. Pacienti v imunotolerantní fázi infekce HBV
Většina pacientů v imunotolerantní fázi infekce HBV je pod 30 let věku, mají trvale normální ALT, vysokou hladinu HBV DNA v séru (obvykle > 107 IU/ml), jsou bez projevů jaterního onemocnění, bez rodinné anamnézy jaterní cirhózy či HCC. U těchto pacientů není nutné okamžitě provést jaterní biopsii ani je začít léčit. Jejich pravidelné a dlouhodobé sledování (v intervalu 3–6 měsíců) je však nezbytné (B1). Pokud jde o osoby starší 30 let a/nebo s jaterní cirhózou či HCC v rodinné anamnéze, je na místě zvážit provedení jaterní biopsie a zahájení léčby.
8.2. Pacienti HBeAg negativní s trvale normální aktivitou ALT a nízkou viremií
Jedná se o pacienty, u kterých je trvale normální aktivita ALT stanovená v intervalu tří měsíců po dobu nejméně jednoho roku a HBV DNA v séru mezi 2 000 a 20 000 IU/ml, bez známek jaterního onemocnění. V tomto případě není nutné okamžité provedení jaterní biopsie ani léčba (B1). Na místě je monitorování aktivity ALT (každé tři měsíce) a HBV DNA (každých 6–12 měsíců) po dobu nejméně tří let (C1). Pokud iniciální biochemický a virologický nález přetrvává nejméně tři roky, je možné takového pacienta označit jako inaktivního nosiče HBV. Vhodné je u těchto pacientů posouzení závažnosti fibrózy pomocí neinvazivních metod vhodné (C2).
8.3. Pacienti se zjevně aktivní chronickou hepatitidou B
U HBeAg pozitivních i negativních pacientů s aktivitou ALT > 2× ULN a hladinou HBV DNA v séru > 20 000 IU/ml je léčba indikována i bez předchozího provedení jaterní biopsie (B1). Histologické vyšetření může sice přinést nové důležité informace, ale nijak neovlivní rozhodnutí léčit. Neinvazivní vyšetřovací metody pomohou posoudit pokročilost jaterní fibrózy a zejména přítomnost či absenci cirhózy, proto je jejich provedení velmi vhodné, zejména u pacientů léčených bez předchozí jaterní biopsie (B1).
8.4. Pacienti s kompenzovanou jaterní cirhózou
Pokud je u nich detekovatelná jakákoli hladina HBV DNA v séru metodou PCR v reálném čase, mají být léčení, i když je ALT normální (B1).
8.5. Pacienti s dekompenzovanou jaterní cirhózou
Nemocní s dekompenzovanou jaterní cirhózou a detekovatelnou HBV DNA v séru vyžadují urgentní zahájení antivirové léčby, protože útlum virové replikace u nich může vést ke klinickému zlepšení. U velmi pokročilé jaterní cirhózy nemusí být léčba úspěšná a je nutná transplantace jater (A1).
9. Léky pro léčbu chronické infekce HBV
Pro léčbu chronické infekce HBV lze obecně použít následující léky:
- pegylovaný interferon alfa-2a (PEG--IFN),
- interferon alfa (IFN), tzv. konvenční,
- lamivudin (LAM),
- adefovir dipivoxil (ADV),
- entecavir (ETV),
- tenofovir (TDV),
- telbivudin (TBV).
Pegylovaný IFN alfa-2a se podává v dávce 180 μg jednou týdně podkožně. Doba léčby je 48 týdnů u pacientů HBeAg pozitivních i negativních. Je nejúčinnějším lékem ve smyslu dosahování sérokonverzí HBeAg/anti-HBe, HBsAg/anti-HBs či setrvalých virologických odpovědí (u HBeAg negativní formy).
Doporučená dávka konvenčního IFN alfa je 5–10 milionů mezinárodních jednotek (IU) třikrát týdně subkutánně po dobu 4–6 měsíců nebo denně po dobu 4 měsíců u HBeAg pozitivních nemocných. U HBeAg negativní formy infekce je doporučována delší doba léčby, zpravidla 12 měsíců.
Dobu léčby analogy nukleosidovými (LAM, ETV, TBV) ani nukleotidovými (ADV, TDV) nelze předem stanovit a řídí se pravidly uvedenými v kapitole 12.
Tenofovir
Tenofovir v monoterapii (245 mg jednou denně) je určen:
- k dlouhodobé léčbě i časově omezené léčbě chronické hepatitidy B u dosud neléčených pacientů,
- k pokračující léčbě úspěšně léčených pacientů s chronickou hepatitidou B,
- k léčbě pacientů s rezistencí na LAM, ETV a/nebo ADV,
- k léčbě akutní hepatitidy B s těžkým nebo protrahovaným průběhem,
- k dlouhodobé profylaxi reaktivace HBV při imunosupresi u HBsAg pozitivních pacientů.
Tenofovir a lamivudin
Tenofovir (245 mg jednou denně) v kombinaci s lamivudinem (100 mg jednou denně) je určen:
- k léčbě pacientů, kteří nedosáhnou virologické odpovědi monoterapií tenofovirem (opakovaně měřitelná viremie více než tři měsíce po zahájení léčby).
Entecavir 0,5 mg
Entecavir 0,5 mg v monoterapii je určen:
- pro pokračující léčbu úspěšně léčených pacientů s chronickou hepatitidou B (bez mutanty rezistentní na lamivudin),
- k dlouhodobé léčbě i časově omezené léčbě chronické hepatitidy B u dosud neléčených pacientů,
- k dlouhodobé profylaxi reaktivace HBV při imunosupresi u HBsAg pozitivních pacientů.
Entecavir 1,0 mg
Entecavir 1,0 mg v monoterapii je určen:
- k dlouhodobé léčbě chronické hepatitidy B u pacientů s rezistencí na lamivudin s intolerancí nebo kontraindikací tenofoviru,
- k léčbě akutní hepatitidy B s těžkým nebo protrahovaným průběhem,
- k dlouhodobé léčbě i časově omezené léčbě chronické hepatitidy B u dosud neléčených pacientů, kteří zahajují léčbu až při dekompenzaci jaterní cirhózy.
Lamivudin
Lamivudin (100 mg jednou denně) je určen:
- v kombinaci s tenofovirem k léčbě pacientů s chronickou hepatitidou B, kteří nedosáhnou virologické odpovědi na monoterapii tenofovirem (opakovaně měřitelná viremie více než 3 měsíce po zahájení léčby),
- v kombinaci s adefovirem k léčbě pacientů s chronickou hepatitidou B s intolerancí tenofoviru,
- v monoterapii k pokračující dlouhodobé léčbě pacientů s chronickou hepatitidou B s dobrou virologickou odpovědí na lamivudin (tj. s negativní viremií),
- k léčbě těžké akutní nebo protrahované hepatitidy B; podávání lamivudinu u těžké akutní nebo protrahované hepatitidy B by mělo být zahájeno pouze v případě, že není možné nebo přípustné podávat jiné alternativní antivirotikum, u kterého je menší pravděpodobnost vzniku rezistence,
- k časově omezené profylaxi reaktivace chronické hepatitidy B u imunosuprimovaných pacientů s HBV DNA v séru < 2 000 IU/ml, kteří jsou: HBsAg pozitivní a/nebo HBsAg negativní a současně anti-HBc pozitivní; profylaxe lamivudinem je ukončena 12 měsíců po ukončení imunosuprese.
Adefovir a lamivudin
Adefovir (10 mg jednou denně) v kombinaci s lamivudinem (100 mg jednou denně) je určen:
- k dlouhodobé léčbě pacientů s rezistencí na lamivudin, kteří netolerují tenofovir.
Telbivudin
Telbivudin v monoterapii (600 mg jednou denně) je potentním inhibitorem replikace HBV, ale vzhledem k nízké rezistenční bariéře a relativně vysoké ceně se v České republice prakticky nepoužívá.
Srovnání četnosti vzniku rezistence při léčbě různými NA je uvedeno v grafu 1.
Graf 1. Srovnání četnosti výskytu rezistence spojené s léčbou různými NA v závislosti na délce léčby [3]. Graph 1. Comparison of the incidence of resistance associated with the treatment of various NA depending on the length of treatment [3]. ![Srovnání četnosti výskytu rezistence spojené s léčbou různými NA v závislosti na délce léčby [3].
Graph 1. Comparison of the incidence of resistance associated with the treatment of various NA depending on the length of treatment [3].](https://pl-master.mdcdn.cz/media/image/33390de4761169085563f739285ed2f8.jpg?version=1537793391)
10. Předpovědní faktory úspěšné léčby chronické infekce HBV
10.1. Pro léčbu pegylovaným či konvenčním interferonem (IFN) alfa
1. před léčbou
Vyšší pravděpodobnost dosažení sérokonverze HBeAg/anti-HBe je u nemocných, kteří mají před léčbou relativně nízkou viremii (HBV DNA < 2 × 108 IU/ml), vysokou aktivitu ALT (> 2–5 × ULN) a histologicky vysokou zánětlivou aktivitu (≥ A2) (B2). Pacienti infikovaní genotypem A nebo B lépe odpovídají na léčbu IFN alfa než při infekci genotypy C nebo D. Obecně však má infekce určitým genotypem HBV malou individuální předpovědní hodnotu a sám genotyp nesmí ovlivnit rozhodnutí o léčbě. U HBeAg negativních pacientů nebyly dosud nalezeny významné vstupní předpoklady dosažení virologické odpovědi.
1. v průběhu léčby
Pokud ve 12. týdnu léčby poklesne HBV DNA < 20 000 IU/ml, je 50% pravděpodobnost dosažení sérokonverze HBeAg/anti-HBe u původně HBeAg pozitivních pacientů a 50% pravděpodobnost dosažení setrvalé virologické odpovědi na léčbu u HBeAg negativních pacientů. Sérokonverze HBeAg/anti-HBe je častější, pokud během léčby dojde k imunologicky podmíněným vzestupům aktivity ALT (ALT flares) následovaných poklesem sérové hladiny HBV DNA (B2). Rovněž pokles hladiny HBsAg ve 12. týdnu léčby pod 1 500 IU/ml je silným prediktorem sérokonverze HBeAg/anti-HBe (C2). Naopak hladina HBsAg > 20 000 IU/ml nebo absence poklesu hladiny HBsAg během prvních 12 týdnů léčby jsou spojeny s malou pravděpodobností dosažení sérokonverze HBeAg/anti-HBe (C2). U HBeAg negativních osob evropského původu infikovaných genotypem D je kombinace absence poklesu hladiny HBsAg a poklesu HBV DNA o méně než 2 dekadické logaritmy během prvních 12 týdnů léčby prediktorem neúspěšné léčby PEG-IFN, která by měla být v tomto případě předčasně ukončena (B2).
10.2. Pro léčbu nukleosidovými či nukleotidovými analogy
1. před léčbou
Před léčbou jsou příznivými předpovědními faktory HBV DNA < 2 ×× 108 IU/ml, vysoká aktivita ALT a vysoká histologická aktivita jaterního procesu (A1). Úspěšnost léčby žádným NA není ovlivněna genotypem HBV (A1).
2. v průběhu léčby
Virologická odpověď (negativní HBV DNA v séru) ve 24. týdnu léčby LAM nebo TBV a ve 48. týdnu léčby ADV jsou spojeny s nižším nebezpečím vzniku rezistence, a tím s větší pravděpodobností dosažení sérokonverze HBeAg/anti-HBe (u HBeAg pozitivních) a setrvalé virologické odpovědi u HBeAg negativních (B1). Pokles hladiny HBsAg během léčby NA u HBeAg pozitivních pacientů může předpovídat následnou ztrátu HBeAg nebo HBsAg (C2).
11. Úspěšnost léčby chronické hepatitidy B
Srovnání úspěšnosti roční léčby různými léky používanými pro léčbu chronické hepatitidy B je patrné z tab. 2 (HBeAg pozitivní pacienti) a tab. 3 (HBeAg negativní pacienti). Obecně lze říci, že srovnání účinnosti jednotlivých preparátů je velmi obtížné, protože nejde o výsledky přímých head-to-head studií, ale o data z různých klinických studií, která se lišila svým designem a zejména citlivostí setů použitých pro detekci HBV DNA v séru, což mohlo velmi významně ovlivnit dosažené výsledky.
Tab. 2. Výsledky léčby HBeag pozitivních pacientů (u PEG-iFn šest měsíců po 48 nebo 52 týdnech léčby, u na po 48 nebo 52 týdnech dosud probíhající léčby) [3]. Tab. 2. The results of treatment of HBeAg-positive patients (PEG-IFN six months after 48 or 52 weeks of treatment, NA after 48 or 52 weeks of treatment still ongoing) [3]. ![Výsledky léčby HBeag pozitivních pacientů (u PEG-iFn šest měsíců po 48 nebo 52 týdnech léčby, u na po 48 nebo 52 týdnech dosud probíhající léčby) [3].
Tab. 2. The results of treatment of HBeAg-positive patients (PEG-IFN six months after 48 or 52 weeks of treatment, NA after 48 or 52 weeks of treatment still ongoing) [3].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/c57d9951734d8205a35f3ed76b6082d4.png)
Tab. 3. Výsledky léčby HBeag negativních pacientů (u PEG-iFn šest měsíců po 48 týdnech léčby, u na po 48 nebo 52 týdnech dosud probíhající léčby) [3]. Tab. 3. Results of treatment of HBeAg-negative patients (PEG-IFN six months after 48 weeks of treatment, NA after 48 or 52 weeks of treatment still ongoing) [3]. ![Výsledky léčby HBeag negativních pacientů (u PEG-iFn šest měsíců po 48 týdnech léčby, u na po 48 nebo 52 týdnech dosud probíhající léčby) [3].
Tab. 3. Results of treatment of HBeAg-negative patients (PEG-IFN six months after 48 weeks of treatment, NA after 48 or 52 weeks of treatment still ongoing) [3].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/4ac4199961715e4c4293a5a54b90f250.png)
U HBeAg pozitivních pacientů došlo k vymizení HBsAg u 3–7 % léčených PEG-IFN a 3 % léčených TDV. Při léčbě ostatními léky byla po jednom roce léčby ztráta HBsAg prokázána jen výjimečně.
U HBeAg negativních pacientů došlo ke ztrátě HBsAg u 4 % léčených PEG-IFN. Při léčbě ostatními léky nebyla po jednom roce léčby ztráta HBsAg zaznamenána.
12. Strategie léčby chronické hepatitidy B
Obecně jsou možné dvě strategie léčby chronické hepatitidy B – časově omezená a časově neomezená (dlouhodobá) léčba.
12.1. Časově omezená léčba chronické hepatitidy B
Pro časově omezenou léčbu lze obecně použít:
PEG-IFN alfa
Hlavní výhodou léčby PEG-IFN je absence vzniku rezistence a potenciál léku pro dosažení imunologicky podmíněné kontroly infekce HBV manifestující se jako setrvalá virologická odpověď po skončení léčby a v některých případech i ztráta HBsAg. 48týdenní léčba PEG-IFN se doporučuje především pro HBeAg pozitivní pacienty s nejlepšími výchozími předpoklady pro dosažení sérokonverze HBeAg/anti-HBe (bod 10.1) (A1).
ETV nebo TDV
Pouze u HBeAg pozitivních pacientů. Potřebnou dobu léčby není možné před léčbou stanovit, stejně tak nelze předem stanovit, zda bude postačovat časově omezená léčba nebo zda bude nutná dlouhodobá, časově neomezená léčba. Závisí to na tom, zda se podaří v průběhu léčby dosáhnout sérokonverze HBeAg/anti-HBe, či nikoli (A1). Doba léčby má pokračovat 12 měsíců po dosažení HBeAg/anti-HBe sérokonverze. Při splnění této podmínky lze očekávat trvalou sérokonverzi HBeAg/anti-HBe v 40–80 % případů (B1).
Pacient musí být předem informován o nežádoucích účincích navržené léčby a měl by se podílet na rozhodnutí, zda chce být léčen PEG-IFN nebo NA (A1).
12.2. Časově neomezená (dlouhodobá) léčba chronické hepatitidy B
Tato léčba je indikována u následujících pacientů:
- HBeAg pozitivních, u kterých se nepodaří během léčby NA dosáhnout sérokonverze HBeAg/anti-HBe,
- u HBeAg negativních léčených NA,
- u cirhotiků bez ohledu na stav HBeAg.
Cílem dlouhodobé léčby je suprimovat replikaci HBV, tedy udržet HBV DNA v séru pod hranicí detekovatelnosti metodou PCR v reálném čase, a tím zastavit či zpomalit progresi jaterního onemocnění (C1).
Pro dlouhodobou léčbu jsou nejlepšími léky ETV nebo TDV, a to vzhledem k jejich vysoké účinnosti a současně vysoké genetické bariéře pro vznik rezistence, což má při dlouhodobé léčbě mimořádný význam (A1). V současné době není k dispozici dostatek dat pro doporučení iniciální kombinované léčby s ETV nebo TDV (C1).
13. Primární selhání léčby chronické hepatitidy B
13.1. Primární rezistence na IFN alfa (pegylovaný či konvenční)
Primární rezistence (non-response) nebyla dosud prokázána.
13.2. Primární rezistence na NA
Jako primární rezistence (non-response) na NA se označuje situace, kdy během prvních 12 týdnů léčby poklesne hladina HBV DNA v séru o << 1 log10 IU/ml oproti výchozí (baseline) hodnotě. Nejčastější je u ADV (10–20 %), protože se musí podávat v suboptimální denní dávce vzhledem k nefrotoxicitě vyšších a účinnějších dávek ADV. Řešením je rychlý přechod na TDV nebo ETV. Primární rezistence je vzácná u LAM, TBV, ETV nebo TDV, proto je na místě nejdříve kontrola compliance pacienta. Pokud se in vitro prokáže přítomnost mutanty HBV rezistentní na některé z těchto NA, je nutný rychlý přechod na léčbu NA účinným na rezistentní mutantu viru (B1).
13.3. Parciální virologická odpověď na léčbu NA
Tímto termínem se označuje pokles hladiny HBV DNA v séru > 1 log10 IU/ml oproti výchozí (baseline) hodnotě, ale pomocí velmi citlivé PCR v reálném čase lze HBV DNA v séru prokázat. U léků s nízkou genetickou bariérou proti vzniku rezistence se hodnotí ve 24. týdnu (LAM, TBV), resp. ve 48. týdnu (ADV) léčby. Při zaznamenání parciální virologické odpovědi je nutné vždy nejprve zkontrolovat compliance pacienta s léčbou a přejít na léčbu účinnějším lékem – ETV nebo TDV, při respektování zkřížené rezistence HBV na NA (A1).
U pacientů iniciálně léčených ETV nebo TDV se posuzuje event. parciální virologická odpověď po 48 týdnech léčby. Názory na způsob pokračování léčby se mezi experty různí. V každém případě je nutné posoudit hladinu HBV DNA v séru ve 48. týdnu léčby a kinetiku jejího poklesu. Pokud dojde k poklesu viremie, je možné pokračovat v léčbě stejným lékem (ETV nebo TDV), protože pravděpodobnost dosažení virologické odpovědi s prodlužující se délkou léčby stoupá a riziko vzniku rezistence je malé. Jiní odborníci doporučují přidání dalšího léku do kombinace (tedy TDV k ETV nebo naopak) pro oddálení rezistence v budoucnosti (C2).
13.4. Virologický breakthrough při léčbě NA
Vznik virologického breakthrough je u pacientů s dobrou adherencí k léčbě spojen se vznikem mutant HBV rezistentních na daný NA. Vznik rezistence je spojen s vysokou vstupní viremií, pomalým poklesem HBV DNA v séru během antivirové léčby a s volbou NA, které nemá optimální účinnost (B1).
Při volbě léků pro následnou terapii je nutné vzít do úvahy dosud známá data o zkřížené rezistenci mezi jednotlivými NA, která jsou uvedena v tab. 4 (A1). V případě vzniku rezistentní mutanty na LAM (TBV) je záměna lamivudinu (TBV) za tenofovir považována za stejně účinnou jako přidání TDV k LAM (TBV) (B1, C1). Pokud vznikne rezistence na ADV, je možná náhrada adefoviru entecavirem nebo tenofovirem (B1). V případě rezistence na ETV, která je vzácná u pacientů neléčených v minulosti LAM, je na místě náhrada entecaviru tenofovirem nebo přidání TDV k ETV (C1). Rezistence na TDV zatím popsána nebyla, proto nejsou zkušenosti s léčbou TDV rezistentní mutanty viru. Kdyby k této situaci došlo, přichází do úvahy přidání ETV, TBV nebo LAM k TDV. V případě, že pacient nebyl v minulosti léčen LAM, je možná i náhrada tenofoviru entecavirem (C2).
Tab. 4. Zkřížená rezistence mezi mutantami HBV, které vznikají při léčbě na nejčastěji (S – citlivost, R – rezistence, i – snížená citlivost) [3]. Tab. 4. Cross-resistance between HBV mutants which arise most frequently in the treatment (S – sensitivity, R – resistance, I – insensitivity) [3]. ![Zkřížená rezistence mezi mutantami HBV, které vznikají při léčbě
na nejčastěji (S – citlivost, R – rezistence, i – snížená citlivost) [3].
Tab. 4. Cross-resistance between HBV mutants which arise most frequently
in the treatment (S – sensitivity, R – resistance, I – insensitivity) [3].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/8eeaa0e254ee444f7b6659c76c7bf3ba.png)
14. Monitorování virologických a sérologických parametrů během léčby a po jejím skončení
14.1. Léčba interferonovými preparáty
Hladina HBV DNA v séru se stanovuje metodou PCR v reálném čase před léčbou, v 6. a 12. měsíci léčby a 6 a 12 měsíců po skončení léčby. U pacientů HBeAg pozitivních se ve stejných intervalech provádí i stanovení HBeAg a anti-HBe (A1).
Pacienti po sérokonverzi HBeAg/anti-HBe musí být dlouhodobě sledováni, protože je po skončení léčby možná séroreverze a může vzniknout HBeAg negativní forma chronické hepatitidy B (A1).
Nedetekovatelná HBV DNA (metodou PCR v reálném čase) v období po skončení léčby je optimálním výsledkem léčby HBeAg pozitivní i HBeAg negativní formy chronické hepatitidy B, protože je spojena s velkou pravděpodobností ztráty HBsAg v budoucnosti. Proto je v případě HBV DNA negativity nutná kontrola HBsAg v intervalu šesti měsíců. Kvantifikace HBsAg zatím není rutinní metodou. Její význam je zmíněn v kapitole 10.
14.2. Léčba NA
Hladina HBV DNA v séru se stanovuje metodou PCR v reálném čase před léčbou, po třech měsících léčby (posouzení virologické odpovědi) a dále během léčby v intervalu 3–6 měsíců. U léků s vysokou účinností a genetickou bariérou pro vznik rezistence (ETV a TDV) lze intervaly mezi vyšetřeními HBV DNA v séru prodloužit, pokud byla prokázána virologická odpověď a je dobrá adherence ze strany pacienta. U pacientů HBeAg pozitivních se ve stejných intervalech provádí každých šest měsíců i stanovení HBeAg a anti-HBe (A1). Pokud dojde k sérokonverzi HBeAg/anti-HBe, je vhodné kontrolovat každých 12 měsíců, zda nedošlo ke ztrátě HBsAg.
15. Monitorování nežádoucích účinků během léčby NA
Všechna NA jsou vylučována ledvinami, proto je nutná redukce dávek nebo prodlužování intervalů mezi jednotlivými dávkami při poklesu clearance kreatininu. Nefrotoxický potenciál mají nukleotidová analoga větší než analoga nukleosidová, a to zejména ADV. Doporučuje se monitorovat renální funkce (sérový kreatinin, glomerulární filtraci) a sérovou hladinu fosforu během léčby ADV a TDV u všech pacientů a během léčby nukleosidovými analogy u pacientů v riziku renálního postižení (C1). Renální funkce by měly být vyšetřeny po třech měsících léčby a potom každých šest měsíců, pokud nedochází k jejich zhoršování. Vzácně byly publikovány i případy osteoporózy u HIV pozitivních pacientů léčených TDV. Myopatie byla vzácně prokázána při léčbě TBV. Probíhají studie hodnotící možnou karcinogenitu ETV při dlouhodobém podávání. Dlouhodobá bezpečnost kombinované léčby několika NA, včetně TDV a ETV, není zatím známa.
16. Léčba pacientů s kompenzovanou jaterní cirhózou (Child A)
Pokud lze u nich detekovat HBV DNA v séru metodou PCR v reálném čase, mají být léčeni, i když je ALT normální (B1). Dlouhodobá a účinná suprese HBV DNA může stabilizovat stav pacienta a oddálit nebo trvale odstranit potřebu transplantace jater. PEG-IFN lze použít jen u dobře kompenzovaných cirhotiků. Preferovaná je monoterapie ETV nebo TDV vzhledem k účinnosti, minimálnímu riziku vzniku rezistence a nežádoucích účinků (A1). Léčba NA je u naprosté většiny cirhotiků časově neomezená.
17. Léčba pacientů s dekompenzovanou jaterní cirhózou (Child B a C)
Nemocní s dekompenzovanou jaterní cirhózou a detekovatelnou HBV DNA v séru vyžadují urgentní zahájení antivirové léčby ve specializovaných centrech s napojením na transplantační jednotky. Lékem volby jsou NA s vysokou genetickou bariérou pro vznik rezistence, tedy ETV (v této indikaci 1 mg jednou denně) nebo TDV (A1), interferon alfa (pegylovaný i konvenční) je kontraindikován. Léčbou navozená suprese virové replikace může vést k pomalému zlepšování klinického stavu, a to v horizontu 3–6 měsíců, ale u velmi pokročilých cirhotiků nemusí být antivirová léčba vždy úspěšná a je nutná transplantace jater. I přes úspěšnou léčbu NA zůstávají tito pacienti v riziku vzniku HCC, a proto je nutná dlouhodobá surveillance HCC.
18. Léčba nemocných před transplantací jater a po ní pro konečná stadia chronické infekce virem hepatitidy B
Před transplantací je nutné u všech HBsAg pozitivních pacientů dosažení co nejnižší hladiny HBV DNA v séru. Pokud dojde před transplantací jater k poklesu HBV DNA v séru pod hranici detekovatelnosti, snižuje se pravděpodobnost rekurence HBV ve štěpu. Lékem volby jsou NA s vysokou genetickou bariérou pro vznik rezistence, tedy ETV nebo TDV (A1). Podávání NA po transplantaci je s velkou pravděpodobností doživotní. V současnosti je nejvíce zkušeností s kombinací LAM a/nebo ADV a hyperimunního imunoglobulinu proti HBV (HBIg). Touto léčbou lze redukovat riziko reinfekce štěpu pod 10 %. Mezi zatím jen studované postupy patří:
- možnost snížit dávky HBIg nebo zkrátit dobu podávání tohoto imunoglo-bulinu,
- ETV bez HBIg,
- TDV s emtricitabinem (Truvada) s/bez HBIg.
19. Profylaxe reaktivace a rekurence infekce HBV
Replikace HBV sama o sobě nevede k destrukci infikovaných hepatocytů, virus není ve většině případů cytopatogenní. Imunosupresivní léčba sice sníží imunitní reakci namířenou proti infikovaným hepatocytům, na druhou stranu oslabí imunitní kontrolu replikace viru. Zvyšuje se podíl infikovaných hepatocytů, replikace HBV výrazně stoupá a dosáhne úrovně, kdy již vede k přímému poškození infikovaných hepatocytů, a HBV se tím stává cytopatogenní. Klinickým korelátem popsaných pochodů je rozvoj fibrotizující cholestatické hepatitidy, což je závažné život ohrožující onemocnění, během několika měsíců vede bez účinné léčby u většiny případů k selhání jater. Stav, kdy imunosupresivní léčba vede k výraznému nárůstu replikace HBV a vzplanutí hepatitidy u dosud inaktivního nosiče HBsAg, se označuje jako reaktivace chronické hepatitidy B. Rekurencí se rozumí stav, kdy se pacient, který prodělal hepatitidu B a vymizel u něj HBsAg ze séra, stane znovu HBsAg pozitivním a replikace HBV rychle roste. Virová nukleová kyselina totiž perzistuje trvale v hepatocytech ve formě tzv. cccDNA (covalently closed circular DNA), a to i u pacientů, kteří se stali HBsAg negativními. K úplné eliminaci HBV nikdy nedojde. Stav dříve nazývaný eliminací viru je jen účinnou imunitní kontrolou replikace s poklesem viremie pod hranici detekovatelnosti. Ztráta imunitní kontroly replikace viru vlivem imunosupresivní léčby tak vede k rekurenci hepatitidy B. Z uvedených důvodů je nezbytné, aby byl u všech pacientů před zahájením chemoterapie nebo imunosupresivní terapie proveden screening HBsAg a anti-HBc (A1).
K reaktivaci replikace HBV dochází u 20–50 % inaktivních nosičů HBsAg podstupujících imunosupresivní či protinádorovou terapii. Reaktivace replikace HBV je častější, pokud chemoterapeutické režimy obsahují rituximab samostatně nebo v kombinaci s kortikosteroidy. Reaktivací hepatitidy B jsou ohroženi nejvíce pacienti s maligními lymfomy léčení rituximabem, ale i pacienti se solidními tumory, pacienti po transplantaci kostní dřeně, pacienti po orgánových transplantacích, dále pacienti s autoimunními chorobami léčení klasickými imunosupresivy a nově i anti-TNF a anti-CD20 protilátkami. Reaktivace byla popsána i po transarteriální chemoembolizaci HCC. Reaktivace hepatitidy B obvykle přichází po 2–4 cyklech chemoterapie a klinický obraz kolísá od asymptomatického zvýšení aktivity aminotransferáz (50 %) k obrazu těžké akutní hepatitidy s ikterem (10 %), nejzávažnější variantou je fulminantní selhání jater (5 %).
V současné době je u pacientů HBsAg pozitivních preferována léčba preemptivní, která se zahajuje nejméně týden před chemoterapií nebo imunosupresí bez ohledu na výši hladiny HBV DNA v séru. U pacientů s nízkou vstupní viremií (HBV DNA v séru < 2 000 IU/ml) se doporučuje podávat protivirové léky ještě 12 měsíců po skončení imunosupresivní či protinádorové terapie (A1). Ukončení léčby je možné jen u pacientů, u kterých se nepředpokládá opakování chemoterapie. V opačném případě je nutná léčba celoživotní. Léčba pacientů s vysokou vstupní viremií (> 2 000 IU/ml) musí pokračovat až do dosažení stejných cílových kritérií jako u imunokompetentních pacientů (B1). V současnosti je v této indikaci nejvíce zkušeností s LAM, ale zejména u nemocných s vysokou vstupní viremií (> 2 000 IU/ml) a předpokládanou dlouhodobou nebo opakovanou imunosupresí by měl mít přednost ETV nebo TDV kvůli výrazně nižšímu nebezpečí vzniku rezistence (C1).
U pacientů s pozitivitou anti-HBc protilátek a negativitou HBsAg je nezbytné stanovení HBV DNA v séru. V případě pozitivity HBV DNA (okultní infekce HBV) je na místě stejný postup jako u HBsAg pozitivních osob (C1). Pokud je HBV DNA v séru negativní, je nutné monitorování aktivity ALT a přítomnosti HBV DNA v séru v intervalu 1–3 měsíce podle typu imunosupresivní terapie a přítomnosti komorbidit. V případě rekurence infekce HBV je nezbytné zahájení léčby NA, a to nejlépe ještě před vzestupem aktivity ALT. Profylaktické podávání LAM je doporučeno při léčbě rituximabem, u příjemců kostní dřeně a kmenových buněk (C2). Optimální délka profylaxe není v těchto indikacích známa.
HBsAg negativní příjemci štěpu jater od anti-HBc pozitivních dárců by měli dostávat profylakticky LAM, a to po časově neomezenou dobu (B1).
20. Léčba zvláštních skupin pacientů s chronickou infekcí HBV
20.1. Těhotné ženy
Podle americké klasifikace US FDA Pharmaceutical Pregnancy Categories, která rozlišuje pět kategorií léků (A, B, C, D, X) podle možného ovlivnění těhotenství, patří TBV a TDV do kategorie B (tedy s druhým nejnižším rizikem) a LAM, ADV, ETV do kategorie C. Nejvíce informací o bezpečnosti NA pochází od HIV pozitivních žen léčených léky účinnými současně proti infekci HIV i HBV. Protivirová léčba u gravidních žen by neměla být zahajována, pokud to není vzhledem k aktivitě a pokročilosti jaterního procesu nezbytné. Preferovaný je v těhotenství TDV, protože má vysokou genetickou bariéru proti vzniku rezistence a k dispozici je nejvíce informací o bezpečném podávání během těhotenství (B1). Bezpečnost léčby ETV v těhotenství není známa. Interferon alfa (pegylovaný i konvenční) je v graviditě kontraindikován (A1).
20.2. Ženy plánující těhotenství
Pokud se jedná o ženu bez pokročilé fibrózy počítající s těhotenstvím v blízké době, je možné počkat se zahájením léčby až po porodu, event. až po ukončení kojení (C1). V případě pokročilé fibrózy nebo cirhózy je na místě okamžité zahájení léčby, pokud lze těhotenství plánovat do budoucna. Přednost by měla mít časově omezené léčba PEG-IFN, pokud nejsou přítomny její kontraindikace (C1). Nutností je adekvátní antikoncepce během této léčby. Pokud není možné léčit PEG-IFN nebo tato léčba selhala, je nutná léčba NA (C1). Vzhledem k předpokládané nutnosti léčby i během event. těhotenství v budoucnosti má přednost v této indikaci TDV (B1).
20.3. Ženy, které neplánovaně otěhotněly během antivirové léčby
Pokud se jedná o ženu s pokročilou fibrózou nebo cirhózou, je nutné pokračovat v léčbě za těchto podmínek:
- interferon alfa (konvenční nebo pegylovaný) musí být vysazen a nahrazen NA,
- NA kategorie rizika C (ETV, ADV) by měla být nahrazena NA kategorie B.
Preferovaný je v této indikaci TDV, protože má vysokou účinnost a genetickou bariéru proti vzniku rezistence a k dispozici je nejvíce informací o bezpečném podávání během těhotenství.
20.4. Prevence perinatálního přenosu HBV u hyperviremických matek
Prevence perinatálního přenosu HBV standardní kombinací pasivní a aktivní imunizace nemusí být u matek s velmi vysokou viremií dostatečně účinná. U žen s hladinou HBV DNA v séru > 106–7 IU/ml, které jsou většinou HBeAg pozitivní, je riziko vertikálního přenosu HBV > 10 % i přes podání HBIg a vakcinaci. Podle výsledků klinických studií (LAM, TBV) nebo názoru expertů (TDV) může podávání NA v posledním trimestru u pacientek s vysokou HBV DNA v séru zvýšit účinnost pasivní a aktivní imunizace proti HBV (B1). Pokud byla léčba NA pouze z důvodu prevence perinatálního přenosu, může být ukončena během prvních tří měsíců po narození dítěte (C1).
20.5. Kojící matky
HBsAg lze v mateřském mléce prokázat, ale kojení není kontraindikováno u HBsAg pozitivních matek, zejména při standardní pasivní a aktivní imunizaci novorozence. Bezpečnost léčby NA při kojení není známa. TDV přechází do mateřského mléka, ale jeho orální biologická dostupnost je limitována, a děti jsou proto při kojení exponovány jen malé dávce léku. Přesto nelze léčbu TDV při kojení doporučit, protože nejsou známy účinky léku na novorozence a kojence.
20.6. Děti
U většiny dětí má chronická hepatitida B benigní průběh, proto indikace k léčbě musí být pečlivě zvážena (A1). Do současné doby bylo prokázáno, že bezpečnost a účinnost konvenčního IFN alfa, LAM, ADV a TDV u dětí je srovnatelná s dospělými pacienty. Stále probíhají studie s jinými NA u dětí.
Léčba konvenčním IFN je schválena u dětí ve věku > 3 roky (ostatní indikační kritéria jsou stejná jako u dospělých), PEG-IFN není u dětí schválen. Doporučená dávka IFN alfa je 6 MU/m2, maximálně 10 MU, podávaná třikrát týdně. Doba léčby je stejná jako u dospělých pacientů. TDV je schválen podle SPC pro léčbu dětí od 12 let. Dávka LAM byla stanovena na 3 mg/kg/den, maximálně však 100 mg denně. V klinické studii bylo prokázáno, že denní dávka ADV 0,3 mg/kg u dětí ve věku 2–6 let a 10 mg u starších dětí vede ke stejným léčebným výsledkům jako dávka 10 mg denně u dospělých pacientů a je stejně dobře tolerována. Lamivudin a ADV byly v České republice zatím registrovány pouze pro léčbu chronické hepatitidy B u dospělých pacientů.
20.7. Zdravotníci provádějící invazivní zákroky
Za potenciálně nebezpečnou viremii vzhledem k přenosu HBV na pacienty se bere hladina HBV DNA v séru ≥≥ 2 000 IU/ml. Proto by měli být zdravotníci provádějící invazivní zákroky léčeni účinným NA s vysokou genetickou bariérou proti vzniku rezistence (ETV, TDV), aby u nich viremie klesla pod hranici detekovatelnosti PCR v reálném čase nebo alespoň < 2 000 IU/ml (B1).
20.8. Hemodialyzovaní a po transplantaci ledviny
Interferon alfa (pegylovaný i konvenční) i NA lze použít v léčbě nemocných s renální insuficiencí. Dávku léků nebo intervaly mezi jednotlivými dávkami (především NA) je nutné upravit podle tíže ledvinného poškození (podle SPC příslušných léků) (A1) a během léčby je nutná monitorace ledvinných funkcí (B1). TDV není určen pro léčbu nedialyzovaných pacientů s clearance kreatininu < 10 ml/min. Po transplantaci ledviny není možná léčba interferonem alfa (pegylovaným nebo konvenčním) – hrozí rejekce štěpu. Vzhledem k nutnosti trvalé imunosuprese po transplantaci ledviny musí každý HBsAg pozitivní pacient dostávat NA. Podle výše iniciální viremie je podání NA profylaktické nebo terapeutické.
20.9. Pacienti s koinfekcí HBV a HIV
Díky výraznému prodloužení délky života a zlepšení jeho kvality v důsledku kombinované antiretrovirové terapie (cART) u HIV pozitivních osob je léčba chronické infekce HBV u těchto nemocných plně indikovaná. U pacientů koinfikovaných HBV a HIV je větší riziko vzniku jaterní cirhózy a HCC. V důsledku restituce imunitního systému během cART může dojít k akutní exacerbaci chronické hepatitidy B. Indikace pro léčbu jsou u koinfikovaných stejné jako u HIV negativních. V souladu s doporučeními pro léčbu infekce HIV se doporučuje léčit u většiny pacientů infekci HIV i HBV de novo. Lékem volby je tenofovir s emtricitabinem (Truvada) nebo lamivudinem v kombinaci s dalším lékem účinným na HIV infekci (A1). Pokud se lékař rozhodne léčit pouze infekci HBV (výjimečný případ), je základním pravidlem nevolit léky účinné i na HIV (LAM, ETV, TDV) vzhledem k nebezpečí vzniku rezistence HIV při monoterapii. Léky volby jsou proto PEG-IFN, ADV a TBV. Pokud se po 12 měsících léčby ADV nebo TBV nedosáhne negativity HBV DNA v séru metodou PCR v reálném čase, je na místě začít léčit i infekci HIV stejným způsobem jako v případě de novo terapie koinfekce HBV a HIV (A1).
20.10. Pacienti s koinfekcí HBV a HDV
Infekce HDV je zatím v podmínkách České republiky ojedinělá, ale s rostoucím počtem imigrantů může incidence onemocnění narůstat. K potvrzení aktivní koinfekce slouží průkaz HDV RNA v séru nebo protilátek anti-HDV IgM nebo HDAg imunohistochemicky. Problémem je dostupnost a standardizace uvedených vyšetření. Jedinými účinnými léky jsou PEG-IFN nebo konvenční IFN alfa, NA jsou na HDV neúčinná (A1). Cílem léčby je útlum replikace HDV (HBV DNA bývá většinou negativní i metodou PCR v reálném čase díky supresivnímu vlivu HDV na replikaci HBV), který je většinou spojen s normalizací ALT a s histologickým zlepšením. Potřebná délka léčby je pravděpodobně více než jeden rok. Pro kontrolu účinnosti léčby se doporučuje monitorovat hladinu HDV RNA v séru každých 3–6 měsíců (C2). Úspěšnost léčby není přesně známa, ale asi u 20–40 % léčených dojde k setrvalé virologické odpovědi po skončení léčby s negativitou HDV RNA v séru a s tím spojeným histologickým zlepšením. U některých osob vymizí i HBsAg. Pokud je u HDV/HBV koinfikovaných osob trvale nebo intermitentně HBV DNA v séru > 2 000 IU/ml, je třeba uvažovat o léčbě infekce HBV s pomocí NA.
20.11. Pacienti s koinfekcí HBV a HCV
U naprosté většiny nemocných utlumí replikace HCV replikaci HBV, proto je hladina HBV DNA v séru většinou nízká nebo nedetekovatelná metodou PCR v reálném čase. Úvodní terapií volby je standardní léčba chronické infekce HCV (B1). Setrvalá virologická odpověď vzhledem k infekci HCV je zhruba stejně častá jako u pacientů s hepatitidou C bez současné HBV. Existuje potenciální riziko reaktivace HBV po útlumu replikace HCV. V tomto případě je na místě zahájení léčby NA podle obecně platných pravidel (B1).
20.12. Pacienti s extrahepatálními projevy infekce HBV
Antivirová léčba HBsAg pozitivních pacientů s aktivní replikací HBV a extrahepatálními projevy infekce HBV může vést k poklesu závažnosti nebo úplnému vymizení mimojaterních projevů infekce, kterými jsou zejména různé kožní choroby, polyarteritis nodosa a glomerulonefritida. V této indikaci je nejvíce zkušeností s LAM, ale předpokládá se, že ETV a TDV jsou účinnější. V některých indikacích může být účinná současně prováděná plazmaferéza a podávání kortikosteroidů (C2). Interferon alfa (pegylovaný nebo konvenční) může zhoršit mimojaterní projevy, jejichž podkladem je autoimunitní mechanizmus.
21. Léčba nemocných s těžkým průběhem akutní hepatitidy B
Přibližně 95–99 % dospělých pacientů s akutní hepatitidou B se spontánně vyléčí a dojde u nich bez antivirové terapie k sérokonverzi HBsAg/anti-HBs (A1). Někteří pacienti s fulminantní hepatitidou nebo těžkou protrahovanou subakutní jaterní nekrózou jsou kandidáty transplantace jater a mohou profitovat z léčby NA (A1). Nejvíce zkušeností je v této indikaci zatím s LAM, ale podání léků s vyšší genetickou bariérou k rezistenci (ETV, TDV) je vhodnější. Proto by měla být léčba LAM zahájena pouze v případě, že není možné nebo přípustné podávat ETV nebo TDV. Délka léčby nebyla stanovena, ale doporučuje se pokračovat nejméně 3 měsíce po sérokonverzi HBsAg/anti-HBs nebo 12 měsíců po sérokonverzi HBeAg/anti-HBe (C2). Pokud nelze odlišit akutní hepatitidu B a reaktivaci chronické hepatitidy B, je na místě léčba NA (B1).
22. Význam jaterní biopsie a způsob provedení histologického hodnocení
Provedení jaterní biopsie je doporučeno pro stanovení stupně zánětlivě-nekrotické aktivity a fibrózy u pacientů s nejasnými indikacemi pro okamžité zahájení antivirové léčby. Biopsie může být rovněž užitečná pro posouzení přítomnosti jiných možných příčin jaterního onemocnění, jako jsou steatóza nebo steatohepatitida. Jaterní biopsie není obvykle nutná u pacientů s jaterní cirhózou nebo u těch, u kterých je léčba indikována bez ohledu na stupeň aktivity a pokročilosti jaterního procesu. Je nezbytné, aby bioptický vzorek byl dostatečně velký pro přesné posouzení stupně jaterního poškození, zejména fibrózy (A1). I když je jaterní biopsie invazivním zákrokem, riziko závažných komplikací je velmi nízké (1/4 000–10 000 zákroků). Histologické hodnocení se provádí stejně jako u jiných chronických hepatitid (Knodell, Ishak, METAVIR). Odmítnutí jaterní biopsie pacientem či jeho neprovedení z důvodů nebezpečnosti zákroku u komplikovaného pacienta (hemofilie, trombocytopenie, koagulační poruchy, jaterní hemangiomy apod.) nesmí být důvodem k neposkytnutí léčby, pokud se jedná o klinicky a laboratorně jasně indikované případy.
V současnosti narůstá význam neinvazivních metod určujících pokročilost jaterní léze. Nejširšího uplatnění na tomto poli dosáhly metody měření jaterní elasticity, které mají v případech chronické HBV infekce akceptovatelnou výpovědní hodnotu. Je nicméně třeba určité zkušenosti při jejich použití, existuje řada faktorů, které mohou jejich výsledky negativně ovlivnit, např. obezita. Ke stanovení pokročilosti lze užít i některé tzv. krevní biomarkery jaterní fibrózy. Tato vyšetření jsou však spolehlivá pouze v diskriminaci jaterní cirhóza vs non-cirhóza. K hodnocení jednotlivých stadií jaterní fibrózy se zatím nehodí.
Kombinace vyšetření jaterní elasticity a krevních biomarkerů jaterní fibrózy zvyšuje přesnost hodnocení pokročilosti jaterního procesu a snižuje nezbytnost provedení jaterní biopsie.
23. Způsob dispenzarizace pacientů s infekcí virem hepatitidy B
V České republice je ze zákona nařízena povinná izolace nemocných s akutní hepatitidou na infekčních klinikách či odděleních. Dále jsou pacienti nejméně 12 měsíců kontrolováni v jaterních poradnách při těchto pracovištích. Pokud infekce přejde do chronicity, je nutná dlouhodobá, event. celoživotní dispenzarizace v jaterních poradnách infekčních, gastroenterologických nebo interních pracovišť; v případě vzniku HCC na gastroenterologii a onkologii. Oprávnění poskytovat antivirovou léčbu chronické hepatitidy B mají pouze pracoviště garantovaná Českou hepatologickou společností a Společností infekčního lékařství České lékařské společnosti J. E. Purkyně.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 30. 9. 2014
Přijato: 20. 10. 2014
Tento doporučený postup byl schválen výbory SIL ČLS JEP a ČHS ČLS JEP v září 2014.
prof. MUDr. Petr Husa, CSc.
Klinika infekčních chorob LF MU a FN Brno
Jihlavská 20, 625 00 Brno
phusa@fnbrno.cz
Zdroje
1. Husa P, Plíšek S, Šperl J et al. Diagnostika a léčba chronické hepatitidy B. Doporučený postup ČHS a SIL ČLS JEP. Datum vydání doporučení: duben 2009. Klin Mikrobiol Inf Lék 2009; 15(2): 65–76.
2. Husa P, Plíšek S, Šperl J et al. Diagnostika a léčba chronické hepatitidy B. Doporučený postup ČHS a SIL ČLS JEP. Datum vydání doporučení: duben 2009. Prakt Lék 2009; 89(4): 167–176.
3. European Association for the Study of the Liver. EASL clinical practice guidelines: management of chronic hepatitis B virus infection. J Hepatol 2012; 57(1): 167–185. doi: 10.1016/j.jhep.2012.02.010.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článek Zimní mix...Článek KvízČlánek Správná odpověď na kvízČlánek DR. BARES AWARDČlánek Poděkování recenzentům
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2014 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Zimní mix...
- SOUTĚŽ O NEJLEPŠÍ KAZUISTIKU 2015
- Kvíz
- Vedolizumab – nová antiintegrinová protilátka s vysokou gastrointestinální selektivitou
- OVESCO klip jako řešení komplikace ERCP
- Neobvyklý zdroj krvácení do gastrointestinálního traktu
- Problematika diferenciální diagnostiky autoimunitní formy pankreatitidy a pankreatického adenokarcinomu
- Standardní diagnostický a terapeutický postup chronické infekce virem hepatitidy C
- Doporučený postup diagnostiky a léčby chronické hepatitidy B
- Správná odpověď na kvíz
- Perorálna endoskopická myotómia (POEM) v liečbe achalázie na Slovensku
- Zpráva o celorepublikovém mezilaboratorním porovnání vyšetření fekálního kalprotektinu
- Podzimní pracovní den České hepatologické společnosti
- Karlovy Vary gastroenterologické – letos už potřinácté
- DR. BARES AWARD
- International professional competition Dr. Bares Award lived to see the 20th anniversary
- Poděkování recenzentům
- Anketa spokojenosti čtenářů časopisu Gastroenterologie a hepatologie
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- OVESCO klip jako řešení komplikace ERCP
- Perorálna endoskopická myotómia (POEM) v liečbe achalázie na Slovensku
- Neobvyklý zdroj krvácení do gastrointestinálního traktu
- Vedolizumab – nová antiintegrinová protilátka s vysokou gastrointestinální selektivitou
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



