-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Problematika diferenciální diagnostiky autoimunitní formy pankreatitidy a pankreatického adenokarcinomu
Differential diagnosis of autoimmune form of the pancreatitis and pancreatic adenocarcinoma
Differencial diagnosis of autoimmune pancreatitis and pancreatic carcinoma is usaully quite difficult procedure. In clinical practice a combination of clinical disease course and response to the therapy, serological markers, imaging methods and histology are used. The team-work and close cooperation with dedicted experts from other specialisation are absolutely needed.
Key words:
autoimmune pancreatitis – autoimmune diseases – pancreatic carcinoma
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
5. 9. 2014Accepted:
7. 10. 2014
Autoři: Petr Dítě 1
; Magdalena Uvírová 2
; M. Bojková 1; I. Novotný 3; J. Dvořáčková 4; Bohuslav Kianička 5
; H. Nechutová 5; L. Dovrtělová 6; K. Floreanová 7; Arnošt Martínek 1
Působiště autorů: Akademické centrum gastroenterologie, Interní klinika LF OU a FN Ostrava 1; CGB Laboratoř Agel, Ostrava 2; Masarykův onkologický ústav, Brno 3; Ústav patologie LF OU a FN Ostrava 4; II. interní klinika FN u sv. Anny, Brno 5; Katedra podpory zdraví, FSS MU, Brno 6; Interní gastroenterologická klinika LF MU a FN Brno 7
Vyšlo v časopise: Gastroent Hepatol 2014; 68(6): 492-496
Kategorie: Gastrointestinální onkologie: přehledová práce
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amgh2014492Souhrn
Diferenciální diagnostika autoimunitní pankreatitidy a karcinomu pankreatu je ve většině případů velmi obtížná. V klinické praxi využíváme klinické zhodnocení a posouzení odpovědi na podávanou terapii, sérologické markery, výsledky zobrazovacích metod a histologie. Podmínkou je těsná týmová spolupráce odborníků z různých oborů.
Klíčová slova:
autoimunitní pankreatitida – autoimunitní nemoci – karcinom pankreatu
Autoimunitní pankreatitida je řazena do skupiny chorob, které jsou označovány jako onemocnění asociovaná s nadprodukcí imunoglobulinu IgG4 (IgG4 related diseases) [1]. Jedná se o heterogenní onemocnění, etiologicky nespecifikovaná, která postihují různé orgány [2]. Epidemiologická data jsou známa jen částečně, podle studie Umehara et al je incidence těchto onemocnění nízká a pohybuje se od 0,28 do 1,08 případů/100 000 obyvatel/rok, což v případě 100milionového Japonska představuje 336–1 300 nově diagnostikovaných osob během jednoho roku [2]. I když autoimunitní pankreatitida (AIP) představuje vzácnou formu chronické pankreatitidy (2–4 % ze všech chronických pankreatitid), z hlediska IgG4 asociovaných chorob je jednou z nejdůležitějších nozologických jednotek. Rozděluje se na AIP typ 1, který patří do spektra IgG4 asociovaných nemocí, zatímco AIP typ 2 je vzhledem ke klinickým a histomorfologickým odlišnostem uváděn jako systémové postižení a často se sdružuje s idiopatickými střevními záněty.
Klinické symptomy
Ve studii Vlachou et al [3] byly nejčastějšími klinickými symptomy nepříliš intenzivní bolest nebo dyskomfort v břiše (58 %), obstrukční ikterus (54 %), pokles tělesné hmotnosti (51 %) a nově vzniklý diabetes mellitus (38 %). Vedle vleklých bolestí břicha je obstrukční ikterus druhým nejčastějším symptomem, který nemocné přivádí na vyšetření. Autoimunitní forma pankreatitidy postihuje v typických případech difuzně celý pankreas, u některých nemocných se však může objevovat v podobě fokálního nebo multifokálního postižení žlázy [4]. Je pochopitelné, že právě forma AIP s ložiskovými změnami způsobuje značné nesnáze v diferenciální diagnostice od karcinomu pankreatu. Zásadním klinickým znakem AIP je odpověď na imunosupresivní terapii s možností úplné regrese [5].
AIP je konsenzuálně diagnostikována podle změn v krevním séru, nálezu histomorfologického, odchylek v popisu zobrazovacích metod (CT pankreatu, endosonografie a MRCP).
Markery krevního séra
Diferenciální diagnostika mezi AIP a karcinomem pankreatu bývá velmi obtížná. Především to platí pro odlišení fokální formy AIP, kdy je zvětšena hlava pankreatu a prvním příznakem je nebolestivý obstrukční ikterus. Zvýšení hladiny sérového IgG4 nad limit 135,0 mg/dl [6] a pozitivní odpověď na nasazení terapie glukokortikoidy podporují diagnózu AIP. Diagnosticky velmi specifický znak AIP je nejméně dvojnásobné zvýšení sérové hladiny IgG4, avšak tento nález není příliš specifický, protože asi 10 % nemocných s karcinomem pankreatu má hodnoty sérového IgG4 přesahující 135 mg/dl [7–10] a z nich někteří dosahují dvojnásobku normy [11]. Hladina karbohydrátového nádorového markeru CA 19-9 vyšší než 200 IU/ml je u nemocných s AIP vzácná a doprovází obvykle adenokarcinom pankreatu [12]. V našem souboru 116 nemocných s histologicky prokázaným karcinomem pankreatu jsme potvrdili vyšší hladinu IgG4 u 11 osob (10,1 %), z nichž dvojnásobek normy (IgG4 > 270,0 mg/dl) mělo šest nemocných (4,0 %) [13]. U dvou osob z tohoto souboru nemocných s pankreatickým karcinomem jsme nalezli současně také AIP. V literatuře se objevily práce, které ukázaly, že „IgG4 related diseases“ představují rizikový faktor pro vznik neoplazií v různé lokalizaci, včetně pankreatu. Yamamoto et al nalezli u 106 osob s IgG4 asociovanými nemocemi u 11 z nich (11,7 %) současnou přítomnost malignity [14]. U nemocných se sialoadenitidou a autoimunitní pankreatitidou byly nalezeny malignity v tlustém střevě a plicích. Popsány jsou také non-hodgkinské lymfomy u pacientů s Mikuliczovým syndromem a Kuttnerovým nádorem slinné žlázy. Publikace o výskytu autoimunitní pankreatitidy a pankreatického karcinomu jsou stále publikacemi kazuistickými [15–18].
Zobrazovací metody
Zobrazovací metody jsou významné, a to jak pro diagnostiku AIP, tak i pro pankreatický karcinom. Počítačová tomografie má některé charakteristické znaky pro AIP [19]. U difuzní formy AIP je typickým nálezem difuzní zvětšení celé žlázy ve tvaru připomínajícím párek (sausage-like). Pankreatický vývod je nepravidelného, nedilatovaného lumena, a to v rozsahu minimálně 1/3 délky vývodu. Typický je nález hypodenzního lemu (capsule-like rim) při zevním okraji pankreatu. Tento příznak vzniká zřejmě přítomností inflamace s fibrotickými změnami peripankreatického tuku. Na rozdíl od tohoto typu je fokální forma AIP od karcinomu pankreatu velmi obtížně odlišitelná [20]. Problémem je také fakt, že řada příznaků na CT vyšetření je přítomna jak u AIP, tak u karcinomu pankreatu. Zobrazovací metody diagnostikované metastázy samozřejmě podporují diagnózu pankreatického karcinomu. Jako nadějné se zdálo využití metody FDG-PET při magnetické rezonanci. Avšak ukázalo se, že metoda není efektivnější než počítačová tomografie v rozlišení mezi karcinomem a AIP [12]. Příslibem je se zdá být využití magnetické rezonanční elastografie [21], zvláště jako metoda vylučující přítomnost karcinomu. Endoskopická retrográdní cholangiopankreatografie patří mezi tzv. asijská diagnostická kritéria AIP [22]. Mezi změny prokazatelné na pankreatickém vývodu u osob AIP patří difuzní, nepříliš výrazné nepravidelnosti pankreatického vývodu v rozsahu minimálně 1/3 délky vývodu. V případě segmentální stenózy pankreatického vývodu je poststenotická dilatace vývodu vzácná, na rozdíl od karcinomu pankreatu, kde je nález poststenotické dilatace častý [23,24]. Délka stenózy pankreatického vývodu je větší než u karcinomu pankreatu a dosti typickým nálezem pro AIP je zobrazení odstupujících sekundárních větví z oblasti stenózy vývodu. Kontroverzní jsou názory na diagnostický význam histologických nálezů z biopsií odebraných z oblasti Vaterovy papily, ve kterých bývá přítomnost plazmocytů s pozitivitou IgG4 uváděna jako možný podporující znak autoimunitní pankreatitidy [25,26].
Histomorfologie
AIP typ 1 – lymfoplazmocytární sklerozující forma nebo jako granulocytoepiteliální léze negativní – má v histomorfologickém obraze následující typické znaky: a) masivní fibrózu; b) periduktální infiltraci plazmatickými buňkami a lymfocyty; c) venulitidu a cévní obliterace na základě útlaku cév masivní buněčnou infiltrací parenchymu imunoglobulin G4 pozitivními plazmatickými buňkami [5].
AIP typ 2 – idiopatická pankreatitida centrálního duktu nebo také jako AIP forma s pozitivními granulocytoepiteliálními lézemi – se od AIP typu 1 odlišuje právě výlučnou pozitivitou intraepiteliální přítomnosti neutrofilů v epiteliích vývodů. Právě tato masivní přítomnost neutrofilů v pankreatických acinech a malých pankreatických vývodech je příčinou jejich obliterace a následné destrukce žlázy [27]. Přítomnost IgG4 pozitivních plazmatických buněk je ve tkáni velmi nízká, hladina IgG4 v séru bývá normální. Klinické rozdíly mezi oběma typy autoimunitní pankreatitidy ukazuje tab. 1. Zmíněný histologický obraz odlišuje AIP od pankreatického karcinomu, ale přítomnost pankreatického karcinomu v terénu AIP byla opakovaně pozorována (tab. 2).
Tab. 1. Přehled klinických charakteristik autoimunitní pankreatitidy 1. a 2. typu. Tab. 1. Overview of the clinical characteristics of autoimmune pancreatitis type 1 and 2. 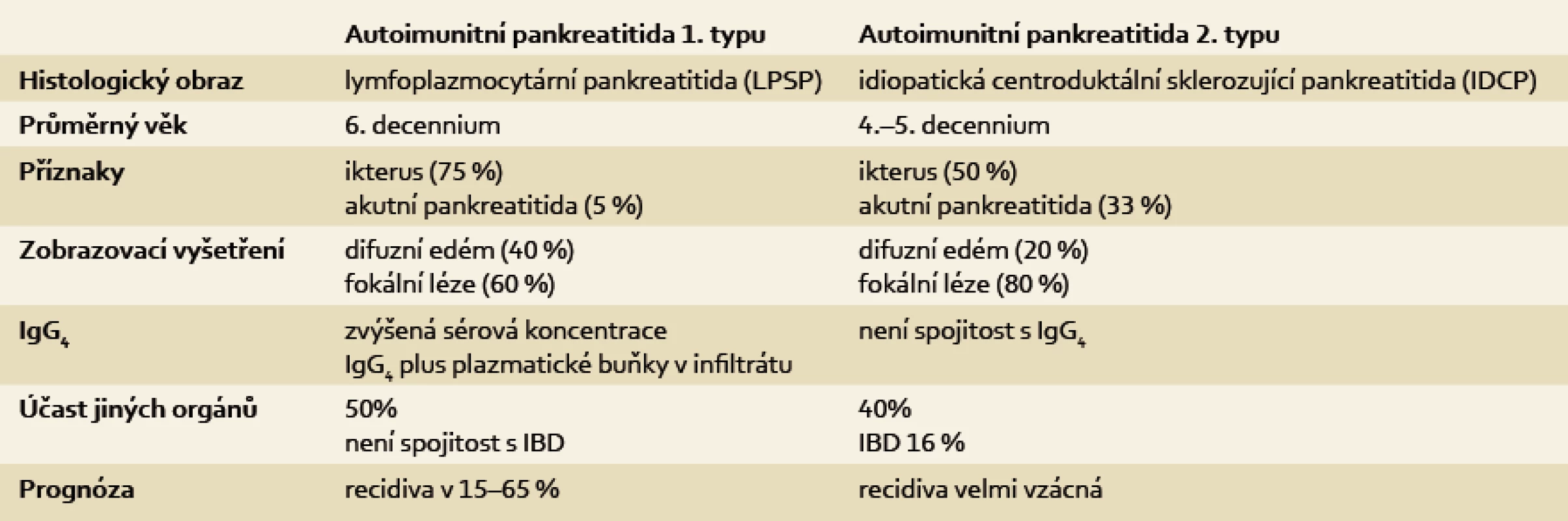
IBD – chronické zánětlivé onemocnění střev Tab. 2. Histopatologická kritéria pro diagnostiku autoimunitní pankreatitidy 1. a 2. typu. Tab. 2. Histopathological criteria for the diagnosis of autoimmune pancreatitis type 1 and 2. 
LPSP – lymfoplazmocytární sklerozující pankreatitida, IDCP – idiopatická centroduktální pankreatitida Extrapankreatické znaky
Autoimunitní forma pankreatitidy je provázena extrapankreatickými příznaky. Naitoh et al [28] prokázali, že právě přítomnost extrapankreatických příznaků v diferenciální diagnostice je významným faktorem svědčícím pro diagnózu AIP proti karcinomu. Diferenciální diagnostika AIP a karcinomu pankreatu na základě publikovaných nálezů klinického sledování, biochemických markerů, zobrazovacích metod, histologického obrazu a efektu léčby steroidy jsou shrnuty v tab. 3 [11]. Je na místě podotknout, že je pouze orientační a nelze použít absolutně.
Tab. 3. Diferenciální diagnostika aiP a karcinomu pankreatu. Upraveno podle Psarrase et al [11]. Tab. 3. Differential diagnosis of AIP and pancreatic cancer. Adapted by Psarras et al [11]. ![Diferenciální diagnostika aiP a karcinomu pankreatu. Upraveno podle Psarrase et al [11].
Tab. 3. Differential diagnosis of AIP and pancreatic cancer. Adapted by Psarras et al [11].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/bea062d88f62ec8946591f4f49930f20.png)
Závěr
Diferenciální diagnostika mezi pankreatickým karcinomem a fokální formou autoimunitní pankreatitidy je velmi obtížná a někdy i nemožná. Konsenzuálně schválená a zveřejněná kritéria AIP jsou významným přínosem v diagnostice a z praktického hlediska umožňují nastavit správnou strategii léčby včetně možnosti ochránit nemocné před zbytečnou pankreatickou resekcí stejně tak jako diagnostikovat karcinom pankreatu. Přesto je potřeba zmínit, že existují dva strategické pohledy, jak přistoupit k diferenciální diagnostice AIP.
Diferenciálně diagnostický přístup doporučený Charim et al [29] logicky vychází z HISORt kritérií diagnostiky AIP [30] a doporučuje použití pankreatické biopsie (core biopsy). Iniciální roli v rozhodnutí se, jaké diagnostické schéma zvolit, má vyšetření počítačovou tomografií. U osob s významnými známkami AIP, tj. včetně přítomnosti mimopankreatických orgánových lézí a pozitivní sérologie, je bez dalšího vyšetření nasazena terapie steroidy a je sledován jejich terapeutický efekt. U osob, kde lze nálezy označit jako nejasné, neúplné, hraniční a v případě, že není přítomen žádný z typických markerů AIP, je doporučeno provést biopsii pankreatu. V případě vysoké klinické a laboratorní pravděpodobnosti pankreatického karcinomu je postupováno, jako by se jednalo o karcinom a nikoli o možnou AIP. Jako zvláště významná je u těchto osob považována nepřítomnost extrapankreatických orgánových lézí podporující diagnózu pankreatického karcinomu.
Japonský přístup k diferenciální diagnostice AIP a pankreatického karcinomu je podmíněn místně používanými kritérii pro diagnózu AIP [24]. Japonské doporučení spočívá v hodnocení anamnestických dat, radiologických změn (CT, ERCP) a sérologických odchylek s cílem stanovení počtu pozitivních znaků. Tento přístup počítá s významnou diagnostickou výpovědí rolí endoskopické retrográdní cholangiopankreatografie. Jestliže nejsou nalezena žádná z hlavních diagnostických kritérií AIP, nemocný je dále vyšetřován a léčen na karcinom pankreatu. U nejasného nálezu, tj. při 1–2 příznacích svědčících pro AIP a negativní hladině IgG4 nebo při vysoké hladině IgG4 a pouze jednom přítomném příznaku AIP, je z důvodu podezření na AIP doporučena tenkojehlová biopsie pankreatu. Jestliže je biopsie negativní nebo když jsou přítomny dva typické znaky a IgG4 v séru je vysoké, resp. jsou-li zjištěny tři typické znaky AIP, je zahájena terapie steroidy. Není-li odpověď na steroidy relevantní, je nutno opakovat celý diagnostický algoritmus znovu. Obecně lze shrnout, že ani jeden z uvedených přístupů nedává absolutní záruku ve správnosti diagnózy, japonský přístup je jednodušší, ale je samozřejmě značně dependentní kvalitě vyšetřujícího radiologa a endoskopisty. Přístup skupiny Charito je zřejmě komplexnější, ale stejně i zde je limitace v efektivnosti core-biopsie pankreatu [31]. Sami máme zkušenost, že pacient s typickými znaky AIP a s negativním nálezem ve smyslu malignity při tenkojehlové biopsii pankreatu byl léčen steroidy s evidentním zlepšením klinického a laboratorního nálezu. Při kontrolním vyšetření za šest měsíců od stanovení diagnózy AIP bylo při endosonografickém vyšetření vysloveno podezření na pankreatickou malignitu. Peroperačně byl prokázán adenokarcinom pankreatu, i když sérová hladina IgG4 byla více než trojnásobek normy (417,0 mg/dl).
Z uvedeného lze uzavřít, že i přes jasně daná diagnostická kritéria AIP je diferenciální diagnostika mezi AIP a pankreatickým karcinomem stále fenomén „ars medicae“ vyžadující multidisciplinární přístup pro zajištění co nejvyšší diagnostické spolehlivosti [32–34].
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 5. 9. 2014
Přijato: 7. 10. 2014
prof. MUDr. Petr Dítě, DrSc.
Akademické centrum gastroenterologie
Interní klinika LF OU a FN Ostrava
17. listopadu 5/1790, 708 52 Ostrava
pdite.epc@gmail.com
Zdroje
1. Umehara H, Okazaki K, Masaki Y et al. Comprehensive diagnostic criteria for IgG4-related disease (IgG4-RD), 2011. Mod Rheumatol 2012; 22(1): 22–30. doi: 10.1007/s10165-011-0571-z.
2. Umehara H, Okazaki K, Masaki Y et al. A novel clinical entity, IgG4-related disease (IgG4RD): general concept and details. Mod Rheumatol 2012; 22(1): 1–14. doi: 10.1007/s10165-011-0508-6.
3. Vlachou PA, Khalili K, Jang HJ et al. IgG4-related sclerosing disease: autoimmune pancreatitis and extrapancreatic manifestation. Radiographics 2011; 31(5): 1379–1402. doi: 10.1148/rg.315105735.
4. Kamisawa T, Egawa N, Nakajima H et al. Clinical difficulties in the differentiation of autoimmune pancreatitis and pancreatic carcinoma. Am J Gastroenterol 2003; 98(12): 2694–2699.
5. Shimosegawa T, Chari ST, Frulloni L et al. International consensus diagnostic criteria for autoimmune pancreatitis: guidelines of the International Association of Pancreatology. Pancreas 2011; 40(3): 352–358. doi: 10.1097/MPA.0b013e3182142fd2.
6. Hamano H, Kawa S, Horiuchi A et al. High serum IgG4 concentrations in patiens with sclerosing pancreatitis. N Engl J Med 2001; 344(10): 732–738.
7. Ghazale A, Chari ST, Smyrk TC et al. Value of serum IgG4 in diagnosis of autoimmune pancreatitis and in distinguishing it from pancreatic cancer. Am J Gastroenterol 2007; 102(8): 1646–1653.
8. Raina A, Krasinskas A, Greer JB et al. Serum immunoglobulin G fraction 4 levels in pancreatic cancer: elevations not associated with autoimmune pancreatitis. Arch Pathol Lab Med 2008; 132(1): 48–53. doi: 10.1043/1543-2165(2008)132[48:SIGFLI]2.0.CO;2.
9. Kamisawa T, Chen PY, Tu Y et al. Pancreatic cancer with a high serum IgG4 concentration. World J Gastroenterol 2006; 12(38): 6225–6228.
10. Sugumar A, Takahashi NB, Chari ST et al. Distinguishing pancreatic cancer from autoimmune pancreatitis. Curr Gastroenterol Rep 2010; 12(2): 91–97. doi: 10.1007/s11894-010-0098-z.
11. Psarras K, Baltatzis ME, Pavlidis ET et al. Autoimmune pancreatitis versus pancreatic cancer: a comprehensive review with emphasis on differential diagnosis. Hepatobiliary Pancreat Dis Int 2011; 10(5): 465–473.
12. Wakabayashi T, Kawaura Y, Satomura Y et al. Clinical and imaging features of autoimmune pancreatitis with focal pancreatic swelling or mass formation: comparison with so-called tumor-forming pancreatitis and pancreatic carcinoma. Am J Gastroenterol 2003; 98(12): 2679–2687.
13. Dite P, Novotny I, Kala Z et al. The serological positivity of immunoglobulin G4 in patients with autoimmune pancreatitis and pancreatic carcinoma. [In press].
14. Yamamoto M, Takahashi H, Tabeya T et al. Risk of malignancies in IgG4-related disease. Mod Rheumatol 2012; 22(3): 414–418. doi: 10.1007/s10165-011-0520-x.
15. Shiokawa M, Kodama Y, Yoshimura K et al. Risk of cancer in patients with autoimmune pancreatitis. Am J Gastroenterol 2013; 108(4): 610–617. doi: 10.1038/ajg.2012.465.
16. Pezzilli R, Vecchiarelli S, Di Marco MC et al. Pancreatic ductal adenocarcinoma associated with autoimmune pancreatitis. Case Rep Gastroenterol 2011; 5(2): 378–385. doi: 10.1159/000330291.
17. Loos M, Esposito I, Hedderich DM et al. Autoimmune pancreatitis complicated by carcinoma of the pancreatobiliary system: a case report and review of the literature. Pancreas 2011; 40(1): 151–154. doi: 10.1097/MPA.0b013e3181f74a13.
18. Witkiewicz AK, Kennedy EP, Kennyon I et al. Synchronous autoimmune pancreatitis and infiltrating pancreatic ductal adenocarcinoma: case report and review of the literature. Hum Pathol 2008; 39(10): 1548–1551. doi: 10.1016/j.humpath.2008.01.021.
19. Kawamoto S, Siegelman SS, Hruban RH et al. Lymphoplasmacytic sclerosing pancreatitis (autoimmune pancreatitis), evaluation with multidetector CT. Radiographics 2008; 28(1): 157–170. doi: 10.1148/rg.281065188.
20. Takahashi N, Fletcher JG, Fidler JL et al. Dual-phase CT of autoimmune pancreatitis: a multireader study. Am J Roentgenol 2008; 190(2): 280–286. doi: 10.2214/AJR.07.2309.
21. Mariappan YK, Glaser KJ, Ehman RL. Magnetic resonance elastography: a review. Clin Anat 2010; 23(5): 497–511. doi: 10.1002/ca.21006.
22. Otsuki M, Chung JB, Okazaki K et al. Asian diagnostic criteria for autoimmune pancreatitis: consensus of the Japan-Korea Symopsium on autoimmune pancreatitis. J Gastroenterol 2008; 43(6): 403–408. doi: 10.1007/s00535-008-2205-6.
23. Sugumar A, Levy MJ, Kamisawa T et al. Endoscopic retrograde pancreatography criteria to diagnose autoimmune pancreatitis: an international multicentre study. Gut 2011; 60(5): 666–670. doi: 10.1136/gut.2010.207951.
24. Kamisawa T, Imai M, Yui Chen P et al. Strategy for differentiating autoimmune pancreatitis from pancreatic cancer. Pancreas 2008; 37(3): e62–e67. doi: 10.1097/MPA.0b013e318175e3a0.
25. Rebours V, Le Baleur Y, Cazals-Hatem D et al. Immunoiglobulin G4 immunostaining of gastric, duodenal, or colonic biopsies is not helpful for the diagnosis of autoimmune pancreatitis. Clin Gastroenterol Hepatol 2012; 10(1): 91–94. doi: 10.1016/j.cgh.2011.09.008.
26. Kim MH, Moon SH, Kamisawa T et al. Major duodenal papilla in autoimmune pancreatitis. Dig Surg 2010; 27(2): 110–114. doi: 10.1159/000286573.
27. Chari ST, Kloeppel G, Zhang L et al. Histopathologic and clinical subtypes of autoimmune pancreatitis: the Honolulu consensus document. Pancreas 2010; 39(5): 549–554. doi: 10.1097/MPA.0b013e3181e4d9e5.
28. Naitoh I, Nakazawa T, Ohara H et al. Clinical singnificance of extrapancreatic lesions in autoimmune pancreatitis. Pancreas 2010; 39(1): e1–e5. doi: 10.1097/MPA.0b013e3181bd64a1.
29. Chari ST, Takahashi N, Levy MJ et al. A diagnostic strategy to distinguish autoimmune pancreatitis from pancreatic cancer. Clin Gastroenterol Hepatol 2009; 7(10): 1097–1103. doi: 10.1016/j.cgh.2009.04.020.
30. Chari ST, Smyrk TC, Levy MJ et al. Diagnosis of autoimmune pancreatitis: the Mayo Clinic experience. Clin Gastroenterol Hepatol 2006; 4(8): 1010–1016.
31. Agrawal S, Daruwala C, Khurana J. Distinguishing autoimmune pancreatitis from pancreatobiliary cancers: current strategy. Ann Surg 2012; 255(2): 248–258. doi: 10.1097/SLA.0b013e3182324549.
32. Khalid A, Dewitt J, Ohori NP et al. EUS-FNA mutational analysis in differentiating autoimmune pancreatitis and pancreatic cancer. Pancreatology 2011; 11(5): 482–486. doi: 10.1159/000331505.
33. Kim JH, Kim MH, Byun JH et al. Diagnostic strategy for differentiating autoimmune pancreatitis from pancreatic cancer: is an endoscopic retrograde pancreatography essential? Pancreas 2012; 41 : 639–647.
34. Nishino T, Oyama H, Toki F et al. Differentiation between autoimmune pancreatitis and pancreatic carcinoma based on endoscopic retrograde cholangiopancreatography findings. J Gastroenterol 2010; 45(9): 988–996. doi: 10.1007/s00535-010-0250-4.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článek Zimní mix...Článek KvízČlánek Správná odpověď na kvízČlánek DR. BARES AWARDČlánek Poděkování recenzentům
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2014 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Zimní mix...
- SOUTĚŽ O NEJLEPŠÍ KAZUISTIKU 2015
- Kvíz
- Vedolizumab – nová antiintegrinová protilátka s vysokou gastrointestinální selektivitou
- OVESCO klip jako řešení komplikace ERCP
- Neobvyklý zdroj krvácení do gastrointestinálního traktu
- Problematika diferenciální diagnostiky autoimunitní formy pankreatitidy a pankreatického adenokarcinomu
- Standardní diagnostický a terapeutický postup chronické infekce virem hepatitidy C
- Doporučený postup diagnostiky a léčby chronické hepatitidy B
- Správná odpověď na kvíz
- Perorálna endoskopická myotómia (POEM) v liečbe achalázie na Slovensku
- Zpráva o celorepublikovém mezilaboratorním porovnání vyšetření fekálního kalprotektinu
- Podzimní pracovní den České hepatologické společnosti
- Karlovy Vary gastroenterologické – letos už potřinácté
- DR. BARES AWARD
- International professional competition Dr. Bares Award lived to see the 20th anniversary
- Poděkování recenzentům
- Anketa spokojenosti čtenářů časopisu Gastroenterologie a hepatologie
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- OVESCO klip jako řešení komplikace ERCP
- Perorálna endoskopická myotómia (POEM) v liečbe achalázie na Slovensku
- Neobvyklý zdroj krvácení do gastrointestinálního traktu
- Vedolizumab – nová antiintegrinová protilátka s vysokou gastrointestinální selektivitou
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



