-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Molekulárně spektroskopická analýza krevní plazmy – cesta k diagnostice karcinomu pankreatu?
Molecular spectroscopy of blood plasma – towards the diagnostics of pancreatic cancer?
Pancreatic cancer is a malignancy with a poor prognosis and is estimated to become one of the leading causes of death from cancer by the end of the decade. Only early diagnosis may alter this adverse trend. To select a group of patients at risk of pancreatic cancer, an effective biomarker is required. The main objective of the pilot study is to identify a new specific spectral biomarker of pancreatic cancer using unpolarized methods of molecular spectroscopy (Raman spectroscopy) in combination with chiroptical methods that are inherently sensitive to structural changes of chiral molecules (electronic circular dichroism and Raman optical activity).
Methods:
Blood samples were collected from 10 patients with pancreatic cancer and 23 healthy controls. Subsequently, blood plasma was separated and preserved. The obtained samples were analysed using a combination of chiroptical and vibrational spectroscopies.Results:
In a pilot study with a limited number of samples, the sensitivity of the established statistical model reached 85–90% after cross-validation. The results are better in comparison with so far the only clinically available biomarker CA-19-9.Conclusion:
The obtained results are suitable for further testing in a larger group of patients. The spectroscopic examination of high-risk patients may form part of a screening process.Key words:
pancreatic cancer – blood plasma – biomarkers – spectroscopy – circular dichroism – Raman optical activity – chirality
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
5. 11. 2015Accepted:
30. 11. 2015
Autori: B. Bunganič 1; L. Šťovíčková 2; M. Tatarkovič 2; L. Kocourková 2; Š. Suchánek 1; P. Frič 1; V. Setnička 2; M. Zavoral 1
Pôsobisko autorov: Interní klinika 1. LF UK a ÚVN – VFN v Praze 1; Ústav analytické chemie, VŠCHT v Praze 2
Vyšlo v časopise: Gastroent Hepatol 2015; 69(6): 518-524
Kategória: Gastrointestinální onkologie: původní práce
doi: https://doi.org/10.14735/amgh2015518Súhrn
Karcinom pankreatu je nádorové onemocnění s nepříznivou prognózou. Odhaduje se, že se do konce desetiletí stane jednou z hlavních příčin úmrtí na nádorová onemocnění vůbec. Pouze časná diagnostika může tento nepříznivý trend změnit. K selekci rizikové skupiny pacientů je potřeba efektivního biomarkeru. Cílem pilotní studie je nalezení nových specifických spektrálních markerů karcinomu pankreatu použitím nepolarizovaných metod molekulové spektroskopie (Ramanova spektroskopie) v kombinaci s chiroptickými metodami citlivými ke strukturním změnám chirálních molekul (elektronový cirkulární dichroismus a Ramanova optická aktivita).
Metody:
U 10 pacientů s karcinomem pankreatu a 23 zdravých kontrol byl proveden odběr krve s následnou separací a konzervací získaného materiálu. Kombinací metod chiroptické a vibrační spektroskopie byly vyšetřeny vzorky pacientů i kontrol.Výsledky:
V pilotní studii s omezeným počtem vzorků bylo použitím statistického modelu dosaženo po křížové validaci 85 – 90% senzitivity, tedy lepší ve srovnání s doposud jediným klinicky dostupným biomarkerem CA 19-9.Závěr:
Získané výsledky jsou vhodné k dalšímu testování na větším souboru pacientů. Spektroskopické vyšetření rizikových pacientů by mohlo být součástí screeningového procesu.Klíčová slova:
nádory slinivky břisní – krevní plazma – biologické markery – spektroskopie – cirkulární dichroismus – Ramanova optická aktivita – chiralitaÚvod
Incidence a mortalita karcinomu pankreatu (KP) v ČR i ve světě narůstá. Podle odhadů se do roku 2020 stane KP druhou nejčastější příčinou úmrtí na nádorová onemocnění [1]. Z důvodu, že až 80 % pacientů s KP je v čase diagnózy ve stadiu generalizace, blíží se mortalita KP ke 100 % a je téměř shodná s incidencí [2]. Bez možnosti chirurgické léčby, jediné efektivní terapie KP, je prognóza nepříznivá [3]. Pacienti s časným neinvazivním KP dosahují po operaci významně lepšího přežití ve srovnání z pozdním stadiem (85,7 % pro stadium 0; 68,7 % pro stadium Ia; 23,8 % v případě stadia Ib a 2,3 % pro pozdní stadia) (tab. 1) [1,4].
Tab. 1. Pětileté přežití u karcinomu pankreatu podle klinických stadií. Tab. 1. Five-year survival rate for pancreatic cancer according to clinical stages. 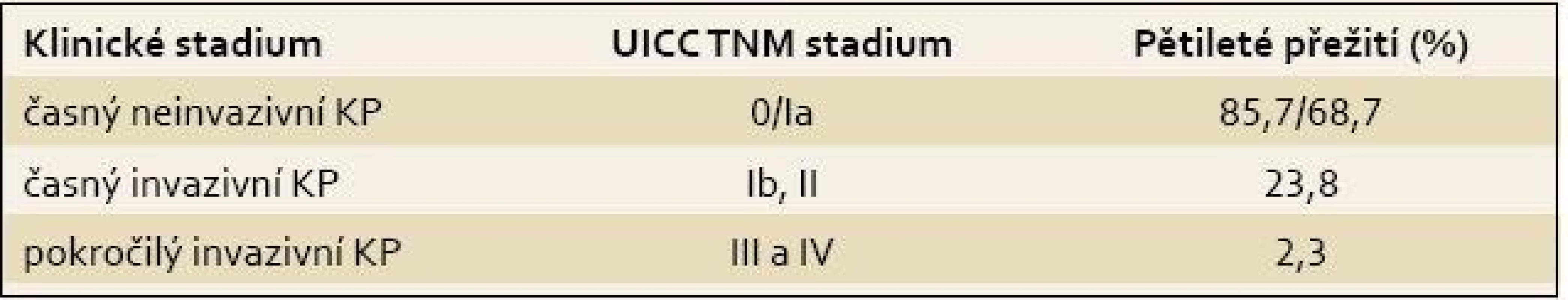
KP – karcinom pankreatu Moderní diagnostické postupy – zobrazovací metody a biomarkery – jsou neefektivní, neboť bývají aplikovány pozdě, teprve až po objevení klasických symptomů KP – ikteru, cholangitidy, kachexie či bolestí břicha a zad [5].
Na druhou stranu jsou známy i časné symptomy KP, které však zatím nenacházejí klinické využití. U většiny pacientů s KP se přitom objevují 2 – 3 roky před diagnózou [6 – 9]. I přes dostatečně dlouhé diagnostické okno je detekce časného KP nedostatečná a odráží se v malém počtu zachycených časných klinických stadií. V roce 2012 bylo v ČR evidováno pouze 4,7 % pacientů ve stadiu I a 11,3 % ve stadiu II [4]. Diagnostika KP tedy nadále spoléhá pouze na sérové biomarkery s nízkou efektivitou a zobrazovací metody. Protože žádný z biomarkerů nedosahuje dostatečné senzitivity a specificity, nemůže být použit ve screeningovém programu ani u pacientů s vysokým rizikem KP. Např. karbohydrát antigen 19-9 (CA 19-9) ze skupiny glykoproteinových biomarkerů KP (MUC – mucin core proteins) je dle doporučení European Society for Medical Oncology z roku 2015 vhodný pouze k odhadu prognózy a sledování odpovědi na léčbu a ne k časné diagnostice KP [10]. Hledání biomarkerů ze skupiny MUC, miRNA (inhibitor messengerové ribonukleové kyseliny) a cirkulujících nádorových buněk je předmětem celé řady současných preklinických i klinických studií [11 – 14]. Souběžně nacházejí značné uplatnění genomické a proteomické diagnostické metody [15 – 18]. Nedávné proteomické studie se zaměřily na hledání sérového biomarkeru časného stadia KP. Od zdravé populace je možné nemocné s časným karcinomem odlišit např. na základě sledování rozdílů signálů a změn 3D struktury plazmatických biomolekul [19,20]. Analýza krevní plazmy jako celku (všech obsažených biomolekul, ne pouze jednoho biomarkeru) je metoda s velkým potenciálem pro diagnózu KP na molekulární úrovni. Cílem naší pilotní studie je nalezení nových specifických spektrálních markerů KP použitím nepolarizovaných metod molekulové spektroskopie (Ramanova spektroskopie) v kombinaci s chiroptickými metodami citlivými ke strukturním změnám chirálních molekul (elektronový cirkulární dichroismus a Ramanova optická aktivita) [17]. Kombinací těchto metod lze pozorovat stereochemické a konformační změny nejen plazmatických, ale i jiných cirkulujících biomolekul a jejich metabolitů [20].
Materiál a metody
Pacienti
Do této pilotní studie bylo zařazeno 10 pacientů s KP a 23 kontrolních jedinců, jejichž výběr byl proveden na Interní klinice 1. LF UK a ÚVN – VFN v Praze. Průměrný věk pacientů s KP a kontrol byl 66 ± 7 let, resp. 61 ± 8 let. Pacienti s KP byli vyšetřeni dle doporučených postupů, vč. cytologické verifikace karcinomu [21]. V rámci stagingu bylo doplněno CT břicha s intravenózní a perorální kontrastní látkou s použitím třífázového pankreatického protokolu [22]. Hodnocení bylo prováděno zkušeným cytopatologem a radiologem. Ve všech případech se jednalo o pokročilá stadia III a IV dle TNM klasifikace. V rámci odběru krve bylo provedeno základní biochemické vyšetření, vč. stanovení hladiny sérového albuminu, celkové bílkoviny, glykemie a hladiny CA 19-9. Kontrolní skupinu tvořili zdraví dárci, s vyrovnanou distribucí obou pohlaví. Všem kontrolním jedincům byla rovněž provedena základní klinická vyšetření vč. podrobné anamnézy a laboratorní analýzy krve. Na základě výsledků těchto vyšetření nebylo shledáno podezření na KP ani diabetes. Studie byla provedena v souladu se zásadami uvedenými v Helsinské deklaraci a schválena Etickou komisí ÚVN – VFN v Praze. Všichni jedinci zařazení do studie podepsali informovaný souhlas.
Krevní plazma
Po endosonografickém vyšetření byla všem pacientům odebrána žilní krev do sterilních, antikoagulantem ošetřených odběrových zkumavek (BD Vacutainer Systems, Velká Británie). Po odběru byla provedena centrifugace vzorků při 1 500 g po dobu 10 min; následně byly získané frakce krevní plazmy zamrazeny, transportovány v termoboxu při teplotě suchého ledu ( – 78 °C) na Ústav analytické chemie, VŠCHT v Praze, kde byly nadále skladovány v hlubokomrazicím boxu při teplotě – 80 °C. Před každou analýzou byly vzorky plazmy volně rozmrazeny při pokojové teplotě a pro odstranění reziduálních částic filtrovány přes PVDF membránový filtr s porozitou 0,45 µm (Grace, USA) při 13 000 g po dobu 10 min.
Ramanova optická aktivita a Ramanova spektroskopie
Ramanova spektra a spektra Ramanovy optické aktivity byla zaznamenávána simultánně na spektrometru ChiralRAMAN-2XTM (BioTools, Inc., USA), který je vybaven systémem Opus 2W/ mpc6000 (Laser Quantum, Velká Británie) s excitační vlnovou délkou 532 nm. Zfiltrované vzorky krevní plazmy (100 µl) byly měřeny v kyvetě o rozměrech 4 × 4 × 10 mm ošetřené antireflexní vrstvou (BioTools, Inc., USA). Teplota analyzovaného vzorku (15 °C) byla kontrolována pomocí Peltierova článku vlastní výroby. Pro získání kvalitních spekter s rozlišením ~ 7 cm– 1 ve spektrálním rozsahu 2 500 – 90 cm– 1 jsme vyvinuli metodiku měření [19] sestávající z přídavku zhášedla fluorescence, vysvěcování vzorku laserem pro urychlení zhášení fluorescence a záznamu spekter. Pro eliminaci zbytkové distorze pozadí bylo využito Fourierova filtru.
Elektronový cirkulární dichroismus
Analýzy elektronového cirkulárního dichroismu (ECD) byly provedeny na spektrometru J-815 (Jasco, Japonsko), který umožňuje kontrolu teploty vzorků. Pro měření při kratších vlnových délkách byly zfiltrované vzorky naředěny v poměru 1 : 3 v/ v sterilním fosfátovým pufrem o pH = 7,4. Zředěné vzorky (20 µl) byly analyzovány v křemenné kyvetě s délkou optické dráhy 0,01 mm (Hellma, Německo) v oblasti 185 – 260 nm. Pro každý vzorek bylo zaznamenáno šest spekter s rozlišením 0,1 nm; spektra byla následně zprůměrována v modulu Spectra Analysis programu Spectra Manager, verze 2.6.0.1 (Jasco, Japonsko).
Před spektrálním měřením a po něm byly všechny použité kyvety vyčištěny roztokem Starna CellClean (Starna Scientific Ltd., Velká Británie), opakovaně propláchnuty demineralizovanou vodou a metanolem a následně vysušeny.
Statistické zpracování
Pro odlišení pacientů s KP a kontrolní skupiny byla získaná spektrální data vyhodnocena s použitím lineární diskriminační analýzy v programu XLSTAT (Addinsoft, Francie). Pro vybrané oblasti spekter, ve kterých jsou obsaženy informace o struktuře plazmatických biomolekul a jejich možné změny, byl vytvořen statistický model. Zároveň byla stanovena senzitivita a specificita použitého klasifikačního modelu. K ověření jeho platnosti a vypovídací schopnosti byla rovněž provedena křížová validace typu leave-one-out a výpočet hodnot pro křivku ROC (receiver operating characteristics).
Výsledky
Ramanova spektroskopie
V průměrných Ramanových spektrech pacientů s KP a kontrolních jedinců (obr. 1) jsou patrné tři intenzivní pásy náležící především vibracím karotenoidů (1 006, 1 156 a 1 517 cm– 1), které jsou přítomny v plazmě v nízkých koncentracích. Vysoká intenzita těchto pásů v Ramanově spektru je zapříčiněna rezonančním zesílením po excitaci ve viditelné oblasti [23,24]. U skupiny kontrolních jedinců byla pozorována několikanásobně vyšší intenzita těchto pásů v porovnání s pacienty, což naznačuje možnou roli karotenoidů v procesu kancerogeneze. Ve spektrech je zároveň možné pozorovat změnu intenzity pásů typických pro proteiny s vysokým obsahem α-helikální struktury, a to především u 1 270 cm– 1 v oblasti rozšířeného amidu III, který odpovídá vibracím peptidové vazby [20,25]. V krvi rovněž přítomné sacharidy a lipidy jsou zastoupeny pásy 960 a 1 450 cm– 1 [20], jejichž intenzita byla nižší v případě pacientů s KP.
Obr. 1. Průměrná Ramanova spektra krevní plazmy pacientů s karcinomem pankreatu (čárkovaná čára) a kontrolních jedinců (plná čára). Fig. 1. The average Raman spectra of blood plasma from patients with pancreatic cancer (dashed line) and control subjects (solid line). 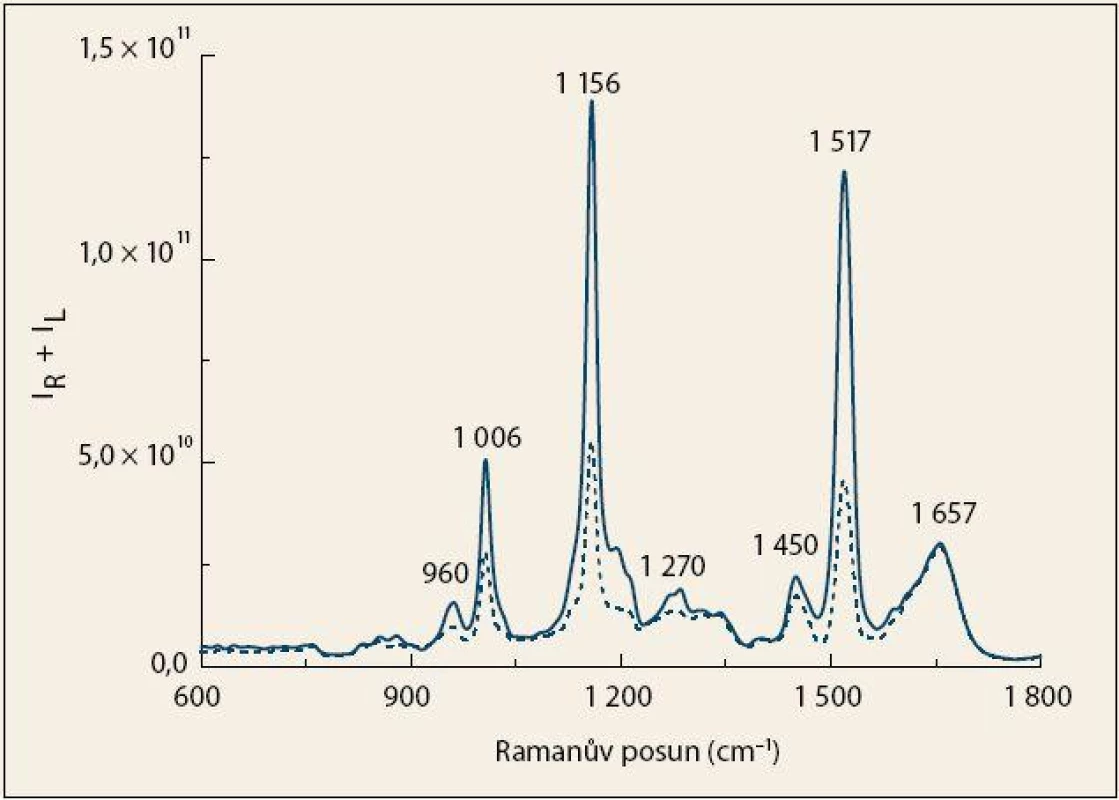
Ramanova optická aktivita
Ve spektrech Ramanovy optické aktivity (obr. 2) byla zaznamenána skupina pásů proteinů v oblastech amidu I (1 645, 1 674 cm– 1) a amidu III (1 248, 1 311, 1 345 cm– 1). Spektrální průběh v těchto oblastech je opět typický pro proteiny s vysokým obsahem α-helikálních struktur [15,16,20]. Výrazné pozitivní pásy 1 156 a 1 517 cm– 1 vyskytující se ve spektrech kontrolních jedinců mohou být přiřazeny karotenoidům, přičemž některé z nich se překrývají s pásy aromatických aminokyselin [20].
Obr. 2. Průměrná spektra ROA krevní plazmy pacientů s karcinomem pankreatu (čárkovaná čára) a kontrolních jedinců (plná čára). Fig. 2. The average ROA spectra of blood plasma from patients with pancreatic cancer (dashed line) and control subjects (solid line). 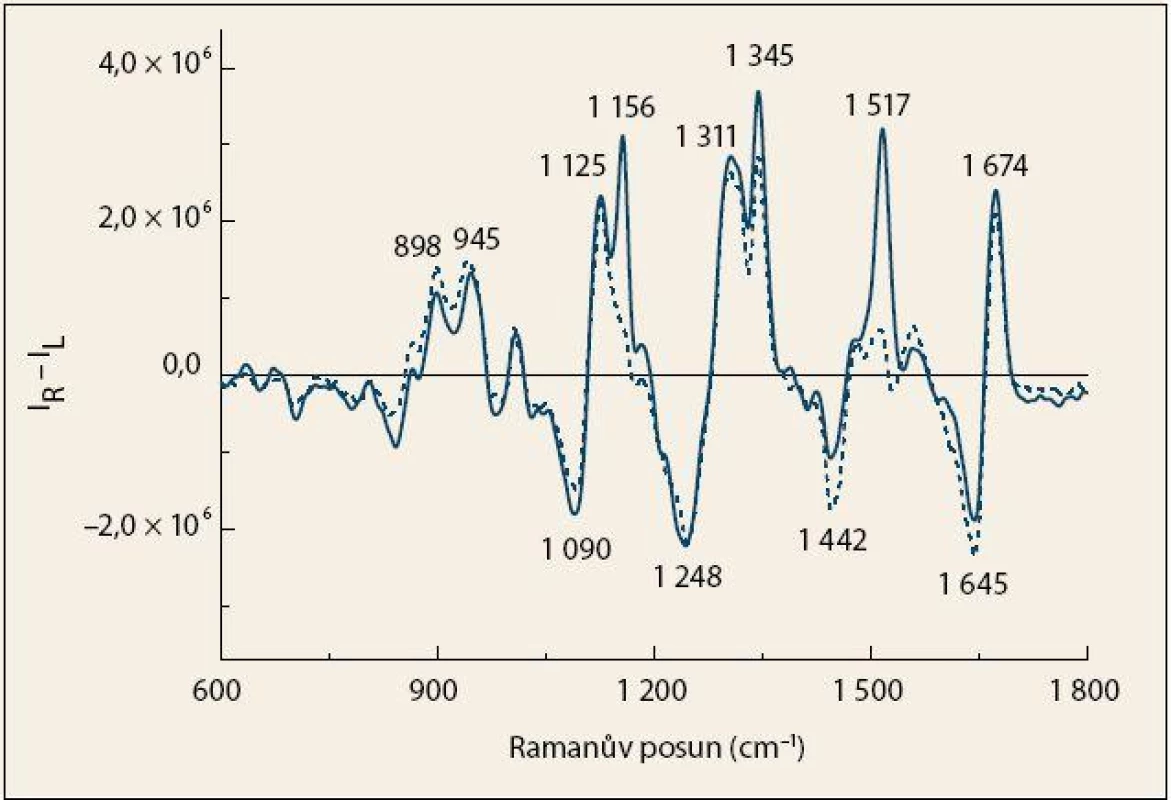
Elektronový cirkulární dichroismus
Ve spektrech ECD (obr. 3) dominují tři pásy charakteristické pro sekundární strukturu proteinů [17,23]. Pozitivní pás 192 nm a dva částečně se překrývající negativní pásy 209 a 222 nm jsou výsledkem elektronových přechodů v rámci peptidové vazby. Intenzita a tvar těchto pásů se mění v závislosti na konformaci peptidového řetězce [20,26]. Průběh spekter odpovídá proteinům s vysokým obsahem α-helikální struktury [17,27], které jsou v krvi zastoupeny převážně lidským sérovým albuminem. Je patrné, že v případě pacientů s KP mají všechny tři uvedené pásy nižší intenzitu než ve spektrech kontrolních jedinců.
Obr. 3. Průměrná spektra ECD krevní plazmy pacientů s karcinomem pankreatu (čárkovaná čára) a kontrolních jedinců (plná čára). Fig. 3. The average ECD spectra of blood plasma from patients with pancreatic cancer (dashed line) and control subjects (solid line). 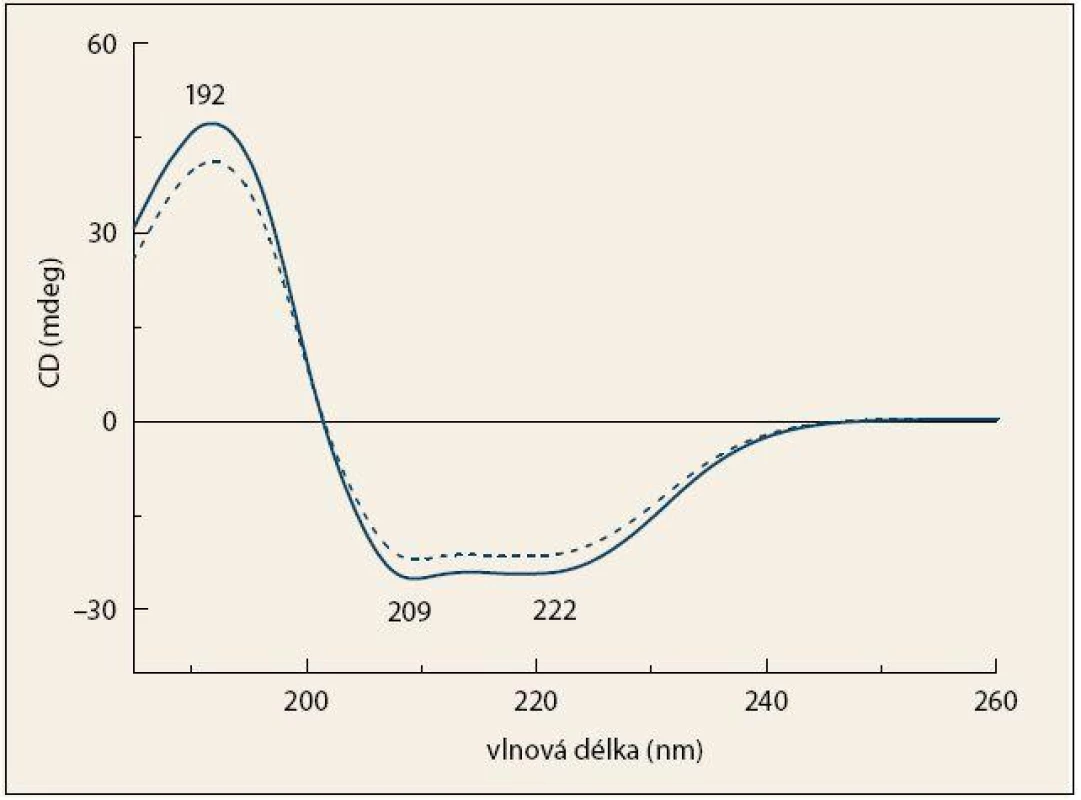
Lineární diskriminační analýza
Jelikož byly některé změny ve spektrech pacientů s KP a kontrolních jedinců obtížně pozorovatelné, byla získaná spektrální data vyhodnocena vícerozměrnými statistickými metodami. Cílem bylo odlišit pacienty od kontrolních jedinců na základě rozpoznání charakteristických spektrálních vzorů, určit senzitivitu a specificitu využitých spektroskopických metod a zároveň prokázat spolehlivost klasifikačního modelu vytvořeného pro kombinaci všech tří použitých metod.
Byla pozorována úplná separace skupiny pacientů s KP a kontrolních jedinců (obr. 4), přičemž celková správnost přiřazení jednotlivých vzorků do příslušných skupin činila 100 %. Specificita a senzitivita vytvořeného modelu dosahovaly vysokých hodnot i po provedení křížové validace, a to 90 %, resp. 87 % (tab. 2). Zároveň byly z křížové validace vypočteny hodnoty pro křivku ROC, kde plocha pod křivkou dosahovala hodnoty 0,907 (obr. 5).
Obr. 4. Grafické znázornění výsledku LDA pro kombinaci chiroptických metod (ECD, ROA) a konvenční Ramanovy spektroskopie v analýze krevní plazmy pacientů s karcinomem pankreatu (●) a kontrolních jedinců (▲). Fig. 4. Graph representation of the LDA result for the combination of chiroptical methods (ECD, ROA) and conventional Raman spectroscopy in the analysis of blood plasma from patients with pancreatic cancer (●) and control subjects (▲). 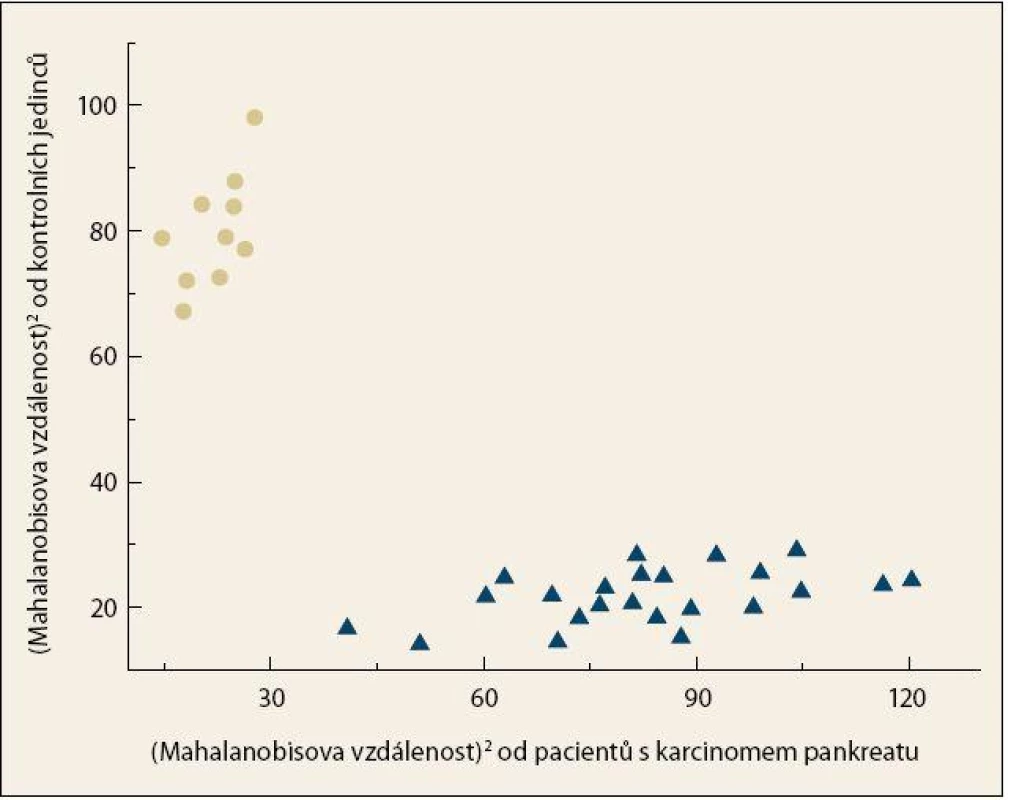
Tab. 2. Konfuzní matice výsledků křížové validace modelu LDA pro diskriminaci vzorků krevní plazmy pacientů s karcinomem pankreatu a kontrolních jedinců. Tab. 2. Confusion matrix of the LDA cross-validation results for the discrimination between blood plasma samples of patients with pancreatic cancer and control subjects. 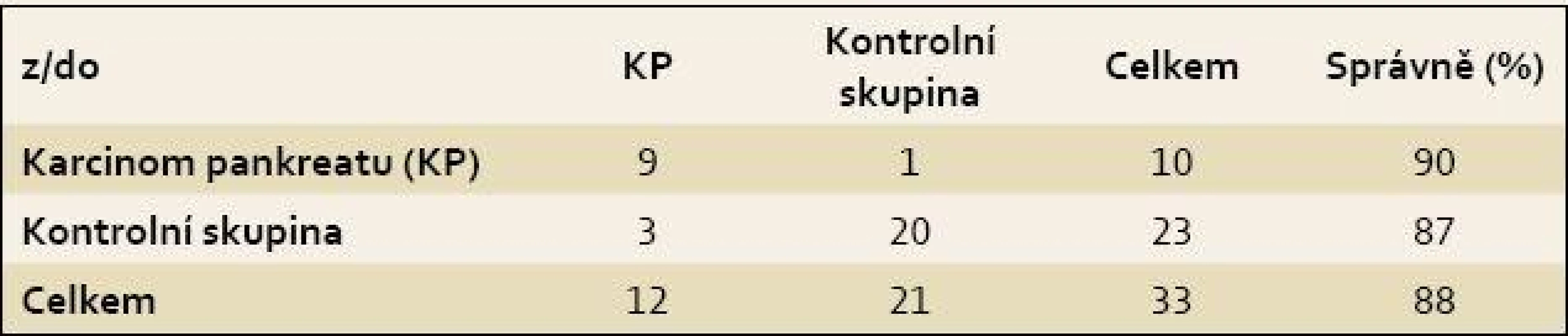
Obr. 5. Křivka ROC po křížové validaci LDA modelu pro diskriminaci vzorků krevní plazmy pacientů s KP a kontrolních jedinců; AUC = 0,907. Fig. 5. ROC curve after cross-validation of the LDA model for the discrimination of blood plasma samples in patients with pancreatic cancer and control subjects; AUC = 0.907. 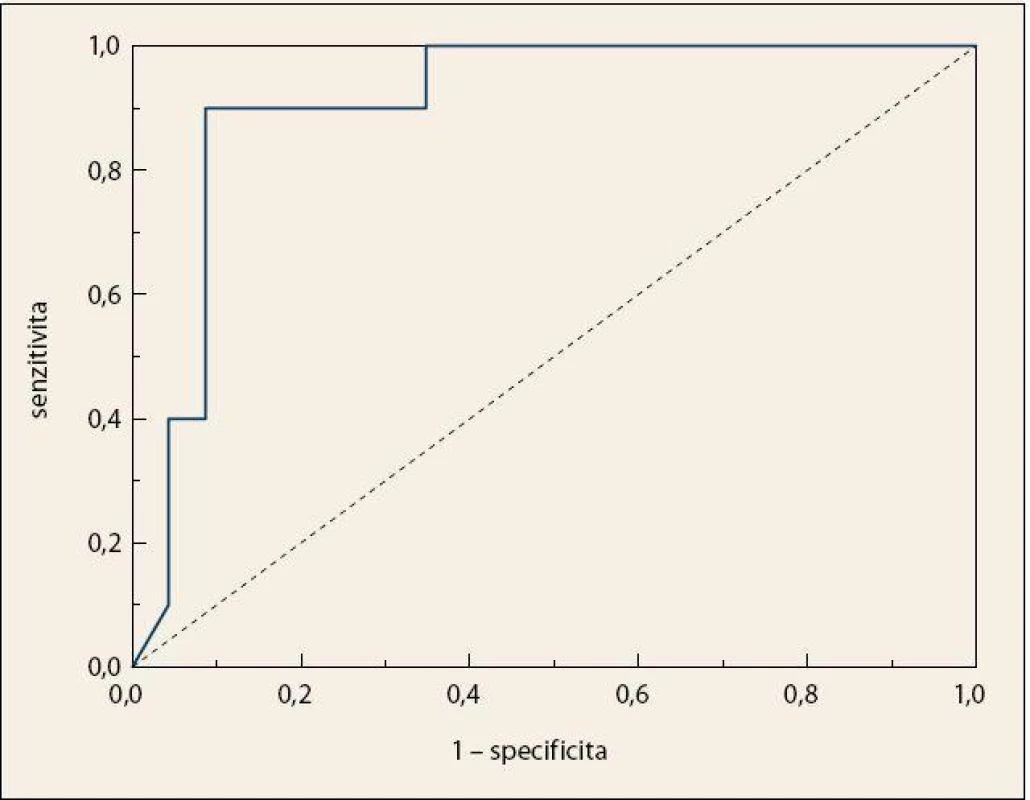
Diskuze
V naší pilotní studii byl pomocí kombinace pokročilých spektroskopických metod vytvořen klasifikační model, který dosahuje hodnot senzitivity a specificity ~ 90 %.
U symptomatických pacientů s KP je senzitivita CA 19-9 79 – 81 % a specificita 82 – 90 % [28]. Výzkumem časného KP bez typických symptomů bylo potvrzeno, že CA 19-9 není vhodný detekční nástroj časného KP, zejména pro jeho nízkou pozitivní prediktivní hodnotu (PPV) 0,5 – 0,9 % [29,30]. V rozsáhlém retrospektivním hodnocení 37 studií s 1 882 případů KP a kontrolní skupiny byla specificita CA 19-9 na úrovni 82,8 % [9]. Bohužel se v praxi také často setkáváme s falešně negativní hodnotou CA 19-9. Jedním z důvodů časté chybovosti je, že protilátka je vázána na oligosacharid – krevní antigen Lewis A. U 5 – 10 % pacientů s krevní skupinou A a antigenem Lewis A– / B– je hladina CA 19-9 u KP nižší než 1,0 U/ ml [31]. Příčinou falešné negativity CA 19-9 mohou být i jiné patologické stavy, např. jaterní cirhóza, cholangitida, chronická pankreatitida a další gastrointestinální tumory [32]. Ve fázi pilotního projektu byl sledovaný soubor pacientů malý a zároveň naměřené hodnoty CA 19-9 vykazovaly značný rozptyl (28,5 – 14 250 kU/ l) bez korelace se stadiem onemocnění. Kromě toho platí, že CA 19-9 není doporučen jako diagnostický biomarker [10]. Při předběžném hodnocení se však zdá, že naproti tomu spektrální biomarkery sledované v našem pilotním projektu nejsou zatíženy chybovostí, a to bez ohledu na hladinu bilirubinu, CRP či krevní skupinu, a je tedy možné je k diagnostice použít.
V současnosti bylo publikováno několik studií zabývajících se detekcí prekurzorů a premaligního stadia KP. Ze skupiny glykoproteinových mucinů dosáhl vysoké senzitivity a specificity MUC5AC u prekurzorových Pan-IN-1 lézí na myších modelech [12]. MUC je v séru pacientů s KP jen v omezeném množství a snaha o jejich detekci pomocí klasické immunoassay nepostačuje. Proto jsou testovány další techniky vhodné pro úpravy a měření vzorků (např. povrchem zesílená Ramanova spektroskopie), které jsou 100 – 1 000× citlivější než konvenční metody [11,33]. Mezi další aberantně exprimované muciny patří CA 50, CA 19-5, CA 125/ MUC16, CA 242, CAM 17.1, MUC4, MUC5AC, DUPAN 2, PAM4 a SPan-1. Pro sporné výsledky však zatím nejsou v klinické praxi využívány [13,14].
Další práce zabývající se časnou detekcí KP studovaly efektivitu miRNA. Rodinu miRNA tvoří asi 2 000 molekul, jejichž hlavní funkce spočívá v inhibici translace messengerové RNA (mRNA) a degradaci transkriptu. Byla prokázána exprese různých forem miRNA v plazmě jedinců s KP [18]. Kombinace některých miRNA s CA 19-9 dosahuje vyšší senzitivity než pro CA 19-9 samotné [34].
Zajímavé je zjištění, že již v časných fázích nádorové onkogeneze jsou v cirkulaci přítomné pankreatické buňky. Diseminace pankreatických buněk v prostředí časného KP je označována jako cirkulující pankreatické buňky (CPCs). Cirkulující přednádorové buňky se objevují u PanIN-1 a PanIN-2 a dokonce i u BRCA mutace. Rhim et al [35] ověřili sledované změny klinicky a prokázali CPCs asi u 30 % pacientů s intraduktální papilární mucinózní neoplazií (IPMN) zatím bez morfologických změn typických pro KP. Detekce CPCs v séru je také jedním z potenciálních biomarkerů časného stadia KP [36].
V našem pilotním projektu byly potvrzeny předpokládané rozdíly v signálech charakterizujících odlišnosti 3D struktury plazmatických bílkovin a dalších plazmatických biomolekul. Hlavní rozdíly byly zjištěny nejen v sekundární struktuře proteinů krevní plazmy, ale i dalších molekul jako lipidů, sacharidů, aromatických aminokyselin a karotenoidů. Zejména poslední zmiňovaná molekula byla v různých intenzitách zachycena v Ramanových spektrech i pomocí ROA. V plazmě pacientů s KP byla pozorována nízká intenzita karotenoidů. Účast karotenoidů v procesu onkogeneze zřejmě souvisí se změnou mikroprostředí a navozením dezmoplastické reakce aktivací stellate cells [37]. Tyto buňky jsou schopné se transformovat z klidového stadia do stadia aktivního, kdy se podílejí na fibroprodukci. Retinoidy na modelech KP u transgenních myší indukovaly vznik klidového stadia stellate cells, a tím navodily inhibici růstu KP [38]. Karotenoidy jsou těsně propojeny s nádorovou progresí KP a jak se ve fázi pilotního projektu zdá, jsou dobře definovatelné pomocí citlivých spektroskopických metod. Zjištění rozdílů v intenzitách spektrálních pásů karotenoidů mezi pacienty s KP a kontrolami má v tuto chvíli informativní charakter. Tento nález a jeho případnou korelaci s KP bude třeba řádně prozkoumat.
Hlavním limitem většiny studií zabývajících se biomarkery KP je samotné testování využívaných metod a postupů na detekci časného karcinomu u pokročilých stadií nádorů. I v této studii byl spektroskopický biomarker testován pouze u pozdních stadií KP, protože časná stadia se v diagnostické praxi vyskytují extrémně vzácně a do této pilotní studie nebylo možno takové pacienty zahrnout. Příslibem do budoucna by jistě mohl být navazující projekt testování pacientů s IPMN, které jsou pokládány za prekurzory KP.
Závěr
Časná diagnostika KP s cílem detekce operabilního stadia vyžaduje identifikaci efektivního biomarkeru. Je testováno několik kandidátů ze skupiny biomarkerů časného KP, ale zatím nejsou dostupné pro běžnou klinickou praxi. CA 19-9 je sice klinicky dostupný, ale jako marker časného karcinomu není vyhovující. V této studii byla testována specificita a senzitivita nového spektrálního biomarkeru charakterizovaného vybranými změnami všech biomolekul krevní plazmy. Pro obě sledované charakteristiky bylo dosaženo hodnot ~ 90 %, což je více než doposud publikované výsledky pro CA 19-9. Jedním z dalších úkolů je spektroskopické vyšetření rizikových pacientů s recentně diagnostikovanou poruchou glukózové tolerance, s premaligním stadiem karcinomu a familiárními rizikovými syndromy.
Tato studie byla realizována v rámci projektů Interní grantové agentury Ministerstva zdravotnictví ČR (NT 13638, NT 14254-3 a NT 13259-3), Grantové agentury Ministerstva obrany ČR (MO 1012) a Grantové agentury ČR (P208/ 11/ 0105). Práce byla dále podpořena Operačními programy Praha – Konkurenceschopnost (CZ.2.16/ 3.1.00/ 22197 a CZ.2.16/ 3.1.00/ 21537), Národním programem udržitelnosti (NPU MŠMT – LO1215; 34807/ 2013) a Účelovou podporou na specifický vysokoškolský výzkum (MŠMT 20/ 2015).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 5. 11. 2015
Přijato: 30. 11. 2015
MU Dr. Bohuš Bunganič
Interní klinika 1. LF UK a ÚVN – VFN
U Vojenské nemocnice 1200
169 02 Praha 6
bohus.bunganic@uvn.cz
Zdroje
1. Trends in SEER incidence and U.S. mor-tality using the Joinpoint Regression Program, 1975 – 2011 with up to five Joinpoints,1992 – 2011 with up to three Joinpoints,both sexes by race/ ethnicity. [online]. Avail-able from: http:/ / seer.cancer.gov/ csr/ 1975_2011/ results_merged/ sect_22_pancreas.pdf#search=pancreatic.
2. Katz MH, Hwang R, Fleming JB et al. Tumor-node-metastasis staging of pancreatic adenocarcinoma. CA Cancer J Clin 2008; 58(2): 111 – 125. doi: 10.3322/ CA.2007.0012.
3. Gobbi PG, Bergonzi M, Comelli M et al. The prognostic role of time to diagnosis and presenting symptoms in patients with pancreatic cancer. Cancer Epidemiol 2013; 37(2): 186 – 190. doi: 10.1016/ j.canep.2012.12.002.
4. Dušek L, Mužík J, Kubásek M et al. Epidemiologie zhoubných nádorů v České republice. [online]. Dostupné z: www.svod.cz.
5. Gangi S, Fletcher JG, Nathan MA et al. Time interval between abnormalities seen on CT and the clinical diagnosis of pancreatic cancer: retrospective review of CT scans obtained before diagnosis. AJR Am J Roentgenol 2004; 182(4): 897 – 903.
6. Bunganič B, Frič P, Zavoral M. Pancreatic adenocarcinoma – early symptoms and screening. Cas Lek Cesk 2014; 153(6): 267 – 270.
7. Sah RP, Nagpal SJ, Mukhopadhyay D et al. New insights into pancreatic cancer-induced paraneoplastic diabetes. Nat Rev Gastroenterol Hepatol 2013; 10(7): 423 – 433. doi: 10.1038/ nrgastro.2013.49.
8. Aggarwal G, Kamada P, Chari ST. Prevalence of diabetes mellitus in pancreatic cancer compared to common cancers. Pancreas 2013; 42(2): 198 – 201. doi: 10.1097/ MPA.0b013e3182592c96.
9. Poruk KE, Firpo MA, Adler DG et al. Screening for pancreatic cancer: why, how, and who? Annal Surg 2013; 257(1): 17 – 26. doi: 10.1097/ SLA.0b013e31825ffbfb.
10. Ducreux M, Cuhna AS, Caramella C. Cancer of the pancreas: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol 2015. 26 (Suppl 5): v56 – v68. doi: 10.1093/ annonc/ mdv295.
11. Wang G, Lipert RJ, Jain M et al. Detection of the potential pancreatic cancer marker MUC4 in serum using surface-enhanced Raman scattering. Anal Chem 2011; 83(7): 2554 – 2561. doi: 10.1021/ ac102829b.
12. Kaur S, Kumar S, Momi N et al. Mucins in pancreatic cancer and its microenvironment. Nat Rev Gastroenterol Hepatol 2013; 10(10): 607 – 620. doi: 10.1038/ nrgastro.2013.120.
13. Horn A, Chakraborty S, Dey P et al. Immunocytochemistry for MUC4 and MUC16 is a useful adjunct in the diagnosis of pancreatic adenocarcinoma on fine-needle aspiration cytology. Arch Pathol Lab Med 2013; 137(4): 546 – 551. doi: 10.5858/ arpa.2011-0229-OA.
14. Carrara S, Cangi MG, Arcidiacono PG et al. Mucin expression pattern in pancreatic diseases: findings from EUS-guided fine-needle aspiration biopsies. Am J Gastroenterol 2011; 106(7): 1359 – 1363. doi: 10.1038/ ajg.2011.22.
15. Zhu F, Isaacs NW, Hecht L et al. Raman optical activity: a tool for protein structure analysis. Structure 2005; 13(10): 1409 – 1419.
16. Barron LD, Zhu F, Hecht L et al. Raman optical activity: an incisive probe of molecular chirality and biomolecular structure. J Mol Struct 2007; 834 – 836(1): 7 – 16.
17. Berova N, Nakanishi K, Polavarapu PL et al. Comprehensive Chiroptical Spectroscopy. 2nd ed. New Jersey: John Wiley & Sons Inc 2012.
18. Schultz NA, Dehlendorff C, Jensen BV et al. MicroRNA biomarkers in whole blood for detection of pancreatic cancer. JAMA 2014; 311(4): 392 – 404. doi: 10.1001/ jama.2013.284664.
19. Tatarkovič M, Synytsya A, Šťovíčková Let al. The minimizing of fluorescence background in Raman optical activity and Ra-man spectra of human blood plasma. Anal Bioanal Chem 2015; 407(5): 1335 – 1342. doi: 10.1007/ s00216-014-8358-7.
20. Synytsya A, Judexová M, Hrubý T et al. Analysis of human blood plasma and hen egg white by chiroptical spectroscopic methods (ECD, VCD, ROA). Anal Bioanal Chem 2013; 405(16): 5441 – 5453. doi: 10.1007/ s00216-013-6946-6.
21. Seufferlein T, Bachet JB, Van Cutsem E et al. Pancreatic adenocarcinoma: ESMO-ESDO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol 2012; 23 (Suppl 7): vii33–vii 40.
22. Tempero MA, Arnoletti JP, Behrman S et al. Pancreatic adenocarcinoma. Journal Natl Compr Canc Netw 2010; 8(9): 972 – 1017.
23. Withnall R, Chowdhry BZ, Silver J et al. Raman spectra of carotenoids in natural products. Spectrochim Acta, Part A 2003; 59(10): 2207 – 2212.
24. Parker SF, Tavender SM, Dixon NM et al. Raman spectrum of beta-carotene using laser lines from green (514.5 nm) to near-infrared (1064 nm): implications for the characterization of conjugated polyenes. Appl Spectrosc 1999; 53(1): 86 – 91.
25. Kinalwa MN, Blanch EW, Doig AJ. Accurate determination of protein secondary structure content from Raman and Raman optical activity spectra. Anal Chem 2010; 82(15): 6347 – 6349. doi: 10.1021/ ac101334h.
26. Whitmore L, Wallace BA. Protein secondary structure analyses from circular dichroism spectroscopy: methods and reference databases. Biopolymers 2008; 89(5): 392 – 400.
27. Hirst JD, Colella, K, Gilbert AT. Electronic circular dichroism of proteins from first -principles calculations. J Phys Chem B 2003; 107 : 11813 – 11819.
28. Molina V, Visa L, Conill C et al. CA 19-9 in pancreatic cancer: retrospective evaluation of patients with suspicion of pancreatic cancer. Tumour Biol 2012; 33(3): 799 – 807. doi: 10.1007/ s13277-011-0297-8.
29. Kim JE, Lee KT, Lee JK et al. Clinical usefulness of carbohydrate antigen 19-9 as a screening test for pancreatic cancer in an asymptomatic population. J Gastroenterol Hepatol 2004; 19(2): 182 – 186.
30. Ballehaninna UK, Chamberlain RS. The clinical utility of serum CA 19-9 in the diagnosis, prognosis and management of pancreatic adenocarcinoma: an evidence-based appraisal. J Gastrointest Oncol 2012; 3(2): 105 – 119. doi: 10.3978/ j.issn.2078-6891.2011.021.
31. Itzkowitz SH, Kim YS. New carbohydrate tumor markers. Gastroenterology 1986; 90(2): 491 – 494.
32. Duffy MJ, Sturgeon C, Lamerz R et al. Tumor markers in pancreatic cancer: a European Group on Tumor Markers (EGTM) status report. Ann Oncol 2010; 21(3): 441 – 447. doi: 10.1093/ annonc/ mdp332.
33. Baine M. Pancreatic cancer biomarkers. In: Encyclopedia of Cancer. Heidelberg: Springer 2009 : 790 – 805.
34. Gao L, He SB, Li DC. Effects of miR-16 plus CA 19-9 detections on pancreatic cancer diagnostic performance. Clin Lab 2014; 60(1): 73 – 77.
35. Rhim AD, Mirek ET, Aiello NM et al. EMT and dissemination precede pancreatic tumor formation. Cell 2012; 148(1 – 2): 349 – 361. doi: 10.1016/ j.cell.2011.11.025.
36. Rhim AD, Thege FI, Santana SM et al. Detection of circulating pancreas epithelial cells in patients with pancreatic cystic lesions. Gastroenterology 2014; 146(3): 647 – 651. doi: 10.1053/ j.gastro.2013.12.007.
37. Apte MV, Wilson JS, Lugea A et al. A starring role for stellate cells in the pancreatic cancer microenvironment. Gastroenterology 2013; 144(6): 1210 – 1219.
38. He XY, Yuan YZ. Advances in pancreatic cancer research: moving towards early detection. World J Gastroenterol 2014; 20(32): 11241 – 11248. doi: 10.3748/ wjg.v20.i32.11241.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2015 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Gastrointestinální onkologie
- Dětská gastroenterologie a hepatologie
- Široká diferenciální diagnóza enteropatie
- Farmakoekonomický pohľad na diagnostiku a terapiu kolorektálneho karcinómu
- Epidemiologie a populační screening nádorů tlustého střeva a konečníku v České republice na podkladě nově dostupných dat
- Molekulárně spektroskopická analýza krevní plazmy – cesta k diagnostice karcinomu pankreatu?
- Předoperační staging u nemocného s karcinomem pankreatu
- Výlučná enterální výživa – léčba první volby Crohnovy choroby u dětí
- Porucha signalizácie dráhy IL-10 a nešpecifické črevné zápalové ochorenie s veľmi včasným nástupom
- Výsledky transplantácií pečene u slovenských detí
- Progressive familial intrahepatic cholestasis type 2 – paediatric patients followed at the Paediatric Clinic of the 2nd Medical Faculty, University Hospital Motol, Prague
- Význam genetického vyšetrenia u detí s idiopatickou chronickou pankreatitídou
- Urolitiáza u pacientů s idiopatickými střevními záněty
- MUDr. Igor Páv 17. 9. 1962–20. 11. 2015
- Česká gastroenterologie opět uspěla v soutěži Dr. Bares Award
- 33rd Czech and Slovak Gastroenterology Congress, 12th– 14th November 2015
- Vyhlášení soutěže o nejlepší kazuistiku 2015
- Dva kontinenty, dvě země, jedno společné téma – hepatogastroenterologie
- Výběr z mezinárodních časopisů
- Poděkování recenzentům
- Správná odpověď na kvíz
- Autodidaktický test: gastrointestinální onkologie a dětská gastroenterologie a hepatologie
- Ursodeoxycholová kyselina (Ursosan® tobolky)
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Ursodeoxycholová kyselina (Ursosan® tobolky)
- Výlučná enterální výživa – léčba první volby Crohnovy choroby u dětí
- Výsledky transplantácií pečene u slovenských detí
- Význam genetického vyšetrenia u detí s idiopatickou chronickou pankreatitídou
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



