-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Význam genetického vyšetrenia u detí s idiopatickou chronickou pankreatitídou
The importance of genetic testing in children with idiopathic chronic pancreatitis
While in adults the major etiological factor of chronic pancreatitis is excessive alcohol consumption, in children, together with anatomical anomalies of the pancreas and biliary tract, genetic factors seem to be crucial.
Aim:
Our aim was to investigate the frequency of mutations in genes associated with the development of recurrent acute pancreatitis or chronic pancreatitis in children and then monitor the genotype-phenotype correlations in the patients.Material and methods:
Twenty-one children with recurrent acute pancreatitis or chronic pancreatitis of unknown etiology diagnosed between 2008 and 2013 at the 2nd Department of Pediatrics, University Children’s Hospital, Bratislava, were enrolled in the study. Molecular genetic analysis of PRSS1, SPINK1 and CTRC genes was performed in cooperation with the Department of Medical Genetics at St. Elisabeth’s Institute of Oncology.Results:
Family history was positive in five cases. In 2 out of 21 patients, the p.R122H mutation of PRSS1 gene was found; one patient was a trans-heterozygous carrier of the p.G208A (PRSS1) and p.G60G (CTRC) variants. The p.N34S mutation of SPINK1 gene was seen in six patients (two homozygous and four heterozygous), out of which four were trans-heterozygotes with the p.G60G (CTRC) variant. One patient was homozygous for p.G60G, one was heterozygous for p.R254W and one was heterozygous for p.G214R variant of the CTRC gene.Conclusion:
In a group of 21 pediatric patients with recurrent acute pancreatitis/chronic pancreatitis of unknown etiology, a high prevalence of causal mutations associated with the development of the disease was found. These results confirm the importance of genetic testing in children with idiopathic recurrent acute pancreatitis/chronic pancreatitis.Key words:
chronic pancreatitis – hereditary pancreatitis – genetic predisposition to disease – genetic analysis – pancreatitis in children
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
5. 11. 2015Accepted:
29. 11. 2015
Autoři: E. Hegyi 1; L. Vávrová 2; M. Konečný 2; L. Kovács 1; I. Čierna 1
Působiště autorů: II. detská klinika LF UK a DFNsP Bratislava, Slovenská republika 1; Oddelenie lekárskej genetiky, Onkologický ústav sv. Alžbety, s. r. o., Bratislava, Slovenská republika 2
Vyšlo v časopise: Gastroent Hepatol 2015; 69(6): 554-559
Kategorie: Dětská gastroenterologie a hepatologie: původní práce
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amgh2015554Souhrn
Zatiaľčo u dospelých sa ako hlavný etiologický faktor chronickej pankreatitídy uvádza nadmerná konzumácia alkoholu, u detí sa okrem anatomických anomálií pankreasu a žlčových ciest uplatňujú predovšetkým genetické faktory.
Cieľ:
Charakterizovať frekvenciu výskytu mutácií jednotlivých génov asociovaných so vznikom rekurentnej akútnej pankreatitídy alebo chronickej pankreatitídy u detí a následne sledovať genotypovo-fenotypové korelácie u týchto pacientov.Materiál a metodika:
Do štúdie bolo zaradených 21 detí s diagnózou rekurentnej akútnej pankreatitídy/ chronickej pankreatitídy nejasnej etiológie, ktoré boli v období 2008 – 2013 vyšetrené na II. detskej klinike LF UK a DFNsP v Bratislave. Molekulovo-genetická analýza génov PRSS1, SPINK1 a CTRC sa uskutočnila v spolupráci s Oddelením lekárskej genetiky Onkologického ústavu sv. Alžbety.Výsledky:
Rodinná anamnéza bola pozitívna v piatich prípadoch. U dvoch pacientov bola dokázaná prítomnosť mutácie p.R122H génu PRSS1; jeden pacient je zmiešaný heterozygot pre mutácie p.G208A (PRSS1) a p.G60G (CTRC). Mutácia p.N34S génu SPINK1 sa potvrdila u šiestich pacientov (dvaja homozygotní a štyria heterozygotní), z nich u štyroch bola potvrdená aj mutácia p.G60G (CTRC) v heterozygotnom stave. Jeden pacient je homozygot pre mutáciu p.G60G; jeden heterozygot pre p.R254W a jeden heterozygot pre mutáciu p.G214R génu CTRC.Záver:
V súbore 21 detských pacientov s rekurentnou akútnou pankreatitídou/ chronickou pankreatitídou neznámej etiológie sme zaznamenali vysoký výskyt kauzálnych mutácií asociovaných so vznikom ochorenia. Uvedené výsledky potvrdzujú dôležitosť genetického vyšetrenia u detí s idiopatickou rekurentnou akútnou pankreatitídou / chronickou pankreatitídou.Kľúčové slová:
chronická pankreatitída – hereditárna pankreatitída – genetická náchylnosť – genetická analýza – pankreatitída u detíÚvod
Chronická pankreatitída (CHP) patrí medzi zriedkavé ochorenia detského veku. Jej incidencia sa vo vekovej skupine mladších ako 20 rokov odhaduje na 0,5/ 100 000, vekom však postupne narastá a v dospelosti sa vyznačuje až 4 – 9× vyšším výskytom v porovnaní s detskou populáciou [1]. Ochorenie je definované ako trvalo progredujúci zápalový proces podžalúdkovej žľazy vedúci k vzniku ireverzibilných morfologických zmien parenchýmu v zmysle fibrózy, atrofie acinárnych buniek a kalcifikácie vývodov. Vplyvom uvedených zmien dochádza k poškodeniu exokrinnej aj endokrinnej funkcie pankreasu [2].
Zatiaľ čo u dospelých sa ako hlavný etiologický faktor uvádza nadmerná konzumácia alkoholu, u detí sa okrem anatomických anomálií pankreasu a žlčových ciest uplatňujú predovšetkým genetické faktory. Mutácie v géne PRSS1 (kationický trypsinogén) [3] podmieňujú vznik hereditárnej pankreatitídy (HP), kým mutácie v génoch SPINK1 (inhibítor serínovej proteázy typ Kazal 1) [4], CTRC (chymotrypsín C) [5], CFTR (transmembránový regulátor vodivosti pri cystickej fibróze) [6], CPA1 (karboxypeptidáza A1) [7] a CLDN2 (klaudín 2) [8] sú asociované so zvýšeným rizikom vzniku CHP.
Cieľom tejto štúdie bolo charakterizovať mutačné spektrum génov asociovaných so vznikom CHP u detí s idiopatickou chronickou pankreatitídou (ICHP) a rekurentnou akútnou pankreatitídou (RAP).
Súbor pacientov a metodika
Charakteristika pacientov
Do štúdie bolo zaradených 21 detských pacientov s RAP alebo ICHP, ktorí boli v období 2008 – 2013 vyšetrení na II. detskej klinike LF UK a DFNsP Bratislava (tab. 1) alebo ich vzorka krvi bola zaslaná do Laboratória klinickej a molekulovej genetiky II. detskej kliniky LF UK a DFNsP Bratislava za účelom uskutočnenia genetickej analýzy pre podozrenie geneticky podmienenej RAP/ ICHP. Diagnóza RAP alebo CHP bola stanovená v súlade s odporúčaním konzorcia INSPPIRE (International Study Group of Pediatric Pancreatitis: In Search for a Cure) [9]. Ako RAP bol označený výskyt minimálne dvoch jednoznačných atakov akútnej pankreatitídy (AP) spolu s: 1. úplným vymiznutím bolesti (≥ jednomesačný bezbolestný interval medzi diagnó-zami AP) alebo 2. úplnou normalizáciou hladín sérových pankreatických enzýmov (amylázy, lipázy) pred nástupom ďalšej epizódy AP. Diagnóza CHP bola stanovená splnením aspoň jedného z uvedených kritérií: 1. abdominálna bolesť a zobrazovacie vyšetrenie potvrdzujúce chronické pankreatické poškodenie; 2. prítomnosť exokrinnej pankreatickej insuficiencie a zobrazovacie vyšetrenie potvrdzujúce chronické pankreatické poškodenie alebo 3. prítomnosť endokrinnej pankreatickej insuficiencie a zobrazovacie vyšetrenie potvrdzujúce chronické pankreatické poškodenie, alebo bioptická vzorka demonštrujúca histopatologické zmeny charakteristické pre CHP. Diagnóza HP bola stanovená v prípade výskytu mutácie v géne PRSS1 u pacienta s pozitívnou rodinnou anamnézou. Jedinci, u ktorých boli vylúčené všetky iné príčiny CHP (trauma, anatomické anomálie pankreasu, lieky, infekcie, systémové a metabolické ochorenia, pozitívna rodinná anamnéza), boli zaradení do skupiny ICHP.
Tab. 1. Charakteristika pacientov. Tab. 1. Patient characteristics. 
RAP – rekurentná akútna pankreatitída, CHP – chronická pankreatitída Štúdia bola schválená etickou komisiou DFNsP Bratislava. Rodičia pa-cienta boli informovaní o priebehu štúdie a pacienti boli zaradení na základe rodičmi podpísaného informovaného súhlasu.
Molekulovo-genetická analýza
Periférna krv (2– 3 ml) od pacientov bola odobratá do skúmavky EDTA za účelom následnej izolácie genomickej DNA prostredníctvom komerčne dostupného izolačného kitu (Qiagen, Hilden, Germany). Molekulovo-genetická analýza génov PRSS1, SPINK1 a CTRC sa uskutočnila v spolupráci s Oddelením lekárskej genetiky Onkologického ústavu sv. Alžbety. V prípade génov PRSS1 a SPINK1 boli priamym sekvenovaním vyšetrené všetky exóny a exón-intrónové hranice, kým v géne CTRC exóny 2, 3 a 7. V troch prípadoch sa analýza uskutočnila v spolupráci s Ústavem biologie a lékarské genetiky 2. LF UK a FN v Motole, Praha.
Štatistická analýza
Na porovnanie priemerného veku nástupu ochorenia medzi jednotlivými skupinami bol použitý Mann-Whitneyho U test, v ostatných prípadoch bol použitý Fisherov exaktný test. Za štatisticky významný rozdiel bol považovaný p < 0,05.
Výsledky
Z celkového počtu 21 detí s diagnózou RAP/ CHP u 14 (67 %) bola potvrdená mutácia aspoň v jednom z vyšetrených génov (PRSS1, SPINK1, CTRC) (obr. 1). V troch (14 %) prípadoch bola zistená mutácia v géne PRSS1, u šiestich (28 %) pacientov sa jednalo o mutáciu v géne SPINK1 a u 10 (47 %) o mutáciu v géne CTRC; pričom u piatich pacientov bola súčasne dokázaná mutácia dvoch génov.
Obr. 1. Výsledok genetickej analýzy u pacientov s rekurentnou akútnou pankreatitídou/ chronickou pankreatitídou nejasnej etiológie. Fig. 1. The result of genetic analysis in patients with recurrent acute pancreatitis/ chronic pancreatitis of unknown etiology. 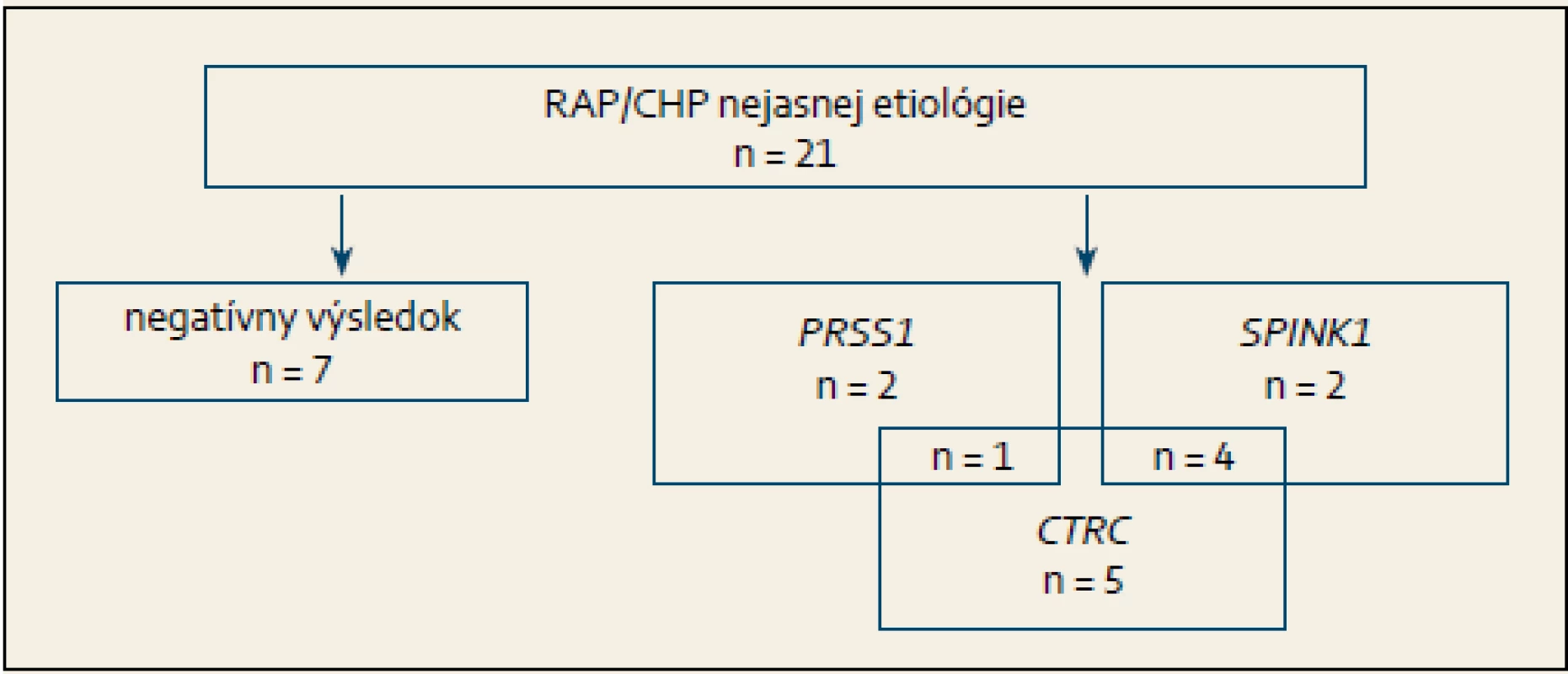
RAP – rekurentná akútna pankreatitída, CHP – chronická pankreatitída, PRSS1 – kationický trypsinogén, SPINK1 – inhibítor serínovej proteázy typ Kazal 1, CTRC – chymotrypsín C Priemerný vek nástupu ochorenia bol 9,1 ± 4,7 (rozsah od 2,5 do 17), ktorý sa štatisticky významne nelíšil medzi skupinami pacientov s potvrdenou mutáciou a bez nej (9,9 ± 4,2 resp. 7,7 ± 5,92; p = 0,34), ani medzi skupinou chlapcov a dievčat (10,5 ± 6,3 resp. 8,5 ± 4,3; p = 0,51) (tab. 1) a skupinou s diagnózou RAP v porovnaní s CP (8 ± 5,1 resp. 9,7 ± 4,9 (p = 0,51). Diagnóza CHP bola stanovená v 14 (67 %) prípadoch, u siedmich (33 %) detí sa jednalo o RAP. Rodinná anamnéza bola pozitívna v piatich (24 %) prípadoch, z toho v štyroch sa potvrdila genetická príčina ochorenia: v dvoch rodinách bola prítomná mutácia v géne PRSS1 a v dvoch rodinách v géne SPINK1. Chirurgická intervencia bola nevyhnutná celkovo v štyroch prípadoch, pričom u každého dieťaťa bola dokázaná mutácia aspoň v jednom z vyššie uvedených génov (p = 0,26) (tab. 2).
Tab. 2. Genotypová a fenotypová charakteristika pacientov s potvrdenou patogénnou mutáciou. Tab. 2. Genotype-phenotype characteristics of patients with confirmed pathogenic mutations. 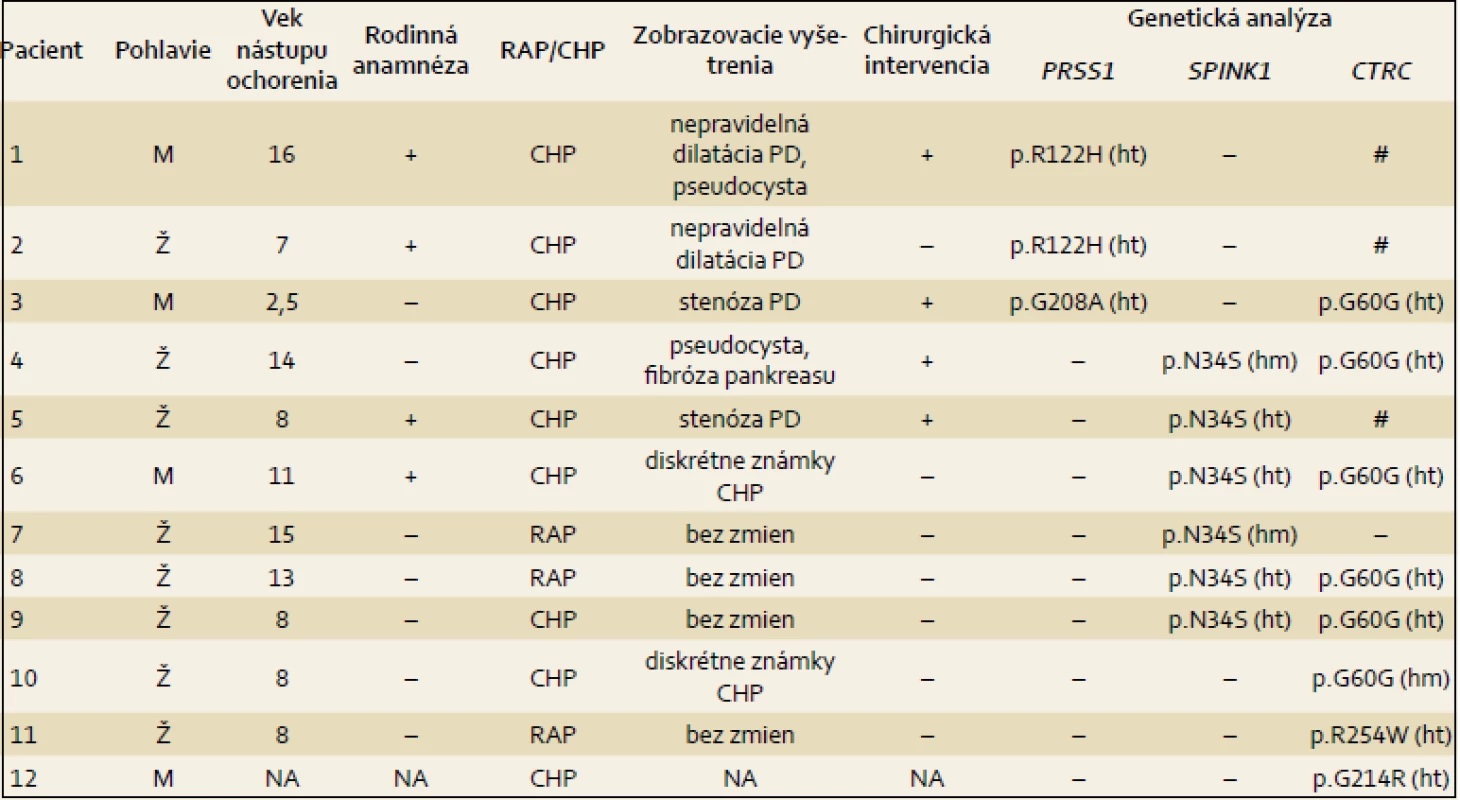
RAP – rekurentná akútna pankreatitída, CHP – chronická pankreatitída, PD – pankreatický vývod, M – muž, Ž – žena, PRSS1 – kationický trypsinogén, SPINK1 – inhibítor serínovej proteázy typ Kazal 1, CTRC – chymotrypsín C, hm – homozygot, ht – heterozygot, # – genetická analýza nebola vykonaná, NA – údaj nie je známy Mutácie v géne PRSS1
U dvoch pacientov s pozitívnou rodinnou anamnézou bola dokázaná prítomnosť mutácie p.R122H génu PRSS1 v heterozygotnom stave (obr. 2). Zobrazovacím vyšetrením boli u obidvoch pacientov popísané chronické zmeny pankreasu, u jedného z nich bolo pre závažnosť stavu indikované chirurgické riešenie. Mutácia p.G208A bola potvrdená v jednom prípade v heterozygotnom stave, pričom sa jednalo o pacienta s veľmi včasným nástupom ťažkostí, u ktorého pre zúženie pankreatického vývodu bol zavedený stent. Súčasne bola zistená mutácia p.G60G génu CTRC v heterozygotnom stave. Rodinná anamnéza bola negatívna (tab. 2).
Obr. 2. Rodokneň pacienta s hereditárnou pankreatitídou. Čiernou sú označení jedinci s chronickou pankreatitídou a potvrdenou heterozygotnou mutáciou p.R122H génu PRSS1. Bodkou je označený zdravý nosič mutácie. Zdravý jedinec bez mutácie je označen jako WT – wild type. Šípka smeruje na pacientku zaradenú do štúdie. Fig. 2. Family tree of a patient with hereditary pancreatitis. Individuals with chronic pancreatitis and confirmed heterozygous mutation in p.R122H of the PRSS1 gene are marked in black. A healthy carrier of the mutation is marked with a dot. A healthy individual without the mutation is marked with WT – wild type. The arrow points to the patient enrolled in the study. 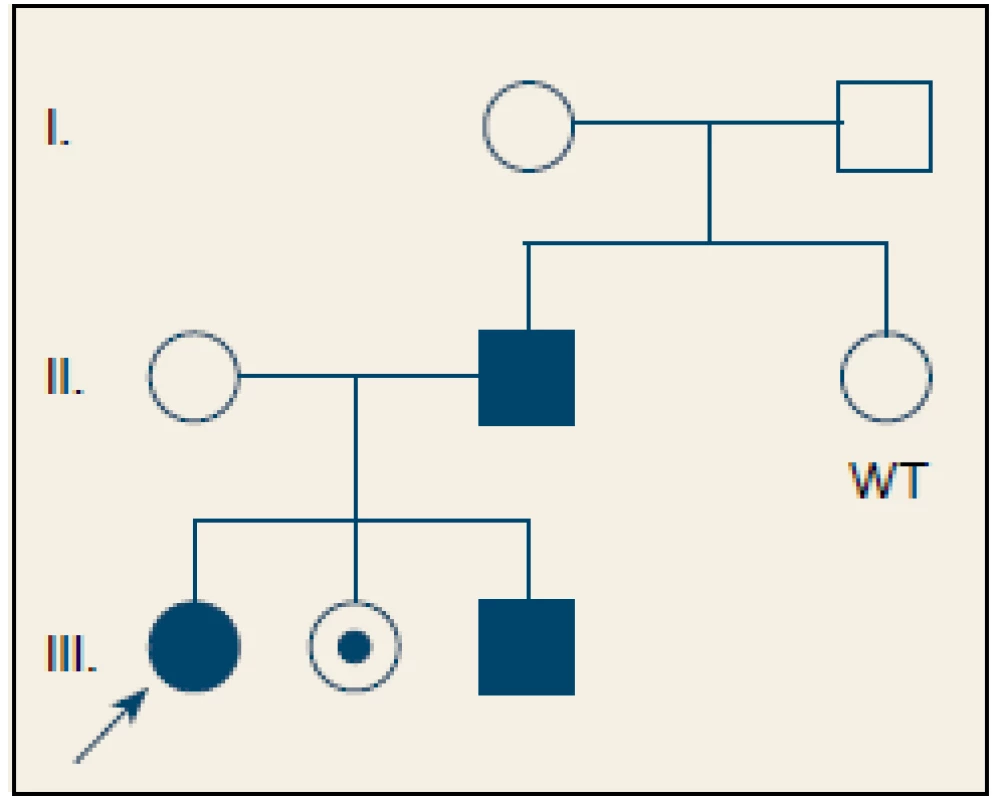
Mutácie v géne SPINK1
Mutácia p.N34S v géne SPINK1 bola prítomná u šiestich pacientov. Dve pacientky boli homozygotné pre uvedenú mutáciu, pričom u jednej sa potvrdila aj mutácia p.G60G génu CTRC v heterozygotnom stave. Klinicky sa ochorenie prejavilo u jednej pacientky s chronickými zmenami pankreasu v zmysle pankreatickej fibrózy a vznikom pseudocysty, ktorá vyžadovala operačné riešenie. Zo štyroch pacientov s heterozygotnou mutáciou p.N34S sa ochorenie manifestovalo ako RAP v dvoch prípadoch a rovnako u dvoch boli zobrazovacími vyšetreniami popísané chronické zmeny podžalúdkovej žľazy. Zo SPINK1 pozitívnych pacientov bol u dvoch potvrdený rodinný výskyt ochorenia (tab. 2).
Mutácie v géne CTRC
V prípade génu CTRC boli vyšetrené exóny 2, 3 a 7, v ktorých bol dokázaný vysoký výskyt kauzálnych mutácií v porovnaní s ostatnými exónmi génu [5,10]. Mutácia p.G60G bola prítomná u ôsmich pacientov, z toho u jednej pacientky v homozygotnom stave a u siedmich v heterozygotnom stave, pričom v piatich prípadoch bola potvrdená aj mutácia v géne PRSS1, resp. SPINK1. U jednej pacientky s RAP bola dokázaná mutácia p.R254W v heterozygotnom stave. Heterozygotná forma mutácie p.G214R sa vyskytla u jedného pacienta s chronickou pankreatitídou (tab. 2).
Diskusia
Na možnú genetickú podmienenosť chronickej pankreatitídy poukázali Comfort so Steinbergom už v roku 1952, kedy ako prví demonštrovali výskyt ochorenia u viacerých členov tej istej rodiny [11]. Štúdie u pacientov s ICHP postupne viedli k objaveniu viacerých génov, ktorých mutácie predisponujú k vzniku chronického zápalu pankreasu [3 – 8,12].
Molekulovo-genetická analýza génov PRSS1, SPINK1 a CTRC bola uskutočnená u 21 detských pacientov s diagnózou CHP alebo RAP s cieľom zistiť mutačné spektrum ochorenia v slovenskej populácii.
HP je zriedkavou príčinou CHP. Pri prevalencii 0,3/ 100 000, ktorá sa udáva v západnej Európe [13], môžeme na Slovensku očakávať približne 17 prípadov HP. Ochorenie je spôsobené mutáciou génu PRSS1, ktorý kóduje kationický trypsinogén. Mutácie typu „gain-of-function“ (mutácie, ktoré vedú k zmene génového produktu v zmysle ich zvýšenej alebo abnormálnej funkcie) génu PRSS1 (p.R122H, p.N29I, p.A16V) sú zodpovedné za veľkú väčšinu prípadov HP kaukazskej populácie. Biochemické štúdie preukázali, že tieto mutácie vedú k zvýšenej auto-aktivácii trypsinogénu a/ alebo zvýšenej stabilite trypsínu [14]. Tento nález potvrdzuje hypotézu, podľa ktorej je ochorenie pankreatitída vznikajúce na podklade samonatrávenia žľazy, kedy predčasne aktivovaný trypsín v pankrease hrá kľúčovú úlohu v aktivácii kaskády všetkých pankreatických digestívnych enzýmov [15].
V géne PRSS1 bola prítomná mutácia u troch (14 %) pacientov s RAP/ CHP. Frekvencia výskytu mutácie je porovnateľná s nemeckou štúdiou, v ktorej bolo vyšetrených 96 detí s CHP a mutácia v géne PRSS1 sa zistila u 11 (11 %) [4]. Vo švajčiarskej štúdii 16 pacientov so skorým nástupom ochorenia sa PRSS1 mutácia potvrdila u dvoch (12,5 %) [16]. Vyšší výskyt mutácií PRSS1 (23,1 %) u detí s CHP bol popísaný v poľskej štúdii [17]. Mutácia p.R122H bola potvrdená u dvoch pacientov s pozitívnou rodinnou anamnézou. Ide o najčastejšiu mutáciu asociovanú so vznikom HP, ktorá vedie k zámene arginínu za histidín v rámci kodónu 122. Arginín 122 je iniciačným miestom autolytickej autoinaktivácie trypsínu, a preto zámena aminokyselín na tejto pozícii zablokuje účinnú intrapankreatickú inaktiváciu trypsínu [3]. Prvé príznaky ochorenia sa väčšinou objavujú okolo 10. roku života [18], čo môžeme potvrdiť aj v prípade našich pacientov s priemerným vekom nástupu 11,5 rokov. Dedičnosť je autozómovo dominantná s inkompletnou penetranciou (80 %). Rodokmeň pacienta na obr. 2 sa vyznačuje inkompletnou penetranciou, treba si však uvedomiť, že príznaky ochorenia u zdravej nosičky sa vzhľadom na jej vek (12 rokov) ešte môžu prejaviť. U jej súrodencov sa však ochorenie v tomto veku už manifestovalo. U druhého pacienta s mutáciou p.R122H sa ochorenie prejavilo po nezávažnom úraze brucha (úder loptou do brucha pri futbale). Stav bol prvotne uzavretý ako posttraumatická pankreatitída s vývojom pseudocysty a následnými chronickými zmenami na pankrease. Päť mesiacov po prepustení sa však u pacienta vytvoril pankreatický ascites, ktorý vyžadoval chirurgické riešenie. Vzhľadom na pozitívnu rodinnú anamnézu bolo u pacienta doplnené genetické vyšetrenie a potvrdená diagnóza HP [19].
Mutácie génu PRSS1 sa však našlinielen u pacientov s HP, ale aj u pacientov s ICHP [20]. V našom súbore sa v jednom prípade potvrdila mutácia p.G208A v heterozygotnom stave. Uvedená mutácia je veľmi zriedkavá – počet publikovaných prípadov 29 (www.pancreasgenetics.org) – a doteraz bola považovaná za unikátnu mutáciu typickú pre ázijskú populáciu [21]. Mechanizmus, ako uvedená mutácia vedie k vzniku ochorenia, sa odlišuje od mutácie p.R122H. Mutáciou indukovaná zmena proteínu spôsobí jeho hromadenie v bunke, čo vedie k vzniku tzv. stresu endoplazmatického retikula, ktorý v konečnom dôsledku spôsobí poškodenie acinárnych buniek [22]. U pacienta sa okrem tejto mutácie potvrdila prítomnosť mutácie p.G60G v heterozygotnom stave. Rovnaký genotyp p.G208A (PRSS1)/ p.G60G (CTRC) mala klinicky zdravá matka a stará matka. Jedným možným vysvetlením pre tento stav by mohla byť nižšia penetrancia mutácie p.G208A alebo prítomnosť ďalších doposiaľ neznámych environmentálnych faktorov, ktoré sa u matky a starej matky pacienta neuplatňujú alebo len mierne [23].
SPINK1 je potencionálny inhibítor proteáz a považuje sa za špecifický inaktivačný faktor intrapankreatickej trypsínovej aktivity [4]. Tento peptid je schopný inaktivovať až 20 % trypsínovej aktivity, a predstavuje tak prvý stupeň ochrany pankreasu pred samonatrávením. Mutácie v géne SPINK1 sa vyskytujú u 1 – 3 % populácie a pre ich nízku penetranciu sa považujú za predispozičný alebo chorobu modifikujúci a nie za chorobu vyvolávajúci faktor. Najčastejšou mutáciou v géne SPINK1 je p.N34S, ktorého biochemický efekt dodnes nebol objasnený. Asociácia mutácie so vznikom chronickej pankreatitídy však bola potvrdená viacerými štúdiami [4,24].
V našom súbore bola prítomná mutácia p.N34S génu SPINK1 v šiestich (28 %) prípadoch. V súbore amerických pediatrických pacientov bola daná mutácia pozorovaná až v 40 % prípadov [24], podobne vysoký výskyt (43 %) bol popísaný v nemeckej populácii [25]. Nižší výskyt v našej populácii je možné vysvetliť rozdielnou geografickou distribúciou mutácie. Fenotyp pacientov s mutáciou p.N34S bol značne odlišný (tab. 2), pričom v dvoch prípadoch bol pozorovaný rodinný výskyt ochorenia.
Enzým CTRC podporuje proteolytickú inaktiváciu trypsinogénu a trypsínu v podžalúdkovej žľaze, čím predstavuje ďalší dôležitý obranný mechanizmus pred vznikom pankreatitídy. Patogénne mutácie génu CTRC vedú k strate funkcie proteínu odlišnými, avšak vzájomne sa nevylučujúcimi mechanizmami, ktoré znižujú sekréciu, katalytickú aktivitu a proteolytickú stabilitu enzýmu [26].
Mutácia v géne CTRC bola potvrdená u 10 (47 %) pacientov. Najčastejší bol výskyt mutácie p.G60G, ktorá sa zistila u ôsmich pacientov. Jedná sa o synonymný variant (nedochádza k zámene aminokyselín v dôsledku mutácie), ktorý v heterozygotnom stave len veľmi mierne, 1,65× zvyšuje riziko vzniku CHP; v homozygotnej forme až 8,44× [27]. Homozygotná forma mutácie p.G60G bola potvrdená u jednej pacientky s CHP, u ktorej predpokladáme, že vznik ochorenia je asociovaný s danou mutáciou. V dvoch prípadoch sa okrem variantu p.G60G v heterozygotnej forme nezistila ďalšia mutácia v žiadnom z vyšetrovaných génov. Nakoľko je miera zvýšenia rizika vzniku CHP v tejto forme veľmi nízka, u týchto pacientov predpokladáme pôsobenie iného etiologického faktora ako hlavnú príčinu vzniku ochorenia. CHP sa v súčasnosti považuje za komplexné genetické ochorenie, ktoré vzniká interakciou environmentálnych a genetických faktorov [28]. U pacientov s dokázanou mutáciou v génoch PRSS1/ SPINK1 a pri súčasnom výskyte mutácie p.G60G v heterozygotnom stave môže preto dôjsť k vzájomnému potencovaniu rizika vzniku ochorenia.
V jednom prípade bola potvrdená mutácia p.R254W v heterozygotnom stave. Mutácia sa vyskytuje približne u 2 % pacientov s CHP [5]. Ide o patogénny variant, u ktorého mutácia génu spôsobí sekrečný defekt proteínu a zároveň dochádza k zvýšenej degradácii proteínu trypsínom [10]. Mutácia p.G214R bola zistená u jedného pacienta v heterozygotnom stave. Ide o unikátny variant, ktorý nebol doposiaľ popísaný v literatúre, jeho klinický efekt bol neznámy. V spolupráci s Ústavom molekulárnej a bunkovej biológie Univerzity v Bostone, USA, bola vykonaná funkčná analýza, ktorá potvrdila patogénnosť mutácie. Na biochemickej úrovni dochádza k zníženiu katalytickej aktivity enzýmu [29].
Limitáciou uvedenej štúdie je relatívne malý súbor pacientov. Táto skutočnosť mohla zohrávať úlohu pri snahe o vytvorenie genotypovo-fenotypovej korelácie. Nepozorovali sme štatisticky významný rozdiel pri porovnaní fenotypov pacientov s mutáciou niektorého génu a bez mutácie.
U pacientov, u ktorých nebola dokázaná prítomnosť mutácie ani v jednom z vyšetrených génov, sa môžu uplatniť iné, zriedkavejšie príčiny ochorenia ako mutácie v géne CPA1 alebo CLDN2, ktoré sú taktiež asociované so vznikom CHP, pričom práve mutácie génu CPA1 boli popísané v súbore pacientov so včasným nástupom ochorenia [7].
Záver
V súbore 21 detských pacientov s RAP/ CHP neznámej etiológie sme zaznamenali vysoký výskyt kauzálnych mutácií asociovaných so vznikom ochorenia. Uvedené výsledky potvrdzujú dôležitosť genetického vyšetrenia u detí s idiopatickou RAP/ CHP.
Mutácie génov PRSS1 a SPINK1 sa na Slovensku vyšetrujú na Oddelení lekárskej genetiky Onkologického ústavu sv. Alžbety, Bratislava. V prípade záujmu o vyšetrenie mutácií v géne CTRC je možné vzorku zaslať do Laboratória klinickej a molekulovej genetiky II. detskej kliniky LF UK DFNsP Bratislava.
Autori ďakujú MU Dr. Eve Bačinskej (Žilina), MU Dr. Renáte Szépeovej, PhD. (Martin), MU Dr. Jane Kosnáčovej (Bratislava), MU Dr. Jaroslavovi Bibzovi, PhD. (Bratislava) a doc. MU Dr. Denise Ilenčíkovej, PhD. (Bratislava) za spoluprácu.
Štúdia bola podporená Grantmi Univerzity Komenského 244/ 2012 a 573/ 2013, a grantom Collegium Talentum (EH).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 5. 11. 2015
Přijato: 29. 11. 2015
MU Dr. Ester Hegyi, PhD.
Department of Molecular and Cell Biology
Boston University Medical Campus
72 East Concord Street, Evans-433
Boston, MA 021 18
hester@bu.edu
Zdroje
1. Spanier B, Bruno MJ, Dijkgraaf MG. Incidence and mortality of acute and chronic pancreatitis in the Netherlands: a nationwide record-linked cohort study for the years 1995 – 2005. World J Gastroenterol 2013; 19(20): 3018 – 3026. doi: 10.3748/ wjg.v19.i20.3018.
2. Whitcomb DC. Mechanisms of disease: advances in understanding the mechanisms leading to chronic pancreatitis. Nat Clin Pract Gastroenterol Hepatol 2004; 1(1): 46 – 52.
3. Whitcomb DC, Gorry MC, Preston RA et al. Hereditary pancreatitis is caused by a mutation in the cationic trypsinogen gene. NatGenet 1996; 14(2): 141 – 145.
4. Witt H, Luck W, Hennies HC et al. Mutations in the gene encoding the serine protease inhibitor, Kazal type 1 are associated with chronic pancreatitis. Nat Genet 2000; 25 : 213 – 216.
5. Rosendahl J, Witt H, Szmola R et al. Chymotrypsin C (CTRC) variants that diminish activity or secretion are associated with chronic pancreatitis. Nat Genet 2008; 40(1): 78 – 82.
6. Sharer N, Schwarz M, Malone G et al. Mutations of the cystic fibrosis gene in patients with chronic pancreatitis. N Eng J Med 1998; 339(10): 645 – 652.
7. Witt H, Beer S, Rosendahl J et al. Variants in CPA1 are strongly associated with early onset chronic pancreatitis. Nat Genet 2013; 45(10): 1216 – 1220. doi: 10.1038/ ng.2730.
8. Whitcomb DC, LaRusch J, Krasinskas AM et al. Common genetic variants in the CLDN2 and PRSS1-PRSS2 loci alter risk for alcohol-related and sporadic pancreatitis. Nat Genet 2012; 44(12): 1349 – 1354. doi: 10.1038/ ng.2466.
9. Morinville VD, Husain SZ, Bai H et al. Definitions of pediatric pancreatitis and survey of present clinical practices. J Pediatr Gastroenterol Nutr 2012; 55(3): 261 – 265.
10. Beer S, Zhou J, Szabó A et al. Comprehensive functional analysis of chymotrypsin C (CTRC) variants reveals distinct loss-of-function mechanisms associated with pancreatitis risk. Gut 2013; 62(11): 1616 – 1624. doi: 10.1136/ gutjnl-2012-303090.
11. Comfort MW, Steinberg AG. Pedigree of a family with hereditary chronic relapsing pancreatitis. Gastroenterology 1952; 21(1): 54 – 63.
12. Čierna I. Hereditárna pankreatitída. Gastroenterol Prax 2009; 8(2): 94 – 98.
13. Rebours V, Levy P, Ruszniewski P. An overview of hereditary pancreatitis. Dig Liver Dis 2012; 44(1): 8 – 15. doi: 10.1016/ j.dld.2011.08.003.
14. Sahin-Tóth M, Tóth M. Gain-of-function mutations associated with hereditary pancreatitis enhance autoactivation of human cationic trypsinogen. Biochem Biophys Res Commun 2000; 278(2): 286 – 289.
15. Chiari H. Über die Selbstverdauung des menschlichen Pancreas. Z Heilk 1896; 17 : 69 – 96.
16. Truninger K, Kock J, Wirth HP et al. Trypsinogen gene mutations in patients with chronic or recurrent acute pancreatitis. Pancreas 2001; 22(1): 18–23.
17. Sobczyńska-Tomaszewska A, Bak D, Oralewska B et al. Analysis of CFTR, SPINK1, PRSS1 and AAT mutations in children with acute or chronic pancreatitis. J Pediatr Gastroenterol Nutr 2006; 43(3): 299 – 306.
18. Howes N, Greenhalf W, Rutherford S et al. A new polymorphism for the R122H mutation in hereditary pancreatitis. Gut 2001; 48(2): 247 – 250.
19. Čierna I, Cingel V. Hereditárna pankreatitída u 17-ročného pacienta. Pediatr Prax 2011; 12(3): 121 – 122.
20. Bátovský M. Úloha génových mutácií v patogenéze chronickej pankreatitídy. Gastroenterol Prax 2013; 12(2): 72 – 74.
21. Masamune A, Nakano E, Kume K et al. PRSS1 c.623G>C (p.G208A) variant is associated with pancreatitis in Japan. Gut 2014; 63(2): 366. doi: 10.1136/ gutjnl-2013-304925.
22. Schnúr A, Beer S, Witt H et al. Functional effects of 13 rare PRSS1 variants presumed to cause chronic pancreatitis. Gut 2014; 63(2): 337 – 343. doi: 10.1136/ gutjnl-2012-304331.
23. Hegyi E, Čierna I, Vavrová Ľ et al. Chronic pancreatitis associated with the p.G208A variant of PRSS1 gene in a European patient. JOP 2014; 15(1): 49 – 52. doi: 10.6092/ 1590-8577/ 1896.
24. Pfützer RH, Barmada MM, Brunskill AP et al. SPINK1/ PSTI polymorphisms act as disease modifiers in familial and idiopathic chronic pancreatitis. Gastroenterology 2000; 119(3): 615 – 623.
25. Truninger K, Witt H, Köck J et al. Mutations of the serine protease inhibitor, Kazal type 1 gene, in patients with idiopathic chronic pancreatitis. Am J Gastroenterol 2002; 97(5): 1133 – 1137.
26. Zhou J, Sahin-Tóth M. Chymotrypsin C mutations in chronic pancreatitis. J Gastroenterol Hepatol 2011; 26(8): 1238 – 1246. doi: 10.1111/ j.1440-1746.2011.06791.x.
27. Beer S, Ludwig M, Németh BC et al. Synonymous CTRC variant c.180C>T contributes significantly to chronic pancreatitis risk. Pancreatology 2014; 14(3): S15.
28. Rosendahl J, Landt O, Bernadova J et al.CFTR, SPINK1, CTRC and PRSS1 variantsin chronic pancreatitis: is the role of mutated CFTR overestimated? Gut 2013; 62(4): 582 – 592. doi: 10.1136/ gutjnl-2011-300645.
29. Szabó A, Ludwig M, Hegyi E et al. Mesotrypsin signature mutation in a chymotrypsin C (CTRC) variant associated with chronic pancreatitis. J Biol Chem 2015; 290(28): 17282 – 17292. doi: 10.1074/ jbc.M114.618439.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2015 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Gastrointestinální onkologie
- Dětská gastroenterologie a hepatologie
- Široká diferenciální diagnóza enteropatie
- Farmakoekonomický pohľad na diagnostiku a terapiu kolorektálneho karcinómu
- Epidemiologie a populační screening nádorů tlustého střeva a konečníku v České republice na podkladě nově dostupných dat
- Molekulárně spektroskopická analýza krevní plazmy – cesta k diagnostice karcinomu pankreatu?
- Předoperační staging u nemocného s karcinomem pankreatu
- Výlučná enterální výživa – léčba první volby Crohnovy choroby u dětí
- Porucha signalizácie dráhy IL-10 a nešpecifické črevné zápalové ochorenie s veľmi včasným nástupom
- Výsledky transplantácií pečene u slovenských detí
- Progressive familial intrahepatic cholestasis type 2 – paediatric patients followed at the Paediatric Clinic of the 2nd Medical Faculty, University Hospital Motol, Prague
- Význam genetického vyšetrenia u detí s idiopatickou chronickou pankreatitídou
- Urolitiáza u pacientů s idiopatickými střevními záněty
- MUDr. Igor Páv 17. 9. 1962–20. 11. 2015
- Česká gastroenterologie opět uspěla v soutěži Dr. Bares Award
- 33rd Czech and Slovak Gastroenterology Congress, 12th– 14th November 2015
- Vyhlášení soutěže o nejlepší kazuistiku 2015
- Dva kontinenty, dvě země, jedno společné téma – hepatogastroenterologie
- Výběr z mezinárodních časopisů
- Poděkování recenzentům
- Správná odpověď na kvíz
- Autodidaktický test: gastrointestinální onkologie a dětská gastroenterologie a hepatologie
- Ursodeoxycholová kyselina (Ursosan® tobolky)
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Ursodeoxycholová kyselina (Ursosan® tobolky)
- Výlučná enterální výživa – léčba první volby Crohnovy choroby u dětí
- Výsledky transplantácií pečene u slovenských detí
- Význam genetického vyšetrenia u detí s idiopatickou chronickou pankreatitídou
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



