-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Endoskopická transmurální resekce v léčbě lokálních reziduálních neoplazií tlustého střeva – analýza souboru 19 pacientů
Endoscopic full-thickness resection for the treatment of local residual neoplastia in the colon – an analysis of 19 cases
Introduction:
Endoscopic full-thickness resection (FTR) is a novel endoscopic technique that allows transmural resection of the colonic wall. Limited data suggest that FTR is efficacious and safe for the management of local residual neoplasia (LRN). Standard endoscopic treatment of LRN is usually complicated by scarring and non-lifting sign caused by a previous endoscopic resection.Methods:
We prospectively evaluated patients treated with FTR for difficult LRN after at least one session of endoscopic treatment in two tertiary endoscopic centers between June 2016 and January 2018. Primary outcomes were technical success rate, R0, and curative resection rate and occurrence of complications.Results:
Nineteen patients with LRN (age 69.2 ± 10.5 years; 79% males) were treated between June 2016 and January 2018. Six cases of LRN were localized in the rectum and 13 cases in the colon. Mean size of the lesions was 16 (8–25) mm. There were four cases of low-grade dysplasia adenoma, 13 cases of high-grade dysplasia adenoma, one intramucosal adenocarcinoma, and one adenocarcinoma with superficial submucosal invasion. FTR was technically successful in 90% (17/19) of cases. R0 and concurrently curative resection was achieved in 74% (14/19) of cases. In 2 patients with large LRNs, a combination of endoscopic mucosal resection and FTR was successfully used. Complications were noted in 11% (2/19) of cases, 1 patient suffered from delayed bleeding, and one patient from acute appendicitis, but both responded to conservative treatment. Conclusion: In our series of 19 patients with difficult LRN, FTR was technically feasible in 90% of cases. Both R0 and curative resection were achieved in 74% of cases. Mild complications not requiring surgery occurred in 11% of patients.Key words:
local residual neoplasia – endoscopic full-thickness resection – endoscopic mucosal resection – colorectal cancerThe authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Submitted: 16. 4. 2018
Accepted: 12. 5. 2018
Autori: Přemysl Falt 1,2
; T. Hucl 3; P. Fojtík 4; P. Drastich 3
; J. Martínek 3; R. Andělová 5; L. Voska 6; J. Špičák 3; O. Urban 1,2
Pôsobisko autorov: II. interní klinika – gastroenterologie a geriatrie LF UP a FN Olomouc 1; Katedra interních oborů, LF UK v Hradci Králové 2; Klinika hepatogastroenterologie, Transplantcentrum, IKEM, Praha 3; Centrum péče o zažívací trakt, Vítkovická nemocnice a. s., Ostrava 4; Oddělení patologie, Nemocnice Nový Jičín a. s. 5; Pracoviště klinické a transplantační patologie, Transplantcentrum, IKEM, Praha 6
Vyšlo v časopise: Gastroent Hepatol 2018; 72(3): 206-211
Kategória: Digestivní endoskopie: původní práce
doi: https://doi.org/10.14735/amgh2018206Súhrn
Úvod:
Endoskopická transmurální resekce (FTR – full-thickness resection) je nová technika resekce stěny tlustého střeva. Limitované zkušenosti naznačují možnou efektivitu a bezpečnost v léčbě lokálních reziduálních neoplazií (LRN), jejichž další endoskopická léčba bývá komplikována jizevnatými změnami a příznakem „non-liftingu“.Metodika:
Do studie byli zařazeni prospektivně sledovaní pacienti indikovaní k FTR pro obtížné LRN po min. jedné neúspěšné endoskopické léčbě ve dvou terciárních endoskopických centrech od června 2016 do ledna 2018. Primárními sledovanými parametry byly technická úspěšnost, dosažení R0 a kurativní resekce a výskyt komplikací.Výsledky:
Celkem bylo ošetřeno 19 pacientů (věk 69,2 ± 10,5 let; 79 % muži). LRN byly v 6 případech lokalizovány v rektu a v 13 případech v tračníku a jejich průměrná velikost byla 16 (8–25) mm. Histologicky se jednalo o adenomy s intraepiteliální neoplazií nízkého stupně (4), adenomy s intraepiteliální neoplazií vysokého stupně (13), intramukózní adenokarcinom (1) a adenokarcinom s povrchovou submukózní invazí (1). FTR bylo technicky úspěšné v 90 % (17/19). R0 a současně kurativní resekce bylo dosaženo v 74 % (14/19) případů. Ve 2 případech rozsáhlé LRN byla použita kombinace endoskopické slizniční resekce a FTR. Komplikace byly zaznamenány v 11 % (2/19). V 1 případě šlo o významnou hematochezii bez nutnosti endoskopické nebo chirurgické léčby a v 1 případě o akutní apendicitu po FTR periapendikulární léze řešenou antibiotiky a prodloužením hospitalizace. Závěr: V našem souboru 19 nemocných ošetřených FTR pro obtížné LRN tlustého střeva prokazujeme technickou úspěšnost metody v 90 % případů a dosažení R0 a kurativní resekce v 74 % případů. Komplikace nevyžadující chirurgickou léčbu se vyskytly u 11 % nemocných.Klíčová slova:
lokální reziduální neoplazie – endoskopická transmurální resekce – endoskopická slizniční resekce – kolorektální karcinomÚvod
Lokální reziduální neoplazie (LRN) jsou častým následkem endoskopické slizniční resekce (EMR) povrchových neoplastických lézí tračníku. Vyskytují se zejména po EMR větších lézí (> 20 mm) a při resekci po částech („piecemeal“). Další endoskopická léčba LRN bývá komplikována submukózní fibrózou, a tím i příznakem „non-liftingu“. K eradikaci některých LRN mohou být nutné opakované koloskopie a některé léze musí být řešeny i chirurgicky, přestože obvykle neobsahují invazivní neoplazii. Standardní endoskopická léčba LRN navíc obvykle nedosáhne en bloc resekce, což komplikuje následné histologické hodnocení. Endoskopická transmurální („full-thickness“) resekce (FTR) je nová endoskopická technika umožňující resekci celé stěny trávicí trubice [1]. FTR kombinuje techniku OTS (over-the-scope) klipu a EMR pomocí „capu“ (obr. 1). Za hlavní indikaci FTR jsou považovány adenomy s pozitivním příznakem „non-liftingu“ a LRN v tlustém střevě. Dle zatím limitovaných dat vykazuje FTR poměrně vysokou efektivitu a příznivý bezpečnostní profil [2]. Naše práce analyzuje soubor nemocných ošetřených technikou FTR pro LRN tlustého střeva ve dvou terciárních endoskopických centrech.
Obr. 1. A. Lokální reziduální neoplazie rekta, v okolí patrné koagulační body k označení zdravých okrajů léze; B. vtahování léze do „capu“ s nasazeným OTS klipem speciálními kleštěmi zavedenými pracovním kanálem koloskopu; C. nasazený OTS klip s příznakem terče („target sign“) indikující správně provedenou transmurální resekci; D. resekát našpendlený na korkovou podložku, histologické vyšetření prokázalo R0 resekci tubulovilózního adenomu s HGIN.
Fig. 1. A. Local residual neoplasia (LRN) in the rectum, coagulation marks evident around the lesion; B. pulling the lesion into the cap with an over-the-scope (OTS) clip using a grasper introduced through the working channel of the colonoscope; C. OTS clip with target signindicating a correctly completed transmural resection; D. specimen pinned on a cork board, histology showed completely resected tubulovillous adenoma with high-grade dysplasia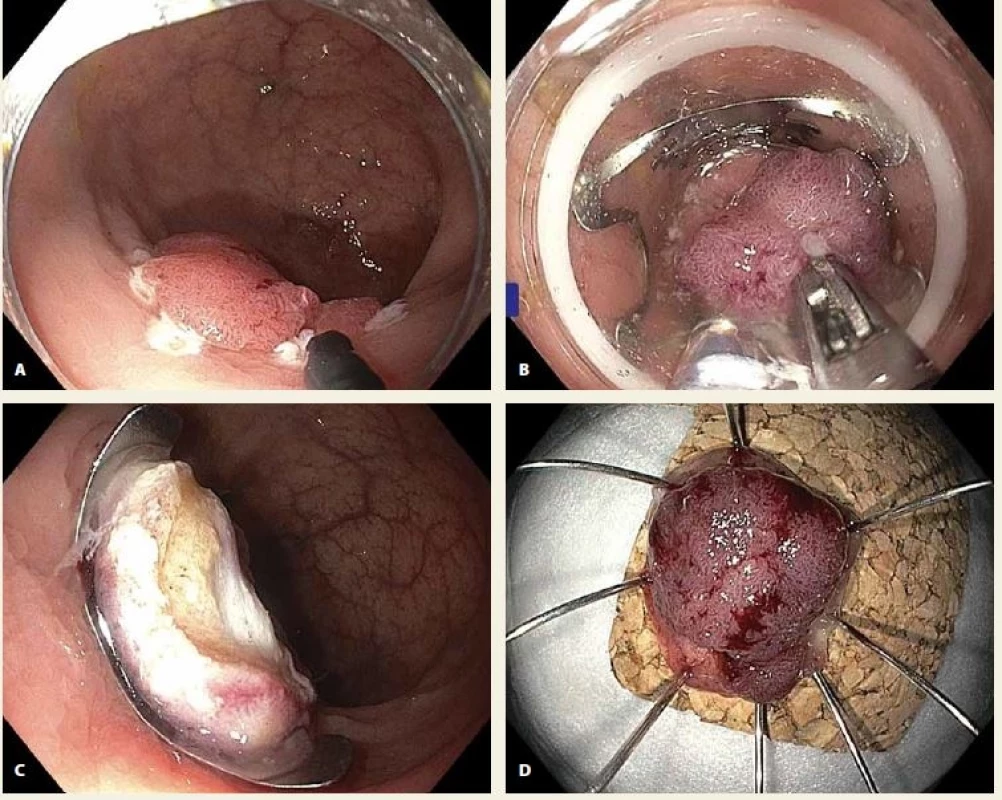
Metodika
Do souboru byli zařazeni prospektivně sledovaní nemocní ošetření technikou FTR pro LRN po předchozí endoskopické resekci. Indikací k FTR byly obtížné LRN nevhodné k běžné endoskopické ablaci nebo resekci, tedy LRN recidivující po min. jedné endoskopické léčbě, s pozitivním příznakem „non-liftingu“, v nevhodné lokalizaci a/nebo s možnou přítomností pokročilé neoplazie. Výkony byly provedeny ve dvou terciárních endoskopických centrech (Vítkovická nemocnice a. s., Ostrava; IKEM, Praha). Všichni pacienti podepsali informovaný souhlas a k výkonu byli připraveni standardní dělenou střevní očistou. Po vizualizaci léze a označení okrajů koagulačními body byl zaveden standardní koloskop s nasazeným FTR setem. Léze byla vtažena do „capu“ a po uvolnění OTS klipu byl vytvořený pseudopolyp resekován čistým řezacím proudem. Resekát byl extrahován a našpendlen na korkovou podložku. Bezprostředně po výkonu bylo jednorázově podáno širokospektré antibiotikum a pacienti byli sledováni za krátkodobé hospitalizace.
Hlavními sledovanými parametry byly technická úspěšnost FTR, dosažení R0 a kurativní resekce a výskyt komplikací. Technická úspěšnost byla definována jako úspěšné vtažení léze do nástavce FTR setu s následnou resekcí naloženou kličkou, R0 resekce jako histologicky potvrzená kompletní en bloc resekce neoplastické léze a kurativní resekce jako R0 resekce neoplazie s nízkým rizikem lymfatické diseminace, tedy s max. povrchovou submukózní invazí a absencí nepříznivých prognostických faktorů [3].
Výsledky
Od června 2016 do ledna 2018 bylo ošetřeno celkem 19 nemocných (věk 69,2 ± 10,5 let, 79 % mužů). Indikací k ošetření byly LRN po předchozí EMR, v jednom případě šlo o LRN po transanální endoskopické mikrochirurgii, všichni nemocní podstoupili již min. 1× neúspěšnou endoskopickou léčbu LRN. Léze byly lokalizovány v rektu (6), descendens (1), transverzu (3) a ascendens (4) a céku (5), z toho 2 periapendikulárně. Průměrná velikost lézí byla 16 (8–25) mm a jednalo se o léze typu 0–IIa (7), 0–Is (2), 0–IIa + Is (8) a 0–IIa + IIc (2) dle Pařížské klasifikace [4]. Histologicky se jednalo o adenom s intraepiteliální neoplazií nízkého stupně (LGIN – low-grade intraepitelial neoplasia) (4), adenom s intraepiteliální neoplazií vysokého stupně (HGIN – high-grade intraepitelial neoplasia) (13), intramukózní adenokarcinom (1) a adenokarcinom s povrchovou submukózní invazí (1). Průměrná velikost transmurálního resekátu byla 22 (10–28) mm. Během výkonu byly 2 nemocní s lézí v rektu bez sedace, 6 se sedací midazolamem, 10 se sedací kombinací midazolamu a fentanylu a 1 nemocná v celkové anestezii po neúspěšném dosažení léze céka v analgosedaci. Průměrná doba hospitalizace byla 1,7 (1–5) nocí po výkonu.
FTR bylo technicky úspěšné u 17 z 19 pacientů (90 %). V jednom případě nebylo možné vtáhnout fixovanou lézi rekta do „capu“ a léze byla ošetřena polypektomickou kličkou a argonovou plazmakoagulací (APC) (obr. 2). V jednom případě došlo k prasknutí kličky po naložení OTS klipu, léze poté byla resekována kličkou nad naloženým OTS klipem. R0 a současně kurativní resekce bylo dosaženo u 14 z 19 pacientů (74 %). Ve dvou již zmíněných případech nebyla FTR technicky úspěšná a ve dvou případech došlo k asymetrickému vtažení léze do „capu“, makroskopicky inkompletní resekci tubulárního adenomu s HGIN a resekce byla dokončena kličkou a bioptickými kleštěmi nad OTS klipem (obr. 3). V jednom případě bylo kompletně resekováno centrum léze s fokusem povrchově submukózně invadujícího karcinomu, ale drobná rezidua tubulárního adenomu s HGIN musela být odstraněna kličkou a bioptickými kleštěmi.
Obr. 2. A. LRN v jizvě po EMR v rektu; B. neúspěšný pokus o vtažení fixované léze do „capu“.
Fig. 2. A. LRN in a post-EMR scar in the rectum; B. an unsuccessful attempt to pull the lesion into the cap.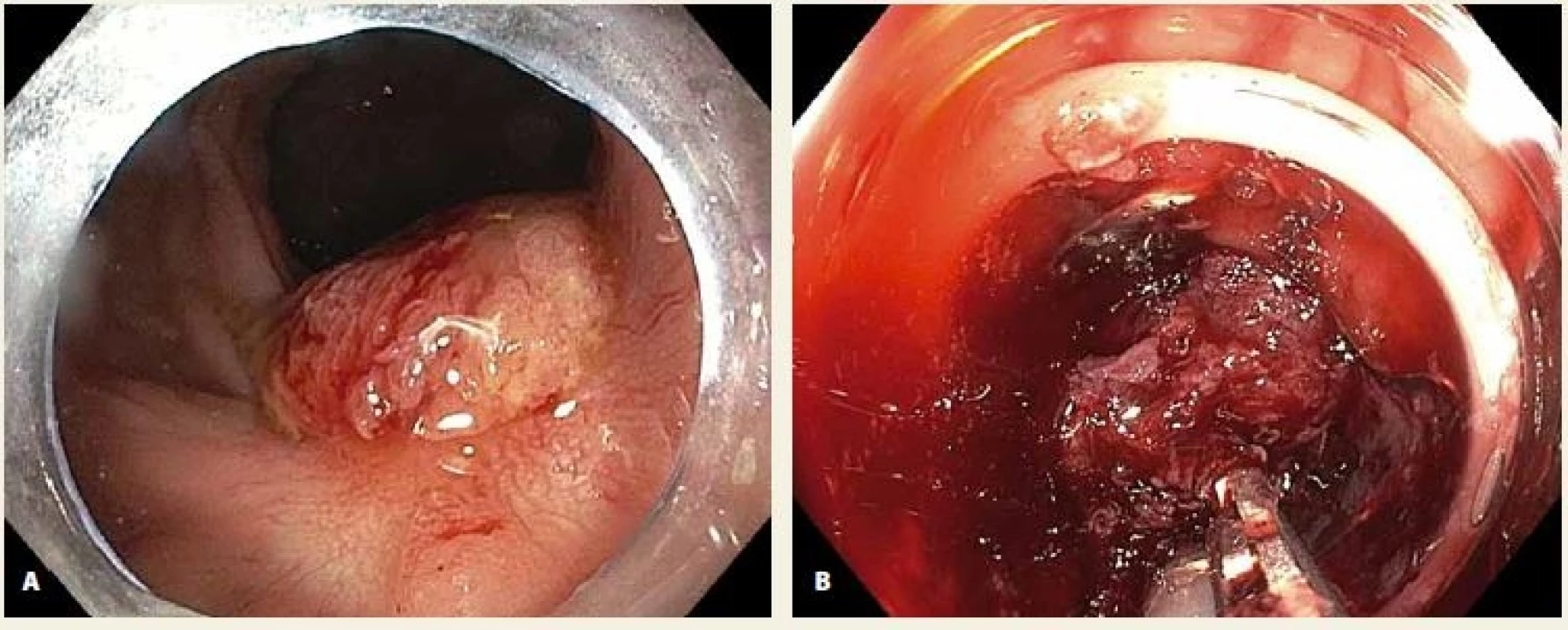
Obr. 3. A. Resekát na korkové podložce po inkompletní resekci LRN ascendens, fragmenty neoplazie jsou patrné v okraji resekátu; B. místo resekce s drobným reziduem LRN nad naloženým OTS klipem. Fig. 3. A. Specimen on a cork board after an incomplete resection of LRN in the ascending colon, fragments of neoplastic tissue evident at the resection margins; B. residual neoplastic tissue above the OTS clip. 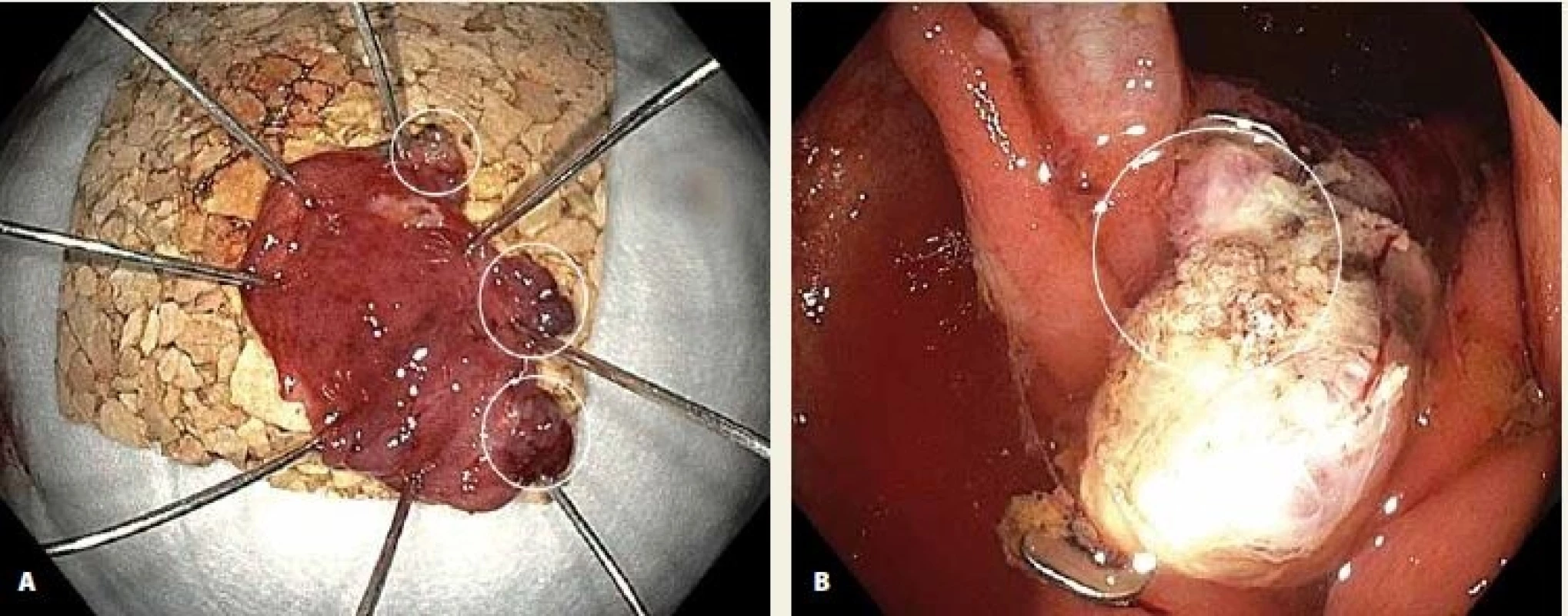
Ve dvou případech byla vzhledem k velikosti léze a předpokládané nemožnosti vtažení celé léze do „capu“ provedena kombinace EMR a FTR v jedné době. Jednalo se o LRN v rektu a na bázi céka, v obou případech byly okrajové části odstraněny EMR s nálezem adenomu s LGIN a centrální fixovaná část odstraněna FTR s negativními laterálními okraji a nálezem adenomu s HGIN (obr. 4). V 10 případech kurativní resekce byla provedena kontrolní koloskopie s nálezem endoskopicky i histologicky negativní jizvy, a to vč. obou případů kombinace EMR a FTR (obr. 5). V ostatních 7 případech koloskopie zatím nebyla provedena. Negativní koloskopie byla i u 1 z pacientů po inkompletní resekci.
Obr. 4. A. LRN v rektu s výraznou centrální fixací; B. příznak terče („target sign“) po kombinaci EMR okrajových částí a FTR centrální fixované části.
Fig. 4. A. LRN in the rectum with signicant central scarring; B. target sign after EMR of the lateral parts and FTR of the central part of the lesion.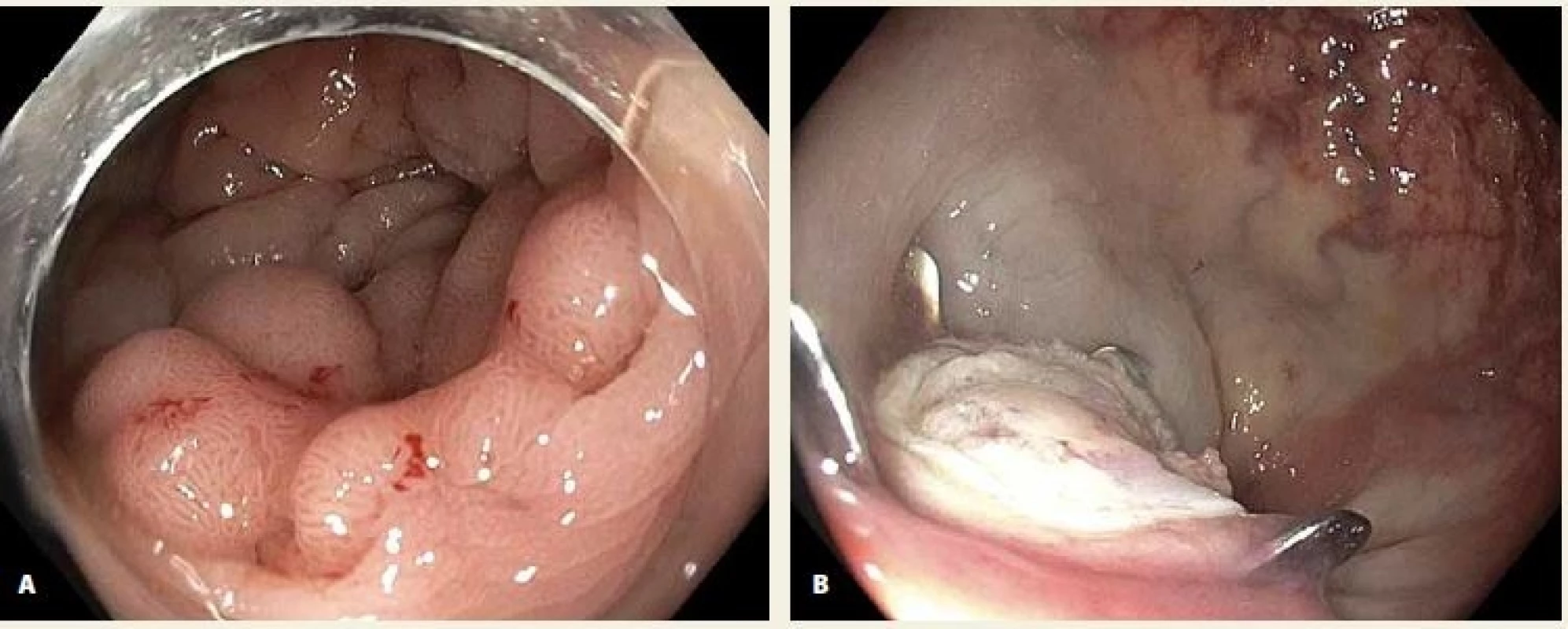
Obr. 5. Klidná jizva po FTR LRN hepatální flexury.
Fig. 5. Negative scar after FTR of a LRN in the hepatic flexure.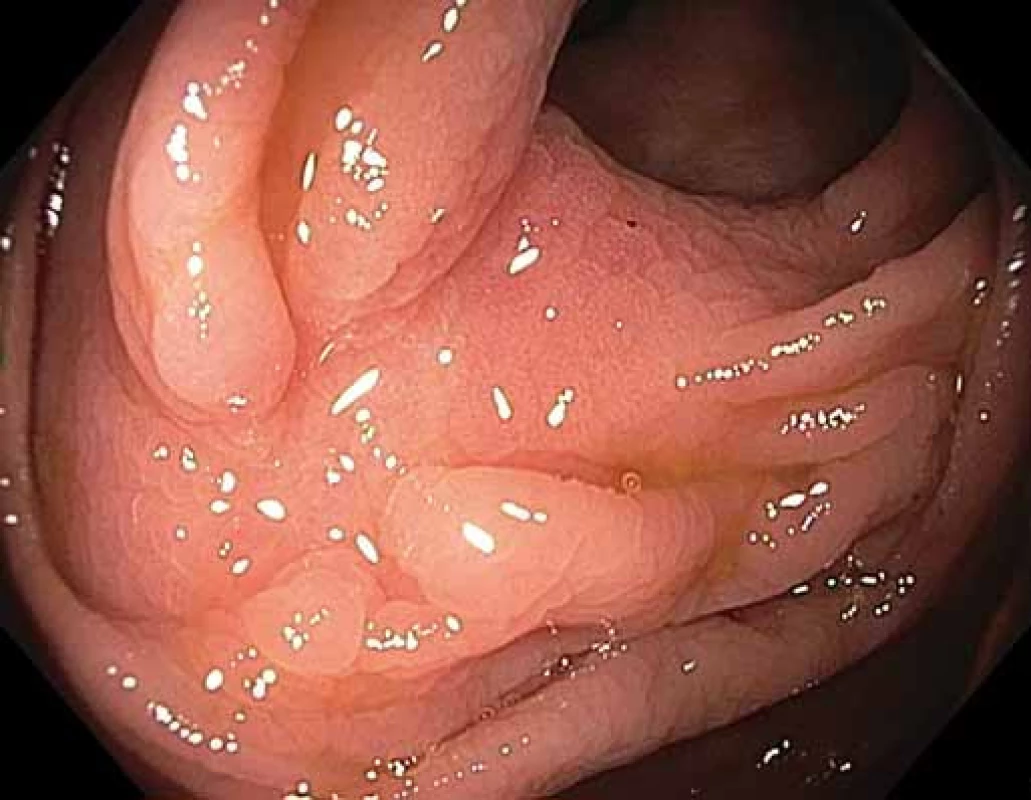
Komplikace byla zaznamenána u 2 z 19 pacientů (11 %). V jednom případě došlo 14 dní po FTR k významné hematochezii u pacienta na nepřerušené antiagregační léčbě kyselinou acetylsalicylovou. Pacient byl krátkodobě hospitalizován s provedením koloskopie (obr. 6) bez nutnosti endoskopické léčby nebo krevních převodů. Další pacient po FTR periapendikulární LRN vykazoval klinické a laboratorní známky akutní apendicitidy, která byla úspěšně vyřešena prodloužením hospitalizace a intravenózními antibiotiky.
Obr. 6. Spodina po FTR s již nepřítomným OTS klipem přisedlým koagulem u pacienta hospitalizovaného pro hematochézii 14. den po FTR.
Fig. 6. Base after FTR with adhered coagulum in patient readmitted for haematochesia on the 14th day after FTR.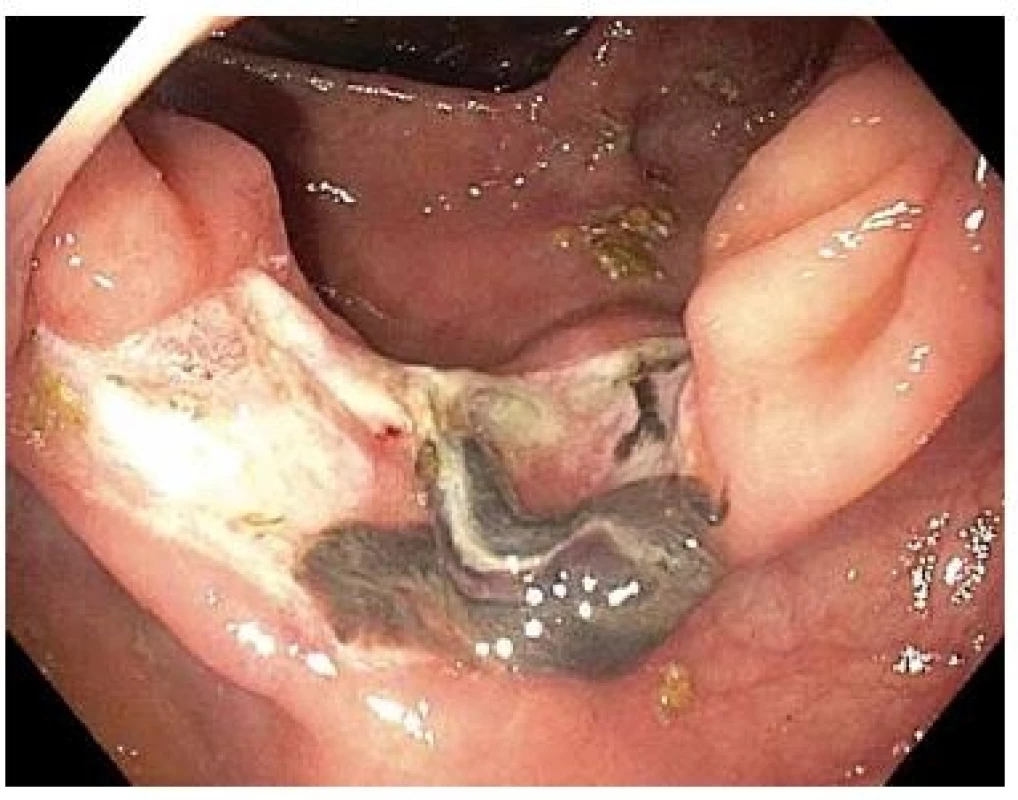
Diskuze
LRN jsou poměrně častým následkem EMR povrchových neoplastických lézí tlustého střeva, podle recentních metaanalýz je jejich výskyt udáván u asi 15 % pacientů [5,6]. Za zmínku stojí dva české soubory pacientů s frekvencí LRN 21,5 a 17,7 % [7,8]. Byly identifikovány některé rizikové faktory vzniku LRN, za nejvýznamnější jsou považovány velikost původní léze nad 20 mm a provedení EMR po částech („piecemeal“) [6,7,9]. LRN detekované během kontrolní koloskopie jen výjimečně obsahují invazivní neoplazii [5], ale přítomnost LRN zvyšuje riziko vzniku kolorektálního karcinomu [10]. Spekuluje se i o vyšší biologické agresivitě LRN ve srovnání s původní neoplazií [11]. Léčba LRN je komplikována přítomností submukózní fibrózy. Volba techniky endoskopické léčby závisí na velikosti LRN, přítomnosti „liftingu“, předpokládané histologii a lokalizaci. Pro drobné LRN se obvykle použí-vá klešťová biopsie a ablace APC, pro větší LRN s „liftingem“ re-EMR, při absenci „liftingu“ lze zvážit endoskopickou submukózní disekci (ESD) nebo její kombinaci s EMR. Zřídka je nutná chirurgická resekce [12], která, a to i pokud je provedena pro benigní afekci, je zatížena nezanedbatelnou morbiditou a mortalitou [13]. Jedno sezení endoskopické léčby nemusí být úspěšné a někteří nemocní proto musí absolvovat opakované koloskopie [6,7]. Použití klešťové biopsie, APC a/nebo EMR po částech navíc komplikuje histologické hodnocení a znemožňuje posouzení R0 resekce. Úspěšnost léčby je tak hodnocena inspekcí jizvy a biopsiemi při další koloskopii. Pokus o en bloc resekci LRN pomocí ESD bývá technicky a časově náročný a je i zatížen vyšším rizikem perforace [14,15].
FTR je nová endoskopická technika umožňující resekci celé stěny tlustého střeva od roku 2016 dostupná i v ČR [16]. Zatím největší publikovaný soubor 181 pacientů přináší multicentrická německá studie WALL-RESECT. FTR byla technicky úspěšná v 90 % a R0 resekce bylo dosaženo v 77 %, při nálezu karcinomu v resekátu ale bylo pouze 45 % resekcí hodnoceno jako kurativních pro výskyt hluboké submukózní invaze u zbylých lézí. Ke komplikacím jako krvácení, akutní apendicita a perforace došlo u 10 % pacientů [2]. LRN jsou sice považovány za vhodnou indikaci k FTR, zkušenosti jsou ale zatím limitované [17] a žádný soubor pacientů s LRN zatím nebyl publikován.
V našem souboru 19 nemocných s LRN již po min. 1 neúspěšné endoskopické léčbě jsme dosáhli R0 a současně kurativní resekce v 74 % případů. Za hlavní limitaci našeho souboru považujeme relativně malý počet ošetřených nemocných a absenci kontrolní koloskopie u části z nich. Ve srovnání se standardní endoskopickou léčbou je potenciální výhodou FTR rychlost provedení, menší technická náročnost, vysoká pravděpodobnost en bloc resekce, předpokládaná bezpečnost a díky transmurálnímu resekátu i detailní lokální staging v případě invazivní neoplazie. Ve srovnání s nativními lézemi je vzhledem k přítomnosti fibrotických změn třeba počítat s menším rozsahem resekce. V souboru pacientů s LRN byla průměrná velikost resekátu 22 (10–28) mm, zatímco u 8 pacientů s adenokarcinomy s povrchovou submukózní invazí ošetřených na našich pracovištích byla průměrná velikost resekátu 29 (20–34) mm. Vtažení LRN léze do „capu“ může být asymetrické, obtížné až zcela nemožné a bude zřejmě nejčastější příčinou selhání FTR v léčbě LRN. Dle našich zkušeností bývá fixace nejvýraznější v rektu. U některých pacientů lze s výhodou využít dvoukanálového endoskopu a zachycení léze dvojicí kleští (obr. 7). Ve vybraných případech rozsáhlejších LRN lézí se lze pokusit o kombinaci EMR a FTR [17,18], nevýhodou je ale problematické hodnocení R0 resekce v případě invazivní neoplazie. Další limitací FTR může být obtížné zavedení koloskopu s FTR setem přes anus a do orálních partií tlustého střeva. Náklady spojené s ošetřením zatím samozřejmě nejsou hrazeny plátci zdravotní péče.
Obr. 7. Zachycení LRN dvojicí kleští s použitím dvoukanálového endoskopu.
Fig. 7. Pulling the lesion by two graspers introduced through a double-channel endoscope.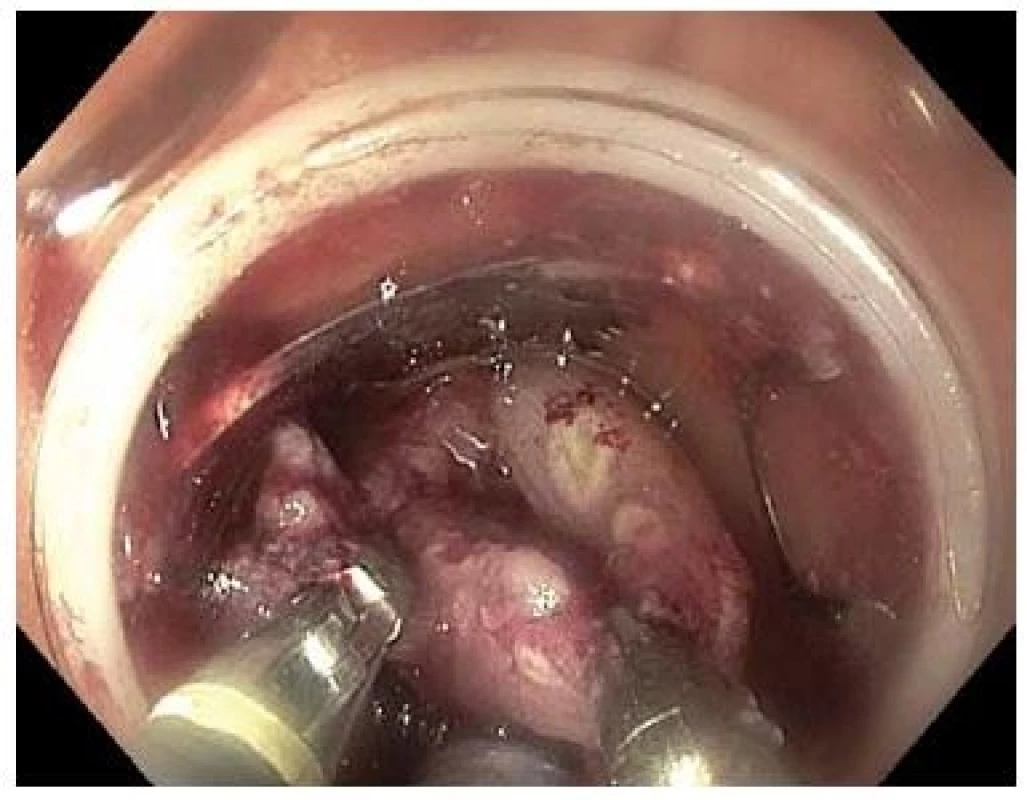
V našem souboru 19 pacientů ošetřených FTR pro obtížné LRN prokazujeme technickou úspěšnost v 90 % případů. R0 a kurativní resekce bylo dosaženo u 74 % pacientů. Hlavním důvodem selhání bylo obtížné až nemožné vtažení jizevnatě fixované léze do „capu“. Komplikace nevyžadující chirurgickou léčbu se vyskytly v 11 % případů. FTR může představovat efektivní a bezpečnou alternativu léčby vybraných LRN nevhodných ke standardní endoskopické léčbě
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 16. 4. 2018
Přijato: 12. 5. 2018
MUDr. Přemysl Falt, Ph.D.
II. interní klinika – gastroenterologie a geriatrie
LF UP a FN Olomouc
I. P. Pavlova 185/6 779 00 Olomouc
Zdroje
1. Schmidt A, Meier B, Caca K. Endoscopic full-thickness resection: current status. World J Gastroenterol 2015; 21 (31): 9273–9285. doi: 10.3748/wjg.v21.i31.9273.
2. Schmidt A, Beyna T, Schumacher B et al. Colonoscopic full-thickness resection using an over-the-scope device: a prospective multicentre study in various indications. Gut 2017. In press. doi: 10.1136/gutjnl-2016-313677.
3. Falt P, Urban O, Suchánek Š et al. Doporučené postupy České gastroenterologické společnosti JEP pro diagnostickou a terapeutickou koloskopii. Gastroent Hepatol 2016; 70 (6): 523–538. doi: 10.14735/amgh2016csgh.info19.
4. The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach, and colon: November 30 to December 1, 2002. Gastrointest Endosc 2003; 58 (6 Suppl): S3–S43.
5. Hassan C, Repici A, Sharma P et al. Efficacy and safety of endoscopic resection of large colorectal polyps: a systematic review and meta-analysis. Gut 2016; 65 (5): 806–820. doi: 10.1136/gutjnl-2014-308481.
6. Belderbos TD, Leenders M, Moons LM et al. Local recurrence after endoscopic mucosal resection of nonpedunculated colorectal lesions: systematic review and meta-analysis. Endoscopy 2014; 46 (5): 388–402. doi: 10.1055/s-0034-1364970.
7. Urban O, Kijonkova B, Kajzrlikova IM et al. Local residual neoplasia after endoscopic treatment of laterally spreading tumors during 15 months of follow-up. Eur J Gastroenterol Hepatol 2013; 25 (6): 733–738. doi: 10.1097/MEG.0b013e32835eda96.
8. Brogyuk N, Grega T, Voška M et al. Rizikové faktory lokální reziduální neoplazie po endoskopické mukózní resekci. Gastroenterol Hepatol 2017; 71 (5): 394–400. doi: 10.14735/amgh2017394
9. Moss A, Williams SJ, Hourigan LF et al. Long-term adenoma recurrence following wide-field endoscopic mucosal resection (WF-EMR) for advanced colonic mucosal neoplasia is infrequent: results and risk factors in 1000 cases from the Australian Colonic EMR (ACE) study. Gut 2015; 64 (1): 57–65. doi: 10.1136/gutjnl-2013-305516.
10. Cottet V, Jooste V, Fournel I et al. Long-term risk of colorectal cancer after adenoma removal: a population-based cohort study. Gut 2012; 61 (8): 1180–1186. doi: 10.1136/gutjnl-2011-300295.
11. Kunihiro M, Tanaka S, Haruma K et al. Electrocautery snare resection stimulates cellular proliferation of residual colorectal tumor: an increasing gene expression related to tumor growth. Dis Colon Rectum 2000; 43 (8): 1107–1115.
12. Urban O, Pipek B, Kajzrlikova IM et al. The efficacy of treatment of local residual neoplasia under standardized conditions. Vnitr Lek 2016; 62 (5): 365–369.
13. Le Roy F, Manfredi S, Hamonic S et al. Frequency of and risk factors for the surgical resection of nonmalignant colorectal polyps: a population-based study. Endoscopy 2016; 48 (3): 263–270. doi: 10.1055/s-0034-1392976.
14. Pimentel-Nunes P, Dinis-Ribeiro M, Ponchon T et al. Endoscopic submucosal dissection: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2015; 47 (9): 829–854. doi: 10.1055/s-0034-1392882.
15. Kuroki Y, Hoteya S, Mitani T et al. Endoscopic submucosal dissection for residual/locally recurrent lesions after endoscopic therapy for colorectal tumors. J Gastroenterol Hepatol 2010; 25 (11): 1747–1753. doi: 10.1111/j.1440-1746.2010.06331.x.
16. Falt P, Urban O, Hanousek M et al. “Full-thickness” endoskopická resekce lokální reziduální neoplazie v hepatální flexure – videokazuistika. Gastroenterol Hepatol 2016; 70 (5): 398–401. doi: 10.14735/amgh2016398
17. Falt P, Štěpán M, Andělová R et al. Kombinace endoskopické slizniční resekce a transmurální resekce v léčbě lokálních reziduálních neoplazií tračníku – popis dvou případů. Rozhl Chir 2017; 96 (9): 394–398.
18. Falt P, Andělová R, Urban O. Kombinace endoskopické slizniční resekce a „full-thickness“ resekce v léčbě adenomu ascendens s příznakem „non-liftingu“ – kazuistika. Gastroenterol Hepatol 2017; 72 (2): 148–151. doi: 10.14735/amgh2018csgh.info03.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článek Digestivní endoskopieČlánek Videoprezentace
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2018 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Editorial šéfredaktora časopisu
- Digestivní endoskopie
- Jaká byla příčina vzniku obrovského žaludečního vředu?
- Srovnání endoskopické slizniční resekce a endoskopické submukózní disekce při léčbě plochých neoplastických lézí konečníku
- Cholangiopankreatoskopie – doporučený postup České gastroenterologické společnosti ČLS JEP
- Endoskopická transmurální resekce v léčbě lokálních reziduálních neoplazií tlustého střeva – analýza souboru 19 pacientů
- Případ maligního melanomu metastazujícího do pankreatu
- Úspěšná léčba krvácení z aortoezofageální píštěle metalickým samoexpandibilním stentem
- Migrace samoexpandibilního metalického stentu do drénované pseudocysty po endoskopické pseudocystogastrostomii a jeho endoskopická extrakce
- Adenóm Brunnerových žliaz – zriedkavá príčina krvácania z gastrointestinálneho traktu
- 40. české a slovenské endoskopické dny 19. endoskopický den IKEM - Postery
- Videoprezentace
- Příspěvek k problematice hepatorenálního poškození a selhání
- Naše zkušenosti s léčbou masivního krvácení u Crohnovy nemoci pomocí anti-TNF terapie
- Intoxikácia Amanita phalloides – stále aktuálny problém?
- Tumorózní atrioezofageální píštěl jako neobvyklý zdroj sepse
- Nový člen redakční rady časopisu
- 40th Czech and Slovak Endoscopic Days 19th Endoscopic Day IKEM
- Výběr z mezinárodních časopisů
- Správná odpověď na kvíz NSA-gastropatie
- Kreditovaný autodidaktický test: digestivní endoskopie
- Vistaprep – standard přípravy střeva před koloskopickým vyšetřením
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Vistaprep – standard přípravy střeva před koloskopickým vyšetřením
- Tumorózní atrioezofageální píštěl jako neobvyklý zdroj sepse
- Intoxikácia Amanita phalloides – stále aktuálny problém?
- Naše zkušenosti s léčbou masivního krvácení u Crohnovy nemoci pomocí anti-TNF terapie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



