-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Resekce gliomů inzuly – volumetrické hodnocení radikality
Resection of Insular Gliomas – Volumetric Assessment of Radicality
Aim:
The main aim of this work is to document the operability of insular gliomas and to evaluate the achieved radicality of resection exactly.Patients and methods:
The prospectively studied patient group included eight patients harboring an insular glioma, who were operated on in the period of 18 months. The radicality of the resection was evaluated with the use of two methods. For quick evaluation, a simple ellipsoid approximation was used. A volumetric evaluation using semiautomatic segmentation was used as a precise, yet more elaborate method.Results:
There was no permanent neurological morbidity in our study group. We could achieve an average 84% (56 – 100%) tumor mass reduction. In the group of seven large and surgically complex WHO grade II and III gliomas, we achieved an average 82% tumor mass reduction (56 – 94%). The semiautomatic segmentation volumetry showed minimal deviation of the measurements and it played a crucial role especially in residual tumor volume evaluation.Conclusions:
There is no standard method for the treatment for low-grade insular glioma. As a general recommendation, we prefer an active and maximally radical approach, mainly due to the risk of undiagnosed anaplastic astrocytoma. The intraoperative motor evoked potentials monitoring and a meticulous microsurgical preparation of the middle cerebral artery branching, as well as the preoperative knowledge of the position of the lenticulostriate perforators are of utmost importance for the safety of the surgery.Key words:
insula – glioma – magnetic resonance imaging – motor evoked potentials
Autoři: R. Bartoš 1,4; M. Sameš 1; A. Zolal 1; T. Radovnický 1; A. Hejčl 1; P. Vachata 1,4; F. Cihlář 2; D. Bejšovec 3; P. Petrovický 4
Působiště autorů: Krajská zdravotní, a. s., Masarykova nemocnice v Ústí nad Labem, o. z. Neurochirurgická klinika UJEP 1; Krajská zdravotní, a. s., Masarykova nemocnice v Ústí nad Labem, o. z. Radiodiagnostické oddělení 2; Krajská zdravotní, a. s., Masarykova nemocnice v Ústí nad Labem, o. z. Oddělení anestezie a intenzivní medicíny 3; Krajská zdravotní, a. s., Masarykova nemocnice v Ústí nad Labem, o. z. Anatomický ústav 1. LF UK v Praze 4
Vyšlo v časopise: Cesk Slov Neurol N 2009; 72/105(6): 534-541
Kategorie: Původní práce
Souhrn
Cíl:
Hlavním cílem práce bylo zdokumentovat operabilitu inzulárních gliomů a exaktně vyhodnotit dosaženou radikalitu resekcí.Soubor a metodika:
Prospektivně vedený soubor tvoří osm pacientů s inzulárním gliomem operovaných v období 18 měsíců. Radikalita resekce byla hodnocena dvěma metodami – jednoduchou: aproximace ke tvaru rotačního elipsoidu, a náročnější: volumetrie pomocí semiautomatické segmentace.Výsledky:
V našem souboru jsme nezaznamenali trvalou neurologickou morbiditu při dosažení průměrné 84% (56 – 100%) redukce objemu nádoru; v podskupině sedmi objemných a pro resekci náročných gliomů WHO grade II a III byla redukce objemu nádoru 82 % (56 – 94 %). Volumetrie pomocí semiautomatické segmentace vykazovala minimální odchylku mezi jednotlivými měřeními a měla zejména při hodnocení rezidua tumoru nezastupitelnou roli.Závěry:
Léčebný postup u pacienta s nízkostupňovým inzulárním gliomem není jednoznačný, naše doporučení preferuje aktivní a maximálně radikální přístup, zejména pro riziko rychlé progrese nediagnostikovaného anaplastického astrocytomu. Zásadní význam pro bezpečnost operace má intraoperativní monitorování motorických evokovaných potenciálů a pečlivá mikrochirurgická preparace větvení arteria cerebri media včetně znalosti pozice laterálních lentikulostriatálních perforátorů.Klíčová slova:
inzula – gliom – magnetická rezonance – motorické evokované potenciályÚvod
Po diagnóze inzulárního gliomu následuje pro pacienta i lékaře nelehký úkol daný nutností rozhodnutí o dalším postupu. Vzhledem k obtížnosti chirurgického řešení a nedostatku evidence týkající se radikality resekce nízkostupňových gliomů obecně, je častým postupem observace pacienta. Naše pracoviště preferuje aktivní přístup, jsme si ovšem vědomi rizik spojených s operací nádoru v této lokalizaci. Rizika jsou dána potenciální elokvencí přilehlého kortexu, nutností preparace větvení arteria cerebri media (ACM) v úseku od M1/2 po M4 a možností poranění laterálních lentikulostriatálních perforátorů (LLsA) při resekci mediální části nádoru. Za základní předpoklad považujeme mikrochirurgický přístup se širokou disekcí sylvijské rýhy, devaskularizací tumoru koagulací a přerušením inzulárních větévek z M2. Neméně důležité je monitorování integrity pyramidové dráhy pomocí motorických evokovaných potenciálů (MEP). V tomto článku chceme na prospektivně vedeném souboru volumetricky hodnotit dosaženou radikalitu resekcí a popsat naše výsledky a komplikace, které tyto výkony provázely.
Materiál a metodika
Vlastním operacím předcházela anatomická kadaverózní studie inzulárního laloku na čtyřech hemisférách, zaměřená na gyrifikaci a cévní zásobení této oblasti (obr. 1a–c). Následně jsme od října 2007 do března 2009 odoperovali osm gliomů uložených v inzule. Data pacientů byla prospektivně shromažďována. Jedná se o pět mužů a tři ženy, ve věku od 25 do 61 let (průměr 39 let). U pěti pacientů byl nádor lokalizován vpravo, u tří vlevo. Podle Yaşargilovy klasifikace jsme přiřadili dva nádory k typu 3A, tedy pouze v inzulárním laloku; dva k typu 3B, s infiltrací frontálního či temporálního operkula; dva k typu 5A, s postižením frontobazálních struktur či neokortikální části T laloku a dva k typu 5B, tedy obdobně, ale s infiltrací meziotemporálních struktur. Společným jmenovatelem vstupních klinických obtíží byla epilepsie, u tří pacientů ve formě parciálních záchvatů, u dalších pěti sekundárně generalizovaných. U čtyř pacientů se jednalo o low-grade gliom WHO grade II, u tří o anaplastický astrocytom a u jednoho o multiformní glioblastom (GBM). Všichni pacienti byli pečlivě informováni o potenciálních rizicích spojených s operací a podepsali informovaný souhlas. Před operací jsme provedli hodnocení vztahu inzulárního gliomu k laterálním lentikulostriatálním cévám dle Moshela [1]. Pro hodnocení byla na rozdíl od předlohové práce, která využívala DSA, použita neinvazivní magnetická rezonance (obr. 2a, b). Operace byla provedena v celkové anestezii, za monitoringu MEP pomocí přístroje Medelec Synergy (Oxford Instruments, Oxford, Velká Británie) s transkraniální stimulací u šesti pacientů. U dvou pacientů nebyly MEP z technických důvodů prováděny. Náhradním řešením byla přímá subkortikální stimulace za použití Ojemannova stimulátoru (Integra, Plainsboro, USA). Operace byla započata mikrodisekcí sylvijské rýhy v celé její délce s průnikem k inzulární části nádoru. V případě nádorů Yaşargilova typu 5 jsme pokračovali temporální či rozšířenou meziotemporální resekcí tumoru, obdobně při postižení nedominantního frontálního operkula jsme po preparaci frontálních M4 větví toto resekovali. Následně jsme pečlivě ozřejmili inzulární (M2), operkulární (M3) větve a bifurkaci ACM. Pokračovali jsme koagulací a transcizí drobných inzulárních perforátorů zásobujících tumor, s následnou resekcí tumoru průnikem mezi jednotlivými arteriálními větvemi. V distální části inzuly jsme se snažili již perforující větve šetřit, vzhledem k potenciálnímu riziku léze dlouhých inzulárních perforátorů. Důležitým momentem bylo dosažení stavu, kdy se větvení ACM distálně od M1/2 již nacházelo ve volném prostoru (obr. 3a). Pokud byly infiltrovány frontobazální oblasti, po ozřejmení komplexu arteria cerebri anterior a optických struktur jsme resekovali tímto směrem. Konečně jsme pokračovali resekcí mediální inzulární porce nádoru. Při všech operacích jsme se stran hloubky resekce řídili neuronavigací Treon Plus (Medtronic, Minneapolis, USA), samozřejmě s vědomím potenciální nepřesnosti (obr. 4a–c). Obecně jsme volili konzervativní přístup, při němž jsme nepřekročili hloubkou resekce úroveň prvního LLsA odstupujícího z M1 (obr. 3b). Mikroskopická fáze operace, event. jejich součet v případě dvoudobé operace, trvala průměrně téměř 8 hod, v rozmezí od 2 do 10 hod. Relativně krátce trvala operace malého GBM, v případě nízkostupňového gliomu či anaplastického astrocytomu probíhala nejkratší mikroskopická fáze operace 6 hod.
Obr. 1. A. Pohled na gyrifikaci levé inzuly po odstranění frontálního, parietálního a temporálního operkula; asg, amg, psg: gyrus insulae brevis anterior, medius et posterior; alg, plg: gyrus insulae longus anterior et po sterior; 1: sulcus periinsularis anterior, 2: sulcus periinsularis inferior a, pars horizontalis b, pars verticalis; 3: sulcus periinsularis superior; 4: sulcus centralis insulae. B. Inzulární, operkulární a kortikální větve ACM vpravo. C. Odstup laterálních lentikulostriatálních perforátorů z M1. 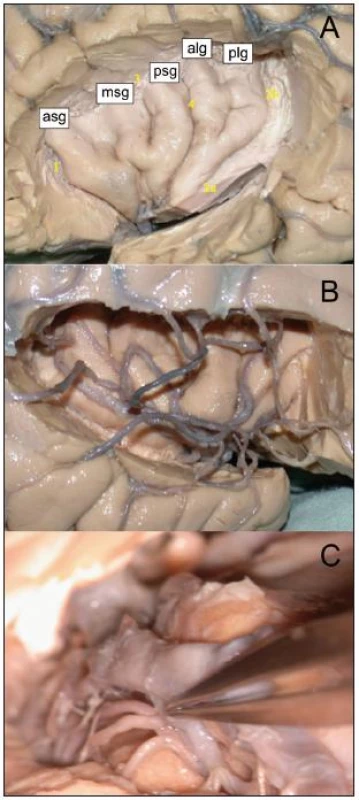
Obr. 2. Vstupní T2 vážená MR pacientky N.4. A. Laterální lentikulostriatální perforátory odtlačeny na mediální okraj nádoru (laterální varianta). B. Odstup LLsA z M1 (A., B. – pozice LLsA označena šipkou). 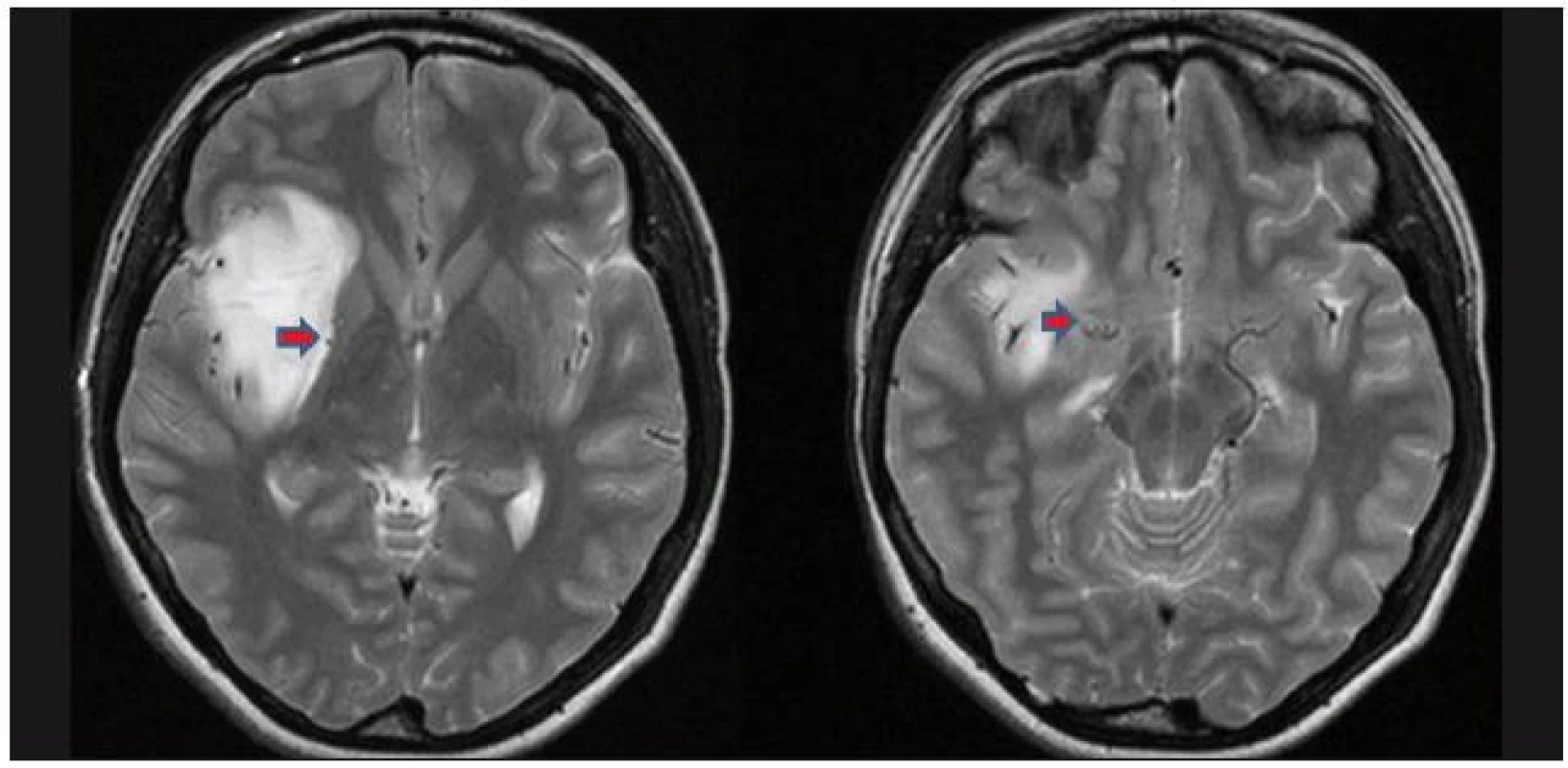
Obr. 3. A. Ozřejmení základních anatomických struktur během resekce insulárního gliomu Yaşargilova typu 5B. B. Odstup LLsA vypreparovaný během resekce inzulárního gliomu (šipka). F: frontální lalok; MCA: větvení arteria cerebri media; CN II: nervus opticus; ACI: arteria cerebri interna; komora: temporální roh postranní komory (meziotemporální struktury a temporální lalok resekovány) 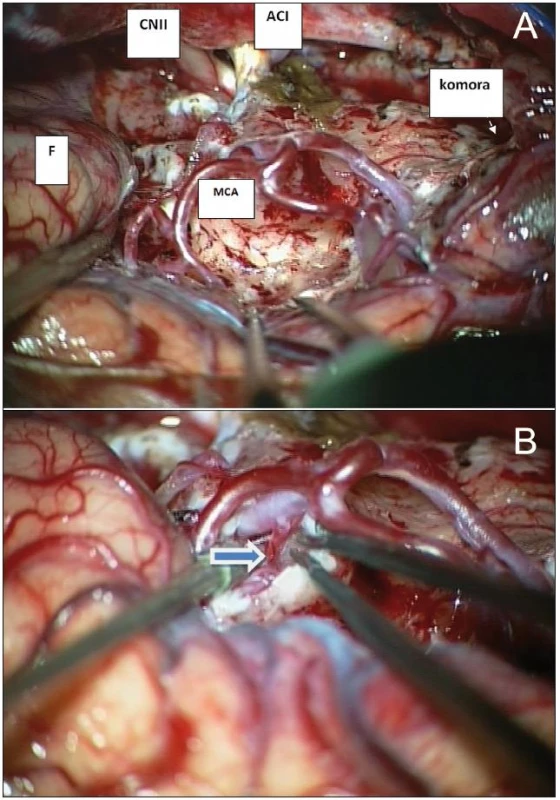
Obr. 4. A. MR-T2 vážený obraz 52leté pacientky (N.2) s inzulárním AA (Yaşargil 3A) před operací. B. MR-T1 vážený obraz intraoperativní navigace zobrazující dosažení mediálního okraje nádoru. C. MR-T2 vážený obraz stejné pacientky 18 měsíců po operaci a dokončené adjuvantní chemoradioterapii (na časné MR po operaci 94% radikalita resekce). 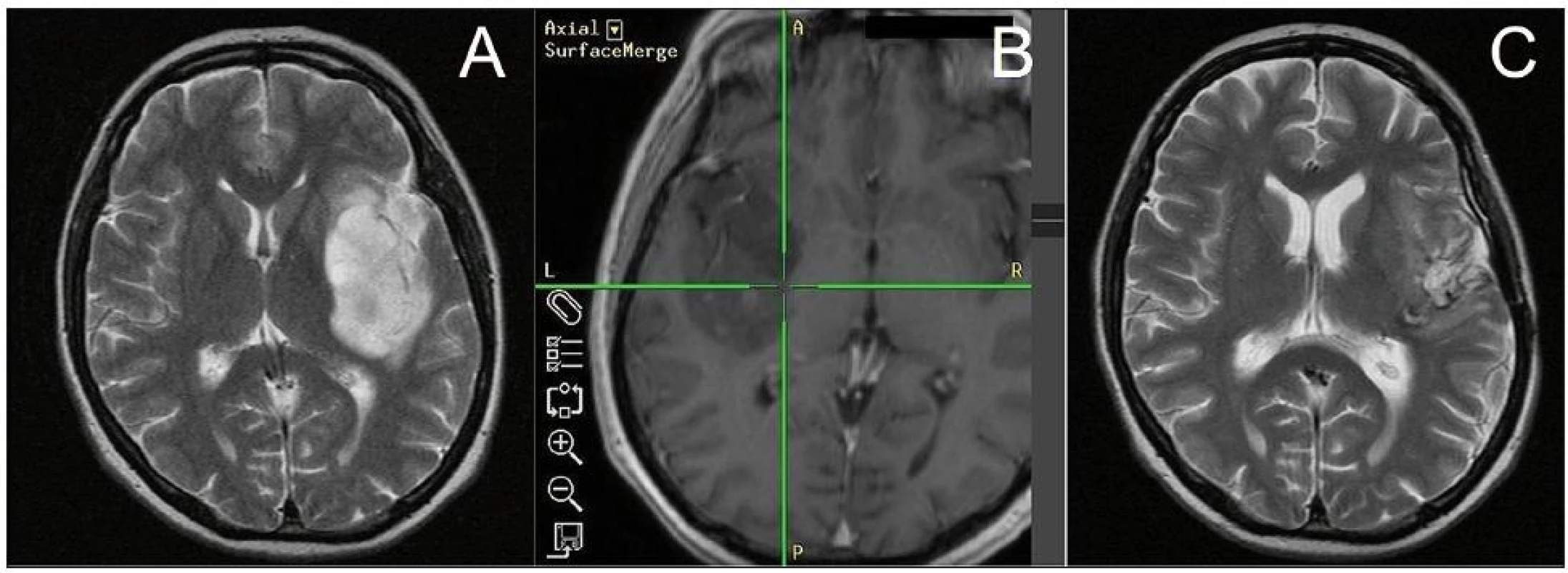
Všem pacientům byla provedena časná grafická kontrola pomocí MR do 72 hod po operaci, další MR včetně navigačních sekvencí se uskutečnila za tři měsíce po operaci.
Kromě klinického výsledku operací pokládáme za klíčový výstup práce také výpočet objemu resekce, respektive rezidua nádoru dvěma volumetrickými metodami. V případě nádorů WHO II a III jsme za definitivní grafická data hodnotící radikalitu operací pokládali MR v T2 vážení provedenou po třech měsících od operace. V jednom zde prezentovaném případě operace inzulárního GBM byla radikalita posuzována na základě časné pooperační MR. Pro jednoduchou a rychlou předběžnou analýzu jsme zvolili metodu výpočtu objemu elipsoidu (V = 4/3 Π a b c), kdy za a–c jsou dosazeny poloměry základních rozměrů tumoru, zjištěné přímým měřením pomocí software MagicWeb (Siemens, Erlangen, Německo). Měření byla prováděna dvěma vyšetřujícími, neurochirurgem a radiologem, výsledné hodnoty jsou aritmetickým průměrem obou měření. Jako metodu přesnějšího výpočtu jsme použili objemovou analýzu prahové konturace doplněné manuální korekcí pre ‑ i postoperativních navigačních dat (volumetrie pomocí semiautomatické segmentace). Pro stanovení objemu tumoru byl použit software StealthDTI (Medtronic, Minneapolis, USA), pro analýzu byly využity sagitální T2 vážené obrazy s vysokým rozlišením vhodné pro použití v módu multiplanar reconstruction (MPR). Pro náběr těchto obrazů byl použit stroj Symphony 1.5T (Siemens, Erlangen, Německo) v módu turbo spin echo s parametry TR: 2 500, TE: 355, matrix 0,5 × 0,5 × 2 mm. Segmentace byla provedena semiautomaticky pomocí startovního bodu a prahování intenzity rozsahu výběru s manuální korekcí rozsahu v oblastech styku rezidua tumoru s postresekční dutinou a komorovým systémem (obr. 5). Měření prováděli dva titíž lékaři vždy třikrát (v axiální, koronární a sagitální rovině). Jako výsledný objem byl brán údaj získaný jako průměr těchto šesti hodnot.
Obr. 5. Volumetrie pomocí semiautomatické segmentace: manuální ohraničení oproti objemu mozkové komory (pacientka N.5: pooperační snímek obr. 7a). 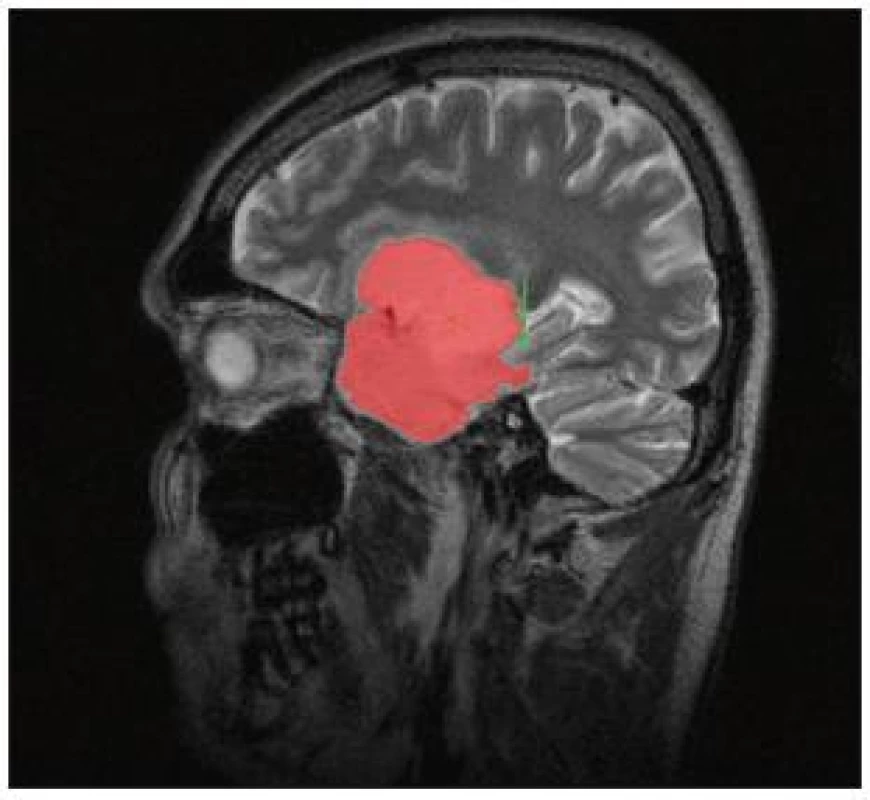
Výsledky
Výsledky a soubor pacientů shrnuje tab. 1.
Tab. 1. Přehled souboru pacientů a shrnutí výsledků léčby. 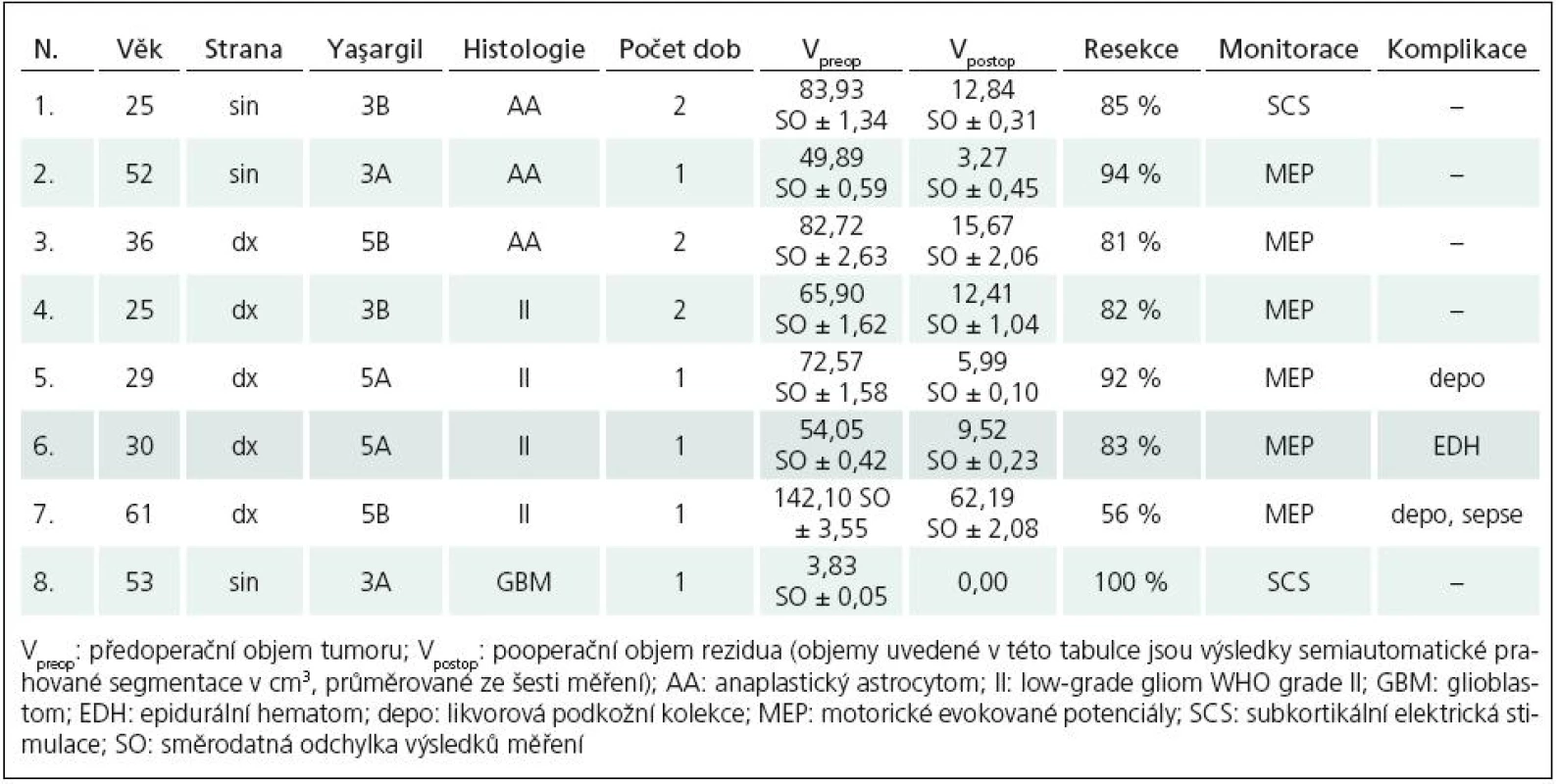
Klinický stav a komplikace
U pěti pacientů jsme resekci provedli v jedné operační době. U tří jsme se rozhodli, poté, co jsme je seznámili s výsledkem časné MR kontroly, pro rozšíření resekce v druhé době. Pouze u jedné pacientky došlo v časném pooperačním období k přechodnému zhoršení fatických funkcí a k lehké poruše hybnosti končetin (BMRC 4/5). Její stav se během týdenní hospitalizace upravil. V případě nejstaršího pacienta, dlouhodobě dispenzarizovaného na jiném pracovišti, který tři týdny před operací prošel epileptickým statem a v době operace u něho byla přítomna monoparéza horní končetiny, došlo k její úpravě. Nedošlo však ke zlepšení již před operací alterovaných mnestických a kognitivních funkcí. Karnofsky Performance Scale (KPS) skóre tři měsíce po operaci dosahuje 60, tedy pacient vyžaduje občasnou pomoc manželky. Ostatní pacienti jsou zcela soběstační (KPS 90–100) a čtyři z nich se vrátili k původnímu zaměstnání. Všichni dále berou antiepileptika, po operaci došlo u všech pacientů k poklesu frekvence či úplnému vymizení epileptických záchvatů, doposud krátká doba sledování však neumožňuje zařazení do skupiny dle Engelovy klasifikace.
Pokud budeme ovšem přísně popisovat výskyt všech komplikací, musíme přiznat 37,5 %. Jedná se však o komplikace, jež nemají trvalý vliv na neurologický stav pacientů a kvalitu jejich života. V jednom případě jsme museli provést revizi pro akutní EDH v oblasti kraniotomie u pacienta, jehož časné pooperační období bylo komplikováno výrazným neklidem ještě před extubací. U dalších dvou pacientů jsme museli neoperačně řešit likvorové depo, u jednoho z nich komplikované meningitidou a následným septickým stavem, s nutností nasazení intravenózní antibiotické léčby.
Motorické evokované potenciály (MEP)
MEP byly během všech monitorovaných operací výbavné pro HK i DK. U jedné pacientky jsme zaznamenali > 50% pokles amplitudy MEP pro HK i DK při přímé manipulaci s M1 a odstupujícími perforátory, stav se normalizoval po lokální aplikaci papaverinu. U zbylých pěti pacientů během šesti operací byla vždy zaznamenána nestabilita MEP v průběhu resekční fáze pod úrovní větví M2. Během tří operací došlo k izolovanému poklesu amplitudy MEP pro DK maximálně na 60 %, MEP pro HK zůstal intaktní. Identicky obráceně během dalších tří operací došlo k nejvýše 40% poklesu amplitudy pro HK za zachování startovní amplitudy pro DK. U tří pacientů byl tento pokles reverzibilní ještě v průběhu peroperační fáze. U dvou pacientů, u nichž MEP nebyly prováděny, jsme nezaznamenali pozitivní stimulační odpověď při subkortikální stimulaci proudem do 8mA.
Hodnocení vztahu laterálních lentikulostriatálních perforátorů (LLsA) a nádoru
U šesti pacientů jsme hodnotili pozici nádoru mozku k LLsA jako laterální, cévy byly na mediálním okraji nádoru a byly nádorem pouze odtlačeny (obr. 2a, b). U dvou pacientů (č. 5, 7) nádor infiltroval i oblasti mediálně od LLsA, perforátory tedy gliomem probíhaly. Ani u jednoho z pacientů, u kterých nádor infiltroval oblast mediálně od LLsA, jsme však po operaci nezaznamenali zhoršení neurologického stavu.
Volumetrie
a) Výpočet daný aproximací k objemu rotačního elipsoidu V = 4/3 Π a b c
Průměrný objem nádoru před operací byl 67 cm3. Z rozmezí 6–134 cm3 vybočoval pacient s GBM o objemu malé enhancující léze 6 cm3. Ostatní gliomy WHO grade II a III zaujímaly průměrný objem 75 cm3, v rozmezí od 44 do 134 cm3. Pooperační průměrný objem reziduálního nádoru v T2 vážení pro gliomy WHO II a III byl 9 cm3, v rozmezí od 0 do 31 cm3. Při výpočtu pomocí této volumetrické metody jsme u inzulárních gliomů WHO grade II a III dosáhli průměrně 90% redukce původního objemu nádoru. U pacienta s GBM jsme operaci v T1 kontrastním vážení hodnotili jako radikální.
b) Výpočet daný počítačovou volumetrií pomocí semiautomatické segmentace
Průměrný objem nádoru před operací byl 69 cm3. V rozmezí 4–142 cm3 opět vybočoval pacient s GBM o objemu enhancující léze 4 cm3. Při použití této volumetrické metody zaujímaly gliomy WHO grade II a III průměrný objem 79 cm3, v rozmezí od 50 do 142 cm3. Pooperační průměrný objem reziduálního nádoru v T2 vážení pro gliomy WHO II a III byl 17 cm3, v rozmezí od 3 do 62 cm3 Při výpočtu pomocí této volumetrické metody jsme u inzulárních gliomů WHO grade II a III dosáhli průměrně 82% redukce původního objemu nádoru. U pacienta s GBM jsme operaci v T1 kontrastním vážení opět hodnotili jako radikální.
Diskuze
Nelze jinak než na prvním místě vyzdvihnout pionýrskou sérii 80 inzulárních a fronto-inzulo-temporálních tumorů prezentovanou Yaşargilem roku 1992 v rámci analýzy nádorů celé limbické a paralimbické oblasti [2], od které se odráží většina následujících prací. Jejím shrnujícím jmenovatelem je absolutně precizní mikrochirurgie podložená detailní znalostí anatomie příslušné oblasti. Již lehce abstraktnější je popis výborných výsledků operací, u 71 pacientů (89 %) autor popisuje funkční stav po operaci jako „dobrý“, dle uvedené definice odpovídající úplné nezávislosti na pomoci ostatních osob. U devíti pacientů (11 %) udává autor jistý stupeň závislosti na okolí, daný hemiparézou; při pečlivé analýze tohoto článku shledáváme, že těchto 11 % „kazí“ celý soubor 177 pacientů. U všech 97 pacientů s meziotemporálními nádory nepostihujícími inzulu byl totiž výsledek operací výborný. Ani v inzulární skupině však nedošlo k úmrtí či výraznému zhoršení následkem operace. Pooperační snímky prezentované formou výběru některých jednotlivých případů dokládají neoddiskutovatelné umění autora [3]. Chronologicky následuje práce Zentnera et al z roku 1996 [4]. Shrnuje výsledky operací 30 pacientů a zaměřuje se již na kvantifikaci radikality resekcí. U 21 (70 %) pacientů byli operatéři schopni dosáhnout > 80% redukce původní velkosti nádoru. Ke zhoršení neurologického stavu časně po operaci došlo v 57 % případů (17 pacientů); byl hodnocen jednak vznik fokálního neurologického deficitu a jednak propad KPS, celková časná morbidita byla navýšena o další dva pacienty s chirurgickými komplikacemi (hemoragie do postresekční dutiny, depo). Autoři poctivě přiznávají vysokých 63% komplikací. S odstupem 8,5 měsíce po operaci však došlo u naprosté většiny k úpravě symptomů, trvalá neurologická morbidita je vyčíslena přijatelnými 10 %. Lang et al roku 2001 [5] precizně popisují mikrochirurgické aspekty úspěšného operování inzulárních gliomů se zaměřením na anatomii odstupu LLsA, dlouhou disekci a širokou preparaci inzuly až do oblasti horního a dolního periinzulárního sulku. Z 22 pacientů bylo dosaženo > 90% resekce původního objemu nádoru u deseti (45 %), u šesti (27 %) pacientů 75–90% resekce a u dalších šesti pacientů (27 %) < 75 %. Neurologický deficit časně po operaci vznikl u osmi pacientů (36 %), avšak při hodnocení stavu za tři měsíce bylo zjištěno, že omezuje provádění běžných denních aktivit, obdobně jako u předchozích autorů, pouze u dvou z nich, tedy u 9 % pacientů. Recentně se aspektu mikrochirurgie a předoperační verifikace pozice LLsA věnují Moshel et al [1]. Za zásadní předpoklad možnosti radikální resekce pokládají laterální pozici nádoru od průběhu LLsA. Tato příznivá situace (laterální varianta nádoru) nastávala v jejich souboru 38 pacientů v 66 % (u 25 pacientů). V této skupině byl navíc v 80 % (20 pacientů) nádor na T2 vážených MR směrem k bazálním gangliím ohraničen. Naopak v 34 % (u 13 pacientů) LLsA nádorem prostupovaly, navíc tento typ nádoru (mediální varianta) vykazoval ve vyšším procentu případů – v 85 % (11 pacientů) difuzní růst. Radikalita resekce zásadně závisela na typu nádoru, v případě laterální varianty s LLsA odtlačenými na mediální okraj nádoru dosáhli 90% a vyšší resekce v 84 % případů, oproti 54 % v případě druhé varianty. Ke vzniku či zhoršení existující hemiparézy po operaci došlo u pěti pacientů (13 %). Ve všech případech se jednalo o mediální variantu nádoru. V našem malém souboru pacientů jsme zastihli příznivou situaci na předoperačních T2 vážených MR u šesti pacientů, zatímco u dvou pacientů byla oblast mediálně od LLsA nádorem infiltrována. Tento fakt neměl vliv na pooperační neurologický deficit, ale spíše na radikalitu operace, a to hlavně u pacienta č. 7, kde část nádoru mediálně od LLsA tvořila značnou část celého jeho objemu.
A konečně Simon et al, publikující roku 2009 [6] úctyhodný soubor 94 pacientů operovaných během 101 operací, preferuje k této diagnóze aktivní mikroneurochirurgický přístup, vylučující pouze operace starších pacientů s multiformním glioblastomem. Více než 90% objemu resekce dosáhli u 42 % pacientů, u 51 % se tento pohyboval mezi 70–90 %. Jeden rok po operaci bylo 76 % pacientů z těch, kteří primárně trpěli epilepsií, zcela bez záchvatů či tyto záchvaty byly pouze zcela izolované. Nový neurologický deficit po operaci – hemiparéza či dysfázie, vznikl v 20 % (19 pacientů). Autoři však hodnotí také příznivý trend související s narůstajícími zkušenostmi, kdy v posledních pěti letech (2000–2005) došlo k perioperačním neurologickým komplikacím pouze u 9 % pacientů (5 z 55). Autoři taktéž poctivě hodnotí KPS skóre, kdy tři měsíce po operaci dosahovalo 68 % pacientů KPS 80–100 (před operací bylo v této KPS skupině 82 % pacientů), 25 % pacientů KPS 60–70 (před operací bylo v této KPS skupině 13% pacientů). Po vyloučení tří pacientů, kteří zemřeli v perioperačním 30denním období, 7 % pacientů dosahovalo tři měsíce po operaci KPS < 60. Autoři tedy přiznávají signifikantní riziko operace; konstatují však, že nepřesahuje obecné riziko udávané 13 až 26 % při operacích neselektovaných mozkových nádorů. Poukazují také na významná rizika spojená s alternativní léčbou pomocí intersticiální radiochirurgie [7] – způsobuje 18 % komplikací do jednoho roku, s nutností operace pro progresivní radionekrózu u 7 % pacientů. Důležitá je také selekce pacientů, např. 91 % pacientů mladších 40 let, bez vstupního neurologického deficitu, s gliomem WHO I–III, mělo tříměsíční KPS 80–100, naopak skličující byly výsledky resekcí multiformního glioblastomu s výsledným KPS menším či rovným 70 v 65 % operací. Simon et al [6] staví bezpečnost resekce na elektrofyziologickém monitoringu MEP, kterému se detailně věnují Neuloh et al [8] ze stejného pracoviště. Odlišný přístup k operační technice, spočívající v transoperkulárním přístupu u naprosté většiny pacientů, i k monitorování založeném na přímé kortikální a subkortikální stimulaci a awake resekcích v dominantní hemisféře, preferují Duffau et al [9,10]. V letos publikovaném souboru čítajícím 51 pacientů [9] dosahuje totálních či subtotálních (reziduum ≤ 10 cm3) resekcí v 77 % případů. Zhoršení časně po operaci zaznamenali u 30 pacientů (59 %), u 28 z nich došlo k návratu ke vstupnímu stavu či se tento stav zlepšil, trvalá celková morbidita představuje pouhá 4 %.
V předchozím výčtu prací věnujících se operacím inzulárních gliomů jsme uniformně shrnuli výsledky týkající pooperační morbidity a radikality resekce. Pokud tyto výsledky zobecníme, můžeme konstatovat dosažitelnost resekce ≥ 70 % objemu tumoru u 2/3 pacientů při trvalé morbiditě do 10 %. V našem souboru dominuje přechodná chirurgická morbidita daná vysokým zastoupením likvorového depa po operaci, které si ani v jednom případě nevyžádalo operační revizi. Výsledek potenciálně ohrožující komplikací byla nutnost revize pro akutní EDH u jednoho pacienta. Naštěstí jsme nezaznamenali trvalý neurologický deficit ani významný propad KPS po operaci.
I přes obdiv k výtečným pracím zahraničních autorů, prosazujících radikalitu resekce jako jeden z primárních cílů operace, je nutno podotknout, že pouze Lang et al [4] hodnotí radikalitu resekcí volumetrickou analýzou podobně jako náš soubor. Domníváme se, že počítačová volumetrie pomůže objektivně a poctivě vyhodnotit výsledek operace (obr. 6a–f). Je poměrně náročná na čas hodnotitele a je pro zaneprázdněné neurochirurgy obtížně plošně aplikovatelná. My jsme ji srovnali s metodou výpočtu objemu pomocí aproximovaného elipsoidu, která je časově méně náročná. Výsledky této jednodušší metody jsou však bohužel validní pouze pro určení objemu nádoru před operací. V pooperačním hodnocení tato metoda zcela selhává nadhodnocením radikality resekce, a to z pochopitelného důvodu nepravidelnosti tvaru rezidua.
Obr. 6. A. MR-T2 vážený obraz 30letého pacienta s gliomem WHO grade II typu Yaşargil 5A (N.6). B, C. Pooperační T2 vážené obrazy stejného pacienta – dosaženo 83% resekce (Ki-67 2%). D. MR-T2 vážený obraz 29leté pacientky s gliomem WHO grade II–III typu Yaşargil 5A (N.5). E, F. Pooperační T2 vážené obrazy stejné pacientky – dosaženo 92% resekce (Ki-67 7%). B, E. Příklady prezentace „nejpěknějších“ snímků. C, F. Snímky zobrazující reziduální nádor. 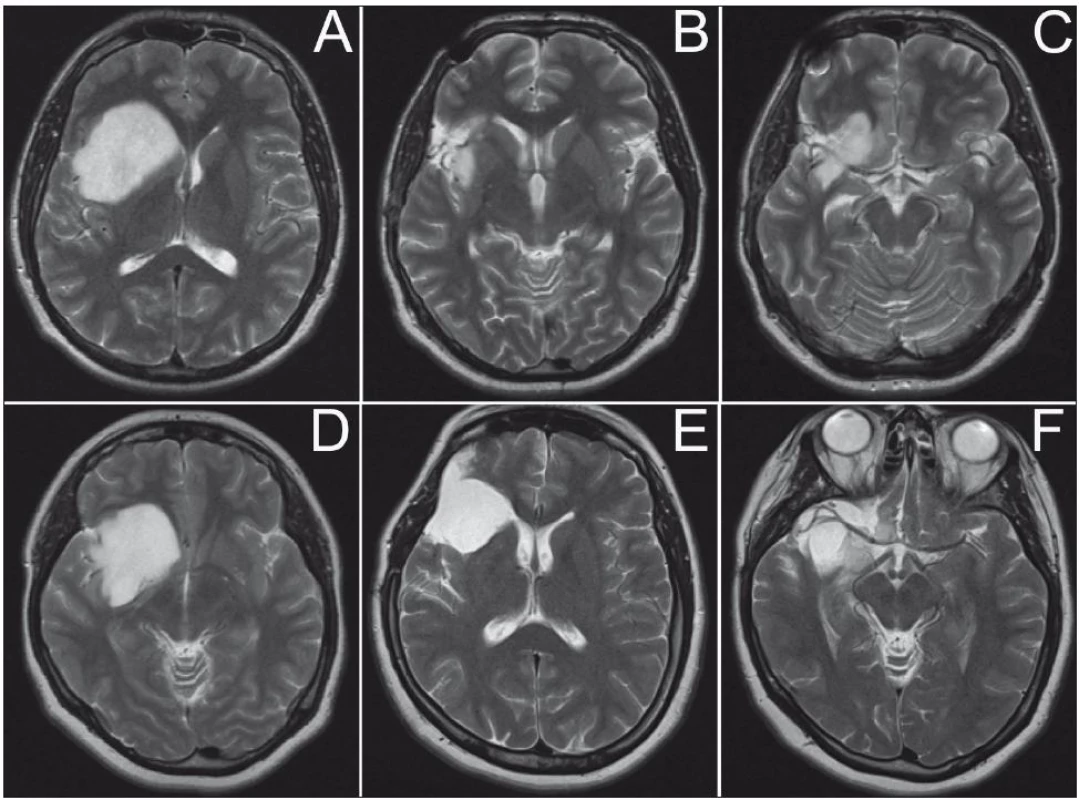
Dle exaktní počítačové volumetrické metody jsme pro gliomy WHO II a III dosáhli průměrné 82 % radikality resekce. Za nejobtížnější a nejvíce stresující považujeme resekci mediální části tumoru směrem k LLsA (obr. 7a) a resekci posteriorní části inzuly (obr. 7b), kterou mohou prostupovat dlouhé inzulární perforátory odstupující z distálních větví M2. Aktivní přístup k resekci inzulárního gliomu preferujeme zejména kvůli časté neodlišitelnosti nízkostupňového gliomu WHO grade II od anaplastického astrocytomu pomocí MR. V našem souboru jsme byli překvapeni častým zastoupením anaplastického astrocytomu či WHO grade II gliomu s vysokým (7%) proliferačním indexem Ki-67; 71 % pacientů (5 ze 7), kterým byla v rámci předoperačního pohovoru nabídnuta možnost vyčkávací strategie, patřilo právě do této skupiny. Dalším jednoznačným kladem je vymizení epileptických záchvatů či alespoň zmírnění jejich frekvence, které všichni pacienti našeho souboru subjektivně hodnotí jako příjemné zlepšení kvality svého života.
Obr. 7. A. Postresekční dutina u 29leté pacientky (N.5) s gliomem WHO grade II (Yaşargil 5A) – dosaženo 92% resekce; šipkou je označeno drobné reziduum, jímž probíhají LLsA (předoperační MR obr. 5). B. Reziduum nádoru v posteriorní části inzuly u 25leté pacientky (N.4) s gliomem WHO grade II (Yaşargil 3B) – dosaženo 82% resekce (předoperační MR obr. 2a, b). 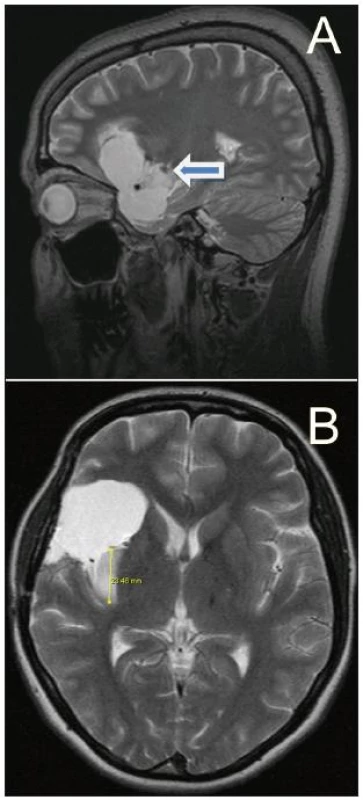
Závěr
Na základě vlastních zkušeností i zahraničních článků zastáváme názor, že pacientovi se symptomatickým inzulárním gliomem bychom měli doporučit operaci se snahou o významnou redukci objemu nádoru. Samozřejmě tento názor není dogmatický a bere v potaz pacientův věk a celkový stav. Konzervativní sledování však s sebou nese riziko pozdní diagnózy anaplastického astrocytomu, naopak pacientovi s gliomem WHO grade II nepřináší provedení pouhé biopsie žádný užitek. Definitivní rozhodnutí následně leží na pacientovi, kterého plně informujeme o výsledcích daného pracoviště a o potenciálních komplikacích. Neurochirurg musí použít pečlivou mikrochirurgickou techniku a vyhradit si na výkon dostatečný čas. Navigace mu poskytne základní představu o vývoji operace, zcela zásadní je však výkon monitorovat a hloubku resekce řídit dle vývoje MEP.
V našem souboru jsme dosáhli průměrné 84% (56–100%) redukce objemu nádoru, v podskupině objemných a pro resekci náročných gliomů WHO grade II a III 82% (56–94%) redukce.
Exaktní hodnocení objemu rezidua inzulárního gliomu pomocí počítačové volumetrie, zatím v našem písemnictví nepublikované, je výhodné pro další sledování; ať již progrese, či naopak k posouzení efektu následných léčebných modalit.
MUDr. Robert Bartoš
Neurochirurgická klinika
Masarykova nemocnicea UJEP v Ústí nad Labem
Sociální péče 12A
401 13 Ústí nad Labem-Bukov
e-mail: robert.bartos@mnul.czPřijato k recenzi: 8. 6. 2009
Přijato do tisku: 17. 9. 2009
Zdroje
1. Moshel YA, Marcus JD, Parker EC, Kelly PJ. Resection of insular gliomas: the importance of lenticulostriate artery position. J Neurosurg 2008; 109(5): 825 – 834.
2. Yaşargil MG, von Ammon K, Cavazos E, Doczi T, Reeves JD, Roth P. Tumours of the limbic and paralimbic systems. Acta Neurochir 1992; 118(1 – 2): 40 – 52.
3. Yaşargil MG. Microneurosurgery, vol. 4. New York: Thieme Medical 1996.
4. Zentner J, Meyer B, Stangl A, Schramm J. Intrinsic tumors of the insula: a prospective surgical study of 30 patients. J Neurosurg 1996; 85(2): 263 – 271.
5. Lang FF, Olansen NE, DeMonte F, Gokaslan ZL, Holland EC, Kalhorn C et al. Surgical resection of intrinsic insular tumors: complication avoidance. J Neurosurg 2001; 95(4): 638 – 650.
6. Simon M, Neuloh G, von Lehe M, Meyer B, Schramm J.Insular gliomas: the case for surgical management. J Neurosurg 2009; 110(4): 685 – 695.
7. Mehrkens JH, Kreth FW, Muacevic A, Ostertag CB. Long term course of WHO grade II astrocytomas of the Insula of Reil after I - 125 interstitial irradiation. J Neurol 2004; 251(12): 1455 – 1464.
8. Neuloh G, Pechstein U, Schramm J. Motor tract monitoring during insular glioma surgery. J Neurosurg 2007; 106(4): 582 – 592.
9. Duffau H, Capelle L, Lopes M, Faillot T, Sichez JP, Fohanno D. The insular lobe: physiopathological and surgical considerations. Neurosurgery 2000; 47(4): 801 – 810.
10. Duffau H. A personal consecutive series of surgically treated 51 cases of insular WHO grade II glioma: advances and limitations. J Neurosurg 2009; 110(4): 696 – 708.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článek Syndróm karpálneho tunelaČlánek Varianty katatonieČlánek Rettův syndromČlánek Webové okénko
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2009 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Syndróm karpálneho tunela
- Mikrodialýza v neurochirurgii
- Varianty katatonie
- Rettův syndrom
- Resekce gliomů inzuly – volumetrické hodnocení radikality
- Korelace transkraniální barevné duplexní sonografie, CT angiografie a digitální subtrakční angiografie u pacientů s aterosklerotickým postižením mozkových tepen v běžné klinické praxi
- Je clinical‑ diffusion mismatch sdružen s dobrým klinickým výsledkem u pacientů s akutním ischemickým iktem léčených intravenózní trombolýzou?
- Vliv léčby botulinum toxinem‑ A a redresního sádrování na délku musculus triceps surae a ekvinózní postavení nohy během chůze u pacientů s dětskou mozkovou obrnou
- Neuropatie nervus mentalis jako manifestace systémové malignity
- Extrakraniální schwannom nervi hypoglossi – kazuistika
- Recidivující ischemická mozková příhoda při systémové skleróze – kazuistika
- Intrakraniální hematomy u warfarinizovaných pacientů – kazuistiky a doporučení léčby
- Kavernózní malformace kaudy equiny – kazuistika
- Mezinárodní klasifikace funkčních schopností, disability a zdraví (ICF) – kvantitativní měření kapacity a výkonu
- Webové okénko
-
Analýza dat v neurologii XVIII.
O t-testu jsme ještě nenapsali vše - Šedesátiny primáře MU Dr. Milana Choce, CSc.
- Komentář k práci Brichtová et al. Malfunkce peritoneálního katétru vnitřního drenážního systému u dětí
- Vyhlášení cen České neurologické společnosti za rok 2008
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Varianty katatonie
- Rettův syndrom
- Neuropatie nervus mentalis jako manifestace systémové malignity
- Syndróm karpálneho tunela
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



