-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Ataxie
Ataxia
Term “ataxia” means impaired, irregular movement, but is also known as a group of hereditary diseases. Thanks to progress in molecular genetics, new types of ataxia are found daily, together with specification of phenotype-genotype correlation. With progress in neuroimaging and electrophysiology, ataxia as a symptom might not get the appropriate attention of clinicians. However, clinical features of ataxia can serve as an important clue in differential diagnosis. This text describes ataxia as a syndrome. We discussed specific signs of ataxia from a syndromological point of view and highlighted the most common causes of ataxia and some of the rare causes imitating ataxia as well.
Key words:
ataxia – cerebelar ataxia – sensory ataxia – vestibular ataxia – etiology of ataxia
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autori: J. Paulasová Schwabová 1,2; M. Daňková 1
Pôsobisko autorov: Centrum hereditárních ataxií, Neurologická klinika 2. LF UK a FN Motol, Praha 1; Laboratoř sportovní motoriky, Fakulta tělesné výchovy a sportu UK v Praze 2
Vyšlo v časopise: Cesk Slov Neurol N 2018; 81(2): 131-149
Kategória: Minimonografie
doi: https://doi.org/10.14735/amcsnn2018131Tato nová verze textu nahrazuje již dříve otištěnou minimonografii (Cesk Slov Neurol N 2017; 80/113(4): 379–391), která byla stažena.
Súhrn
Výraz „ataxie“ se používá jak ve významu porušeného, nepravidelného pohybu, tak jako označení skupiny dědičných chorob. Ta se denně rozrůstá o nové genetické objevy a dochází ke zpřesňování jejich feno-/ genotypové korelace. V souvislosti s rozvojem vyšetřovacích zobrazovacích a elektrofyziologických metod se však dostává do pozadí klinická typizace ataxie jako symptomu, který může být neurologovi dobrým vodítkem v diferenciálně-diagnostické rozvaze o etiologii obtíží pacienta. Následující text je proto věnován pohledu na ataxii jako na syndrom, jsou probrána specifika ataxie z hlediska jejího zařazení a v závěru jsou stručně nastíněny nejčastější či záludné příčiny, které mohou ataxii způsobovat, event. imitovat.
Klíčová slova:
ataxie – cerebelární ataxie – senzitivní ataxie – vestibulární ataxie – etiologie ataxie
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.Ataxie jako symptom
Výraz „ataxie“ pochází z řečtiny, kde „αταξία“ (a = ne, bez; taxia = pořádek) znamená nepravidelnost, neuspořádanost. Poprvé ho použil Hippokrates (460 – 377 př. n. l.) ve významu mnohem obecnějším, protože tímto termínem označoval netypický průběh jakékoli choroby. Význam, který pod tímto pojmem rozumíme dodnes, krystalizoval v polovině 19. století, kdy Bouillard definoval ataxii jako poruchu koordinace chtěných pohybů [1]. Do neurologických učebnic se však tato definice dostala až o 20 let později. Nejdůležitějším úkolem pro neurology konce 19. století bylo odlišit ataxii senzitivní, zejména tabickou, od forem dědičných, tzv. neurodegenerativních, popsaných zvláště Friedreichem (1863) [2] a Marieem (1893) [3 – 5].
Proto zavádí Huppert (1878) pojem hypermetrie a Babinski (1899), v jehož pojetí se mozeček jevil poeticky jako „orchestrion svalových synergií“, vytváří termín cerebelární asynergie, aby lépe odlišil cerebelární příznaky od ataxie tabické [6,7]. Holmes [8] v roce 1904 charakterizoval efekt mozečkové léze na hybnost obecněji než Babinski – jako poruchu časování, rozsahu a síly pohybu [7]. Výraz pasivita pochází od Thomase (1912) [9,10].
Z českých osobností, které jsou spojeny se studiem problematiky mozečku a jeho funkcí, je nutno vzpomenout Jana Evangelistu Purkyně (1787 – 1869), Kamila Hennera (1895 – 1967) a Ivana Lesného (1914 – 2002). Purkyně, jehož jméno nese hlavní buněčný element mozečkové kůry, se do světové literatury zapsal svými pracemi věnovanými poruchám rovnováhy a mikroskopické anatomii mozečku. Henner vytvořil na základě francouzské neurologické školy ucelený systém vyšetření a klasifikace mozečkových lézí, který dosud zůstává součástí naší neurologické propedeutiky [10,11]. Přínos Ivana Lesného je zejména ve studiu mozečkových symptomů v dětském věku [12].
Ataxie neboli symptom ataxie je v povědomí neurologů spjat především s patologickou nebo vývojovou symptomatikou mozečkovou. Přestože, jak bude uvedeno dále, patří i do symptomatiky postižení jiných systémů, má mozeček pro koordinaci chtěných pohybů zásadní význam. Proto je této zajímavé části nervového systému věnována následující stať.
Mozeček – funkční anatomie a fyziologické roleF
Část mozku v zadní jámě lební připomínala prvním anatomům zmenšený přední mozek – odtud název „mozeček“. Jeho význam nebyl dlouho znám. Thomas Willis ve svém díle „Cerebri anatome“, publikovaném v roce 1664, považoval „velký mozek“ za orgán volní hybnosti a mozeček naproti tomu za orgán hybnosti mimovolní [12,13]. Když si uvědomíme, že tato teorie byla postulována v době barbarských honů na čarodějnice, oceníme její pokrokovost.
Z hlediska fylogeneze a ontogeneze vzniká mozeček jako výchlipka mozkového kmene ve výši vestibulárních jader. Ve fylogenetickém vývoji se s ním poprvé setkáváme u primitivních kruhoústých ryb; významnějším orgánem se stává až u ptáků. Zajímavé je, že fylogenetický vývoj mozečku nejde vždy přímočaře, ale je do značné míry podmíněn vlivem prostředí a způsobem života jednotlivých živočišných druhů. Je např. pokročilejší u ryb žijících v proudících řekách než u těch, které žijí při dně stojatých vod. Zdá se, že „funkce zde vytváří orgán“ [12,14].
Během evoluce primátů došlo ke zvětšení objemu dvou subkortikálních struktur – mozečku [15] a bazálních ganglií. Bazální ganglia se však dále během následné lidské evoluce příliš neměnila, zatímco cerebelum se vyvinulo v mozkovou strukturu, která má více neuronů než kůra velkého mozku spolu se zbytkem CNS [16]. Typická pro mozeček je uniformní cytoarchitektonika, velice konzervativní i v rámci živočišného druhu [14,17]. Zajímavý je také průběh každé neuronální operace – vzhledem k bohatému recipročnímu spojení s extracerebelárními strukturami lze předpokládat, že na rozdíl od kortexu cerebrálního probíhá v mozečku každá neuronální operace ve všech jeho mikrokomplexech [14].
Přes současný exponenciální rozmach vědy a techniky víme sice podrobně to, jak mozeček vypadá, z čeho se skládá, zkoumají se jeho bohaté spoje s ostatními částmi nervového systému; objevili jsme, jaké má v organizmu funkce vč. nedávno poznané afektivně-kognitivní – takže víme, co dělá, ale nevíme přesně, jak to dělá. Matematici a počítačoví experti se horlivě snaží vypracovat model, který by dosáhl lidské elegance pohybu, ale zatím neúspěšně [16,18]. Zájem o mozeček jako strukturu se postupně přesouvá ke studiu jeho sítí – zejména s cerebrálním kortexem a bazálními ganglii [14].
Mozeček je mimo motoricko-senzitivních operací zapojen také do kognitivních úkolů a procesů emočních [19]. Obvykle se mezi funkce motorické a kognitivní klade tlustá čára, avšak právě mozeček ukazuje nesprávnost tohoto postoje. I když i motorické funkce mozečku nás s prohlubováním poznání neustále překvapují, víme o nich mnohem více než o v mozečku probíhajících procesech neurokognitivních [20,21].
Jednou z motorických rolí mozečku je asistovat v iniciaci a modulaci chtěného pohybu, který je generován v mozkové hemisféře. Zdá se, že kortikocerebelární okruhy predikují plán, který okruhy přepojující kortex a bazální ganglia zhodnotí a dle výsledku spustí jeho provedení [14,22]. Mozeček si lze představit jako ústředí, které zpracuje senzorickou informaci z periferie a srovná ji s příkazem, který byl zaslán motorickým kortexem. Informace o plánu integruje a, na rozdíl od kůry mozkové, nepřetržitě provádění pohybu kontroluje [11,16,23]. Tato kontrola není pouze zpětnovazebná (feedback), ale také tzv. feedforward (směrem kupředu). Právě jejich kombinace vede k dokonale kontrolní strategii, která spojuje účinnost anticipace se sílou zpětné vazby [14]. Rovnováha těchto dvou principů je pravděpodobně zásadní pro správné provádění pohybu a její nerovnováha může vést k poruchám, jako jsou např. dyskineze u Parkinsonovy choroby [14].
Fungování zpětnovazebné kontroly je všeobecně známo i z jiných biosystémů. Tímto způsobem mozeček přímo ovlivňuje konečný pohybový vzorec [23,24]. Feedforward systém pracuje jinak. Průběh akce pomocí kortexu modifikuje nebo kontroluje na základě předpokládaných výsledků [23]. To znamená, že se mozeček tímto způsobem přímo podílí při programovaní volních pohybů, zejména naučených a složitých dovednostních, které se jejich zdokonalováním stávají rychlejšími [23]. Tuto jeho schopnost lze vysvětlit pomocí vytvoření tzv. vnitřního modelu (internal model) [22,23,25], který odpovídá zevním podmínkám, umožňuje predikci [26] a následně optimalizuje motorické chování [20]. Mozeček si tak lze představit jako trenéra, který nejen že reaguje na to, zda byl jeho tým při vybraném způsobu hry úspěšný (zpětná vazba), ale také na základě předchozích zkušeností, možností svých svěřenců, natrénovaných situací a kvalit soupeře vybírá vhodnou strategii (feedforward) s cílem nejlepšího výkonu v dané herní situaci [16]. Mozeček tedy na základě informací z periferie a z motorického kortexu v úzké součinnosti s extrapyramidovým systémem koriguje provedení svalových kontrakcí tak, aby byl výsledný pohyb plynulý, co nejpřesnější a nejefektivnější. Tato činnost je většinou inhibiční, proto si lze mozeček také představit jako „brzdu“ omezující rozsah a sílu pohybu. V této funkci mu nejspíše napomáhá spojení se subtalamickým jádrem [27]. U klasického zánikového mozečkového syndromu se brzdný účinek ztrácí a nemocný pohyby přestřeluje [11].
Mozeček je zapojen do časování volního pohybu [28]. Právě hypotéza o vnitřním modelu se významně prolíná se studiemi, které prokazují význam mozečku v časování, stejně jako predikci, sekvenování a stanovování chyb během probíhajícího pohybu [21]. Z českých autorů se problematice predikce časování věnují Bareš et al, kteří publikovali několik zajímavých prací na toto téma [29 – 33]. Při rychlém pohybu mozeček stanoví rychlost pohybu a vypočítá čas, který pohybový systém potřebuje k dosažení plánovaného postavení. Po dosažení cíle mozeček aktivuje motorický kortex tak, aby došlo k inhibici agonistů a naopak aktivaci antagonistů, jež pohyb zastaví (trifázická sekvence svalových stahů agonisty – antagonisty – agonisty – doladění ukončení pohybu) [34,35]. Čím je pohyb rychlejší, tím dříve musí být antagonista aktivován. Proces provádění pohybu a zároveň korekce chyb je bezpochyby příliš rychlý pro kontrolu pouze motorickým kortexem [36].
Je všeobecně známo, že mozeček je důležitý pro koordinaci pohybů [19,28,37]. Méně si však uvědomujeme, že mozeček pomáhá i při sledovacích pohybech a je důležitý k predikci pohybů probíhajících v našem okolí [36,38]. Například pomáhá předvídat, jak a kam dopadne basketbalový míč. Mozeček je schopen predikovat jeho rychlost a trajektorii a pomáhá tak aranžovat plán nezbytných pohybů hráče tak, aby míč doběhl, chytil, vyhnul se obránci a v dvoutaktu hodil do koše. Vše závisí na předešlé zkušenosti a tréninku [16].
Tím se dostáváme k motorickému učení. Mozeček má důležité jak neuroanatomické, tak neurofyziologické předpoklady k tomu, aby v něm hrál důležitou roli. Velké množství neuronů stejně jako vysoký stupeň adaptability plynoucí z jeho synaptické plasticity ho k tomu předurčují [20]. Motorické učení lze obecně rozdělit na tři části: 1. kontrolované mozečkové učení založené na plasticitě paralelního zapojení Purkyňových buněk [14,18], 2. nekontrolované kortikální učení založené na Hebiánských asociativních procesech [14] a 3. učení založené na teorii pokus-omyl, tedy tzv. zpětnovazebné učení probíhající v bazálních gangliích [14]. Jak neustále narůstá počet důkazů o velmi úzké spolupráci těchto tří systémů (viz níže), zdá se, že ani tato představa o motorickém učení není zcela správná. Nejspíše se všechny struktury spolupodílejí ve všech typech učení společně [14,36]. Příkladem může být opět mozeček, který hraje zásadní roli v motorické adaptaci, jíž se také říká „učení založené na chybách“ [36], která se prokazatelně spolupodílí na všech třech typech učení [39]. Tento proces je zásadní např. při správném úchopu předmětu v měnících se podmínkách prostředí – třeba úchop šálku v jedoucím vlaku, kdy navíc pasažérovi šálek podává servírka [36,38]. Subkortikální struktury na rozdíl od kortexu profitují z tréninku motorických dovedností [40]. Mozečkové okruhy generují motorické vzorce, které naplňují určené cíle, a v okruzích bazálních ganglií pak dochází k vybírání těch nejoptimálnějších [14]. Pokud se jedná o nový motorický úkol a musí být nejprve vytvořen plán, nucleus dentatus vyšle signál do prefrontálního kortexu. Jedná-li se o již dobře naučený motorický vzorec, mozeček vyšle signál přímo do motorických oblastí. Mozeček je zřejmě schopen uchovávat různé pohybové vzorce (kombinace svalových kontrakcí) naučené v průběhu života, které spojuje s určitým kontextem chování a které dokáže okamžitě spustit. Proto žádný vrcholový sportovec nebo hudebník, i přes svůj vrozený talent, nemůže dosáhnout skutečně špičkové úrovně bez tréninku [11,16,41].
Pro optimální plnění svých funkcí je mozeček obdařen hustou sítí aferentních a eferentních drah zajišťujících přívod informací z mozkové kůry a ze senzorických orgánů (především propriocepce) a předávajících zpětné podněty jak ascendentně do talamu a mozkové kůry, tak descendentními drahami zpět do periferie [11,14,16].
Protože má mozeček velký význam pro korekci zejména rychlých repetitivních pohybů [42], nepřekvapí, že právě rychlost ve spinocerebelárních drahách je nejvyšší v celém nervovém systému [41]. Je-li mozeček vyřazen, musí být využita cesta přes parietální lalok, gyrus angularis, gyrus supramarginalis do nemotorické korové oblasti. Proto se takto postižený jedinec může sice pohyby naučit, ale protože jsou pomalejší, nemůže se naučit dovednosti, kde je rozhodujícím faktorem čas - jako je např. tanec nebo zápas [12].
Koordinované a plynulé pohyby končetin a trupu jsou důsledkem neuronální organizace mozečku, která dovoluje současné a okamžité srovnání chtěného a prováděného pohybu, kdy v jednom okamžiku kooperuje obrovský počet neuronů. Odhaduje se, že informace do mozečku přivádí 40× více aferentních vláken, než je vláken eferentních [7].
Mozeček nepřekvapuje ani svým významem v somatosenzitivním systému. Zdá se, že hraje kritickou roli v modifikaci snímání receptorů během pohybu, a to zejména v situacích, kde je důležité přesné načasování [19]. V minulosti se tato role zpochybňovala, protože u pacientů s mozečkovou lézí nebyl v somatosenzitivním systému deficit prokázán [43,44] a také nebyla prokázána porucha propriocepce při pasivním testování [45]. Další studie však prokázaly jak poruchu odhadu hmotnosti objektů (percepce sil) [46], tak poruchu propriocepce během pohybu [47], či v procesu zhodnocení trvání a rychlosti pohybu [48].
Jak bylo již výše řečeno, mozeček byl po desetiletí spojován pouze s motorickými funkcemi. V roce 1997 však publikovali Schmahmann a Shermanová převratnou práci týkající se kognitivního a behaviorálního deficitu u pacientů s cerebelární lézí, zejména v oblasti vermis a zadního mozečkového laloku [49]. Příčinu předpokládali v poruše modulace neuronálních okruhů, které spojují prefrontální, zadní parietální, horní a limbický kortex s mozečkem [49,50]. Tyto projevy dostaly souhrnný název kognitivně afektivní cerebelární syndrom (cerebellar cognitive affective syndrome; CCAS), do něhož patří poruchy exekutivních funkcí [49,51], zrakově-prostorové orientace, poruchy řeči ve smyslu snížené verbální fluence, agramatizmu, dysprozódie atd. [49,52,53] a poruchy emoční [49,54,55].
Na základě zkoumání neurobehaviorálních profilů mozečkových pacientů (poruchy pozornosti, emoční kontroly, sociální interakce, autizmus či okruh psychotických onemocnění) byla postulována hypotéza dysmetrie myšlení, u které dochází k hypermetrickým nebo hypometrickým odpovědím na vnitřní či zevní prostředí [56,57]. A tak se ke klasické představě o ataxii motorické přidává i ataxie kognitivní a behaviorální [54].
Jak bylo uvedeno výše, mozeček kóduje tzv. vnitřní model (internal model), který odpovídá zevním podmínkám, umožňuje predikce a následně optimalizuje motorické chování. Zdá se, že stejný princip platí i pro procesy neurokognitivní [23]. Byla postulována teorie o tzv. univerzální mozečkové transformaci [57,58], která předpokládá, že principy vlastní pro motorické projevy při lézi mozečkové platí i pro emocionální a kognitivní procesy. Jedním z podpůrných faktů je téměř uniformní cytoarchitektonika mozečku. Pokud funkce vytváří formu, pak by funkce cerebelární – motorické i nemotorické, stejně jako dysfunkce, měly být uniformní, protože je provádí stejný kortikonukleární mikrokomplex [23,57,59,60].
Vyšetřovací baterii neuropsychologických testů pro pacienty s mozečkovou lézí vhodnou pro výzkum i klinické testování publikovali v loňském roce Bolceková et al [61]. CCAS se může manifestovat u dětí, stejně jako u dospělých pacientů, nejčastěji po cévní mozkové příhodě, krvácení, infekční a parainfekční cerebelitídě, po operaci cerebelárních nádorů či u neurodegenerativních onemocnění [62].
Průkaz kognitivního a afektivního deficitu u pacientů s mozečkovou lézí vedl také k revizi topografické organizace mozečku. Nyní se předpokládá, že primární senzorimotorická oblast se nachází v předním laloku mozečkovém, sekundární senzorimotorická oblast v lobulus VIII, kognitivní oblast v zadním laloku a zadní část vermis je zapojena do limbických okruhů [19,63,64]. V případě, že fokální léze je izolována pouze na kognitivní a limbický mozeček, může dojít k intelektovému a emočnímu deficitu se zcela intaktním systémem motorickým. Proto lze o patologii mozečku a jeho drah uvažovat např. při poruchách schizoafektivních, při poruchách pozornosti [65] či při dyslexii [66].
Závěrem lze tedy shrnout, že mozeček je zapojen do základních funkčních okruhů (kortiko-ponto-cerebelárního, cerebelo-talamokortikálního), které ho propojují se supratentoriálními motorickými, paralimbickými a asociačními oblastmi. Porucha těchto spojů se proto může projevit manifestací cerebelárních symptomů [19]. Funkčně je spojen zejména s kortexem (nejen s primární motorickou oblastí, jak se předpokládalo, ale také s premotorickou, prefrontální a parietálními oblastmi) [14,58] a bazálními ganglii. Tvoří tak významný funkční integrovaný celek důležitý jak pro motorické, tak i kognitivní funkce [14,19,67,68]. Je typický unikátní cytoarchitektonikou, recipročním propojením a synaptickou plasticitou [69,70]. Recentní studie prokazují možnost existence oboustranného propojení mezi mozečkem a bazálními ganglii [71], konkrétně se striatem. Zajímavé je, že uniformní cytoarchitektonika typická pro mozeček se nachází také ve striátu [57]. Právě data potvrzující silné vazby mezi těmito strukturami vedla k současným studiím role mozečku v patofyziologii onemocnění/ klinických jednotek dosud typicky spojovaných s bazálními ganglii, jako jsou např. dystonie [72,73], Parkinsonova nemoc [74], Tourettův syndrom, či s kůrou – např. Alzheimerova nemoc [75].
Ataxie a další mozečkové symptomy
Ataxie je symptom, který se může vyskytovat u různých syndromů – mozečkového, vestibulárního, talamického, při postižení laloků parietálních atd. Ataxie může u některých syndromů postihovat pouze stoj a chůzi, jindy také pohyb končetin a řeč [76].
Aby bylo možné jednotlivé typy ataxie odlišit, je obvykle nutné pátrat po dalších symptomech cerebelárního syndromu jako např. dysmetrii, třesu, nystagmu, tonických odchylkách, změnách výbavnosti elementárních reflexů posturálních, pyramidových jevech atd., stejně jako pátrat po symptomech odlišujících přímo jednotlivé typy ataxií (např. parestezie u senzitivní ataxie) [10,77], které budou probrány v následující stati – Ataxie jako součást syndromu.
Protože při nálezu symptomu ataxie obvykle diferenciální diagnostika začíná mozečkovým syndromem, je vhodné si cerebelární syndrom rozebrat podrobněji. Pokud budou mozečkové symptomy přítomny, jedná se o mozečkovou lézi. Pokud ne, diferenciální diagnostika se zužuje. Rutinní mozečkové vyšetření se skládá z vyšetření okulomotoriky, řeči, pohybu končetin, tremoru, postury a chůze [78]. Pro potřebu co nejpřesnějšího zhodnocení neurologického deficitu byly vytvořeny klinické škály International Cooperative Ataxia Ratng Scale (ICARS) [78], Scale for the Assesment and Rating of Ataxia (SARA) [79] a Brief Ataxia Rating Scale (BARS) [80]. Každá z nich má své výhody i nevýhody [81]. ICARS je relativně dlouhá, SARA neobsahuje vyšetření očních pohybů, BARS pokrývá pouze základní symptomy mozečkového motorického syndromu.
Ataxie
Do klasického klinického obrazu mozečkové ataxie patří dysmetrie, dyssynergie a dysdiadochokinéza. Ataxie se vyznačuje dekompozicí (rozložení pohybu na jednotlivé fáze) a abnormitami časování, rozsahu a síly pohybu. Pohyb se neděje typicky po přímce, ale je charakteru cik-cak. Podle postižené činnosti či části těla se používají termíny ataxie chůze, posturální (trupová) ataxie, končetinová ataxie, ataxie řeči (sakadovaná řeč) [11].
Dysmetrie
Dysmetrie (porucha cílení pohybu) je hlavní složkou mozečkové ataxie. Lze ji vysvětlit poruchou predikce pohybu, což je v souladu s hypotézou týkající se kritické role mozečku pro udržení správného vnitřního modelu dynamiky plánovaného pohybu [82]. V důsledku opožděného a nedostatečného stahu svalových antagonistů, jež mají pohyb ukončit, dochází k nepřesnému zakončování cílených pohybů [10,11].
Dysmetrie se vyskytuje u lézí postihujících kmen, talamus i subkortikální bílou hmotu, kde dochází k poškození aferentních nebo eferentních mozečkových drah [83]. Babinski i Henner doporučují u cerebelárních poruch používat spíše pojem hypermetrie (přestřelování pohybu), protože nález této odchylky je pro mozečkovou lézi velice suspektní [6,10].
Směr pohybu, i přes četné odchylky (cik-cak fenomén), není u mozečkové hypermetrie téměř porušen, nejvýše na samém konci pohybu, kdy vidíme kolísání v různých rovinách a kdy je cíl míjen (intenční tremor). Porucha chtěných pohybů je stejná při zrakové kontrole i bez ní, hypermetrii lze pozorovat při pohybech spontánních i na výzvu. Podobně i při psaní a kreslení (spontánní písmo, pilovité čáry, spojování dvou bodů apod.) se projeví přestřelování pohybů způsobující tzv. cerebelární makrografii.
Při rychlých a bezděčných pohybech je hypermetrie výraznější [84], při pohybech na výzvu nemocný mobilizuje svoji pozornost a pohyb tak lze částečně korigovat. Při výraznějším postižení může kompenzace vést k bradyteleokinéze, což je zástava pohybu před cílem, kterého se pak dosáhne až po několika ataktických záškubech [10,11,19]. Jedná se o důsledek faktu, že při volním rychlém pohybu dochází nejdříve k inhibici antagonisty následované aktivitou v agonistovi (Hufschmidtův fenomén). U pacientů s mozečkovou lézí nastává překrytí – funkce antagonisty přetrvává i po začátku nástupu agonisty. V praxi to vede k tzv. poruše kontroly (impaired check) [41].
Přesto, že zájem je věnován zejména závěrečné fázi pohybu, u ataktického pacienta dochází také k poruše přípravy a iniciace pohybu [19,28]. Iniciace bývá zpožděna a reakční časy prodlouženy [28,82,85].
Mezi klinické testy pomáhající dysmetrii verifikovat patří: zkouška prst – prst, prst – nos, pata – koleno, pata – hýždě, dotyk na špičku nosu nebo lalůčku ucha, zkouška obrácení rukou, zkouška úchopu, vyšetření písma (crescendový charakter) a zkouška Stewarta-Holmese (pacient ohýbá loket a přitahuje silou k sobě předloktí proti odporu vyšetřujícího – po náhlém uvolnění dojde na postižené straně k přestřelení flexe předloktí) [10,11,76]. U nás se pro posledně jmenovaný příznak ne zcela správně vžil název rebound fenomén. Rebound fenomén je dle anglosaské literatury vyšetřován při předpažení horních končetin, kdy vyšetřující zatlačí na horní končetiny stejnou silou, na postižené straně dochází k neúměrně přehnané korekci se snahou vrátit se do výchozí polohy, což souvisí spíše z asynergií než dysmetrií. Také můžeme pacienta požádat, aby zvedl ruce naráz do polohy, kterou mu určíme - na postižené straně přestřelí. Pokud na předpažených horních končetinách tlačíme proti odporu nemocného dolů, postižená strana při náhlém povolení tlaku nezabrzdí. Jsou to zkoušky zaměřené na poruchu neocerebela neboli obdoba ke zkouškám stoje a chůze, jimiž vyšetřujeme hlavně vermis, tedy paleo/ archicerebelum [41].
Při vyšetřování testu prst – prst je nutné hodnotit nejen míru přestřelování, ale také rychlost provedení pohybu. Je vhodné pacienta instruovat, aby prováděl pohyb co nejrychleji, protože pacienti často pohyb zpomalí, aby zmírnili přestřelování. Ani u ataktického pacienta pohyb nemusí být přestřelen, ale může být zpomalen a tudíž hypometrický. Přestřelování je však ve srovnání se zpomalením pro ataktické pacienty specifičtější [41].
Pohybová ladnost (synergie)
U ataktických pacientů dochází k poruše koordinace při jednoduchých pohybech, jako je např. pohyb při vyšetřování prst – prst. Tato porucha, popisující rozpad neboli dezintegraci pohybu vedoucí k abnormní dráze pohybu, se označuje dyssynergie/ asynergie. I pohyb u zdravých jedinců vykazuje odchylky od pomyslné dokonalé křivky, ale u ataktických pacientů se jedná o abnormální míru a také o určitou specificitu tohoto patologického motorického vzorce.
Henner definuje asynergii jako asynchronizmus elementárních pohybů, časové a prostorové uvolnění, rozčlánkování pohybů. Asynergie/ dyssynergie je tedy synonymum pro inkoordinaci. Čím je pohyb složitější, tím je asynergie zjevnější, protože je pro kontrolu mnohem náročnější [10,11,19,35,41,86].
Termín se v současné době používá méně a je většinou nahrazen širším a obecnějším termínem ataxie. V anglosaské literatuře slouží pojem asynergie výhradně k popisu patofyziologie ataktického pohybu [41], nikoli ke klinickému popisu, u nás zavedenému Hennerem [10].
O praktickém významu dělení na tzv. malou asynergii, jež vzniká při postižení mozečkových hemisfér (a projevuje se poruchami koordinace končetin), a velkou asynergii při paleocerebelárním postižení (projevující se poruchou koordinace jednotlivých skupin trupového axiálního svalstva při udržování stoje, při posazování z lehu, vzpřimování apod.) diskutují i Růžička et al [11]. Navíc Henner považoval za malou asynergii to, co není zřejmé prima vista, ale k vizualizaci poruchy je nutné použít dalších zkoušek – např. kombinovanou flexi trupu a stehen, pohyb patami k hýždím či zkoušku zvrácení trupu [10].
Adiadochokinéza
Adiadochokinéza (z řeckého diadoché = následování; porucha sledu pohybů za sebou) byla u nemocného s patologií mozečkovou poprvé popsána Babinskim, který její vyšetření doporučil jako součást neurologického vyšetření [87], kam patří dodnes [44,88]. Babinski se domníval, že se jedná o příznak samostatný a že ho nelze vysvětlit jiným příznakem [87]. Naproti tomu Holmes viděl za touto patologií poruchu svalového tonu.
Na dysdiadochokinézu lze pohlížet jako na kombinaci dysrytmie a dyssynergie [28,34,89]. Adiadochokinéza/ dysdiadochokinéza postihuje rychle alternující pohyby tvořené střídavým zapojováním svalových agonistů a antagonistů. Pohyby jsou váhavé, jednotlivé fáze nestejné, arytmické, nedotažené i přestřelené. Je třeba si uvědomit, že v dětství je určitá dysdiadochokinéza fyziologická z důvodu nedozrálosti mozečkových struktur. V dospělosti frustně přetrvává na nedominantní horní končetině. Provází i parézy periferního a centrálního původu a hypo - i hyperkinetické extrapyramidové syndromy [19]. Zatímco však pro mozečkovou adiadochokinézu, resp. dysdiadochokinézu je charakteristická porucha koordinace, u paréz je většinou koordinace zachována, pohyb má však menší exkurze (hypodiadochokinéza); u extrapyramidových poruch pak bývá porušena jak koordinace, tak rozsah pohybu [10,11,41,77].
Klinicky se dysdiadochokinéza, stejně jako dysrytmie, testuje pomocí rychlých střídavých pohybů, protože tak maximalizujeme senzitivitu detekce. Příkladem je střídání pronace a supinace na horních končetinách, střídavé plácání dlaně a hřbetu ruky na stehno nebo tapping (palec – ukazovák). Během těchto testů ataktičtí pacienti předvádějí jak nepravidelný rytmus, tak i nesprávnou pozici z důvodu selhání několikasegmentové koordinace [86]. Také lze vyšetřit diadochokinézu řeči opakováním slabik [90]. Běžně se používá kombinace pa-ta-ka.
Svalový tonus u pacientů s mozečkovou lézí
V literatuře se uvádí, že do obrazu mozečkové léze patří také snížený svalový odpor při pasivní manipulaci s končetinami, který se nazývá pasivita. Pasivita bývá často nepřesně nebo z neznalosti nahrazována pojmem hypotonie. Hypotonie je však pojem mnohem širší [7]. Pasivita se projevuje snížením svalového napětí, zvýšeným rozsahem pohybu v kloubech a snížením odporu kladeného pasivním pohybům příslušného segmentu. Na rozdíl od svalové hypotonie z jiných příčin u pasivity nebývají svaly na pohmat změněny. Podkladem pasivity je snížení odporu antagonistů (podobně jako u hypermetrie) a snížení až vymizení elementárních reflexů posturálních. Pasivitě se přičítá i zvýšení synkinéz (např. souhybů horních končetin při chůzi), což způsobuje dojem rozháranosti.
Holmes popsal pasivitu u vojáků s akutním střelným poraněním mozečku, avšak zároveň připustil, že se nenachází u všech těchto pacientů. Přesto na ni nahlížel jako na zásadní abnormitu, která je podkladem dalších motorických deficitů souvisejících s mozečkovou lézí [91]. Dle Gilmana [37] tento nález nejspíše souvisí se sníženou citlivostí svalových vřetének při ztrátě fuzimotorické facilitace. Pasivita je nejmarkantnější u akutních lézí. Holmes rozlišil slabost, která vzniká po mozečkové lézi, tedy astenii, od té, která postihuje kortikospinální trakt –parézu [91]. Astenie nepostihuje, na rozdíl od parézy, predilekčně specifické svalové skupiny a není nutně spojena se změnou ve výbavnosti myotatických reflexů. Astenii lze nejlépe ozřejmit při vyšetření svalové síly během pohybu, protože statický odpor vyšetřovaného bývá obvykle zcela normální.
I když je síla i svalový tonus v normě, často se u pacientů s mozečkovou lézí vyskytuje snadná unavitelnost. Únava může být lokalizována do určité svalové oblasti, ale může být pacientem vnímána i jako únava celková. Někteří pacienti udávají, že všechny příznaky ataxie se únavou zhoršují a nepomáhají jim ani krátké odpočinky během dne [10,11,19,41]. Elektrofyziologické studie u pacientů s mozečkovou lézí a únavou, avšak bez známek depresivního syndromu, ukazují sníženou facilitaci motorických evokovaných potenciálů po námaze [92].
U některých pacientů s chronickou mozečkovou lézí byla popsána hypertonie, ale předpokládá se, že spíše pramení z poškození jiných částí CNS [93]. V literatuře se také opakovaně objevuje pojem mozečkové záchvaty (fits) ve spojení zejména s mozečkovými nádory a CMP postihujícími mozečkový kortex (mozečková jádra nejsou postižena) [8,94]. Mechanizmus tohoto vzácného fenoménu nejspíše souvisí s desinhibicí extenzorů.
Henner ve své monografii nabádá, že z dlouhé série zkoušek na pasivitu dle Thomase pro klinickou praxi zcela postačí počet 15 [10]. V současné době, kdy se významně zvýšila přesnost a dostupnost pomocných vyšetřovacích metod a vede se diskuze o optimalizaci rozsahu neurologického vyšetření z pohledu časové efektivity při stanovování diagnózy, se nezdá ani takovéto testování racionální [95]. Vybíráme proto jen čtyři zkoušky – plácnutí na předpažené končetiny (na straně léze bude postižená končetina přemístěna níž a může i oscilovat – při difuzním postižení obě horní končetiny), sukuse trupu (zvýšený rozkyv horních končetin při pasívním otáčením trupu ve stoji), zkoušku odrazu (phénomène du ressaut) a kyvadlové reflexy při vyšetření reflexu patelárního a tricipitového (mají větší rozsah, ale na rozdíl od léze pyramidové nejsou tak briskní a nedějí se silou) [7,10,11].
Mozečkový třes
Pro typický mozečkový třes se ustálil pojem tremor intenční, i když je tento pojem do jisté míry zavádějící. Již Babinski zpochybňoval, zda se jedná o skutečný třes [10]. Spíše vysvětloval nepravidelné, méně nebo více rytmické oscilace ze strany ke straně před cílem jako důsledek asynergie. Ropper a Samuels zpochybňují i adjektivum tohoto třesu, protože se neobjevuje ve chvíli, kdy pacient pohyb zamýšlí (z anglického to intend = zamýšlet něco), ale až během nejnáročnější fáze aktivního provedení, tedy přiblížení se k cíli [7]. Na druhé straně, pokud adjektivum vychází z latinského intentio, tedy snaha – v tomto případě nejspíše dosáhnout cíle, jeví se pojmenování jako adekvátní.
Nicméně pojem intenční tremor je zaveden a používán. Jeho výskyt se vždy kombinuje s mozečkovou ataxií – ukazuje tudíž na lézi mozečkovou, a to zejména postižení nucleus dentatus nebo poškození drah probíhajících horním mozečkovým stonkem. Není patrný, pokud jsou končetiny inaktivní a v průběhu první fáze pohybu. Jak však pohyb pokračuje a je třeba jeho jemné doladění (např. zkouška prst – nos, zkouška prst – prst), objeví se nepravidelné, méně nebo více rytmické (2 – 4 Hz) oscilace ze strany ke straně. Na rozdíl od tremoru familiárního či parkinsonského se oscilace vyskytují v mnoha rovinách. Jako většina třesů i mozečkový se zhoršuje únavou. Zavřením očí se může zlepšit nebo zcela eliminovat. Propranolol na něj nemá výrazný efekt a alkohol ho obvykle zhoršuje [7].
Pod pojmem mozečkový třes se v poslední době chápe pouze třes intenční, i když toto zjednodušení není správné. Už Holmes popsal několik dalších typů tremorů, které lze u mozečkového deficitu nalézt [96]. Jeden typ pojmenoval jako statický, t. č. se používá spíše název posturální [96], další jako kinetický [91,96]. Ten se na rozdíl od tremoru intenčního objevuje v celém průběhu pohybu. Na vzniku mozečkového třesu se tedy podílí nejspíše několik mechanizmů, mimo jiné porucha posturální fixace či centrálního oscilátoru při dysfunkci cerebelotalamických okruhů [97,98].
S mozečkovou ataxií se pojí i další typ tremoru, u kterého každý pohyb vč. statické postury vede k rytmickému (2 – 5 Hz) třesu s velkou amplitudou, nazývaný wing-beating (mávání křídel). Jeho síla je někdy dostatečná, aby způsobila u pacienta i ztrátu rovnováhy. Jedná se o důsledek afekce dentátorubrotalamických vláken a mediální části ventrálního tegmentálního retikulárního jádra. Vzhledem k lokalizaci léze v regionu nuclei ruber nazval Holmes tento tremor jako rubrální [96]. I když bylo prokázáno, že vzniká přerušením mozečkových eferentních vláken formujících horní mozečkový pedunkl, tedy brachium conjuctivum, název se dosud používá. Typicky se objevuje u pacientů s Wilsonovou nemocí.
Rytmický, pomalý (3 – 4 Hz) třes hlavy a případně horní části trupu převážně v předozadním směru, který často doprovází mediální léze mozečku a trupovou ataxii, se nazývá titubace [7]. V české neurologii se traduje odlišné chápání tohoto pojmu jako kymácivé nestability těla ve stoji a při chůzi [11]. Z pohledu moderní neurologie je na tomto místě také zajímavé uvést, že i u esenciálního tremoru byly nalezeny projevy mozečkové [99,100].
Okohybné poruchy u mozečkové léze
Mozeček optimalizuje oční pohyby tak, aby se pozorované obrazy okamžitě dostávaly do oblasti fovey - místa s nejlepší zrakovou ostrostí. K tomu jsou využívány sakadické pohyby a vergence (konvergence či divergence). Pomocí fixace, plynulých sledovacích pohybů a vestibulo-okulárního reflexu lze stabilizovat obrázky na retině i v případě, že se cíl nebo nahlížející pohybují [19]. Mozeček hraje stěžejní roli jak v momentální, tak dlouhodobé kontrole očních pohybů [101]. Na tomto úkolu se spolupodílí zejména tři důležité oblasti: flokulus/ paraflokulus, nodulus s přední částí uvuly a dorzální část vermis, která je funkčně spojena s okulomotorickou oblastí ncl. fastigií [19]. U pacienta s mozečkovým postižením zahrnujícím výše uvedené oblasti můžeme tedy nalézt jak nystagmus, tak poruchy plynulých sledovacích pohybů, poruchy kombinovaných sledovacích pohybů současně vykonávaných hlavou a očima i poruchy sakád a vestibulo-okulárního reflexu [19,102].
Nystagmus vzniká nejčastěji u těch mozečkových lézí, které zasahují vestibulocerebelum (archicerebelum) nebo jeho spoje s vestibulárními jádry [19,103]. Pokud během neurologického vyšetření nalezneme nepochybný mozečkový syndrom a není přítomen nystagmus, jedná se zcela jistě o proces intracerebelární. Nejčastější formou mozečkového nystagmu je dolů bijící nystagmus (tzv. downbeat nystagmus) [104]. Pohledový nystagmus, měnící směr v závislosti na směru pohledu, posiluje podezření na afekci mozečkovou, ale nelze vyloučit ani jinou lézi v oblasti CNS [105]. U lézí mozečku vč. nucleus fastigii (vestibulocerebelum) není nikdy nystagmus čistě rotační.
Plynulé sledovací pohyby oční jsou při klinickém vyšetření porušené – nepravidelné a sakadované [10,11]. Při vyšetření sakád (pacient fixuje centrálně nos vyšetřujícího, poté zafixuje na periferní cíl - např. prst vyšetřujícího a zpátky), lze zaznamenat dysmetrii [106]. Než se podaří cíl pevně zachytit, dochází nejprve k přestřelení a poté následné oscilaci v několika cyklech – tedy stejné poruchy jako při testování hybnosti končetin.
K dalším typickým okohybným poruchám při mozečkové lézi patří postižení konjugovaného pohledu, kdy se při volním stočení bulbů ke stranám objevuje paretický pohledový nystagmus.
Porucha úchopu u mozečkového deficitu
Úchop patří mezí základní motorické dovednosti a je zásadní pro provádění běžných denních činností. Přesto, že „nešikovnost“ je častým příznakem mozečkové ataxie, testování úchopu není součástí klinických škál [78 – 80] (klasické mozečkové vyšetření dle Hennera úchop vyšetřuje). Úchop lze rozfázovat na transport ruky k objektu a poté formaci samotného úchopu, po které následuje sevření. U pacientů s mozečkovou patologií může docházet k poruše v obou fázích [107]. Na deficit úchopu mají vliv dysmetrie, asynergie a tremor [107], stejně jako poruchy okulomotoriky [19]. Bývá porušena i prediktivní kontrola samotného sevření [83,108]. Protože technická analýza současně dovoluje zkoumat a objektivizovat jak kinematiku (transport ruky k objektu a formaci úchopu), tak i kinetiku (sevření) úchopu, může se stát užitečným diagnostickým nástrojem u pacientů s mozečkovým onemocněním [19].
Poruchy řeči
Mozeček způsobuje poruchy řeči jak motorické, tak nemotorické. Poruchu fonace a artikulace s protahovanými a explozivními slabikami v důsledku dyskoordinace mluvidel nazýváme obvykle jako sakadovanou nebo skandovanou řečí. Darley et al pojmenovali tuto mluvu jako ataktickou [19,109]. U některých cerebelárních pacientů však může být patrna pouze prostá dysartrie se zpomalením tempa a setřelou výslovností připomínající poruchu řeči u pseudobulbárního syndromu [10,11]. Vzhledem k tomu, že se mozeček spolupodílí také na kognitivních a afektivních procesech vč. funkcí jazykových, patří k nemotorickým poruchám řeči u mozečkové léze porucha plánovaní artikulace a grafomotoriky, porucha dynamiky, verbální fluence, fonologické a sémantické slovní vyhledávání, porucha syntaxe a jiné poruchy v procesu čtení a psaní [19,49,110 – 113].
Elementární reflexy posturální
Elementární reflexy posturální (ERP) byly poprvé popsány Foixem a Thévenardem [114] jako reakce svalu na přiblížení jeho úponů. Vyšetřují se nejčastěji krátkými flekčními sakadovanými pohyby na bicepsech s tím, že za normálních okolností se sval mírně stáhne a je připraven na pohyb z nové polohy. U mozečkového syndromu jsou ERP typicky snížené nebo vyhaslé. Snížené nebo vyhaslé ERP lze také najít při postižení centrálního nebo periferního motoneuronu a při postižení hluboké citlivosti (míšní ataxie, talamický syndrom). Zvýšené jsou naopak u syndromů extrapyramidových, zvláště u choroby Parkinsonovy, ale též u disociativních poruch [10].
Ataxie jako součást syndromu
Ataxie patří mezi hlavní projevy cerebelárního syndromu. Jedná se však i o symptom syndromu vestibulárního a výraz „senzitivní ataxie“ je užíván pro symptom vznikající v důsledku poruchy propriocepce, což sice není samostatný syndrom, ale zapadá např. do syndromu polyneuropatického, syndromu postižení zadních provazců míšních apod.
Podrobné klinické neurologické vyšetření s důrazem na pozorování stoje, chůze, hybnosti končetin a dalších symptomů doprovázejících ataxii zpravidla postačí ke správnému syndromologickému závěru (tab. 1) [11].
Tab. 1. Diferenciální diagnostika jednotlivých typů ataxie. 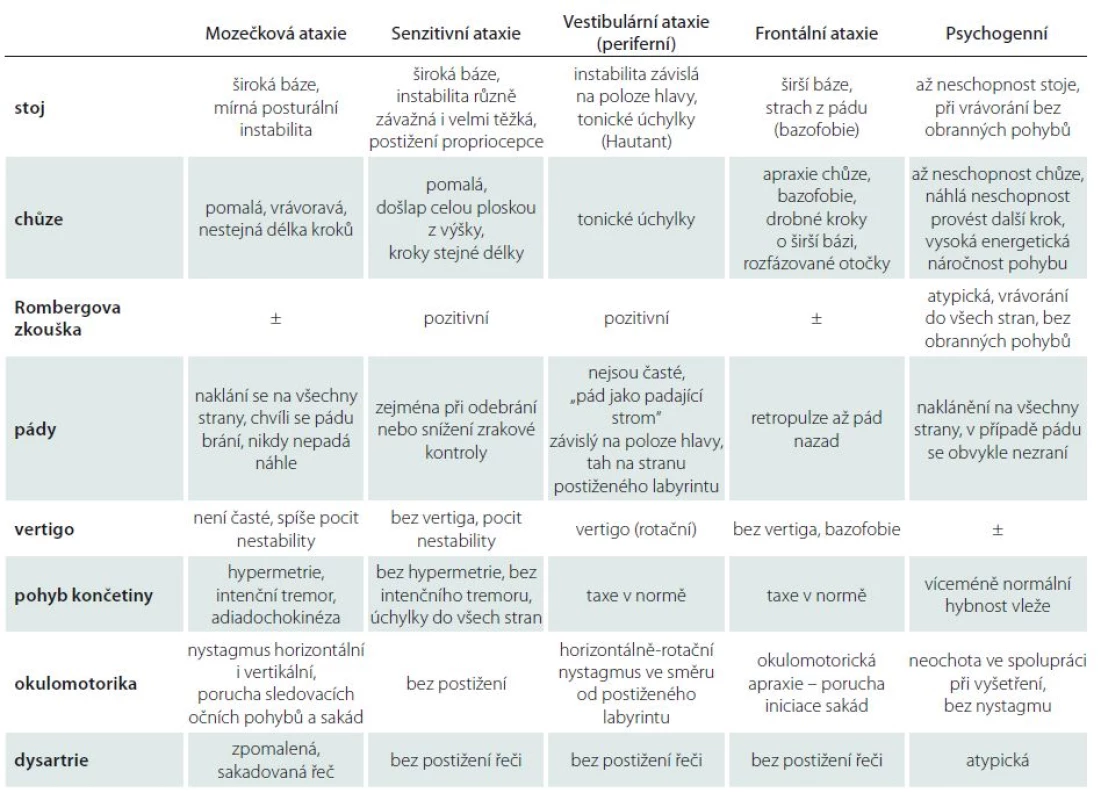
Mozečková ataxie
Syndrom mozečkový může být jednostranný nebo oboustranný. V případě, že je mozečková léze v oblasti středních struktur, bývá postižen izolovaně stoj a chůze (paleocerebelární syndrom), pohyb vleže může být zcela v normě [115]. Je to logické, protože v mozečku končí dráhy spinocerebelární a také direktní i indirektní dráhy vestibulární [10,116]. Oblast koordinuje pohyby jednodušší, globální a vždy současně pro obě strany (není možné, aby byl syndrom paleocerebelární pouze jednostranný). V minulosti se předpokládalo, že poruchu stoje a lokomoce způsobuje léze v oblasti celého vestibulocerebela. Současný výzkum však prokazuje, že zásadní vliv má postižení zvláště v přední horní části vermis [19,115].
Pokud se přidávají i nekoordinované pohyby končetin, jsou postiženy mozečkové hemisféry (syndrom neocerebelární). Hemisféry koordinují pohyby komplikovanější a jednostranné, symptomatika může být stejně patrna na horní i dolní končetině, většinou jsou však mozečkové příznaky vyjádřeny nestejně, často výrazněji na končetině horní [10,115]. Při oboustranné lézi se může také objevit tremor hlavy a trupu, který bývá v anglosaské literatuře označován jako titubace (titubation). V české neurologii jsme zvyklí používat tento pojem po vzoru Hennera ve významu kolísání při stoji či chůzi z latinského „titubo“ = vrávorat.
Nesnadná bývá diagnostika postižení mozečkových pedunkulů. Při jejich lézi jsou mozečkové příznaky přítomny vždy, avšak nemusí být striktně homolaterální. Kromě toho se manifestují i příznaky z postižení jiných nervových struktur, jako jsou hlavové nervy či pyramidová dráha. Těžko lze rozeznat zejména lézi corporis restiforme, kde se kombinují cerebelární a vestibulární příznaky [10].
Význačný mozečkový obraz může způsobit i izolované postižení spinocerebelárních drah. Reálně však tyto dráhy izolovaně postiženy nebývají – obyčejně je doprovází příznaky pyramidové či příznaky z postižení zadních provazců. Mozečkové poruchy mohou být kompenzovány mnoha jinými mechanizmy, takže i hrubší mozečková léze může dlouho unikat [10].
Paleocerebelární syndrom
U pacienta s mozečkovou lézí postihující stoj a chůzi je porucha motoriky značně nápadná. Už Duchènne tento typ chůze popisoval jako chůzi opileckou (démarche d’ivresse), i když jisté odlišnosti by při velmi pozorném vyšetření bylo možné najít [115].
Při typickém cerebelárním stoji je trup více nebo méně v retroflexi, extendované dolní končetiny neprovádějí normální souhyb s flexí v kolenou [10,11,117]. Důvodem je, mimo asynergie, nejspíše změna strategie pohybové kompenzace pro udržení rovnováhy, kdy pacient snižuje počet bodů volnosti a zpevňuje kolena (tzv. knocking knees), aby nedocházelo k rozkmitání i v těchto kloubech [5]. Stoj je nestabilní, horní končetiny jsou v neúplné extenzi a taženy vzad, dolní končetiny nezůstávají nehnutě stát, lze pozorovat stálé kontrakce a dekontrakce na šlachách nártů, někdy je nemocný dokonce nucen neustále přešlapovat z nohy na nohu. Báze je reaktivně rozšířena tak, aby nedošlo k astázii, dolní končetiny jsou v extenzi a abdukci. Při zatažení ramenou nazad (zkouška zvrácení trupu; „pull test“) se zdůrazní náklon a vrávorání na místě, pacient se brání pádu, ke kterému případně dojde až s časovou latencí [10,11]. Často je mozečkový stoj jistější, než vypadá na první pohled, i když pacient vrávorá, mnohdy může bez pádu stát i se zúženou bází. Ztráta zrakové kontroly (Rombergova zkouška) nemá na stabilitu stoje výraznější vliv [10]. Na rozdíl od vestibulární léze si pacienti s čistě mozečkovou symptomatikou přes jakoukoli nestabilitu ve stoji nestěžují na závrať ani nejsou nuceni stále sledovat své nohy jako pacienti s ataxií senzitivní. Pokud však pacient prokazuje instabilitu ve stoji se zrakovou kontrolou, může se po zavření očí mírně zhoršit – rozdíl však nikdy není tak výrazný jako u ataxie senzitivní, kde může nastat i promptní pád (obr. 1) [115].
Obr. 1. Grafické znázornění instability u jednotlivých typů ataxie. Na obrázku je modře znázorněna dráha středu tlakového zatížení plosek (Centre of Pressure; COP). Ve stoji přímém si lze střed tlakového zatížení představit jako průmět těžiště těla na podložku a grafické znázornění jeho dráhy proto poskytuje představu o posturální stabilitě. Jsou zobrazeny různé typy ataxií. U cerebelární ataxie je patrna porucha posturální stability, která není v tomto případě výrazná a závažněji se po odebrání zrakové kontroly nemění. U ataxie senzitivní je také patrna porucha stability, která se však významně zhorší po odebrání zrakové kontroly. Pacient s čerstvou vestibulární ataxií (cca 3 dny od vzniku akutního periferního vestibulárního syndromu) nemá kupodivu poruchu stability v přímém stoji lateralizovanou, jak by bylo možné očekávat, ale na rozdíl od předchozích typů ataxií neustále mění zatížení plosek ze strany na stranu. Frekvence těchto změn se ještě zvýší po odebrání zrakové kontroly. Nejspíše se jedná o kompenzační mechanizmy k zajištění stability. Fig. 1. Graphical depiction of instability in different types of ataxia. The center of foot pressure (COP) trajectory is shown in blue. The COP during stance can be imagined as a projection of the center of gravity of the body on the surface, so the graphical representation of its trajectory provides information about postural stability. Different types of ataxia are graphically represented. In cerebellar ataxia, postural instability is evident, but not significant and does not fundamentally change after removal of the visual control. Sensory ataxia is also characterized by postural instability, but it is significantly worse after removal of the visual control. A patient with acute vestibular ataxia (approx. 3 days after the onset of acute peripheral vestibular syndrome) surprisingly does not show laterality of postural imbalance but compared to previously mentioned types of ataxia constantly moves the center of pressure from side to side. The frequency of these changes increases after removal of visual control. These are probably postural compensatory mechanisms. 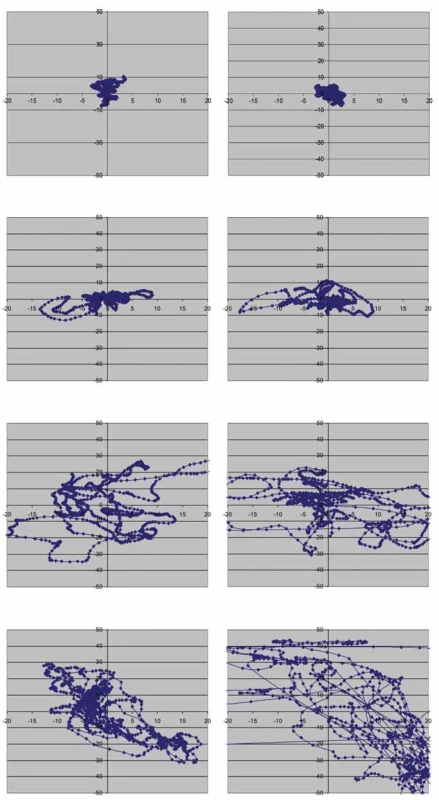
Pro mozečkovou chůzi je charakteristická široká báze, porucha stability a vrávorání. Nemocný značně zvedá dolní končetiny, hypermetricky je vyhazuje, jsou časté úchylky od směru chůze pro stálé vrávorání [10,118,119]. Nejvýrazněji se instabilita s nepravidelnými kmity trupu projevuje při změně strategie pohybu, tedy např. při výzvě k rychlému posazení nebo postavení ze sedu [118,119]. U lehčích forem mozečkové ataxie se může zdát chůze fyziologická, teprve vyšetření ve stoji spojném prokáže instabilitu. Ještě mírnější forma se může prokázat při chůzi „pata-špička“ (tandemová chůze), kdy po kroku nebo dvou pacient ztrácí rovnováhu a udělá úkrok stranou [115]. Je dobré mít na paměti, že porucha mozečková bývá mnohem zřetelnější v bezděčném, nenacvičeném jednání a za nezvyklých okolností. Je proto vhodné zkoušet některé méně obvyklé způsoby chůze – např. skákání po jedné noze, testovat otáčení, chůzi po schodech, chůzi pozadu, po špičkách apod. [10,11]. Neurologové minulého století kladli při syndromologickém zařazení důraz také na charakter spontánních pádů [115]. Obecně však lze říci, že tyto odchylky prokázány nebyly.
Klasický klinický popis zpřesnily pohybové analýzy, které jsou schopny kvantifikovat příčinu a míru motorické dysfunkce [120 – 122]. Pacienti mají potíže během chůze, ale také při její iniciaci, ukončování a otočkách [118,119].
Kroky mají rozšířenou bázi, jsou zkrácené, zpomalené, se sníženou kadencí [120,121], nejisté a nestejně velké. Umístnění plosek bývá značně variabilní. Během chůzového cyklu se také prodlužuje fáze dvojí opory (double support), tedy fáze, kdy pacient setrvává oběma končetinami na podložce. Změny chůzového mechanizmu jsou podmíněny jak poruchou načasování koordinace pohybu, tak poruchou rovnováhy [123]. Většina projevů je však spíše důsledkem kompenzačních mechanizmů při instabilitě, než že by reprezentovala přímo důsledek mozečkové léze [121,124,125]. Pro pacienta je cerebelární chůze dynamicky velice náročná. Na rozdíl od hlasivek a končetin, které jsou mechanicky stabilní a lze je v rámci relaxace zklidnit, je totiž vzpřímené tělo, představující obrácené kyvadlo, vratké. Při postižení mozečku se pohybový aparát automaticky nevrací po každém kroku do výchozí pozice a každý další krok musí vycházet z nové situace – variabilně provedeného kroku předcházejícího [41]. Proto je variabilita typickým příznakem mozečkové chůze [120,121,124] a souvisí nejspíše s interakcí mezi lézí mozečkovou a možnostmi adaptivních a kompenzačních mechanizmů motorického systému jako celku [126].
Neocerebelární syndrom
Neocerebelární syndrom se skládá z výše popsaných příznaků hypermetrie s přestřelováním a nepřesným zakončováním pohybů a adiadochokinézy postihující obratnost zpomalením a ztrátou rytmu rychle alternujících pohybů [28,89]. Neocerebelární asynergie se vyznačuje nesouhrou pohybů a nešikovností, zvláště nápadnou při jemných pohybech vyžadujících přesnou koordinaci. Cílené pohyby ruší intenční tremor, který se někdy jen obtížně odlišuje od hypermetrického přestřelení pohybu [91,96]. Dalším nálezem při vyšetření bývá snížení svalového napětí a odporu kladeného pasivním pohybům spolu se zvýšeným rozkyvem příslušného tělesného segmentu a dalšími projevy pasivity. Neocerebelární postižení dolních končetin může vést k úchylkám stoje a chůze k postižené straně. Výše uvedené příznaky jsou podkladem neobratných, nepřesných a neúměrných pohybů končetin, zvláště jejich distálních části, jež lze zahrnout pod pojem neocerebelární ataxie [10,11,115].
Senzitivní ataxie
Senzitivní ataxie vzniká při poruše propriocepce. Jedná se o důsledek léze proprioceptivní dráhy v kterékoli její části – při lézi aferentních nervových vláken v periferním nervu (častěji postižení silných myelinizovaných vláken), při postižení míšním (zadní provazce), lézi mediálního lemnisku, talamu a výjimečně při lézi obou parietálních laloků [11,115]. Vzhledem k tomu, že většina axonů kortikospinálních drah nekončí přímo na α motoneuronech, ale na míšních interneuronech [127], které přijímají, mimo motorických příkazů z kortexu, také senzitivní zpětnovazebné informace z kožních, šlachových i svalových receptorů [128], je na míšní interneurony nutno nahlížet jako na klíčový bod motorické kontroly a koordinace pohybů [129].
Nezávisle na lokalizaci léze je pacient zbaven povědomí o pozici svého těla. Má pocit poruchy rovnováhy, ale jen občas, např. na vrcholu schodiště, interpretuje tento pocit jako závrať – stejně jako pacient s lézí cerebelární. Jedná se však jen o verbalizaci nejistoty před dalším pohybem. Typický je stesk na zhoršenou kontrolu končetin, pacient říká, že „nemá problém v hlavě, ale v nohách“, uvědomuje si, že našlapuje nesprávně, avšak není schopen špatně provedený krok opravit. Výsledkem je různá míra postižení stoje a chůze, v těžkých případech až úplná ztráta lokomoce i přes zachovanou svalovou sílu.
Výrazným rysem tohoto typu ataktické chůze je těžké došlapování atypicky rovnou na celou plochu plosky, protože pacient se snaží intenzivnějším přidupáváním zintenzivnit vjem doteku chodidla s podložkou. Báze je rozšířena jako reakce na subjektivně vnímanou poruchu rovnováhy; pacient bedlivě sleduje povrch, po kterém kráčí, stejně jako svá chodidla. Trup drží v mírné flexi a část váhy bývá přenesena na oporu, kterou pacienti obvykle vyžadují – na rozdíl od ataxie cerebelární, kdy pacienti o hůl zakopávají a spíše jim vadí. Už Hunt charakterizoval takového pacienta jako „stamp and stick“, tedy dupající pacient s hůlkou.
Další významnou charakteristikou je nápadné zhoršení stability stoje i chůze po snížení zrakové kontroly; pacienti spontánně udávají výrazné obtíže např. v noci při chůzi na toaletu.
U periferní neuropatie a zadněprovazcové ataxie vybavíme příznak Rombergův. Tento symptom není typický u ataxie mozečkové, i když v pokročilých stadiích cerebelárního syndromu, kdy je patrná instabilita i ve stoji se zrakovou kontrolou, může k částečné agravaci docházet. Zhoršení však není tak výrazné a nezpůsobuje pád pacienta (obr. 1).
Obraz senzitivní ataxie dokresluje při klinickém neurologickém vyšetření porucha polohocitu a obvykle i porucha vibračního čití. Periferní nebo centrální původ senzitivní léze rozliší výbavnost myotatických reflexů [5,115].
Volní pohyb pacienta se senzitivní ataxií je značně rozháraný všemi směry, a to jak kvalitativně, tak kvantitativně. Na rozdíl od ataxie cerebelární, kde je zachován alespoň směr taxe a po nácviku se může pohyb i zlepšovat, ataxie senzitivní na trénink téměř nereaguje.
Tremor, zejména u polyneuropatií silných vláken, bývá nápadný, ale nemá charakter intenční, spíše je možné ho přirovnat k výraznému tremoru esenciálnímu.
Už Thomas upozorňuje, že ataxie při postižení zadních kořenů (např. tabická) je vlastně zároveň ataxií spinální, bulbární, mozečkovou i mozkovou, protože podněty, které přicházejí zadními kořeny, mají vliv na všechny tyto etáže. Proto je její obraz mnohem pestřejší a neuspořádanější než porucha koordinace u léze parietální či mozečkové [10].
Vestibulární ataxie
Klinické odlišení vestibulární ataxie od ataxie mozečkové je obtížné, v některých případech centrálního vestibulárního syndromu až nemožné. Důvodem je těsný vztah mezi vestibulárním ústrojím a mozečkem.
Periferní vestibulární lézi lze odlišit od jiných typů ataxií přítomností závratě, tonické úchylky (Hautantova zkouška, Unterbergerova zkouška) a nálezem typického horizontálně-rotačního nystagmu [130]. Také Rombergova zkouška bývá pozitivní (obr. 1). Směr spontánních pádů souhlasí u periferního vestibulárního syndromu se směrem nystagmu a polohou hlavy, u mozečkových lézí padá pacient trvale ke všem stranám, změna postavení hlavy tuto situaci neovlivní. Pacient s chronickou vestibulopatií trpí poruchou rovnováhy ve stoji a při chůzi, často bez rozšíření báze a typická je neschopnost sejít schody bez držení se zábradlí [131].
Porušena je stabilita zejména při pohybu, pacient udává, že se cítí, jako by stál na palubě lodi. Nestabilita při chůzi se typicky zmírňuje rychlostí provádění pohybu – při rychlé chůzi pacient udržuje rovnováhu lépe [7]. Naopak při rychlých otáčkách se nejistota zvýrazňuje ve všech směrech. Pacient má přitom velký problém cíl zafixovat; stejný problém se objeví, pokud je osoba v klidu a cíl se pohybuje. Při náhlém otočení hlavy při pohybu celého těla může vnímat objekty jako rozmazané nebo poskakující nahoru a dolů (oscilopsie) [130]. Řídit auto nebo číst v dopravním prostředku je pro pacienta těžké až nemožné. Tyto abnormity jsou výsledkem ztráty stabilizace okulární fixace vestibulárním systémem během pohybu (vestibulo-okulární reflex). V diferenciální diagnostice také napomáhá „head impulse test“ [115,131,132], pozitivní u periferní vestibulární léze.
U vestibulárních lézí centrálních je nystagmus variabilní, bývá dysrytmický, častá je vertikální komponenta, směr se může měnit i v průběhu vyšetření [133]. K diferenciaci od mozečkových lézí napomůže jen pečlivé vyšetření všech cerebelárních symptomů a teprve při jejich absenci lze vyslovit podezření na centrální vestibulární syndrom [10].
Ataxie jako funkční porucha motoriky
Funkční poruchy motoriky jsou definovány nestálostí projevů měnících se významně odvedením pozornosti či nefyziologickými manévry (vč. výrazné placebové reakce) a neshodují se s obrazem poruchy hybnosti na podkladu známého neurologického onemocnění [134,135]. Před stanovením diagnózy funkční motorické poruchy je vždy nutno myslet na možnost organického postižení s atypickou nebo bizarní symptomatikou, a proto je nutné pacienta pečlivě klinicky vyšetřit.
Rozeznání čistě funkční ataxie od syndromu mozečkového obvykle nebývá těžké. Problém nastává u pacientů, kteří dříve trpěli závratí a instabilitou na organickém podkladu a funkční obtíže u nich přetrvávají i po uzdravení [43]. Pátráme po nestálosti a měnlivosti příznaků, kolísání obtíží v čase a jejich zmírnění při odvedení pozornosti [134]. Na funkční ataxii nás může přivést i nesoulad uváděných či předváděných příznaků se známými anatomicko-fyziologickými zákonitostmi [136].
U instability stoje a chůze je pro funkční poruchy hybnosti příznačná absence obranných pohybů při vrávorání, event. kompenzační mechanizmy bývají často neekonomické. Báze je nepřiměřeně široká, paradoxně se někdy zlepšuje při zkoušce chůze tandemové [135].
Je však třeba upozornit na některé poruchy a diagnózy, které mohou působit obtíže v diferenciálně diagnostické rozvaze. Je např. známo, že léze v oblasti přední horní části vermis cerebelli může způsobit ataxii nebo těžkou instabilitu, která se manifestuje až ve chvíli, kdy se pacient snaží postavit nebo chodit. To samé je typické pro pokročilý normotenzní hydrocefalus, onemocnění čelního laloku, anebo fenytoinovou intoxikaci. Také případy těžké periferní neuropatie, zejména pokud dochází k postižení propriocepce, mohou výrazně zhoršit stoj a chůzi a působit až bizarně. Za funkční poruchu motoriky je možné zaměnit i vzácný ortostatický tremor dolní končetiny, který způsobuje po delším stání její nekontrolovatelné podklesávání [115].
Poruchy stoje a chůze u léze frontálních laloků (frontální ataxie, senilní chůze, syndrom astázie-abázie, parkinsonizmus dolní části těla, „marche à petits pas“ neboli lakunérská chůze)
Přes častý výskyt poruchy chůze tohoto typu působí její klinická klasifikace určité nesnáze. Problém začíná už jejím pojmenováním. Při povrchním klinickém vyšetření se mnohdy nález uzavírá jako „paleocerebelární“ syndrom, ačkoli z mozečkových symptomů bývá vyjádřena pouze ataxie axiální [11]. Bruns proto na přelomu 20. století zavádí termín ataxie frontální, což vyvolává diskuze přetrvávající dodnes [115,137]. Henner používal pro stejný obraz název syndrom pseudocerebelární a příznaky přisuzoval postižení začátku drah fronto-ponto-cerebelárních při bilaterální lézi [10]. Avšak ani tento termín nepostihuje celou šíři frontální poruchy chůze s prvky prefrontálního a extrapyramidového hypokinetického syndromu.
Z dnešního pohledu by se teoreticky mohlo zdát, že nejpřesnější by bylo mluvit o frontální apraxii. Definice apraxie ovšem vychází ze ztráty schopnosti provést naučený pohyb, ale při vyšetření zjišťujeme, že pacienti s apraxií dolních končetin netrpí nápadnou poruchou chůze, a naopak, pacienti s lézí frontálních laloků nemají apraxii dolních končetin.
Typický stoj při lézi frontálních laloků zahrnuje vzpřímený trup, někdy s tendencí k záklonu, s pokrčením dolních končetin v kolenou a poklesem pánve [115].
Pacient si často stěžuje na zpomalení a snížení jistoty při chůzi, má strach z pádu. Obvykle je zřetelná porucha iniciace chůze se zpomaleným startem (hezitací) a v reakci na subjektivní obtíže dochází k přirozené kompenzaci, což znamená zmenšení kadence, rozšíření báze, zkrácení kroků a šoupání nohou po podložce. Lokomoci těchto pacientů nelze mnohdy charakterizovat jinak než jako karikaturu normální chůze.
Pacienti se mohou během chůze navíc zastavovat, protože pociťují velké obtíže, ale již s malou dopomocí nebo se slovním pobízením se jejich výkon výrazně zlepšuje. Hledají oporu u doprovodu nebo se chytají nábytku či zdí. Chůze a otočky jsou doprovázeny sérií drobných krůčků, které jsou často prováděny jen jednou nohou, zatímco druhá je umístěna pevně na podlaze a tvoří pacientovi relativně stabilní oporu. Pokud je při chůzi současně vyjádřeno „zamrzání“, může být provázeno bizarními projevy snahy o rozejití nebo o zachování chůze – nadměrným komíháním paží, náklony trupu ze strany na stranu apod. [138].
Při postrčení nazad (vychýlení těžiště vzad) nenastává u frontální poruchy pád na místě, ale následuje několik krůčků – zpočátku pomalých a krátkých, rychle se však prodlužujících, zrychlujících, tedy tzv. crescendová retropulze.
Iniciace chůze se během trvání onemocnění stává stále obtížnější. U pokročilejších stavů je pacient schopen pouze několika krátkých nezdařených kroků na místě, není schopen se pohnout vpřed, později není schopen ani krok naznačit – jako by byly jeho nohy přilepeny k zemi, tzv. magnetická chůze [139]. Ve finálním stadiu, typicky např. u pacienta s nepoznaným, a tedy neléčeným normotenzním hydrocefalem, není pacient schopen ani sedu, bez opory padá dozadu nebo ke straně.
V příkrém kontrastu s těžkou poruchou chůze je dobře zachována hybnost dolních končetin při vyšetření vleže, vč. schopnosti chůzových pohybů a „šlapání na kole“. Progresí onemocnění se však všechny pohyby končetin stávají pomalé a nemotorné a končetiny při pasivně prováděném pohybu kladou různý odpor (tzv. paratonia neboli gegenhalten), pacient se velmi obtížně otáčí v posteli.
Výše uvedené motorické problémy obyčejně doprovází demence, nicméně chůzové a mentální obtíže se nemusí vyvíjet paralelně. Například pacienti s Alzheimerovou nemocí mohou mít vysoký stupeň demence několik let předtím, než se objeví poruchy chůze. U jiných jednotek, jako např. normotenzního hydrocefalu a chronické vaskulární encefalopatie, je tomu naopak – potíže s chůzí předcházejí příznaky demence. V neurologickém nálezu se dále typicky objevuje dezinhibice chování a primitivních reflexů a pseudobulbární syndrom [11,115].
Mozečkový syndrom v dětském věku
Pro úplnost tohoto textu je vhodné v krátkosti věnovat pozornost i mozečkovému syndromu v raném dětství. Mozečkové příznaky jsou v dětství daleko častější než v dospělosti. Vysvětlit to lze tzv. Kőrnyeyovým pravidlem, které říká: „V případě postižení vyvíjející se CNS jsou to právě nezralé struktury, které jsou především postiženy“ [12,140]. A mozečkové struktury dozrávají dlouho [141], dráhy cerebelofugální i cerebelopetální myelinizují až kolem 18 měsíců postnatálního života, funkční vývoj však trvá daleko déle – až kolem 6., 7. roku získáváme koordinaci pohybů a typ motoriky charakteristický pro dospělého člověka. Jedná se o zcela fyziologický proces, který musíme při vyšetřování respektovat, protože nezralý nervový systém ještě není schopen vytvořit klasický klinický obraz dospělého věku.
V raném dětství se mozečková patologie projevuje většinou obrazem vývojového centrálního hypotonického syndromu, který ovšem může být i známkou postižení jiných struktur CNS. Teprve v dalším vývoji nás na paleocerebelární symptomatiku může upozornit rozšířená báze při lezení po čtyřech, tvrdší přidupávání a zejména elevace bérců nad podložku. Nástup chůze bude u mozečkového postižení opožděný, dítě bude při pokusech o samostatnou chůzi dlouho padat ke všem stranám, bude chodit o rozšířené bázi déle než jeho vrstevníci. I u neocerebelárního syndromu je v prvních fázích vývoje typická centrální hypotonie, která se postupně vyvíjí – ve 3 – 4 letech již sice můžeme mluvit o ataxii, ale teprve v 6 – 7 letech se jasně projeví dysmetrie. Testovat spolehlivě a-/ diadochokinézu stejně jako pasivitu nám spolupráce s dítětem dovolí většinou až mezi 8. a 10. rokem věku [12].
Ataxie jako klíč k diagnóze
Po rozpoznání ataxie jako symptomu a následném syndromologickém zařazení lze obvykle stanovit současně diagnózu topickou. Následuje určení diagnózy nozologické, kterému správná lokalizace léze výrazně napomáhá. Mimoto diferenciální diagnostice napomáhají další okolnosti, jako jsou věk pacienta, rychlost rozvoje obtíží (akutní, subakutní, chronické), charakter léze (bilaterální nebo jednostranné) atd. (tab. 2).
Tab. 2. Přehled etiologie jednotlivých typů ataxií. 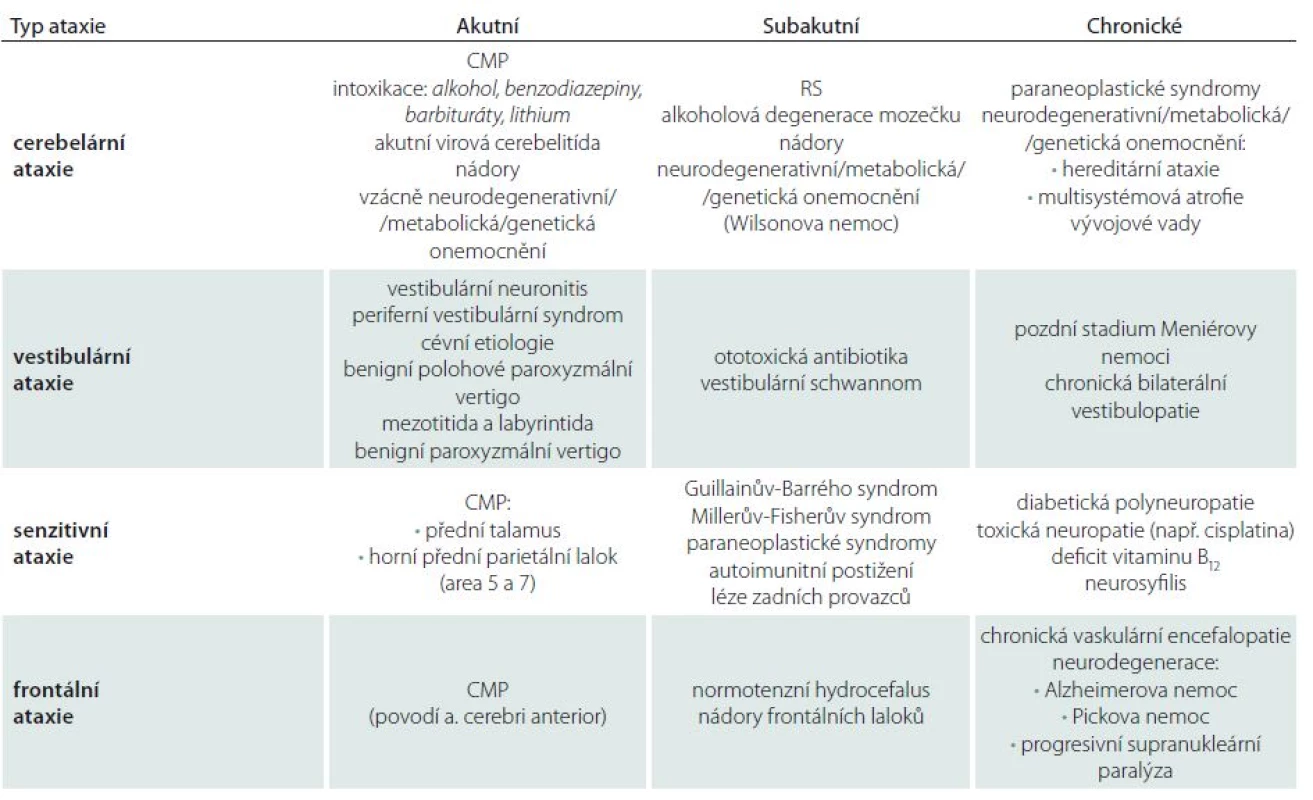
Pokud se jedná o ataxii náhle vzniklou, mimo klasický periferní vestibulární syndrom [130,142], lze doporučit provedení akutního zobrazovacího vyšetření. Kromě abúzu alkoholu je vždy potřebné vyloučit ataxii způsobenou užíváním léků, jako jsou lithium, fenytoin, amiodaron, 5-fluorouracil a chemoterapeutika [143].
Komplexní vyšetřovací postup u dospělého pacienta se získanou ataxií lze nalézt v tab. 3, volně dle Ramireze-Zamory et al a Fogela a Perlmana [143,144]. Má dvě části – vyšetření prvního kontaktu jsou relativně finančně nenáročná a běžně dostupná. Tato vyšetření mohou proběhnout i v ambulanci praktického lékaře a mohou vyloučit příčiny běžné, ne nutně neurologické, často i jednoduše léčitelné. Rozšířené vyšetření by mělo obsahovat zejména zobrazení mozku, nejlépe MR, a další doporučená vyšetření uvedená v tab. 3. Je nutné si uvědomit, že se jedná pouze o návod, výběr diagnostických metod a postupů je nutné provést na základě neurologického vyšetření, anamnézy a také výsledků vyšetření předešlých. V případě, že příčina získané ataxie nebyla objasněna, byly tedy vyloučeny možnosti získaných ataxií uvedené v tab. 3, je třeba u pacienta s progresivní mozečkovou ataxií doporučit genetické vyšetření [143]. V tomto případě je pravděpodobnost, že se jedná o nejčastější typy hereditárních ataxií (autozomálně dominantní spinocerebelární ataxie 1, 2, 3, 6, 8, 17 a ataxii Friedreichovu) cca 13% [143,145]. Dále lze geneticky potvrdit nebo vyloučit ataxii s okulomotorickou apraxií 1, 2, Tay-Sachsovu nemoc, nebo některé z X-vázaných metabolických chorob, mitochondriálních nemocí nebo leukodystrofií. V případě, že ani takto podrobným vyšetřením není objasněna příčina obtíží, lze doplnit cílenou nebo exomovou sekvenci DNA [143].
Tab. 3. Vyšetřovací postup u dospělého pacienta zaměřený na vyloučení získané ataxie.* 
ACE – angiotenzim konvertující enzym; AFP – alfafetoprotein; ANA – antinukleární protilátky; CK – kreatin kináza; CRP – C-reaktivní protein; Cu – měď; Ds-DNA – protilátky proti dvouřetězcové DNA; FTA – fluorescenční-absorbční test užívaný k diagnostice syfilis; MRS – magneticko-rezonanční spektroskopie; MSA – multisystémová atrofie; NH3 – amoniak; RF – revmatoidní faktor; RPR – rapid plasma regain – test užívaný k diagnostice syfilis; SLE – systémový lupus erythematosus; SSA/Ro – antinukleární protilátky; SSB/La – antinukleární protilátky; SSEP – somatosenzorické evokované potenciály; VEP – zrakové evokované potenciály *Jedná se pouze o návod – výběr diagnostických metod a postupů je nutné provést na základě neurologického vyšetření, anamnézy a také výsledků vyšetření předešlých. Tabulka neobsahuje všechna vyšetření vhodná pro kompletní diagnostiku jednotlivých onemocnění, v případě konkrétního podezření je nutné postupovat dle platných doporučení. Cerebelární ataxie v dospělém věku
Již při odebírání základních anamnestických dat se většinou dozvíme, zda se u pacienta jedná o manifestaci obtíží akutní, subakutní či chronickou – tedy zda se jednalo o jednorázové poškození mozečku (trauma, CMP, hypertermie) nebo se spíše zaměříme na onemocnění progresivní z okruhu neurometabolických, neurodegenerativních či neurogenetických chorob [11,12,115,144,146].
Toto simplexní dělení má však své výjimky, na které je třeba myslet. I pacienti s pomalu progredujícím dědičným onemocněním totiž někdy udávají začátek obtíží jako náhlý, což obvykle souvisí s vyčerpáním kompenzačních mechanizmů při zátěži infektem, stresem nebo fyzickou zátěží. Obdobné obtíže v diagnostice mohou způsobit data odebraná z rodinné anamnézy. Již dávno neplatí, že autozomálně dominantní onemocnění musí nutně postihovat každou generaci – existují mutace s neúplnou penetrancí, ale i spinocerebelární onemocnění repeatová s fenoménem anticipace. Při progresivním mozečkovém postižení je relativně frekventní chybou to, že se obtíže vysvětlí abúzem alkoholu (přičemž za abúzus bylo u jednoho pacienta považováno již jedno až dvě piva denně), a přitom se může jednat o onemocnění z okruhu chorob neurogenetických.
Při akutním mozečkovém postižení symetrickém je potřeba vyloučit intoxikaci (alkohol, lithium, hydantoin, barbituráty, benzodiazepiny atd.), akutní virovou cerebelitídu a postinfekční syndrom (obvykle po neštovicích) [146,147], i když jsou typičtější pro dětský věk. Při jednostranné afekci je pravděpodobnější postižení cévní – mimo ischemie a hemoragie i subdurální hematom. Ataxie akutní s intermitentním průběhem vede v dospělosti většinou k podezření na RS.
Při subakutní symetrické lézi lze zvažovat alkoholovou degeneraci mozečku. Postihuje přední horní část vermis a způsobuje poměrně čistou ataxii stoje a chůze se žádným nebo minimálním postižením pohybu končetin. Nejčastějším typem subakutní jednostranné afekce je RS, pro kterou je mozečkový syndrom takřka patognomickým projevem.
Pomalu progresivní a chronický průběh vede k podezření na paraneoplastické syndromy [148] a hereditární formy mozečkových ataxií [149]. U pacientů s paraneoplastickým onemocněním nebo s infarktem laterální části mozkového kmene a dolního mozečku se kombinuje ataxie s vertigem. Pokud je postižena zejména chůze, je třeba pomýšlet na Friedreichovu chorobu a skupinu autozomálně dominantních spinocerebelárních ataxií – v ČR zejména spinocerebelární ataxii typu 2. U těchto chorob se mozečková symptomatika zpravidla kombinuje s postižením dalších systémů (pyramidového či extrapyramidového, periferního motorického nebo senzitivního neuronu) [150]. Diferenciálně diagnosticky je třeba zvažovat i multisystémovou atrofii a amyotrofickou laterální sklerózu.
V případě nálezu tzv. rubrálního tremoru je nutno diferenciálně diagnosticky pomýšlet na diagnózu RS a Wilsonovy choroby. Velmi vzácně se může jednat o vaskulární lézi v oblasti tegmenta. Zcela raritní, avšak popsanou příčinou je nežádoucí účinek antipsychotik [7,11,12,146].
Zvláštní zmínku na závěr si zasluhují léčbou ovlivnitelné formy získané cerebelární ataxie, kam patří např. deficit vitaminu E, abetalipoproteinemie, cerebrotendinózní xantomatóza, Niemannova-Pickova nemoc typu C, některé typy Refsumovy nemoci, deficit glukózového transportéru typu 1, epizodická ataxie typu 2, sideróza [143]. Dále imunitně navozené mozečkové ataxie, u kterých je zásadní si uvědomit, že terapie musí být započata záhy od vzniku obtíží, jinak nemusí mít efekt [148]. Do této skupiny patří i ataxie s protilátkami svědčícími pro přecitlivělost na lepek [151], protilátkami proti dekarboxyláze kyseliny glutamové [152], ataxie jako součást paraneoplastického neurologického syndromu [153] nebo ataktická varianta encefalopatie reagující na steroidy asociované s autoimunitní tyreoiditidou (Hashimotova encefalopatie) [148,154].
Cerebelární ataxie v dětském věku
Diferenciální diagnostika mozečkového syndromu dětského věku se od dospělého značně liší. Příčiny lze také rozdělit na vrozené a získané, avšak CMP nebo RS v dětství mezi časté příčiny nepatří.
Akutní mozečková ataxie v dětském věku bývá nejčastěji zánětlivého nebo nádorového původu. Zánětlivá mozečková onemocnění jsou v dětství právě tak častá jako v dospělosti vzácná [147]. Už Henner upozornil na častý výskyt cerebelitid v tomto věku – nejčastěji v souvislosti s varicelou, ale i spalničkami nebo zarděnkami. Kromě toho se s rozvojem akutní ataxie setkáváme při intoxikaci např. barbituráty, mozečkovou symptomatiku však může vyvolat celá řada jiných léků, které buď pacient sám užívá, nebo dojde k požití při nepozornosti rodičů. Ani v tomto věku nemůžeme vyloučit požití léků se sebevražednými úmysly. Skupinu akutně vzniklé ataxie v dětském věku uzavírá možnost úrazu, avšak izolovaná kontuze mozečková je jak v dospělosti, tak v dětství vzácná.
Ataxie akutní s intermitentním průběhem je v dětském věku dost vzácná, je třeba zvažovat pomalu postupující leukodystrofie, jako např. Pelizaeusovu-Merzbacherovu chorobu [155], nebo dědičná metabolická onemocnění, např. Hartnupovu chorobu [156], nemoc javorového sirupu [157] či subakutní nekrotizující encefalopatii (Leighovu nemoc). Pro úplnost do této skupiny patří syndrom opsoclonus-myoclonus (v anglosaské literatuře také dancing eyes-dancing feet). Jedná se o paraneoplastický syndrom typicky doprovázející neuroblastom. Je proto třeba v první fázi vyšetřit oblast retroperitonea a v moči hladinu kyseliny vanilmandlové – bohužel, negativní nálezy neuroblastom nevylučují a pacienta s tímto podezřením je nutné dále vyšetřovat a sledovat [158].
Chronická mozečková onemocnění dětského věku jsou velmi častá, avšak semiologické hodnocení není jednoduché a nelze jednoduše aplikovat kritéria známá z mozečkových vyšetření neurologie dospělých. Je nutno zohlednit faktor vývoje a dozrávání mozečku - a to až do věku 6 či 7 let. I zde však můžeme afekce dělit na progresivní a neprogresivní. Neprogresivní mozečková onemocnění dětského věku, typicky dětská mozková obrna, ale nejsou stacionární, klinický obraz se vyvíjí v závislosti na dozrávání mozkových struktur, neměnná zůstává původní léze [159]. Do skupiny progresivních patří onemocnění hereditární v podobném spektru jako v dospělosti [12], typicky ataxia teleangiektázia [160], ataxie při deficitu vitaminu E nebo Friedreichova choroba.
Vestibulární ataxie
Onemocnění postihující periferní vestibulární aparát představují většinu neurologických chorob, které se projevují závratěmi. Mezi nejčastější akutní afekce periferního vestibulárního ústrojí náleží např. benigní paroxyzmální polohové vertigo, vestibulární neuronitida či vaskulárně podmíněné periferní syndromy (a. cerebelli anterior inferior, a. cerebelli posterior inferior). U cévních syndromů je periferní vestibulární postižení obvykle doprovázeno centrálními motorickými příznaky. Pokud ne, představují svízelný diferenciálně diagnostický problém oproti ostatním periferním syndromům [116].
V diferenciální diagnostice může pomoci rozlišit vertigo na tři skupiny podle průběhu obtíží. 1. Buď se jedná o akutně vzniklý symptom trvající dny, týdny, někdy i déle (cévní mozková příhoda, krvácení nebo zánět) [19], nebo 2. můžeme vysledovat rekurentní ataky trvající několik vteřin (centrální polohovací nebo poziční vertigo) či minut (epizodické ataxie). 3. Jedná se o chronické trvalé vertigo, často progresivní (hereditární ataxie, roztroušená skleróza, nádory, paraneoplatický syndrom nebo vrozené metabolické onemocnění).
V dětském věku je při akutním periferním vestibulárním syndromu nutné především vyloučit bakteriální mezotitidu či labyrintitidu [161]. Při paroxyzmální závrati je třeba zvažovat benigní paroxyzmální vertigo, které patří mezi periodické syndromy v dětství, obvykle předcházející rozvoj migrény. Také je pro tento věk typická kinetóza a závrať může být i ekvivalentem aury předcházející epileptický záchvat.
Příčiny akutního centrálního vestibulárnímu syndromu jsou cévní, nádorové, zánětlivé a traumatické [162].
Chronické nemoci vestibulárního aparátu jsou způsobeny zejména protrahovaným užíváním ototoxických antibiotik nebo jiných toxických léků, které ničí vláskové buňky Cortiho orgánu. Může se jednat i o pozdní stadium Ménierovy choroby. Diferenciálně diagnosticky připadá v úvahu seniorský typ chůze, kdy se kombinuje porucha stárnoucího vestibulárního aparátu s poruchou propriocepce, způsobenou distální neuropatií seniorů a poruchou zraku [131].
Senzitivní ataxie
Příčinou senzitivní ataxie mohou být periferní neuropatie, které postihují zejména dorzální ganglia nebo silná Ia vlákna (neuropatie slabých vláken způsobují zvláště bolest a autonomní dysfunkci, nikoli senzitivní ataxii [163] – příkladem je diabetes mellitus). Dále do tohoto okruhu chorob patří subakutní senzitivní neuropatie autoimunitní nebo paraneoplastická, u Guillainova-Barrého syndromu pacienti často trpí senzitivní ataxií na počátku onemocnění a může přetrvávat i jako reziduální deficit [164]. Toxická neuropatie je nežádoucí jev při podávání cytostatik, je třeba na ni pomýšlet i při podání vysokých dávek pyridoxinu [165].
U míšní léze dochází k senzitivní ataxii při poškození zadních provazců, při poškození drah spinocerebelárních k ataxii cerebelární. Klasickou příčinou syndromu zadních provazců byla v minulosti neurosyfilis, dnes jsou to spíše metabolické poruchy, jako např. diabetes mellitus. Zejména u starších lidí může být příčinou senzitivní ataxie deficit vitaminu B12, stejně jako meningeom, spondylóza či plaka zasahující do oblasti zadních provazců. Friedreichova ataxie postihuje jak zadní provazce, tak dráhy spinocerebelární, jedná se proto o ataxii smíšenou. U Millerova-Fisherova syndromu (oftalmoplegie, areflexie, ataxie), který je považován za samostatnou variantu syndromu Guillanova-Barrého, způsobuje těžkou ataxii a intenční tremor nejspíše selektivní postižení periferních vláken určených pro spinocerebelární trakt v kombinaci s Ia vlákny [166]. Atypická tranzientní senzitivní ataxie kontralaterálních končetin se může objevit akutně po infarktu nebo krvácení do předního talamu. Mimo další příznaky typické pro lézi talamu se objevuje i jednostranný flapping tremor. Léze v oblasti horního parietálního laloku (area 5 a 7) se může velmi vzácně projevit ataxií kontralaterálních končetin [5,7,10,11,146].
Frontální ataxie
Mezi nejčastější příčiny frontální ataxie patří mnohočetné ischemické postižení bílé hmoty frontálních laloků odpovídající chronické vaskulární encefalopatii, případně ohraničené malacie v oblasti zásobené arteria cerebri anterior. Dále se tento typ poruchy chůze vyskytuje u normotenzního hydrocefalu, Alzheimerovy nemoci, Pickovy nemoci, progresivní supranukleární obrny, rozsáhlých nádorů (meningeom a gliomatosis cerebri) a u jiných oboustranných postižení frontálních laloků [7,10,11].
Závěr
Ataxie je dobře rozpoznatelný symptom, který se však může manifestovat jako součást řady syndromů, nikoliv pouze nejčastějšího a nejvíce známého, tedy mozečkového. I v dnešní době aplikace moderních zobrazovacích metod a elektrofyziologických vyšetření má předcházející klinické neurologické vyšetření s určením typu ataxie své nezastupitelné místo. Klasický neurologický postup u ataktického pacienta vycházející z anamnestických dat, neurologického vyšetření se syndromologickým závěrem, následná diferenciálně diagnostická rozvaha a teprve poté racionální aplikace dalších vyšetřovacích metod je i v současné době nejlepší zárukou stanovení správné diagnózy a adekvátní léčby.
Podporováno grantem GACR 16-2179S, MZ ČR – RVO, FN Motol00064203.
Chtěly bychom poděkovat MU Dr. Aleně Zumrové, Ph.D., za cenné rady a připomínky a doc. Ing. Františkovi Zahálkovi, Ph.D., za laskavé poskytnutí obrazové dokumentace posturografických vyšetření.
Přijato k recenzi: 7. 12. 2017
Přijato do tisku: 12. 2. 2018
MUDr. Jaroslava Paulasová Schwabová, Ph.D.
Neurologická klinika
2. LF UK a FN Motol
V Úvalu 84
150 06 Praha
e-mail: schwabova@gmail.com
MU Dr. Jaroslava Paulasová Schwabová, Ph.D.
MU Dr. Jaroslava Paulasová Schwabová, Ph.D. se narodila v Liptovském Mikuláši. Tam také vystudovala gymnázium Michala Miloslava Hodžu, poté 2. LF UK v Praze. Během studií její zájem směřoval k neurologii. Zpočátku se věnovala Alzheimerově nemoci, poté se pod vedením MU Dr. Aleny Zumrové, Ph.D., zaměřila na problematiku hereditárních ataxií. Po studiích nastoupila na místo sekundární lékařky na Klinice dětské neurologie 2. LF UK a FN Motol. Od roku 2010 působí na Neurologické klinice 2. LF UK a FN Motol. Tam se v rámci Centra hereditárních ataxií věnuje ataxiím, mimoto se stala členkou cerebrovaskulárního týmu. V roce 2014 složila atestaci z dětské neurologie, v roce 2015 z neurologie dospělé. V tom stejném roce také obhájila doktorskou práci na téma „Využití baropodometrie k objektivizaci neurologického nálezu u pacientů s hereditární ataxií“ (školitel: prof. MU Dr. Valdimír Komárek, CSc.; odborný konzultant: MU Dr. Alena Zumrová, Ph.D.). Mimo svou klinickou práci působí rovněž na 2. LF UK a FN Motol. Je také členkou vědeckého týmu Laboratoře sportovní motoriky Fakulty tělesné výchovy a sportu UK v Praze. Pravidelně publikuje v odborných českých i zahraničních časopisech.
Zdroje
1. Bouillaud (1846). Referred to by Garcin R. In: Vinken PJ, Bruyn GW (eds). Handbook of neurology. Amsterdam: North Holland Pub Co 1975 : 309 – 355.
2. Friedreich N. Ueber degenerative Atrophie der spinalen Hinterstränge. Arch Pathol Anat Physiol Klin Med 1863; 26(5 – 6): 433 – 459.
3. Marie P. Sur l’hérédo-ataxie cérébelleuse. Semaine medicale 1893; 13 : 444 – 447.
4. Klockgether T. Handbook of ataxia disorders (Neurological disease and therapy). New York: Marcel Dekker 2000.
5. Sudarsky L. Cerebellar gait and sensory ataxia. In: Bronstein AM, Brandt T, Woollacott MH et al (eds). Clinical disorders of balance, posture and gait. 2nd ed. New York: Oxford University Press 2004 : 163 – 172.
6. Babinski J. De l’asynergie cérébelleuse. Rev Neurol (Paris) 1899; 7 : 806 – 816.
7. Ropper AH, Brown RH. Incoordination and other disorders of cerebellar fiction. Adams and Victor‘s principles of neurology. 8th ed. New York: McGraw-Hill 2005 : 78 – 88.
8. Holmes G, Stewart TG. Symptomatology of cerebellar tumors: a study of forty cases. Brain 1904; 27 : 522 – 591.
9. Thomas JA, Herring WC. Cerebellar functions (1912). Whitefish: Kessinger Publishing 2010.
10. Henner K. Všeobecná diagnostika chorob mozečkových. Praha: Bursík & Kohout 1936.
11. Růžička E, Ambler Z. Mozeček. In: Ambler Z, Bednařík J, Růžička E (eds). Klinická neurologie: část obecná. Praha: Triton 2008 : 143 – 161.
12. Lesný I. Mozečková onemocnění dětského věku. Praha: Avicenum 1976.
13. Willis T. Cerebri Anatome: cui accessit nervorum descriptio et usus. London: Londini 1664.
14. Caligiore D, Pezzulo G, Baldassarre G et al. Consensus Paper: Towards a systems-level view of cerebellar function: the interplay between cerebellum, basal ganglia, and cortex. Cerebellum 2017; 16(1): 203 – 229. doi: 10.1007/ s12311-016-0763-3.
15. MacLeod CE, Zilles K, Schleicher A et al. Expansion of the neocerebellum in Hominoidea. J Hum Evol 2003; 44(4): 401 – 429.
16. Leonard CT. The neuroscience of human movement. St. Louis: Mosby 1998.
17. Hashimoto M, Hibi M. Development and evolution of cerebellar neural circuits. Dev Growth Differ 2012; 54(3): 373 – 389. doi: 10.1111/ j.1440-169X.2012.01348.x.
18. Houk J, Buckingham J, Barto A. Models of the cerebellum and motor learning. Behav Brain Sci 1996; 19(3): 368 – 383.
19. Bodranghien F, Bastian A, Casali C et al. Consensus paper: revisiting the symptoms and signs of cerebellar syndrome. Cerebellum 2016; 15(3): 369 – 391. doi: 10.1007/ s12311-015-0687-3.
20. Mariën P, Manto M. Cerebellum as a master-piece for linguistic predictability. Cerebellum. 2017. In press. doi: 10.1007/ s12311-017-0894-1.
21. Sokolov AA, Miall RC, Ivry RB. The cerebellum: adaptive prediction for movement and cognition. Trends Cogn Sci 2017; 21(5): 313 – 332. doi: 10.1016/ j.tics.2017.02.005.
22. Doya K. What are the computations of the cerebellum, the basal ganglia and the cerebral cortex? Neural Netw 1999; 12(7 – 8): 961 – 974.
23. Ito M. Control of mental activities by internal models in the cerebellum. Nat Rev Neurosci 2008; 9(4): 304 – 313. doi: 10.1038/ nrn2332.
24. Ishikawa T, Tomatsu S, Izawa J et al. The cerebro-cerebellum: could it be loci of forward models? Neuroscience Research 2016; 104 : 72 – 79. doi: 10.1016/ j.neures.2015.12.003.
25. Doya K. Complementary roles of basal ganglia and cerebellum in learning and motor control. Curr Opin Neurobiol 2000; 10(6): 732 – 739.
26. Lesage E, Morgan BE, Olson AC et al. Cerebellar rTMS disrupts predictive language processing. Curr Biol 2012; 22(18): R794 – R795. doi: 10.1016/ j.cub.2012.07.006.
27. Hikosaka O, Isoda M. Switching from automatic to controlled behavior: cortico-basal ganglia mechanisms. Trends Cogn Sci 2010; 14(4): 154 – 161. doi: 10.1016/ j.tics.2010.01.006.
28. Diener HC, Dichgans J. Pathophysiology of cerebellar ataxia. Mov Disord 1992; 7(2): 95 – 109.
29. Bareš M, Lungu OV, Husárová I et al. Predictive motor timing performance dissociates between early diseases of the cerebellum and parkinson’s disease. Cerebellum 2010; 9(1): 124 – 135. doi: 10.1007/ s12311-009-0133-5.
30. Bareš M, Lungu OV, Liu T et al. The neural substrate of predictive motor timing in spinocerebellar ataxia. Cerebellum 2011; 10(2): 233 – 244. doi: 10.1007/ s12311-010-0237-y.
31. Husárová I, Lungu OV, Mareček R et al. Functional imaging of the cerebellum and basal ganglia during predictive motor timing in early Parkinson’s disease. J Neuroimaging 2014; 24(1): 45 – 53. doi: 10.1111/ j.1552-6569.2011.00663.x.
32. Lungu OV, Bares M, Liu T et al. Trial-to-trial adaptation: parsing out the roles of cerebellum and bg in predictive motor timing. J Cogn Neurosci 2016; 28(7): 920 – 934. doi: 10.1162/ jocn_a_00943.
33. Filip P, Lošák J, Kašpárek T et al. Neural network of predictive motor timing in the context of gender differences. Neural Plast 2016; 2016 : 2073454. doi: 10.1155/ 2016/ 2073454.
34. Hallett M, Shahani BT, Young RR. EMG analysis of stereotyped voluntary movements in man. J Neurol Neurosurg Psychiatry 1975; 38(12): 1154 – 1162.
35. Hallett M, Massaquoi SG. Physiologic studies of dysmetria in patients with cerebellar deficits. Can J Neurol Sci 1993; 20 (Suppl 3): S83 – S92.
36. Galea JM, Vazquez A, Pasricha N et al. Dissociating the roles of the cerebellum and motor cortex during adaptive learning: the motor cortex retains what the cerebellum learns. Cereb Cortex 2011; 21(8): 1761 – 1770. doi: 10.1093/ cercor/ bhq246.
37. Gilman S, Bloedel JR, Lenchtenberg R. Disorders of the cerebellum. Contempora: F. A. Davis Co 1981.
38. Jayaram G, Galea JM, Bastian AJ et al. Human locomotor adaptive learning is proportional to depression of cerebellar excitability. Cereb Cortex 2011; 21(8): 1901 – 1909. doi: 10.1093/ cercor/ bhq263.
39. Haith AM, Krakauer JW. Model-based and model-free mechanisms of human motor learning. Adv Exp Med Biol 2013; 782 : 1 – 21. doi: 10.1007/ 978-1-4614-5465-6_1.
40. Houk J, Mugnaini E. Cerebellum. In: Squire L, Bloom F, Roberts J et al (eds). Fundamental neuroscience. San Diego: Academic 2003 : 841 – 872.
41. Fahn S. Principles and practice of movement disorders. 2nd ed. Edinburgh: Elsevier 2011 : 51 – 59.
42. Geborek P, Nilsson E, Bolzoni F et al. A survey of spinal collateral actions of feline ventral spinocerebellar tract neurons. Eur J Neurosci 2013; 37(3): 380 – 392. doi: 10.1111/ ejn.12060.
43. Holmes G. The symptoms of acute cerebellar injuries due to gunshot injuries. Brain 1917; 40(4): 461 – 535.
44. Dow RS, Moruzzi G. The physiology and pathology of the cerebellum. Am J Med Sci 1959; 240(2): 540.
45. Maschke M, Gomez CM, Tuite PJ et al. Dysfunction of the basal ganglia, but not the cerebellum, impairs kinaesthesia. Brain 2003; 126(10): 2312 – 2322.
46. Angel RW. Barognosis in a patient with hemiaraxia. Ann Neurol 1980; 7(1): 73 – 77.
47. Bhanpuri NH, Okamura AM, Bastian AJ. Predictive modeling by the cerebellum improves proprioception. J Neurosci 2013; 33(36): 14301 – 14306. doi: 10.1523/ JNEUROSCI.0784-13.2013.
48. Grill SE, Hallett M, Marcus C et al. Disturbances of kinaesthesia in patients with cerebellar disorders. Brain 1994; 117(6): 1433 – 1447.
49. Schmahmann JD, Sherman JC. The cerebellar cognitive affective syndrome. Brain 1998; 121(4): 561 – 579.
50. Schmahmann JD, Pandya DN. The cerebrocerebellar system. In: Schmahmann JD (ed). The cerebellum and cognition. San Diego: Academic Press 1997 : 31 – 60.
51. Baillieux H, De Smet HJ, Dobbeleir A et al. Cognitive and affective disturbances following focal cerebellar damage in adults: a neuropsychological and SPECT study. Cortex 2010; 46(7): 869 – 879. doi: 10.1016/ j.cortex.2009.09.002.
52. Stoodley CJ, Schmahmann JD. The cerebellum and language: evidence from patients with cerebellar degeneration. Brain Lang 2009; 110(3): 149 – 153. doi: 10.1016/ j.bandl.2009.07.006.
53. Guell X, Hoche F, Schmahmann JD. Metalinguistic deficits in patients with cerebellar dysfunction: empirical support for the dysmetria of thought theory. Cerebellum 2015; 14(1): 50 – 58. doi: 10.1007/ s12311-014-0630-z.
54. Manto M, Mariën P. Schmahmann’s syndrome – identification of the third cornerstone of clinical ataxiology. Cerebellum Ataxias 2015; 2(1): 2. doi: 10.1186/ s40673-015-0023-1.
55. Hoche F, Guell X, Sherman JC et al. Cerebellar contribution to social cognition. Cerebellum 2016; 15(6): 732 – 743.
56. Schmahmann JD. Disorders of the cerebellum: ataxia, dysmetria of thought, and the cerebellar cognitive affective syndrome. J Neuropsychiatry Clin Neurosci 2004; 16(3): 367 – 378.
57. Guell X, Gabrieli JDE, Schmahmann JD. Embodied cognition and the cerebellum: perspectives from the dysmetria of thought and the universal cerebellar transform theories. Cortex 2018; 100 : 140 – 148. doi: 10.1016/ j.cortex.2017.07.005.
58. Koziol LF, Budding D, Andreasen N et al. Consensus paper: the cerebellum’s role in movement and cognition. Cerebellum 2014; 13(1): 151 – 77. doi: 10.1007/ s12311-013-0511-x.
59. Ito M. Synaptic plasticity in the cerebellar cortex and its role in motor learning. Can J Neurol Sci 1993; 20 (Suppl 3): S70 – S74.
60. Ito M. Cerebellar long-term depression: characterization, signal transduction, and functional roles. Physiol Rev 2001; 81(3): 1143 – 1195.
61. Bolceková E, Mojzeš M, Van Tran Q et al. Cognitive impairment in cerebellar lesions: a logit model based on neuropsychological testing. Cerebellum Ataxias 2017; 4(1): 13. doi: 10.1186/ s40673-017-0071-9.
62. Tedesco AM, Chiricozzi FR, Clausi S et al. The cerebellar cognitive profile. Brain 2011; 134(12): 3672 – 3686. doi: 10.1093/ brain/ awr266.
63. Schmahmann JD, Pandya DN. The cerebrocerebellar system. Int Rev Neurobiol 1997; 41 : 31 – 60.
64. Schmahmann JD. From movement to thought: Anatomic substrates of the cerebellar contribution to cognitive processing. Hum Brain Mapp 1996; 4(3): 174 – 198. doi: 10.1002/ (SICI)1097-0193(1996)4 : 3<174::AID-HBM3>3.0.CO;2-0.
65. Goetz M, Schwabova JP, Hlavka Z et al. Dynamic balance in children with attention-deficit hyperactivity disorder and its relationship with cognitive functions and cerebellum. Neuropsychiatr Dis Treat 2017; 13 : 873 – 880. doi: 10.2147/ NDT.S125169.
66. Phillips JR, Hewedi DH, Eissa AM et al. The cerebellum and psychiatric disorders. Front Public Health 2015; 3 : 66. doi: 10.3389/ fpubh.2015.00066.
67. Caligiore D, Pezzulo G, Miall RC et al. The contribution of brain sub-cortical loops in the expression and acquisition of action understanding abilities. Neurosci Biobehav Rev 2013; 37 (10 Pt 2): 2504 – 2515. doi: 10.1016/ j.neubiorev.2013.07.016.
68. Koziol LF, Budding DE, Chidekel D. From movement to thought: executive function, embodied cognition, and the cerebellum. Cerebellum 2012; 11(2): 505 – 525. doi: 10.1007/ s12311-011-0321-y.
69. Popa T, Velayudhan B, Hubsch C et al. Cerebellar processing of sensory inputs primes motor cortex plasticity. Cereb Cortex 2013; 23(2): 305 – 314. doi: 10.1093/ cercor/ bhs016.
70. Hamada M, Galea JM, Di Lazzaro V et al. Two distinct interneuron circuits in human motor cortex are linked to different subsets of physiological and behavioral plasticity. J Neurosci 2014; 34(38): 12837 – 12849. doi: 10.1523/ JNEUROSCI.1960-14.2014.
71. Bostan AC, Dum RP, Strick PL. The basal ganglia communicate with the cerebellum. Proc Natl Acad Sci 2010; 107(18): 8452 – 8456. doi: 10.1073/ pnas.1000496 107.
72. Filip P, Gallea C, Lehéricy S et al. Disruption in cerebellar and basal ganglia networks during a visuospatial task in cervical dystonia. Mov Disord 2017; 32(5): 757 – 768. doi: 10.1002/ mds.26930.
73. Burciu RG, Hess CW, Coombes SA et al. Functional activity of the sensorimotor cortex and cerebellum relates to cervical dystonia symptoms. Hum Brain Mapp 2017; 38(9): 4563 – 4573. doi: 10.1002/ hbm.23684.
74. Wu T, Hallett M. The cerebellum in Parkinson’s disease. Brain 2013; 136(Pt 3): 696 – 709. doi: 10.1093/ brain/ aws 360.
75. Fukutani Y, Cairns NJ, Rossor MN et al. Purkinje cell loss and astrocytosis in the cerebellum in familial and sporadic Alzheimers disease. Neurosci Lett 1996; 214(1): 33 – 36.
76. Ambler Z. Neurologie pro studenty lékařské fakulty. 5. vyd. Praha: Karolinum 2004.
77. Vítek J. Obecná neurologická diagnostika. 3. vyd. Praha: Státní zdravotnické nakladatelství 1955.
78. Trouillas P, Takayanagi T, Hallett M et al. International Cooperative Ataxia Rating Scale for pharmacological assessment of the cerebellar syndrome. J Neurol Sci 1997; 145(2): 205 – 211.
79. Schmitz-Hübsch T, du Montcel ST, Baliko L et al. Scale for the assessment and rating of ataxia: development of a new clinical scale. Neurology 2006; 66(11): 1717 – 1720.
80. Schmahmann JD, Gardner R, MacMore J et al. Development of a brief ataxia rating scale (BARS) based on a modified form of the ICARS. Mov Disord 2009; 24(12): 1820 – 1828. doi: 10.1002/ mds.22681.
81. Bürk K. Clinical scales of cerebellar ataxias. In: Manto M, Schmahmann J, Rossi F et al (eds). Handbook of the cerebellum and cerebellar disorders. Dordrecht: Springer 2013 : 1785 – 1798.
82. Bhanpuri NH, Okamura AM, Bastian AJ. Predicting and correcting ataxia using a model of cerebellar function. Brain 2014; 137(7): 1931 – 1944. doi: 10.1093/ brain/ awu115.
83. Marek M, Paus S, Allert N et al. Ataxia and tremor due to lesions involving cerebellar projection pathways: a DTI tractographic study in six patients. J Neurol 2015; 262(1): 54 – 58. doi: 10.1007/ s00415-014-7503-8.
84. Grimaldi G. Cerebellar motor disorders. In: Manto M, Schmahmann J, Rossi F et al (eds). Handbook of the cerebellum and cerebellar disorders. Dordrecht: Springer 2013.
85. Brunamonti E, Chiricozzi FR, Clausi S et al. Cerebellar damage impairs executive control and monitoring of movement generation. PLoS One 2014; 9(1): e85997. doi: 10.1371/ journal.pone.0085997.
86. Bastian AJ, Martin TA, Keating JG et al. Cerebellar ataxia: abnormal control of interaction torques across multiple joints. J Neurophysiol 1996; 76(1): 492 – 509.
87. Babinski J. Sur le role du cervelet dans les actes volitionnels nécessitant une succession rapide de mouvements (1) (diadococinésie). Rev Neurol (Paris) 1902; 10 : 1013 – 1015.
88. Campbell. DeJong’s The neurologic examination. 6th ed. Philadelphia: Lippincott Williams & Wilkins 2005.
89. Spidalieri G, Busby L, Lamarre Y. Fast ballistic arm movements triggered by visual, auditory, and somesthetic stimuli in the monkey. II. Effects of unilateral dentate lesion on discharge of precentral cortical neurons and reaction time. J Neurophysiol 1983; 50(6): 1359 – 1379.
90. Ziegler W, Wessel K. Speech timing in ataxic disorders: sentence production and rapid repetitive articulation. Neurology 1996; 47(1): 208 – 214.
91. Holmes G. The cerebellum of man. Brain 1939; 62(1): 1 – 30.
92. Samii A, Wassermann EM, Hallett M. Decreased postexercise facilitation of motor evoked potentials in patients with cerebellar degeneration. Neurology 1997; 49(2): 538 – 542.
93. Koeppen AH. The pathogenesis of spinocerebellar ataxia. Cerebellum 2005; 4(1): 62 – 73.
94. Manto MU. Cerebellar disorders: a practical approach to diagnosis and management. Cambridge: Cambridge University Press 2010.
95. Růžička E, Marusič P. Základní neurologické vyšetření – nastal čas pro změny? Cesk Slov Neurol N 2017; 80/ 113(1): 84 – 91. doi: 10.14735/ amcsnn201784.
96. Holmes G. The Croonian lectures on the clinical symptoms of cerebellar disease and their interpretation. Lecture III. Lancet 1922; 200 : 59 – 65.
97. Deuschl G, Raethjen J, Lindemann M et al. The pathophysiology of tremor. Muscle Nerve 2001; 24(6): 716 – 735.
98. Flament D, Hore J. Comparison of cerebellar intention tremor under isotonic and isometric conditions. Brain Res 1988; 439(1 – 2): 179 – 186.
99. Grimaldi G, Manto M. Is essential tremor a purkinjopathy? The role of the cerebellar cortex in its pathogenesis. Mov Disord 2013; 28(13): 1759 – 1761. doi: 10.1002/ mds.25645.
100. Filip P, Lungu OV, Manto MU et al. Linking essential tremor to the cerebellum: physiological evidence. Cerebellum 2016; 15(6): 774 – 780.
101. Manto M, Bower JM, Conforto AB et al. Consensus paper: roles of the cerebellum in motor control-the diversity of ideas on cerebellar involvement in movement. Cerebellum 2012; 11(2): 457 – 487. doi: 10.1007/ s12311-011-0331-9.
102. Leigh RJ, Zee DS. The neurology of eye movements. 5th ed. Oxford: University Press 2015.
103. Kremmyda O, Zwergal A, la Fougère C et al. 4-Aminopyridine suppresses positional nystagmus caused by cerebellar vermis lesion. J Neurol 2013; 260(1): 321 – 323. doi: 10.1007/ s00415-012-6737-6.
104. Wagner JN, Glaser M, Brandt T et al. Downbeat nystagmus: aetiology and comorbidity in 117 patients. J Neurol Neurosurg Psychiatry 2008; 79(6): 672 – 677.
105. Zee DS. Mechanisms of nystagmus. Am J Otol 1985; Suppl: 30 – 34.
106. Selhorst JB, Stark L, Ochs AL et al. Disorders in cerebellar ocular motor control: I. Saccadic overshoot dysmetria an oculographic, control system and clinico-anatomical analysis. Brain 1976; 99(3): 497 – 508.
107. Brandauer B, Hermsdörfer J, Beck A et al. Impairments of prehension kinematics and grasping forces in patients with cerebellar degeneration and the relationship to cerebellar atrophy. Clin Neurophysiol 2008; 119(11): 2528 – 2537. doi: 10.1016/ j.clinph.2008.07.280.
108. Nowak D, Timmann D, Hermsdörfer J. Deficits of grasping in cerebellar disorders. In: Manto M, Schmahmann J, Rossi F et al (eds). Handbook of the cerebellum and cerebellar disorders. Dordrecht: Springer 2013 : 1657 – 1667.
109. Darley F, Aronson A, Brown J. Motor speech disorders. Philadelphia: Saunders 1975.
110. Adamaszek M, Strecker K, Kessler C. Impact of cerebellar lesion on syntactic processing evidenced by event-related potentials. Neurosci Lett 2012; 512(2): 78 – 82. doi: 10.1016/ j.neulet.2012.01.020.
111. Moretti R, Bava A, Torre P et al. Reading errors in patients with cerebellar vermis lesions. J Neurol 2002; 249(4): 461 – 468.
112. Moretti R, Torre P, Antonello RM et al. Peculiar aspects of reading and writing performances in patients with olivopontocerebellar atrophy. Percept Mot Skills 2002; 94(2): 677 – 694.
113. Mariën P, Baillieux H, de Smet HJ et al. Cognitive, linguistic and affective disturbances following a right superior cerebellar artery infarction: a case study. Cortex 2009; 45(4): 527 – 536. doi: 10.1016/ j.cortex.2007.
114. Foix C, Thévenard A. Les réflexes de posture. Rev Neurol (Paris) 1923; 30 : 449 – 468.
115. Ropper AH, Brown RH. Disorders of stance and gait. Adams and Victor‘s principles of neurology. 8th ed. New York: McGraw-Hill 2005 : 111 – 121.
116. Kim JS, Lee H. Vertigo due to posterior circulation stroke. Semin Neurol 2013; 33(3): 179 – 184. doi: 10.1055/ s-0033-1354600.
117. Morton SM, Bastian AJ. Cerebellar control of balance and locomotion. Neuroscientist 2004; 10(3): 247 – 259.
118. Timmann D, Horak F. Perturbed step initiation in cerebellar subjects 1. Modifications of postural responses. Exp Brain Res 1998; 119(1): 73 – 84.
119. Serrao M, Conte C, Casali C et al. Sudden stopping in patients with cerebellar ataxia. Cerebellum 2013; 12(5): 607 – 616. doi: 10.1007/ s12311-013-0467-x.
120. Palliyath S, Hallett M, Thomas SL et al . Gait in patients with cerebellar ataxia. Mov Disord 1998; 13(6): 958 – 964.
121. Serrao M, Pierelli F, Ranavolo A et al. Gait pattern in inherited cerebellar ataxias. Cerebellum 2012; 11(1): 194 – 211. doi: 10.1007/ s12311-011-0296-8.
122. Van de Warrenburg BP, Bakker M, Kremer BP et al. Trunk sway in patients with spinocerebellar ataxia. Mov Disord 2005; 20(8): 1006 – 1013. doi: 10.1002/ mds.20486.
123. Van de Warrenburg BP, Steijns JA, Munneke M et al. Falls in degenerative cerebellar ataxias. Mov Disord 2005; 20(4): 497 – 500. doi: 10.1002/ mds.20375.
124. Ilg W, Golla H, Thier P et al. Specific influences of cerebellar dysfunctions on gait. Brain 2007; 130(3): 786 – 798. doi: 10.1093/ brain/ awl376.
125. Morton SM, Bastian AJ. Mechanisms of cerebellar gait ataxia. Cerebellum 2007; 6(1): 79 – 86. doi: 10.1080/ 14734220601187741.
126. Hausdorff JM. Stride variability: beyond length and frequency. Gait Posture 2004; 20(3): 304. doi: 10.1016/ j.gaitpost.2003.08.002.
127. Bortoff GA, Strick PL. Corticospinal terminations in two new-world primates: further evidence that corticomotoneuronal connections provide part of the neural substrate for manual dexterity. J Neurosci 1993; 13(12): 5105 – 5118.
128. Santello M, Baud-Bovy G, Jörntell H. Neural bases of hand synergies. Front Comput Neurosci 2013; 7 : 23. doi: 10.3389/ fncom.2013.00023.
129. Alstermark B, Isa T. Circuits for skilled reaching and grasping. Annu Rev Neurosci 2012; 35(1): 559 – 578. doi: 10.1146/ annurev-neuro-062111-150527.
130. Jeřábek J. Diagnostika pacienta s akutní závratí. Cesk Slov Neurol N 2015; 78/ 111(5): 503 – 509. doi: 10.14735/ amcsnn2015503.
131. Strupp M, Kim JS, Murofushi T et al. Bilateral vestibulopathy: diagnostic criteria consensus document of the classification committee of the Bárány Society. J Vestib Res 2017; 27(4): 177 – 189. doi: 10.3233/ VES-170 619.
132. Halmagyi GM, Curthoys IS, Halmagyi G et al. A clinical sign of canal paresis. Arch Neurol 1988; 45(7): 737 – 739.
133. Choi JY, Lee SH, Kim JS. Central vertigo. Curr Opin Neurol 2018; 31(1): 81 – 89. doi: 10.1097/ WCO.0000000000000 511.
134. Edwards MJ, Bhatia KP. Functional (psychogenic) movement disorders: merging mind and brain. Lancet Neurol 2012; 11(3): 250 – 260. doi: 10.1016/ S1474-4422(11)70310-6.
135. Serranová T, Růžička E, Roth J. Funkční poruchy hybnosti. Cesk Slov Neurol N 2014; 77/ 110(3): 270 – 286.
136. Album D, Westin S. Do diseases have a prestige hierarchy? A survey among physicians and medical students. Soc Sci Med 2008; 66(1): 182 – 188. doi: 10.1016/ j.socscimed.2007.07.003.
137. Bruns L. Über Störungen des Gleichgewichts bei Stirnhirntumoren. Dtsch Med Wschr. 1892; 18 : 138 – 140.
138. Liston R, Mickelborough J, Bene J et al. A new classification of higher level gait disorders in patients with cerebral multi-infarct states. Age Ageing 2003; 32(3): 252 – 258.
139. Atchison PR, Thompson PD, Frackowiak RSJ et al. The syndrome of gait ignition failure: a report of six cases. Mov Disord 1993; 8(3): 285 – 292. doi: 10.1002/ mds.870080 306.
140. Környey S. Beiträge zur Entwicklungsmechanik und Pathologie des foetalen Zentralnervensystems. Arch Psychiatr 1925; 72 : 755 – 787.
141. Diamond A. Close interrelation of motor development and cognitive development and of the cerebellum and prefrontal cortex. Child Dev 2000; 71(1): 44 – 56.
142. Newman-Toker DE, Kerber KA, Hsieh YH et al. HINTS outperforms ABCD2 to screen for stroke in acute continuous vertigo and dizziness. Acad Emerg Med 2013; 20(10): 986 – 996. doi: 10.1111/ acem.12223.
143. Ramirez-Zamora A, Zeigler W, Desai N et al. Treatable causes of cerebellar ataxia. Mov Disord 2015; 30(5): 614 – 623. doi: 10.1002/ mds.26158.
144. Fogel BL, Perlman S. An approach to the patient with late-onset cerebellar ataxia. Nat Clin Pract Neurol 2006; 2(11): 629 – 635. doi: 10.1038/ ncpneuro0319.
145. Abele M, Bürk K, Schöls L et al. The aetiology of sporadic adult-onset ataxia. Brain 2002; 125(5): 961 – 968.
146. Fahn S, Jankovic J, Hallet M, eds. Ataxia pathophysiology and clinical syndrome. Principles and practice of movement disorders. 2nd ed. Edinburgh: Elsevier 2011 : 541 – 551.
147. Pandolfo M, Manto M. Cerebellar and afferent ataxias. Continuum 2013; 19 (5 Movement Disorders): 1312 – 1343. doi: 10.1212/ 01.CON.0000436158.39285.22.
148. Mitoma H, Adhikari K, Aeschlimann D et al. Consensus Paper: neuroimmune mechanisms of cerebellar ataxias. Cerebellum 2016; 15(2): 213 – 232. doi: 10.1007/ s12311-015-0664-x.
149. Ilg W, Bastian AJ, Boesch S et al. Consensus paper: management of degenerative cerebellar disorders. Cerebellum 2014; 13(2): 248 – 268. doi: 10.1007/ s12311-013-0531-6.
150. Zumrová A, Kopečková M, Mušová Z et al. Autosomálně dominantní spinocerebelární ataxie. Neurol praxi 2007; 8(5): 277 – 282.
151. Hadjivassiliou M, Rao DG, Wharton SB et al. Sensory ganglionopathy due to gluten sensitivity. Neurology 2010; 75(11): 1003 – 1008. doi: 10.1212/ WNL.0b013e3181f25ee0.
152. Honnorat J, Saiz A, Giometto B et al. Cerebellar ataxia with anti-glutamic acid decarboxylase antibodies: study of 14 patients. Arch Neurol 2001; 58(2): 225 – 230.
153. Mahta A, Vijayvergia N, Bhavsar T et al. Diagnostic approach to a patient with paraneoplastic neurological syndrome. World J Oncol 2012; 3(5): 243 – 246. doi: 10.4021/ wjon571w.
154. Nakagawa H, Yoneda M, Fujii A et al. Hashimoto’s encephalopathy presenting with progressive cerebellar ataxia. J Neurol Neurosurg Psychiatry 2007; 78(2): 196 – 197. doi: 10.1136/ jnnp.2006.093005.
155. Laukka JJ, Kamholz J, Bessert D et al. Novel pathologic findings in patients with Pelizaeus-Merzbacher disease. Neurosci Lett 2016; 627 : 222 – 232. doi: 10.1016/ j.neulet.2016.05.028.
156. Azmanov DN, Kowalczuk S, Rodgers H et al. Further evidence for allelic heterogeneity in Hartnup disorder. Hum Mutat 2008; 29(10): 1217 – 1221. doi: 10.1002/ humu.20777.
157. Morton DH, Strauss KA, Robinson DL et al. Diagnosis and treatment of maple syrup disease: a study of 36 patients. Pediatrics 2002; 109(6): 999 – 1008.
158. Gorman MP. Update on diagnosis, treatment, and prognosis in opsoclonus – myoclonus – ataxia syndrome. Curr Opin Pediatr 2010; 22(6): 745 – 750. doi: 10.1097/ MOP.0b013e32833fde3f.
159. Distefano G, Praticò AD. Actualities on molecular pathogenesis and repairing processes of cerebral damage in perinatal hypoxic-ischemic encephalopathy. Ital J Pediatr 2010; 36 : 63. doi: 10.1186/ 1824-7288-36-63.
160. Rothblum-Oviatt C, Wright J, Lefton-Greif MA et al. Ataxia telangiectasia: a review. Orphanet J Rare Dis 2016; 11(1): 159. doi: 10.1186/ s13023-016-0543-7.
161. Pavone P, Praticò AD, Pavone V et al. Ataxia in children: early recognition and clinical evaluation. Ital J Pediatr 2017; 43(1): 6. doi: 10.1186/ s13052-016-0325-9.
162. Ljunggren M, Persson J, Salzer J. Dizziness and the acute vestibular syndrome at the emergency department: a population-based descriptive study. Eur Neurol 2017; 79(1 – 2): 5 – 12. doi: 10.1159/ 000481982.
163. Lefaucheur J-P. [Painful neuropathies and small fiber involvement]. Rev Neurol (Paris) 2014; 170(12): 825 – 836. doi: 10.1016/ j.neurol.2014.10.008.
164. Tavee JO. Immune Axonal Polyneuropathy. Continuum 2017; 23 (5, Pheripheral Nerve and Motor Neuron Disorders): 1394 – 1410. doi: 10.1212/ CON.0000000000000523.
165. Iżycki D, Niezgoda AA, Kaźmierczak M et al. Chemotherapy-induced peripheral neuropathy – diagnosis, evolution and treatment. Ginekol Pol 2016; 87(7): 516 – 521. doi: 10.5603/ GP.2016.0036.
166. Pavone P, Praticò AD, Ruggieri M et al. Acquired peripheral neuropathy: a report on 20 children. Int J Immunopathol Pharmacol 2012; 25(2): 513 – 517. doi: 10.1177/ 039463201202500222.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2018 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Naděje budí časná diagnostika Parkinsonovy choroby založená na pachu kůže
-
Všetky články tohto čísla
- Editorial
- Ataxie
- Dopis redakci časopisu Česká a slovenská neurologie a neurochirurgie
- Dopis redakci časopisu Česká a slovenská neurologie a neurochirurgie
- Komentář autorů
- Komentář redakce
- Antikoagulačná liečba u pacientov s fibriláciou predsiení a cerebrálnou amyloidovou angiopatiou
- Antikoagulačná liečba u pacientov s fibriláciou predsiení a cerebrálnou amyloidovou angiopatiou
- Antikoagulační léčba u pacientů s fibrilací síní a cerebrální amyloidovou angiopatií
- Fabryho choroba, přehled problematiky a nejčastější neurologické projevy
- Je amyloid podstatný pro senilní demenci?
- Syndrom GLUT-1 deficience – expandující klinické spektrum léčitelného onemocnění
- Syndrom karpálního tunelu v kontextu funkčních poruch pohybového systému
- Identifikace dětských pacientů s farmakorezistentní epilepsií a výběr kandidátů nefarmakologické terapie
- Lehké řetězce neurofilament v séru a mozkomíšním moku a stav hematolikvorové bariéry u vybraných neurologických onemocnění
- Fyzioterapie u Parkinsonovy nemoci v České republice – demografická studie
- Hladiny anti-Mülleriánského hormonu v séru při roztroušené skleróze – multicentrická případová kontrolní studie
- Follow-up pacientů s idiopatickou poruchou chování v REM spánku – fenokonverze do parkinsonského syndromu a demence
- Pilotní studie Edinburské kognitivně-behaviorální zkoušky pro amyotrofickou laterální sklerózu na české populaci
- Akutní myelitida u dětí – soubor 20 pacientů
- Invazivní primarně intracerebrální infekce u žen způsobené Streptococcus intermedius a manifestující se jako purulentní meningitida a intracerebrální absces
- Nádor z granulárních buněk stopky hypofýzy
- Maligní melanotický schwannom obratlového těla u pacienta s Carneyho komplexem
- Biopsie mozku v deseti bodech – co může neurolog očekávat od neurochirurga a neuropatologa?
-
Analýza dat v neurologii LXVIII.
Úvod do korelační analýzy - Účast českého neurochirurga při umírání Stalina a Gottwalda
- Recenze knih
- Prof. MUDr. Pavel Haninec, CSc. slaví 60 let
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Ataxie
- Biopsie mozku v deseti bodech – co může neurolog očekávat od neurochirurga a neuropatologa?
- Fabryho choroba, přehled problematiky a nejčastější neurologické projevy
- Prof. MUDr. Pavel Haninec, CSc. slaví 60 let
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




