Hand‑ foot syndrom po podání inhibitorů tyrozinkinázové aktivity
Hand‑ Foot Syndrome after Administration of Tyrosinkinase Inhibitors
At present, the dermal toxicity of anti‑cancer drugs is ever more apparent in cancer patients. This phenomenon appears, in particular, in relation to the increased administration of targeted anti‑cancer treatment, especially of monoclonal antibodies and tyrosinkinase inhibitors (TKI), towards various receptors of growth factors which are applied in the ethiopathogenesis of a tumour cell. Our article focuses on the palmoplantar erythrodysesthesia syndrome, designated also as the hand‑ foot skin reaction (HFSR), which most frequently occurs in patients treated with TKI sorafenib and sunitinib. Developed HFSR may be a strongly perceived adverse effect for patients and may lead to dose intensity reduction in the targeted treatment, or to its interruption if necessary. However, a correct approach from the oncologist and dermatologist, including instructions to be provided to the patient on how to prevent a serious grade of HFSR from being developed, may ensure a smooth anti‑cancer treatment and a satisfactory quality of life for cancer patients.
Key words:
targeted therapy – tyrosinkinase inhibitor – sorafenib – sunitinib – skin – toxicity – hand- foot syndrome
Autoři:
D. Bednaříková 1; I. Kocák 2
Působiště autorů:
Privátní kožní ambulance, Brno
1; Klinika komplexní onkologické péče, Masarykův onkologický ústav a LF MU, Brno
2
Vyšlo v časopise:
Klin Onkol 2010; 23(5): 300-305
Kategorie:
Přehledy
Souhrn
V současné době se u onkologických pacientů stále častěji setkáváme s kožní toxicitou protinádorových léčiv. K tomuto jevu dochází zejména v souvislosti s nárůstem podávání cílené protinádorové léčby, a to především monoklonálních protilátek a inhibitorů tyrozinkinázové aktivity (TKI) vůči různým receptorům růstových faktorů, které se uplatňují v etiopatogenezi nádorové buňky. Náš článek je zaměřen na syndrom palmoplantární dysestezie, označovaný rovněž jako syndrom dlaní a chodidel (hand‑ foot skin reaction – HFSR), k jehož vzniku dochází nejčastěji u pacientů léčených TKI sorafenibem a sunitinibem. Rozvinutý HFSR může být pro pacienty výrazně vnímaným nežádoucím účinkem a může vést k ohrožení dávkové intenzity cílené léčby, případně až k ukončení jejího podávání. Přitom správný přístup ze strany onkologa a dermatologa, včetně poučení pacienta, jak lze rozvinutí těžkého stupně HFSR předcházet, může zabezpečit plynulou protinádorovou léčbu a uspokojivou kvalitu života onkologických pacientů.
Klíčová slova:
cílená léčba – inhibitory tyrozinkinázové aktivity – sorafenib – sunitinib – kůže – toxicita – hand- foot syndrom
Úvod
Kožní toxicity po použití cílené protinádorové léčby, zvláště pak inhibitorů tyrozinkinázové aktivity, jsou poměrně častým jevem a je pro ně charakteristické široké spektrum často zaměnitelných projevů a přístupů k jejich zvládání. Jde o projevy zpravidla neobvyklé, se kterými se dermatologie doposud nesetkala. Cílem tohoto článku je vnést podrobný pohled na jednu z častých kožních toxicit cílené léčby tzv. hand foot syndromu (syndrom palmoplantární erytrodysestézie, hand foot syndrom, hand foot skin reaction – HFSR).
Syndrom HFSR byl poprvé popsán v roce1974 v souvislosti s podáváním protiná-dorového léčiva mitotanu (1- chloro 2- [2,2- dichloro 1- (4- chlorophenyl)- ethyl]- benzene), derivátu DDT [1]. HFSR je charakterizován bolestivými erytomatózními lézemi, které postihují především akrální části končetin, nejvíce pak dlaně a chodidla. S ohledem na publikovaná data se zdá, že častěji bývají postižena chodidla [2]. Ačkoli HFSR není život ohrožující nežádoucí účinek (NÚ), závažným způsobem ovlivňuje kvalitu života, a vede tak ke snižovaní dávek, přerušování až ukončení terapie, což již může negativním způsobem ovlivnit život prodlužující účinky jakékoli protinádorové léčby.
Klinická manifestace HFSR
Běžně HFSR zahrnuje následující symptomy:
- znecitlivění, palčivá bolest nebo pocit „mravenčení“
- zvýšená citlivost kůže
- bolest při doteku horkých předmětů
- pocit pálení
- zarudnutí
- otok
- tvorba tvrdé kůže nebo otlaků v tlakových bodech jako paty nebo vypoukliny na chodidlech
- tvorba puchýřů
- suchá, popřípadě popraskaná pokožka
- odlupování, případně šupinatění pokožky
Prozatím je stále nejisté, zda se jedná o jednu entitu onemocnění, nebo zda je tato porucha složena z kombinace více onemocnění na podkladě různých etiologií [3]. Léze se objevují zpravidla v tlakových bodech a místech vystavených mechanickému dráždění [4,5].
Výskyt a kritéria k hodnocení HFSR
HFSR je jedním z nejčastějších nežádoucích účinků po podání tyrozinkinázových inhibitorů (TKI) sorafenibu a sunitinibu. Jeho výskyt u pokročilého renálního karcinomu (mRCC) dosahuje až 62 % (medián výskytu u všech malignit 33,8 %) u sorafenibu a 18,9 % po podání sunitinibu [6– 8]. Relativní riziko rozvoje HFSR je 6,6 pro sorafenib a 9,9 pro sunitinib.
Výskyt HFSR je též zaznamenán často po podání antracyklinových antineoplastik (doxorubicin), pyrimidinových derivátů (cytarabin, deriváty 5- FU – kapecitabin). Méně často byl HSFR reportován při užívání paklitaxelu, hydroxyurey, metotrexátu, 6 merkaptopurinu, cyklofosfamidu, cisplatiny, etoposidu, vinorelbinu, irinotekanu a epirubicinu [9].
Klinickou závažnost popisujeme třemi stupni dle NCI CTCAE v 4.0 (National Cancer Institute, Common Terminology Criteria for Adverse Events) (obr. 1) [10]:
- minimální kožní změny nebo dermatitida (např. erytém, edém nebo hyperkeratóza) bez bolesti
- bolestivé kožní změny (např. olupování pokožky, puchýře, krvácení nebo hyperkeratóza), mírně limitující obvyklé denní činnosti
- bolestivé závažné kožní změny (např. olupování pokožky, puchýře, krvácení nebo hyperkeratóza), výrazně limitující základní sebeobsluhu
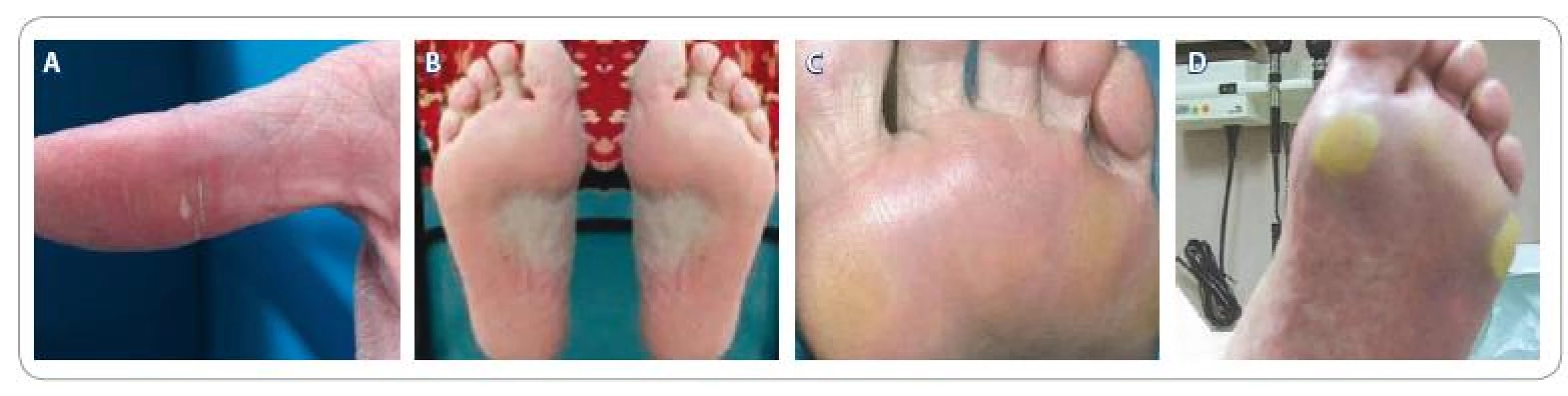
Při terapii sorafenibem dochází k výskytu HFSR obvykle v průběhu prvních týdnů, zatímco v případě sunitinibu se tento nežádoucí účinek objevuje i po několika měsících léčby [11]. Medián do objevení prvních příznaků HFSR je zaznamenán pro sorafenib v délce 18,4 dnů (rozpětí 3– 56 dní) po zahájení terapie, pro sunitinib pak 32,4 dní (rozpětí 5– 82 dní). Po vysazení léčby HFSR v průběhu 1– 2 týdnů obvykle odeznívá [12].
Na rozdíl od HFSR způsobeného chemoterapií většinou nebyly zaznamenány u TKI žádné léze na dorzálních částech rukou a nohou nebo intertriginózních oblastech. Klinická prezentace HFSR po podání TKI zahrnuje počáteční dysestezii a erytém, obzvláště následkem mechanického nebo termického dráždění. Poté následuje obvykle zhoršení ostře ohraničeného erytému, který se stává bolestivý. Ztluštění (mozolnatění) erytematózních oblastí probíhá v dalším kroku (tento jev bývá často pojmenován jako „palmoplantární epidermální hyperplazie“) [13].
V ztluštělých zatvrdlých vrstvách pokožky se mohou objevit puchýře s napjatou krytbou. Klinický stav HFSR se může významně zhoršovat řádově v průběhu dní. Histologicky můžeme pozorovat poškození keratinocytů v epidermis a dilatované cévy v dermis a mírný až středně rozvinutým perivaskulárním lymfoplazmocytárním infiltrátem, ojediněle potom ekrinní skvamózní mataplazii. Lze též zaznamenat zvýšenou epidermální buněčnou proliferaci s akantózou, papilomatózu, hyperkeratózu a parakeratózu [4,5, 13].
Etiologie HFSR
Mechanizmus rozvoje HFSR indukovaného TKI není ještě definitivně prokázán. Jednou z příčin se zdá vlastní PDGFR a VEGFR inhibice, kdy jsou narušeny vaskulární reparační mechanizmy, a častá mikrotraumata cév na mechanicky více zatěžovaných dlaních a chodidlech tak tuto teorii podporují. Byl zaznamenán případ, kdy u pacienta s amputovanou dolní končetinou došlo při pravidelném používaní protézy k rozvoji HFSR na pahýlu [14]. K výskytu HFSR ovšem dochází i na tlaku a mechanickému dráždění nevystavovaných místech, a tak se oprávněně můžeme domnívat, že patogeneze HSFR je multifaktoriální [15].
Je pravděpodobné, že pro indukci HFSR je nutné kombinované ovlivnění PDGRF a VEGFR, neboť po podání léčiv s cílenou inhibicí pouze jedné z těchto drah (jako např. PDGFR inhibitor – imatinib nebo VEGF protilátka – bevacizumab) k tomuto NÚ nedochází [15].
Vyšší výskyt HFSR po administraci sorafenibu může doplňovat též poškození keratinocytů v důsledku inhibice c kit a RAF kinázy, která je právě pro sorafenib charakteristická [16].
Podání sorafenibu modifikuje expresi cytokeratinu (CK) a zdá se, že sorafenib ovlivňuje diferenciaci keratinocytů [17].
Rizikové faktory HFSR
Zvyšující se dávka sorafenibu zvyšuje pravděpodobnost výskytu HFSR i jeho závažnost [18] při dávkování < 300 mg 2krát denně byl výskyt HFSR 4,7 % (stupeň 3 – 0 %), 300– 400 mg 2krát denně pak 31,7 % (stupeň 3 – 7,7%) a při dávce 600– 800 mg 2krát denně dokonce 53,8 % (stupeň 3 – 25 %) [19]. Přidání bevacizumabu do léčebného režimu k sorafenibu též eskalovalo přítomnost HFSR [20].
Metaanalýza provedená na 4 883 pacientech prokázala po sorafenibu vyšší výskyt HFSR u mRCC ve srovnání s ostatními malignitami (relativní riziko 1,52, 95% CI: 1,32– 1,75, p < 0,001) [6].
Dle recentního reportu nebyla nalezena jakákoli spojitost s exkrecí sorafenibu potem a výskytem/ závažností HFSR (sorafenib se do potu pravděpodobně vůbec nevylučuje) [21].
Nezávislými rizikovými faktory jsou též vyšší věk, ženské pohlaví, performance status, ozařování, etnicita (častější výskyt u Asijců) [22–26].
Přítomnost specifického VEGFR genotypu (VEGFR2 alela H472Q) zvyšuje riziko HFSR (OR = 2,7, 95% CI: 1,3– 5,6, p = 0,0136) [27].
HFSR a odpověď na léčbu
Je vysoce pravděpodobné, že HFSR je nezávislým prediktorem úspěchu léčby. Pacienti léčení sorafenibem, kteří zároveň měli HFSR, zaznamenali dvojnásobný PFS ve srovnání s pacienty bez tohoto nežádoucího účinku (PFS 6,1 vs 3,7 měsíce, n = 113, p = 0,0003) [27]. Další data „dvojnásobného účinku“ tuto hypotézu jen potvrzují: TTP (doba do progrese) byl u nemocných léčených sorafenibem pro HCC (hepatocelulární karcinom) signifikantně delší, pokud byla opět současně přítomná časná kožní toxicita (8,1 vs 4,0 měsíce, p = 0,006) [28].
Terapie HFSR
Prozatím nebyla provedena žádná randomizovaná studie prevence nebo terapie HFSR po použití TKI, musíme se proto zatím opírat o data ze sérií případů či jednotlivé kazuistiky a osobní zkušenosti [11].
S opatřeními pro zvládání HFSR lze započít již preventivně před jeho objevením. Existuje několik opatření, kterými lze závažnost HFSR předcházet nebo snížit.
- Otlaky: Jakmile je zahájena cílená léčba, je doporučeno odstranit veškeré již existující otlaky, resp. hyperkeratotické oblasti na rukou nebo nohou.
- Tlakové body: Jde o body nebo exponovaná místa na rukou či nohou. Při práci např. s nářadím nebo noži apod., které mohou pokožku rukou rozdírat nebo poškozovat, se doporučuje používat měkké rukavice. K ochraně odřených nebo otlačených míst na nohou je vhodné nosit měkkou obuv, bavlněné ponožky, popřípadě používat vnitřní výstelky.
- Krémy: Je vhodné aplikovat zvlhčující krémy, případně exfoliační přípravky (Excipial U Lipolotio, Excipial U Hydrolotio, Dexeryl krém, Kerasal ung.)
Bylo též s úspěchem sledováno profylaktivní podávání pyridoxinu (vitamin B6), ovšem pouze u HFSR indikovaného léčbou kapecitabinem [29–31].
Zároveň je doporučeno vyhýbat se styku s horkou vodou a pobytu v prostředí se zvýšenou teplotou (např. saunování). Je vhodné též zamezit vystavování pokožky přímému slunečnímu záření. V současné době probíhá extenzivní výzkum možností prevence HFSR u pacientů léčených sorafenibem [32].
Terapie HFSR po jeho vzniku zahrnuje symptomatickou léčbu a úpravu dávkování cílené léčby (tab. 1, 2).
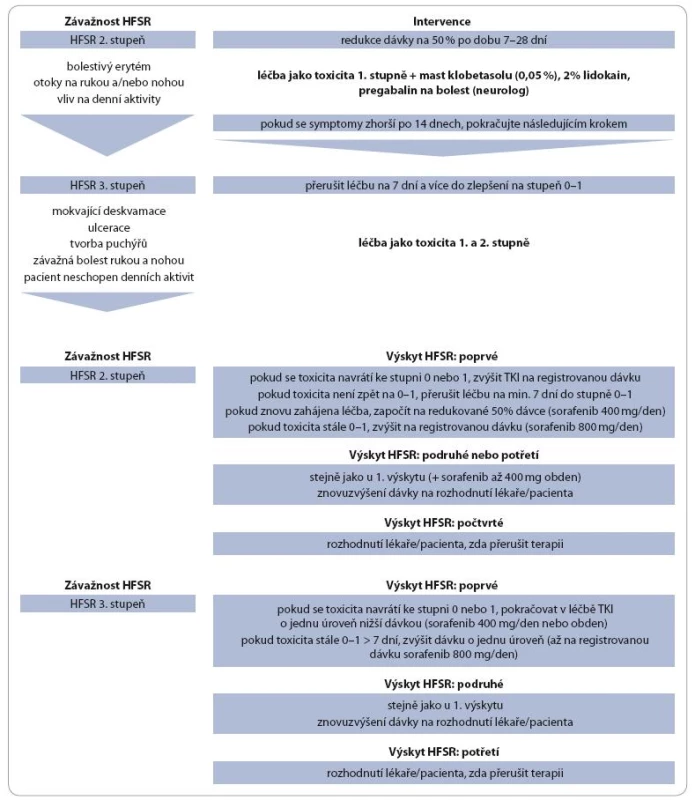
![Sumarizace redukce dávky sorafenibu v návaznosti na výskyt kožních reakcí dle Lacouture 2008 [11].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/c171287acceb7fd07e557b0b93d87d4e.jpeg)
Preventivně před vznikem HFSR doporučujeme pravidelné ošetřování kůže dlaní a nohou hydratačními krémy (Excipial krém, Excipial mastný krém) a emulzemi s obsahem glycerolu (např. Dexeryl krém) a urey (Excipial U Lipolotio).
Při vzniku ložiskových hyperkeratóza lamelárního olupování doporučujeme k dosavadní terapii přidat externa keratolytická (např. Kerasal ung. nebo magistraliter vyrobené masti s obsahem urey 10– 20 %).
Při vzniku ragád, puchýřů a erodovaných ploch pod ložiskovými hyperkeratózami doporučujeme epitelizační prostředky (Calcium pantothenicum ung., Infadolan ung.) v kombinaci s prostředky dezinfekčními (např. Cyteal sol., Dermacyn sol., Fucidin ung.) a silnými topickými kortikoidy (např. Elocom ung., Advantan mastný krém).
Ošetřování postižené kůže se provádí 2krát denně (ráno a večer po provedení osobní hygieny).
Závěr
Hlavním cílem protinádorové léčby by měl být její příznivý účinek jak ve smyslu ovlivnění nádorové choroby, tak i ve smyslu celkové snášenlivosti léčby. Míra klinických projevů HFSR ovlivňuje dávkovací schémata cílené protinádorové léčby a také celkové výsledky terapie. Správným zvládáním a předcházením tomuto nežádoucímu účinku tak můžeme významně přispět k celkovému úspěchu cílené protinádorové léčby. V současné době probíhá extenzivní výzkum možností prevence HFSR u pacientů léčených sorafenibem a lze předpokládat, že tyto výsledky budou obecně použitelné u všech přípravků s podobným mechanizmem účinku.
Autoři
deklarují, že v souvislosti s předmětem studie nemají žádné
komerční zájmy.
The
authors declare they have no potential conflicts of interest
concerning drugs, products, or services
used in the study.
Redakční
rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro
publikace zasílané do bi omedicínských
časopisů.
The
Editorial Board declares that the manuscript met the ICMJE “uniform
requirements” for biomedical papers.
MUDr.
Dagmar Bednaříková
Privátní
kožní ambulance
Masarykův
onkologický ústav
Žlutý
kopec 7
656
53 Brno
e-mail:
dagmar.b@centrum.cz
Zdroje
1. Zuehlke RL. Erythematous eruption of the palms and soles associated with mitotane therapy. Dermatologica 1974; 148(2): 90– 92.
2. Demetri GD, van Oosterom AT, Garrett CR et al. Efficacy and safety of sunitinib in patients with advanced gastrointestinal stromal tumour after failure of imatinib: a randomised controlled trial. Lancet 2006; 368(9544): 1329– 1338.
3. Baack BR, Burgdorf WH. Chemotherapy‑induced acral erythema. J Am Acad Dermatol 1991; 24(3): 457– 461.
4. Lacouture ME, Reilly LM, Gerami P et al. Hand foot skin reaction in cancer patients treated with the multikinase inhibitors sorafenib and sunitinib. Ann Oncol 2008; 19(11): 1955– 1961.
5. Yang CH, Lin WC, Chuang CK et al. Hand‑ foot skin reaction in patients treated with sorafenib: a clinicopathological study of cutaneous manifestations due to multitargeted kinase inhibitor therapy. Br J Dermatol 2008; 158(3): 592– 596.
6. Chu D, Lacouture ME, Fillos T et al. Risk of hand‑ foot skin reaction with sorafenib: a systematic review and meta‑analysis. Acta Oncol 2008; 47(2): 176– 186.
7. Chu D, Lacouture ME, Weiner E et al. Risk of hand‑ foot skin reaction with the multitargeted kinase inhibitor sunitinib in patients with renal cell and non‑renal cell carcinoma: a meta‑analysis. Clin Genitourin Cancer 2009; 7(1): 11– 19.
8. Autier J, Escudier B, Wechsler J et al. Prospective study of the cutaneous adverse effects of sorafenib, a novel multikinase inhibitor. Arch Dermatol 2008; 144(7): 886– 892.
9. Nagore E, Insa A, Sanmartín O. Antineoplastic therapy‑induced palmar plantar erythrodysesthesia (‘hand‑ foot’) syndrome. Incidence, recognition and management. Am J Clin Dermatol 2000; 1(4): 225– 234.
10. Common Terminology Criteria for Adverse Events (CTCAE). Version 4.0. Published: May 28, 2009 (v 4.03: June 14, 2010). Available from: http:/ / evs.nci.nih.gov/ ftp1/ CTCAE/ CTCAE_4.03_2010– 06– 14_QuickReference_8.5x11.pdf.
11. Lacouture ME, Wu S, Robert C et al. Evolving strategies for the management of hand‑ foot skin reaction associated with the multitargeted kinase inhibitors sorafenib and sunitinib. Oncologist 2008; 13(9): 1001– 1011.
12. Lee WJ, Lee JL, Chang SE et al. Cutaneous adverse effects in patients treated with the multitargeted kinase inhibitors sorafenib and sunitinib. Br J Dermatol 2009; 161(5): 1045– 1051.
13. Beldner M, Jacobson M, Burges GE et al. Localized palmar‑ plantar epidermal hyperplasia: a previously undefined dermatologic toxicity to sorafenib. Oncologist 2007; 12(10): 1178– 1182.
14. Lai SE, Kuzel T, Lacouture ME. Hand‑ foot and stump syndrome to sorafenib. J Clin Oncol 2007; 25(3): 341– 343.
15. Thompson DS, Greco FA, Spigel DR et al. Bevacizumab, erlotinib, and imatinib in the treatment of patients with advanced renal cell carcinoma: Update of a multicenter phase II trial. J Clin Oncol 2006; 24 (Suppl 18): 4594.
16. Yang CH, Chuang CK, Hsieh JJ et al. Targeted therapy and hand‑ foot skin reaction in advanced renal cell carcinoma. Expert Opin Drug Saf 2010; 9(3): 459– 470.
17. Robert C, Mateus C, Spatz A et al. Dermatologic symptoms associated with the multikinase inhibitor sorafenib. J Am Acad Dermatol 2009; 60(2): 299– 305.
18. Robert C, Escudier B. Cutaneous side effects of multikinase inhibitors used in renal cell cancer. Oncology News International 2007; 5: 1– 20.
19. Strumberg D, Clark JW, Awada A et al. Safety, pharmacokinetics, and preliminary antitumor activity of sorafenib: a review of four phase I trials in patients with advanced refractory solid tumors. Oncologist 2007; 12(4): 426– 437.
20. Azad NS, Aragon‑ Ching JB, Dahut WL et al. Hand‑ foot skin reaction increases with cumulative sorafenib dose and with combination anti‑vascular endothelial growth factor therapy. Clin Cancer Res 2009; 15(4): 1411– 1416.
21. Jain L, Gardner ER, Figg WD et al. Lack of association between excretion of sorafenib in sweat and hand‑ foot skin reaction. Pharmacotherapy 2010; 30(1): 52– 56.
22. Meta‑Analysis Group In Cancer. Toxicity of fluorouracil in patients with advanced colorectal cancer: effect of administration schedule and prognostic factors. J Clin Oncol 1998; 16(11): 3537– 3541.
23. Keohan M, D’Adamo D, Qin L et al. Analysis of toxicity in a phase II study of sorafenib in soft tissue sarcoma (STS). J Clin Oncol 2007; 25(Suppl 18): 10061.
24. Kampmann KK, Graves T, Rogers SD. Acral erythema secondary to high‑dose cytosine arabinoside with pain worsened by cyclosporine infusions. Cancer 1989; 63(12): 2482– 2485.
25. Abou‑ Alfa GK, Schwartz L, Ricci S et al. Phase II study of sorafenib in patients with advanced hepatocellular carcinoma. J Clin Oncol 2006; 24(26): 4293– 4300.
26. Cheng AL, Kang YK, Chen Z et al. Efficacy and safety of sorafenib in patients in the Asia‑ Pacific region with advanced hepatocellular carcinoma: a phase III randomised, double‑blind, placebo‑ controlled trial. Lancet Oncol 2009; 10(1): 25– 34.
27. Jain L, Sissung TM, Danesi R et al. Hypertension and hand‑ foot skin reactions related to VEGFR2 genotype and improved clinical outcome following bevacizumab and sorafenib. J Exp Clin Cancer Res 2010; 29: 95.
28. Vincenzi B, Santini D, Russo A et al. Early skin toxicity as a predictive factor for tumor control in hepatocellular carcinoma patients treated with sorafenib. Oncologist 2010; 15(1): 85– 92.
29. Gressett SM, Stanford BL, Hardwicke F. Management of hand‑ food syndrome induced by capecitabine. J Oncol Pharm Pract 2006; 12(3): 131– 141.
30. Lee S, Lee S, Chun Y et al. Pyridoxine is not effective for the prevention of hand foot syndrome (HFS) associated with capecitabine therapy: Results of a randomized double‑blind placebo‑ controlled study. J Clin Oncol 2007; 25: 9007.
31. Mortimer JE, Lauman M, Tan B et al. Pyridoxine treatment and prevention of hand‑ and‑ foot syndrome in patients receiving capecitabine. J Oncol Pharm Practice 2003; 9: 161– 166.
32. Holečková P. Studie PRESSO 1. Prevence hand – foot skin reaction = kožní reakce na dlaních a chodidlech při terapii Nexavarem (sorafenibem) a korelace stupně hand – foot skin reaction a hladiny neopterinu. Multicentrická randomizovaná nezaslepená prospektivní studie. Data u autorky.
Štítky
Detská onkológia Chirurgia všeobecná OnkológiaČlánok vyšiel v časopise
Klinická onkologie

2010 Číslo 5
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
- Tramadol a paracetamol v tlumení poextrakční bolesti
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
Najčítanejšie v tomto čísle
- Úskalí diagnostiky Kaposiho sarkomu sdruženého s HIV infekcí
- Hand‑ foot syndrom po podání inhibitorů tyrozinkinázové aktivity
- Mukoepidermoidní karcinom dutiny nosní – vzácný nádor
- 18F‑ FDG PET/ CT v diagnostice mnohočetného myelomu a monoklonální gamapatie nejistého významu: srovnání s 99mTc‑ MIBI scintigrafií
