-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Léčebné výsledky pacientů léčených v letech 1980– 2004 na jediném pracovišti pro nefroblastom
Treatment Results in Patients Treated from 1980 to 2004 for Wilms‘ Tumour in a Single Centre
Backgrounds:
The principle behind the treatment of nephroblastoma has been similar for at least 4 decades, based on vincristine and dactinomycine, radiotherapy in selected stages. The last three decades have been characterised by the aim to reduce the intensity and length of treatment.Design:
To retrospectively compare survival rates and treatment success in a cohort of patients aged under 19 years, treated from 1980 to 2004 at a single centre by five consecutive treatment protocols.Materials and Methods:
The outcome was evaluated in patients treated consecutively by two protocols established at the centre before 1980 and modified in 1986, and from 1988 consecutively by three accepted protocols, SIOP9, SIOP93 and SIOP2001.Results:
Overall survival as well as event‑free survival rates were evaluated by Kaplan ‑ Meier functions in 315 patients (52.7% women). The average age at diagnosis was 3.9 ± 2.9 years, median 3.3, range 0.01 – 17.2 years. Age over 12 years in 2.2% patients. The average follow‑up time was 13.1 ± 7.8, median 13.6, range 0.2 – 27.8 years. The original 104 weeks of protocol KDO86 treatment had a 10‑year overall survival rate of 91.9 ± 3.2%. Overall survival significantly fell with radiotherapy reduction in lower clinical stages and treatment diversification in protocols with substantial treatment length reduction. Overall survival returned to the original value of KDO86 only in 1994, when SIOP93 was accepted with a 10‑year overall survival rate of 92.47 ± 3.0% and event‑free survival 85%, with similar trends in the latest protocol, SIOP2001. In the entire cohort two coincident malignancies (tumour duplicities) were found: one B‑lymphoma, one neuroblastoma. A second malignancy occurred in one patient – superficial spreading melanoma.Conclusion:
from the retrospective view the accepted SIOP9 protocol has a significantly worse outcome in both the overall survival and in event‑free survival rate compared with the original therapy. Only the SIOP93 and SIOP2001 protocols accepted after 2003 have an acceptable 10‑year overall survival rate (around 92%) as well as event‑free survival (85%) with substantially reduced length and intensity of treatment, lowering the risk of late effects.Key words:
nephroblastoma – survival – treatment protocols
Autoři: J. Mališ 1; J. Radvanská 1; K. Slabý 2; T. Eckschlager 1; M. Procházka 2; B. Malinová 1; K. Pýcha 3; D. Kodetová 4; J. Radvanský 2
Působiště autorů: Klinika dětské hematologie a onkologie 2. LF UK a FN Motol, Praha 1; Klinika rehabilitace a tělovýchovného lékařství 2. LF UK a FN Motol, Praha 2; Klinika dětské chirurgie 2. LF UK a FN Motol, Praha 3; Ústav patologické anatomie a molekulární medicíny 2. LF UK a FN Motol, Praha 4
Vyšlo v časopise: Klin Onkol 2010; 23(5): 332-342
Kategorie: Původní práce
Souhrn
Východiska:
Základ léčby nefroblastomu je obdobný přinejmenším již čtyři dekády – vinkristin a daktinomycin, v indikovaných případech radioterapie. V posledních třech dekádách je snaha redukovat délku a intenzitu v principu podstatně nezměněné léčby.Cíl studie:
Retrospektivně zhodnotit léčebný úspěch a výskyt závažných komplikací na populaci pacientů mladších 19 let, léčených na jediném pracovišti v letech 1980 – 2004.Materiál a metody:
Vyhodnotili jsme výsledky pěti léčebných schémat: dvě původní z let 1980 – 1988, poté postupně přejatá tři další schémata evropské pracovní skupiny: SIOP9, SIOP93 a SIOP2001.Výsledky:
Léčebný úspěch byl hodnocen Kaplan ‑ Meierovými funkcemi přežití, a to jak pro celkové přežití, tak pro přežití bez následků. Základní soubor má 315 pacientů, z toho 52,7 % žen. Průměrný věk v době stanovení diagnózy byl 3,9 ± 2,9 roku, medián 3,3, rozsah 0,01 – 17,2 roku, 2,2 % nad 12 let. Průměrná délka sledování byla 13,1 ± 7,8, medián 13,6, rozsah 0,2 – 27,8 roku. Původní dvouletý protokol KDO86 měl 10leté celkové přežití 91,9 % ± 3,2 %. Redukcí radioterapie u nižších klinických stadií a postupnou diverzifikací protokolů s podstatně kratší dobou léčby celkové přežití kleslo a k původní hodnotě se vrátilo až od roku 1994 s přechodem na protokol SIOP93 s 10letým celkovým přežitím 92,47 % ± 3,0. Přežití bez následků protokolu SIOP93 dosahuje 85 %, trend přežití bez následků dosud užívaného protokolu SIOP2001 je obdobný. V celém souboru se vyskytly dvě duplicitní malignity (1krát B lymfom, 1krát neuroblastom), sekundárně 1krát plošně se šířící melanom.Závěr:
Ze zpětného pohledu ukazuje přejatý protokol SIOP9 signifikantně horší celkové přežití i přežití bez následků proti původní terapii. Teprve protokoly SIOP93 a SIOP2001 používané po roce 1993 mají příznivé 10leté celkové přežití okolo 92 % i přežití bez následků (85 %) při podstatně redukované délce i intenzitě léčby snižující riziko pozdních následků onemocnění.Klíčová slova:
nefroblastom – přežití – léčebné protokolyVýchodiska
Nefroblastom je jeden ze čtyř nejčastějších solidních nádorů dětského věku, s poměrně dobrou kurabilitou již od 70. let 20. století, s výrazně horším přežitím u vyšších klinických a histopatologicky nepříznivých stadií, která jsou poměrně méně četná. Pouze okolo 6 % pacientů mívá postižení bilaterální a dalších 12 % pacientů mívá více ložisek v jedné ledvině nebo metastázy. Zatímco klinické stadium I s příznivým histopatologickým nálezem má dobrou prognózu s vysokým celkovým přežitím již více dekád, vyšší klinická stadia, histopatologicky nepříznivé typy a zejména „non Wilms“ nádory ledvin dětského věku mají prognózu dodnes významně horší, a to i za použití podstatně agresivnější léčby. Na rozdíl od jiných solidních nádorů dětského věku neprošla chemoterapie zásadní změnou kvalitativní, ale spíše procesem kvantitativním s upřesňováním dávek a kombinace s radioterapií dle klinického stadia choroby za použití stejných základních cytostatik.
Historicky vznikly dva rozdílné přístupy k léčebné strategii. Hlavním rozdílem je zařazování definitivní operace – americká NWTS (National Wilms Tumor Study Group) používá nefrektomii jako iniciální terapii a podle rozsahu onemocnění a histopatologického typu nádoru pokračuje v pooperační léčbě. SIOP, evropská pracovní skupina (Nephroblastoma Study & Trial), řadí nefrektomii až po předoperační – neoadjuvantní chemoterapii, v jejímž průběhu se nádor významně změní a snižuje se riziko perioperačních komplikací.
Problém stanovení optimální léčby vzniká již při diagnostice nádoru. Neoadjuvantní chemoterapie významně mění histopatologické vlastnosti Wilmsova tumoru (WT) [1], odlišné histopatologické vlastnosti při použití a bez použití neoadjuvantní chemoterapie jsou znázorněné v tab. 1.
Tab. 1. Rozdíly histologického nálezu v závislosti na použití neoadjuvantní chemoterapie [2]. ![Rozdíly histologického nálezu v závislosti na použití neoadjuvantní chemoterapie [2].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/1b151a074782f119dffa9ac1b2811747.jpeg)
Pro tyto odlišné nálezy vznikl zásadní a dodnes plně nedořešený spor, zda neoadjuvantní chemoterapie nezastíní jasně patrný trend obdobný pro většinu malignit – snahu velmi přesně stratifikovat léčbu podle klinického stadia, histopatologického typu, případně odpovědi na předoperační léčbu [2].
Ať už je správnější cesta s neoadjuvantní terapií nebo bez ní, výsledkem doporučení evropské i americké skupiny je omezené a přesně indikované použití radioterapie a rezervování intenzivní chemoterapie, včetně antracyklinů, pouze na prognosticky méně příznivé typy WT. Celkové léčebné výsledky obou skupin se však v současné době od sebe signifikantně neliší, a proto obě pokračují v odlišném léčebném schématu; diskuze nad sjednocujícím přístupem již začíná [3].Ve Velké Británii dokonce existuje „intermediární“ názor, některá pracoviště zde dodnes provádějí punkční biopsii intaktního tumoru. Zdůvodňují to benefitem věrného histopatologického obrazu pro stanovení strategie léčby, zejména diagnózu non WT nádorů, a přesnější morfologickou diagnostikou s nasazením adekvátní terapie. Soudí, že benefit je vyšší než riziko možného nádorového rozsevu biopsií [4]. Pro současnou optimalizaci léčby je charakteristické, že NWTS i SIOP ve svých doporučeních výrazně zkrátily pooperační chemoterapii z počátečních dvou let až na současné, v některých situacích pouze čtyřtýdenní trvání [2]. Dříve paušálně používaná radioterapie se omezila pouze na vysoce rizikové typy nádorů a celkově se dnes používá u asi 15 % pacientů s WT, což významně snižuje riziko postiradiačních komplikací. V naprosté většině případů již pacienti nejsou zářeni, ale léčeni kombinací daktinomycinu a vinkristinu a ve vyšších stadiích je dávka radioterapie snížena většinou z původních 30 na 10 Gy s tím, že zbylá třetina dostává ještě doxorubicin, který snižuje četnost lokálních relapsů nepříznivých stadií [5]. Kromě klasických nefroblastomů se vyčlenila skupina vysoce rizikových a prognosticky horších nádorů ledvin, např. do kostí metastazující nádor lediny (sarkom z jasných buněk), které vyžadují zcela odlišnou, intenzivní polyvalentní chemoterapii, často i radioterapii.
U pacientů s relapsem bylo historicky dlouhodobé přežití velmi nízké – méně než 30 %, ale po zavedení moderních cytostatik do onkologické léčby se ukázalo, že na nefroblastom mají značnou protinádorovou účinnost cyklofosfamid, ifosfamid, karboplatina, etoposid. Záchranná léčba tak zlepšila dlouhodobé přežití i u pacientů s relapsem na dnešních 50 – 60 a více procent. Lepší prognózu mají ti pacienti, kteří měli nádor v klinickém stadiu I – II, byli původně léčeni pouze vinkristinem a daktinomycinem, nebyli původně zářeni, měli histologicky příznivý typ a u kterých relaps vznikl déle než 6 měsíců po původním stanovení diagnózy. Ale i pro pacienty s nepříznivou prognózou při relapsu se ukazují slibné výsledky při vysokodávkované chemoterapii s převodem autologních kmenových buněk [6].
Vývoj radioterapie
Radioterapie nefroblastomu prodělala vývoj obdobný jako u dalších malignit dětského věku. Zatímco začátkem 80. let byly zářeny kobaltovým zářičem všechny děti s WT, ukázala první studie, že pacienti pod 2 roky věku s nefroblastomem klinického stadia I neměli vyšší léčebný úspěch při kombinované chemoterapii a radioterapii proti skupině, která byla léčena 15 měsíců daktinomycinem bez radioterapie. Tatáž studie prokázala, že není nutné u pacientů s nefroblastomem stadia III s lokálním porušením nádoru nebo po biopsii používat radioterapii celého břicha. Studie NWSTS 2 později ukázala, že radioterapie může být z léčebného protokolu vypuštěna u všech dětí s klinickým stadiem I, pokud jsou léčeny kombinací vinkristinu a daktinomycinu. Již v té době byla radioterapie limitována na 18 – 24 Gy pro děti ve věku pod 8 měsíců, 24 – 30 Gy pro děti ve věku 19 – 30 měsíců, 30 – 35 Gy pro děti ve věku 31 – 40 měsíců a 35 – 40 Gy pro děti nad 40 měsíců věku. Třetí studie NWTSG ukázala, že radioterapie může být vypuštěna i u dětí s klinickým stadiem II, pokud byly léčeny kombinací vinkristinu a daktinomycinu. Tatáž studie prokázala podobný účinek pro terapii pacientů s klinickým stadiem III,pokud dostali dávku 11 Gy + trojkombinaci vinkristinu, daktinomycinu a doxorubicinu jako při protokolu s 20 Gy radioterapie a dvojkombinací chemoterapie vinkristin – daktinomycin [2,6].
Kromě zdroje ionizujícího zařízení se významně změnila technologie zaměřování ozařovaného pole. Od použití kobaltového zářiče bylo zcela upuštěno a radioterapie je prováděna lineárními urychlovači s velmi přesnou modelací ozařovacího pole, jehož cílem je ozařovat jen nádorem postižené tkáně a minimalizovat dopad záření na okolní zdravé struktury. Děti s nefroblastomem jsou vyvíjející se a rostoucí organizmy a nejčastějším a nejviditelnějším pozdním následkem je postižení muskuloskeletálního systému (skolióza). Právě postižení fyziologického růstu mělo významný vliv na tvorbu ozařovacího pole. V počátcích radioterapie až do počátku 80. let respektovalo radioterapeutem vytvářené ozařovací pole zcela stranové postižení s tím, že kopírovalo iniciální rozsah nádoru a končilo ve střední čáře. Polovina obratlového těla tak byla ozářena a dále se nevyvíjela a druhostranná část byla zářením nepostižena a vyvíjela se takřka normálně. Výsledkem byla velmi závažná skolióza s následky nejen kosmetickými, ale také funkčními. Proto se posléze ozařovací pole rozšířilo tak, že překročilo střední čáru na druhostrannou polovinu, aby se do ozařovací oblasti dostala celá oblast obratlového těla, takže se pak vyvíjelo symetricky a výsledná skolióza pak byla zvýrazněna méně. V současné době používaná lineární technika dokáže významně snížit dávku záření, kterou obratlová těla obdrží, a rozvoj skoliózy je ještě méně pravděpodobný.
Ke změnám léčebného algoritmu v posledních 3 dekádách je nutno přiřadit také dramatické změny v diagnostice – neprovádí se angiografie, kavografie, plicní tomografie. Základní diagnózu lze stanovit z klinického a sonografického, eventuálně CT vyšetření a sumačního RTG snímku a CT plic.
Cíle práce
Při optimalizaci strategie léčby každého zhoubného nádoru je hlavním cílem vysoký léčebný úspěch při minimalizaci pozdních následků léčby. Základním cílem této práce bylo ověřit na datech z jediného pracoviště v období 1980 – 2004, zda tento trend je platný i pro převzaté modifikace léčebných protokolů nefroblastomu.
Další cíle:
- Ukázat úspěšnost léčby v závislosti na klinickém stadiu a použitém léčebném protokolu.
- Ověřit počet a strukturu onkologických událostí (úmrtí, relaps či recidiva, sekundární malignita).
- Zjistit příčiny smrti jiné než z progrese choroby. Nefatální pozdní následky jsou předmětem samostatného sdělení [7].
Soubor pacientů a metody
Měřená skupina
Do základního souboru pacientů jsme zařadili všechny léčené od 1. 1. 1980 do 31. 12. 2004 na Klinice dětské onkologie (dnes Klinice dětské hematologie a onkologie UK 2. LF a FN Motol) splňující následující kritéria:
- U pacienta byla diagnostikována a následně histologicky potvrzena diagnóza WT.
- V době hospitalizace byl občanem České republiky.
Základním zdrojem informací pro zpracovanou databázi byly původní chorobopisy pacientů a data z příjmových knih pracoviště. Fáze verifikace dat: Podskupinu těch pacientů, jejichž údaje jsou již součástí vnitřní databáze klinických dat pracoviště, jsme konfrontovali s chorobopisy, výsledky jsme konfrontovali i s výsledky z ÚZIS.
Sledované parametry:
- data relevantní pro potvrzení diagózy nefroblastomu (ze základního souboru jsme vyřadili pacienty s non nefroblastomovou diagnózou při primárním postižení ledviny a pacienty, u kterých nebyl prokázán maligní nádor ledviny),
- data relevantní pro určení klinického stadia, datum stanovení diagnózy, začátku a konce léčby, typ a lateralitu operace,
- případné události („events“): relapsy nebo recidivy, neodpovídavost na léčbu, data úmrtí s daty pro určení přežití bez následků (events free survival – EFS) a celkového přežití (overall survival – OS),
- typ léčebného protokolu zařazení do jednoho z pěti schémat používaných v letech 1980 – 2004 a případnou nutnost jeho změn,
- komplikace léčby, informace o případné sekundární malignitě či souběhumalignit,
- poslední data kontrol a poslední známáadresa bydliště.
Sporná či neúplná data: O jednom pacientovi nevíme vůbec, zda žije. U dalších šesti známe jen přibližně datum události (relaps, smrt). U jednoho pacienta nebylo možno určit klinické stadium zejména kvůli duplicitnímu nádoru (ipsilaterální suprarenální neuroblastom), a tudíž i nestandardnímu léčebnému postupu.
Léčebná schémata na Klinice dětské onkologie
Vývoj léčby na pracovišti lze charakterizovat následovně:
- V období 1980 – 1985 vzniká dominantní centrum léčby pro ČSSR. Již tehdy byla chemoterapie založena na dvojkombinaci vinkristin–aktinomycin, u nepříznivých stadií doxorubicin.
- Původní klasické schéma s předoperační radioterapií a chemoterapií bylo nahrazeno koncem roku 1986.
- Od roku 1985 se KDO aktivně zúčastnila tří celoevropských klinických studií a podle toho se také odvíjel léčebný postup se zkracováním délky zajišťující chemoterapie.
- období (1. 1. 1980 až 30. 11. 1986) – protokol KDO86
Stručná charakteristika: Invazivní diagnostické metody – břišní angiografie,popř. dolní kavografie, tomografie plic, paušální radioterapie na oblast primárního nádoru, chemoterapie trvající 2 roky. - období (1. 12. 1986 až 30. 6. 1988) – protokol KDO88
Stručná charakteristika: Zavedení moderních diagnostických metod: ultrazvuk a CT, radioterapie indikována jen u neradikálně odoperovaných nádorů, chemoterapie zkrácena na dobu 1 roku. - období (1. 7. 1988 až 31. 12. 1993) – SIOP Nephroblastoma Study 9
Stručná charakteristika: Standardní diagnostika ultrazvukovým a CT vyšetřením, participace pracoviště v probíhající studii. Randomizace předoperační chemoterapie 4 vs 8 týdnů. - období (1. 1. 1994 až 31. 12. 2001) – SIOP Nephroblastoma Study 93 - 01
Stručná charakteristika: Standardní diagnostika ultrazvukovým a CT vyšetřením, participace pracoviště v probíhající studii. Další zkrácení pooperační chemoterapie. - období (1. 1. 2002 až 31. 12. 2004) – SIOP Nephroblastoma Study 2001
Stručná charakteristika: Standardní diagnostika ultrazvukovým a CT vyšetřením, participace pracoviště v probíhající studii. Další zkrácení pooperační chemoterapie, stratifikace léčby podle histopatologických typů.
Výsledné léčebné protokoly jsou uvedeny v tab. 2.
Tab. 2. Léčebné protokoly používané v období 1980– 2004. 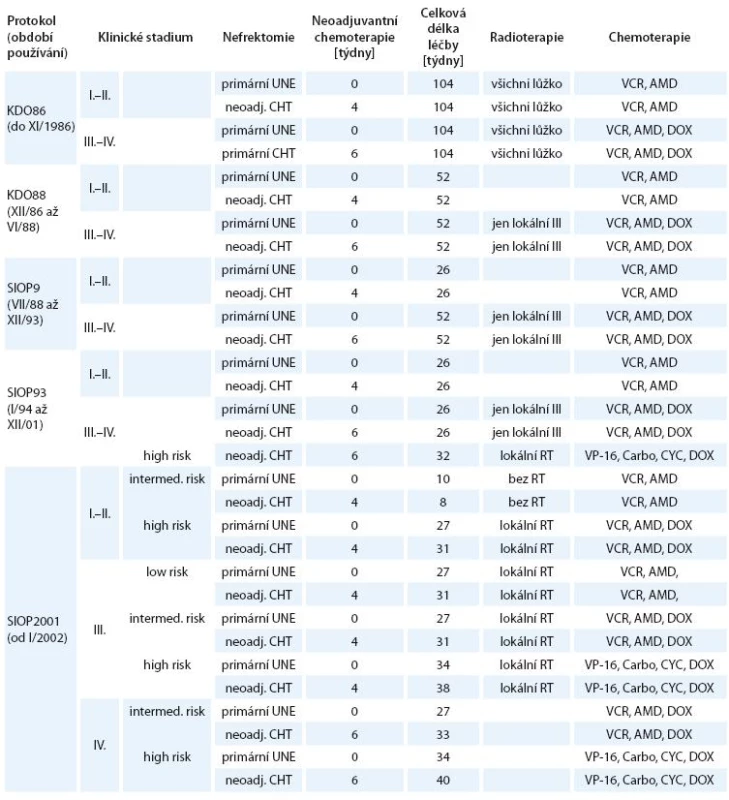
UNE – primární nefrektomie, RT – radioterapie Kdy u pacientů s WT nebyla použita neoadjuvantní chemoterapie:
- diagnóza nefroblastomu nebyla jednoznačná,
- v nádoru převažovaly cystické podíly s minimem nádorové tkáně, a tudíž byla šance na zmenšení malá,
- u dětí mladších jednoho roku,
- u dětí starších šesti let,
- jestliže nádor spontánně perforoval a byl řešen jako urgentní situace.
Statistické zpracování
Léčebný úspěch jsme hodnotili následujícími parametry – celkové přežití (overall survival – OS) a přežití bez události (events free survival – EFS). Přežití bylo dokumentováno pomocí Kaplan - Meierovy neparametrické metody analýzy přežívání. Metodiku jsme podrobněji popsali v práci v roce 2004 [8]. Doba přežití byla počítána od data diagnózy do data zjištění současného zdravotního stavu pacienta, nebo do úmrtí. Pro výpočty křivek přežití jsme započítali poslední známé datum.
Výsledky
Primární soubor pacientů
Do studie jsme zahrnuli 315 pacientů, z toho 166 žen (52,7 % souboru). Průměrný věk v době stanovení diagnózy byl 3,9 ± 2,9 roku (medián 3,3, rozsah 0,01 – 17,2 roku). Průměrná délka sledování byla 13,1 ± 7,8 (medián 13,6, rozsah 0,2 – 27,8 roku). Výskyt diagnóz ve vyšším věku: 2,2 % souboru bylo diagnostikováno ve věku nad 12 let.
V klinickém stadiu I bylo 60,6 % pacientů, v klinickém stadiu II bylo 7,0 %, v klinickém stadiu III bylo 11,7 %, v klinickém stadiu IV bylo 13,7 %, v klinickém stadiu V (bilaterální nádor) bylo 6,3 %.
Lateralita postižení: 148 (46,9 %) levostranných, 145 (46,0 %) pravostranných postižení, 20 (6,4 %) bilaterálních a dva (0,7 %) extrarenální projev.
Zemřelo 47 pacientů (14,9 %), z toho jeden na sepsi zřejmě z jiné příčiny než WT, jeden při léčbě duplicitní malignity (B - nonhodgkinský lymfom). Devatenáct pacientů zemřelo v důsledku recidivy či relapsu. Zbylých 26 pacientů zemřelo v souvislosti s progresí základního onemocnění při selhání terapie. Recidiva či relaps se vyskytly celkem u 31 pacientů, jejich mortalita tedy činila 61 %.
Lokalizace relapsů byla následující: plíce v 16 případech, lůžko po nefrektomii 9,zbývající ledvina 4 (z toho dva případy u pacientů s pátým klinickým stadiem), játra 3, mozek 1. Počet relapsů podle klinického stadia byl následující: 18 u stadia I(9,4 %), 4 u stadia II (17,4 %), 2 u stadia III(5,4 %), 3 u stadia IV (7,0 %) a 4 u stadia V (20,0 %). V závislosti na léčebném protokolu je počet relapsů následující: 3 u KDO86 (4,0 %), 4 u KDO88 (13,3 %), 13 u SIOP9 (13,5 %), 9 u SIOP93 (11,1 %) a 2 u SIOP2001 (6,1 %). Celkově se ve 13 případech (43,3 %) jednalo o časný relaps.
Nádorové duplicity:
- 1krát nádorová duplicita se suprarenálním neuroblastomem na straně postižené ledviny (žije, v remisi).
- 1krát B - NHL během léčby (zemřel na sepsi při zahájení terapie pro NHL).
Sekundární malignity:
Nalezli jsme jedinou malignitu, jejíž zařazení do sekundárních maligit není typické, a je otázkou, zda je v souvislosti s nefroblastomem nebo jeho terapií: povrchově se šířící melanom (nádor mimo oblast záření, pacientka žije, v remisi).
Progrese při léčbě
Pacienti s progresí choroby v průběhu léčby, která proto musela být měněna ještě během základního schématu léčby před uvedením do remise – 34 pacientů (z toho 15 žen), přežilo 5 pacientů (14,7 %):
- Žena, narozená 1974. V 6 letech diagnostikován WT pravé ledviny a metastáza do plic, klinické stadium IV.Předoperačně zářena na ledvinu, při léčbě podle protokolu KDO86 progrese plicního nálezu, proto byla změna terapie. O druhém eventu (události) – plicní recidivě – není dokumentace.
- Muž, narozen 1978, původně diagnostikován před 3. rokem věku jako WT klinického stadia I, vpravo, protokol KDO86. Pro progresi WT na léčbě (metastáza v plicích) byla aplikována RT na plíce a změněna chemoterapie. Terapie ukončena po třech letech. Trvá kompletní remise.
- Žena, narozená 1981. V necelých 2 letech byl diagnostikován WT levé ledviny, původně první klinické stadium, byla zahájena terapie podle protokolu KDO86, po roce od nefrektomie ještě v průběhu chemoterapie byla zjištěna plicní metastáza. Řešeno radioterapií na plíce, změnou terapie a chirurgicky. Konec terapie po 3,7 roku od diagnózy. Trvá kompletní remise.
- Muž, narozen 1987. V půl roce věku nalezen bilaterální WT, klinické stadium V.Léčen protokolem SIOP9. Na sonografii byla zjištěna progrese nálezu v levé ledvině ještě v průběhu chemoterapie. Po změně chemoterapie resekce a radioterapie. Léčba ukončena po 2,2 roku. Trvá kompletní remise.
- Muž, narozen 1990. Ve věku 3,3 roku byl zjištěn WT třetího klinického stadia vpravo, léčen protokolem SIOP9. Tři měsíce po primární nefrektomii ještě na terapii byla zjištěna progrese choroby – WT v lůžku, léčený chemoterapií a radioterapií.
Genderové rozdíly v primárním souboru
V základním souboru je 166 žen (52,7 %).
Ženy a muži se významně liší (p < 0,01) ve věku diagnózy nefroblastomu: ženy 4,3 ± 2,8 roku (medián 3,91 roku), muži 3,4 ± 2,9 roku (medián 2,81 roku).
Neliší se zastoupením klinických stadií, procentem přeživších, procentem zastoupení v „events“ ani zastoupením mužů a žen v jednotlivých léčebných protokolech.
Označíme li za recidivu nález po více než 3 měsících po ukončení léčby (což je datum v chorobopise přesněji zjistitelné než uvedení do remise), pak jich měly ženy 19 ze 166 (11,4 %) a muži 5 ze 149 (3,4 %), což je signifikantní rozdíl (p < 0,01). Kaplan - Meierovy grafy EFS však statisticky významně odlišné pro muže a ženy nejsou, zahrnují ale všechny události, nejen recidivy.
Porovnání zastoupení jednotlivých stadií v různých typech léčebného protokolu je znázorněno v tab. 3.
Tab. 3. Zastoupení jednotlivých klinických stadií v jednotlivých léčebných protokolech. 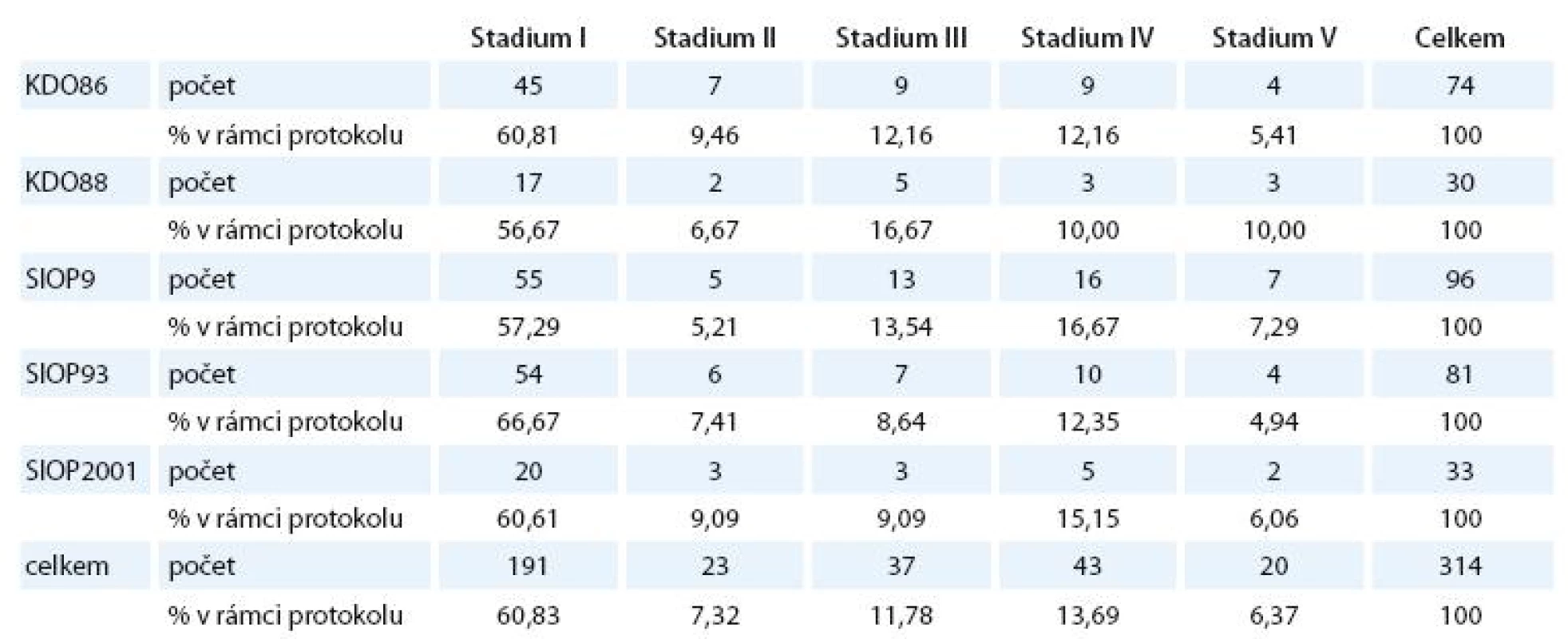
Zastoupení jednotlivých stadií ve skupinách podle protokolu se signifikantně neliší.
Obdobně jsme nezjistili ani rozdíly v zastoupení mužů a žen u jednotlivých protokolů.
Křivky přežítí
V tab. 4 je znázorněno celkové přežití základního souboru v závislosti na odstupu od diagnózy.
Tab. 4. Celkové přežití souboru v závislosti na odstupu od stanovení diagnózy. 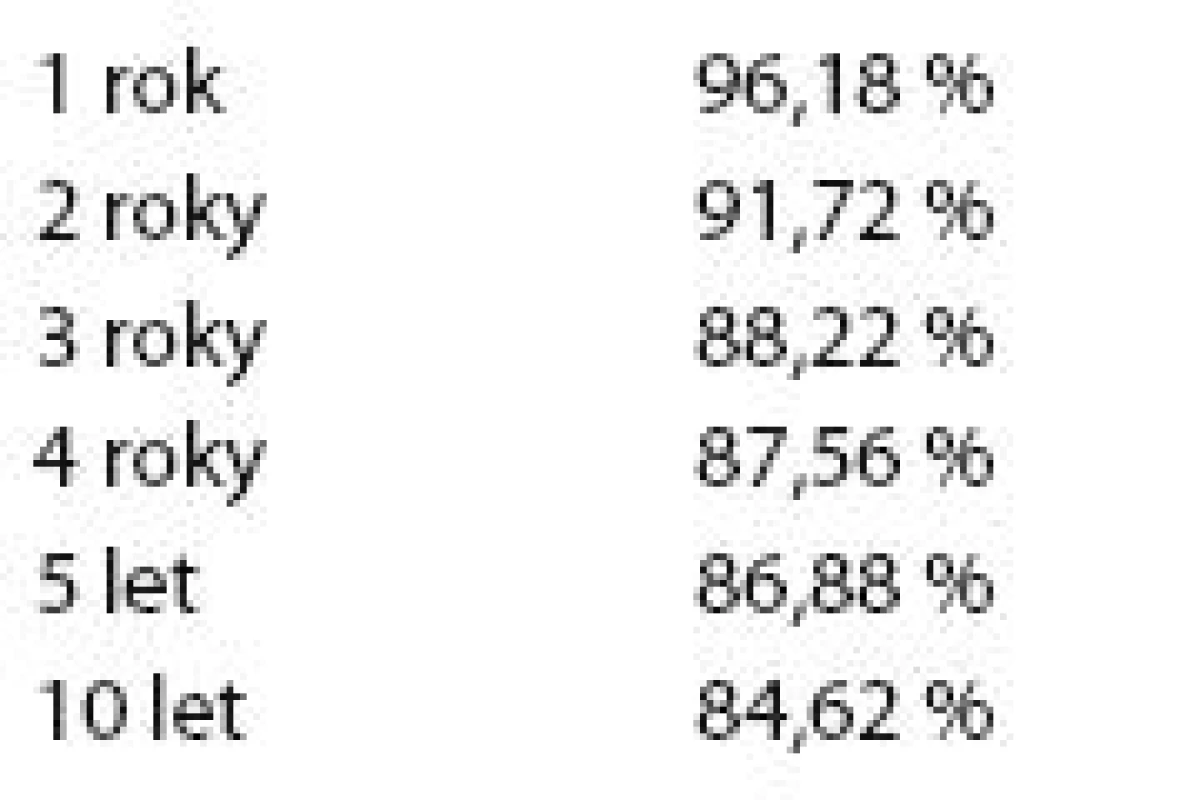
Graf 1 ukazuje Kaplan - Meierův graf celkového přežití celého základního souboru pacientů.
Graf 1. Kaplan-Meierův graf celkového přežití celého základního souboru pacientů. 
V tab. 5 je znázorněno přežití bez události (EFS) celého základního souboru.
Tab. 5. Přežití bez události celého základního souboru. 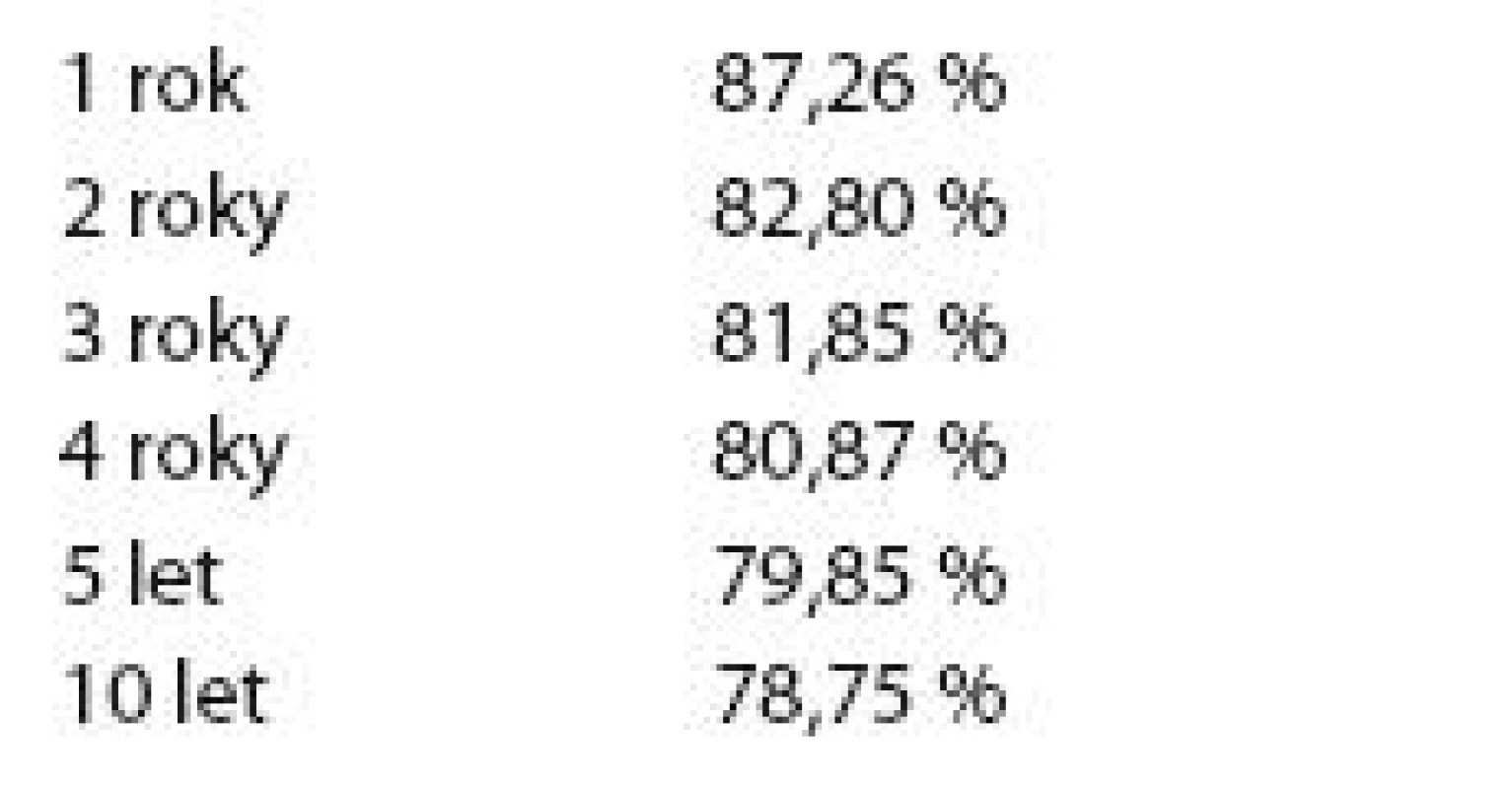
Graf 2 znázorňuje Kaplan - Meierův graf EFS celého základního souboru.
Graf 2. Kaplan-Meierův graf EFS celého základního souboru. 
Celkové přežití podle klinického stadia
Log - Rank Test 20,3, p = 0,00045. Zamítá se hypotéza o shodném průběhu křivek přežití pro všechna klinická stadia.
V tab. 6 je znázorněno procento a standardní chyba přežití jednotlivých klinických stadií.
Tab. 6. Procento přežití podle jednotlivých klinických stadií. 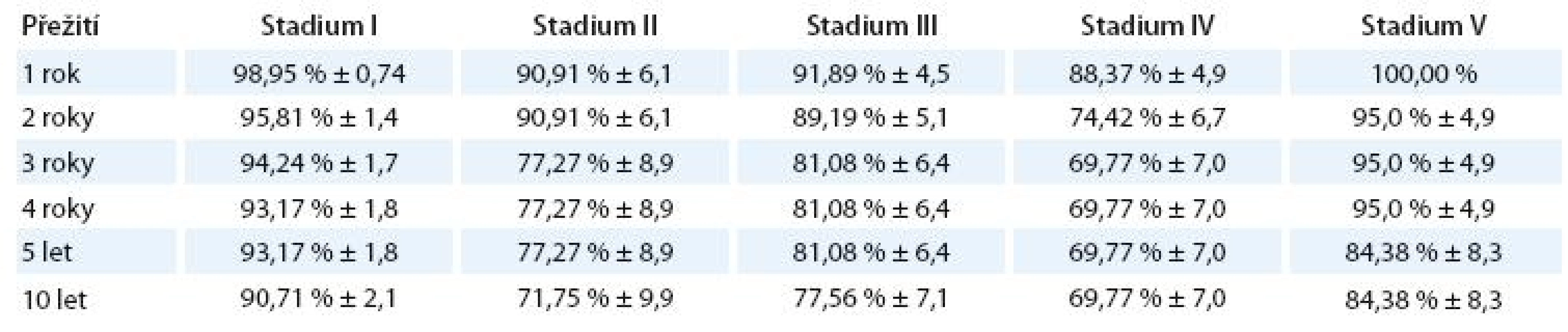
Graf 3 znázorňuje Kaplan - Meierův graf celkového přežití u jednotlivých klinických stadií.
Graf 3. Kaplan-Meierův graf celkového přežití u jednotlivých klinických stadií. 
Statisticky významně rozdílné jsou křivky celkového přežití pro stadium I vs II(p = 0,006), I vs III (p = 0,015) a I vs IV (p = 0,00004).
Přežití bez události podle klinického stadia
Log - Rank statistika 15,8, p = 0,0042. Zamítá se hypotéza o shodném průběhu křivek EFS u všech klinických stadií choroby.
V tab. 7 je znázorněno procento a standardní chyba přežití bez události (EFS) jednotlivých klinických stadií.
Tab. 7. EFS jednotlivých klinických stadií. 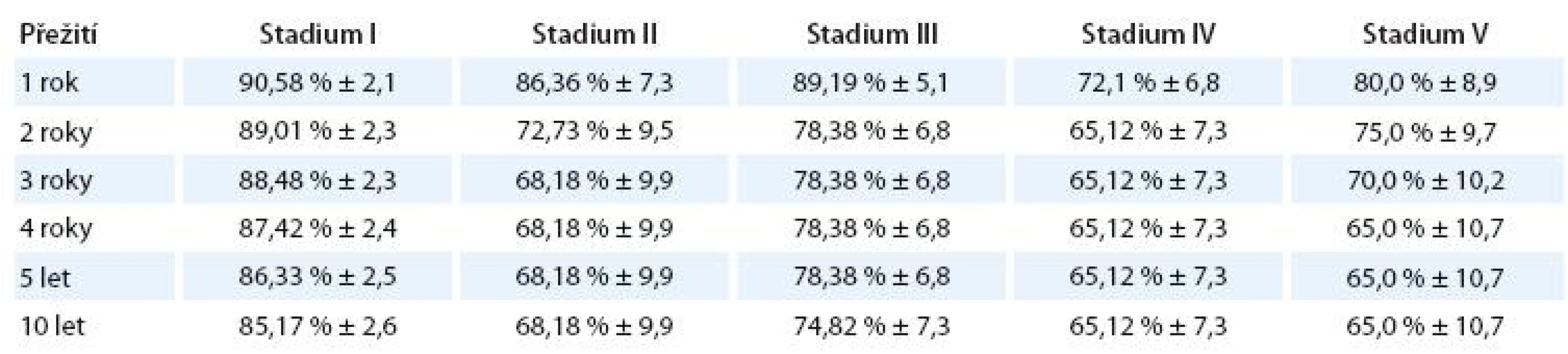
Signifikantně se liší pouze stadium I vs II (p = 0,039), I vs IV (p = ,0005) a I vs V(p = 0,028).
Graf 4 znázorňuje Kaplan - Meierovy křivky EFS u jednotlivých klinických stadií.
Graf 4. Kaplan-Meierovy grafy EFS u jednotlivých klinických stadií. 
Celkové přežití podle typu použitého léčebného protokolu
Log - Rank statistika 10,4, p = 0,034. Zamítá se hypotéza o shodném průběhu křivek OS u jednotlivých typů léčebného protokolu.
Statisticky významný je pouze rozdíl mezi lepším přežitím u původního, 2 roky dlouhého protokolu KDO86 a horším OS jak dlouhého protokolu bez záření prvního klinického stadia KDO88 (p = 0,012), tak i mezi KDO86 a podstatně zkráceným převzatým protokolem SIOP9 (p = 0,031), dále rozdíl mezi lepším OS novějšího protokolu SIOP93 a horším OS staršího protokolu KDO88 (p = 0,0096) a SIOP9 (p = 0,0023).
Kaplan - Meierovy grafy celkového přežití u jednotlivých léčebných protokolů jsou znázorněny v grafu 5.
Graf 5. Kaplan-Meierovy grafy celkového přežití u jednotlivých léčebných protokolů. 
Standardizované celkové přežití a jeho standardní chyba v závislosti na době od diagnózy jsou znázorněny v tab. 8.
Tab. 8. Celkové přežití a jeho standardní chyba závislosti na době od diagnózy. 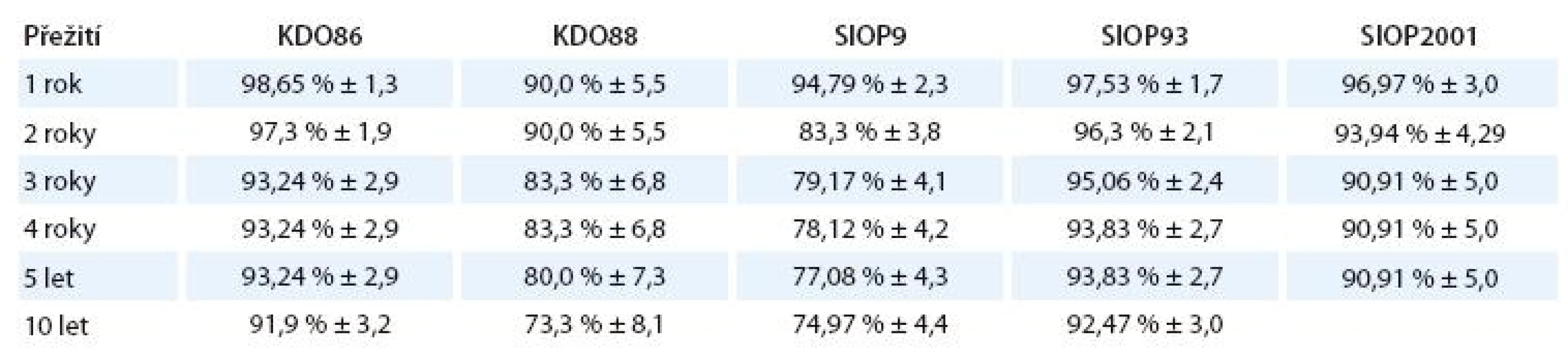
EFS podle typu použitého léčebného protokolu
Log - Rank Test 10,4, p = 0,034. Zamítá se hypotéza o shodném průběhu křivek EFS u různých typů léčebného protokolu.
Porovnáním dvojic typů léčebného protokolu navzájem jsme nalezli signifikantní rozdíl EFS pouze pro protokoly KDO86 vs SIOP9 (p = 0,0087) a SIOP9 vs SIOP93 (p = 0,016).
Kaplan - Meierovy grafy EFS u jednotlivých léčebných protokolů jsou znázorněny v grafu 6.
Graf 6. Kaplan-Meierovy grafy EFS u jednotlivých léčebných protokolů. 
Přežití bez události a jeho standardní chyba v závislosti na době od diagnózy jsou znázorněny v tab. 9.
Tab. 9. EFS a jeho standardní chyba v závislosti na době od diagnózy. 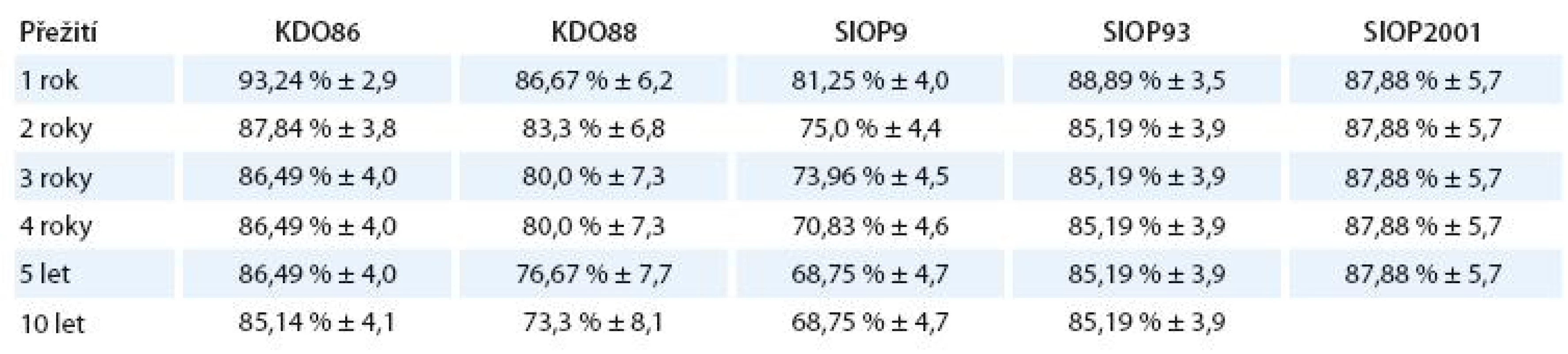
Srovnání vlivu více proměnných na celkovou dobu přežití
Pomocí Coxova regresního modelu (viz tab. 10) jsme srovnali vliv jednotlivých proměnných na celkové přežití pacientů. Věk v době diagnózy jsme vzali jako nezávislou spojitou veličinu, klinické stadium jsme jako kategorickou veličinu srovnali s referenčním vlivem stadia I, léčebné protokoly jsme srovnali jako kategorickou veličinu s referenčním vlivem původního dlouhého protokolu KDO86.
Tab. 10. Vliv jednotlivých explanatorních proměnných na OS. 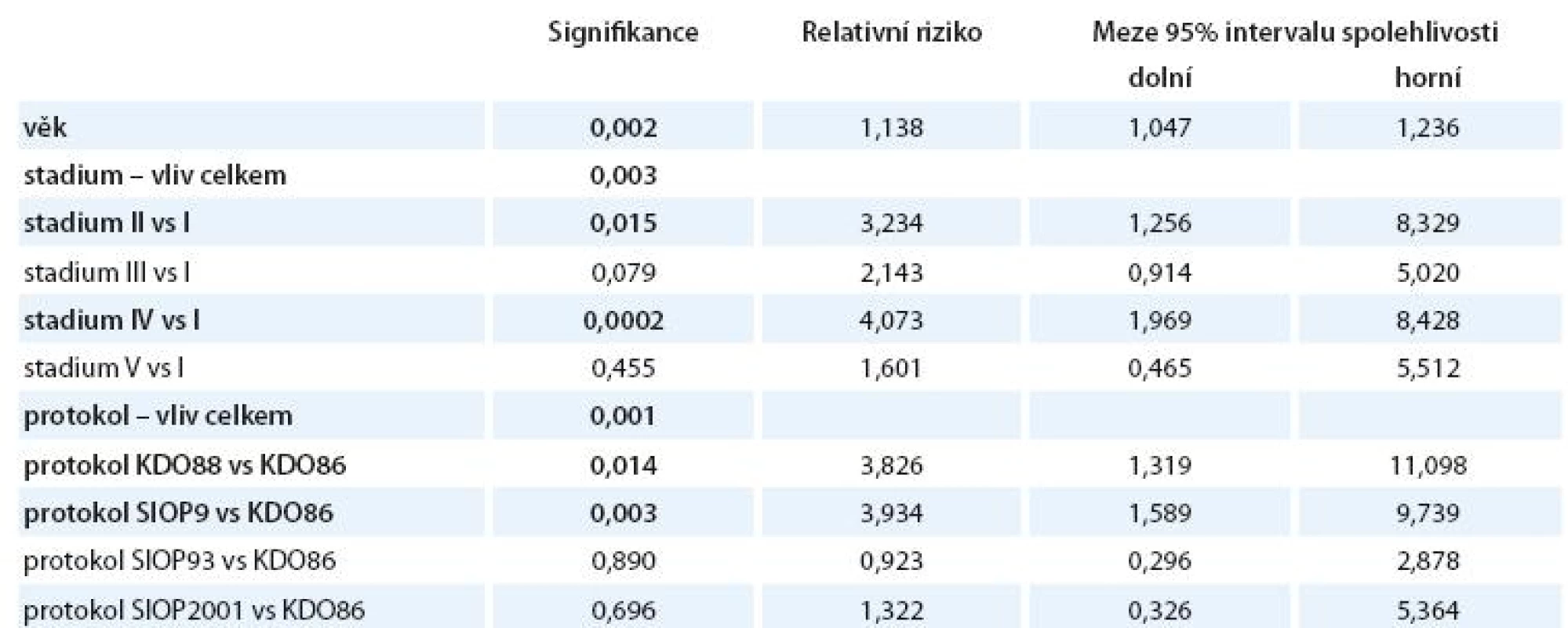
Pozn.: Signifikantně významné (p < 0,05) parametry jsou zvýrazněny. - Zamítá se nulová hypotéza, že věk v době diagnózy neovlivňuje riziko úmrtí (p = 0,002). Každé zvýšení věku diagnózy o 1 rok zvyšuje riziko úmrtí 1,1krát (95% interval spolehlivosti 1,047 – 1,236).
- Nulová hypotéza – riziko úmrtí je shodné ve všech klinických stadiích – se zamítá (p = 0,003).
- Stadium II zvyšuje signifikantně proti stadiu I riziko úmrtí (p = 0,015). Relativní riziko úmrtí stoupá 3,2krát (95% interval spolehlivosti 1,26 – 8,33).
- Stadium IV zvyšuje signifikantně proti stadiu I riziko úmrtí (p = 0,0002). Relativní riziko úmrtí stoupá 4,07krát (95% interval spolehlivosti 1,97 – 8,43).
- Nulová hypotéza – riziko úmrtí je shodné u všech pěti protokolů léčby – se zamítá (p = 0,001).
- Protokol KDO88 zvyšuje riziko úmrtí proti protokolu KDO86 signifikantně (p = 0,014). Relativní riziko úmrtí stoupá 3,83krát (95% interval spolehlivosti 1,32 – 11,098).
Diskuze
Protokol KDO86 se jeví jako překvapivě dobrý jak v OS, tak v EFS. Nebereme ovšem v úvahu, že děti byly léčeny 2 roky s vyšší kumulativní dávkou chemoterapie a zejména s radioterapií při nejčetnějším, prvním klinickém stadiu. Sekundárních malignit je v našem souboru zatím zanedbatelné množství – jedna. Takto malý výskyt neumožňuje statistické hodnocení. Při průměrné době sledování 13,1 roku je prevalence okolo 0,32 %. To přibližně odpovídá udávanému kumulativnímu riziku malignity 0,65 % pro 15leté přežití u pacientů zahrnutých do studie SIOP mezi roky 1971 a 1987. Severoamerická studie NWTSG udává kumulativní riziko malignity za 15 let 1,6 % [9].
Tentýž zdroj udává incidenci sekundárních malignit především v první dekádě (zkoumá ovšem jejich výskyt za první tři dekády života pacientů). Očekávat postupné horšení křivek přežití u protokolu KDO86 proti novějším, šetrnějším léčebným protokolům není příliš pravděpodobné. Otázkou je vývoj přežití s odstupem více dekád.
Gatta et al [10] srovnali pětiletá přežití nefroblastomu diagnostikovaného v letech 1985 – 1989 u pacientů pod 15 let věku. Evropa N = 951, odhad přežití 83 % s intervalem spolehlivosti 80 – 85 %, v západních zemích Evropy odhad přežití 85 % s intervalem spolehlivosti 82 – 87 %, naproti tomu v USA bylo přežití signifikantně vyšší – odhad 90 % s intervalem spolehlivosti 86 – 94 % (ovšem při ne zcela reprezentativním nízkém počtu dětí, N = 221). Stanovili jsme proto pětiletý odhad přežití našich pacientů diagnostikovaných v identickém období, kteří byli v den diagnózy mladší 15 let. Odhad přežití je 84,7 % s intervalem spolehlivosti 76 – 93 %. Výsledek není signifikantně odlišný ani od Evropy, ani od USA.
Porovnání odhadů pětiletého přežití (v tab. 8) ukazuje přechodný pokles, vyrovnaný zřejmě až s protokolem SIOP93, používaným v letech 1994 – 2001. Protokol SIOP9, používaný u nás v letech 1988 – 1993, má signifikantně horší celkové přežití jak proti původnímu protokolu KDO86, tak proti novějšímu SIOP93.
Ve srovnání s multicentrickou studií ze SRN [11] hodnotící podstatně větší soubor 440 pacientů (proti našim 96) léčených protokolem SIOP9 jsou naše výsledky horší: pětileté přežití německých pacientů 89,5 % (CI 86,6 – 92,4 %) proti našemu 77,1 ± 4,3%. Statistika malých čísel ale může být zavádějící. Protokol SIOP93 už má v našich datech signifikantně lepší OS než jeho předchůdce SIOP9. OS všech stadií dosahuje 93,83 % ± 2,7, což je hodnota srovnatelná s evropskými výsledky [2].
Výsledky USA (zdroj National Cancer Institute – SEER [12]) přitom udávají pro období 1985 – 1994 pětiletý OS 92 % u pacientů s WT ve věku do 15 let, tedy hodnoty obdobné protokolu KDO86 a posledním dvěma protokolům používaným od roku 1994 dodnes.
Také EFS se významně neliší od výsledků publikovaných De Krakerem et al [13].Protokolem SIOP2001 nebylo léčeno dost pacientů na to, abychom mohli zjistit statisticky významný rozdíl, trend OS jej řadí do skupiny podobné protokolu SIOP93 s další redukcí délky terapie převažujících nižších klinických stadií.
Závěr
Ze zpětného pohledu na výsledky našeho pracoviště se může jevit krok ke změně protokolu z KDO86 na KDO88 (nezářit lůžko ledviny při klinickém stadiu I a II) a dále na SIOP9, zkracující délku léčby, sporný. Po přijetí protokolu SIOP9 se oproti očekávání založenému na výsledcích multicentrických studií signifikantně zhoršilo jak celkové přežití, tak přežití bez události. Přesnou příčinu nezjistíme, výsledky mohou být zatíženy chybou malých čísel nebo přesností určení klinického stadia a histologického typu. Porovnání s německými výsledky ukazuje, že od roku 1994 jsou naše léčebné výsledky srovnatelné [11]. Horší výsledky v předchozím období lze vysvětlit hlavně obtížnou dostupností některých zobrazovacích metod nezbytných k určení klinického stadia, které bylo vyrovnáno až počátkem 90. let. To by mohlo být v budoucnu podstatně usnadněno novými genetickými metodami dále zpřesňujícími stratifikaci léčby [6]. Percentuální zastoupení pacientů podle klinických stadií v jednotlivých obdobích odpovídajících léčebnému protokolu není signifikantně rozdílné. Data ale ukazují signifikantní zlepšení celkového přežití předposledního protokolu (SIOP93) a trend obdobného výsledku posledního protokolu (SIOP2001) proti hodnotám původní dvouleté, radioterapií zatěžující léčby. Minimalizace pozdních následků je přitom patrná i v našich datech [7]. To v dlouhodobém důsledku jasně kvalifikuje více dekád trvající úsilí o optimalizaci léčby na základě multicentrických studií jako opodstatněné. Za nutné považujeme v souladu s písemnictvím také důsledně sjednotit klasifikaci a staging WT (které nejsou podle NWTS a SIOP zcela shodné) i popisnou statistiku úspěšnosti léčby WT všech klinických stadií současně u multicentrických studií.
Práce vznikla za podpory grantu NR 8796-3 IGA MZČR.
This work was supported by the grant No. NR 8796-3 IGA of the Czech Ministry of Health.Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.MUDr. Josef Mališ
Klinika dětské hematologie a onkologie
2. LF UK a FN Motol
V úvalu 84
150 06 Praha 5
e-mail: josef.malis@lfmotol.cuni.cz
Zdroje
1. Kalapurakal JA, Dome JS, Perlman EJ et al. Management of Wilms‘ tumour: current practice and future goals. Lancet Oncol 2004; 5(1): 37 – 46.
2. Metzger ML, Dome JS. Current Therapy for Wilms’ Tumor. The Oncologist 2005; 10(6): 815 – 826.
3. D’Angio JG. Pre ‑ or Postoperative Therapy for Wilms’ Tumor? J Clin Oncol 2008; 26(25): 4055 – 4057.
4. Vujanić GM, Kelsey A, Mitchell C et al. The role of biopsy in the diagnosis of renal tumors of childhood: Results of the UKCCSG Wilms tumor study 3. Med Pediatr Oncol 2003; 40(1): 18 – 22.
5. Breslow NE, Ou SS, Beckwith JB et al. Doxorubicin for favorable histology, Stage II – III Wilms tumor: results from the National Wilms Tumor Studies. Cancer 2004; 101(5): 1072 – 1080.
6. Kaste SC, Dome JS, Babyn PS et al. Wilms tumour. prognostic factors, staging, therapy and late effects. Pediatr Radiol 2008; 38(1): 2 – 17.
7. Radvanský J, Radvanská J, Slabý K et al. Pozdní následky Wilmsova tumoru a jeho léčby u pacientů léčených v letech 1980 – 2001 na jediném pracovišti. Klin Onkol 2010; 23(4): 245 – 255.
8. Radvanská J, Slabý K, Hladíková M et al. Léčebný úspěch onkologické léčby pacientů v dlouhodobé remisi Hodgkinovy choroby léčených v letech 1980 – 1999 na klinice dětské onkologie. Klin Onkol 2004; 17(2): 51 – 56.
9. Carli M, Fanscella E, Tournande MF et al. Second malignant neoplasms in patients treated on SIOP Wilms tumour studies and trials 1, 2, 5, and 6. Med Pediatr Oncol 1997; 29(8): 239 – 244.
10. Gatta G, Capocaccia R, Coleman MP et al. Childhood cancer Survival in Europe and the United States. Cancer 2002; 95(8): 1767 – 1772.
11. Weirich A, Ludwig R, Graf N et al. Survival in nephroblastoma treated according to the trial and study SIOP ‑ 9/ GPOH with respect to relapse and morbidity. Ann Oncol 2004; 15(5): 808 – 820.
12. SEER: Surveillance, Epidemiology and End Results. SEER Pediatric Monograph. Cancer Incidence and Survival among Children and Adolescents: United States SEER Program 1975 – 1995. National Cancer Institute 2004. [http:/ / seer.cancer.gov/ publications/ childhood].
13. De Kraker J, Graf N, Van Tinteren H et al. Reduction of postoperative chemotherapy in children with stage I intermediate ‑ risk and anaplastic Wilms‘ tumour (SIOP93 – 01 trial): a randomised controlled trial. Lancet 2004; 364(6): 1229 – 1235.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2010 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Úskalí diagnostiky Kaposiho sarkomu sdruženého s HIV infekcí
- Detekcia hypermetylácie DNA ako potenciálny biomarker pre karcinóm prostaty
- Hand‑ foot syndrom po podání inhibitorů tyrozinkinázové aktivity
- Role membránových transportérů v chemorezistenci karcinomu pankreatu při terapii gemcitabinem
- Incidence a mortalita nádorových onemocnění v České republice
- 18F‑ FDG PET/ CT v diagnostice mnohočetného myelomu a monoklonální gamapatie nejistého významu: srovnání s 99mTc‑ MIBI scintigrafií
- Léčebné výsledky pacientů léčených v letech 1980– 2004 na jediném pracovišti pro nefroblastom
- České programy screeningu zhoubných nádorů v roce 2010
- Mukoepidermoidní karcinom dutiny nosní – vzácný nádor
- Kazuistika pacientky s triple negativním karcinomem prsu, která při léčbě paklitaxelem a bevacizumabem dosáhla kompletní remise plicního, uzlinového a kostního metastatického postižení
- Klinický registr TARCEVA
- Gefitinib v monoterapii u nemocných s pokročilým NSCLC nesoucím aktivující mutaci EGFR zlepšuje významně léčebné výsledky oproti standardní chemoterapii – aktualita z klinické praxe
- Profesor Koutecký osmdesátiletý
- Zápis ze schůze výboru České onkologické společnosti dne 21. 9. 2010 v Liberci
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Úskalí diagnostiky Kaposiho sarkomu sdruženého s HIV infekcí
- Hand‑ foot syndrom po podání inhibitorů tyrozinkinázové aktivity
- Mukoepidermoidní karcinom dutiny nosní – vzácný nádor
- 18F‑ FDG PET/ CT v diagnostice mnohočetného myelomu a monoklonální gamapatie nejistého významu: srovnání s 99mTc‑ MIBI scintigrafií
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



