-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vliv kouření a volných radikálů na antioxidační ochranu a na patogenezi některých nemocí
Influence of smoking and free radicals on antioxidant defence and on the pathogenesis of certain diseases
Cigarette smoke leads to the production of a large number of different free radicals, especially superoxide, alkoxy - and alkyl - radicals and free hydroxyl radicals. Antioxidant defence must be complex, i.e. a mixture of different substances. Smoking injures intracellular antioxidant balance, decreases the levels of glutathione, ascorbic acid, glutathione peroxidase and catalase. β-carotene, lutein, zeaxanthin and others are decreased in the extracellular fluid. The most dangerous complications of smoking in the respiratory pathways are inflammatory reactions, proliferation of cells, carcinoma cells, emphysema, and chronic obstructive pulmonary disease. Decrease of antioxidants, increase of asymmetric dimethylarginine, of lipoperoxidation, of endothelin and peroxynitrite are the most important laboratory findings of damage. Another complication is endothelial dysfunction. Nitric oxide production is decreased, as is the dilatation of vessels; apoptosis of endothelial cells is increased, and the differentiation and function of endothelial cells is impaired. There are many causes for the acceleration of atherosclerosis, but oxidative stress is one of the most dangerous. Oxidated and altered LDL-cholesterol contributes to the formation of foam cells. Activated myeloperoxidase produces hypochloric acid, the substrate for which is not only hydrogen peroxide, but also thiocyanate from tobacco. Free radicals oxidate and mutate DNA leading to an increased incidence of carcinomas. Free radicals and reactive oxygen species decrease the fertility of spermatozoa, and in pregnancy can damage the development of the foetus, they also encourage the origin of neurological and psychiatric diseases (Parkinson’s disease, Alzheimer’s disease, hemodynamic and inflammatory diseases of the brain, they evoke the pain etc.). Macular degeneration of the eyes, certain dental, gastrointestinal, renal, orthopaedic and skin diseases, and damage to cochlear epithelial cells due to noise are some of other possibilities of damage due to cigarette smoke.
Key words:
smoking, free radicals, antioxidants, oxidative stress, diseases induced by cigarette smoke.
Autoři: V. Holeček 1; R. Rokyta 2
Působiště autorů: Oddělení klinické biochemie a hematologie Mulačova nemocnice s. r. o., Plzeň Přednosta: prim. MUDr. Štěpánka Sobotová 1; Ústav normální, patologické a klinické fyziologie 3. lékařská fakulta UK, Praha Přednosta: prof. MUDr. Richard Rokyta, DrSc. 2
Vyšlo v časopise: Prakt. Lék. 2008; 88(1): 22-30
Kategorie: Postgraduální vzdělávání
Souhrn
Kouřením cigaret vzniká velké množství různých volných radikálů, zvláště superoxid, alkoxylové a alkylové radikály a volný hydroxylový radikál. Antioxidační obrana musí být komplexní, tj. směsí různých substancí. Kouření poškozuje intracelulární antioxidační rovnováhu, snižuje hladinu glutathionu, kyseliny askorbové, glutathion peroxidázy a katalázy. V extracelulární tekutině je snížený β-karoten, lutein, zeaxanthin a jiné. V respiračním traktu zánětlivé reakce, proliferace buněk, karcinomatózní buňky, emfyzém a chronické obstrukční plicní onemocnění jsou nejnebezpečnější důsledky kouření. Pokles antioxidantů, vzestup asymetrického dimetylargininu, lipoperoxidace endothelinu a peroxynitritu jsou nejdůležitější laboratorní známky poškození. Jinou komplikací je endoteliální dysfunkce. Tvorba oxidu dusnatého a dilatace cév jsou snížené, zvýšená je apoptóza endoteliálních buněk, poškozená je diferenciace a funkce endoteliálních buněk. Akcelerace aterosklerózy má více příčin, ale oxidační stres patří k nejnebezpečnějším. Oxidovaný a modifikovaný LDL-cholesterol přispívá k tvorbě pěnových buněk. Aktivovaná myeloperoxidáza vytváří kyselinu chlornou, substrátem není jen peroxid vodíku, ale i tiocyanát z tabáku. Volné radikály oxidují a mutují DNA se zvýšeným výskytem karcinomů. Volné radikály a ROS látky snižují fertilitu spermatozoí, v těhotenství mohou poškodit vývoj fétu, podporují vznik neurologických a psychiatrických onemocnění (Parkinsonovu a Alzheimerovu chorobu, hemodynamické a zánětlivé choroby mozku, vyvolávají bolest aj.). Makulární degenerace očí, některé stomatologické, gastrointestinální, renální, ortopedické a kožní nemoci a poškození kochleárních epiteliálních buněk následkem hluku jsou dalšími možnostmi poškození účinkem cigaretového kouře.
Klíčová slova:
kouření, volné radikály, antioxidanty, oxidační stres, choroby působené cigaretovým kouřem.Úvod
V cigaretovém kouři je obsaženo více než 1 000, někteří autoři uvádí dokonce až 4 000 různých látek. Kouření je velkým zdrojem volných radikálů. Jedna cigareta představuje příjem 1017volných radikálů. Volné radikály z cigaretového kouře jsou hlavně superoxid a alkoxylové a alkylové radikály, volný hydroxylový radikál, různé organické radikály, ale i ROS látky (reactive oxygen species), které sice narozdíl od volných radikálů nemají volný nepárový elektron na své valenční sféře, ale chovají se podobně. Patří k nim například peroxid vodíku, který proniká i přes buněčné membrány, dále singletový kyslík, elektronicky excitovaný stav kyslíku s chemickou reaktivitou, aj. Všechny tyto látky jsou velmi reaktivní. Jeden z nejagresivnějších volných radikálů – volný hydroxylový radikál (OH.) – má poločas jen 10-9s.
Biochemické reakce působené volnými radikály z cigaretového kouře
Volné radikály z cigaretového kouře působí lipoperoxidaci těch mastných kyselin, které obsahují konjugované dieny. Vzniklé produkty lipoperoxidace neslouží již jako plnohodnotné lipidy, některé mají i velmi škodlivé účinky (např. aldehydy jako malondialdehyd, hydroxynonenal, aj. jsou kancerogenní). Produkty lipoperoxidace jsou i peroxidy a lipofusciny, které se postupně ukládají (stařecké zabarvení kůže). Podobně jako u lipoperoxidace poškozují volné radikály bílkoviny, oxidované proteiny jsou odbourávány, jejich množství lze stanovit jako karbonyly.
Superoxid s oxidem dusnatým tvoří peroxynitrity, které nitrují organické molekuly, a tím je poškozují. Prokazují se obvykle jako nitrotyrosiny. Glycidy v pří-tomnosti VR tvoří škodlivé AGE-látky (advanced glycation end-products). Bílkoviny s dlouhým poločasem jsou touto přeměnou nejvíce poškozeny (např. myelin z nervové tkáně, bílkoviny retiny, glomerulární membrány, cévního endotelu – tedy orgány postižené nejčastěji u diabetu). Dusíkaté baze DNA a RNA mohou být volnými radikály mutovány, což může způsobit zhoubné bujení.
Nerovnováha mezi oxidanty a antioxidanty ve prospěch volných radikálů se nazývá oxidační stres. Markerem oxidačního stresu jsou mj. F(2)-izoprostany i ve vydechovaném vzduchu, které u kuřáků korelují s BMI, zvláště u astmatiků. Většina volných radikálů vzniká intracelulárně, a proto ochrana antioxidanty v tomto prostoru je mimořádně důležitá. Kuřáci mají snížené hladiny antioxidačních enzymů superoxiddismutázy (SOD) a katalázy v erytrocytech. Cigaretový kouř totiž inhibuje katalázu, a tím zvyšuje oxidační stres. Vystavení vyšším koncentracím cigaretového kouře zvyšuje náchylnost erytrocytů na poškození peroxidy. U kuřáků v krvi stoupají karbonyly, ale klesají vitamin C, sulfhydrilové skupiny, glutathionperoxidáza (GPx), kataláza a redukovaný glutathion (GSH) v erytrocytech (7), tedy i celková antioxidační kapacita (AOC).
Kuřáci, a to i pasivní, mají signifikantně snížený β-karoten v plazmě a signifikantně zvýšený γ-tokoferol. Kuřáci mají narozdíl od pasivních kuřáků i snížený β-kryptoxantin, kyselinu askorbovou, lutein a zeaxantin. Lykopen, γ-tokoferol a retinol nemají hladiny signifikantně odlišné od nekuřáků. Ovšem podání vitaminu E zvýší jeho hladinu více u nekuřáků než u kuřáků. Kadmium z cigaret snižuje v buňkách hladinu GSH a ATP. Glutathion chrání před toxickým vlivem kadmia. Kouření snižuje obranný mechanismus před singletovým kyslíkem, který má schopnost pronikat přes buněčnou membránu a je velmi reaktivní vůči biomolekulám a může působit ventrikulární tachykardii až arytmie. Dále působí i progresivní neuronální degeneraci. Oxidační poškození, aktivace destiček a zánět jsou známkami patofyziologických změn ve stáří s poruchou mobility a zvýšenou mortalitou.
Přestane-li kuřák s kouřením, upraví se poměrně brzy hladina vitaminu C, γ-tokoferolu, β-karotenu, ale i antioxidační kapacita (AOC) v plazmě, ale nikoliv oxidace LDL-cholesterolu a dalších ukazatelů.
Detoxikace volných radikálů
Odstraňování volných radikálů z organismu probíhá několika způsoby:
- pomocí antioxidantů, které výrazně zpomalují radikálové reakce, nebo
- volné radikály jsou pevně zachycovány jinými molekulami a tak zneškodněny (quenching), nebo
- reakcí dvou volných radikálů spolu zanikají, nebo
- mohou být vylučovány z organismu (např. močí, stolicí aj.).
Je důležité mít na paměti, že ne každý antioxidant zneškodňuje jakýkoliv volný radikál. Proto účinná bývá hlavně směs antioxidantů. Tak kupř. SOD (superoxiddismutáza) katalyzuje přeměnu superoxidu na peroxid vodíku, ale už nemá žádný účinek např. na volný hydroxylový radikál. Zneškodnění volných radikálů obvykle probíhá v několika reakcích. Přitom kyselina askorbová se mění na radikál kyseliny askorbové, vitamin E na radikál tokoferolový, atd. Až v závěru redukovaný glutathion (GSH) je volným radikálem oxidován, ale hned následně zpět redukován na GSH za katalytického účinku glutathionreduktázy v přítomnosti NADPH (obr. 1).
Obr. 1. GS – glixylový radikál GSSG – oxidovaný glutation NADPH – redukový NADP NADP – nikotinamidadenindinukleotid fosfát glutation reduktáza 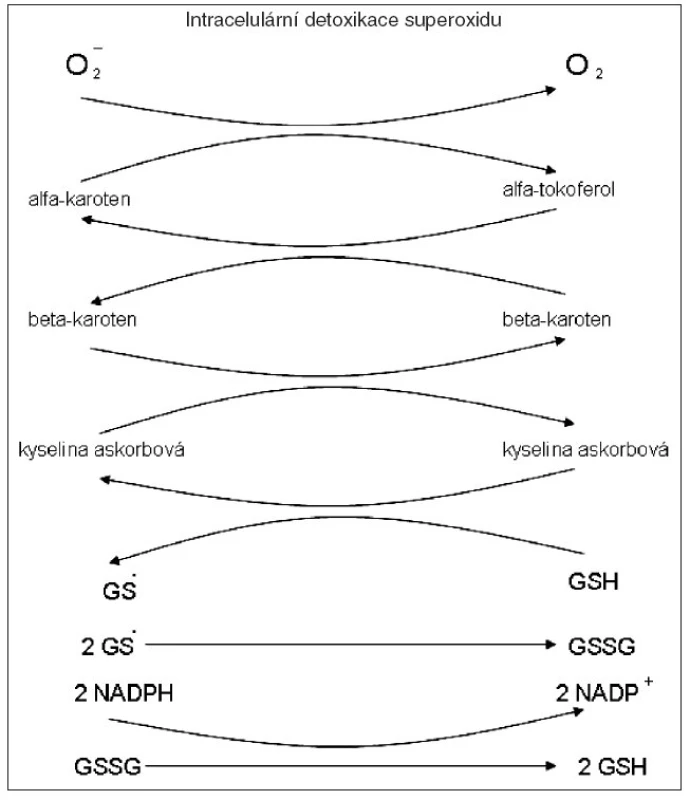
Nejdůležitějšími nitrobuněčnými antioxidanty jsou glutathion a selenoenzym thioredoxin reduktáza. Vlivem volných radikálů z kouření stoupají TBARS (thiobarbituric acid reactive substances – markery lipoperoxidace). U mladých kuřáků dokonce kompenzačně může glutathion přechodně stoupnout. U diety se sníženým příjmem proteinů jsou biochemické nálezy u kuřáků horší.
Účinek kouření na respirační cesty
Ačkoliv kyslík je nutný k životu, jeho vysoká koncentrace je pro buňky zvláště v plicích nebezpečná, proto buňky musí být chráněny antioxidanty. Částečky z cigaretového kouře ulpívají na povrchu epiteliálních plicních buněk, adhezi mohou snížit scavengery ROS. Cigaretový kouř podporuje fibrogenní účinek azbestu. Částečky z kouře, ale i ozón zvyšují zánětlivou reakci, zvětšují proliferaci buněk a uvolňují zvýšené hladiny chemoatraktivních a vaskulárních mediátorů, jako např. endotelinu (8).
Nejdůležitějšími antioxidanty v plicích jsou glutathion, vitaminy C a E, beta-karoten, kyselina močová a enzymy SOD, kataláza a peroxidázy. Dále jsou to různé proteiny jako peroxiredoxiny, thioredoxiny, glutaredoxiny a hemové oxygenázy a reduktázy. Poruchy oxidoredukční rovnováhy mohou podporovat onemocnění plic, jako chronickou obstrukční plicní nemoc (CHOPN), astma, idiopatickou plicní fibrózu, aj. Např. u kuřáků s pneumónií ve vydechovaném vzduchu jsou zvýšené TBARS jako následek účinku volných radikálů, ale je snížený peroxid vodíku. U astmatu je deregulována iNOS (nitroxid syntáza), a tito lidé exhalují jen nízké koncentrace NO. Nikotin zvyšuje arginázu I a ornithin dekarboxylázu v dýchacích cestách, což může mít souvislost s CHOPN. Kouření interferuje s metabolismem L-argininu a NO. U kuřáků je vyšší hladina asymetrického dimetylargininu v plazmě, což je rizikový faktor kardiovaskulárních chorob (17).
ROS stoupají v dýchacích cestách při inhalaci čistého kyslíku nebo cigaretového kouře, což podporuje vznik tracheobronchitidy. U kuřáků se aktivují makrofágy, což je ovšem klíčový projev zánětlivé reakce. Makrofágy stimulující protein (MSP) zvyšují produkci superoxidu, uvolňování cytokinů IL-1, IL-10, TNF a aktivaci NF-B. Tento účinek lze snížit protilátkou proti MSP. Jako první obrana proti ROS účinkuje extracelulární glutathionperoxidáza, kterou syntezuje epitel dýchacích cest a alveolární makrofágy do povrchového epiteliálního bronchiálního sekretu. NO, produkovaný NO syntázou 2 se rychle váže na ROS a vytváří volné dusíkaté radikály (RNS). Těžcí kuřáci mají sníženou schopnost alveolárních makrofágů produkovat ROS. Efekt glukokortikoidů snižovat produkci ROS buňkami bronchoalveolární laváže u CHOPN se však nejeví jako významný.
Epiteliální buňky na alveolárním povrchu lidských dolních cest dýchacích jsou zranitelné toxickými oxidanty. I když tyto buňky obsahují intracelulární antioxidanty, jejich ochrana před oxidanty bývá neschopná ochránit epiteliální povrch. Proto epiteliální bronchiální sekret dolních cest dýchacích obsahuje velké množství sulfhydrilových skupin, speciálně redukovaného glutathionu. Toho je z celkového množství glutathionu 96 % v redukované formě a je jej 140x více než v plazmě téhož člověka. Kuřáci jako kompenzaci oproti nekuřákům mají v bronchiálním sekretu více GSH, a toto množství obvykle stačí chránit buňky před přebytkem ROS, hlavně peroxidem vodíku.
Reakce myeloperoxidázy a peroxidu vodíku má schopnost inaktivovat inhibitor alfa 1 proteinázy, takže se porušuje proteázová a antiproteázová rovnováha v plicích. Ochranu před oxidativní inaktivací inhibitoru alfa 1 proteinázy, a tím kuřáckého emfyzému, skýtá glutathion, který odstraňuje hlavně v této reakci peroxid vodíku. Kuřáci mají i zvýšený počet neutrofilů v dolních cestách dýchacích. Velkou roli hrají v patogenezi emfyzému alveolární makrofágy. V dolních cestách dýchacích nastane relativní převaha neutrofilní elastázy nad anti-neutrofilní elastázou, hlavně zastoupenou alfa-1-antitrypsinem. Elastáza tak může poškozovat alveolární struktury a vyvolat plicní emfyzém.
Na inaktivaci alfa-1-antitrypsinu se podílí hlavně alveolární makrofágy kuřáků, které produkují superoxid a peroxid vodíku v mnohem větší míře než u nekuřáků, také proto, že je snížená antioxidační kapacita alveolárních makrofágů hlavně u starších kuřáků. Superoxid s oxidem dusnatým reaguje vznikem peroxynitritu (ONOO-), který může nitrovat makromolekuly. Už po 3 vdechnutích cigaretového kouře alveolární makrofágy produkují do 30 minut peroxynitrit! Při vdechnutí kouře je poměr NO/ONOO- 2 : 1, ale ve vydechovaném vzduchu 1 : 9. Ve vydechovaném vzduchu je též pentan, který vzniká z 6 - PUFA (polynenasycené mastné kyseliny) a etan z 3-PUFA. Množství etanu je úměrné kouření, v játrech se etan odbourává pomaleji než pentan. Snížená je mj. aktivita Cu, Zn-SOD, glutation S-transferázy a glutation-peroxidázy. Peroxynitrit nitruje tyrosin na 3-nitrotyrosin, modifikuje tak plazmatické lipoproteiny a podporuje vznik aterosklerózy. Protektivně může působit SOD a kataláza, které snižují inaktivaci alfa-1-antitrypsinu.
Cigaretový kouř se uvádí jako častá příčina plicního emfyzému, který ale nevzniká u všech kuřáků. Oxidační stres je příčinou poškození alveolárních fibroblastů, ale existuje individuální variabilita mezi lidskými fibroblasty, a proto i velké rozdíly ve velikosti poškození plic. Za smrt fibroblastů u kuřáků je zodpovědný oxidační stres a apoptóza. Zřejmě záleží na GSH, případně podaném N-acetyl-L-cysteinu, které chrání fibroblasty před poškozením (2). N-acetyl-L-cystein však může mít i určité vedlejší prooxidační účinky. Cigaretový kouř zvětšuje indukci respiračních mucinů prozánětlivými stimuly u chronické obstrukční plicní nemoci (CHOPN) a přispívá k hyperprodukci mucinu (1).
Ve Skotsku po zákazu kouření ve veřejných místnostech poklesl počet respiračních a sensorických symptomů u zaměstnanců o téměř 25 %. Snížil se i počet bílých krvinek, zlepšily se i některé spirometrické hodnoty, je méně zánětů dýchacích cest a snížilo se i množství exhalovaného NO v dechu. V Kanadě z kuřáků je asi 30 % astmatiků. Při hypoxii jak β-karoten, tak γ-tokoferol a kyselina askorbová mají antioxidační schopnost. Jejich směs má silnější antioxidační účinek než jednotlivé složky. Při vysoké tenzi kyslíku však stoupá lipoperoxidace, oxidace proteinů i poškození DNA, vzniká tedy prooxidační účinek.
Nádorová onemocnění podporovaná kouřením
Jednou z příčin vzniku nádorů jsou nepochybně právě volné radikály. Mohou těžce poškodit DNA a/nebo DNA mutovat. Poškození DNA (double-strand breaks) jsou potenciální mutagenní/kancerogenní následky cigaretového kouře. Množství poškozených DNA je úměrné vylučování nikotinu a kotininu močí kuřáků, počtu vykouřených cigaret a nepřímo úměrné buněčné koncentraci GSH. Kapacita opravy DNA je nejrychlejší u nekuřáků (5). Tato poškození snižují N-acetyl-L-cystein nebo glutathion. Např. oxidací -NH2 skupiny na -OH volným hydroxylovým radikálem vzniká oxidovaný adenin, který se váže místo s thyminem na cytosin, nebo oxidací guaninu se tento místo vazby na cytosin váže na adenin. Některé z mutací mohou vést k nádorovému bujení. Význam v kancerogenezi může mít i schopnost metylace cytosinu, která ve stáří ubývá.
Ozářením vodného roztoku cigaretového kouře stoupá množství volného hydroxylového radikálu (OH) a oxidační stres u kuřáků zvyšuje i množství vyloučeného 8-hydroxy-deoxyguanosinu (8-OHdG) močí. Katechol a hydrochinon z extraktu redukují kyslík na superoxid a posléze na peroxid vodíku. Metylované dihydroxybenzeny jsou více cytotoxické než hydrochinon a katechin. Nikotin poškozuje DNA, ale méně než fenolická frakce kouře.
Neoplastické buňky vznikají např. poruchou diferenciace buněk nebo poruchou apoptózy. Volné radikály podporují účinek kancerogenů, brání přirozené apoptóze, ale na druhé straně mohou i pomoci léčit již vzniklé nádory. Toho se využívá např. při RTG ozařování nádorů, pomocí volných radikálů ničí T-lymfocyty nádorové buňky, některá cytostatika fungují jako volné radikály (adriamycin, cis-platina, aj.). Význam antioxidantů k obraně proti nádorovému bujení je nepochybný, ale antioxidanty mohou i chránit nádorové buňky, které dovedou z extracelulární tekutiny absorbovat antioxidanty lépe než buňky zdravé.
Kouř z cigaret potlačuje tvorbu plicních T-lymfocytů, takže se zvyšuje náchylnost k respiračním infekcím a vzniku nádorů. Vystavení lidských T-buněk dehtu z cigaret působí okamžitý pokles syntézy DNA.
Důležitá je též angiogeneze. Bez cévního zásobení nemůže nádor vyrůst více než na velikost 1 mm3. Zdá se, že angiogenezi snižují i volné radikály podobně jako kyselina g-linolenová a 2-methoxyestradiol (3).
U nádorů se často objevuje fenomén zvýšené aktivity SOD, která produkuje peroxid vodíku. Ten však není dostatečně odbouráván glutathionperoxidázou a katalázou, a tak podporuje množení nádorových buněk a je i substrátem pro myeloperoxidázu.
Myeloperoxidáza může přímo kontrolovat cévní odpověď na zánět tím, že reguluje dosažitelnost oxidu dusnatého. Ovšem myeloperoxidáza produkuje kyselinu chlornou, která podporuje oxidační poškození tkání, a tím nejen možnost vzniku karcinomu, ale i aterosklerózy, aj.
Bronchopulmonální epiteliální buňky představují první a nejdůležitější linii ochrany před cigaretovým kouřem. Cigaretový kouř lze rozdělit na 2 fáze: plynnou a pevnou (dehet). Obě jsou škodlivé a obsahují vysoké koncentrace toxických a karcinogenních látek. V méně kvalitních cigaretách mohou být i pesticidy.
Plynná fáze působí hlavně na bronchopulmonální epiteliální buňky. Na každých 500 ml vdechnutého vzduchu při kouření připadá asi 350 ml cigaretového kouře. 350 ml se vydechne a 150 ml se dostane do bronchů. Při každém vdechu bez kouře se zředí cigaretový kouř cca 14x, dokud opět se nevdechne další kouř. Denně průměrný člověk inhaluje přibližně 1010 prachových částic. Toto množství se výrazně zvyšuje u kuřáků.
Dehtové částečky o průměru 0,2–5 μmm se deponují v tekutině, která pokrývá řasinky bronchopulmonálního epitelu. Mucus, který je zdrojem důležitých antioxidantů, chrání dýchací cesty od trachey až po konec bronchiolů. Každá bronchoepiteliální buňka má 200 řasinek. Tyto řasinky se kontinuálně pohybují směrem k laryngu a odstraňují mucus. Dehtové částečky zvyšují produkci mucusu a aktivují čistící mechanismus. Pokud je tento ochranný účinem řasinek toxickými látkami poškozen, takže je jejich pohyb paralyzován, stávají se buňky cílem toxických a kancerogenních částeček. Ztráta řasinek nastává např. účinkem akroleinu nebo oxidu dusičitého. Mucus není odstraňován, mění svou viskozitu, řasinky se totiž nepohybují. Tak může lokálně vzniknout příznivá situace pro vznik nádoru.
Plynná fáze cigaretového kouře obsahuje genotoxické komponenty a inhibitory opravy DNA. Toxické a kancero-genní látky v cigaretovém kouři jsou některé uhlohydráty (etylén, butadien, izopren, aj.), aldehydy a ketony (acetaldehyd, akrolein, aceton, aj.), nitrily a aminy (etylnitril, fenylamin, aj.), aromatické uhlohydráty (benzen, toluen, styren, aj.), heterocyklické sloučeniny obsahující kyslík (furany, aj.) a další plynné i ne-or-ganické látky (oxid siřičitý, oxid uhelnatý, amoniak, kyanovodík, aj.). Např. benzen působí chromozomální mutace a zlo-my obou šroubovic DNA, takže nemůže dojít k jejich reparaci. Některé látky se stávají karcinogeny až při metabolické pře-měně v orga-nismu, např. 1,3-butadien se mění na mutagenní a karcinogenní epoxidy.
Dehtové částečky se ukládají subepiteliálně, v plicním intersticiu apod., dlouhodobě pak na povrchu epitelu v době, kdy řasinky jsou poškozeny. Anorganické karcinogenní látky z kouře jsou – byť v malé koncentraci – šestimocný chrom, arsen, olovo, rtuť, nikl a kadmium v ionizované formě. Kancerogenita následkem kovů je hlavně způsobena produkcí ROS. Ovšem ani vyšší koncentrace kovů nemusí způsobit vznik karcinomu, nejsou-li přítomny dehtové látky.
Inhalované kovy nelze degradovat a jsou ukládány na různá místa plicní tkáně. Některé kovy jako zinek, měď, železo a vápník participují v důležitých buněčných aktivitách jako je kontrola genové transkripce, vodivost nervů, příjem kyslíku, v některých enzymových funkcích, kontrole buněčné apoptózy, apod. Některé toxické kovy mohou nahradit tyto prvky, následkem čehož jsou poškozeny vitálně důležité funkce. Dokonce v některých případech i biologicky užitečné kovy se mohou stát toxickými.
Šestimocný chrom ve formě chromanu snadno proniká buněčnými membránami, asi iontovými kanály. Má mutagenní, genotoxické a karcinogenní účinky. Pro vznik karcinogenního účinku musí být asi šestimocný chrom redukován, a to zřejmě i užitečnými látkami jako kyselinou askorbovou, NADPH, GSH, glutathion reduktázou, aj. Reakcí pěti-, čtyřmocného, ale i trojmocného chromu s peroxidem vodíku vzniká volný hydroxylový radikál, který poškozuje DNA, např.:
CrIII + H2O2 → CrVI + 2 (OH.)
Tumor supresivní protein p53 hraje důležitou roli v ochraně buněk před onkogenním poškozením. CrVI, NADPH a SOD a následně (OH.) aktivují p53 v lidských epiteliálních buňkách. Volný hydroxylový radikál (OH.) však účinkem na guanin vytvoří 8-hydroxyguanosin, který je považován za marker karcinogenního účinku ROS. CrVI může způsobit apoptózu. Mutace genu p53 usnadňují rezistenci k apoptóze. Tedy ROS vzniklé účinkem CrVImají dvojí roli v karcinogenezi. Jednak působí genetické poškození, jednak apoptózu.
Kadmium patří mezi velmi toxické látky v cigaretovém kouři. Jeho karcinogenní účinek má vztah k produkci ROS. Hladina kadmia v tukové tkání je u kuřáků cca 4x vyšší než u nekuřáků (10ng/g), v plicní tkáni cca 3x vyšší. Poločas setrvání kadmia v lidských plicích je delší než 9 let. Kadmium působí deregulaci genu, oxidační stres, inhibici opravy DNA (opačně působí Zn) a podílí se na apoptóze. Působení kadmia na buňky vyvolá expresi mnoha stresových genů, např. pro „heat shock proteiny“, pro syntézu glutathionu, aj. V bílkovinách obsahujících zinek ho může nahradit kadmium. Proti toxicitě a karcinogenezi kadmia působí glutathion, respektive enzymy, které toxicitu kadmia eliminují, tj. glutamino-cystein syntáza a glutathion-S-transferázy. Časté vystavení kadmiu snižuje blahodárný účinek glutathionu a je potlačena exprese genů pro SOD a katalázu. Kadmium též zvyšuje hladinu intracelulárního vápníku. Karcinogeneze kadmia zahrnuje dále E-cadherin, molekulu, která reguluje buněčnou permeabilitu a polaritu.
Nikl je další složkou tabáku, který ho absorbuje z půdy. Nikl váže histony a působí oxidační poškození DNA.
Pre-neoplastické změny v plicích bývají stacionární, nebo dokonce mohou regredovat, ovšem část se může akumulovat a progredovat v invazívní karcinom (14).
Celková antioxidační aktivita má pochopitelně svůj význam v prevenci nádorů. Je zajímavé, že její hodnota je mj. závislá i na genetické výbavě jednotlivce. Desetiletá studie úmrtnosti na karcinom byla nižší u pacientů s vyšší, ale ještě normální hladinou bilirubinu v krvi, zřejmě vlivem jeho antioxidační schopnosti. Rovněž pití zeleného čaje, který obsahuje silně antioxidační polyfenoly, snižuje hladinu močového 8-OHdG po 4 měsících u kuřáků, což by mělo znamenat i snížení rizika vzniku karcinomu.
Podávání polynenasycených mastných kyselin zvýší jejich množství v buněčných membránách nádorových buněk, které pak snaze podléhají lipoperoxidaci a smrti.
Karcinom plic je častější u lidí s nedostatkem karotenoidů. Vysoké hladiny b-karotenu znamenají snížení rizika karcinomu, ale jeho oxidovaná forma – např. u kuřáků – může působit opačně. Proto je důležitá i přítomnost dalších antioxidantů, především glutathionu. Riziko karcinomu žlučníku následkem kouření lze mírně snížit konzumací zeleniny a ovoce, které obsahují množství antioxidantů.
Účinnost cigaretových filtrů
Cigaretový kouř obsahuje – jak již bylo řečeno – mnoho škodlivých složek, jako oxidy dusíku, peroxid vodíku, oxid uhelnatý, kancerogenní aldehydy a nitroso-slou-čeniny, toxické a stopové prvky aj. Tyto látky jsou jen nedostatečně odstraňovány dosavadnímu filtry. Ty odstraňují jen málo polycyklické aromatické uhlohydráty, heterocyklické a aromatické aminy, volné radikály a ROS. Proto jsou konány pokusy na vylepšení stávajících filtrů. Přidání Pycnogenolu (0,4 mg), což je směs cca 40 antioxidantů z kůry borovice rostoucí na jihu Francie, do filtru sníží množství vdechovaných volných radikálů, tím sníží toxicitu o 70 % a mutage-nicitu o 48 %.
Pokusy s cigaretovými filtry, které by do značné míry odstraňovaly škodliviny zahrnují i aktivované uhlí impregnované suchým hemoglobinem. Tento filtr by měl odstraňovat oxidy dusíku, nitroso skupiny, CO, peroxid vodíku, aldehydy a toxické stopové prvky. EPR (elektronová paramagnetická rezonance) ukázala, že sice volné radikály poklesají o 30–35 % ve středním proudu kouře, ale filtr není účinný pro postranní proud a neredukuje dehtové částice ani v hlavním proudu kouře (15). Různé další pokusy sice zvyšují množství retinovaných škodlivin, ale nikdy se nepodaří je odstranit všechny. Zajímavé jsou pokusy s hemoglobinem ve filtru, který zachycuje stereospecificky vázané železo včetně porfyrinů, a to i s vázaným jiným kovem (Cu2+, Mg2+) a vedle toho i NO a ONOO-. Jiným pokusem, jak snížit škodlivost cigaretového kouře je systém Eclipse. V něm se tabák spíše hodně zahřívá, než spaluje. Snižuje se tak alveolární epitelové poškození, ale zvyšuje se v kouři karboxyhemoglobin a oxidační stres.
Kouření a endotelová dysfunkce
Kouření způsobuje endotelovou dysfunkci poškozením tvorby NO a zvýšením oxidačního stresu. Pro funkci endotelu a monocytů je důležitý vaskulární endoteliální růstový faktor (VEGF-A). Stimulace migrace monocytů účinkem VEGF-A byla snížena u kuřáků, zlepšení nastává suplementací vitaminem C. Kouření snižuje hladinu vitaminu C, který je sice více extracelulárním antioxidantem, ale jeho nedostatek je provázen nízkou hladinou glutathionu v lymfocytech. Vlivem cigaretového kouře stoupá průměrný arteriální tlak a klesá elasticita koronárních arterií. Expozice nikotinu působí zvýšenou produkci volných radikálů, zvyšuje adhezivitu vaskulární stěny a snížení fibrinolytické aktivity v plazmě (6). Kouření poškozuje srdeční hemodynamiku, působí dyslipidémii (vzestup celkového cholesterolu, LDL, triacylglycerolů, apolipoproteinu B) a oxidační poškození (vzestup malondialdehydu, pokles SOD).
Endotelovou dysfunkci lze ovlivnit mnoha způsoby. Roli hrají zvýšený superoxid a vazokonstrikční eikosanoidy (prostanoidy) z cigaretového kouře závislé i nezávislé na cyklooxygenáze. Relaxace cév acetylcholinem a ADP je cigaretovým kouřem porušena, zachována je aktivita guanylát cyklázy. SOD a poněkud i indomethacin chrání před endotelovou dysfunkcí. Zmenšuje se dilatace cév vlivem proudění krve, což je patrné ještě 30 až 60 minut po ukončení kouření. I rozpustné lipidové částečky z cigaretového kouře poškozují arteriální endotel a snižují na endotelu závislou dilataci cév (18).
Volné radikály inaktivují NO, což přispívá k endotelové dysfunkci. Podání vitaminu C ji rovněž snižuje. Vitamin C u lidí s porušenou glukózovou tolerancí snižuje hladinu TBARS a zvyšuje průtokem krve působenou dilataci a snižuje inzulínovou rezistenci kuřáků. Cigaretový kouř snižuje NO asi více účinkem volných radikálů než vlivem na NO syntázu.
Poškození tvorby NO je spojeno se sníženou biodostupností tetrahydrobiopterinu (BH4). BH4 snižuje kontrakci cév, ale je kouřením inaktivován. Tedy i tato látka má význam u chronické kuřácké endoteliální dysfunkce.
Cigaretový kouř zvyšuje i apoptózu endoteliálních buněk, počínaje aktivací kaspázy 3 a 8, NO zpomaluje apoptózu. Zvýšené uvolňování endotelinu u chronických kuřáků působí zvýšení vaskulární muskulatury, a tím zvýšení kontrakce cév, snížení dilatace a vazospasmus (12). Kouření je spojeno s dysfunkcí endoteliálních progenitorových buněk s vážným poškozením jejich diferenciace a funkčních aktivit. Počet těchto buněk je u kuřáků signifikantně snížen. To zhoršuje hojení cév u kuřáků.
Nebezpečím je vznik trombózy. Trombocytů koluje v krvi asi 1 000 bilionů. Při poškození cévy se aktivují se kontaktem s kolagenem a agregují na ráně, aby došlo k zástavě krvácení. Menší poškození endotelia např. vysokým krevním tlakem, zvýšeným cholesterolem, ale i kouřením působí adhezi a aktivaci destiček, a tím zánětlivou odpověď. To dále může vyvolávat zánětlivý proces na cévní stěně a vaskulární komplikace včetně trombózy, vedoucí posléze k srdečnímu onemocnění, k infarktu myokardu nebo iktu, případně k diabetu. Dlouhodobé kouření poškozuje normální ranní vzestup senzitivity trombocytů na NO, a tak se zvyšuje nebezpečí ranní trombogenity. Endoteliální buňky i destičky však produkují a secernují i chemické látky, které přímo inhibují agregaci destiček. Klíčovou látkou je plynný volný radikál oxidu dusnatého. Uplatňuje se v tomto procesu i apolipoprotein E, transportní nosič cholesterolu, který reaguje s povrchem destiček, stimuluje tvorbu (NO.) a tak snižuje aktivaci destiček.
Kouření a jeho vztah k ateroskleróze
Vznik aterosklerózy řeší mnoho teorií. Jednou z nejvýznamnějších je teorie volně radikálová: Receptory na buňkách zachycují LDL-cholesterol, který se dostává intracelulárně, kde je zpracováván. Pokud je LDL oxidován volnými radikály, receptory oxidovaný nebo jinak modifikovaný LDL nepoznají a je z krve odstraňován scavengerovými receptory makrofágů v cévním endotelu. V makrofázích se hromadí volné radikály, cholesterol, snižuje se výkon Ca-ATP pumpy, tím se zvyšuje intracelulární Ca, který aktivuje proteázy s následným štěpením bílkovin elastinu, kolagenu aj. za vzniku pěnové buňky, základu aterosklerotických změn.
Mnoho oxidačně modifikovaných molekul LDL-cholesterolu vzniká v systému myeloperoxidáza/peroxid vodíku v aktivovaných fagocytech, kdy oxidace vznikají účinkem kyseliny chlorné. Substrátem pro myeloperoxidázu nemusí být jen peroxid vodíku, ale i tiokyanát (SCN), který je obsažen v cigaretovém kouři. Vzniká reaktivní směs HOSCN/SCN. I tiokyanát katalyzuje oxidaci LDL-cholesterolu. Ochranou před touto reakcí je kyselina askorbová, ale nikoliv tokoferol, ani chloridy.
V organismu vznikají též protilátky proti modifikovaným LDL, které chrání organismus před jejich škodlivými účinky. Volné radikály z kouření zvyšují lipoperoxidaci, což je dalším rizikovým faktorem pro aterosklerózu. Dalším postupem vzniká endotelová dysfunkce. Kouření zvyšuje významně hladiny rozpustné intercelulární molekuly buněčné adheze-1: sICAM-1 (soluble intercellular cell adhesion molecule-l) a rozpustné vaskulární buněčné adhezívní molekuly-1: sVCAM-1 (soluble vascular cell adhesion molecule-1). Snížení hladiny vitaminu C je provázeno zvýšením adhezivity monocytů na endotel.
NADPH oxidáza je hlavním zdrojem superoxidu ve fagocytárních a vaskulárních buňkách. Je zajímavé, že mezi produkcí superoxidu fagocytárními buňkami a tloušťkou intimy + medie karotid je přímá úměra a dokonce je přímý vztah i s BMI (16). Cigaretový kouř má imunosupresivní účinek, což asi lze spojovat i se ztluštěním stěny intimy. Ve vodě rozpustné složky cigaretového kouře aktivují vaskulární NADPH oxidázu, tvoří se superoxid a peroxid vodíku a aktivuje se NF B s následkem prozánětlivých změn vaskulárního fenotypu a počátkem aterosklerózy (10).
Kouření zvyšuje tepovou frekvenci, zvyšuje vaskulární koronární rezistenci, srdeční kontraktilitu a spotřebu kyslíku srdcem. Zvyšuje zánětlivou reakci se zvýšením počtu leukocytů a zvýšením CRP, porušuje rovnováhu mezi antitrombotickými a protrombotickými faktory a působí snížení fibrinolytické aktivity.
Některé epidemiologické studie popírají význam antioxidantů v prevenci či terapii aterosklerózy. Podávání vitaminů C a E totiž signifikantně neovlivnilo toto onemocnění. Příčinou je však zřejmě to, že nebyla podávaná směs antioxidantů, proto vzhledem k redox potenciálu se neodstranily všechny volné radikály, nebyla sledována hladina GSH intracelulárně, osoby v pokuse měly dostatek vitaminů C a E už v potravě, nebyla sledována aktivita myeloperoxidázy, která produkcí kyseliny chlorné zvyšovala hladinu oxidovaných LDL. Navíc vitamin C a E činí v lidském těle jen asi 11 % z celkové antioxidační kapacity, která však nebyla sledována, ani nebyla sledována hladina selenu. Důvodem, proč antioxidanty někdy nejsou účinné proti volným radikálům u chronických kuřáků z hlediska aterosklerózy je i to, že kouř poškozuje některé antioxidanty, zvláště enzymy a protože podporuje ukládání škodlivin, zvláště tuků.
Kouření marihuany
V posledních desetiletích se rozmáhá kouření marihuany, která se používá jako droga již asi 10 000 let. Pochází z Číny, odkud se rozšířila do světa. Surová marihuana obsahuje více než 400 aktivních chemických látek, z nichž některé jsou toxické. Působí příjemné pocity, ovlivňuje psychiku, a proto se stala návykovou drogou.
Zpočátku působí povzbuzení, zvýšenou aktivitu, obluzuje, později však utlumuje. Je pravda, že návyk nenastává u všech lidí a vytváří se až postupně. Marihuana – kromě známého poškozování mozkových buněk – působí záněty, edém, poškození buněk tracheobronchiální mukózy a zvy-šuje riziko karcinomu plic. Zvyšuje produkci ROS a výrazně snižuje intracelulární hladinu GSH.
Marihuana také snižuje funkci alveolárních makrofágů a schopnost zabíjet bakterie a nádorové buňky. Bylo syntetizováno i mnoho umělých látek, podobných kanabinoidům. Receptory pro kanabinoidy jsou hlavně v mozku, míše a některých buňkách imunitního systému. Z negativních vlastností marihuany je třeba jmenovat genotoxicitu, pokles teploty, poškození makrofágů v plicích a produkci některých důležitých látek jako jsou cytokiny. Je poškozena schopnost zabíjet bakterie a nádorové buňky. Poškozováním DNA je zvýšena možnost vzniku vrozených poruch v další generaci. Poškozuje soustředění, marihuana je nevhodná pro lidi, kteří musí pracovat rychle a přesně. Delší užívání může vyvolat deprese a výrazné zhoršení paměti.
Na druhé straně má marihuana i určité antioxidační vlastnosti, chrání před toxicitou některých látek. Probíhají i diskuse o jiném lékařském využívání, např. u mnohočetné mozkomíšní sklerózy nebo u nádorových bolestí, ovšem riziko užívání marihuany převažuje před jejími příznivými vlastnostmi a je správné chránit zvláště mladou generaci před jejím zneužíváním.
Vliv kouření na fertilitu
Spermatozoa produkují ROS, které podporují narušení povrchu vajíčka při oplodnění. Kouření výrazně zvyšuje množství ROS a zvyšuje lipoperoxidaci ve varlatech. Hladina malondialdehydu v nich stoupá téměř o 50 %, klesá GSH a GPx, je poškozena tkáň varlat a vzniká abnormální spermatogeneze. Kouření zvyšuje až o 48 % vzestup seminálních leukocytů a o 107 % vzestup ROS (13). Seminální plazma má normálně vysokou antioxidační kapacitu, aby membrány spermatozoí nebyly poškozovány lipoperoxidací, která je totiž okamžitě usmrcuje. Nejvyšší antioxidační kapacitu v seminální plazmě má kyselina askorbová, dále uráty a albumin. Překročí-li počet leukocytů – jako dalšího zdroje volných radikálů – 1,5.106 a hladina kyseliny askorbové je nízká, může množství volných radikálů překročit antioxidační kapacitu a způsobit poškození motility a hynutí spermií.
Kyselina askorbová reaguje hlavně se slabšími volnými radikály jako se superoxidem, zatímco kyselina močová zneškodňuje silné oxidanty jako např. peroxylové radikály a váže i volné železo, čímž chrání kyselinu askorbovou před oxidací. Zajímavé je, že kyselina askorbová ovlivňuje uložení tuků nezávisle na BMI. Nízká hladina kyseliny askorbové u kuřáků podporuje vznik mužského typu obezity. Významným zdrojem scavengerů superoxidu je prostatický sekret.
Volné radikály ovšem hrají i výz-nam-nou roli v ženské fertilitě. Jsou produkovány mj. vaječníky. Během menstruačního cyklu se značně mění ovariální hladiny antioxidačních vitaminů a GSH, které jsou nejvyšší při tvorbě folikulu.
Vliv kouření na těhotenství, poroda novorozence
V těhotenství se kouření v žádném případě nedoporučuje. Přesto jsou matky, které buď z nevědomosti, anebo ze závislosti, nedokážou s kouřením přestat. Množství volných radikálů pochopitelně těhotenství významně ovlivňuje. Postižena je matka, placenta i plod. Vystavení Graafových folikulů oxidačnímu stresu působí signifikantní vzestup intenzity peroxidace folikulárních lipidů a signifikantní lokální pokles antioxidačního potenciálu.
Nikotin a oxidační stres se považují za významné teratogenní faktory v těhotenství. Relativně častá je otevřená neurální trubice, v deformovaných strukturách je veliká apoptóza, zvláště v přítomnosti vysoké intracelulární hladiny vápníku. Jako jedna z příčin předčasného odtoku plodové vody se uvádí i kouření. Zánět nebo infekce produkují kyselinu chlornou, která poškodí amnion a chorion, respektive kolagen I. Podání vitaminů C a E může toto poškození tkáně snížit. U kuřačky na počátku těhotenství je SOD i GPx vyšší než u nekuřaček, naopak kataláza je vyšší u nekuřaček a během těhotenství její aktivita stoupá, zatímco u kuřaček klesá. Kouření tedy během těhotenství mění antioxidační obranu v erytrocytech, což má negativní vliv na antioxidační systém novorozence. Kom-penzatorní mechanismy proti účinku volných radikálů sice u kuřaček vznikají, placenta chrání před oxidačním stresem, ale je otázka, nakolik dokáže být efektivní. Např. hladina vitaminu A, β-karotenu a vitaminu E jsou u kuřaček i v pupečníkové krvi novorozence nižší jako projev neutralizace volných radikálů.
Nejen nižší porodní váha novorozenců, ale je i nižší koncentrace vitaminu C, SH - skupin, katalázy, paraoxonázy 1 a celkové antioxidační kapacity v pupečníkové krvi a naopak vyšší hladina lipidových hydroperoxidů a oxidačního stresového indexu u kuřaček a dokonce i u matek vystavených pasivnímu kouření. Kompenzačně vyšší je i hladina ceruloplasminu a kyseliny močové v pupečníkové krvi kuřaček (4). U dětí s nejnižší porodní váhou bývá i nízká hladina vitaminu E, což podporuje nadprodukci peroxidů a redukci prostacyklinu. Nedostatek prostacyklinu může působit sníženou perfúzi placenty. Tak se někdy i vysvětluje nižší porodní váha dětí kuřaček. Významný dilatátor z endoteliálních buněk, který moduluje mateřský a fetální vaskulární tonus je oxid dusnatý (NO). Kouření snižuje sérovou hladinu některých vitaminů, což se může při nedostatku kyseliny listové a vitaminu B12 projevit hyperhomocysteinemií, známým rizikovým faktorem v těhotenství. U hyperhomocysteinemie klesá produkce NO, což podporuje vazokonstrikci v placentě. V placentě kuřaček mohou být přítomny arsen a kadmium, což zvyšuje hladinu lipoperoxidů a snižuje GSH. Pasivní kouření u dětí snižuje celkovou antioxidační kapacitu a stoupají peroxidy v plazmě.
Stomatologická poškození vlivem kouření
Kouření mění orální bakteriální floru a případně působí tvorbu acetaldehydu, který je karcinogenní. Kouření jako mohutný zdroj volných radikálů ovlivňuje i vznik zubních kazů. Volné radikály totiž uvolňují z dentinu vápník. Kouř z cigaret poškozuje dásně, snižuje hladinu vitaminu C a A, působí vazokonstrikci a snižuje antioxidační schopnost, působí pokles redukovaného glutathionu a dalších antioxidantů. Jak je z uvedeného patrno, volné radikály a jejich rychlé řetězové reakce mohou být patogenními faktory zubních onemocnění. Kouření významně ovlivňuje zvláště periodontitidu. Při ní v gingivální krvi klesá antioxidační kapacita a zánět progreduje.
Sliny účinkují jako čistící roztok a rezervoár iontů, ale i jako pufr a mají i antioxidační kapacitu. Hladina kyseliny močové jako významného antioxidantu koreluje s její hladinou v plazmě. Aktivita peroxidáz ve slinách vystavením cigaretovému kouři rychle klesá, což má vliv i na antimikrobiální ochranu. Antioxidanty tento pokles neovlivňují, příčinou je zřejmě kyanid z cigaret. Exposice tabákových výrobků na orální epitelové buňky může způsobit orální karcinom ze skvamózních buněk.
Kouření a gastrointestinální trakt
Trávící ústrojí je ohroženo volnými radikály jak exogenního původu (sem patří i kouř z cigaret), tak endogenně při biochemickém metabolismu. Peptický vřed je spojován s kouřením a alkoholovým poškozením žaludeční sliznice. Kouř snižuje průtok krve a zvyšuje aktivitu xantinoxidázy, zatímco aktivita SOD se signifikantně nemění. Kouření a nikotin stimulují sekreci pepsinogenu a stimulují bazální výdej kyselých iontů, což je více vyznačeno u pacientů s ulcus duodeni. Kouření také zvyšuje reflux žlučových solí, reflux zvyšuje riziko žaludečního vředu u kuřáků. Kouření a nikotin zvyšují i ulceraci způsobenou Helicobacterem pylori, alkoholem, protizánětlivými léky a chladovým stresem. Nízká hladina vitaminu C, která bývá u kuřáků obvyklá, v přítomnosti H. pylori asi podporuje vznik žaludečního karcinomu. U této infekce jsou zvýšené volné radikály a lipoperoxidace, antioxidanty mohou být prospěšné. Velkou roli hrají i poly-morfonukleární neutrofily jako zdroj volných radikálů a hladina vasopresinu. Kouření zvyšuje tvorbu destičky aktivujícího faktoru (PAF) a endotelinu, které jsou potentními žaludečními ulcerogeny.
Zatímco Crohnova choroba je spojována i s kouřením, ulcerózní kolitida je nemocí převážně nekuřáků a bývalých kuřáků. Kouření dokonce má nějaký příznivý účinek na toto onemocnění. U těchto dvou onemocnění ovšem hrají roli různé mechanismy, kromě kouření i humorální i buněčná imunita, cytokiny, hladina eikosanoidů, pohyblivost střeva, permeabilita, průtok krve a mucus v colon. Zajímavý je poznatek, že kouření snižuje plazmatický adiponektin, který mj. snižuje obezitu.
Volné radikály a antioxidanty u nervových a psychiatrických nemocí
Mozek je nejvíce ohrožen volnými radikály (má nízkou antioxidační kapacitu, hodně polynenasycených mastných kyselin, které snadno podléhají lipoperoxidaci, má vysokou potřebu kyslíku, volné radikály nevratně poškozují neurony). Příčiny poškození jsou různé:
a) nedostatek scavengerů volných radikálů
amyotrofická laterální skleróza, migréna (lipoperoxidy působí spasmus mozkových cév), Downův syndrom, deficit GPx (chronické záchvaty, opakované infekce), deficit vitaminu E (ataxie, slabost, myopatie, demyelinizace), Wilsonova choroba (snížený antioxidant ceruloplasmin), epilepsie (lze ji vyvolat injekcí FeCl3 do mozku)
b) zánětlivá onemocnění
encefalitis, meningitis, roztroušená skleróza mozkomíšní (pokles SH-skupin), aj.
c) hemodynamické poruchy
apoplexie, subarachnoidální krvácení (vzestup lipoperoxidace, MDA působí cerebrální vazospasmus), trauma CNS, (uvolnění Fe z Hb), hydrocefalus, bolest (zvýšené volné radikály a zvýšená propustnost hematoencefalické bariéry, edém, vzestup prostaglandinů)
d) degenerativní choroby
tardivní dyskinéza, schizofrenie, myotonická dystrofie, Alzheimerova choroba (snížení SOD, katalázy, vitamin C, AOC, zvýšený lipofuscin, peroxidace bílkovin, AGE-látky, poškození DNA), muskarinové cholinergní neurony jsou kritické pro učení a paměť, (lipofilní antioxidanty je chrání), Parkinsonova choroba (oxidační stres, zvýšené peroxid vodíku, Fe, (OH), Mn).
Je pravděpodobné, že apoptóza je odpovědná za poškození mozku způsobené kouřením. Pro rozvoj mozku a udržení jeho funkce má velkou důležitost zinek, který funguje i jako antioxidant. Váže se na p53. Enzymy obsahující Zn jsou důležité pro syntézu serotoninu a melatoninu, nedostatek Zn může způsobit nízkou hladinu obou těchto hormonů. Zinek má tendenci klesat, je-li nadbytek Cu a Cd. Etanol zvyšuje eliminaci Zn a Mg, proto může klesat i Cu, ZnSOD. Těhotné s nízkým Zn a vysokým Cu mohou mít určité problémy s vývojem mozku fétu, později může být častější schizofrenie, autismus a epilepsie. Člověk, který akumuluje Cu, má tendenci mít nízkou hladinu Zn, následuje eventuálně oxidační poškození a Parkinsonova choroba. U Raynaudovy choroby a systemické sklerózy je snížená hladina kyseliny askorbové. Nízká hladina selenu byla nalezena hlavně u difúzní systémové sklerózy, zvýšená hladina kyseliny linolenové pak u Raynaudova syndromu. Tyto nálezy byly výraznější u kuřáků.
Volné radikály působí bolest, antioxidanty pak mohou fungovat jako analgetika pro neuropatický a zánětlivý model bolesti.
Vliv kouření na choroby očí
Kouření jako nezávislý rizikový faktor nesporně ovlivňuje na věku závislou makulární degeneraci, kataraktu, Gravesovu oftalmopatii a glaukom, které v konečném výsledku mohou způsobit až slepotu. Tyto choroby sice mají multifaktoriální etiologii, ale kouření působí účinkem volných radikálů morfologické a funkční změny čočky a retiny hlavně aterosklerotickými a trombotickými účinky na oční kapiláry.
Otorhinolaryngologická poškození u kuřák
Je známo, že kuřáci častěji trpí karcinomem jazyku, hrtanu, aj. Kouření zhoršuje obstrukční spánkovou apneu. Ta u těžších případů působí sníženou antioxidační kapacitu. Poškození kochleárního epitelu hlukem je provázeno uvolňováním volných radikálů. Proto geny, které regulují volné radikály jako MnSOD a paraoxonáza, mohou ovlivnit vulnerabilitu kochley na hluk. Negativně se podílí na tomto procesu i kouření. Polymorfismus obou enzymů může vést k predispozici k hlukem způsobené ztráty sluchu. Kouření snižuje hladinu NO ve vydechovaném vzduchu zřejmě účinkem na NO syntézu.
Vliv kouření na funkce ledvin
Kouření vlivem volných radikálů je i rizikovým faktorem pro onemocnění ledvin. Je nefrotoxické pro pacienty s diabetem a renálními chorobami. Důvodem je vzestup krevního tlaku, změna intrarenální hemodynamiky, aktivace sympatiku, renin-angiotenzinového a endotelového systému.
Ovlivňuje kouření i stav kostí?
V tomto směru je zatím velmi málo poznatků. Volné radikály zvyšují pomocí osteoklastů resorpci kostí. Byly sledovány zlomeniny krčku kosti stehenní a bylo zjištěno, že u kuřáků s nízkým příjmem vitaminu C a E jsou častější a že jejich podávání snižuje toto riziko.
Kouření a vrásky
Kouření snižuje okysličování kůže, a tím i podporuje její stárnutí. Při sledování vlivu slunce a potravy na kůži, bylo prokázáno, že strava obsahující hojně antioxidantů, tj. zelenina, ovoce, ale i čaj, olivový olej a ryby příznivěji ovlivňovala stav kůže a vrásek než strava s máslem, margarinem, mléčnými produkty, masem a cukry.
Další nemoci, na kterých se podílejí volné radikály
Kromě výše uvedených nemocí je dosti dalších, které ve vztahu ke kouření nejsou příliš publikovány, ale na jejich vzniku i průběhu se podílejí volné radikály. Sem patří diabetes, infekce, poruchy imunity, alergie, septické stavy, záněty všeho druhu, Crohnova choroba, nemoci štítné žlázy, v pracovním lékařství u práce se styrenem, asbestem, silikóza, revmatická artritida, kloubní poškození, osteoporóza, obezita aj. Volné radikály mají význam i při transplantacích, u krevní transfuze, ale i u alkoholismu, volné radikály přijímáme i ve výživě, množství volných radikálů vzniká i při extrémní námaze a vrcholovém sportu, atd.
Význam podávání antioxidantů u kuřáků
Před volnými radikály nás chrání antioxidanty. Ty rozlišujeme jako intracelulární, extracelulární, rozpustné v tucích, ve vodě, přirozené, vytvářené v organismu, nebo uměle vyrobené, složením vitaminy, enzymy, vysokomolekulární i nízkomolekulární, atd. Nebylo dosud epidemiologicky prokázáno, že by antioxidanty prodlužovaly lidský život, ale určitě snižují počet předčasných úmrtí na nemoci, které jsou volnými radikály působeny nebo podporovány.
Je známo, že je třeba podávat vyvážené směsi antioxidantů, protože ne každý volný radikál je zneškodňován jakýmkoliv antioxidantem. Navíc je třeba zachovávat určitý poměr mezi volnými radikály a antioxidanty, protože i volné radikály mají pro organismus svůj význam. Např. volné radikály v bílých krvinkách zabíjí bakterie, viry, kvasinky, v T-lymfocytech i nádorové buňky, v osteoklastech regulují remodelaci kostní tkáně, apod. Někteří autoři udávají poměr volných radikálů k antioxidantům v poměru 1 : 3, ale záleží pochopitelně i na složení antioxidantů a na tom, které volné radikály v těle účinkují.
Význam mají především intracelulární antioxidanty, redukovaný glutathion a selen jako složka selenoenzymu tioredoxin reduktázy. Glutathion je stále nedostatečně oceněn, což vyplývá i z dlouhodobého – po několik desetiletí – sledování jeho hladiny v krvi různých zvířat i lidí. Bylo prokázáno, že u 36 % případů nových hospitalizovaných pacientů s nějakým chronickým onemocněním (kardiovaskulárním, jaterním, u diabetes mellitus, apod.) byl v krvinkách nedostatek redukovaného glutathionu. Naopak u lidí s výbornou fyzickou kondicí a dobrým duševním zdravím byla nalezena jeho vysoká hladina. Prudký pokles hladiny glutathionu byl provázen rychlým zhoršením zdravotního stavu (9). Glutathion vzniká do jisté míry i z N-acetyl-L-cysteinu. Vlivem volných radikálů z kouření glutathion klesá a stoupají TBARS (thiobarbituric acid reactive substances – markery lipoperoxidace). U mladých kuřáků dokonce kompenzačně může glutathion přechodně stoupnout.
Horší je nález u diety se sníženým příjmem proteinů. Suplementace N-acetyl-L-cysteinem zvyšuje hladinu GSH v plicích i játrech. Podání glutathionu a/nebo N-acetyl-L-cysteinu snižuje tvorbu volných radikálů v reperfúzní fázi po nedokrevnosti v mozku, a tím snižuje i jeho poškození. Oxidovaný glutathion (GSSG) je z buněk odstraňován tak, že se váže na proteiny (GSSG -> GSSP) a v této formě se dostává do extracelulární tekutiny. Glutathiolace bílkovin se považuje za důležitý redox-senzitivní signalizační mechanismus v regulaci kritických buněčných funkcí. Hladina GSSP v plaz-mě je u kuřáků asi o 20 % vyšší než u nekuřáků a koreluje s počtem vykouřených cigaret, s hladinou kotininu a tiocya-nátu v plazmě. Někteří autoři se domnívají, že hladina GSSP může sloužit jako citlivý biomarker oxidativního stresu. Kadmium z cigaret snižuje v buňkách hladinu GSH a ATP. Glutathion chrání před toxickým vlivem kadmia.
I převážně extracelulární antioxidanty jsou pro organismus velmi důležité. Z nejznámějších antioxidantů lze jmenovat vitamin E, koenzym Q10, ginkgo bilobu, melatonin a další. Zajímavý je účinek β-karotenu. Ten svou prooxidační schopností zvyšuje lipoperoxidaci. Některé práce poukazují na zvýšený výskyt karcinomu plic u chronických kuřáků po suplementaci β-karotenem. Zdá se, že při obvyklé tenzi kyslíku v plicích může β-karoten účinkovat již prooxidačně. Při pokusech s nízkým pO2 (cca 2 kPa) účinkuje β-karoten jako antioxidant a snižuje lipoperoxidaci, při vyšších hodnotách pO2 cca od 6 kPa už stoupá jeho prooxidační účinek, který však může snížit současně podaný γ-tokoferol (11).
Kouření snižuje hladinu vitaminu C, který je sice více extracelulárním antioxidantem, ale jeho nedostatek je provázen nízkou hladinou glutathionu v lymfocytech. Delší podávání vitaminu C zvyšuje i hladinu glutathionu v lymfocytech. Vysoká hladina malondialdehydu u kuřáků poklesla po 30denní suplementaci ovocnou a zeleninovou šťávou. Pokud pacient přestane s kouřením, hladina glutathionu se poměrně rychle zvyšuje.
Významnou ochranou před zhoubným bujením je selen, kterého je však v naší zemi v půdě, a tím i v potravě, nedostatek. Nádorová buňka jej jako antioxidant přednostně vstřebává z mimobuněčné tekutiny, selen reaguje s glutathionem v buňce a dochází k těžkému poškození a smrti nádorové buňky. Udává se, že podávání 300 mg selenu denně je prevencí před vznikem karcinomu. Ovšem bezpečná dávka selenu je 250 mg/den, takže je třeba u pacienta kontrolovat jeho hladinu.
Selenoenzym thioredoxin reduktáza se podílí na regulaci aktivity syntázy oxidu dusnatého. Uplatňuje se u syntézy DNA, při ochraně kůže před UV paprsky, při remodelaci kostí, má ochranný účinek vůči oxidačnímu stresu v centrálním nervovém systému, chrání i před vznikem nádorového bujení.
Účinkem vitaminu C může se snižovat hladina superoxidu, snižovat oxidace LDL-cholesterolu, mohou se redukovat dusitany na NO, aktivovat endoteliální NO syntéza. Účinek kombinace vitaminu C (1 g/den) a vitaminu E (500 mg/den) po dobu 25 dnů odezní cca 4 týdny po ukončení suplementace. Antioxidační flavanoly z kakaa (cca 180 mg) zvyšují hladinu NO s vrcholem za 2 hodiny, a tedy rovněž přispívají ke snížení endotelové dysfunkce u kuřáků. Allopurinol, který inhibuje xanthin oxidázu produkující superoxid, rovněž snižuje u kuřáků endotelovou dysfunkci i porušenou odpověď bradykininu. Podávání ibuprofenu snižuje adhezi monocytů na lidské endoteliální buňky umbilikálních cév, potlačuje oxidační stres a zvyšuje HDL-cholesterol. Denní podávání ovoce chronickým kuřákům snížilo hladinu lipidových hydroperoxidů. Podávání směsi antioxidantů s poměrně vysokou AOC působilo mírné snížení cholesterolu, triacylglycerolů a apolipoproteinu B a tiocyanátů v séru, stoupl β-karoten, stoupla aktivita GPx, klesla hladina malondialdehydu (MDA).
Práce byla podporována Výzkumným záměrem 00216 208 16
MUDr Václav Holeček CSc.
Mulačova nemocnice
Dvořákova 17
32002 Plzeň
E-mail: vholecek@volny.cz
Zdroje
1. Baginski, T.K., Dabbagh, K., Satjawat-charaphong, C. Cigarette smoke synergistically enhance respiratory mucin induction by proinflammatory stimuli. Am. J. Respir. Cell Mol. Biol. 2006, 35, 2, p. 165-174.
2. Baglole, C.J., Bushinsky, S.M., Garcia, T.M. et al. Different induction of apoptosis by cigarette smoke extrakt in primary human lung fibroblast strains: implications for emphysema. Am. J. Physiol. Lung. Cell Mol. Physiol. 2006, 291, 1, p. 19-29.
3. Das, U. A radical approach to cancer. Med. Sci. Monit. 2002, 8, 4, p. 79-92.
4. Fazol, L., Gulian, J.M., Dalmasso, C. et al. Antioxidant status - of neonates exposed in utero to tobacco smoke. Biol. Neonate 2005, 87, 2, p. 121-126.
5. Fracasso, M.E., Doria, D., Franceschettin P. et al. DNA damage and repair capacity by comet assay in lymphocytes of white-collar active smokers and passive smokers (non - and ex-smokers) at workplace. Toxicol. Lett. 2006, 167, 2, p. 131-141.
6. Hanna, S.T. Nicotine effect on cardiovascular system and ion channels. J. Cardiovasc. Pharmacol. 2006, 47, 3, p. 348-358.
7. Hemalatha, A., Venkatesan, A., Bobby, Z. et al. Antioxidant response to oxidative stress induced by smoking. Indian. J. Physiol. Pharmacol. 2006, 50, 4, p. 416-420.
8. Churg, A. Interactions of endogenous or evoked agents and particles: the role of reactive oxygen species. Free Radic. Biol. Med. 2003, 34, 10, p. 1230-1235.
9. Lang, C.A., Mills, B.J., Lang, H.L. High blood glutathione levels accompany excellent physical and mental health in women ages 60-103 years. J. Lab. Clin. Med. 2002, 140, p. 413-417.
10. Orosz, Z., Csiszar, A., Labinsky, N. et al. Cigarette smoke-induced proinflammatory alterations in the endothelial phenotype: role of NAD(P)H oxidase activation. Am. J. Physiol. Heart Circ. Physiol. 2007, 292, 1, p. 130-139.
11. Palozza, P., Serini, S., Trombino, S. et al. Dual role of beta-carotene in combination with cigarette smoke aqueous extract on the formation of mutagenic lipid peroxidation products in lung membrane: dependence on pO2. Carcinogenesis 2006, 27, 12, p. 2383-2391.
12. Rahman, M.M., Elami, S., Chang, T.K. et al. Increased vascular contractility in isolated vessels from cigarette smoking rats is mediated by basal endothelin release. Vascul. Pharmacol. 2007, 46, 1, p. 35-42.
13. Saleh, R.A., Agarwal, A., Sharma, R.K. et al. Effect of cigarette smoking on levels of seminal oxidative stress in infertile men: a prospective study. Fertil. Steril. 2002, 78(3): p. 491-499.
14 Stavrides J.C. Lung carcinogenesis: Pivotal role of metals in tobacco smoke. Free Rad. Biol. Med. 2006, 41, p. 1017-1030.
15. Valavanidis, A., Haralambous, E. A comparative study by electron paramagnetic resonance of free radical species in the mainstream and sidestream smoke of cigarettes with conventional acetate filters and „bio-filters“. Redox Rep. 2001, 6, 3, p. 161-171.
16. Zalba, G., Beloqui, O., San José, G. et al. NADPH oxidase-dependent superoxide production is associated with carotid intima-media thickness in subjects free of clinical atherosclerotic disease. Arterioscler. Tromb. Vasc. Biol. 2005, 25, 7, p. 1452-1457.
17. Zhang, W.Z., Venardos, K., Chin-Dusting, J. et al. Adverse effects of cigarette smoke on NO bioavailability: role of arginine metabolism and oxidative stress. Hypertension 2006, 48, 2, p. 278-285.
18. Zheng, J.Y., Cao, Y.X., Xu, C.B. et al. Lipid-soluble smoke particles damage endothelial cells and redukce endothelium-dependent dilatation in rat and man. BMC Cardiovasc. Disorders. 2006, 19, 6, p. 3.
Štítky
Praktické lekárstvo pre deti a dorast Praktické lekárstvo pre dospelých
Článek RecenzeČlánek Konsiliární psychiatrie
Článok vyšiel v časopisePraktický lékař
Najčítanejšie tento týždeň
2008 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Vareniklin jako pomocník v léčbě nikotinismu i u psychiatrických pacientů
-
Všetky články tohto čísla
- Problematika diagnostiky nealkoholovej steatohepatitídy v klinicko-patologickej praxi
- Vztah klinického obrazu a neurobiologie vaskulárních demencí
- Vliv kouření a volných radikálů na antioxidační ochranu a na patogenezi některých nemocí
- Etické komise v České republice
- Importované tropické horečnaté infekce
- Záchranná léčba kombinací paclitaxel + gemcitabine pacientů s germinálními nádory (GCT – germ cell tumors)
- Kauzální metody léčby varixů dolních končetin
- Recenze
- Úloha praktického lékaře a odborníka pro nemoci z povolání při diagnostice profesního bronchiálního astmatu a profesní rinitidy
- Linka pro odvykání kouření – významná součást nabídky léčby závislosti na tabáku
- Dynamika onkomarkerů v rámci onkologické léčby testikulárních germinálních nádorů
- Psychotrauma a jeho problématika při poskytování zdravotní péče
- Miniportréty slavných českých lékařů Profesor MUDr. Ladislav Borovanský – představitel české anatomie v poválečné době
- Projekt CRAB, aneb Časnou diagnostikou k lepší kvalitě života
- Vyšetřování kůže vysokofrekvenčním ultrazvukem
- Mamma HELP a „umění žít naplno!“
- Projekt „Regionální centrum pro podporu výuky a výzkumu v oblasti medicínských obrazových a klinických dat
- Od základní péče po špičkovou specializaci
- Konsiliární psychiatrie
- Praktický lékař
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Vztah klinického obrazu a neurobiologie vaskulárních demencí
- Kauzální metody léčby varixů dolních končetin
- Dynamika onkomarkerů v rámci onkologické léčby testikulárních germinálních nádorů
- Vliv kouření a volných radikálů na antioxidační ochranu a na patogenezi některých nemocí
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



