-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Blok I
Vyšlo v časopise: Prakt. Lék. 2009; 89(9): 526-530
Kategorie: Kongres
1. Prevence zhoubných nádorů je významnou součástí Národního onkologického programu ČR
Vorlíček J., Dušek L., Abrahámová J.
Česká onkologická společnost ČLS JEP
Souhrn
Národní onkologický program ČR (NOP) byl zpracován na základě podmínek a potřeb České republiky a v souladu se závěry Světové zdravotnické organizace (WHO) přijatých ke kontrole nádorových onemocnění. Cíle Národního onkologického programu České republiky směřují ke snižování výskytu a úmrtnosti nádorových onemocnění, ke zlepšování kvality života onkologicky nemocných a k racionalizaci nákladů na diagnostiku a léčbu nádorových onemocnění v ČR. Program je pod garancí České onkologické společnosti (ČOS) rozesílán velkému množství institucí, které mohou napomoci plnění jednotlivých bodů NOP. Instituce jsou vyzývány k podpisu programu a ke spoluodpovědnosti za jeho plnění. K NOP je možné se přihlásit nebo jej podpořit na portálu ČOS: www.linkos.cz.
Primární i sekundární prevence zhoubných nádorových onemocnění představuje velmi významnou komponentu NOP. ČOS si je vědoma faktu, že plnění cílů v této oblasti vyžaduje odbornou spolupráci mnoha lékařských odborností a k této spolupráci se hlásí. Jedině posílení včasné diagnostiky nádorových onemocnění může změnit nelichotivá epidemiologická data české populace. Ročně je v ČR nově diagnostikováno více než 68 000 pacientů se zhoubným novotvarem a více než 27 000 pacientů ročně umírá. Prevalence, tedy počet osob žijících se zhoubným novotvarem, přesahuje 380 000. U řady velmi častých malignit přitom máme velké rezervy v diagnostice onemocnění, a stále velké procento pacientů je diagnostikováno v pokročilých stadiích onemocnění.
Národní onkologický program ČR
Cíle
- Snižování incidence a mortality nádorových onemocnění.
- Zlepšení kvality života onkologicky nemocných.
- Racionalizace nákladů na diagnostiku a léčbu nádorových onemocnění v ČR.
Strategie
- Boj se zhoubnými nádory jako součást celorepublikové i regionální politické agendy.
- Boj se zhoubnými nádory jako životní zájem laické i odborné veřejnosti.
- Mezinárodní kooperace a harmonizace v rámci partnerských struktur EU a WHO.
- Trvalá udržitelnost programu boje s rakovinou kontrolou nákladů.
- Stanovení a průběžné vyhodnocování indikátorů, výstupů (outputs) a výsledků (outcomes), fungování a účinnosti NOP. Každoroční komentář k plnění, případně revize a doplňování.
Úkoly
- Odborná podpora výuky prevence nádorů na školách. Na veřejnosti popularizace primární prevence nádorů. Snížit zejména kouření mládeže a žen. Pomáhat kladným změnám ve výživě a v životním stylu.
- Zajistit dlouhodobé fungování a informační zázemí programů pro screening karcinomu prsu, karcinomu hrdla děložního a karcinomu kolorekta. Vyhodnocovat vliv parascreeningových vyšetření v populaci.
- Zlepšit časnou diagnostiku zhoubných nádorů, zejména ve spolupráci s praktickými lékaři. Inovovat náplň preventivních prohlídek integrujících záchyt onkologických, kardiovaskulárních a metabolických onemocnění.
- Pojmenovat síť center komplexní diagnostiko-léčebné onkologické péče, akreditovaných ČOS na principu čtyř kompetencí: kvalifikace, vybavení, sebeevaluace a komunikace. Vytvořit Radu onkocenter České republiky jako nástroj pro koordinaci práce.
- Prosazování ekvity, čili pokrytí populace srovnatelnými onkologickými službami a přístupu k informacím o prevenci, diagnostice a léčbě onkologických onemocnění.
- Zajistit ukotvení a stabilitu zařízení pro paliativní a terminální péči. Podpořit rozvoj domácí péče. Sledovat stav kvality života a léčby bolesti nemocných s pokročilými zhoubnými nádory.
- Podpora kontinuity, stabilizace, modernizace a praktického využívání databáze Národního onkologického registru ČR pro řízenou preventivní a diagnosticko-léčebnou péči v onkologii.
- Podpora aplikovaného onkologického výzkumu a inovací. Zavádění principů HTA (health technology assessment) v onkologii. Podpora vzdělávání v onkologii.
2. Informační zázemí organizovaných programů screeningu zhoubných nádorových onemocnění v ČR
Dušek L.1, Májek O.1, Brabec P.1, Klimeš D.1, Šnajdrová L.1, Mužík J.1, Daneš J.2, Zavoral M.3, Dvořák V.4, Bartoňková H.5, Skovajsová M.6
1Institut biostatistiky a analýz, Masarykova univerzita, Brno
2Radiodiagnostická klinika, Všeobecná fakultní nemocnice, Praha
3Interní klinika, Ústřední vojenská nemocnice, Praha
4Česká gynekologická a porodnická společnost ČLS JEP
5Radiodiagnostické oddělení, Masarykův onkologický ústav, Brno
6Asociace mamodiagnostiků České republiky
Souhrn
Programy sekundární prevence zhoubných nádorových onemocnění představují účinný nástroj pro snížení s nimi související úmrtnosti. Implementace těchto programů byla doporučena Radou Evropské unie. Rada doporučuje, v souladu s přesvědčivými výsledky klinických a epidemiologických studií, zavedení tří populačních screeningových programů:
- screening nádorů prsu prostřednictvím mamografického vyšetření,
- screening nádorů tlustého střeva a konečníku prostřednictvím testu na okultní krvácení do stolice, a
- screening nádorů děložního hrdla prostřednictvím cytologického vyšetření stěru z děložního hrdla.
V České republice jsou v současnosti nabízeny všechny tři uvedené screeningové programy. Nezbytné předpoklady organizovaného screeningového programu zahrnují dle doporučení IARC stanovení režimu screeningu (specifikace cílových věkových skupin, screeningového testu a screeningového intervalu), definice cílové populace pro účely adresného zvaní klientů, pověření skupiny zodpovědné za implementaci programu a nastavení jasné rozhodovací struktury a zodpovědnosti za zdravotní péči o klienty programu.
Mezi nezbytné komponenty organizovaného programu patří rovněž propracovaný systém informační podpory. Ten zahrnuje monitoring screeningového procesu prostřednictvím hodnocení dat o provedených vyšetřeních a zároveň monitoring dopadu programu na epidemiologické charakteristiky onemocnění v cílové populaci. Všechny tři české programy jsou takovým informačním systémem vybaveny. Monitoring screeningového procesu využívá cíleného sběru dat o vyšetřeních na jednotlivých centrech pro průběžné hodnocení prostřednictvím indikátorů kvality, které informují o účinnosti, bezpečnosti a nákladové efektivitě programu. Další cenná data lze získat využitím údajů sbíraných plátci zdravotní péče pro účely jejich výkaznictví. Pro potřeby screeningu jsou v ČR také k dispozici všechna populační data nezbytná pro hodnocení jeho vlivu. Jde o demografická data a databázi zemřelých (Český statistický úřad) a Národní onkologický registr (ÚZIS ČR). Základní epidemiologické přehledy jsou interaktivně dostupné na portálu „Epidemiologie zhoubných nádorů v ČR“, www.svod.cz. O jednotlivých programech lze získat další informace na portálech www.mamo.cz, www.kolorektum.cza www.cervix.cz.
3. Epidemiologie a časný záchyt preventabilních nádorových onemocnění v ČR
Mužík J., Májek O., Dušek L.
Institut biostatistiky a analýz, Masarykova univerzita, Brno
Souhrn
Jedním z nejdůležitějších předpokladů úspěšné léčby nádorových onemocnění je jejich včasný záchyt. Díky tomu, že v Národnímu onkologickému registru České republiky (NOR) jsou dlouhodobě zaznamenávány údaje o klinickém stádiu onemocnění při stanovení diagnózy, je možné pomocí těchto dat sledovat trendy v záchytu stadií a jejich případné změny v důsledku zavádění pokročilejších diagnostických metod a programů screeningu. Z pohledu záchytu časných stadií u nově diagnostikovaných malignit lze v ČR diagnózy rozdělit do tří skupin.
První skupinu tvoří novotvary s nízkým podílem časných stádií, u kterých zásadní zlepšení stavu není reálně očekávatelné. Lze sem zařadit především některé nádory trávícího traktu (nádory jater, žlučníku a žlučových cest, slinivky břišní), dále nádory plic a nádory hlavy a krku.
Druhou skupinu tvoří novotvary s relativně vysokým podílem časných stádií, u nichž již je dostupná efektivní diagnostika a/nebo je zaveden screening. Patří sem všechny nádory kůže, nádory varlete, nádory prsu a hrdla děložního s běžícím screeningem a dále nádory ledvin, močového měchýře a prostaty, u nichž jsou plošně zaváděny efektivní diagnostické metody, díky kterým dochází k viditelnému nárůstu podílu časných stadií.
Třetí skupinu tvoří novotvary s relativně nízkým podílem časných stádií, které jsou však preventabilní, a zvýšení podílu časných stádií je reálně možné. Mimo jiné sem můžeme zařadit nádory tlustého střeva a konečníku, u kterých je sice zaveden screening, nicméně k žádoucímu nárůstu podílu časných stádií zatím v české populaci nedochází. Cílem tohoto příspěvku je představit souhrnný přehled aktuálního stavu záchytu časných stádií nádorových onemocnění u nově diagnostikovaných nádorů a dokumentovat časové trendy u preventabilních diagnóz.
4. Spolupráce praktického lékaře a pneumoonkologa v diagnostice karcinomu plic
Skřičková J.
Klinika nemocí plicních a tuberkulózy Lékařské fakulty Masarykovy univerzity a Fakultní nemocnice Brno
Úvod
Nádorová onemocnění jsou známa odedávna, ale chápání jejich podstaty, jejich klasifikace, diagnostika a léčba začaly nabývat racionální podobu až v druhé polovině minulého století. Nádorová onemocnění jsou jak nezhoubná, tak zhoubná. Odborný termín pro zhoubný nádor plic je bronchogenní karcinom (karcinom plic, rakovina plic).
V celosvětovém měřítku je karcinom plic mezi všemi zhoubnými nádory na druhém místě. V České republice je na prvním místě mezi zhoubnými nádory u mužů a na prvním místě v příčinách úmrtí na zhoubné nádory. Celková úmrtnost je 93 %, pravděpodobnost přežití 5 let je 8 %, a tak tomu bude pravděpodobně ještě řadu let. Výskyt plicních nádorů sice souběžně se snižováním kuřáckého návyku u mužů mírně klesá, u žen však stoupá, a to v souvislosti s tím, že kuřaček přibývá. V pokročilém stadiu onemocnění je 80 % nově odhalených případů rakoviny plic. V České republice onemocní touto chorobou během roku přibližně 1 muž z tisíce a od roku 1997 do roku 2005 se počet nově zjištěných případů rakoviny plic u žen více než ztrojnásobil. Nádory plic bývají zjišťovány ve věku 35–85 let, nejčastěji mezi 55.–80. rokem života.
Větší ohrožení rakovinou plic je u kuřáků nezvratně prokázáno řadou studií. Ti, kteří kouřili více než 20 cigaret denně po dobu 20 let, mají 20krát vyšší riziko vzniku karcinomu plic než nekuřáci. Samozřejmě existuje řada dalších příčin, které vznik nádoru také podporují – ionizující záření, chemické a biologické příčiny (viry). Uplatňují se také ekologicky nepříznivé vlivy, i když ne v takovém měřítku, jak kuřáci tvrdívají (např. oxid siřičitý). Riziko zvyšuje rovněž pasivní kouření.
Příznaky plicních nádorů
Neexistují časné varovné signály, které by umožnily zachytit chorobu v počátečním stadiu. Jakmile se příznaky nemoci objeví, je už nádor ve stádiu pokročilém. Občas bývá nádor malého rozsahu objeven při vyšetřování jiné nemoci. Příznaky dělíme do 3 skupin:
Plicní příznaky.
Je to především nově vzniklý dlouhotrvající kašel, nebo změna charakteru chronického kuřáckého kašle z produktivního na dráždivý. V době stanovení diagnózy plicního nádoru trpí kašlem asi 80 % nemocných. Dalším příznakem, který bývá zřídkakdy přehlédnut, je vykašlávání krve nebo nitek krve ve sputu. Běžné jsou záněty plic, které neustupují při léčbě antibiotiky nebo se opakovaně obnovují na stejném místě. Při pokročilém nádoru, který se šíří do pohrudnice, svalstva, žeber nebo kůže, se dostavuje bolest neurčitého charakteru, často bývá vázána na nádech (asi 40 % nemocných). Kruté bolesti horní končetiny se vyskytují při zasažení nervových vláken nádorem. Asi 78 % nemocných má dechové obtíže.
Další plicní příznaky jsou:
- chrapot,
- syndrom horní duté žíly (projevuje se otokem krku a obličeje),
- polykací obtíže (důsledek útlaku jícnu nebo prorůstání nádoru do jícnu).
Mimoplicní příznaky
jsou vždy projevem rozsáhlého onemocnění a šíření nádoru do jiných orgánů, především do centrálního nervového systému, kostí, kostní dřeně a jater.
Paraneoplastické příznaky (vedlejší projevy nádorového růstu)
bývají velmi časté a mohou být i prvním projevem onemocnění. Vznikají především při atypické sekreci některých hormonů, ale mohou být i kožní (dermatomyositis), svalové (myastenie), neurologické (periferní neuropatie) a cévní (záněty žil).
Stanovení diagnózy
Klinické vyšetření
Prvním krokem, a to nejen u nádorového onemocnění, je objektivní klinické vyšetření nemocného. Poslech na hrudníku u nemocných s rakovinou plic bývá často normální, můžeme se však setkat se všemi obrazy patologického poslechového nálezu (s pískoty a vrzoty, vymizelým dýcháním či zkráceným poklepem). Vyšetřovat musíme i lymfatické uzliny a další orgány (především játra a slezinu), abychom mohli posoudit šíření nádoru.
Zobrazovací metody
následují po klinickém vyšetření. Jde především o rentgenový snímek, dále o vyšetření počítačovou tomografií, magnetickou rezonancí a novou citlivou metodou – pozitronovou emisní tomografií (PET).
Všechna tato vyšetření umožňují lokalizovat plicní nádor, určit jeho velikost, postižení uzlin, prorůstání nádoru mimo plicní tkáň (např. do cév, pohrudnice, hrudní stěny, jícnu). Ultrazvukové vyšetření břišní dutiny pomáhá odhalit metastázy především v játrech, radioizotopové vyšetření stanovuje metastázy v kostech a magnetická rezonance v mozku. Na základě zobrazovacích metod můžeme na diagnózu nádoru vyslovit pouze podezření. Definitivní diagnóza se stanovuje na základě histologického a/nebo cytologického vyšetření.
Bronchoskopické vyšetření
Pomocí přístroje – bronchoskopu – lze speciálními kleštičkami a kartáčky nejen odebrat materiál pro histologické či cytologické vyšetření, ale i makroskopicky hodnotit změny v průduškovém stromu, monitorovat průběh nemoci a provádět paliativní (endobronchiální) léčebné zákroky. Bronchoskopické kontroly jsou důležité pro hodnocení úspěchu léčby, při sledování dalšího vývoje onemocnění po léčbě a pro včasný záchyt recidivy choroby.
Obr. 1. Endobronchiálně rostoucí nádor 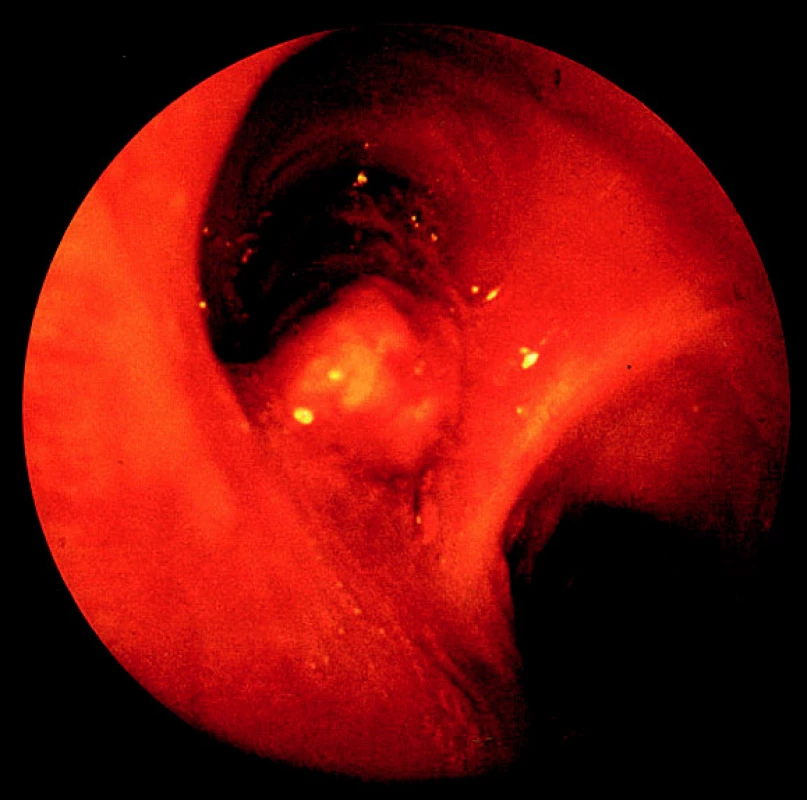
Torakoskopie a cílená transtorakální biopsie
umožňují získat histologicky hodnotitelný vzorek nádoru k určení jeho povahy.
Klasifikace plicních nádorů
Nádory plic dělíme podle jejich biologického chování, histologického složení, rozsahu a umístění. Co nejpřesnější klasifikace nádoru a určení stadia jsou nezbytné pro plánování léčby, rozhodnutí o léčebné strategii a sledování.
První systém pro klasifikaci zhoubných nádorů, popisující anatomický rozsah choroby, vypracoval Pierre Denoix z Francie v letech 1943–1952. Jeho „systém TNM“ je založen na určení tří složek. Jsou to:
T – rozsah nádoru,
N – nepřítomnost, nebo přítomnost metastáz v regionálních mízních uzlinách, a
M – nepřítomnost, nebo přítomnost vzdálených metastáz.
Podle klasifikace TNM můžeme určit klinické stadium onemocnění (I–IV). Naposledy byla klasifikace TNM přepracována v roce 1997, kdy byly vytvořeny nové podskupiny podle rozdílné prognózy nemocných v závislosti na velikosti nádoru.
Pro praxi má největší význam dělení nádorů plic do dvou skupin podle histologického obrazu a biologických vlastností nádoru (z jejich rozdílných biologických vlastností vyplývá i rozdílný přístup k léčbě):
- nemalobuněčné karcinomy plic (70–75%),
- malobuněčné karcinomy plic (25–30%).
V anglické literatuře se používá název Non Small Cell Lung Cancer pro nemalobuněčné karcinomy plic (NSCLC) a Small Cell Lung Cancer (SCLC) pro skupinu malobuněčných karcinomů plic.
Nemalobuněčný karcinom plic
Nemalobuněčný typ plicní rakoviny je jedním z nejčastějších plicních nádorů. Roste pomalu, později metastázuje a je málo citlivý k chemoterapii (podávání speciálních léků – cytostatik) a radioterapii (léčbě ozařováním). Na pětileté přežití má naději 10 % nemocných.
Vzhledem ke své biologické povaze byl tento nádor, na rozdíl od malobuněčných forem, považován až do roku 1980 za léčitelný pouze v těch případech, kdy byla možná operace. Přihlédneme-li ke skutečnosti, že ze všech „včasně“ zjištěných případů není ani 20 % operabilních, bylo zbývajících více než 80 % považováno za nádory neléčitelné. Pro pokročilá stadia onemocnění se léčba nedoporučovala.
Výsledky studií z posledních let prokázaly, že i pokročilé formy nemalobuněčného karcinomu reagují na léčbu chemoterapií a u některých stádií společně s radioterapií. Současná léčba se zaměřuje na prodloužení délky života, jeho kvalitu a ovlivnění vedlejších příznaků nemoci. Léčba nemalobuněčných nádorů plic se řídí zařazením do klasifikace TNM a klinických stádií. V pokročilých stádiích (IIIB a IV) je při stanovení diagnózy onemocnění u více než poloviny nemocných.
Obr. 2. Nemalobuněčný karcinom pravé plíce před léčbou a po léčbě 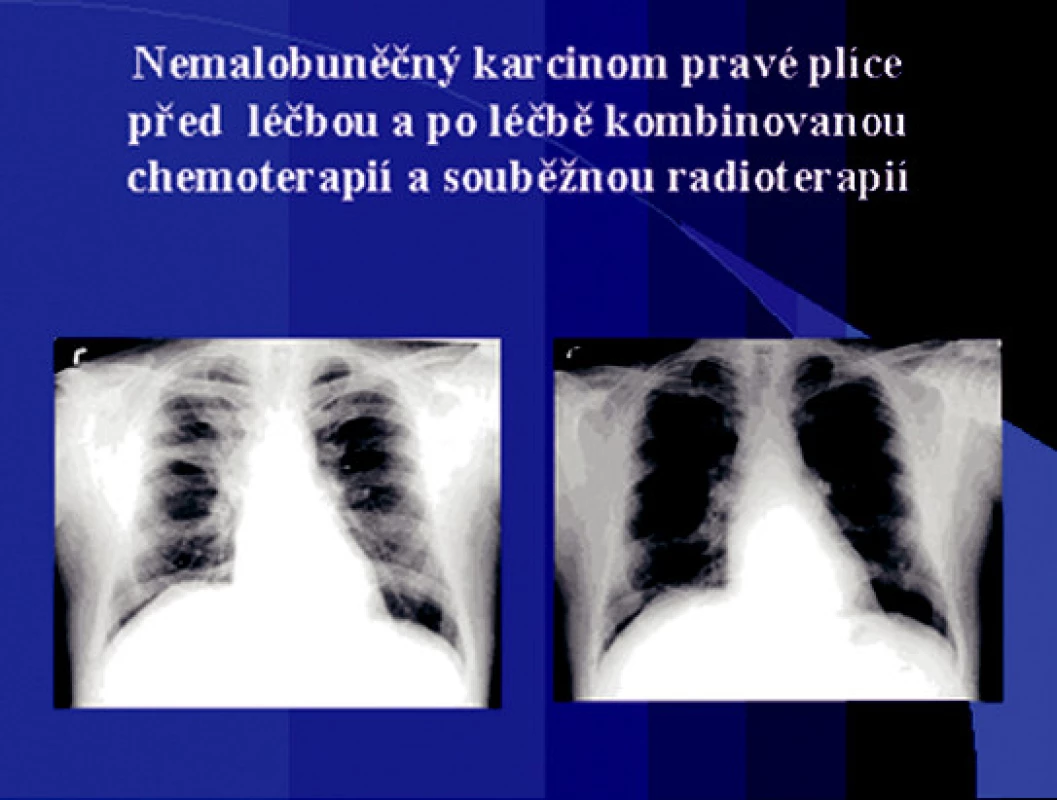
Základní léčebné možnosti nemalobuněčného karcinomu plic
Chirurgická léčba
Podle současných poznatků je chirurgický zákrok s kurativním (léčebným) záměrem doporučován tehdy, kdy je nádor malého rozsahu a nádorové postižení uzlin je minimální. Jde především o klinická stádia I a II, není-li operace vyloučena z hlediska plicní ventilace nebo závažného interního onemocnění. Obdobně je tomu u klinického stadia IIIA, ale před operací se doporučuje u tohoto stádia zmenšit rozsah nádoru pomocí chemoterapie, popř. v kombinací s radioterapií. V době stanovení diagnózy je chirurgická léčba reálná u 20–25 % nemocných podle zahraničních pramenů, v České republice u 10–17 % nemocných. Pět let přežívá u klinického stádia I zhruba 60–70 % operovaných nemocných, u stadia II 35–40 % a u stádia IIIA 10–15 %.
Chemoterapie (léčba cytostatická)
Pokud je nádor diagnostikován jako místně pokročilý a/nebo jsou přítomny metastázy, indikuje se chemoterapie s následnou nebo souběžnou radioterapií. Názory na chemoterapii se postupně vyvíjely. Před rokem 1980 byl nemalobuněčný karcinom plic považován za nádor, který chemoterapii odolává a pro tuto léčbu není vhodný. V letech 1980–1990 se do léčby zavedla cytostatika cisplatina a karboplatina a procento léčebných odpovědí vzrostlo.V devadesátých letech 20. století byla do léčby zařazena tzv. cytostatika III. generace (paclitaxel, docetaxel, vinorelbin, gemcitabin). Při použití léčebných kombinací s těmito cytostatiky se u více pacientů nádor zmenšuje (objektivně odpovídá na léčbu), což pro nemocné znamená především ústup potíží.
Radioterapie (léčba zářením)
Radioterapie s léčebným záměrem je indikována u nemocných, kteří nejsou schopni operace a nemají prokázány vzdálené metastázy.
Kombinovaná léčba chemoterapií a radioterapií patří v současné době do standardních léčebných postupů.
Perspektivy léčby chemoterapií a radioterapií spočívají v současné době ve zdokonalování léčebné taktiky, v optimálním načasování léčby s využitím intenzity dávek, ve snižování toxicity, v účinnějším předcházení vzniku metastáz a v překonání rezistence vůči chemoterapii. Snahou je podávat cytostatika perorálně (obvykle v tabletách), pokud perorální forma existuje.
Nové směry protinádorové léčby nemalobuněčného karcinomu plic – cílená biologická léčba
Ukazuje se, že v chemoterapii již bylo dosaženo maximum a žádná nová cytostatika ani nové kombinace již nepřispějí k významnému zlepšení léčebného efektu a přežívání nemocných. Biologická léčba se někdy nazývá také jako tzv. cílená molekulární terapie, protože lépe vyjadřuje skutečnost, že zasahuje selektivněji do nitrobuněčných pochodů v nádorové buňce.
Většinou se jedná o nízkomolekulární látky, které vazbou např. na receptory, blokují signální dráhy do buněčného jádra. Ty ve svém důsledku ovlivňují vlastnosti buňky, které ji činí maligní, jako jsou:
- inhibice apoptózy (u nádorové buňky nedochází ke kontrolované buněčné smrti tak, jako u fyziologické buňky),
- schopnost novotvorby cév a vlastního zásobování nádoru živinami,
- nekontrolovaná proliferace nádorové buňky,
- schopnost nádorové buňky metastázovat.
V léčbě pokročilého NSCLC byly z této skupiny zkoušeny inhibitory tyrozinkinázy receptoru epidermálního růstového faktoru (EGFR) – erlotinib a gefitinib, také monoklonální protilátka proti EGFR – cetuximab. Zdá se, že prospěch z této léčby mají jen určití nemocní, u nichž na povrchu nádorové buňky je nejen tento receptor pro epiteliální růstový faktor exprimován ve vysokém procentu, ale navíc je nositelem určitých mutací. V klinických studiích byly nalezeny čtyři klinické faktory, které predikují dobrou odpověď na léčbu. Je to asiatská rasa, ženské pohlaví, nekuřáctví a histologický typ – adenokarcinom.
Jednoznačné prediktivní faktory pro léčebnou odpověď jsou však stále ve fázi intenzivního výzkumu. Na základě výsledku randomizované (kontrolované) studie s placebem je v naší republice kategorizován pro léčbu nemocných s nemalobuněčným karcinomem plic erlotinib. Je indikován u nemocných v dobrém klinickém stavu s pokročilým nemalobuněčným bronchogenním karcinomem po selhání první a/nebo druhé línie chemoterapie. Jedná se o léčbu perorální, která je především staršími nemocnými velmi dobře tolerována ve srovnání s konvenční cytostatickou léčbou. V roce 2009 byly publikovány studie, které dokumetují účinnost gefitinibu u nemocných s NSCLC, u kterých byly přítomny mutace genu EGFR.
Dalším nadějným biologickým preparátem nadějným v léčbě NSCLC je protilátka, která blokuje receptor vaskulárního endoteliálního růstového faktoru VEGFR. Jedná se o bevacizumab. V klinických studiích byly prokázány velmi dobré léčebné výsledky v kombinaci s konvenční chemoterapií u nemocných s pokročilým nedlaždicobuněčným NSCLC již v první linii po stanovení diagnózy.
Malobuněčný karcinom plic
Malobuněčný karcinom plic tvoří 20–25 % všech plicních nádorů. Již v roce 1879 publikovali Harting a Hess první práce o endemickém onemocnění u horníků, které je důsledkem dlouhé expozice arzenu a jiným kovům. Později (1917) bylo toto onemocnění pojmenováno jako plicní nádor, a roku 1926 W. G. Barnard přesně popsal malobuněčný karcinom jako nádor odlišný od jiných typů plicních nádorů a nazval jej „oat cells“, protože mu maligní buňky připomínaly zrnka ovsa.
Klasifikace malobuněčného karcinomu plic procházela postupnými změnami v letech 1962–1988. V současné době je pro praxi nejdůležitější dělení do dvou skupin na
- „limitované stádium“, a
- „extenzivní stádium“.
Limitované stádium je onemocnění ohraničené na jedno plicní křídlo, mohou být postiženy uzliny a může být přítomen stejnostranný výpotek. Ozařování může být provedeno v jednom ozařovacím poli.
Extenzivní stádia jsou všechny ostatní formy onemocnění.
Nádor se rychle šíří do jiných orgánů, především uzlin, jater, mozku a kostní dřeně. V době diagnózy se nádor většinou již projevuje svými příznaky. Zároveň se dostavují paraneoplastické syndromy, což jsou často první příznaky, které na nádor upozorňují. Jde o projevy neurologické, kožní, o bolesti kloubů, záněty žil a další.
Malobuněčný typ rakoviny plic je systémové onemocnění, vyžadující systémovou léčbu. Z rozdílných biologických vlastností malobuněčných karcinomů vyplývá i rozdílný přístup k jejich léčbě.
Základním léčebným postupem u obou stádií malobuněčného karcinomu plic je chemoterapie, která pomáhá zlepšit kvalitu života a prodlužuje nemocným život.
Prognóza nemocných závisí na stádiu onemocnění v době stanovení diagnózy. Léčebné odpovědi na chemoterapii se dosahuje u 80–90 % nemocných bez ohledu na původní rozsah nemoci. Je však dočasná a u většiny nemocných se choroba vrací. U limitovaného onemocnění je bez léčby střední doba přežití 3 měsíce, při léčbě chemoterapií 12–14 měsíců a při kombinované léčbě chemoterapií a radioterapií 16–20 měsíců. U extenzivního stadia onemocnění je medián přežití bez léčby 6 týdnů, při léčbě chemoterapií 7–8 měsíců. Dva roky přežívá 5 % nemocných s malobuněčným karcinomem plic.
Obr. 3. Malobuněčný karcinom levé plíce před léčbou a po léčbě 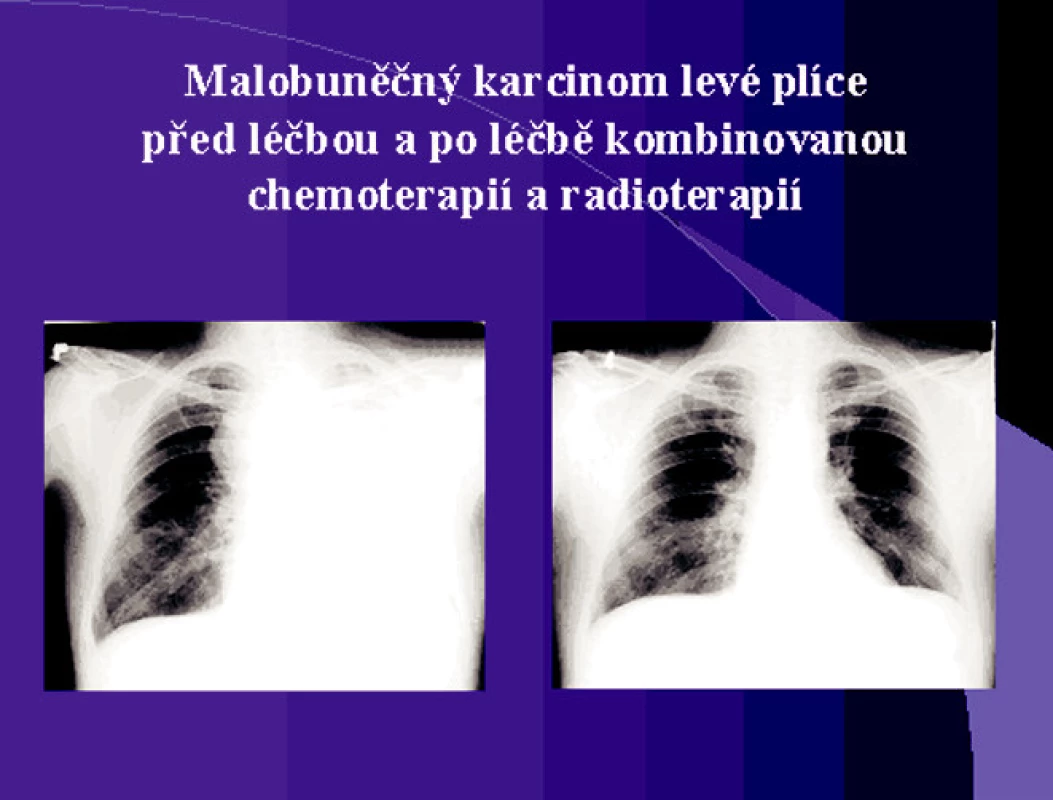
Základní léčebné možnosti u malobuněčného karcinomu plic
Chemoterapie
Za standardní léčbu se v současné době považuje kombinace platinového derivátu (cisplatina, karboplatina) a etoposidu. Po počáteční léčbě se u více než 95 % nemocných onemocnění vrátí. V těchto případech se přistupuje k léčbě druhé linie. Pokud se jedná o onemocnění, které se zhoršuje za dobu delší než 3 měsíce od poslední léčby, podává se opět platinový derivát s etoposidem. Pokud se onemocnění zhoršuje dříve a/nebo na léčbu po stanovení diagnózy nereaguje, podává se topotecan.
Radioterapie
Radioterapie v kombinaci s chemoterapií se dnes u limitovaného stadia onemocnění považuje za standardní léčebný postup. U extenzivního stadia má význam pro ovlivnění příznaků. U nemocných s limitovaným stádiem onemocnění, které odpovědělo na léčbu, se předepisuje preventivní ozáření mozku, aby se snížilo riziko mozkových metastáz, které nemocného zatěžují nejvíce.
Chirurgie
Vzhledem k biologické povaze nádoru se operační zákrok provádí velmi vzácně a jen u nádorů velmi malého rozsahu.
Paliativní léčba karcinomu plic
Cílem paliativní léčby je zmírnit potíže nemocného a pozitivně ovlivnit kvalitu jeho života. Týká se pacientů, jejichž nemoc je ve stadiu, kdy již nelze uvažovat o vyléčení. Zahrnuje všechny aspekty lékařské i nelékařské péče o nemocného i jeho rodinu, a to trvale po celou dobu nemoci.
Paliativní léčba je indikována u více než 50 % nemocných rakovinou plic již po stanovení diagnózy a řídí se stejnými zásadami jako u jiných nádorových onemocnění. Předepisujeme ji především kvůli potížím, které jsou spojeny se syndromem horní duté žíly, s maligním pohrudničním výpotkem a nádorovou obstrukcí dýchacích cest. V rámci paliativní léčby se využívá především aplikace cytostatik do pohrudniční dutiny, podávají se kortikoidy a někdy se i snažíme zmenšit nádor chirurgickou cestou. V případě bronchiální obstrukce se pokoušíme zlepšit průchodnosti dechových cest pomocí laseru nebo využitím elektrické energie (pomocí elektrokauteru), některá pracoviště využívají i zmrazení nádorové tkáně s odstraněním s určitým odstupem (kryoterapii). Lze použít také brachyterapii, což lze zjednodušeně vyjádřit jako zavedení zářiče přímo do dechových cest.
Dalším řešením může být zavedení stentu při tlaku nádoru zvenčí. Endobronchiální stenty jsou umělohmotné, kovové (drátěné) nebo kombinované průduškové a bronchiální protézy se schopností udržet volný průsvit průdušky, a tím zabezpečit přívod vzduchu do ohrožené oblasti. Stenty jsou konstruovány tak, že jsou schopny v roztaženém stavu odolávat tlaku okolní tkáně, lze je proto využít u nádorových i nenádorových jizevnatých stenóz centrálních dechových cest. Při paliativní léčbě se nezapomíná ani na léčbu medikamentózní (pro zmenšení dechových obtíží, bolestí, zánětů žil, kašle, vykašlávání krve, srdečního selhávání) a léčbu přidružených interních nemocí. Velmi důležitou oblastí je péče o psychický stav nemocného. Veškerá paliativní léčba je nedílnou součástí komplexní onkologické péče.
Prognóza a prevence karcinomu plic
Prognóza nemocných závisí na stadiu onemocnění, klinickém stavu, přidružených nemocech a imunologickém stavu. Důležitý je údaj o váhovém úbytku a přítomnosti paraneoplastických příznaků. Nejlepší prognózu mají nemocní, u nichž byl nádor diagnostikován ve stadiu, kdy ho lze operovat. Prognóza nemocných s neoperabilním nádorem je i přes veškerou poskytovanou léčbu stále špatná.
Základním problémem nádorů plic je to, že bývá diagnostikován pozdě, v době, kdy má takový rozsah, že chirurgická léčba, která doposud jako jediná může vést k uzdravení, není možná.
Proto probíhá řada studií, které se zaměřují na význam vyšetření zaměřených na včasný záchyt nádorů plic.
Vzhledem k tomu, že u žádného jiného onemocnění nebyla prokázána tak výrazná souvislost s kouřením jako u nádorů plic, je v současné době výchova k nekuřáctví nejvýraznějším preventivním opatřením.
Kvalitní onkologická péče o nemocné s plicními nádory je možná pouze při zachování komplexnosti a s přihlédnutím ke všem současným možnostem. Při všech diagnostických a léčebných rozvahách se nesmí zapomínat na osobnost nemocného, jeho náhled na onemocnění a jeho motivace, vyplývající se závislosti na životě a sociálním zázemí. V popředí každé zvolené léčebné strategie musí být především snaha o zlepšení kvality života nemocného. U všech onkologicky nemocných platí zásada, že musí být trvale sledováni.
Závěr
Spolupráce pneumoonkologa a praktického lékaře v diagnostice a léčbě karcinomu plic spočívá především v tom, že praktický lékař bude aspoň rámcově seznámen se všemi možnostmi současné léčby, bude na možnost karcinomu plic myslet v případě, že narazí na některý z příznaků tohoto onemocnění, bude věnovat pozornost kuřákům a bývalým kuřákům, dále pracujícím v rizikovém prostředí, bude spolupracovat při léčbě s kurativním záměrem i při léčbě paliativní
Zdroje
1. Altuang, O., Stewart, D., Fossella, F.V. et al. Many Patients over 80 Years and Older with Advanced Non-small Cell Lung Cancer (NSCLC) Can Tolerate Chemotherapy. J. Thorac. Oncol.,2007, 2, p. 141–146.
2. Goldstrraw, P., Crowley, J., Chanski, K. et al. The IASLC Lung Cancer Staging Project: Proposals for Revision of the TNM Stage Griupings in the Forthcoming (Seventh Edition of the TNM Classification of Malignant Tumours. J. Thorac. Oncol. 2007, 2, p. 706–714.
3. Hanna, N.H., Shepherd, F.A., Rosell, R. Randomized phase III trial of pemetrexed versus docetaxel in patients with non-small cell lung cancer previously treated with chemotherapy. J. Clin. Oncol. 2004, 22, p. 1 589–1 597.
4. Le Chevalier, T., Scagliotti, G., Natale, R. et al. Efficacy of gemcitabine plus platinum chemotherapy compared with other platinum containing regimens in advanced non-small cell lung cancer: a metaanalysis of survival outcomes. Lung Cancor 2005, 47, p. 69–80.
5. Lunch, T.J., Bell, D.W., Sordella, R. et al. Activating Mutations in the Epidermal Growth Factor Receptor Underlying Responsiveness of Non-Small-Cell Lung Cancer to Gefitinib. N. Engl. J. Med. 2004, 350, p. 2 129–2 139.
6. Pešek, M. et al. Bronchogenní karcinom. Praha, Galén 2002, 235.
7. Shepherd, F.A., Pereira, J.R., Ciuleanu, T. et al. Erlotinib in previously treated non-small-cell lung cancer. N. Engl. J. Med. 2005, 353, p. 123–132.
8. Skřičková, J. a kol. Bronchogenní karcinom (41-62). In: Adam, Z., Vorlíček, J., Vaníček, J. a kol.: Diagnostické a léčebné postupy u maligních chorob. Druhé, aktualizované a doplněné vydání. Praha, Grada Publishing 2004, 692 s.
9. Zatloukal, P., Petrželka, L. Karcinom plic. Praha, Grada 2001, 367 s.
10. http://www.svod.cz
11. Sculier, J., Pand Moro-Sibilot, D. First-and second-line therapy for advanced non-small cell lung cancer, Eur. Respir. J. 2009, 33, p. 915-930
12. Belani, C.P., Brodowicz. T., Ciuleau. T. et al: Maintenance pemetrexed (Pem) plus best supportive care (BSC) versus placebo (Plac) plus BSC: A randomized phase III study in advanced non-small cell lung cancer. J. Clin. Oncol. 2009. 27 (suppl), p. 18.
Štítky
Praktické lekárstvo pre deti a dorast Praktické lekárstvo pre dospelých
Článok vyšiel v časopisePraktický lékař
Najčítanejšie tento týždeň
2009 Číslo 9- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Naděje budí časná diagnostika Parkinsonovy choroby založená na pachu kůže
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Helsinská deklarace Světové lékařské asociace (WMA)
- Koncepce oboru všeobecné praktické lékařství
- Dříve vyslovená přání aneb o lidské svobodě a důstojnosti
- Echokardiografie a antikoagulační léčba u nemocných s embolickou CMP
- Demence v ordinaci praktického lékaře
- Sebepoškozování – závažný symptom a nebezpečný společenský jev
- Životní styl mladých zdravých žen s rozdílným kuřáckým chováním
- Syndrom vyhoření a posudkoví lékaři
- Deprese a úzkost těhotných žen
- Recenze
- Hudba a zpěv v životě J. E. Purkyně
- Miniportréty slavných českých lékařů: Profesor MUDr. Bohumil Prusík – zakladatel české angiologie
- Čtyřicet let s Rozhledy v chirugii
- Düsseldorfský veletrh MEDICA oslavuje čtyřicátiny
- Kolonoskopie pomáhá zachraňovat životy
- Redakční pošta: Náhle vzniklá dramatická porucha vnímání chuti
- Vybrané kapitoly z medicínskej etiky
- Klíšťata jsou stále nebezpečná: Boj proti klíšťatům nemá konce!
- Blok I
- Blok II
- Blok III
- Blok IV
- Jubilea
- Praktický lékař
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Deprese a úzkost těhotných žen
- Sebepoškozování – závažný symptom a nebezpečný společenský jev
- Demence v ordinaci praktického lékaře
- Echokardiografie a antikoagulační léčba u nemocných s embolickou CMP
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



