-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Patogeneze postižení pojivové tkáně při diabetes mellitus
Pathogenesis of the connective tissue in diabetes
Non-enzymatic glycation and oxidative stress are main contributors in pathogenesis of the connective tissue changes in diabetes. Properties of separate parts in the connective tissue and particularly those of intercellular matrix may be impaired by both mechanisms. In addition, changes in microcirculation including endothelial dysfunction and also diabetic neuropathy further aggravate tissue impairment. Despite known pathogenic mechanisms in development of diabetic microangiopathy there are series of unresolved questions in the pathogenesis of diabetic skin disorders.
Key words:
diabetes mellitus - connective tissue - protein glycation - oxidative stress
Autoři: J. Škrha
Působiště autorů: III. interní klinika 1. lékařské fakulty UK a VFN, Praha, přednosta prof. MUDr. Štěpán Svačina, DrSc., MBA
Vyšlo v časopise: Vnitř Lék 2006; 52(5): 446-450
Kategorie: Diabetes a další obory (infekce, dermatovenerologie a revmatologie), Hradec Králové 3.–4. června 2005
Souhrn
V patogenezi změn pojiva při diabetu se účastní především neenzymová glykace proteinů a oxidační stres. Vlivem obou mechanizmů se mění vlastnosti jednotlivých složek pojivové tkáně s maximem změn v mezibuněčné hmotě. K odchylkám dále přispívají změny mikrocirkulace včetně endotelové dysfunkce a dále postižení nervů. Na rozdíl od patogenetických mechanizmů rozvoje diabetické mikroangiopatie zůstává v patogenezi kožních změn ještě řada nejasností.
Klíčová slova:
diabetes mellitus - pojivová tkáň - glykace proteinů - oxidační stresÚvod
Diabetes mellitus se vyznačuje biochemickými změnami, které podmiňují postižení prakticky všech tkání organizmu. Většina z nich vyplývá ze základní metabolické poruchy, která ovlivňuje řadu biochemických reakcí včetně jejich regulačních mechanizmů. Závisí pak na druhu tkáně, její buněčné i mimobuněčné součásti, jakým pochodům podléhá a k jakým faktorům je citlivější. Hyperglykemie jako základní projev metabolické poruchy při diabetu totiž ovlivňuje rozvoj různých abnormalit, které se podílejí rozdílným způsobem na patogenezi změn příslušné tkáně.
Kůže je samostatným orgánem, který má komplexní strukturu a plní specifické funkce. Je bariérou mezi jedincem a jeho vnitřním prostředím na jedné straně a zevním prostředím na druhé straně. Obsahuje specifické buňky, keratinocyty, které se v jiném orgánu nevyskytují, a dále pojivovou tkáň obsahující též kapiláry a nervová vlákna. Všechny složky mohou být tudíž ovlivněny následky chronické hyperglykemie a vést k projevům diabetu v tomto orgánu. Kůže diabetika však může být postižena i změnami, které nejsou pro diabetes příznačné, neboť se vyskytují i u nediabetické populace. Cílem tohoto sdělení je však poukázat na mechanizmy přímo vyplývající z diabetu, které se podílejí na rozvoji kožních změn a zejména pojivové tkáně jako následek tohoto onemocnění.
Hyperglykemie - zdroj patogenetických změn
Neschopnost organizmu zacházet s glukózou jako za fyziologického stavu je základním rysem diabetu. Porušená utilizace glukózy vede k jejímu hromadění v extracelulárním prostoru, což pak vede ke zvýšené expozici buněk i mimobuněčné hmoty tomuto monosacharidu. Pokud by byla glukóza „inertní“, k žádným změnám by nemuselo dojít. Glukóza je však zapojena do celé řady reakcí, které ovlivňují svými produkty funkci a morfologii příslušných tkání s následným rozvojem komplikací. Analýza experimentálních i klinických studií ukázala, že zvýšená koncentrace glukózy vyvolává řadu abnormalit, jejichž mechanizmy se mohou podílet na patogenezi komplikací [1]. Zvýšená koncentrace glukózy podmiňuje změnu pochodů lokalizovaných jak uvnitř buňky, tak mimo ni (obr. 1). Závisí na druhu buněk i tkáně samotné, jaký pochod je přednostně ovlivněn, a ten pak může ovlivnit rozvoj komplikace. Vzhledem k tomu, že tkáň je tvořena více komponentami, patogeneze jejích komplikací je složitější.
Obr. 1. Patogenetické mechanizmy podmiňující rozvoj pozdních komplikací při diabetes mellitus. 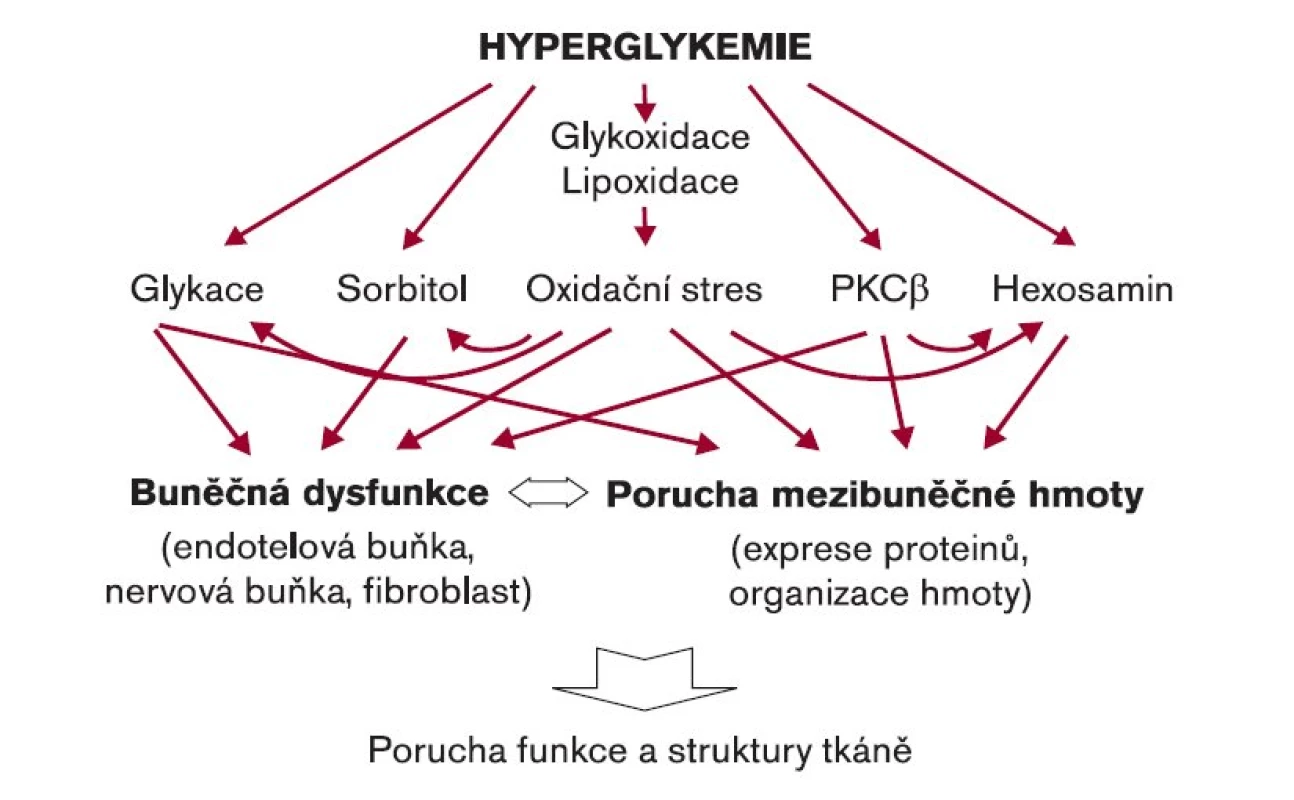
Na rozdíl od patogeneze cévních komplikací zůstávají u kožních změn při diabetu ještě některé nejasnosti. Z klinické praxe je známo, že kůže diabetika může být tužší a méně poddajná než u nediabetiků, že se diabetikovi hůře hojí rány, ale otázky, zda jsou přítomny odchylky v deskvamaci keratinocytů či jaké jsou rozdíly v rohovění (tvorbě otlaků ap), čekají na další výzkum, i když mnohé již byly řešeny. Některé pochody vyplývající z hyperglykemie se však zdají mít patogenetickou souvislost s pozorovanými změnami. Hlavní účast má neenzymová glykace a oxidační stres.
Neenzymová glykace a její následky v pojivové tkáni
Glukóza se váže na protein přes volné aminoskupiny, nejčastěji přes ε-aminoskupinu lyzinu za tvorby glykovaného proteinu. Reakce není katalyzována žádným enzymem a stupeň glykace pak závisí na koncentraci glukózy, délce jejího působení (expozici) a na biologickém poločasu proteinu. Znamená to, že v prostředí s dlouhodobě zvýšenou koncentrací glukózy, jako je tomu při diabetu, dochází ke zřetelně vyšší glykaci. Dlouhodobě dekompenzovaný diabetes skýtá možnost vyššího stupně glykace než diabetes výborně kompenzovaný. Dále je zřejmé, že proteiny s velkým biologickým poločasem, k nimž patří např. kolageny a další strukturní proteiny (laminin, fibronektin ap), podléhají vyššímu stupni glykace než např. enzymy, jejichž biologický poločas je pouze několik minut. Proto pojivová část kůže obsahující kolagen a další proteiny skýtá předpoklady, aby glykace dosáhla vyššího stupně.
Při neenzymové glykaci dochází nejprve ke vzniku aldiminu (Schiffovy báze), který rychle přechází ve stabilnější ketoamin. Ten je pak následně zdrojem tvorby tzv. pokročilých produktů glykace (AGE, advanced glycation endproducts) [2]. Řada z nich již byla detailně popsána (karboxymetyllyzin, pentozidin) (obr. 2) a byly vyvinuty eseje na jejich stanovení. Strukturální změna proteinu způsobená vazbou glukózy na protein umožňuje, aby mezi vlákny proteinu vznikaly nové vazby, takže se může utvářet řetězení vláken kolagenu, který má pak nové vlastnosti (změna poddajnosti, odolnosti k proteázám, pevnosti ap). Vzhledem k tomu, že kolagen má dlouhý biologický poločas, znamená neenzymová glykace významný děj, který podstatně ovlivní charakteristické vlastnosti pojivové tkáně. Biomechanické vlastnosti kůže byly studovány i za experimentálních podmínek [3]. Aminoguanidin, inhibitor glykace, částečně blokoval vznik těchto změn [3]. Jeho použití i v jiných experimentech vedlo nejen k nižší tvorbě glykovaných proteinů, ale i AGE [2].
Obr. 2. Neenzymová glykace proteinů a tvorba pokročilých produktů glykace. 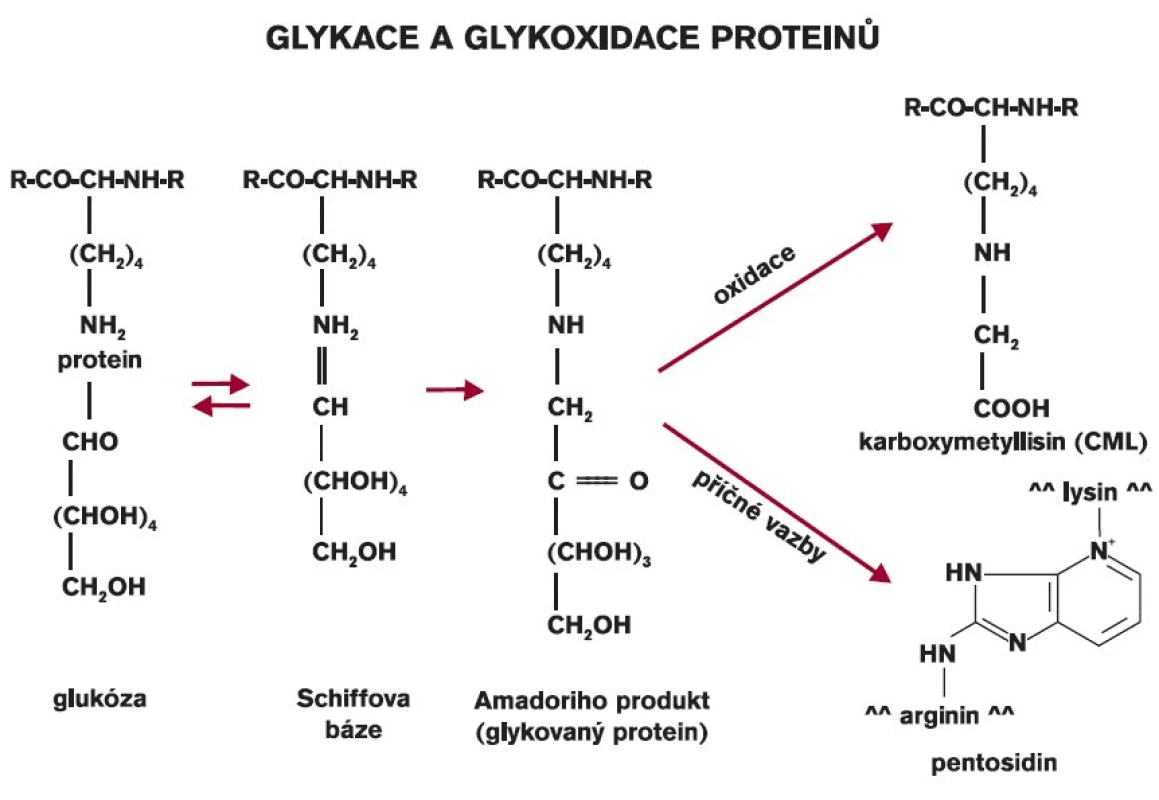
Tvorba pokročilých produktů glykace vede ještě k dalším změnám. AGE jsou totiž rozpoznávány specifickými receptory označenými RAGE, které se vyskytují na membránách různých buněk (např. endotelu, makrofágů aj). Vazba AGE na receptor pak způsobuje aktivaci těchto buněk projevující se zvýšenou syntézou cytokinů, zejména interleukinu 1 a 6 a tumor nekrotizujícího faktoru α. Cytokiny pak mohou ovlivňovat další buňky, a tím zasahovat do mezibuněčných interakcí i vztahů mezi buňkami a mezibuněčnou hmotou. Takto mohou být ovlivněny fibroblasty a exprese některých proteinů v nich. Vedle glykace kolagenu, lamininu a dalších proteinů může být změněna i jejich genová exprese. Ukázalo se totiž, že fibroblasty pěstované ve tkáňové kultuře s vysokým obsahem glukózy v mediu zvyšují expresi kolagenu a fibronektinu a tato schopnost zvýšené tvorby proteinů přetrvává i po jejich přenesení do media s nízkou koncentrací glukózy. Jedná se tedy o paměťový efekt [4]. Dále dochází ke zvýšené expresi některých růstových faktorů, které ovlivní tvorbu mezibuněčné hmoty včetně proliferace kapilár (např. vaskulární endoteliální růstový faktor, VEGF).
Mezibuněčná hmota se mění při diabetu ještě jiným způsobem. Jednotlivé součásti mohou mít porušené vzájemné uspořádání či vztahy, které jsou důsledkem jednak glykace, jednak růstových aktivit. Mění se i složení některých komponent, např. heparan sulfátu, v němž byl pozorován snížený obsah sulfoskupin. Tím se mění jeho vlastnosti, klesá záporný náboj, který ovlivňuje permeabilitu bazální membrány, ale také ovlivňuje interakce součástí pojiva. Uvedené změny jsou typické pro pojivo kůže obsažené v dermis, v níž glykace a její následky mají zřejmě rozhodující význam.
Vedle toho byly pozorovány změny v epidermis, zejména ve stratum corneum. Hlavním strukturním proteinem je vláknitý keratin. U diabetiků byla již dříve popsána zvýšená glykace keratinu v epidermis, která může zřejmě ovlivnit i proces keratinizace, tedy zmíněné rohovatění povrchních vrstev kůže [5,6]. Glykovaný keratin má totiž pozměněné vlastnosti, jak bylo popsáno i v naší literatuře [7].
Uvedené odchylky při diabetu se podílejí i na zvýšeném sklonu k ulceracím, při nichž změny struktury i funkce kůže jsou podmíněny také porušenou proliferací fibroblastů a zvýšenou expresí tkáňových metaloproteináz (MMP), které se podílejí na odbourávání kolagenu pojiva. Jejich zvýšená aktivita pozorovaná v kůži diabetiků se snížila vlivem kyseliny retinové [8]. Tyto i další pokusy svědčí o možnosti farmakologicky ovlivnit enzymy, které přímo zasahují do přestavby mezibuněčné hmoty. Novotvorba kolagenu, jeho vlastnosti a odbourávání jsou tedy důležitým faktorem pro zachování normální struktury a funkce pojiva kůže.
V literatuře byla popsána již dříve řada látek, které snižují neenzymovou glykaci proteinů, jako kyselina acetylsalicylová či askorbová, aminoguanidin, glutation a další [9,10,11]. Ukázalo se, že mnohé z nich ovlivňují i jiný patogenetický mechanizmus, který se podílí na rozvoji chronických změn pojivové tkáně, totiž oxidační stres.
Oxidační stres v pojivu a v kůži při diabetu
Diabetes mellitus podmiňuje vlivem chronické hyperglykemie vyšší tvorbu reaktivních forem kyslíku. Experimentální studie ukázaly, že oxidační stres stimuluje tvorbu glykovaných proteinů, neboť oxidované deriváty glukózy jsou reaktivnější, ale současně i glykace vede k vyššímu stupni oxidačního stresu. Oba procesy jsou velmi úzce propojeny [2,12]. Glukóza podléhá autooxidačním změnám, takže reaktivnější produkty, k nimž se řadí glyoxal a metylglyoxal (dikarbonyl), usnadňují glykační reakce. Vzájemné propojení obou pochodů, tj. neenzymové glykace a autooxidace glukózy, je znázorněno na obr. 3. Během autooxidace vznikají nejen reaktivní dikarbonyly, ale vytvářejí se reaktivní formy kyslíku za účasti přechodných kovů (železa a mědi), které pak mohou přímo působit na proteiny, ale i na nukleové kyseliny. Tomuto procesu jsou vystaveny nejen fibroblasty pojivové tkáně, ale přímo i keratinocyty.
Obr. 3. Autooxidace glukózy provázená tvorbou reaktivních forem kyslíku. 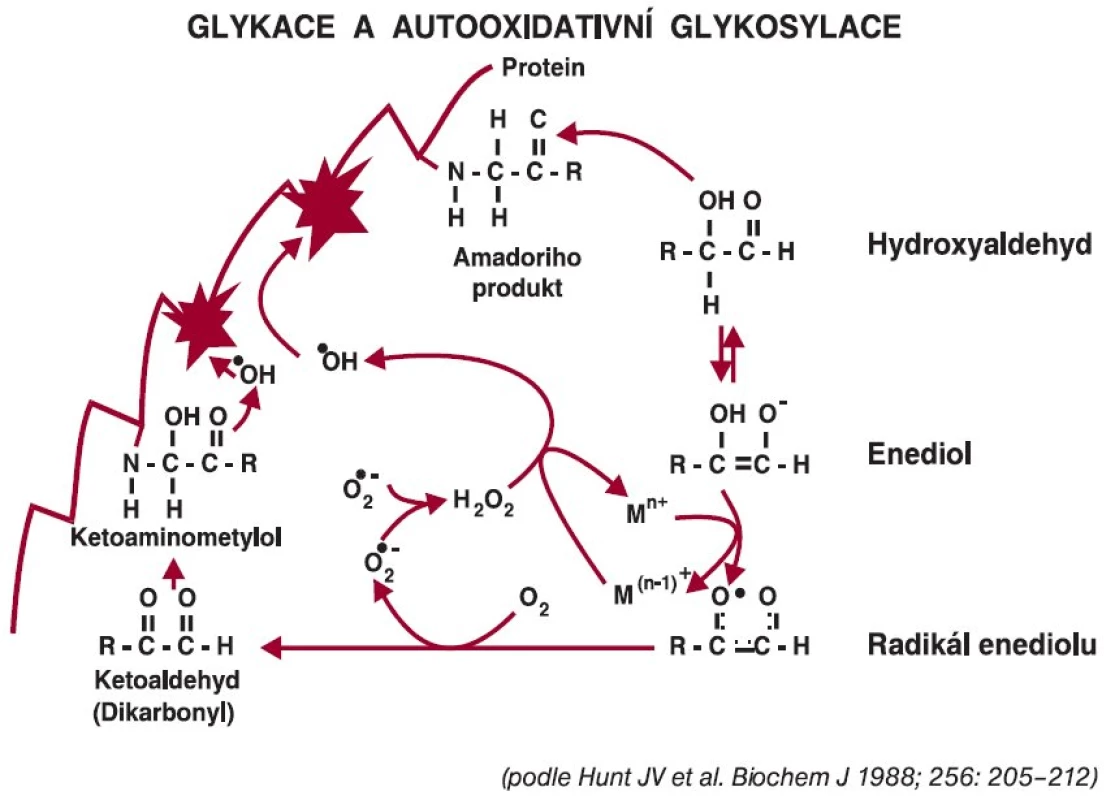
Tvorba reaktivních forem kyslíku je normálně v rovnováze se systémem zametačových (scavengerových) enzymů a dalších antioxidačních látek. Pokud tudíž dojde ke zvýšení produkce reaktivních forem kyslíku, organizmus na to reaguje vyšší aktivitou antioxidačního systému tak, že se opět obnoví rovnováha v celém organizmu. K důležitým enzymům patří zejména superoxiddismutáza (SOD), kataláza (CAT), glutáthionperoxidáza (GPx) a glutráthionreduktáza (GRed). V současné době se ukazuje, že klíčovým enzymem, i když v kaskádě reakcí uloženým o něco níže, je NADPH oxidáza (obr. 4). Hyperglykemie zvyšuje genovou expresi antioxidačních enzymů [13,14], i když ne stejně u všech enzymů a také v závislosti na typu buňky. Zatímco v hladké svalové buňce cévní stěny byla pozorována zvýšená genová exprese obou forem superoxiddismutázy (Cu,Zn-SOD i MnSOD) vlivem vyšší koncentrace glukózy, změny v expresi katalázy ani glutáthionperoxidázy nebyly za stejných podmínek pozorovány. Naproti tomu se exprese enzymů v pericytech za stejných podmínek nezvýšila. Navíc byla pozorována snížená aktivita superoxiddismutázy následkem neenzymové glykace enzymu [15]. Účinnost uvedených enzymů může být proto výrazně snížena při chronické expozici vyšší koncentraci glukózy. Vystupňovaný oxidační stres podmíněný hyperglykemií ovlivňuje rozdílně genovou expresi antioxidačních enzymů v závislosti na typu buněk. Znamená to, že různé buňky se mohou rozdílně podílet na vývoji změn při diabetu. Aktivity antioxidačních enzymů a koncentrace redukovaného glutáthionu, který je též zapojen do ochranného antioxidačního systému, byly nalezeny snížené ve fibroblastech kůže diabetiků [16]. Snížená koncentrace redukovaného glutáthionu svědčí o jeho přeměně na oxidovanou formu při zvýšeném oxidačním stresu. Přidání melatoninu do inkubačního media vedlo k významnému vzestupu aktivit antioxidačních enzymů i koncentrace redukovaného glutáthionu [16].
Obr. 4. Hyperglykemie jako příčina tvorby reaktivních forem kyslíku uvnitř buňky. 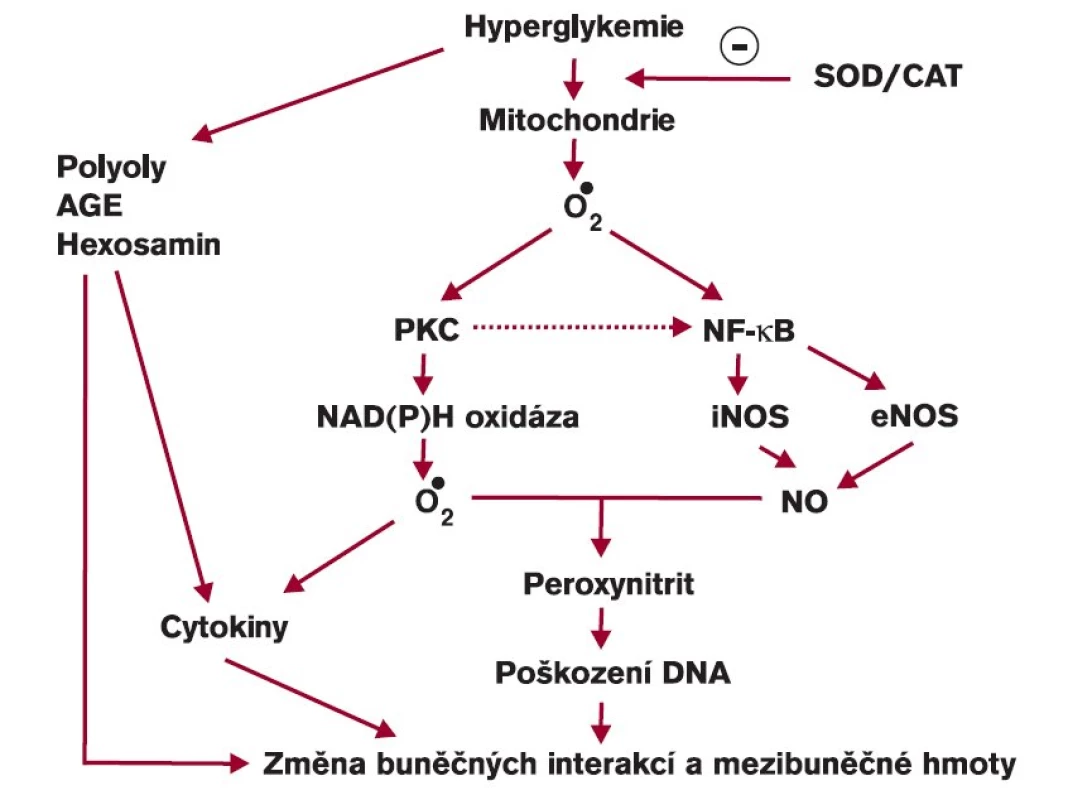
AGE – pokročilé produkty glykace, SOD – superoxiddismutáza, CAT – kataláza, PKC – proteinkináza C, iNOS – inducibilní syntáza oxidu dusnatého, eNOS – endoteliální syntáza oxidu dusnatého Oxidační stres však ovlivňuje pojivovou tkáň a tedy i kůži ještě jiným mechanizmem. Nelze totiž opomenout účast cév (zejména kapilár) a nervů na rozvoji funkčních i strukturálních změn. V době, kdy nejsou prokazatelné morfologické změny cév, se podílí vyšší oxidační stres na rozvoji funkčních změn endotelových buněk. Tato dysfunkce zahrnuje porušenou na endotelu závislou i na endotelu nezávislou vazodilatační odpověď. Snížený vazodilatační efekt oxidu dusnatého pozorovaný u diabetiků v porovnání se zdravou populací se vysvětloval sníženou expresí jeho konstitutivní syntázy (ecNOS). Podávání SOD, CAT nebo antioxidačně působícího probukolu zlepšilo na endotelu závislou vazodilatační odpověď jako následek inhibice peroxidace oxidu dusnatého, z něhož vzniká peroxynitrit (obr. 4) [17]. Dostatečné cévní zásobení je předpokladem postačující dodávky kyslíku, která brání ischemizaci kůže a umožňuje lepší hojení rány. Vedle toho bylo prokázáno, že keratinocyty obsahují inducibilní formu syntázy oxidu dusnatého (iNOS), jejíž exprese a aktivita se mění vlivem koncentrace glukózy. Zatímco krátkodobá expozice keratinocytů vyšší koncentraci glukózy zvýšila aktivitu iNOS, dlouhodobá expozice (desetidenní) vysoké koncentraci glukózy naopak inhibovala transkripci i aktivitu iNOS [18]. Snížená tvorba oxidu dusnatého pak může ovlivnit jak další průběh kožní infekce, tak hojení rány u diabetika [18]. Zachování kožní mikrocirkulace je předpokladem normální funkce kůže a hojení ran. Její vyšetření dynamickou kapilaroskopií [19] nebo pomocí laseru (Doppler) [20] může být vhodným doplněním speciálních vyšetření u diabetiků.
Podobně i postižení nervů, na němž se podílí z patogenetických faktorů jednak oxidační stres a jednak sorbitolová (polyolová cesta) v důsledku zvýšené tvorby sorbitolu uvnitř nervové buňky [21], vedou k ischemii nervu, a tím k ovlivnění vlastností pojiva, resp. kůže včetně denervace či porušené funkce potních žláz.
Závěr
Kůže, jejíž významnou součástí je pojivová tkáň, je komplexní orgán tvořený rozdílnými typy buněk a mezibuněčnou hmotou, jehož součástí je cévní a nervový systém. Patogeneze změn při diabetu vyplývá z metabolické poruchy, na níž se dominantně podílí chronická hyperglykemie jako faktor, od něhož se odvíjejí různé mechanizmy vedoucí k odchylné funkci i morfologii kůže. Úplné poznání patogeneze změn umožní volit takové léčebné postupy, které by minimalizovaly riziko kožních změn. Vzhledem k tomu, že se nedaří zcela normalizovat metabolickou poruchu, a tedy dovést organizmus do euglykemie jako za fyziologického stavu, hledají se cesty, jak omezit vliv glukózy na různé mechanizmy podmiňující rozvoj kožních změn při diabetu. Zatím je však výsledný efekt závislý pouze na kompenzaci diabetu, kdežto použití dalších látek včetně inhibitorů oxidačního stresu či neenzymové glykace zůstává jen na úrovni experimentálních studií.
prof. MUDr. Jan Škrha, DrSc.
III. interní klinika 1. LF UK a VFN
U Nemocnice 1
128 08 Praha 2
e-mail: jan.skrha@lf1.cuni.cz
Doručeno do redakce: 3. 6. 2005
Přijato k otištění: 3. 6. 2005
Zdroje
1. Rask-Madsen Ch, He Z, King GL. Mechanisms of diabetic microvascular complications. In: Kahn CR (ed). Joslin´s Diabetes mellitus. 14th ed. Philadelphia: Lippincott Williams & Wilkins 2005 : 823-838.
2. Brownlee M. Advanced glycation end products in diabetic complications. Curr Opin Endocrinol Diabetes 1998; 3 : 291-297.
3. Reihsner R., Meilling M, Pfeiler W et al. Alterations of biochemical and two-dimensional biomechanical properties of human skin in diabetes mellitus as compared to effects of in vitro non-enzymatic glycation. Clin Biomechanics 2000; 15 : 379-386.
4. Schleicher E, Nerlich A. The role of hyperglycemia in the development of diabetic complications. Horm Metab Rev 1996; 28 : 367-373.
5. Delbridge L, Ellis CS, Robertson K et al. Non-enzymatic glycosylation of keratin from the stratum corneum of the diabetic foot. Brit J Dermatol 1985; 112 : 547-554.
6. Sehnalová H, Záhejský J. Sledování neenzymatické glykace epidermálního keratinu. Čs Dermatol 1991; 66 : 25-30.
7. Sehnalová H, Záhejský J. Charakteristika glykované bílkoviny keratinu. Čs Dermatol 1992; 67 : 29-33.
8. Lateef H, Stevens MJ, Varani J. All-trans-retinoic acid suppresses matrix metalloproteinase activity and increases collagen synthesis in diabetic human skin in organ culture. Am J Pathol 2004; 165 : 167-174.
9. Ceriello A, Dello Russo P, Curcio F et al. Acetylsalicylic acid and lysine inhibit protein glycosylation in vitro. Diabetes Metabolism 1984; 10 : 128-129.
10. Ortwerth BJ, Olesen PR. Glutathione inhibits the glycation and cross-linking of lens protein by ascorbic acid. Exp Eye Res 1988; 47 : 737-740.
11. Khatani M, Suldan Z, David D et al. Inhibitory effects of pyridoxal phosphate, ascorbate and aminoguanidine on nonenzymatic glycosylation. Life Sci 1988; 43 : 1725-1731.
12. Škrha J. Oxidační stres a diabetes mellitus. In: Perušičová J (ed). Trendy soudobé diabetologie. Praha: Galén 1998; 1 : 61-88.
13. Ceriello A, dello Russo P, Amstad P et al. High glucose induces antioxidant enzymes in human endothelial cells in culture. Diabetes 1996; 45 : 471-477.
14. Sharpe PC, Liu WH, Yue KKM et al. Glucose-induced oxidative stress in vascular contractile cells. Diabetes 1998; 47 : 801-809.
15. Kawamura N, Ookawara T, Suzuki K et al. Increased glycated Cu,Zn-superoxide dismutase levels in erythrocytes of patients with insulin-dependent diabetes mellitus. J Clin Endocrinol Metab 1992; 74 : 1352-1354.
16. Kilanczyk E, Bryszewska M. The effect of melatonin on antioxidant enzymes in human diabetic skin fibroblasts. Cell & Molec Biol Lett 2003; 8 : 333-336.
17. Tesfamariam B, Cohen RA. Free radicals mediate endothelial cell dysfunction caused by elevated glucose. Am J Physiol 1992; 263: H321-H326.
18. Nakai K, Kubota Y, Kosaka H. Inhibition of nuclear factor kappa B activation and inducible nitric oxide synthase transcription by prolonged exposure to high glucose in the human keratinocyte cell line HaCaT. Brit J Dermatol 2004; 150 : 640-646.
19. Chang CH, Tsai RK, Wu WC et al. Use of dynamic capillaroscopy for studying cutaneus microcirculation in patients with diabetes mellitus. Microvasc Res 1997; 53 : 121-127.
20. Prázný M. Využití laser Doppleru při vyšetření tkáňové perfuze. Diabetologie, metabolismus, endokrinologie, výživa 2000; 3 : 111-116.
21. Škrha J. Patofyziologie a patogeneze diabetické neuropatie. Vnitř Lék 2005; 51(Suppl 1): S67-S72.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Nemocniční nákazy a diabetesČlánek Dejme tradici nový rozměr!Článek ÚvodníkČlánek Uroinfekce u diabetikůČlánek Mykózy a diabetesČlánek Dna a diabetesČlánek Recenze
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2006 Číslo 5- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Dejme tradici nový rozměr!
-
7. celostátní diabetologické sympozium Diabetes a další obory
(infekce, dermatovenerologie a revmatologie)
Hradec Králové, 3.– 4. června 2005 - Úvodník
- Infekce a syndrom diabetické nohy v terénní praxi
- Komplex hyaluronanu a jodu - Hyiodine® - nová metoda při terapii diabetických defektů
- Uroinfekce u diabetiků
- Respirační infekce a terapie inhalačním inzulinem
- Metabolizmus glukózy a účinky inzulinu v sepsi
- KOMENTÁŘ: Normoglykemie, přívod glukózy a inzulin u kriticky nemocných
- Nemocniční nákazy a diabetes
- Diabetes mellitus a imunizace
- Úloha diabetologa při infekčním onemocnění diabetika
- Patogeneze postižení pojivové tkáně při diabetes mellitus
- Metabolické jaderné receptory PPAR a kůže
- Kožní změny při diabetu z pohledu dermatologa
- Hojení kožních afekcí u syndromu diabetické nohy při hospitalizaci
- Kožní projevy hyperlipidemie u diabetiků z pohledu internisty
- Mykózy a diabetes
- Kožní komplikace terapie diabetes mellitus
- Difuzní idiopatická skeletální hyperostóza a souvislost s metabolickými parametry
- Revmatologické manifestace při diabetes mellitus
- Metabolické kostní choroby a diabetes
- Dna a diabetes
- Glukokortikoidy a diabetes mellitus
- Anagrelid v léčbě esenciální trombocytemie a dalších myeloproliferací s trombocytemií sledovaných v registru pacientů v ČR
- 50. narozeniny Jiřího Widimského juniora
- Odišiel prof. MUDr. Stanislav Cagáň, DrSc.
- Recenze
- XXV. dni mladých internistov Martin, Slovenská republika, 25. - 26. 5. 2006
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Kožní změny při diabetu z pohledu dermatologa
- Glukokortikoidy a diabetes mellitus
- Difuzní idiopatická skeletální hyperostóza a souvislost s metabolickými parametry
- Kožní komplikace terapie diabetes mellitus
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



