-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Naše zkušenosti s kontinuálním podáváním inzulinu pomocí infuzního dávkovače na jednotce intenzivní metabolické péče (JIMP)
Our experience in continuous administration of insulin using infusion dispenser at a metabolic intensive care unit (MICU)
Introduction:
The article summarises the experience of the authors in the administration of insulin using an infusion dispenser at a metabolic intensive care unit (MICU) both to patients with decompensated diabetes mellitus and to patients admitted with a sepsis or other life-threatening condition of internal nature.Patients and results:
Insulin was administered with the use of a dispenser to a total of 50 patients during 6 months of 2005. 13 of those patients showed signs of ketoacidotic or hyperosmolar coma in the course of diabetes mellitus. All of these patients were compensated within 24 hours and transferred to a standard ward for further treatment within 48 hours. 37 patients were admitted in a critical condition, the cause of which was sepsis and a serious internal disease in 29 and 8 patients, respectively. 12 of the patients died during their hospitalisation at MICU, of which 8 in the first 3 days after admission. No significant correlation between the age, diabetes mellitus diagnosis or an associated cardiovascular morbidity and the death at MICU was discovered, but there was a very close ling between the mortality at the intensive care unit and the baseline blood level of C-reactive protein (160 mg/l; 32–352 in the patients who died, and 111 mg/l 15–168 in the patients who survived), p < 0.01. Glycaemia at admission did not differ significantly for the patients who dies and those who survived, but average glycaemia for all three measurements at MICU was significantly higher in the patients who died (10.4 mmol/l; 6.2–22.4) as compared with those who survived (7.8 mmol/l; 5.8–16.6), p < 0.01. The time of insulin administration was significantly shorter in patients who died (3.3 days; 1–6) as compared with those who survived (5.2 days; 3–10), p < 0.01. There was no significant difference between hourly insulin dose in the patients who died (2.8 j/hour; 0.6–8.6) and in those who survived (2.6 j/hour; 0.8–7.6). A trend towards lower mortality was recorded for the group of patients with average glycaemia below 8 mmol/l and/or those in whom glycaemia mostly ranged between 4.4 and 8.0 mmol/l, but the difference was not statistically significant. A significantly lower consumption of insulin was recorded for the patients with average glycaemia below 8 mmol/l and/or those whose glycaemia measurements mostly ranged between 4.4 and 8.0 mmol/l. Hypoglycaemia defined as glycaemia below 4.4 mmol/l was present in 2 % of all measurements, in 11 patients on the total, and their results were not significantly associated with mortality at MICU.Conclusion:
Mortality of patients admitted with sepsis or other life-threatening condition of internal nature was significantly higher in the group of patients with higher average glycaemia among all the measurements performed at MICU. In patients who died, the total time of insulin administration was significantly shorter, but there was no difference between the average hourly insulin dose in the group of the patients who died and those who survived.Keywords:
glycaemia – insulin – infusion dispenser – sepsis – serious internal disease
Autoři: J. Charvát; S. Pálová
; M. Horáčková; J. Kratochvíl; J. Masopust
Působiště autorů: Jednotka intenzivní metabolické péče Interní kliniky 2. lékařské fakulty UK a FN Motol, Praha, přednosta doc. MUDr. Milan Kvapil, CSc.
Vyšlo v časopise: Vnitř Lék 2007; 53(10): 1047-1052
Kategorie: Původní práce
Předneseno na akci Infuzní terapie ve dnech 27. - 28. 4. 2006 v Třeboni.
Souhrn
Úvod:
V práci shrnujeme zkušenosti s aplikací inzulinu pomocí infuzního dávkovače na jednotce intenzivní metabolické péče (JIMP) jednak u nemocných s dekompenzovaným diabetes mellitus, jednak u nemocných přijatých v sepsi nebo jiném život ohrožujícím stavu interní povahy.Pacienti a výsledky:
V průběhu 6 měsíců roku 2005 jsme inzulin pomocí dávkovače podali celkem 50 nemocným. 13 z nich mělo známky ketoacidotického nebo hyperosmolárního selhání v průběhu diabetes mellitus. Všichni tito nemocní byli kompenzováni v průběhu 24 hodin a přeloženi do 48 hodin k další léčbě na standardní oddělení. 37 nemocných bylo přijato v kritickém stavu, jehož příčinou byl u 29 jedinců septický stav, u 8 jiné závažné interní onemocnění. V průběhu hospitalizace na JIMP z nich zemřelo 12 nemocných, 8 v průběhu prvních 3 dnů po přijetí. V uvedené skupině nemocných jsme nezjistili významný vztah mezi věkem, přítomností diabetes mellitus a přidruženou kardiovaskulární morbiditou a úmrtím na JIMP, zatímco mortalita na jednotce významně souvisela s úvodní hodnotou C-reaktivního proteinu v krvi (160 mg/l; 32-352 u zemřelých a 111 mg/l; 15-168 u přeživších nemocných), p < 0,01. Vstupní glykemie se významně nelišila mezi nemocnými, kteří zemřeli a přežili, ale průměrná glykemie ze všech měření na JIMP byla významně vyšší u zemřelých (10,4 mmol/l; 6,2-22,4) ve srovnání s přeživšími nemocnými (7,8 mmol/l; 5,8-16,6), p < 0,01. Doba podávání inzulinu byla významně kratší u zemřelých (3,3 dne; 1-6) ve srovnání s přeživšími (5,2 dne; 3-10) nemocnými, p < 0,01. Hodinová dávka inzulinu se mezi zemřelými (2,8 j/hod; 0,6-8,6) a přeživšími (2,6 j/hod; 0,8-7,6) nemocnými významně nelišila. Ve skupině nemocných s průměrnou glykemií méně než 8 mmol/l a/nebo u těch, kdy většina glykemií byla v rozmezí 4,4-8,0 mmol/l, jsme zjistili tendenci k snížené mortalitě, ale rozdíly nedosáhly statistické významnosti. Významně nižší spotřeba inzulinu byla zjištěna u nemocných s průměrnou glykemií nižší než 8 mmol/l a/nebo u těch, u nichž se většina měřených glykemií pohybovala mezi 4,4-8,0 mmol/l. Hypoglykemie definovaná jako glykemie pod 4,4 mmol/l byla přítomna ve 2 % všech měření, celkem u 11 nemocných a její nález nebyl významně asociován s mortalitou na JIMP.Závěr:
Mortalita nemocných přijatých v sepsi nebo s jinými život ohrožující stavy interní povahy byla významně vyšší ve skupině nemocných s vyšší průměrnou glykemií ze všech měření na JIMP. U zemřelých nemocných byla celková doba podávání inzulínu významně kratší, ale průměrná hodinová dávka inzulínu se nelišila ve skupině zemřelých a přeživších.Klíčová slova :
glykemie - inzulin - infuzní dávkovač - sepse - závažné interní onemocněníÚvod
Léčba inzulinem pomocí infuzního dávkovače je využívána již řadu let při léčení diabetiků s hyperglykemií v rámci ketoacidotického nebo hyperosmolárního kómatu. Při včasné detekci stavu a správné terapeutickém přístupu jsou uvedené komplikace diabetu spojené s příznivou prognózou za předpokladu, že nejsou způsobeny jiným akutním onemocněním [1,2].
Naopak hyperglykemie je v průběhu závažných akutních onemocnění (kardiovaskulární příhody, stavy po rozsáhlých operacích, septické stavy atd.) spojena se zvýšenou mortalitou a morbiditou [3-9]. Podávání inzulinu pomocí infuzního dávkovače u takových nemocných se začalo často využívat po publikování studie Van den Berghové v roce 2001, ve které prokázala, že udržování euglykemie u nemocných po kardiovaskulární operaci s pomocí kontinuální aplikace inzulinu je spojeno s významným poklesem pooperační mortality [3]. Další studie, které potvrdily výsledky práce Van den Berghové, vedly k doporučení udržovat u těchto nemocných horní hranici glykemie na hodnotě 8 mmol/l [4,10].
O vlivu podobné intervence u nemocných s akutním interním onemocněním (především septickým stavem) se objevily zprávy poměrně nedávno. V další práci Van den Berghová nezjistila sice příznivý vliv euglykemie navozené kontinuálním podáváním inzulinu na mortalitu kriticky nemocných s interním onemocněním, nicméně nalezla pozitivní účinek takové intervence ve smyslu zkrácení doby pobytu nemocného na jednotce intenzivní péče, zkrácení doby aplikace umělé plicní ventilace a významného poklesu nutnosti zahájení léčby akutního renálního selhání eliminační metodou [11]. Jiné práce svědčí pro pozitivní vliv podání inzulinu i na prognózu nemocných z hlediska ovlivnění hospitalizační mortality [12,13]. V těchto studiích převažují jedinci s akutní kardiovaskulární příhodou.
Na metabolické jednotce je podání inzulinu pomocí infuzního dávkovače tradičně využíváno v léčbě nemocných přijatých v hyperosmolárním nebo ketoacidotickém kómatu. V posledních letech je ale i na takových jednotkách (podobně jako na ARO) léčeno stále více jedinců s hyperglykemií, která je způsobena akutním závažným onemocnění bez ohledu na skutečnost, zda nemocný je či není diabetik.
Cílem našeho retrospektivního posouzení bylo:
- Posoudit indikace pro kontinuální podávání inzulinu na metabolické jednotce, srovnání četnosti významné dekompenzace diabetu vyžadující takovou léčbu a závažných akutních stavů interní povahy (sepse, orgánové selhání, kardiovaskulární příhody atd.) spojených s úvodní hyperglykemií bez ohledu na předchozí přítomnost či absenci diabetes mellitus.
- Zhodnotit význam hyperglykemie a její léčby inzulinem u skupiny nemocných, u nichž byla příčinou sepse hyperglykemie nebo závažná orgánová dysfunkce
Metodika
Soubor tvoří nemocní, kteří byli v době mezi 1. lednem 2005 a 30. červnem 2005 přijati na jednotku intenzivní metabolické péče (JIMP) a u kterých současně v průběhu hospitalizace byl podáván inzulin pomocí infuzního perfuzoru Compact (BBraun; SRN).
U všech nemocných byl podáván HMR inzulin (40 j ve 20 ml fyziologického roztoku).
Glykemie byla měřena pomocí glukózového analyzátoru Super GL (Dr Müller Geraetebau Gmbh, Freital, SRN).
Nemocní byli rozděleni do 2 skupin podle důvodu, který vedl k zahájení léčby inzulinem.
První skupinu tvořili nemocní, u nichž byla hlavní příčinou přijetí na JIMP dekompenzace 1. nebo 2. typu diabetes mellitus bez přítomnosti jiného závažného akutního stavu. Podle charakteru dekompenzace byli tito nemocní rozděleni do 2 skupin: s ketoacidotickým nebo s hyperosmolárním stavem. Po vyšetření vstupní glykemie byl inzulin podáván pomocí infuzního dávkovače jako součást léčby, při které bylo postupováno podle doporučených algoritmů [3]. Glykemie byla monitorována každou hodinu až do dosažení normoglykemie, což představovalo základní cíl léčby. Zaznamenali jsme dobu nutnou k úpravě glykemie a sledovali délku hospitalizace na JIMP. Glykemie v této skupině nemocných byla měřena z kapilární krve.
Druhou skupinu tvořili nemocní přijati pro závažný akutní stav interní povahy. U nemocných v závažném akutním stavu pravidelně zavádíme arteriální kanylu, a proto jsme využívali při stanovení glykemie heparinizovanou arteriální krev.
Při přijetí jsme vyšetřili vstupní glykemii a zaznamenali, zda nemocný byl již léčen pro diabetes mellitus.
Cílem aplikace HMR-inzulinu pomocí infuzního dávkovače bylo v souladu s publikovanými doporučeními upravení hodnot glykemie pod 8 mmol/l a její udržování v rozmezí 4,4-8,0 mmol/l [4].
Rychlost podávání inzulinu byla řízena ošetřujícím lékařem nebo pověřenou sestrou s cílem dosáhnout cílové hodnoty glykemie a udržení jejích hodnot v požadovaných mezích. Při úvodním podání jsme snižovali hodnotu glykemie nejvýše o 4 mmol/hod.
Při udržování glykemie jsme nepoužívali předem stanovený protokol podávání inzulinu. Změna rychlosti aplikace inzulinu závisela na rozhodnutí ošetřujícího lékaře.
Nemocné se závažným akutním onemocněním jsme rozdělili podle výsledku léčby na JIMP : na nemocné, kteří zemřeli v průběhu hospitalizace na JIMP a na nemocné, kteří přežili a byli přeloženi na standardní oddělení.
Zhodnotili jsme vztah demografických charakteristik, C-reaktivního proteinu při přijetí, hodnoty vstupní glykemie, průměrné glykemie všech měření v průběhu aplikace inzulinu na JIMP, průměrné dávky aplikovaného inzulinu za hodinu a doby, po kterou byl inzulin aplikován k prognóze na JIMP.
Nemocné jsme rovněž rozdělili podle četnosti glykemie v rozmezí 4,4-8,0 mmol/l. Porovnali jsme mortalitu nemocných s většinou měření v tomto rozsahu (více než 50 % měření) s těmi, u nichž byla většina měření mimo takto definovaný rozsah glykemií. Rovněž jsme porovnali dávky inzulinu u nemocných v takto definovaných 2 skupinách.
Posoudili jsme vztah průměrné glykemie nad a do 8 mmol/l po celou dobu přijetí na JIMP k mortalitě na JIMP a k průměrné dávce podávaného inzulinu.
Hypoglykemii jsme definovali jako hodnotu glykemie pod 4,4 mmol/l [4], registrovali jsme její četnost. Zhodnotili jsme vztah mezi přítomností hypoglykemie a mortalitou na JIMP.
Pro statistické zhodnocení kontinuálních parametrů jsme použili Mannův-Whitneyův test, při posouzení logických parametrů Fisherův test. Hodnoty p < 0,05 byly hodnoceny jako statisticky významné.
Informovaný souhlas od nemocných byl získán s přijetím na JIMP. Speciální informovaný souhlas s podáním inzulinu pomocí infuzního dávkovače nebyl vyžadován vzhledem k tomu, že jeho aplikace byla součástí celkové léčby na JIMP a nejednalo se o předem připravený studijní protokol.
Výsledky
Soubor tvořilo celkem 50 nemocných hospitalizovaných na JIMP od ledna do června roku 2005.
Průměrný věk nemocných byl 59,8 ± 17,5 let (rozmezí od 18 do 95 let). 29 bylo žen a 21 mužů.
Z 50 nemocných byl v 13 případech (26 %) vzhledem k dekompenzaci diabetu použit infuzní dávkovač inzulinu. Charakteristiky těchto nemocných i způsob a výsledek léčby jsou uvedeny v tab. 1.
Tab. 1. Charakteristiky, způsob a výsledek léčení u nemocných přijatých na JIMP pro dekompenzaci diabetu bez přítomnosti jiného akutního onemocnění léčených pomocí inzulinu podaného infuzní pumpou. 
Normoglykemie dosaženo vždy v průběhu 24 hod. Překlad na standardní oddělení uskutečněn vždy do 48 hod. 37 nemocným (74 %) byl inzulin podáván v průběhu akutního závažného onemocnění. V průběhu hospitalizace na JIMP z nich zemřelo 12 nemocných (32,4 %), 8 v průběhu prvních 3 dnů po přijetí. Podkladem akutního onemocnění u 29 nemocných byl septický stav, v 8 případech šlo o jiné závažné příčiny (tab. 2, grafy 1 a 2). Základní charakteristiky nemocných včetně vstupní hodnoty C-reaktivního proteinu v plazmě a porovnání vlivu sledování glykemie a podávání inzulinu u nemocných, kteří zemřeli na JIMP, a těch, kteří přežili, jsou uvedeny v tab. 2.
Tab. 2. Charakteristiky, způsob a výsledek léčení u nemocných přijatých na JIMP pro akutní stav – sepse, orgánové selhání. 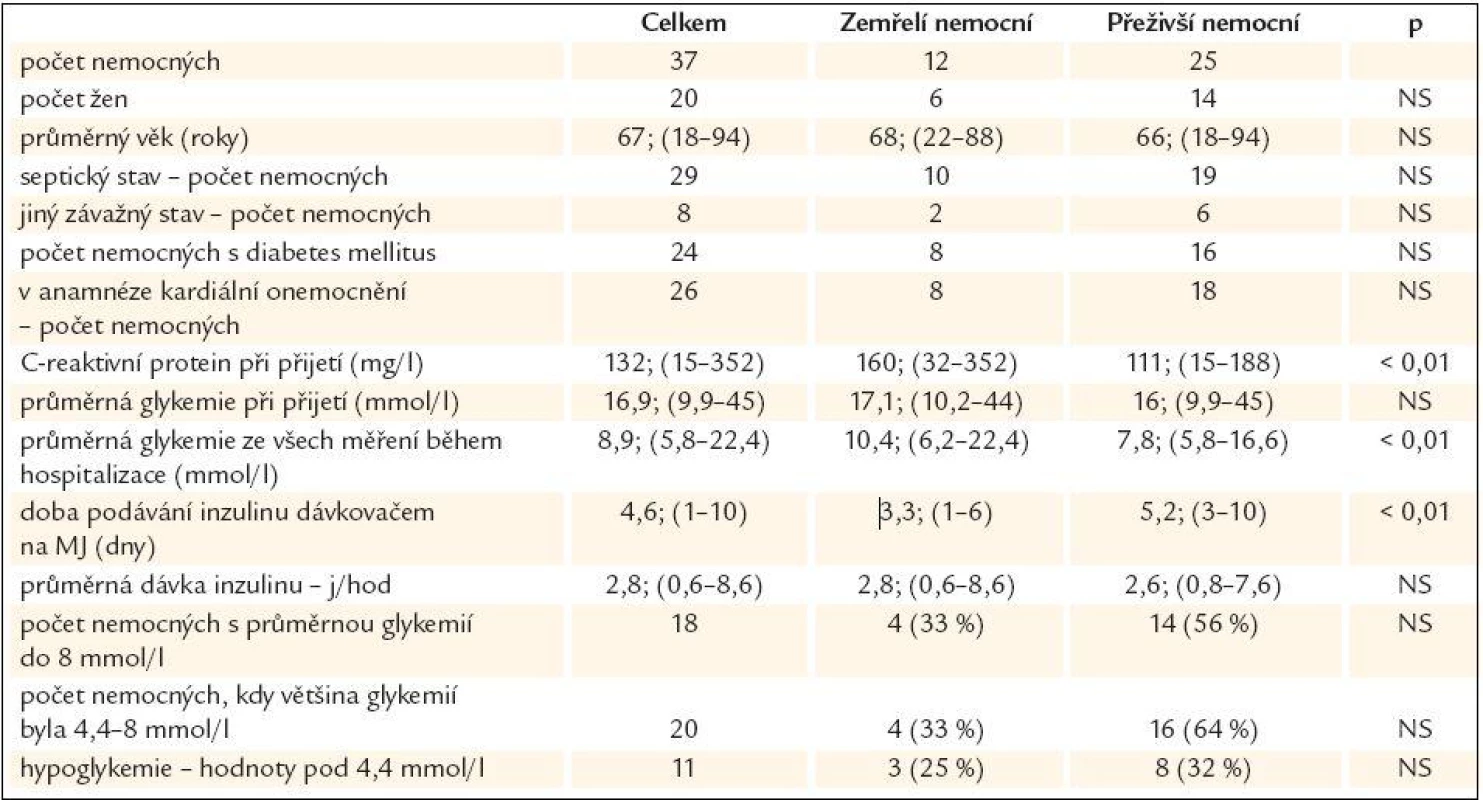
Graf 1. Septické příčiny kritických stavů. 
Graf 2. Ostatní příčiny kritických stavů. 
V průběhu 24 hodin od přijetí se podařilo snížit hodnotu glykemie pod 8 mmol/l u 35 (95 %) nemocných. 2 nemocní, u kterých se glykemii nepodařilo upravit v žádném měření pod 8 mmol/l, zemřeli (1. den hospitalizace, resp. 2.).
Glykemie byla zjištěna v požadovaném rozmezí mezi 4,4-8,0 mmol/l ve 46 % všech měření u 37 nemocných. U jednotlivých nemocných četnost výsledků měření v požadovaném rozmezí kolísala mezi 0-92 %.
Dávka inzulinu podaná nemocným s četností dosažených glykemií mezi 4,4-8,0 mmol/l pod 50 % byla 3,6 (1,0-8,6) j/hod, což bylo významně více než 1,8 (0,6-5,0) j/hod u nemocných s četností dosaženého rozmezí glykemií ve více než 50 % měření (p < 0,05). Dávka inzulinu podaná nemocným s průměrnou glykemií nad 8 mmol/l byla 3,4 (1,0-8,6) j/hod, což bylo významně více než 1,8 (0,6-5,6) j/hod nemocným s průměrnou glykemií nižší než 8 mmol/l (p < 0,05).
Hodinová změna dávky inzulinu se pohybovaly v rozmezí 0,4-4 j.
Hypoglykemie definovaná jako hodnota glykemie pod 4,4 mmol/l byla zjištěna ve 2 % všech měření, byla vždy dobře korigovatelná přechodným zastavením aplikace inzulinu a případně intravenózním podáním glukózy. Nezjistili jsme asociaci mezi nálezem hypoglykemických hodnot a mortalitou na JIMP (tab. 2).
Diskuse
Na metabolické jednotce jsou stále poměrně často léčeni nemocní s ketoacidózou a hyperglykemií při dekompenzaci diabetes mellitus. Léčba inzulinem pomocí infuzního dávkovače usnadňuje postupné snižování hodnot glykemie a je dle našich zkušeností spojena i s rychlou kompenzací a možností přeložení nemocného v krátkém časovém období na standardní oddělení [2].
Nicméně většinu nemocných, kterým je v současné době i na metabolických jednotkách podáván inzulin pomocí infuzního dávkovače, tvoří dle našich výsledků nemocní v septickém stavu nebo jiných život ohrožujících stavů interní povahy bez ohledu na skutečnost, zda nemocný je nebo není diabetik.
Na hyperglykemii a na zvýšené inzulinové rezistenci se ve stresové situaci podílí zvýšená koncentrace katabolických hormonů - kortizolu, katecholaminů a glukagonu [1].
Inzulinová rezistence v průběhu akutního onemocnění vede k tomu, že spotřeba glukózy se snižuje v nepoškozených tkáních, a naopak je dostupnější pro tkáně poškozené, a zejména ty, které mají podstatnou úlohu v obranných a reparačních procesech [1,6,9]. Dochází ke zvýšené spotřebě glukózy, která vzniká zejména rozpadem proteinové tkáně [1] . Z metabolického hlediska tak především dochází k značným ztrátám proteinů, které jsou ve značné míře využívány ke krytí energetických potřeb. Proteinový katabolizmus může významně snížit exogenní přívod glukózy [1,6]. Hyperinzulinemie doprovázející stres není za daných podmínek ale schopna vrátit glykemii do normálních mezí. Z uvedených důvodů je oprávněná hypotéza, že je vhodné překonat inzulinovou rezistenci zevně přivedeným inzulinem. Cílem takové léčby je upravit hodnotu glykemie tím, že dojde k zvýšenému přesunu glukózy do inzulin-senzitivních tkání, což má za následek utlumení glukoneogeneze a šetření endogenních proteinů [1,6,7,10]. Inzulin má rovněž přímý protizánětlivý účinek, vede k poklesu C-reaktivního proteinu, leukocytózy, TNFα, superoxidových aniontů a dalších parametrů charakteristických pro zánětlivou reakce [14].
Na prognózu nemocných v septickém stavu a dalších život ohrožujících stavů má vliv věk nemocných, přidružená komorbidita a závažnost akutního stavu [1,2]. V našem malém souboru jsme zjistili významný vztah vstupní hodnoty C-reaktivního proteinu k mortalitě na JIMP. Úvodní hyperglykemie koreluje se závažností prognózy u nemocných s akutní koronární příhodou, s akutní ischemickou cévní příhodou, s prognózou po kardiochirurgickém výkonu [12,13]. V našem souboru jsme korelaci mezi příjmovou hyperglykemií a mortalitou během hospitalizace nezjistili, což může souviset s tím, že většinu tvořili nemocní v septickém stavu. Ve skupině zemřelých jsme však nalezli významně zvýšenou průměrnou hodnotu glykemie ze všech měření provedených v průběhu hospitalizace na JIMP.
V této souvislosti je zajímavá skutečnost, že většina úmrtí se vyskytla v průběhu prvních 3 dnů hospitalizace na JIMP, takže doba podávání inzulinu skupině zemřelých byla významně kratší ve srovnání s přeživšími jedinci. Ve studii Van den Berghové bylo zjištěno, že prognóza kriticky nemocných s interním onemocněním byla významně horší ve srovnání s kontrolní skupinou při udržování euglykemie pomocí kontinuální aplikace inzulinu v průběhu prvních 3 dnů léčby, zatímco byla významně zlepšena u nemocných s delší dobou aplikace inzulinu [11]. Vysvětlení není jasné. V našem souboru můžeme zvážit skutečnost, zda to byli právě nejtěžší nemocní, kteří zemřeli krátce po přijetí. V práci Van den Berghové ale šlo o kontrolovanou prospektivní studii. Zůstává proto otevřena otázka vhodného načasování zahájení léčby inzulinem u interně kriticky nemocných.
Při srovnání nemocných, kteří zemřeli a přežili, jsme nenalezli významný rozdíl v hodinové dávce podávaného inzulinu. Tato skutečnost svědčí proti názoru, že inzulin přímo ovlivňuje prognózu těchto nemocných.
Soubor našich nemocných je malý a různorodý, takže není možné učinit z výsledků žádné závěry o významu udržování normoglykemie pro mortalitu nemocných v kritickém stavu interní povahy. Nicméně je zřejmé, že u našich nemocných je tendence k lepší prognóze spojená s průměrnou glykemií pod 8 mmol/l nebo s většinou měřených hodnot glykemie v rozmezí mezi 4,4-8,0 mmol/l. Rozmezí glykemie 4,4-8 mmol/l jsme převzali z dříve publikovaných výsledků studií, v nichž byl sledován velký počet nemocných [4]. Hranice 8 mmol/l je uváděná jako horní mez cílových hodnot glykemie při podávání inzulinu, která je spojena s lepší prognózou [4,6,7]. Hodnotu průměrné glykemie všech měření na JIMP 8 mmol/l ve vztahu k mortalitě na JIMP jsme použili proto, že nám rozdělila naše nemocné na 2 stejně početné skupiny.
Skutečnost, že právě u nemocných s průměrnou glykemií nad 8 mmol/l a/nebo s četností hodnoty glykemie nad 8 mmol/l ve více než 50 % vyšetření průběhu hospitalizace na JIMP byla hodinová spotřeba inzulinu významně vyšší, by mohla být vysvětlena závažnějším průběhem akutního onemocnění a zvýšenou inzulinovou rezistencí. Pro toto vysvětlení však nesvědčí skutečnost, že jsme nenalezli významný rozdíl v hodinové dávce podávaného inzulinu mezi nemocnými, kteří zemřeli ve srovnání s těmi, co přežili hospitalizaci na JIMP.
Rizikem v průběhu léčby inzulinem je hypoglykemie, která může při protrahovaném průběhu mít za důsledek závažné poškození nemocného [1,3,4,7]. Z toho důvodu je nezbytné pečlivé a raději častější sledování glykemie, abychom této komplikaci nejlépe předešli nebo ji alespoň co nejdříve zjistili a stav upravili. Ve všech publikovaných studiích byla hypoglykemie opakovaně a relativně často zaznamenána [3,4,10,11]. Hranice stanovení hypoglykemii se ale v různých studiích liší. Z výše uvedených důvodů jsme v našem souboru převzali hodnotu 4,4 mmol/l, kterou uvádí ve své studii Finney [4]. Jde jistě o hodnotu velmi přísnou (jedná se spíše o nízkou glykemii než přímo hypoglykemii) na rozdíl od definice hypoglykemie v jiných studiích (například Van den Berghe uvádí 2,2 mmol/l), ale její využití by mělo být spojeno se snížením rizika vzniku závažných komplikací způsobených hypoglykemií. V našem souboru se glykemie pod 4,4 mmol/l vyskytla přibližně u jedné třetiny nemocných. Byla vždy dobře korigovatelná a její přítomnost nebyla asociována s mortalitou nemocných v průběhu hospitalizace na JIMP.
Pro správnou kompenzaci glykemie u kriticky nemocných jsou nutné její časté kontroly. Skutečnost, že vyšetření glykemie je nutné provádět i mnohokrát denně, vede ke snaze vytvořit algoritmy dávkování inzulinu, podle kterých mohou sestry dávku upravit [6,15,16]. V našem sledování jsme nepostupovali podle předem připraveného předpisu a dávka inzulinu a jeho změna plně závisela na ošetřujícím lékaři. Nicméně celkové dávky a jejich změny v čase u našich nemocných v zásadě odpovídaly dříve publikovaným protokolům v zahraniční i naší literatuře [15,16].
Závěr
Podávání inzulinu pomocí infuzního dávkovače představuje účinný způsob léčby hyperglykemického stavu způsobeného dekompenzací vlastního diabetes mellitus.
Inzulinu se v současné době používá zejména pro korekci hyperglykemie u kriticky nemocných na jednotkách intenzivní péče. Cílem je dosažení normoglykemie, horní hranice glykemie se podle většiny autorů uvádí 8 mmol/l. Podle našich výsledků je taková úprava glykemie spojena s tendencí k příznivější prognóze v průběhu hospitalizace na jednotce intenzivní péče. Za dávkování inzulinu je zodpovědný lékař, nicméně naše zkušenosti potvrzují, že podané dávky u nemocných v zásadě odpovídaly již doporučeným a publikovaným schématům. Tato skutečnost umožňuje, aby inzulin byl podáván zkušenými a dobře instruovanými sestrami podle citovaných algoritmů.
doc. MUDr. Jiří Charvát CSc.
www.fnmotol.cz
e-mail: jiri.charvat@lfmotol.cuni.cz
Doručeno do redakce: 11. 12. 2006
Přijato po recenzi: 25. 4. 2006
Zdroje
1. Zadák Z. Výživa v intenzivní péči. Praha: Grada 2002.
2. Ševčík P, Černý V, Vítovec J. Intenzivní medicína. Praha: Galén 2003.
3. Van den Berghe G, Wouters P, Weekers F et al. Intensive Insulin Therapy in Critically Ill Patients. N Engl J Med 2001; 345 : 1359-1367.
4. Finney SJ, Zekveld C, Elia A et al. Úprava glykémie a úmrtnost u nemocných v kritickém stavu. JAMA-CZ 2004; 12 : 282-288.
5. Rušavý Z, Lacigová S, Jankovec J et al. Vliv inzulinu na glukózový metabolizmus u sepse. Vnitř Lék 2006; 52 : 429-433.
6. Wohl P, Wohl P, Zazula R et al. Současný pohled na hladiny glykemie v kritických stavech. Ročenka intenzivní medicíny 2003; 177-181.
7. Novák I, Matějovič M, Rokyta R jr et al. Kontrola glykemie u kriticky nemocných. Anest Intenziv Med 2003; 14 : 26-30.
8. Montori VM, Bistrian BR, Mahon MM Hyperglykémie u pacienta s akutním onemocněním. JAMA-CZ 2002; 3 : 133-135.
9. Capes SE, Hunt D, Malmberg H et al. Stress hyperglycemia and increased risk of death after myocardial infarction in patients with and without diabetes: a systematic overview. Lancet 2000; 355 : 773-778.
10. Krinsley JS Effect of an intensive glucose management protocol on the mortality of critical patients. Mayo Clin Proc 2004; 79 : 992-1000.
11. Van den Berghe G, Wilmer A, Hermans G et al. Intensive Insulin Therapy in the Medical ICU. N Engl J Med 2006; 354 : 449-461.
12. Mullner M, Sterz F, Binder M et al. Blood glucose concentration after cardiopulmonary resuscitation influences functional neurological recovery in human cardiac arrest survivors. J Cerebr Blood Flow Metab 1997; 17 : 430-436.
13. Norhammar AM, Ryden L, Malmberg K Admission plasma glucose: independent risk factor for long-term prognosis after myocardial infarction even in nondiabetic patients. Diabetic Care 1999; 22 : 1827-1837.
14. Hansen TK, Thiel S, Wouters J et al. Intensive Insulin Therapy Exerts Antiinflammatory Effects in Critically Ill Patients and Counteracts the Adverse Effect of Low Mannose-Binding Lectin Levels. J Clin Endocrin Metabol 2003; 88 : 1082-1088.
15. Chant C, Wilson G, Friedrich JO Validation of an insulin nomogram for intensive glucose control in critically ill patients. Pharmacotheraphy 2005; 25 : 352-359.
16. Šrámek V, Dadák L, Mičkalová K et al. Zavedení protokolu ke kompenzaci glykemie u nemocných vyžadujících intenzivní péči - vyhodnocení účinnosti. Anest Intenziv Med 2003; 5 : 228-232.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2007 Číslo 10- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Endoskopické změny sliznice žaludku a dvanáctníku při léčbě minidávkou acetylsalicylové kyseliny a jejich prevence - editorial
- Rituximab (antiCD20 monoklonální protilátka) a molekulárně biologická negativita po léčbě nemocných s folikulárním lymfomem - cesta k vyléčení? - editorial
- Plicní alveolární proteinóza – minulost a přítomnost – editorial
- Lékové stenty - pro všechny, pro někoho, či pro nikoho? - editorial
- Změny metabolizmu lipidů u pacientů v aktivní fázi Crohnovy choroby
- Hladina kortizolu souvisí s depresivitou a jinými psychopatologiemi více než hladiny katecholaminů
- Naše zkušenosti s kontinuálním podáváním inzulinu pomocí infuzního dávkovače na jednotce intenzivní metabolické péče (JIMP)
- Endoskopické změny sliznice žaludku a dvanáctníku při léčbě minidávkou acetylsalicylové kyseliny a jejich prevence
- Dosažení Bcl-2/IgH negativity v periferní krvi/kostní dřeni po léčbě je u nemocných s folikulárním lymfomem spojeno s lepší prognózou onemocnění
- Vliv terapie statiny na změny kostní denzity postmenopauzálních žen
- Analýza vlivu cirkadiánního rytmu na turbulenci srdeční frekvence u pacientů bez průkazu organického onemocnění srdce
- Plicní alveolární proteinóza
- Pozdní trombóza koronárního stentu a klopidogrel
- Syndróm MIAC (malnutrition, inflammation, atherosclerosis, calcification)
- Pseudomembranózní kolitida
- Inkretinová strategie léčby diabetes mellitus 2. typu - inhibitor DPP-IV sitagliptin
- Přínos ibandronátu pro léčbu postmenopauzální osteoporózy
- Chronická exsudativní benigní perikarditida - popis familiárního výskytu: kazuistiky
- Efekt transplantace ledvin na oxidační stres u pacientů s chronickým selháním ledvin
- Výsledky studie ADVANCE
- Kutnohorská J. Etika ve zdravotnictví.
- Škubla P. Veľký atlas húb
- Grofová Z. Nutriční podpora. Praktický rádce pro sestry.
- Krajíček M, Peregrin JH, Roček M, Šebesta P et al. Chirurgická a intervenční léčba cévních onemocnění.
- Prof. MUDr. Petr Broulík, DrSc., sedmdesátníkem
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Hladina kortizolu souvisí s depresivitou a jinými psychopatologiemi více než hladiny katecholaminů
- Pseudomembranózní kolitida
- Plicní alveolární proteinóza
- Naše zkušenosti s kontinuálním podáváním inzulinu pomocí infuzního dávkovače na jednotce intenzivní metabolické péče (JIMP)
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



