-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Nová a starší farmaka ovlivňující inzulinovou sekreci
New and Older Pharmaceuticals Influencing Insulin Secretion
The author briefly recapitulates the physiology of insulin secretion and pathophysiology with type II diabetes mellitus. Besides sulfonylurea secretagogues and glinides practically used in the long term, the author points out new possibilities of influencing insulin secretion by way of incretin mimetics and gliptins.
Key words:
diabetes mellitus, type II – insulin secretion – sulfonylurea – glinide – incretin mimetic – gliptin
Autoři: J. Olšovský
Působiště autorů: Diabetologické centrum II. interní kliniky Lékařské fakulty MU a FN u sv. Anny Brno, přednosta prof. MUDr. Miroslav Souček, CSc.
Vyšlo v časopise: Vnitř Lék 2009; 55(4): 421-424
Kategorie: Články
Souhrn
Autor krátce rekapituluje fyziologii sekrece inzulinu a patofyziologii u diabetes mellitus 2. typu. Vedle dlouhodobě prakticky využívaných sulfonylureových sekretagog i glinidů poukazuje na nové možnosti ovlivnění sekrece inzulinu cestou inkretinových mimetik a gliptinů.
Klíčová slova:
diabetes mellitus 2. typu – sekrece inzulinu – sulfonylurea – glinid – inkretinové mimetikum – gliptinHlavními příčinami diabetes mellitus (DM) 2. typu jsou inzulinová rezistence (IR) a porucha sekrece inzulinu, které mohou být vyjádřeny v různé míře. Nerovnováha mezi sekrecí inzulinu a účinkem inzulinu vede k hyperglykemii. IR se více podílí na lačné hyperglykemii, zatímco inzulinová deficience (ID) na postprandiální hyperglykemii. IR a ID se také navzájem ovlivňují. Za progresí DM 2. typu stojí úbytek masy β-buněk [1] a její funkční schopnosti (obr. 1).
Obr. 1. Funkce β-buněk determinuje progresi DM 2. typu. 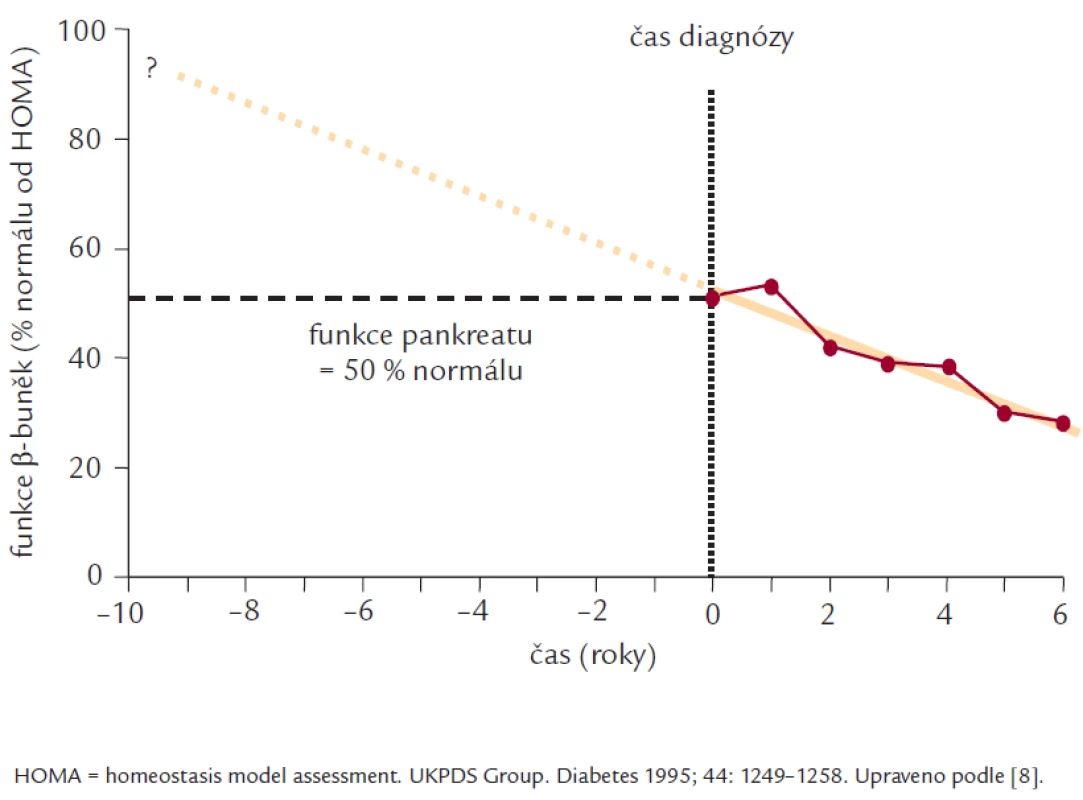
DM 2. typu jako chronické progredující onemocnění ohrožující svého nositele rozvojem cévních komplikací znamená značný terapeutický problém. Problémem není jen terapií dosáhnout cílových hodnot kompenzace diabetu [2], což má za cíl zpomalit rozvoj cévních komplikací, a to jak mikroangiopatických, tak makroangiopatických, ale také zvolit takovou léčbu, která by zpomalila progresi onemocnění, tedy která by vedla k ochraně funkce β-buněk.
Uvedené skutečnosti vedou jednak k vývoji názorů na léčebné strategie, ale také k vývoji nových léků, za jejichž pomoci lze uvedených cílů dosáhnout.
Předmětem tohoto článku je ovlivnění sekrece inzulinu. Pokud chceme dobře pochopit terapeutické možnosti poruchy sekrece inzulinu u DM 2. typu, musíme vycházet z fyziologie sekrece inzulinu, z poruch sekrece inzulinu u DM 2. typu a uvědomit si možnosti i omezení nápravy těchto poruch.
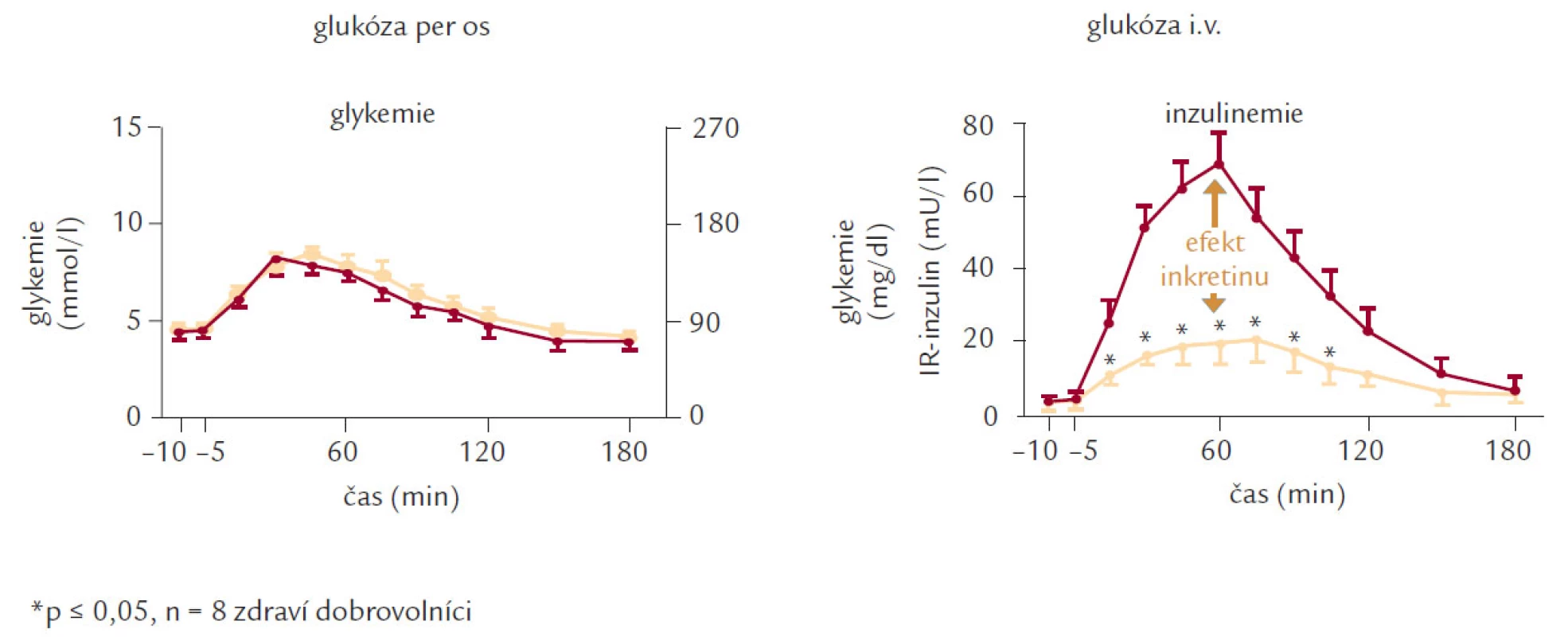
Fyziologická sekrece inzulinu je tvořena přibližně z jedné poloviny bazální sekrecí, která zajišťuje normoglykemii v podmínkách nalačno a z druhé poloviny stimulovanou sekrecí, která je reakcí na příjem potravy. Tato stimulovaná sekrece dosahuje maxima asi za 30 min a v průběhu 120 min se vrací k bazálním hodnotám. Průběh stimulované sekrece můžeme rozdělit podle 2 hledisek. Z časového hlediska hovoříme o časné fázi a pozdní fázi sekrece inzulinu. Časnou fázi představuje vyplavení preformovaného inzulinu ze sekrečních granul a pozdní fázi potom novotvorba inzulinu. U DM 2. typu je narušena zpočátku zejména časná fáze sekrece inzulinu, jak ukazuje obr. 2. Druhým hlediskem, podle kterého můžeme sekreci inzulinu rozdělit, je mechanizmus sekrece. Z hlediska mechanizmu můžeme hovořit o cefalické (stimulace laterálního jádra hypotalamu zvyšuje a stimulace ventromediálního jádra hypotalamu snižuje sekreci inzulinu), gastrointestinální a substrátové sekreci inzulinu. Zatímco v minulosti byla věnována největší pozornost substrátové sekreci inzulinu, je dnes středem zájmu gastrointestinální sekrece v souvislosti s tzv. inkretinovým efektem (tab. 1), tedy se skutečností, že sekrece inzulinu na stejnou glukózovou nálož je větší při perorálním podání než při parenterální aplikaci.
Obr. 2. Porucha sekrece inzulinu po jídle u DM 2. typu. 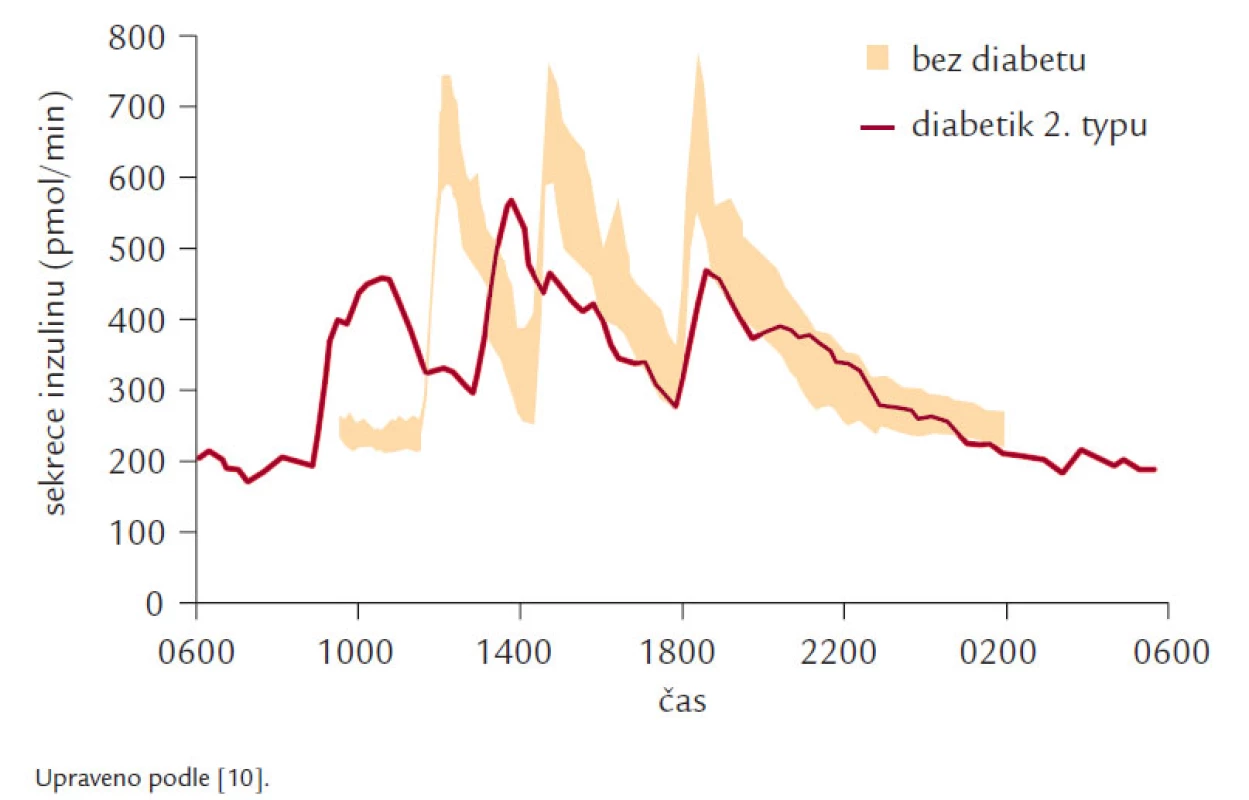
Pokud jde o substrátovou sekreci inzulinu, rozdělujeme hlavní faktory, které mají vliv na sekreci inzulinu, na primární stimulátory a na sekundární stimulátory – nebo také modulátory. Primárními stimulátory jsou nutrienty (glukóza, ketolátky, mastné kyseliny, aminokyseliny). Mezi modulátory patří hormonální působky (jejich účinek na sekreci inzulinu ukazuje obr. 3) a nervové vlivy. Z nervových vlivů má stimulační účinek na sekreci inzulinu parasympatikus a b‑adrenergní působení a inhibiční vliv a‑adrenergní působení.
Gastrointestinální sekrece inzulinu je realizovaná inkretiny, které jsou secernovány ve střevě a působí na sekreci inzulinu v β-buňkách prostřednictvím adenylátcyklázy. Sekrece inkretinů je odpovědí střevních buněk na nutriční podnět. Vyplavuje se jednak glucagon‑like peptid 1 (GLP‑1) a jednak na glukóze závislý inzulinotropní polypeptid (GIP) – starší označení gastrický inhibiční polypeptid. Tyto působky zprostředkovávají až 60 % sekrece inzulinu, která se realizuje postprandiálně. GIP působí jen na β-buňky pankreatu, jak je uvedeno výše, ale GLP‑1 má i vliv na a-buňky, tedy na sekreci glukagonu, kterou ovlivňuje inhibičně, proto je významnějším a efektivnějším působkem a byla mu dále věnována hlavní pozornost pro terapeutické využití. Glucagon‑like peptid 1 má velmi krátký poločas, v plazmě je degradován dipetidyl-peptidázou IV, což činilo potíže v jeho jednoduchém využití (musel by být podáván kontinuálně v infuzi – což není právě v léčbě chronické nemoci ideální řešení). Komplexní efekt GLP‑1 ukazuje obr. 4, kde je vidět i inhibiční vliv na evakuaci žaludku, který vysvětluje i případné nežádoucí GIT účinky a také podává možné vysvětlení vlivu na hmotnost nemocných – centrálním účinkem na regulaci příjmu potravy.
Obr. 4. GLP-1 fyziologické účinky: glukoregulační role inkretinů. 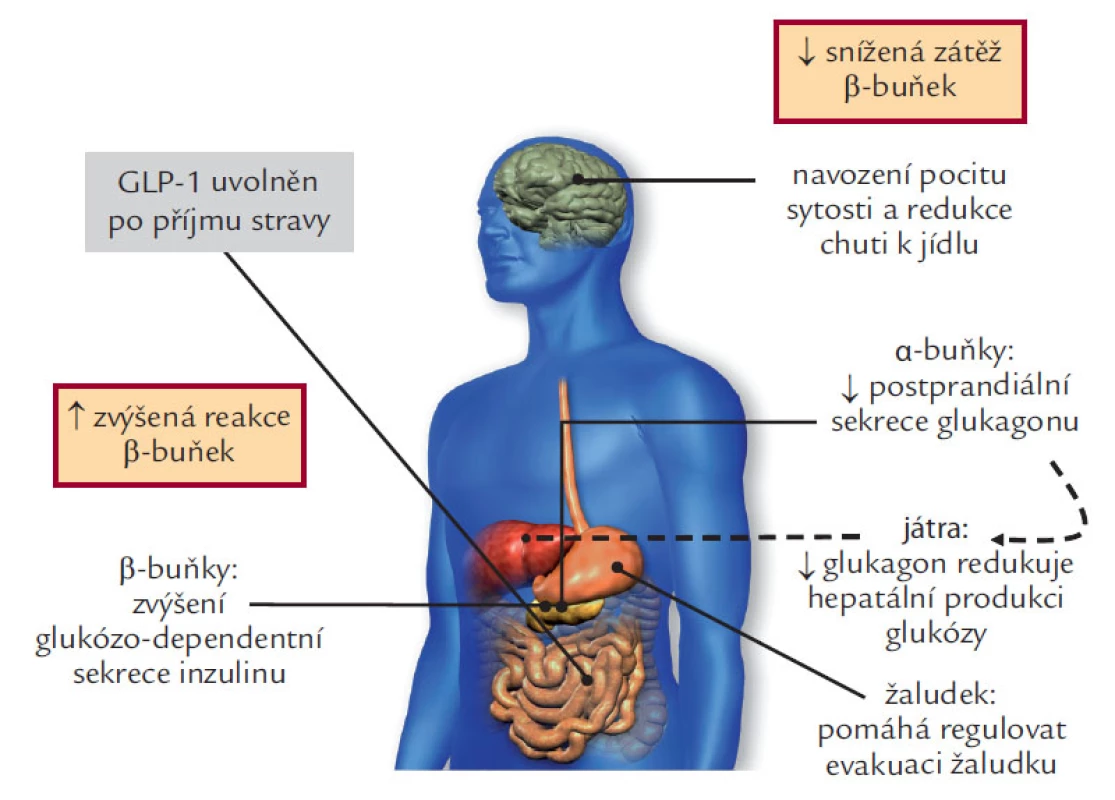
Význam pro možné terapeutické využití inkretiny získaly, když bylo poznáno, že inkretinový efekt je u diabetiků 2. typu snížen, ale hlavně, že je možné jej podáváním inkretinů opět upravit.
GLP‑1 aktivuje glukózo-dependentní sekreci inzulinu, stimuluje transkripci proinzulinu a biosyntézu inzulinu a stimuluje proliferaci a neogenezi β-buněk z duktálních buněk. Tento poslední efekt byl prokázán na zvířecích modelech. Právě tento ochranný efekt na β-buňky, pokud jej klinická praxe prokáže, by představoval značný posun v léčbě DM 2. typu, kde za chronickou progresí nemoci stojí úbytek a apoptóza β-buněk, na kterém participují ještě navíc starší sekretagoga inzulinu.
Jak vypadá na základě uvedených poznatků o GLP‑1 současná strategie pro zlepšení jeho terapeutického potenciálu? Má 2 cesty – jednak cestu působků s efektem GLP‑1, tedy inkretinových mimetik, jednak cestu prodloužení aktivity endogenního GLP‑1, tedy cestu inhibice DPP-IV.
Inkretinová mimetika, tedy látky, které napodobují účinky GLP‑1, jsou rezistentnější k DPP-IV než GLP‑1, např. GLP‑1 analoga, GLP‑1 vázaný na albumin nebo nové peptidy, které napodobují některé glykoregulační účinky GLP‑1. Do této skupiny patří exenatid (Byetta), exenatid LAR, lyraglutid. Jedná se o léky s parenterální aplikací, která se realizuje podobně jako inzulin s.c. aplikátory – pery. Tyto léky mají více nežádoucích gastrointestinálních účinků – nauzea a zvracení, ale velmi příznivý vliv na hmotnost nemocných, protože vedou k redukci hmotnosti.
Inhibitory DPP-IV, tedy gliptiny, jsou klasická perorální antidiabetika, podávaná v jedné (Sitagliptin) nebo dvou (Vildagliptin) dávkách denně. Tyto léky mají výborný bezpečnostní profil a jejich účinnost je ověřena pro kombinaci s metforminem, glitazony, sulfonylureou tak, jak jsou u nás pro léčbu doporučovaná. Jedná se o léky 2. volby při nedostatečné účinnosti metforminu. V kombinaci s metforminem a s glitazony mají velmi malé riziko hypoglykemie. Sitagliptin je v současné době už v běžné klinické praxi pro preskripci diabetologa i internisty.
Starší léky ovlivňující sekreci inzulinu jsou jednak sulfonylureové preparáty a jednak nesulfonylureová sekretagoga – glinidy [3–5].
Sulfonylurea (SU) ovlivňuje sekreci inzulinu přímým uzávěrem ATP dependentního kaliového kanálu β-buňky, čímž se β-buňka depolarizuje a otvírá se voltáž-dependentní kalciový kanál s následným influxem kalcia do β-buňky. Zvýšení intracelulární kalcemie potom vede k vyplavení inzulinu ze sekrečních granul. Obdobný mechanizmus účinku mají i glidiny, jen jiná vazebná místa než SU. Účinkem SU se vyplavuje preformovaný inzulin ze sekrečních granul. Tato granula ale při hyperglykemii (dekompenzaci diabetu) neobsahují žádný inzulin, a proto SU selhává v účinku snížení glykemie – tzv. primární selhání sulfonylurey. Sekundární selhání SU je termín, který se používá pro selhání SU po několikaletém použití u nemocného a souvisí s apoptózou β-buněk. Pokud jde o receptory pro deriváty sulfonylurey (SUR 1) a KIR kanály, účelná je blokáda Kir-SUR 1 v β-buňkách s vysokou afinitou a specificitou a také rychlá reverzibilita této vazby (preferenční selektivita klesá v řadě gliklazid – tolbutamid – glibenklamid). Neúčelná je afinita a blokáda SUR 2A (kardiomyocyty). Vysoká je přitom u glibenklamidu a glimepridu a nízká u gliklazidu a tolbutamidu. Optimální z tohoto pohledu je gliklazid. Kromě této teoretické výhodnosti osvědčil svou účinnost ve studii ADVANCE [6], a to jak v dosahování cílových hodnot kompenzace diabetu dle HbA1c, tak i vlivem na cévní komplikace. Obecně mají SU deriváty potenciál snížit lačnou glykemii o 2–3 mmol/l, postprandiální glykemii o 3–5 mmol/l a HbA1c o 0,8–1,7 %. Nevýhodou této lékové skupiny je váhový příbytek, vyšší riziko hypoglykemií a interakce s jinými léky. Výhodou jsou naopak mnohaleté zkušenosti. Sulfonylmočovina se podává v 1–2 dávkách denně preprandiálně.
Nesulfonylureová sekretagoga – také glinidy – mají stejný mechanizmus účinku jako SU, jen jiná vazebná místa. Mají rychlý nástup účinku a krátkodobé trvání, což souvisí jednak s rychlou resorpcí z GIT a jednak s krátkodobým poločasem účinku. Tyto léky jsou proto také nazývány regulátory prandiální sekrece. Jsou eliminovány stolicí, takže je možné jejich využití u nemocných s postižením ledvin. Snižují HbA1c o 0,8–1,5 %. Mohou vyvolat hypoglykemii, ale v prevenci hypoglykemie při vynechání jídla je možné i vynechání dávky léku, podávají se podle počtu jídel ve 2–4 dávkách denně preprandiálně. V ČR je k dispozici repaglinid.
Starší sekretagoga inzulinu jsou v souladu s mezinárodními doporučeními využívána také jako léky 2. volby po nedostatečném efektu monoterapie metforminem [7].
Závěrem lze konstatovat, že rozšiřující se armamentarium PAD ovlivňující sekreci inzulinu dává naději na lepší metabolickou kontrolu diabetu 2. typu – snazší dosažení cílových hodnot kompenzace DM, a tím i lepší prognózu nemocných. Současně je nutné využití léků ovlivňujících inzulinovou rezistenci. Efekt terapie může zlepšit optimální volba léčby pro konkrétního nemocného [8], tedy individuální přístup, ale rovněž co nejširší využití společných doporučení pro terapii DM 2. typu (zejména ze strany praktických lékařů). Je nezbytné, aby se léčba nemocného s diabetem 2. typu dynamicky měnila adekvátně metabolické situaci nemocného i progresi onemocnění.
Doručeno do redakce: 2. 2. 2009
MUDr. Jindřich Olšovský, Ph.D.
www.fnusa.cz
e‑mail: jindrich.olsovsky@fnusa.cz
Zdroje
1. Butler AE, Janson J, Boner-Weir S et al. Mechanism of reduction of betacell. Diabetes 2003; 52 : 102–110.
2. www.diab.cz: Standardy: Laboratorní diagnostika a sledování stavu DM.
3. Perušičová J et al. Perorální antidiabetika. Praha: Galén 2003.
4. Perušičová J. Léčba perorálními antidiabetiky. Postgrad Med 2003; 5 : 726–729.
5. Rybka J. Současnost a budoucnost perorálních antidiabetik v léčbě diabetu 2. typu. Vnitř Lék 2001; 47 : 285–290.
6. Patel A, MacMahon S, Chalmers J et al. The ADVANCE collaboration Group. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med 2008; 358 : 2560–2572.
7. Nathan DM, Buse JB, Davidson MB et al. Management of hyperglycemia in Type 2 diabetes, a consensus algorithm for the initiation and adjustment of therapy. A consensus statement from the American Diabetes Association and the European Association for the Study of Diabetes. Diabetologia 2006; 49 : 1711–1721.
8. Olšovský J. Jak používat perorální antidiabetika – algoritmy výběru. Farmakoterapie 2005; 1 : 81–85.
9. Holman RR. Assessing the potential for alpha-glucosidase inhibitors in prediabetic states. Diabetes Res Clin Pract 1998; 40 (Suppl 1): S21–S25.
10. Polonsky KS, Given BD, Hirsch LJ et al. Abnormal patterns of insulin secretion in non‑insulin‑dependent diabetes mellitus. New Engl J Med 1988; 318 : 1231–1239.
11. Nauck et al. Diabetologia 1986; 29 : 46–52
12. Larsson H, Holst JJ, Ahrén B. Glucagon‑like peptide-1 reduces hepatic glucose production indirectly through insulin and glucagon in humans. Acta Physiol Scand 1997; 160 : 413–422.
13. Nauck MA, Wollschläger D, Werner J et al. Effects of subcutaneous glucagon‑like peptide 1 (GLP‑1 [7–36 amide]) in patients with NIDDM. Diabetologia 1996; 39 : 1546–1553.
14. Drucker DJ. Glucagon‑like peptides. Diabetes 1998; 47 : 159–169.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2009 Číslo 4- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Co dělat při intoleranci statinů?
-
Všetky články tohto čísla
- Úvodní slovo
- 10. celostátní diabetologické sympozium Diabetes a klinická farmakologie
- Farmakoekonomika léčby diabetu – trendy u nás
- Náklady na diabetes 2. typu v podmínkách zdravotního systému České republiky
- Klinické hodnocení léčiv a jeho význam pro diabetologii
- Klinické studie, které ovlivnily léčbu diabetu
- Enterální a parenterální výživa u diabetu
- Hypolipidemika a diabetes mellitus
- Cílové hodnoty krevního tlaku u pacientů s diabetes mellitus
- Léky ovlivňující kostní metabolizmus diabetiků
- Substituce hypotyreózy a nadledvinové nedostatečnosti u diabetiků
- Možnosti hormonální antikoncepce a substituce u diabetiček
- Farmaceutická péče u pacienta s diabetes mellitus a vztah ke klinické farmacii
- Zlepšení kontroly krevního tlaku jako výsledek spolupráce lékaře a farmaceuta
- Lékové interakce vybraných léků užívaných pacienty s diabetes mellitus
- Liekové interakcie u diabetikov na oddelení klinickej farmakológie
- Význam struktury inzulinových přípravků pro klinickou praxi
- Funkční potraviny a diabetes – důkazy a mýty
- Rostlinné látky ovlivňující metabolizmus diabetu 2. typu
- Nová a starší farmaka ovlivňující inzulinovou sekreci
- Inzulin senzitizující léky
- Potenciální nová antidiabetika pro příští desetiletí
- Pozvánka
- XXXIV. angiologické dny 2009 s mezinárodní účastí
- Recenze
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Cílové hodnoty krevního tlaku u pacientů s diabetes mellitus
- Lékové interakce vybraných léků užívaných pacienty s diabetes mellitus
- Možnosti hormonální antikoncepce a substituce u diabetiček
- Inzulin senzitizující léky
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy