-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Genetické pozadie nádorov kôry nadobličiek – aktuality
Genetic background of adrenal cortex tumours – news
This review has summarized the current knowledge of the genetic background of tumors originating from adrenocortical tissue, manifested as a part of inherited or familial syndromes, as well as specific forms of sporadic tumors caused by aberrant expression of G ‑ protein coupled receptors.
Key words:
adrenal gland – tumor – genetics – genes – syndrome
Autoři: A. Kreze jr. 1; P. Vaňuga 2; M. Pura 2
Působiště autorů: II. interní oddělení FN Na Bulovce Praha, přednosta prim. MU Dr. Jiří Koskuba2 Endokrinologické oddelenie Národného endokrinologického a diabetologického ústavu Ľubochňa, Slovenská republika, prednosta prim. MU Dr. Peter Vaňuga, PhD. 1
Vyšlo v časopise: Vnitř Lék 2010; 56(12): 1279-1285
Kategorie: 80. narozeniny prof. MUDr. RNDr. Luboslava Stárky, DrSc., bývalého ředitele Endokrinologického ústavu Praha
Souhrn
V práci je podaný prehľad aktuálnych poznatkov týkajúcich sa problematiky genetického pozadia nádorov kôry nadobličiek manifestovaných v rámci vrodených a/ alebo familiárnych syndrómov, ako aj špecifickým formám sporadických nádorov adrenokortexu vznikajúcich v dôsledku aberantnej expresie receptorov viazaných s G ‑ proteínmi.
Kľúčové slová:
nadoblička – nádor – genetika – gény – syndrómV poslednom čase došlo k výraznému rozšíreniu poznatkov týkajúcich sa adrenokortikálnych nádorov. Nasledujúci text sa venuje genetickému pozadiu nádorov kôry nadobličiek manifestovaných v rámci vrodených a/ alebo familiárnych syndrómov, ako aj špecifickým formám sporadických nádorov adrenokortexu vznikajúcich v dôsledku aberantnej expresie receptorov viazaných s G - proteínmi.
Syndrómy s výskytom nádorov a familiárne formy nádorov
Mnohopočetná endokrinná neoplázia typ 1 (MEN1)
Syndróm MEN1 je autozomálne dominantným ochorením s výskytom nádorov endokrinných a neendokrinných orgánov. Štandardným klinickým kritériom pre diagnózu MEN1 u pacienta je výskyt nádorov v dvoch z troch najviac postihovaných endokrinných tkanív (paratyreoidea, duodenopankreas a adenohypofýza) [1]. Familiárny MEN1 klinicky definuje proband s MEN1 a minimálne jeden prvostupňový príbuzný s nádorom v minimálnej jednej z vyššie uvedených troch lokalizácií. Nádory nadobličiek sú prítomné u približne 1/ 3 pacientov MEN1 [2]. Väčšinou ide o hormonálne inaktívne benígne adrenokortikálne adenómy, zriedkavo prípady periférneho hyperkortizolizmu a primárneho aldosteronizmu, boli však popísané aj prípady pacientov s unilaterálnym feochromocytómom [2,3]. Germinatívne mutácie MEN1 génu, ktorý má funkciu tumor-supresorového génu, sa podarí identifikovať iba u 70 % u pacientov s familiárnym MEN1 a ešte v menšom prípade u pacientov so sporadickým MEN1 [4].
Mnohopočetná endokrinná neoplázia typ 4 (MEN4)
V roku 2006 a následne o rok neskôr boli publikované prvé 2 prípady rodín s fenotypom pripomínajúcim MEN1 syndróm, u ktorých boli ako podklad ochorenia identifikované inaktivačné mutácie génu proteínu p27Kip1 [5,6]. Proteín p27Kip1 patrí do skupiny inhibítorov cyklín-dependentných kináz (CDKI) [5]. Výsledkom nedávnej štúdie, prevedenej u pacientov s fenotypom MEN1 bez ozrejmených mutácií génu MEN1, bola identifikácia germinatívnych mutácií génov CDKi* kódujúcich proteíny p15, p18, p21 a p27 [7]. Kým na zvieracom modeli sa mutácie p27 spájajú so zmiešaným fenotypom MEN1 a MEN2 syndrómu (tzv. MENX) [5,8], doteraz identifikovaní pacienti s mutáciami CDKi nemali nádory charakteristické pre MEN2, vychádzajúce z C buniek alebo chromafinných buniek [5,9]. Germinatívne mutácie CDKi tvoria malú, avšak nezanedbateľnú frakciu prípadov s fenotypom syndrómu MEN1. Zdá sa, že genetický skríning u pacientov s MEN1 negatívnych na prítomnosť mutácií v géne MEN1 bude treba v budúcnosti rozšíriť o vyšetrenie génov CDKi [10].
* Skratka CDKi súhrnne zastrešuje gény všetkých siedmych známych CDKI, t.j. gén CDKN2A (kódujúci proteín p16Ink4a), CDKN2B (p15Ink4b), CDKN2C (p18Ink4c), CDKN2D (p19Ink4d), CDKN1A (p21Cip1), CDKN1B (p27Kip1) a CDKN1C (p57Kip2).
Carneyho komplex
Carneyho komplex (CNC), synonymum LAMB syndróm (lentiginess, atrial myxoma, mucocutaneous myxoma, blue nevi), resp. NAME syndróm (nevi, atrial myxoma, myxoid neurofibroma, ephelide) je zriedkavé autozomálne dominantné ochorenie, popísané v roku 1985 ako kombinácia myxómov, bodkovitej pigmentácie a endokrinnej hyperfunkcie [11]. Doteraz bolo popísaných menej ako 700 prípadov pacientov s CNC. Ochorenie postihuje viaceré orgány a jeho manifestácia je veľmi variabilná (tab. 1). Za patognomický pre sporadický prípad CNC sa pokladá súčasný výskyt minimálne 2 klinických príznakov uvedených v tab. 1, pre familiárnu formu CNC dôkaz aspoň 1 z nich a prítomnosť ochorenia u prvostupňového príbuzného [12]. Najčastejším príznakom vedúcim k diagnóze CNC sú intrakardiálne a extrakardiálne myxómy.
Tab. 1. Syndrómy s výskytom nádorov kôry nadobličiek. 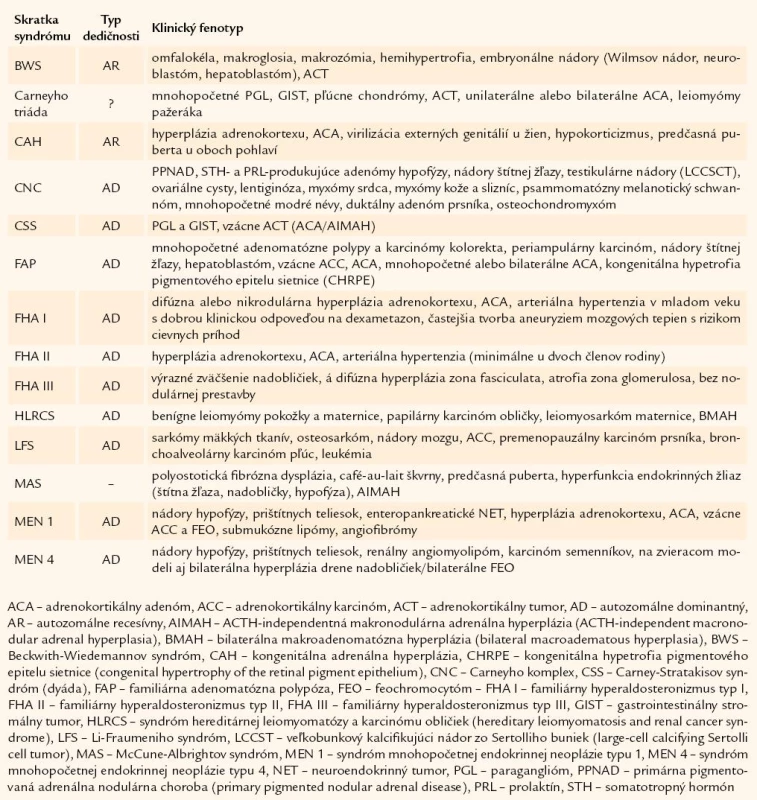
McCune-Albrightov syndróm
Geneticky ide o nededičné ochorenie s aktivačnou mutáciou génu GNAS1, ktorý kóduje α podjednotku stimulačného proteínu GSα. Somatická mutácia, ktorá vzniká postzygoticky vo včasnom embryonálnom období, je prítomná v mozaikovej forme v rôznych tkanivách. Podľa orgánového výskytu mutácie následne vzniká hyperfukcia rôznych endokrinných žliaz. Ochorenie bolo iniciálne definované triádou predčasná puberta, škvrny typu café-au - lait a polyostotická fibrózna dysplázia. Korelátom postihnutia nadobličiek je vznik adenómu, resp. bilaterálnej makronodulárnej hyperplázie [13,14].
ACTH - independentný hyperkortizolizmus
Prehľad ACTH-independentných foriem hyperkortizolizmu s novou klasifikáciou navrhnutou Stratakisom je uvedený v tab. 2 [15,16].
Tab. 2. Formy ACTH‑independentného hyperkortizolizmu. Upravené podľa [15,16]. ![Formy ACTH‑independentného hyperkortizolizmu. Upravené podľa [15,16].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/d3c410582d7fde3554eb63ae0b5a277b.jpeg)
ACTH - independentná makronodulárna adrenokortikálna hyperplázia
Ide o zriedkavú formu hyperkortizolizmu, ktorú vo väčšine prípadov podmieňuje aberantná expresia jedného alebo niekoľkých receptorov viazaných s G-proteínom (tab. 3), syndromologické formy sú vyslovene vzácne (tab. 2) [16 – 19].
Tab. 3. Genetické zmeny pri benígnych adrenokortikálnych nádoroch. Upravené podľa [4]. ![Genetické zmeny pri benígnych adrenokortikálnych nádoroch. Upravené podľa [4].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/250bdbdc8a27a72c4d6d9d3466aa3063.jpeg)
Primárna pigmentovaná nodulárna adrenokortikálna choroba (PPNAD)
Ide o autozomálne dominantné ochorenie, ktoré sa vyskytuje buď v izolovanej familiárnej forme, alebo v rámci Carneyho komplexu (tab. 1) [20]. Nadobličky sú väčšinou nezväčšené, obsahujú niekoľko tmavohnedých mikronodulov, okolitý parenchým môže byť normálny, atrofický, alebo hypertrofický. Podkladom ochorenia sú germinatívne mutácie génu PRKAR1A kódujúceho regulačnú podjednotku typu 1 alfa (R1α) proteínkinázy A (podtyp 1) alebo mutácie génu PDE11A fosfodiesterázy 11A (podtyp 2). Gén PRKAR1A vykazuje funkcie tumor-supresorového génu a obsahuje 12 exónov, mutácie sa vyskytujú v celom priebehu génu. Väčšinou sa jedná o malé substitúcie, delécie a inzercie. Takmer všetky mutácie vedú k predčasnému stop kodónu a skráteniu bielkoviny regulačnej podjednotky R1α a sú funkčne ekvivalentné, mierne odlišný fenotyp podmieňujú delécie veľkých úsekov génu [21].
Adrenokortikálna hyperplázia pri PPNAD sa klasifikuje ako neoplastická lézia. Prekvapivým zistením štúdie na zvieracom modeli PPNAD je, že u myší strata aktivity Prkar1a a dysregulácia aktivity proteínkinázy A vyúsťuje do nesprávneho zachovania a centrifugálnej expanzie kortizol - produkujúcich buniek fetálnej zóny X, so súčasnou regresiou dospelej kôry. Dáta sú prvým in vivo dôkazom toho, že strata R1α postačuje na to, aby navodila autonómnu hyperaktivitu nadobličiek a bilaterálnu hyperpláziu. Výrazné zmeny v diferenciácii zón a v obnove buniek však nasvedčujú tomu, že na PPNAD sa treba pozerať ako na vývojové ochorenie [22].
Fosfodiesteráza PDE11A je duálne-špecifický enzým katalyzujúci hydrolýzu cAMP a cGMP. Genetické varianty PDE11A inhibujú enzymatickú aktivitu a zvyšujú hladiny cyklických nukleotidov. Inaktivačné mutácie génu PDE11A nájdené u detských u pacientov s bilaterálnou mikronodulárnou adrenokortikálnou hyperpláziou naznačujú, že aj v prípade génu PDE11A pôjde o tumor-supresorový gén [23]. Jeho zmeny navyše predisponujú aj na vývoj ďalších foriem benígnych, ako aj malígnych adrenokortikálnych nádorov u dospelých. Genómové štúdie naznačujú, že adrenokortikálnu tumorigenézu podmieňujú aj iné fosfodiesterázy [15]. Genetickým vyšetrením kohorty 20 pacientov s mikronodulárnou adrenokortikálnou hyperpláziou Horvath et al identifikovali germinatívnu mutáciu génu PDE8B u dvojročného dievčatka s Cushingovým syndrómom [21]. Gén PDE8B kóduje fosfodiesterázu s najvyššou afinitou k cAMP. Inaktivačné mutácie PDE8B sú tak novou príčinou vrodenej predispozície na vznik Cushingovho syndrómu u detí.
Renín - independentný hyperaldosteronizmus
Familiárny hyperaldosteronizmus typ I (FHA I)
FHA I, synonymum glukokortikoidmi -vyliečiteľný (glucocorticoid - remediable) alebo dexametazonom-suprimovateľný (dexamethasone - suppressible) aldosteronizmus, prvýkrát popísaný v roku 1966 [24], vzniká v dôsledku nevyváženej výmeny génov kódujúcich aldosterónsyntázu (gén CYP11B2) a 11 - β-hydroxylázu (gén CYP11B1) [25]. Chimerický gén obsahuje promótorovú oblasť génu CYP11B1, čím sa aktivita aldosterónsyntázy stáva ACTH - dependentnou a dochádza k ektopickej tvorbe aldosterónu v bunkách zona fasciculata. Okrem toho dochádza k tvorbe hybridných steroidov – 18 - hydroxykortizolu (18 - OH - F) a 18-oxokortizolu (18 - oxo - F), ktorých zvýšené hladiny (10 - násobne) sa pokladajú za špecifický marker ochorenia. Odhaduje sa, že táto autozomálne dominantná monogenetická forma aldosteronizmu podmieňuje 0,5 – 1,0 % prípadov primárneho aldosteronizmu [26]. Charakteristickým histologickým nálezom u pacientov s FHA I je bilaterálna nodulárna hyperplázia s atrofiou zona glomerulosa, vzácne adrenálny adenóm [27].
Familiárny hyperaldosteronizmus typ II (FHA II)
Ide o familiárnu formu aldosteronizmu na podklade unilaterálneho adenómu alebo bilaterálnej hyperplázie nadobličiek [28,29]. Jednotlivé prípady nie je možné klinicky, biochemicky a morfologicky odlíšiť od zdanlivo sporadických prípadov primárneho aldosteronizmu [28]. Vertikálny prenos svedčí pre autozomálne dominantný typ dedičnosti. Diagnóza FHA II sa zakladá na dôkaze primárneho aldosteronizmu u minimálne 2 členov rodiny a genetickom vyšetrení lokusu 8q21, s vylúčením nálezu hybridného génu CYP11B1/ CYP11B2, ktorý je podkladom FHA I. Presný genetický podklad ochorenia ostáva neznámy. Ukazuje sa spojitosť s lokusom 7p22, kauzálny gén sa však zatiaľ identifikovať nepodarilo [29,30].
Familiárny hyperaldosteronizmus typ III (FHA III)
Ide o novú, nedávno popísanú formu familiárneho primárneho aldosteronizmu, ktorá je charakteristická ťažkou hypertenziou nastupujúcou v detstve, s hypokaliémiou a závažným poškodením cieľových orgánov [28]. Hypertenzia je rezistentná na liečbu, vrátane spironolaktónu a amiloridu (čím sa odlišuje od ostatných familiárnych foriem aldosteronizmu a sporadického aldosteronizmu) a vyžaduje bilaterálnu adrenalektómiu. Typická je výrazná hypersekrécia 18 - OH - F a 18 - oxo - F. V porovnaní hladinami u pacientov s FHA I, pri FHA III sú hladiny 18 - OH - F a 18 - oxo - F dramaticky vyššie (10 - , resp. 1 000 - násobne vyššie). Pacienti s FHA III navyše vykazujú hladinovo fyziologickú, avšak autonómnu sekréciu kortizolu, nesuprimovateľnú dexametazonom. Predpokladá sa, že kortizol je v norme preto, lebo sa využíva ako substrát pre 18 - OH - F a 18 - oxo-F. Nadobličky sú výrazne zväčšené, histologicky je preukázateľná difúzna hyperplázia [27]. Podkladom ochorenia v prípade FHA III bude skôr porucha génu zúčastňujúceho sa kontroly rastu buniek, ako porucha génov kódujúcich syntézu, reguláciu a sekréciu aldosterónu [27].
Familiárne formy nádorov s nadprodukciou adrenálnych androgénov
Zatiaľ nie je definovaný žiadny syndróm s familiárnym výskytom adenómov produkujúcich adrenálne androgény. Nie je však dôvod domnievať sa, že by aberantná expresia receptorov viazaných s G-proteínmi nemohla postihovať bunky zona reticularis. V roku 2005 bol publikovaný prípad pacientky s LH/hCG-dependentným virilizujúcim syndrómom na podklade bilaterálnej makronodulárnej adrenokortikálnej hyperplázie, s čisto androgénovou sekréciou reagujúcou na liečbu leuprolidom [31].
Sporadické nádory
ACTH - independentný hyperkortizolizmus
Za fyziologických okolností je ligandom receptorov na povrchu adrenokortikálnych buniek ACTH. Ukazuje sa, že pomerne veľká časť sporadických prípadov ACTH-independentného hyperkortizolizmu vzniká v dôsledku aberantnej expresie receptorov viazaných s G-proteínmi (GPCR) (tab. 3) [17,32 – 36]. Tieto sú podkladom vzniku solitárnych adenómov a bilaterálnych makronodulárnych hyperplastických lézií. Identifikácia nových GPCR síce otvára nové možnosti stratégie farmakologickej liečby Cushingovho syndrómu, na ovplyvnenie doteraz popísaných GPCR je však dostupných iba minimum liekov [36].
Renín-independentný hyperaldosteronizmus
Podobne ako pri kortizol-produkujúcich adenómoch sa aberantná expresia GPCR dokázala aj v prípade aldosterón-produkujúcich adenómov (aldosterone-producing adenomas – APA). Zatiaľ išlo o prípady APA klasifikovaných ako sporadické. Produkcia aldosterónu môže byť regulovaná viacerými GPCR exprimovanými v nadobličke. Aj keď serotonín a ACTH nie sú primárnymi fyziologickými regulátormi sekrécie aldosterónu, bunky zona glomerulosa exprimujú receptory pre serotonín a pre ACTH. Liečba serotonínom aj ACTH stimuluje produkciu aldosterónu v izolovaných bunkách zona glomerulosa. Selektívny serotoninergný antagonista ketanserín prechodne znížil tlak krvi, hladiny plazmatického aldosterónu, kortizolu u 4 pacientov s APA. Špecifický antagonista serotonínového receptoru, GR113808, inhibuje produkciu aldosterónu u pacientov s APA [37]. Naopak, agonista serotonínového receptoru cisaprid má na vzostup plazmatického aldosterónu u pacientov s APA stimulačný efekt. Dokázaná schopnosť LH-receptoru regulovať produkciu steroidov v gonádach a početné prípady pacientov s LH/ hCG-mediovaným Cushingovým syndrómom [35] podporujú úlohu ektopického LH-receptoru ako potencionálnej príčiny APA [32,38,39]. Ye et al dokázali vo vzorkách APA zvýšenú expresiu GnRH-receptorov [18]. Podobne je dokázaná aberantná expresia endotelínových receptorov, receptorov pre glutamát a TSH-receptorov [16,18,19]. Expresia vyššie uvedených GPCR je zvýšená vo väčšine APA, ale iba v niektorých nádoroch sa dokázala jednoznačná ektopická expresia.
MUDr. Alexander Kreze jr., CSc.
www.fnb.cz
e-mail: krezejr@yahoo.comDoručeno do redakce: 1. 10. 2010
Zdroje
1. Brandi ML, Gagel RF, Angeli A et al. Guidelines for diagnosis and therapy of MEN type 1 and type 2. J Clin Endocrinol Metab 2001; 86 : 5658 – 5671.
2. Koch CA, Pacak K, Chrousos GP. The molecular pathogenesis of hereditary and sporadic adrenocortical and adrenomedullary tumors. J Clin Endocrinol Metab 2002; 87 : 5367 – 5384.
3. Langer P, Cupisti K, Bartsch DK et al. Adrenal involvement in multiple endocrine neoplasia type 1. World J Surg 2002; 26 : 891 – 896.
4. Ozawa A, Agarwal SK, Mateo CM et al. The parathyroid/ pituitary variant of multiple endocrine neoplasia type 1 usually has causes other than p27Kip1 mutations. J Clin Endocrinol Metab 2007; 92 : 1948 – 1951.
5. Pellegata NS, Quintanilla ‑ Martinez L,Siggelkow H et al. Germ‑line mutations in p27KiP1 cause a multiple endocrine neoplasia syndrome in rats and humans. Proc Natl Acad Sci USA 2006; 103 : 15558 – 15563.
6. Georgitsi M, Raitila A, Karhu A et al. Germline CDKN1B/ p27Kip1 mutation in multiple endocrine neoplasia. J Clin Endocrinol Metab 2007; 92 : 3321 – 3325.
7. Agarwal SK, Mateo CM, Marx SJ. Rare germline mutations in cyclin‑dependent kinase inhibitor genes in MEN1 and related states. J Clin Endocrinol Metab 2009; 94 : 1826 – 1834.
8. Fritz A, Walch A, Piotrowska K et al. Recessive transmission of a multiple endocrine neoplasia syndrome in the rat. Cancer Res 2002; 62 : 3048 – 3051.
9. Franklin DS, Godfrey VL, O’Brien DA et al. Functional collaboration between different cyclin‑dependent kinase inhibitors suppresses tumor growth with distinct tissue specificity. Mol Cell Biol 2000; 20 : 6147 – 6158.
10. Falchetti A, Brandi ML. Multiple endocrine neoplasia type I variants and phenocopies: more than a nosological issue? J Clin Endocrinol Metab 2009; 94 : 1518 – 1520.
11. Carney JA, Gordon H, Carpenter PC et al. The complex of myxomas, spotty pigmentation and endocrine overactivity. Medicine (Baltimore) 1985; 64 : 270 – 283.
12. Stratakis CA, Kirschner LS, Carney JA. Clinical and molecular features of the Carney complex: diagnostic criteria and recommendations for patient evaluation. J Clin Endocrinol Metab 2001; 86 : 4041 – 4046.
13. Lytras A, Tolis G. Reproductive disturbances in multiple neuroendocrine tumor syndromes. Endocr Relat Cancer 2009; 16 : 1125 – 1138.
14. Marx SJ, Simonds WF. Hereditary hormone excess: genes, molecular pathways, and syndromes. Endocr Rev 2005; 26 : 615 – 661.
15. Stratakis CA, Boikos SA. Genetics of adrenal tumors associated with Cushing’s syndrome: a new classification for bilateral adrenocortical hyperplasias. Nat Clin Pract Endocrinol Metab 2007; 3 : 748 – 757.
16. Stratakis CA. New genes and/ or molecular pathways associated with adrenal hyperplasias and related adrenocortical tumors. Mol Cell Endocrinol 2009; 300 : 152 – 157.
17. Bourdeau I, Lacroix A. Abberant hormone receptors in adrenal Cushing’s syndrome. Curr Opinion Endocrinol Diab 2002; 9 : 230 – 236.
18. Ye P, Mariniello B, Mantero F et al. G ‑ protein‑coupled receptors in aldosterone ‑ producing adenomas: a potential cause of hyperaldosteronism. J Endocrinol 2007; 195 : 39 – 48.
19. Zwermann O, Suttmann Y, Bidlingmaier M et al. Screening for membrane hormone receptor expression in primary aldosteronism. Eur J Endocrinol 2009; 160 : 443 – 451.
20. Sandrini F, Stratakis C. Clinical and molecular genetics of primary pigmented nodular adrenocortical disease. Arq Bras Endocrinol Metabol 2004; 48 : 637 – 641.
21. Horvath A, Bossis I, Giatzakis C et al. Large deletions of the PRKAR1A gene in Carney complex. Clin Cancer Res 2008; 14 : 388 – 395.
22. Sahut ‑ Barnola I, de Joussineau C, Val P et al. Cushing’s syndrome and fetal features resurgence in adrenal cortex ‑ specific Prkar1a knockout mice. PLoS Genet 2010; 6: e1000980.
23. Libé R, Fratticci A, Coste J et al. Phosphodiesterase 11A (PDE11A) and genetic predisposition to adrenocortical tumors. Clin Cancer Res 2008; 14 : 4016 – 4024.
24. Sutherland DJ, Ruse JL, Laidlaw JC. Hypertension, increased aldosterone secretion and low plasma renin activity relieved by dexamethasone. Can Med Assoc J 1966; 95 : 1109 – 1119.
25. Lifton RP, Dluhy RG, Powers M et al. A chimaeric 11 beta‑hydroxylase/ aldosterone synthase gene causes glucocorticoid ‑ remediable aldosteronism and human hypertension. Nature 1992; 355 : 262 – 265.
26. Pizzolo F, Trabetti E, Guarini P et al. Glucocorticoid remediable aldosteronism (GRA) screening in hypertensive patients from a primary care setting. J Hum Hypertens 2005; 19 : 325 – 327.
27. Geller DS, Zhang JJ, Wisgerhof MV et al. A novel form of human Mendelian hypertension featuring non‑glucocorticoid remediable aldosteronism. J Clin Endocrinol Metab 2008; 93 : 3117 – 3123.
28. Stowasser M, Gordon RD, Tunny TJ et al. Familial hyperaldosteronism type II: five families with a new variety of primary aldosteronism. Clin Exp Pharmacol Physiol 1992; 19 : 319 – 322.
29. So A, Duffy DL, Gordon RD et al. Familial hyperaldosteronism type II is linked to the chromosome 7p22 region but also shows predicted heterogeneity. J Hypertens 2005; 23 : 1477 – 1484.
30. Jeske YW, So A, Kelemen L et al. Examination of chromosome 7p22 candidate genes RBaK, PMS2 and GNA12 in familial hyperaldosteronism type II. Clin Exp Pharmacol Physiol 2008; 35 : 380 – 385.
31. Goodarzi MO, Dawson DW, Li X et al. Virilization in bilateral macronodular adrenal hyperplasia controlled by luteinizing hormone. J Clin Endocrinol Metab 2003; 88 : 73 – 77.
32. Christopoulos S, Bourdeau I, Lacroix A.Aberrant expression of hormone receptors in adrenal Cushing’s syndrome. Pituitary 2004; 7 : 225 – 235.
33. Lacroix A, Ndiaye N, Tremblay J et al. Ectopic and abnormal hormone receptors in adrenal Cushing’s syndrome. Endocr Rev 2001; 22 : 75 – 110.
34. Lacroix A, Baldacchino V, Bourdeau Iet al. Cushing’s syndrome variants secondary to aberrant hormone receptors. Trends Endocrinol Metab 2004; 15 : 375 – 382.
35. Mazzuco TL, Chabre O, Feige JJ et al. Aberrant expression of human luteinizing hormone receptor by adrenocortical cells is sufficient to provoke both hyperplasia and Cushing’s syndrome features. J Clin Endocrinol Metab 2006; 91 : 196 – 203.
36. Assie G, Louiset E, Sturm N et al. Systematic analysis of G protein‑coupled receptor gene expression in adrenocorticotropin‑independent macronodular adrenocortical hyperplasia identifies novel targets for pharmacological control of adrenal Cushing’s syndrome. J Clin Endocrinol Metab 2010; 95: E253 – E262.
37. Lefebvre H, Cartier D, Duparc C et al. Characterization of serotonin(4) receptors in adrenocortical aldosterone ‑ producing adenomas: in vivo and in vitro studies. J Clin Endocrinol Metab 2002; 87 : 1211 – 1216.
38. Li S, Huang S, Peng SB. Overexpression of G protein‑coupled receptors in cancer cells: involvement in tumor progression. Int J Oncol 2005; 27 : 1329 – 1339.
39. Saner ‑ Amigh K, Mayhew BA, Mantero Fet al. Elevated expression of luteinizing hormone receptor in aldosterone ‑ producing adenomas. J Clin Endocrinol Metab 2006; 91 : 1136 – 1142.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek HIV lipodystrofieČlánek Prof. MU Dr. Ctirad John, DrSc. – doyen českých a slovenských lékařských mikrobiologů a imunologůČlánek Vliv saturace jódem na výskyt tyreopatií ve vybraných regionech u dospělé populace České republikyČlánek Hodnotenie aktivity 11β- hydroxysteroid dehydrogenázy typu 1 u pacientiek s reumatoidnou artritídou
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2010 Číslo 12- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Markery funkcie endotelu vo včasných štádiách esenciálnej hypertenzie a účinok antihypertenznej terapie
- HIV lipodystrofie
- Postavení metforminu jako antidiabetika první volby
- Plicní forma histiocytózy z Langerhansových buněk – hodnocení aktivity nemoci a léčebné odpovědi pomocí PET‑CT (indexu SUVmax Pulmo/ SUVmax Hepar). Popis vlastních zkušeností a přehled literatury
- Doporučený postup pro indikaci molekulárně genetických vyšetření v rámci diagnostiky trombofilních stavů v žilním systému
- Klinické fórum expertov: Diagnostika a liečba akútnych porfýrií. 11.– 12. júna 2010, Paríž (Francúzsko)
- Prof. MU Dr. Ctirad John, DrSc. – doyen českých a slovenských lékařských mikrobiologů a imunologů
- Marek J et al. Farmakoterapie vnitřních nemocí. 4. zcela přepracované a doplněné vydání. Praha: Grada Publishing 2010. Počet stran 777. ISBN 978- 80- 247- 2639- 7.
- Olejárová M. Biologická léčba v revmatologii. Praha: Mladá fronta 2010. Počet stran 151. ISBN 978- 80- 204- 2281- 1.
- Prof. MU Dr. RNDr. Luboslav Stárka, DrSc., osmdesátníkem
- Vliv saturace jódem na výskyt tyreopatií ve vybraných regionech u dospělé populace České republiky
- Aktivita osi hypotalamus- hypofýza- nadoblička u pacientov s reumatoidnou artritídou
- Hodnotenie aktivity 11β- hydroxysteroid dehydrogenázy typu 1 u pacientiek s reumatoidnou artritídou
- Genetické pozadie nádorov kôry nadobličiek – aktuality
- Imunoendokrinní vztahy u nadledvin
- Extrémně nízké hladiny SHBG jako důsledek polymorfizmu Pro156Leu v genu pro SHBG – kazuistiky dvou žen se syndromem polycystických ovarií
- Genetické pozadie nádorov adrenomedulárneho a extraadrenálneho chromafinného tkaniva – aktuality
- Porodní hmotnost a genetické pozadí rizika diabetes mellitus 2. typu u české populace
- Jodový deficit ve světě i v České republice – současný stav a perspektivy
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Extrémně nízké hladiny SHBG jako důsledek polymorfizmu Pro156Leu v genu pro SHBG – kazuistiky dvou žen se syndromem polycystických ovarií
- Plicní forma histiocytózy z Langerhansových buněk – hodnocení aktivity nemoci a léčebné odpovědi pomocí PET‑CT (indexu SUVmax Pulmo/ SUVmax Hepar). Popis vlastních zkušeností a přehled literatury
- Aktivita osi hypotalamus- hypofýza- nadoblička u pacientov s reumatoidnou artritídou
- HIV lipodystrofie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



