-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vplyv testosterónu na kardiovaskulárne ochorenia u mužov
The influence of testosterone on cardiovascular disease in men
The influence of testosterone on cardiovascular disease is recently discussed question. Testosterone modulates vascular reactivity by genomic and nongenomic modes of action, it has an impact on endothelial function, production of proinflamatory cytokines and lipid profiles. The possible role of sex hormone binding globulin (SHBG) in androgen action by plasmatic membrane receptors breaks “the free hormone hypothesis”, especially when clinical trials reveal strong association between SHBG and risk factors of cardiovascular disease. The results of last clinical trials mention that androgen deficiency is associated with obesity, insulin resistance and dyslipidaemia. Large clinical trials demonstrated that androgen deficiency predict mortality in elderly men. Testosterone substitution restores vasoreactivity and endothelial function and could potentially reduce cardiovascular disease in men but to confirm this theory more large clinical trials are needed.
Key words:
testosterone – androgen deficiency – endotelial dysfunction – metabolic syndrome
Autoři: J. Payer; A. Baňárová
Působiště autorů: V. interná klinika Lekárskej fakulty UK a FNsP Bratislava, Slovenská republika, prednosta prof. MUDr. Juraj Payer, CSc.
Vyšlo v časopise: Vnitř Lék 2010; 56(7): 702-708
Kategorie: 80. narozeniny předsedy České lékařské společnosti J. E. Purkyně prof. MUDr. Jaroslava Blahoše, DrSc.
Souhrn
Vplyv testosterónu na kardiovaskulárne ochorenia je diskutovanou otázkou posledných rokov. Testosterón vplýva na cievnu reaktivitu genomickými a negenomickými mechanizmami, má vplyv na funkciu endotelu, produkciu prozápalových cytokínov a lipidové spektrum. Možná úloha sex hormone binding globulínu (SHBG) ako molekuly sprostredkujúcej efekt androgénov prostredníctvom receptorov plazmatickej membrány vyvracia teóriu o účinnosti len voľnej frakcie androgénov, najmä keď klinické štúdie poukazujú na silnú asociáciu medzi SHBG a rizikovými faktormi kardiovaskulárnych ochorení. Výsledky posledných klinických štúdií dokázali, že androgénový deficit je asociovaný s obezitou, inzulínovou rezistenciou, dyslipidémiou a zvýšenou mortalitou u starších mužov. Substitúcia testosterónu zlepšuje vazoreaktivitu a funkciu endotelu a potencionálne môže redukovať kardiovaskulárne ochorenia u mužov. K definitívnemu potvrdeniu tejto teórie zatiaľ chýbajú veľké klinické štúdie.
Kľúčové slová:
testosterón – androgénový deficit – endotelová dysfunkcia – metabolický syndrómÚvod
Úmrtnosť na kardiovaskulárne ochorenia je hlavnou príčinou úmrtnosti vo svete (WHO). Je všeobecne známe, že morbidita a mortalita spôsobená kardiovaskulárnymi ochoreniami je vyššia u mužov – udáva sa 2,5 - až 4-násobne vyššie riziko – a že tento rozdiel zaniká po menopauze [1]. Uznávaným vysvetlením tejto teórie bola úvaha o proaterogénnom potenciáli testosterónu a/alebo o nedostatočnom ochrannom efekte estrogénov u mužov [2,3]. Vplyv testosterónu na kardiovaskulárny systém sa stáva diskutovanou otázkou posledných rokov a názor, že muži trpia kardiovaskulárnymi ochoreniami v skoršom veku ako ženy následkom efektu testosterónu, sú dnes minulosťou. Naopak je zrejmé, že adekvátna hladina endogénneho testosterónu je potrebná na ochranu mužského organizmu pred kardiovaskulárnymi ochoreniami.
Testosterón a jeho vplyv na kardiovaskulárny systém
Testosterón (T) pôsobí na bunky cez jadrové receptory. Účinok spôsobuje buď priamo molekula testosterónu, alebo po jeho premene 5-α-reduktázou jeho potentnejšia forma 5-α-dehydrotestosterón. V niektorých tkanivách – predilekčne v tukovom tkanive, kostiach a mozgu – pôsobí T aj nepriamo – po premene aromatázou na estradiol. T cirkuluje v plazme buď voľný (fT), viazaný na albumín, alebo viazaný na špecifický nosič – sex hormone binding globuline (SHBG). Voľný T a T viazaný na albumín vytvárajú frakciu biologicky dostupného testosterónu. Cirkulujúci T je tvorený testikulárnym T a T nadobličkového pôvodu, ktorý zvyšuje celkovú produkčnú rýchlosť T oproti jeho sekrečnej rýchlosti asi o 5 % [4].
Vplyv testosterónu na kardiovaskulárne ochorenia môžeme patofyziologicky rozdeliť na pôsobenie na cievnu stenu, vaskulárnu reaktivitu, vplyv na jednotlivé elementy v procese aterogenézy a pôsobenie prostredníctvom ovplyvnenia rizikových faktorov kardiovaskulárnych ochorení.
Pôsobenie T na cievnu stenu môže byť priame – účinkom samotného testosterónu, alebo nepriame – po premene na estradiol priamo v bunkách (obr. 1). Účinok T v tkanivách je buď genomický pomocou androgénových receptorov, alebo negenomický. Expresia androgénových receptorov bola dokázaná na bunkách arteriálnej cievnej steny zvierat a ľudí [5,6]. Rovnako bola zistená aj na bunkách hladkých svalov, endotelových bunkách, makrofágoch, megakaryocytoch a krvných doštičkách [7,8,9]. V súčasnosti je diskutovanou otázkou aj negenomické pôsobenie pohlavných hormónov prostredníctvom receptorov na plazmatickej membráne. Jednou z teórií je negenómové pôsobenie prostredníctvom receptorov plazmatickej membrány, ktorých ligandom je SHBG [10]. Bol objavený aj nový typ endocytárneho receptora – megalín, ktorý pravdepodobne tiež sprostredkováva androgénový účinok cez SHBG [11].
Obr. 1. Metabolizmus a pôsobenie pohlavných hormónov na cievne bunky. Upravené podľa [2]. ![Metabolizmus a pôsobenie pohlavných hormónov na cievne bunky. Upravené podľa [2].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/bee907dada1ea9f9bf5c074b87093fb2.png)
Skorým znakom aterosklerózy je znížená odpoveď cievnej steny reagovať vazodilatačne na hormonálne stimuly. Klinickým následkom tohto mechanizmu sú vazospazmy a syndróm anginy pectoris. Údaje o vplyve T na cievnu reaktivitu sú protichodné (tab. 1). Akishita et al demonštrovali, že vazodilatácia stanovovaná na základe prietoku v koronárnych cievach bola 1,7-krát nižšia u mužov, ktorých hladina voľného testosterónu bola v najnižšom kvartile oproti tým v najvyššom kvartile, a to nezávisle na rizikových faktoroch kardiovaskulárnych ochorení [12]. To je v súlade so zistením, že krátkodobé intrakoronárne podanie testosterónu v suprafyziologických dávkach vedie k vazodilatácii artérií sprostredkovanej bunkami hladkých svalov a iónovými kanálmi, teda nie cez androgénové receptorty (negenomický účinok) [13]. Na druhej strane je dokázané pôsobenie testosterónu na endotelovú dysfunkciu a jeho vplyv na endotelom sprostredkovanú teda genomickú vazoreaktivitu [14]. Foresta et al demonštrovali, že androgény stimujujú endotelové progenitorové bunky zodpovedné za reparáciu endotelu a tento efekt bol inhibovaný flutamidom – blokátorom androgénových receptorov [15]. Foresta tiež zistil, že hladina progenitorových endotelových buniek je nižšia u hypogonadálnych mužov než u eugonadálnych kontrol a že sa zvýši po exogénnom podaní T [16]. V literatúre sú dáta o negatívnej korelácii hladín voľného testosterónu k adhezívnej molekule endotelu VCAM1 a k intimomediálnemu zhrubnutiu ciev. T inhibuje formáciu ateroskleromového plaku a je inverzne asociovaný so závažnosťou rádiologicky dokumentovanej progresie aterosklerózy aorty [17,18].
O vplyve T na makrofágy a trombocyty nie je veľa dát, predpokladá sa genomický účinok spôsobujúci transport LDL a cholesterolu v oboch smeroch – z makrofágu aj do makrofágu. Vo vzťahu k trombocytom je údaj o proagregačnom účinku testosterónu cez zvýšenú produkciu tromboxánu [19].
Ďalším aspektom, ktorý je dôležitý z hľadiska vzťahu T ku kardiovaskulárnym ochoreniam, je jeho vplyv na rizikové faktory kardiovaskulárnych ochorení: diabetes mellitus, obezitu a lipidové spektrum, v sumári vplyv na metabolický syndróm.
Testosterón a metabolický syndróm
Massachutestská prospektívna štúdia (MMAS) [20] bola za posledných 20 rokov jednou z najväčších štúdií korelujúcich hladinu testosterónu a SHBG k riziku vzniku metabolického syndrómu. Vo vzorke 950 mužov s priemerným vekom 52,9 roka boli muži sledovaní priemerne 14,4 roka a vstupná hladina testosterónu a SHBG bola korelovaná s rizikom vzniku metabolického syndrómu. Počas sledovania sa vyskytlo 300 nových prípadov metabolického syndrómu. Muži, ktorých hladiny celkového T a SHBG boli v najnižších kvartiloch, mali vyšší výskyt vzniku metabolického syndrómu (RR 2,59 pre 3. kvartil, 2,64 pre 4. kvartil), avšak táto korelácia platila iba u mužov s BMI pod 25 kg/m2. U mužov, ktorí boli obézni už na začiatku štúdie, sa korelácia nepotvrdila. Obdobne androgénový deficit, definovaný v uvedenej štúdii ako: 1. minimálne 3 klinické symptómy a celkový testosterón pod 200 ng/dl alebo 2. minimálne 3 klinické symptómy a celková hladina testosterónu v sére 200–400 ng/dl a hladina voľného testosterónu menej ako 8,91 ng/dl, bol asociovaný so vznikom metabolického syndrómu u neobéznych mužov (RR 2,51 u mužov s BMI pod 25 kg/m2 vs RR 1,22 u mužov s BMI nad 25 kg/m2). Negatívna korelácia medzi voľným testosterónom a metabolickým syndrómom nebola dokázaná. Nedostatkom tejto štúdie bol fakt, že kritériá metabolického syndrómu neboli dostatočne objektivizované – diabetes mellitus bol stanovený len na základe ústneho podania pacienta – hladina glykémie nalačno nebola meraná, rovnako nebola v úvodnom meraní stanovená hladina TAG (metabolický syndróm bol definovaný ako prítomnosť 3 a viac z nasledovného: obvod pása nad 105 cm, TK 130/85 mm Hg a viac, hladina HDL pod 2,22 mmol/l a pacientom dokumentovaný diabetes mellitus). Tieto faktory mohli viesť k podhodnoteniu počtu pacientov s metabolickým syndrómom v úvode štúdie. MMAS bola podkladom aj pre vytvorenie súboru pacientov porovnávajúcich hladiny pohlavných hormónov s mortalitou [21]. V súbore bolo 1 686 mužov a počas 15,3 roka sa objavilo 395 úmrtí. Korelácia medzi celkovou mortalitou a hladinou pohlavných hormónov nebola dokázaná. Ďalšia štúdia čerpajúca zo súboru mužov MMAS porovnávala koreláciu T a SHBG k rozvoju diabetes mellitus 2. typu [22]. Hladina nízkeho fT v nej predikovala k vzniku diabetes mellitus 2. typu.
Kupelian et al v prierezovej štúdii potvrdili štatisticky signifikantný vzťah metabolického syndrómu ako celku a aj jeho jednotlivých zložiek k hladinám TT, fT a SHBG, a to medzi všetkými sledovanými etnickými skupinami. U analyzovaných 1 885 mužov dokázali najsilnejšiu asociáciu nízkych hladín TT, fT a SHBG s abdominálnou obezitou a dyslipidémiou v zmysle zvýšených TAG a nízkeho HDL a miernejšiu asociáciu s DM 2. typu [23].
Vzťah testosterónu k metabolickému syndrómu potvrdili aj ďalšie práce. Muller et al [24] dokázali štatisticky signifikantne pozitívnu koreláciu medzi hladinami celkového testosterónu, kalkulovaného biologicky dostupného testosterónu a SHBG s inzulínovou senzitivitou u 400 mužov vo veku 40–80 rokov. Prítomnosť metabolického syndrómu negatívne korelovala s hladinami T, bioT a SHBG, a to nezávisle na hodnotách hladiny inzulínu a antropometrických parametroch (pomer pás/boky, BMI).
Veľká austrálska prierezová štúdia korelovala hladinu T, fT a SHBG s metabolickým syndrómom a jeho jednotlivými zložkami u 2 052 mužov. SHBG koreloval negatívne so všetkými zložkami metabolického syndrómu, celkový testosterón so všetkými okrem hypertenzie a voľný testosterón bol asociovaný len s obvodom pása a hladinou TAG. Celková korelácia metabolického syndrómu s TT a SHBG bola štatisticky signifikantná (OR 1,78 pre TT, 2,04 pre SHBG) [25].
Laaksonen et al [26] sledovali 702 mužov v priemere 11 rokov – u 147 sa počas sledovania vyvinul metabolický syndróm a u 57 diabetes mellitus. Muži, ktorých hodnoty TT, kalkulovaného fT a SHBG boli v najnižšom kvartile mali 2,3-násobne vyššie riziko rozvoja metabolického syndrómu, avšak po korekcii na hmotnosť došlo k oslabeniu korelácie, a to najmä pre fT, ktorý s rozvojom diabetu po korekcii na BMI nekoreloval vôbec. Iné štúdie potvrdili negatívnu koreláciu metabolického syndrómu a testosterónu a SHBG aj po korekcii na hmotnosť [27–29].
Keating et al [30] demonštrovali, že androgénová deprivácia pri terapii karcinómu prostaty je asociovaná so zvýšenou incidenciou DM 2. typu a kardiovaskulárnymi ochoreniami. Naopak, u mužov s evidovaným DM 2. typu boli dokázané nižšie hladiny testosterónu [31–33]. Otázkou zostáva, či je nedostatok celkového T pri nedostatku SHBG dôsledok hyperinzulinizmu alebo naopak deficit testosterónu spôsobuje inzulínovú rezistenciu. Patofyziologicky pri hypogonadizme je zvýšená premena testosterónu na estradiol, estradiol u mužov pôsobí proadipogénne a obezita vedie k inzulínovej rezistencii. Na druhej strane hyperinzulinémia znižuje hladinu SHBG, čo spôsobí pokles celkového testosterónu v plazme [2].
V našom doposiaľ nepublikovanom súbore 39 pacientov s akútnym koronárnym syndrómom sme dokumentovali koreláciu celkového testosterónu a SHBG s BMI a obvodom pása. Pre SHBG sme zistili aj inverznú koreláciu s hladinou TAG a s počtom zložiek metabolického syndrómu. Koreláciu voľného testosterónu s jednotlivými zložkami metabolického syndrómu sme nezaznamenali. Tieto predbežné výsledky vyžadujú potvrdenie na väčšom súbore pacientov.
Obr. 2. Vzťah medzi androgénovým deficitom a metabolickým syndrómom a endotelovou dysfunkciou. Spracované podľa Traish AM, Saad F, Feeley RJ et al. The Dark side of Testosterone Deficiency: III. Cardiovascular Diseae. J of Andrology 2009; 30: 17– 19. 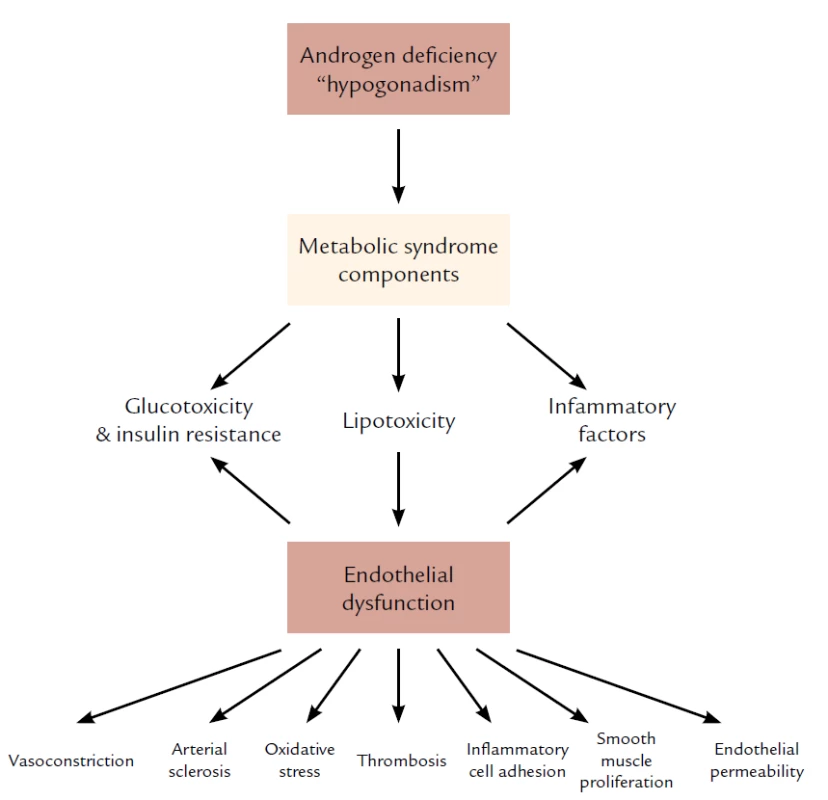
Hladina testosterónu a mortalita u mužov
Prospektívna štúdia Rancho Bernado [34] skúmala príčiny mortality u 794 mužov vo veku 50–91 rokov v rokoch 1984–1987. Sledovaná bola mortalita a príčiny úmrtia počas 11,8 roka. Už pri vstupných meraniach bolo zistené, že muži s nízkou hladinou testosterónu mali vyššie BMI, TK, glykémiu nalačno, TAG a naopak nízke hodnoty HDL. Zo 794 mužov počas sledovania zomrelo 538, pričom muži, ktorých koncentrácie testosterónu spadali do najnižšieho kvartilu, mali o 40 % (pre TT) a 44 % (pre bioT) vyššie riziko úmrtia oproti mužom v najvyššom kvartile. Aj keď údaje korigovali na ďalšie rizikové faktory – DM, kardiovaskulárne ochorenia a metabolický syndróm – výsledky zostali približne rovnaké (tab. 2). Pri skúmaní príčin mortality bolo zaznamenané zvýšené riziko na kardiovaskulárne a respiračné ochorenia, a to aj pri vylúčení mortality v prvých 5 rokov sledovania.
Tromso štúdia [35] bola nórska pro-spektívna štúdia, ktorá sledovala 1 568 náhodne vybratých mužov s prie-merným vekom 59 rokov. Sledované parametre boli hladiny endogénnych pohlavných hormónov vo vzťahu k celkovej mortalite, mortalite na kardiovaskulárne ochorenia, ischemickú chorobu srdca a vzťah hladiny endogénnych pohlavných hormónov k výskytu prvého infarktu myokardu. Štúdia dokázala vyššiu celkovú mortalitu u mužov s hodnotami voľného testosterónu v najnižšom kvartile (RR 1,24, CI 1,01–1,54). Vyššia mortalita na kardiovaskulárne ochorenia ani ischemickú chorobu srdca nebola dokázaná, rovnako výskyt prvého infarktu myokardu nekoreloval s hladinou pohlavných hormónov. Korelácia bola dokázaná len pre hladinu voľného testosterónu, avšak nie pre hladinu celkového testosterónu.
V prospektívnej švédskej štúdii [36] sledujúcej 3 014 mužov dokázali zvýšenú celkovú mortalitu u mužov s nízkymi hladinami voľného aj celkového testosterónu a tiež u mužov s nízkymi hladinami estradiolu.
Iné štúdie nedokázali koreláciu hladiny endogénnych pohlavných hormónov s mortalitou (Caerphilská štúdia [37] a MMAS [21]), avšak v týchto štúdiách bolo významne nižšie percento mortality oproti štúdii Rancho Bernado (19 a 31 % vs 68 %).
Okrem vyššej celkovej mortality sú aj správy o častejšom výskyte cievnej mozgovej príhody a tranzitórnej ischémie mozgu u mužov s nízkymi hladinami celkového testosterónu [38].
SHBG vs voľný testosterón alebo prelom v tzv. „free hormone hypothesis“
V súvislosti s výsledkami niektorých štúdií a názorom, že SHBG a celkový testosterón koreluje s rizikovými faktormi metabolického syndrómu a s mortalitou na kardiovaskulárne ochorenia užšie ako samotný voľný testosterón, ponúka sa otázka vplyvu samotného SHBG na kardiovaskulárne ochorenia. Okrem známeho faktu, že produkcia SHBG je v pečeni znížená pri hyperinzulinizme, a teda negatívna korelácia metabolického syndrómu a SHBG je vysvetliteľná týmto mechanizmom, sa v súčasnosti poukazuje aj na možnosť pôsobenia androgénov v cieľových bunkách práve prostredníctvom SHBG. Hammes et al [11] objavili dôležitosť megalínu – multiproteínového endocytárneho receptora, ktorý je ligandom pre SHBG. V podmienkach in vitro dokázali, že SHBG sa viaže na megalín a že vychytávanie označeného testosterónu v bunkách bolo zablokované megalínovým inhibítorom a nadbytkom SHBG. V štúdiách na myšiach, ktorým zablokovali gén pre megalín došlo k 95% neonatálnej letalite a myši, ktoré prežili, mali buď nezostúpené testes, alebo neotvorenú vagínu, čo sú procesy závisiace na účinku pohlavných hormónov [39]. Iné štúdie zase hovoria o pôsobení SHBG priamo na receptor v cytoplazmatickej membráne, ktorý umožňuje prenos androgénového a estrogénového signálu do bunky pomocou aktivácie cAMP [10,40].
Mortalita a morbidita u pacientov s Klinefelterovým syndrómom
U pacientov s Klinefelterovým syndrómom, a teda deficitom endogénneho testosterónu by sme dľa hypotézy, že deficit testosterónu zvyšuje riziko kardiovaskulárnych ochorení, očakávali, že budú mať vyššiu mortalitu na ischemickú chorobu srdca. Jedna z najväčších prierezových štúdií v Británii sledovala 3 518 pacientov s Klinefeterovým syndrómom [41]. Zaznamenaných bolo 461 úmrtí, pričom najvyššia mortalita bola zaznamená na vaskulárne ochorenia čreva, neurologické a kardiovaskulárne ochorenia. Úmrtie na ICHS však bolo štatisticky signifikantne nižšie oproti ostatnej populácii (RR 0,7). Zvýšená mortalita na kardiovaskulárne ochorenia ako celok bola následkom zvýšeného výskytu mortality na tromboembolické príhody a periférne vaskulárne ochorenia. Výrazným nedostatkom štúdie je však fakt, že autori nemali informácie o liečbe preparátmi exogénneho testosterónu a nebola meraná hladina testosterónu v sére. Nie je teda možné objektivizovať, nakoľko príčiny úmrtí boli asociované s hladinou testosterónu. Naopak v dánskych štúdiách s menším počtom pacientov bola dokázaná zvýšená morbidita na ICHS u pacientov s KS (RR 1,71) [42], avšak v príčine úmrtí dominovali ochorenia infekčné a neurologické oproti kardiovaskulárnym [43].
Substitučná liečba testosterónom
V súvislosti so zistením, že deficit testosterónu je pravdepodobne asociovaný s vyšším rizikovým profilom kardiovaskulárnych ochorení a snáď i mortalitou [34] bola skúmaná substitučná liečba testosterónom jednak na patofyziologickej úrovni vo vzťahu k endotelovej dysfunkcii ako aj na úrovni vzťahu substitučnej liečby T k ovplyvneniu rizikových faktorov kardiovaskulárnych ochorení.
Z hľadiska endotelovej dysfunkcie bol dokázaný pozitívny efekt administrácie T na vazodilatáciu sprostredkovanú NTG po 12 týždňov podávania T [44]. V predklinických štúdiách na potkanoch bol dokázaný výraznejšie poškodený endotel u kastrovaných potkanov a tento vzťah sa čiastočne zlepšil po androgénovej substitúcii [45].
V klinických štúdiách liečba T viedla k predĺženiu času vedúceho k ischémii myokardu. English et al podával transdermálne T v dávke 5 mg denne 46 mužom. U mužov dostávajúcim testosterón došlo po 12 týždňoch k predĺženiu času ischémie dokumentovanej zaznamenaním 1 mm depresie ST segmentu počas záťaže z 309 s na 364 s. Táto zmena bola štatisticky signifikantná v porovnaní s placebom. Rozdiel v subjektívnom vnímaní stenokardií pacientom nebol dokázaný [46].
Dokázaný bol aj efekt podávania T liečby na funkciu myokardu. Pugh et al dokázali, že substitúcia T viedla k zvýšeniu vývrhového objemu srdca a zníženiu vaskulárnej periférnej rezistenicie u mužov s chronickým srdcovým zlyhávaním [47]. V ďalšej štúdii 8-týždňová administrácia T zlepšila perfúziu myokardu v neobliterovaných artériách a zvýšila ejekčnú frakciu srdca, nemala však vplyv na celkovú perfúziu myokardu, endotelovú funkciu a pacientom dokumentovaný klinický korelát – syndróm anginy pectoris [48].
V neposlednom rade sú tu údaje, ktoré poukazujú na zlepšenie jednotlivých rizikových faktorov kardiovaskulárnych ochorení pri liečbe T.
V Sheffieldskej štúdii [49] dokázali, že testosterónová terapia zlepšuje inzulínovú rezistenciu, viscerálnu adipozitu a hypercholesterolémiu u hypogonádnych mužov s DM 2. typu. 24 mužom podávali testosterón v dávke 200 mg 2-krát týždne v priebehu 3 mesiacov, po mesačnej pauze bolo rovnakým spôsobom nasadené placebo. Bol dokázaný štatisticky signifikantný pozitívny vplyv testosterónu na zníženie inzulínovej rezistencie a glykémie nalačno, rovnako aj pokles hladiny celkového cholesterolu a pokles pomeru pás/boky. Vplyv na jednotlivé lipidové frakcie a artériovú hypertenziu nebol preukázaný.
Bhasin popisuje zníženie viscerálnej adipozity, glykémie nalačno a spomaľovanie procesu aterogenézy u mužov, ktorí užívali testosterónovú terapiu, popisuje tiež zvýšenie inzulínovej senzitivity a zlepšenie prietoku koronárnymi cievami [50].
Sumárne je v literatúre popisovaný priaznivý efekt podávania T na všetky zložky metabolického syndrómu: obezitu [51,52], hypertenziu [53], dyslipidémiu [54] a inzulínovú rezistenciu.
Záver
Vzťah medzi hladinou androgénov a rizikom kardiovaskulárnych ochorení je diskutovanou otázkou posledných rokov. Hladina TT a voľného T v rôznej miere koreluje negatívne s jednotlivými zložkami metabolického syndrómu. Otázkou zostáva, či je androgénový deficit následkom alebo príčinou metabolického syndrómu. Inzulínová rezistencia vedie k poklesu SHBG, a teda aj k zníženiu celkovej frakcie plazmatického testosterónu. Na druhej strane sú dôkazy o asociácii metabolického syndrómu a hladiny T nezávisle na hladine inzulínu [24] a zároveň je dokumentované zlepšenie inzulínovej senzitivity po podávaní exogénneho T [49]. Veľké epidemiologické štúdie zistili, že pri deficite T bola zaznamenaná vyššia celková úmrtnosť, kardiovaskulárne ochorenia však neboli hlavnou príčinou úmrtnosti. Výsledky štúdií s podávaním androgénovej substitučnej liečby sa zdajú sľubné, avšak boli zatiaľ zväčša realizované s malým počtom pacientov. K poukázaniu na prínos androgénovej terapie v prevencii kardiovaskulárnych ochorení je potrebná realizácia veľkých dlhodobých randomizovaných placebom kontrolovaných štúdií.
Použité skratky
T – testosterón
TT – celkový (total) testosterón
bioT – biologicky dostupný testosterón
fT – voľný (free) T
BMI – body mass index
RR – risk ratio
OR – odds ratio
HDL – high density lipoproteins
TAG – triacylglyceroly
VCAM1 – vascular cell adhesion molecule-1
prof. MUDr. Juraj Payer, CSc.
www.fnspba.sk
e‑mail: payer@ruzinov.fnspba.sk
Doručeno do redakce: 30. 5. 2010
Zdroje
1. Lerner DJ, Kannel WB. Patterns of coronary heart disease morbidity and mortality in the sexes: a 26‑year follow‑up of the Framingham population. Am Heart J 1986; 111 : 383–390.
2. von Eckardstein A, Wu FC. Androgens and coronary artery disease. Endocr Rev 2003; 24 : 183–217.
3. Blahoš J, Bleha O. Endokrinologie. 2. vyd. Praha: Avicenum 1988.
4. Kreze A, Langer P, Klimeš I et al. Všeobecná a klinická endokrinológia. Bratislava: Academic Electronic Press 2004 : 423–429.
5. Horwitz KB, Horwitz LD. Canine vascular tissues are targets for androgens, estrogens, progestins and glucocorticoids. J Clin Invest 1982; 69 : 750–758.
6. Hanke H, Lenz C, Hess B et al. Effect of testosterone on plaque development and androgen receptor expression in the arterial vessel wall. Circulation 2001; 103 : 1382–1385.
7. Fujimoto R, Morimoto I, Morita E et al. Androgen receptors, 5 alfa‑reductase activity and androgen dependent proliferation of vascular smooth muscle cells. J Steroid Biochem Mol Biol 1994; 50 : 169–174.
8. Cutolo M, Villaggio B, Barone A et al. Primary cultures of human synovial macrophages metabolize androgens. Ann N Y Acad Sci 1996; 784 : 534–541.
9. Khetawat G, Faraday N, Nealen ML et al. Human megakaryocytes and platelets contain the estrogen receptor beta and androgen receptor (AR): testosterone regulates AR expression. Blood 2000; 95 : 2289–2296.
10. Kahn SM, Hryb DJ, Nakhla AM et al. Sex hormone binding globulin is synthesized in target cells. J Endocrinol 2001; 175 : 113–120.
11. Hammes A, Andreassen TK, Spoelgen R et al. Role of endocytosis in cellular uptake of sex steroids. Cell 2005; 122 : 751–762.
12. Akishita M, Hashimoto M, Ohike Y et al. Low testosterone level is an independent determinant of endothelial dysfunction in men. Hypertens Res 2007; 30 : 1029–1034.
13. Yue P, Chatterjee K, Beale C et al. Testosterone relaxes rabbit coronary arteries and aorta. Circulation 1995; 91 : 1154–1160.
14. Zitzmann M, Brune M, Kornmann B et al. The CAG repeat polymorphism in the AR gene affects high density lipoprotein cholesterol and arterial vasoreactivity. J Clin Endocrinol Metab 2001; 86 : 4867–4873.
15. Foresta C, Zuccarello D, De Toni L at al. Androgens stimulate endothelial progenitor cells through an androgen-mediated pathway. Clin Endocrinol (Oxf) 2008; 68 : 284–289.
16. Foresta C, Caretta N, Lana A et al. Reduced number of circulating endothelial progenitor cells in hypogonadal men. J Clin Endocrinol Metab 2006; 91 : 4599–4602.
17. Fu L, Gao QP, Shen JX. Relationship between testosterone and indexes indicating endothelial function in male coronary heart disease patients. Asian J Androl 2008; 10 : 214–218.
18. Malkin CJ, Pugh PJ, Jones TH et al. Testosterone for secondary prevention in men with ischaemic heart disease? QJM 2003; 96 : 521–529.
19. Ajayi AA, Mathur R, Halushka PV. Testosterone increases human platelet tromboxane A2 receptor density and aggregation responses. Circulation 1995; 91 : 2742–2747.
20. Kupelian V, Page ST, Araujo AB et al. Low sex hormone‑binding globulin, total testosterone, and symptomatic androgen deficiency are associated with development of the metabolic syndrome in nonobese men. J Clin Endocrinol Metab 2006; 91 : 843–850.
21. Araujo AB, Kupelian V, Page ST et al. Sex steroids and all cause and specific mortality in men. Arch Intern Med 2007; 167 : 1252–1260.
22. Stellato RK, Feldman HA, Hamdy O et al. Testosterone, SHBG and the development of type 2 diabetes in middle-aged men: prospective results from the Massachusetts male aging study. Diabetes Care 2000; 23 : 490–494.
23. Kupelian V, Hayes FJ, Link CL et al. Inverse association of testosterone and the metabolic syndrome in men is consistent across race and ethnic group. J Clin Endocrinol Metab 2008; 93 : 3403–3410.
24. Muller M, Grobbee DE, den Tonkelaar I et al. Endogenous sex hormones and metabolic syndrome in aging men. J Clin Endocrinol Metab 2005; 90 : 2618–2623.
25. Chubb SA, Hyde Z, Almeida OP et al. Lower sex hormone binding globulin is more strongly associated with metabolic syndrome than lower total testosterone in older men: the health in men study. Eur J Endocrinol 2008; 158 : 785–792.
26. Laaksonen DE, Nikanen L, Punnonen K et al. Testosterone and SHBG predict the metabolic syndrome and diabetes in middle aged men. Diabetes Care 2004; 27 : 1036–1041.
27. Haffner SM, Valdez RA, Mykkänen L et al. Decreased testosterone and dehydroepiandrosterone sulfate concentrations are associated with increased insulin and glucose concentrations in nondiabetic men. Metabolism 1994; 43 : 599–603.
28. Laaksonen DE, Niskanen L, Punnonen K et al. Sex hormones, inflammation and the metabolic syndrome: a population‑based study. Eur J Endocrinol 2003; 149 : 601–608.
29. Haffner SM, Mykkänen L, Valdez RA et al. Relationship of sex hormones to lipids and lipoproteins in nondiabetic men. J Clin Endocrinol Metab 1993; 77 : 1610–1615.
30. Keating NL, O‘Malley AJ, Freedland SJ. Diabetes and cardiovascular disease during androgen deprivation: observational study of veterans with prostate cancer. J Natl Cancer Inst 2010; 102 : 39–46.
31. Barrett-Connor E. Lower endogenous androgen levels and dyslipidemia in men with non‑insulin‑dependent diabetes mellitus. Ann Intern Med 1992; 117 : 807–811.
32. Andersson B, Mårin P, Lissner L et al. Testosterone concentration in women and men with NIDDM. Diabetes Care 1994; 17 : 405–411.
33. Fukui M, Soh J, Tanaka M et al. Low serum testosterone concentration in middle-aged men with type 2 diabetes. Endocr J 2007; 54 : 871–877.
34. Laughlin GA, Barrett-Connor E, Bergstrom J. Low serum testosterone and mortality in older men. J Clin Endocrinol Metab 2008; 93 : 68–75.
35. Vikan T, Schirmer H, Njølstad I et al. Endogenous sex hormones and the prospective association with cardiovascular disease and mortality in men: the Tromsø study. Eur J Endocrinol 2009; 161 : 435–442.
36. Tivesten A, Vandenput L, Labrie F et al. Low serum testosterone and estradiol predict mortality in elderly men. J Clin Endocrinol Metab 2009; 94 : 2482–2488.
37. Smith GD, Ben-Shlomo Y, Beswick A et al. Cortisol, testosterone, and coronary heart disease: prospective evidence from the Cearphilly study. Circulation 2005; 112 : 332–340.
38. Yeap BB, Hyde Z, Almeida OP et al. Lower testosterone levels predict incident stroke and transient ischemic attack in older men. J Clin Endocrinol Metab 2009; 94 : 2353–2359.
39. Willnow TE, Hilpert J, Armstrong SA et al. Defective forebrain development in mice lacking gp330/megalin. Proc Natl Acad Sci USA 1996; 93 : 8460–8464.
40. Rosner W, Hryb DJ, Kahn SM et al. Interactions of sex hormone‑binding globulin with target cells. Mol Cell Endocrinol 2010; 316 : 79–85.
41. Swerdlow AJ, Higgins CD, Schoemaker MJ et al. Mortality in patients with Klinefelter syndrome in Britain: a cohort study. J Clin Endocrinol Metab 2005; 90 : 6516–6522.
42. Bojesen A, Juul S, Birkebaek NH et al. Morbidity in Klinefelter syndrome, a Danish register study based on hospital discharge diagnoses. J Clin Endocrinol Metab 2006; 91 : 1254–1260.
43. Bojesen A, Juul S, Birkebaek N et al. Increased mortality in Klinefelter syndrome. J Clin Endocrinol Metab 2004; 89 : 3830–3834.
44. Kang SM, Jang Y, Kim JY et al. Effect of oral administration of testosterone on brachial arterial vasoreactivity in men with coronary artery disease. Am J Cardiol 2002; 89 : 862–864.
45. Lu YL, Kuang L, Zhu H et al. Changes in aortic endothelium ultrastructure in male rats following castration, replacement with testosterone and administration of 5‑alpha-reductase inhibitor. Asian J Androl 2007; 9 : 843–847.
46. English KM, Steeds RP, Jones TH et al. Low‑dose transdermal testosterone therapy improves angina threshold in men with chronic stable angina: a randomized, double‑blind, placebo-controlled study. Circulation 2000; 102 : 1906–1911.
47. Pugh PJ, Jones TH, Channer KS. Acute haemodynamic effects of testosterone in men with chronic heart failure. Eur Heart J 2003; 24 : 909–915.
48. Webb CM, Elkington AG, Kraidly MM et al. Effects of oral testosterone treatment on myocardial perfusion and vascular function in men with low plasma testosterone and coronary heart disease. Am J Cardiol 2008; 101 : 618–624.
49. Kapoor D, Goodwin E, Channer KS et al. Testosterone replacement therapy improves insulin resistance, glycaemic control, visceral adiposity and hypercholesterolemia in hypogonadal men with type 2 diabetes. Eur J Endocrinol 2006; 154 : 899–906.
50. Bhasin S. Effects of testosterone administration on fat distribution, insulin sensitivity and atherosclerosis progression. Clin Infect Dis 2003; 37 (Suppl 2): S142–S149.
51. Allan CA, Strauss BJ, Burger HG et al. Testosterone therapy prevents gain in adipose tissue and loss of skeletal muscle in nonobese aging men. J Clin Endocrinol Metab 2008; 93 : 139–146.
52. Haffner SM, Karhapää P, Mykkänen L et al. Insulin resistance, body fat distribution and sex hormones in men. Diabetes 1994; 43 : 212–219.
53. Dubey RK, Oparil S, Imthurn B et al. Sex hormones and hypertension. Cardiovasc Res 2002; 53 : 688–708.
54. Haffner SM, Mykkänen L, Valdez RA et al. Relationship of sex hormones to lipids and lipoproteins in nondiabetic men. J Clin Endocrinol Metab 1993; 77 : 1610–1615.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2010 Číslo 7- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- K významnému životnímu jubileu prof. MUDr. Jaroslava Blahoše, DrSc.,
- Prof. MUDr. Jaroslav Blahoš, DrSc., jubilující
- Váženému pánovi prof. MUDr. Jaroslavovi Blahošovi, DrSc.
- Váženému pánovi profesorovi MUDr. Jaroslavovi Blahošovi, DrSc.
- Veda a medicína
- Hyperlipoproteinemie a dyslipoproteinemie II. Terapie: Nefarmakologická a farmakologická léčba
- Chronická pankreatitida a skelet
- Nezbytnost soustavného rozvoje rozsáhlého systému péče o zdraví
- Elektrokardiografické markery u pacientov s hypertrofickou kardiomyopatiou
- Mezinárodní kurz NATO pro nácvik a výuku řešení situací s hromadným výskytem raněných
- Přežití a kvalita života u popálenin
- 12 rokov kontinuálneho medicínskeho vzdelávania na Slovensku
- Hypofyzární adenomy – kam směřuje léčba na počátku 21. století?
- Kyselina oxalová – významný uremický toxín
- Vplyv testosterónu na kardiovaskulárne ochorenia u mužov
- Současné možnosti a principy patomorfologické diagnostiky nádorů
- Nátriuretické peptidy pri aortovej stenóze
- Kardiovaskulárne ochorenia u reumatoidnej artritídy
- Zásady péče o pacienty s intermitentními klaudikacemi
- Trnitá cesta metabolického syndromu prosadit se v praxi
- Diabetická osteopatie: onemocnění kdysi sporné a pravděpodobně významné
- Dočkáme se protinádorových vakcín?
- Současné možnosti léčby osteoporózy
- Technika zaťažovania skeletu so spätnou väzbou v rehabilitácií osteoporotického pacienta (Biomechanická analýza)
- Index pevnosti femuru versus hustota kostného minerálu: nové poznatky (Slovenská epidemiologická štúdia)
- Laboratorní diagnostika a endokrinologie
- Infekcia parvovírusom B19 – príčina závažnej anémie po transplantácii obličky
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Laboratorní diagnostika a endokrinologie
- Vplyv testosterónu na kardiovaskulárne ochorenia u mužov
- Infekcia parvovírusom B19 – príčina závažnej anémie po transplantácii obličky
- Chronická pankreatitida a skelet
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy





