-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Úloha centrálneho nervového systému v etiopatogenéze chorôb periférnych orgánov
The role of central nervous system in etiopathogenesis of peripheral organ diseases
Current research on the etiopathogenesis of diseases of peripheral organs is primarily focused on the study of processes affecting those organs directly altered by diseases. As a result, therapeutic interventions are focused on the cells of those organs affected by pathological processes. However, pathological processes are not restricted to any “circumscribed” group of cells. Cells of tissue affected by pathological process interact with cells in the surrounding tissues. Moreover, pathologic processes also induce changes in the activity of the neuroendocrine and immune systems, which also affect the progression of pathological processes. The neurobiological view of diseases is based on the assumption that the nervous system processes signals related to pathological processes in peripheral organs and then consequently modulates it via the autonomic, neuroendocrine, and neuroimmune regulations. The aim of this paper is to explain the basis of the neurobiological view of diseases of the peripheral organs, and then discuss possible therapeutic consequences.
Key words:
immune system – neuroendocrine system – neurobiology of diseases – inflammation
Autori: B. Mravec 1,2
Pôsobisko autorov: Ústav patologickej fyziológie Lekárskej fakulty UK Bratislava, Slovenská republika, prednosta doc. MUDr. Marián Bernadič, CSc., mim. prof. 1; Ústav experimentálnej endokrinológie SAV Bratislava, Slovenská republika, riaditeľ prof. MUDr. Iwar Klimeš, DrSc. 2
Vyšlo v časopise: Vnitř Lék 2011; 57(10): 839-846
Kategória: Přehledné referáty
Súhrn
Výskum etiopatogenézy chorôb periférnych orgánov sa zameriava prednostne na štúdium dejov, ktoré prebiehajú priamo v orgáne postihnutom patologickým procesom. Podobne je to aj s terapeutickými zásahmi, ktorých zámerom je ovplyvniť činnosť buniek nachádzajúcich sa v orgáne, v ktorom prebieha patologický proces. Patologický proces sa ale netýka iba tejto „ohraničenej“ skupiny buniek periférnych orgánov. Bunky patologicky zmeneného tkaniva v danom orgáne interagujú s bunkami okolitých tkanív. Okrem toho patologický proces vyvoláva zmeny v činnosti imunitného a neuroendokrinného systému a zároveň je týmito regulačnými systémami priebeh patologického procesu ovplyvňovaný. Túto skutočnosť zohľadňuje tzv. neurobiologický pohľad na choroby periférnych orgánov, ktorý vychádza z predpokladu, že nervový systém prijíma a spracúva signály súvisiace s patologickým procesom prebiehajúcim v periférnych orgánoch a následne je tento patologický proces ovplyvňovaný prostredníctvom autonómnych, neuroendokrinných a neuroimunitných regulácií. Zámerom článku je priblížiť súčasné východiská neurobiologického konceptu etiopatogenézy chorôb periférnych orgánov a možné terapeutické využitie.
Kľúčové slová:
imunitný systém – neuroendokrinný systém – neurobiológia chorôb – zápalÚvod
Výskum etiopatogenézy kardiovaskulárnych, respiračných, gastrointestinálnych a ďalších chorôb sa prednostne zameriava na štúdium procesov, ktoré prebiehajú priamo v orgánoch postihnutých patologickým procesom. Podobne je tomu aj s terapeutickými zásahmi, ktoré sa tiež prednostne sústreďujú na moduláciu činnosti buniek orgánov, v ktorých prebieha patologický proces. Patologický proces však nepredstavuje autonómny fenomén, nakoľko sa netýka iba „ohraničenej“ skupiny buniek periférnych orgánov. Bunky patologicky zmeneného tkaniva v danom orgáne interagujú s okolitými bunkami. Aj v dôsledku týchto interakcií dochádza k zmenám v činnosti základných regulačných systémov organizmu, a to neuroendokrinného a imunitného, ktoré následne ovplyvňujú priebeh patologického procesu (obr. 1). Pre poznanie etiopatogenézy chorôb je preto potrebné brať do úvahy aj komplexnosť vzťahov medzi alterovaným tkanivom a regulačnými systémami organizmu, čo zohľadňuje tzv. neurobiologický koncept etiopatogenézy chorôb periférnych orgánov [1–3].
Obr. 1. Schematické znázornenie konceptu psychosomatickej medicíny a neurobiológie chorôb periférnych orgánov. V koncepte psychosomatickej medicíny zohráva kľúčovú úlohu pôsobenie psychosociálnych faktorov (napr. stresory), ktoré prostredníctvom nervových, neuroendokrinných a neuroimunitných mechanizmov negatívne ovplyvňujú priebeh patologických procesov prebiehajúcich v periférnych orgánoch. V koncepte neurobiológie chorôb zohráva kľúčovú úlohu prenos signálov súvisiacich s patologickým procesom do centrálneho nervového systému. Pokiaľ pôsobiace noxy (napr. patogény, ischémia, mechanické, termálne alebo radiačné faktory) prekročia adaptačné schopnosti orgánu, dôjde k vzniku patologického procesu, ktorý podmieňuje vznik choroby. Signály, súvisiace s patologickým procesom (napr. nekróza buniek sprevádzaná uvoľnením intracelulárnych látok, ischémia sprevádzaná aktiváciou imunitných buniek a zmenou lokálneho pH), sú prenášané nervovými a humorálnymi dráhami do centrálneho nervového systému. Po spracovaní týchto signálov dochádza k aktivácii kompenzačných a adaptačných mechanizmov, pričom centrálny nervový systém prostredníctvom neuroendokrinných (1) a neuroimunitných (2) interakcií, ako aj priamo prostredníctvom autonómnej inervácie (3), ovplyvňuje priebeh danej choroby. 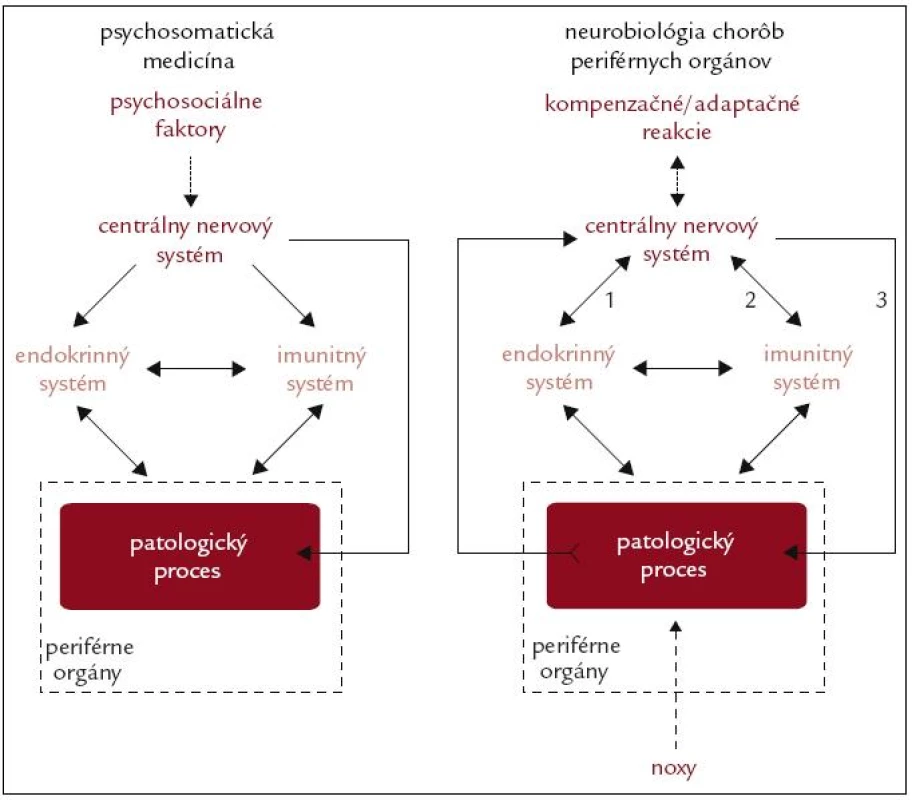
Nasledujúci text približuje súčasné východiská neurobiologického výskumu etiopatogenézy chorôb periférnych orgánov a poukazuje na možnosti klinického využitia získaných poznatkov.
Neurobiológia chorôb periférnych orgánov: vymedzenie pojmu
Termín „neurobiológia chorôb“ sa používa najčastejšie v súvislosti s výskumom etiopatogenetických mechanizmov neurologických a psychiatrických chorôb. Naproti tomu termín „neurobiológia chorôb periférnych orgánov“, ktorý je použitý v tomto článku, označuje oblasť výskumu úlohy nervového systému v etiopatogenéze tých chorôb, pre ktoré je charakteristické, že patologický proces postihuje primárne orgány mimo nervového systému. Označenie „periférny“ v uvedenom kontexte teda znamená „mimo nervového systému“.
Neurobiológia chorôb periférnych tkanív predstavuje nový, komplexný smer štúdia etiopatogenézy chorôb. Aj keď zdieľa niektoré charakteristiky s psychosomatickou medicínou, existujú viaceré zásadné rozdiely. Psychosomatická medicína sa zameriava na štúdium vplyvu sociálnych, psychologických a behaviorálnych faktorov na procesy prebiehajúce v organizme, pričom jej náplňou je prednostne výskum vplyvu prenosu signálov z centrálneho nervového systému na progresiu somatických chorôb [4]. Na rozdiel od toho, neurobiológia chorôb periférnych orgánov sa zameriava na prenos signálov z orgánov, ktorých činnosť je narušená patologickým procesom, na centrálne spracovanie týchto signálov a tvorbu kompenzačných a adaptačných reakcií, ktorých cieľom je modulovať priebeh choroby (obr. 1). Ďalším rozdielom je fakt, že zatiaľ čo sa psychosomatická medicína zaoberá faktormi, ktoré sú spracované prevažne na vedomej úrovni (napr. pôsobenie stresorov), neurobiológia chorôb periférnych orgánov skúma procesy, ktoré prebiehajú prevažne na nevedomej úrovni (napr. spracovanie signálov súvisiacich so zápalom vo vnútorných orgánoch).
Neurobiológia chorôb periférnych orgánov: základné fakty
Podstatou neurobiologického výskumu etiopatogenézy chorôb je predpoklad, že nervový systém na základe signálov súvisiacich s patologickým procesom, prebiehajúcim v periférnych orgánoch, zahajuje kompenzačné, respektíve adaptačné reakcie, ktoré ovplyvňujú priebeh patologického procesu. Tento predpoklad vychádza z nasledujúcich faktov:
- centrálny nervový systém prijíma prostredníctvom nervových a humorálnych dráh signály zo všetkých tkanív organizmu;
- okrem zmien prebiehajúcich priamo v tkanive poškodenom patologickým procesom dochádza teda aj k zmenám v aktivite tých štruktúr centrálneho nervového systému, ktoré spracúvajú periférne signály;
- centrálny nervový systém po spracovaní periférnych signálov zahajuje prostredníctvom autonómnych nervov, neuroendokrinných alebo neuroimunitných regulácií kompenzačné, respektíve adaptačné reakcie, ktoré ovplyvňujú priebeh patologického procesu;
- nervy ovplyvňujú fenotypové charakteristiky inervovaných buniek;
- neadekvátne regulačné pôsobenie nervového systému (napr. v dôsledku chronického pôsobenia stresorov) alebo jeho narušenie (napr. starnutím, iktom) môže významne ovplyvňovať vznik a progresiu patologického procesu v periférnych orgánoch;
- elektrická stimulácia alebo chirurgické vyradenie štruktúr centrálneho alebo periférneho nervového systému sa využíva v liečbe niektorých chorôb periférnych orgánov;
- viaceré klinicky používané lieky pôsobia prospešne nielen priamym pôsobením na bunky periférnych tkanív, ale aj prostredníctvom ovplyvnenia aktivity mozgových štruktúr.
Prenos signálov súvisiacich s činnosťou buniek periférnych orgánov do mozgu
Centrálny nervový systém neustále prijíma signály súvisiace s činnosťou buniek periférnych orgánov a na základe týchto signálov spätne reguluje aktivitu týchto buniek. Signály súvisiace s aktivitou buniek periférnych orgánov sú do centrálneho nervového systému prenášané viscerosenzitívnymi a somatosenzitívnymi nervami, ako aj humorálnymi dráhami. Na význam monitorovania zmien v tkanivách organizmu nervovým systémom poukazuje aj fakt, že v priemere na každých 15 μm3 tkanív pripadá jedno senzitívne nervové zakončenie [5] (v zmyslových orgánoch je hustota nervových zakončení rádovo vyššia). Nervové dráhy umožňujú relatívne rýchly prenos signálov a zároveň „obsahujú“ informáciu aj o lokalite zdroja signálu. Naproti tomu je humorálny prenos signálov pomalší a neinformuje presne o lokalizácii buniek, ktoré signál generovali.
Nervové dráhy
Viscerálne a somatické senzitívne nervové dráhy prenášajú signály o zmenách vo vnútornom prostredí organizmu a aktivite buniek vnútorných orgánov a povrchových tkanív. Umožňuje to široké spektrum receptorov, lokalizovaných na senzitívnych zakončeniach aferentných neurónov. Tieto receptory monitorujú mechanické napätie stien ciev (baroreceptory, volumoreceptory) a vnútorných orgánov (mechanoreceptory), teplotu tkanív (termoreceptory), osmolalitu plazmy (osmoreceptory), glykémiu (glukoreceptory), parciálny tlak kyslíka v krvi a pH (chemoreceptory), zloženie obsahu lúmenu tráviaceho traktu (chemoreceptory) a koncentráciu cytokínov (imunoreceptory). Ďalšiu skupinu receptorov tvoria nociceptory, ktoré sú aktivované podnetmi, ktoré vedú alebo môžu viesť k poškodeniu tkanív. Prominentné postavenie v monitorovaní vnútorného prostredia má n. vagus, v ktorom prebieha viac ako polovica všetkých viscerálnych aferentných dráh. Okrem toho je vnútorné prostredie monitorované vláknami miechových viscerálnych aferentných neurónov a viscerosenzitívnymi hlavovými nervami [6].
Receptory v hlbokých somatických tkanivách monitorujú napätie priečne pruhovaného svalstva (proprioreceptory). Somatické senzitívne nervové dráhy informujú centrálny nervový systém o činnosti buniek v povrchových tkanivách organizmu a prenášajú signály o pôsobení mechanických podnetov, teplote tkanív a pôsobení poškodzujúcich podnetov.
Humorálny prenos signálov
Humorálny prenos signálov je podmienený uvoľňovaním solubilných chemických látok bunkami periférnych tkanív. Zdrojom týchto chemických látok môžu byť fyziologicky aktívne bunky periférnych tkanív, bunky endokrinného a imunitného systému alebo patologickým procesom zmenené bunky (napr. nádorové). Secernované chemické látky sú prostredníctvom cirkulácie transportované do cievneho riečiska mozgu. Následný prenos signálu môže prebiehať prostredníctvom ich väzby na receptory vyčnievajúce do lúmenu ciev mozgu, aktívnym transportom, alebo tieto látky prechádzajú fenestrovanými kapilárami cirkumventrikulárnych orgánov. Príkladom je pôsobenie cirkulujúcich cytokínov, ktoré vyvolávajú široké spektrum zmien v činnosti mozgu [7].
Prenos signálov z orgánov, v ktorých prebieha patologický proces
Patologický proces (napr. infekcia, ischémia, termálne, mechanické alebo radiačné poškodenie) je sprevádzaný tvorbou signálnych molekúl (alarmínov) poškodenými bunkami a bunkami imunitného systému [8]. Zánik buniek je sprevádzaný uvoľňovaním ich obsahu, pričom niektoré z uvoľnených chemických látok (napr. ATP) pôsobia aj ako signálne molekuly aktivujúce senzitívne nervové zakončenia a imunitné bunky. Aktivácia imunitných buniek vedie k tvorbe sekundárnych signálnych molekúl, cytokínov. Tieto imunitné signály aktivujú senzitívne nervové zakončenia obsahujúce receptory pre dané cytokíny, prípadne bunky paraganglií, ktoré plnia úlohu prevodníka signálov medzi imunitnými bunkami a viscerosenzitívnymi neurónmi. Výsledkom je aktivácia štruktúr centrálneho nervového systému a zahájenie kompenzačných autonómnych, neuroendokrinných a neuroimunitných reakcií.
Zmeny v aktivite mozgových štruktúr pozorované pri chorobách periférnych orgánov
V modeloch viacerých chorôb boli u laboratórnych zvierat detekované zmeny v aktivite štruktúr mozgu. Zmeny v činnosti mozgových štruktúr v dôsledku chorôb periférnych orgánov boli preukázané aj u ľudí. Pri interpretácii týchto nálezov je potrebné brať do úvahy fakt, že pozorované zmeny môžu odrážať aktiváciu štruktúr mozgu v dôsledku aferentnej signalizácie z tkaniva postihnutého patologickým procesom, môžu vznikať v dôsledku aktivácie neuronálnych kompenzačných mechanizmov, môžu byť ale aj príčinou, alebo sa aspoň čiastočne podieľať na vzniku danej choroby.
V súčasnosti sú k dispozícii údaje o zmene v aktivite mozgových štruktúr iba pri ohraničenom počte chorôb. Pre širšiu aplikáciu neurobiologického konceptu etiopatogenézy chorôb bude potrebné zistiť, k akým zmenám v mozgovej aktivite dochádza u iných chorôb periférnych orgánov.
Ischémia myokardu
U potkanov s experimentálne indukovaným infarktom myokardu bola v porovnaní so sham operovanými zvieratami pozorovaná zvýšená proliferácia buniek v subgranulárnej zóne gyrus dentatus. Tento nález naznačuje, že infarkt myokardu môže vyvolať zmeny v proliferácii neurónov určitých štruktúr mozgu, pravdepodobne v dôsledku neuronálneho poškodenia niektorých oblastí mozgu [9].
Zlyhanie srdca
Pri zlyhaní srdca dochádza k viacerým zmenám v aktivite mozgových oblastí a okruhov, prevažne tých, ktoré sa podieľajú na regulácii činnosti srdca a modulácii neuroendokrinných reakcií. Dochádza k aktivácii neurónov nucleus paraventricularis hypothalami, obzvlášť tých jeho podoblastí, ktoré syntetizujú a uvoľňujú antidiuretický hormón a kortikoliberín, ako aj tých neurónov, ktoré inervujú rostrálnu ventrolaterálnu predĺženú miechu a intermediolaterálny stĺpec torakolumbálnej miechy, čím sa podieľajú na regulácii aktivity sympatikového nervového systému. Na aktivácii nucleus paraventricularis hypothalami pri srdcovom zlyhaní, zapríčinenom infarktom myokardu, sa podieľajú cytokíny uvoľňované počas ischémie myokardu [10,11].
Nádorové choroby
U zvierat s experimentálne indukovaným nádorom boli preukázané zmeny v aktivite viacerých neuronálnych štruktúr. Dochádza napr. k alterácii v činnosti neuronálnych okruhov, podieľajúcich sa na regulácii príjmu potravy [12,13]. Zmeny, ktoré sme pozorovali v našich experimentoch u zvierat s fibrosarkómom lokalizovaným v brušnej dutine, sa týkali prevažne aktivity kmeňových štruktúr (napr. nucleus tractus solitarii, nucleus parabrachialis) a hypotalamu (nucleus paraventricularis) [14]. Je známe, že tieto štruktúry sú aktivované aj rôznymi imunitnými podnetmi [15]. Predpokladáme preto, že centrálny nervový systém spracúva signály, ktoré vznikajú v dôsledku aktivácie imunitných buniek pri interakciách s nádorovým tkanivom. Aktivácia nucleus paraventricularis hypothalami, centrálnej štruktúry regulujúcej aktivitu autonómneho, endokrinného a imunitného systému, navyše naznačuje, že mozog zahajuje koordinovanú neuroendokrinnú a neuroimunitnú reakciu na periférne rastúci nádor.
Štúdie zmien aktivity mozgových štruktúr u pacientov s nádormi preukázali zníženie prefrontálnej aktivity u onkologických pacientov v porovnaní s kontrolami [16,17]. Tieto zmeny však môžu byť skôr dôsledkom depresie, ktorá je u onkologických pacientov často prítomná. V inej štúdii, ktorá zahŕňala pacientov s nádormi pľúc, boli pozorované signifikantné zmeny v aktivite pravej časti cerebella [18]. Je známe, že cerebellum okrem motorických funkcií reguluje aj imunitné funkcie [19]. Tieto nálezy naznačujú, že mozog reaguje na nádorový rast moduláciou aktivity imunitných buniek.
Ischemicko-reperfúzne poškodenie pečene
U zvierat exponovaných ligácii hepatálnej artérie alebo kombinovanej ligácii portálej triády sme preukázali zvýšenú aktivitu neurónov organum subfornicale, hypotalamických jadier nucleus suprachiasmaticus, paraventricularis, arcuatus a ventromedialis a kmeňových štruktúr, ako sú locus coeruleus, nucleus parabrachialis, nucleus tractus solitarii a A1/C1 katecholaminergické bunkové skupiny [20,21]. Keďže ide o oblasti, ktoré sú aktivované pri expozícii organizmu imunitným podnetom alebo pri zmenách v metabolizme a podieľajú sa aj na regulácii homeostázy telesných tekutín a elektrolytov, predpokladáme, že pozorované zmeny v mozgu u potkanov po ischemicko-reperfúznom poškodení pečene odrážajú prenos signálov súvisiacich so zápalovými zmenami a so zmenami energetického metabolizmu a homeostázy telesných tekutín a elektrolytov. Po spracovaní signálov súvisiacich s ischemicko-reperfúznym poškodením orgánov môže mozog zahájiť adekvátne adaptačné reakcie, na čo poukazuje aj aktivácia hypotalamických štruktúr.
Urémia
Experimentálne navodená urémia u potkanov bola sprevádzaná zvýšenou aktivitou monoaminergických neurónov dolnej časti mozgového kmeňa a štruktúr predného mozgu, o ktorých je známe, že sú aktivované pôsobením stresorov; mozgových štruktúr, ktoré sa podieľajú na regulácii homeostázy telesných tekutín a elektrolytov (napr. cirkumventrikulárne orgány) a tiež centrálnych autonómnych štruktúr, obzvlášť tých, ktoré spracúvajú viscerálne signály z obličiek [22,23].
Sepsa
Zmeny v aktivite centrálneho nervového systému pri zápalových stavoch popisuje viacero štúdií. Sledovala sa napr. aktivita mozgových štruktúr u potkanov so sepsou indukovanou ligáciou a punkciou céka. Pozorované zvýšenie aktivity neurónov nucleus tractus solitarii poukazuje na nervový aferentný prenos signálov, súvisiacich so septickým stavom, do mozgu. Okrem toho došlo k aktivácii ventrolaterálnej predĺženej miechy, nuclei raphe, nucleus parabrachialis, hypotalamu, amygdaly, nucleus interstitialis striae terminalis a preoptickej oblasti. Nakoľko väčšina z aktivovaných oblastí reaguje aj na periférne imunitné podnety, možno predpokladať, že signály prenášané do mozgu počas sepsy súvisia prevažne s aktiváciou imunitného systému [24].
Vplyv mozgových štruktúr na činnosť buniek periférnych tkanív
Po spracovaní senzitívnych signálov moduluje centrálny nervový systém činnosť periférnych orgánov priamo (prostredníctvom motorických nervových dráh) a nepriamo (prostredníctvom regulácie činnosti endokrinného a imunitného systému).
Motorická inervácia
Na regulácii činnosti buniek periférnych orgánov sa významnou mierou podieľa motorická inervácia buniek. Postgangliové vlákna autonómneho nervového systému inervujú napr. myokard, hladké svalstvo, bunky žliaz, tukové tkanivo a imunitné orgány [25].
Nervová regulácia biochemických procesov prebiehajúcich v bunkách
Úlohou nervov, inervujúcich tkanivá organizmu, nie je iba „jednoduchý“ prenos signálov medzi nervovým systémom a cieľovým tkanivom. V prípade, že dochádza k zmenám v inervácii priečne pruhovaných svalových vlákien (denervácia, skrížená reinervácia), následne dochádza v myocytoch k viacerým zmenám na molekulárnej úrovni, ktorých výsledkom môže byť aj zmena fenotypu daného vlákna kostrového svalu [26,27]. Podobný vplyv môže mať aj autonómna inervácia tkanív vnútorných orgánov. Je napr. možné, že inervácia tukového tkaniva ovplyvňuje molekulárne deje v adipocytoch a takto participuje na vzniku obezity. Podporou pre tento predpoklad je zistenie, že na regulácii proliferácie tukových buniek sa významnou mierou podieľa práve sympatiková inervácia tukového tkaniva [28].
Neuroendokrinné regulácie
Nervový systém reguluje činnosť buniek periférnych orgánov aj prostredníctvom ovplyvňovania aktivity endokrinného systému. Primárnu úlohu v týchto reguláciách zohráva hypotalamo-hypofyzárny systém, ktorý umožňuje transformovať zmeny v aktivite neuronálnych štruktúr na zmeny v sekrécii hormónov hypofýzy a periférnych endokrinných orgánov [29].
Neuroimunitné regulácie
Centrálny nervový systém reguluje imunitné reakcie na systémovej, regionálnej a lokálnej úrovni. Senzitívne nervové zakončenia sa podieľajú na reakciách prvej obrannej línie lokálne, v mieste zápalu, prostredníctvom uvoľňovania neuropeptidov, ktoré vo všeobecnosti zvyšujú lokálnu zápalovú reakciu. Sympatikové a parasympatikové nervy zasa uplatňujú regulačný vplyv na regionálnej úrovni, prostredníctvom inervácie imunitných orgánov, pričom pôsobia na zápal inhibične [30].
Zápalový reflex
Zápalový reflex zabezpečuje nervovú reguláciu činnosti imunitného systému počas fyziologických aj patologických situácií. Senzitívne rameno zápalového reflexu tvoria aferentné dráhy n. vagus, ktoré detekujú molekuly vznikajúce v dôsledku poškodenia, infekcie a zápalu. Motorické rameno reflexu tvoria eferentné axóny prebiehajúce v n. vagus, ktoré prenášajú signály podieľajúce sa na modulácii imunitných reakcií. Pretože eferentné neuróny n. vagus uvoľňujúce acetylcholín inhibujú imunitné reakcie, bolo pre eferentné dráhy tvorené týmito neurónmi zavedené označenie „cholinergická protizápalová dráha“ [31–33].
Vplyv narušenia činnosti nervového systému na vznik a priebeh chorôb periférnych orgánov
Spoločným menovateľom viacerých chorôb s vysokou incidenciou (napr. kardiovaskulárne, metabolické a nádorové) je chronický, subklinický zápal [34]. Pritom práve nedostatočná neuroimunitná regulácia môže predstavovať jeden z faktorov, ktorý sa podieľa na vzniku subklinického zápalu [35]. Zdá sa teda, že neuroimunitné interakcie predstavujú jeden zo základných pilierov neurobiológie chorôb periférnych orgánov, na čo poukazujú experimentálne a klinické nálezy [36].
Náhle narušenie mozgových funkcií, napr. v dôsledku iktu, môže viesť k zmenám vo fyziologických aj patologických procesoch prebiehajúcich v periférnych orgánoch. Z hľadiska regulácie imunitných funkcií mozgom bola napr. u pacientov po ikte preukázaná znížená aktivita kožných T-lymfocytov [37]. Modulácia patologických procesov mozgom pritom vykazuje lateralizáciu, na čo poukazujú nálezy výraznejšej imunosupresie po ikte, ktorý bol lokalizovaný v ľavej hemisfére [38]. Na základe uvedených faktov nie je prekvapujúce, že v dôsledku iktu dochádza aj k ovplyvneniu priebehu autoimunitných chorôb. U pacientov po ikte bola napr. pozorovaná remisia reumatoidnej artritídy a výrazné zníženie sklerodermou indukovaných zmien v paretických končatinách [39,40]; u hemiplegických pacientov sa pozoroval asymetrický výskyt reumatoidnej artritídy a reumatoidnej vaskulitídy [41,42]. Bol tiež popísaný protektívny účinok neurologického deficitu na vznik reumatoidnej artritídy u pacienta s mozgovou obrnou [43].
Zdá sa, že na vzniku niektorých chorôb periférnych tkanív sa podieľa aj narušenie činnosti štruktúr mozgu v dôsledku zápalu prebiehajúceho v týchto štruktúrach. Zatiaľ čo zápal v štruktúrach hypotalamu sa dáva do súvislosti so vznikom obezity [44], zápal v cievach mozgového kmeňa sa dáva do súvisu so vznikom hypertenzie [45].
Terapeutické využitie stimulácie nervových štruktúr
V poslednom období sa začína využívať na liečbu vybraných chorôb periférnych orgánov (napr. zlyhanie srdca, hypertenzia) elektrická stimulácia alebo chirurgické vyradenie štruktúr nervového systému.
Elektrická stimulácia n. vagus a zlyhanie srdca
V modeli srdcového zlyhania zvýšila stimulácia n. vagus prežívanie potkanov až o 72 % [57]. Je pritom zaujímavé, že vagová stimulácia vykazuje prospešný účinok aj vtedy, ak nedochádza k poklesu srdcovej frekvencie. Uvažuje sa, že je to v dôsledku antiarytmogénneho pôsobenia stimulovaného vagu [46]. To, či sa na pozitívnom účinku elektrickej stimulácie n. vagus pri zlyhaní srdca podieľa aj ovplyvnenie fenotypových charakteristík kardiomyocytov, nie je známe.
Prospešný účinok priamej elektrickej stimulácie n. vagus pri srdcovom zlyhaní bol preukázaný aj v prvých klinických štúdiách. V štúdii, ktorej sa zúčastnilo 8 pacientov s pokročilým stupňom srdcového zlyhania, boli implantované neurostimulátory, stimulujúce nízkou intenzitou prúdu pravý n. vagus. Stimulačné pulzy boli aplikované synchrónne so srdcovými kontrakciami. Stimulácia n. vagus bola aktivovaná 2–4 týždne po implantácii stimulátorov, pričom intenzita stimulácie sa postupne zvyšovala. Elektrická stimulácia n. vagus bola u pacientov so zlyhávajúcim srdcom dobre tolerovaná, len s miernymi vedľajšími účinkami (kašeľ a pociťovanie elektrickej stimulácie). U pacientov došlo k signifikantnému zlepšeniu stavu (pri hodnotení podľa NYHA klasifikácie a Minnesotskej škály kvality života), k zníženiu ľavokomorového koncovo-systolického objemu a k priaznivému trendu v redukcii koncovo-diastolického objemu [47,48]. Podobne pozitívne výsledky priniesla aj ďalšia, rozsiahlejšia štúdia, ktorej sa zúčastnilo 32 pacientov so zlyhaním srdca [49].
Hypertenzia a denervácia obličiek
V súčasnosti je všeobecne akceptovaným fakt, že určité formy esenciálnej hypertenzie sú neurogénne, t. j. ich vznik a udržiavanie je dôsledkom nadmernej sympatikovej aktivity [50]. Podiel renálnej sympatikovej aktivity na vzniku a progresii hypertenzie, ale aj na zlyhaní srdca a chronických obličkových chorobách, bol preukázaný v experimentoch aj klinických štúdiách. Denervácia obličiek sa využíva ako účinný spôsob redukcie sympatikového vplyvu na činnosť obličiek, ktorý vedie k zvýšeniu natriurézy a diurézy, zníženiu uvoľňovania renínu, pričom nedochádza k nežiaducemu ovplyvneniu iných renálnych funkcií, ako sú rýchlosť glomerulárnej filtrácie a renálny krvný prietok [51].
Hlboká mozgová stimulácia a obezita
Metóda hlbokej mozgovej stimulácie sa využíva predovšetkým v liečbe Parkinsonovej choroby a esenciálneho tremoru, pričom elektrická stimulácia prostredníctvom permanentne implantovanej elektródy ovplyvňuje aktivitu v narušených okruhoch bazálnych ganglií. Okrem toho sa v súčasnosti rozširuje terapeutické využitie tejto metódy aj na liečbu Tourettovho syndrómu, obsedantno-kompulzívnej poruchy, depresie a závislosti [52].
Experimentálna štúdia u potkanov preukázala, že dlhodobá bilaterálna stimulačná inhibícia laterálneho hypotalamu viedla k signifikantnému poklesu telesnej hmotnosti [53]. Aj napriek tomu, že zatiaľ nebola publikovaná klinická štúdia sledujúca terapeutický účinok hlbokej mozgovej stimulácie u väčšieho počtu pacientov s morbídnou obezitou, začína sa skúmať využitie tejto terapeutickej metódy v liečbe obezity [54].
Z pohľadu neurobiológie chorôb periférnych orgánov je možné očakávať, že cielená elektrická stimulácia mozgových štruktúr môže predstavovať potenciálny terapeutický postup zameraný na ovplyvnenie kompenzačných a adaptačných reakcií centrálneho nervového systému s cieľom modulovať progresiu rôznych chorôb, pri ktorých patologický proces prebieha primárne v periférnych orgánoch.
Centrálne účinky farmák
Experimentálne štúdie naznačujú, že prospešné pôsobenie viacerých v súčasnosti používaných liekov môže byť, okrem vplyvu na bunky v periférnom orgáne narušenom patologickým procesom, aspoň čiastočne výsledkom ich modulačného pôsobenia na určité mozgové štruktúry.
Opodstatnenosť tohto predpokladu podporuje len nedávno popísaný nález „centrálneho“ účinku beta-blokátorov pri srdcovom zlyhaní. Bolo preukázané, že blokáda beta-adrenergických receptorov priamo v mozgu obmedzila progresiu remodelácie tkaniva ľavej komory srdca v experimentálnom modeli srdcového zlyhania. Je to prvý priamy dôkaz toho, že mechanizmus zodpovedný za prospešný vplyv niektorých beta-blokátorov na priebeh srdcového zlyhania je sprostredkovaný aj ovplyvnením aktivity mozgových štruktúr [55].
Ďalším príkladom sú statíny, sartany a inhibítory angiotenzín konvertujúceho enzýmu. Predpokladá sa, že uvedené látky môžu okrem periférneho účinku aktivovať na centrálnej úrovni eferentné dráhy n. vagus, ktoré sú súčasťou cholinergickej protizápalovej dráhy, a tým pôsobiť na periférne tkanivá protizápalovo. Zdá sa, že práve protizápalové pôsobenie sa môže čiastočne podieľať na terapeutickom účinku týchto látok [36].
V budúcnosti je možné očakávať vývoj liekov, ktoré budú primárne pôsobiť na úrovni centrálneho nervového systému a moduláciou autonómnych, neuroendokrinných a neuroimunitných regulácií pozitívne ovplyvňovať patologický proces prebiehajúci v periférnych orgánoch [56].
Dopady štúdií neurobiológie chorôb
Podrobnejšie poznanie mechanizmov a dráh, podieľajúcich sa na prenose signálov medzi patologickým procesom a mozgom vytvára podklad pre:
- rozšírenie spektra chorôb, u ktorých sa skúma úloha nervového systému v ich etiopatogenéze (napr. diabetes mellitus, apendicitída, nádory);
- vznik nových disciplín, ktoré sú založené na integrácii poznatkov o chorobách určitých orgánových systémov a poznatkov z neurovied (napr. neurokardiológia, neurobiológia nádorových chorôb);
- ovplyvnenie kompenzačných mechanizmov, ktoré iniciuje centrálny nervový systém, a to prostredníctvom nových farmák, elektrostimulačných alebo inhibičných metód, prípadne prostredníctvom psychoterapeutických postupov;
- porozumenie vzťahom medzi starnutím (ktoré môže byť okrem iného sprevádzané aj zmenami v regulačnom pôsobení centrálneho nervového systému) a zvýšenou incidenciou chorôb periférnych orgánov;
- modifikáciu postupov pri transplantácii orgánov, nakoľko u darcov dochádza v dôsledku mozgovej smrti k narušeniu regulačného vplyvu centrálneho nervového systému na aktivitu periférnych orgánov, ktoré sa tým stávajú vulnerabilnejšími;
- porozumenie mechanizmom centrálnych účinkov farmák, ktoré boli pôvodne vyvinuté so zámerom ovplyvňovať patologický proces účinkom na periférne orgány.
Záver
Pre ucelenejšie pochopenie etiopatogenézy chorôb je potrebné brať do úvahy aj význam regulačných a adaptačných reakcií nervového systému na patologický proces, ktorý podmieňuje vznik a progresiu danej choroby. Experimentálne a klinické štúdie preukázali, že počas patologického procesu prebiehajúceho v periférnych orgánoch dochádza k aktivácii kompenzačných reakcií, ktoré reguluje centrálny nervový systém. Pokiaľ je toto kompenzačné pôsobenie mozgu na činnosť tkanív a orgánov nedostatočné, prípadne maladaptívne, chorobný proces progreduje. Nedostatočné kompenzačné pôsobenie môže byť zapríčinené aj nedostatočnou aferentnou signalizáciou z poškodeného orgánu do mozgu, prípadne neprimeranou aktiváciou neuroendokrinných a neuroimunitných reakcií v dôsledku porúch na úrovni centrálneho alebo periférneho nervového systému.
Zmeny v aktivite mozgových štruktúr, ku ktorým dochádza v reakcii na patologické procesy, prebiehajúce v periférnych orgánoch, sú vysoko komplexné. Pre ich pochopenie bude potrebné zmapovať zmeny v aktivite neuronálnych štruktúr pri jednotlivých chorobách. Experimentálne štúdie na laboratórnych zvieratách umožnili popísať zmeny v mozgu napr. pri akútnom srdcovom zlyhaní, nádorovej chorobe, pri ischemicko-reperfúznom poškodení pečene, zlyhaní obličiek a sepse. Stále však ostáva veľké množstvo chorôb, u ktorých nevieme, k akým zmenám v mozgu dochádza. Podrobné zmapovanie zmien v mozgu, ku ktorým dochádza u jednotlivých chorôb a poznanie mechanizmov a dráh prenosu signálov o prebiehajúcom patologickom procese na periférii organizmu do mozgu a mechanizmov a dráh umožňujúcich mozgu reagovať na tieto patologické zmeny umožní komplexnejší pohľad na etiopatogenézu chorôb a vytvorí podklad pre zavedenie nových terapeutických postupov.
Táto práca bola podporená Agentúrou na podporu výskumu a vývoja (APVV--0045-06 a APVV-0007-10), grantmi VEGA (1/0258/10, 1/0260/10, 2/0010/09) a grantom ITMS 26240120015 („Vybudovanie centra excelentnosti pre náhle cievne mozgové príhody na Lekárskej fakulte UK v Bratislave“ spolufinancovaného zo zdrojov ES z Európskeho fondu regionálneho rozvoja – Podporujeme výskumné aktivity na Slovensku).
doc. MUDr. Boris Mravec, PhD.
www.fmed.uniba.sk
e-mail: boris.mravec@fmed.uniba.sk
Doručeno do redakce: 10. 1. 2011
Přijato po recenzi: 11. 4. 2011
Zdroje
1. Mravec B. Neurobiológia chorôb periférnych tkanív. Bratislava SAP 2008.
2. Mravec B, Ondicova K, Valaskova Z et al. Neurobiological principles in the etiopathogenesis of disease: when diseases have a head. Med Sci Monit 2009; 15: RA6–RA16.
3. Valášková Z, Kiňová S, Danihel L et al. The complexity of interactions of the tumour growth process. Vnitř Lék 2009; 55 : 1145–1158.
4. Lane RD, Waldstein SR, Chesney MA et al. The rebirth of neuroscience in psychosomatic medicine, Part I: historical context, methods, and relevant basic science. Psychosom Med 2009; 71 : 117–134.
5. Koukolík F. Mozek a jeho duše. 3. vyd. Praha: Galén; 2005.
6. Jänig W. The integrative action of the autonomic nervous system. Neurobiology of homeostasis. Cambridge: Cambridge University Press 2006.
7. Banks WA, Erickson MA. The blood--brain barrier and immune function and dysfunction. Neurobiol Dis 2010; 37 : 26–32.
8. Kono H, Rock KL. How dying cells alert the immune system to danger. Nat Rev Immunol 2008; 8 : 279–289.
9. Hwang IK, Yoo KY, Han TH et al. Enhanced cell proliferation and neuroblast differentiation in the rat hippocampal dentate gyrus following myocardial infarction. Neurosci Lett 2009; 450 : 275–280.
10. Felder RB, Francis J, Zhang ZH et al. Heart failure and the brain: new perspectives. Am J Physiol Regul Integr Comp Physiol 2003; 284: R259–276.
11. Li YF, Patel KP. Paraventricular nucleus of the hypothalamus and elevated sympathetic activity in heart failure: the altered inhibitory mechanisms. Acta Physiol Scand 2003; 177 : 17–26.
12. Kergozien S, Delcros JG, Jouan H et al. Induction of Fos protein expression in spinal cord neurons of tumour-bearing rats. Br J Cancer 1999; 80 : 1512–1517.
13. Konsman JP, Blomqvist A. Forebrain patterns of c-Fos and FosB induction during cancer-associated anorexia-cachexia in rat. Eur J Neurosci 2005; 21 : 2752–2766.
14. Pirnik Z, Bundzikova J, Bizik J et al. Activity of brain stem groups of catecholaminergic cells in tumor-bearing rats: response to immobilization stress. Ann N Y Acad Sci 2008; 1148 : 141–147.
15. Hollis JH, Lightman SL, Lowry CA. Integration of systemic and visceral sensory information by medullary catecholaminergic systems during peripheral inflammation. Ann N Y Acad Sci 2004; 1018 : 71–75.
16. Tashiro M, Kubota K, Itoh M et al. Hypometabolism in the limbic system of cancer patients observed by positron emission tomography. Psychooncology 1999; 8 : 283–286.
17. Tashiro M, Itoh M, Kubota K et al. Relationship between trait anxiety, brain activity and natural killer cell activity in cancer patients: a preliminary PET study. Psychooncology 2001; 10 : 541–546.
18. Golan H, Kennedy JA, Frenkel A et al. Brain Mapping of Patients with Lung Cancer and Controls: Inquiry into Tumor-to-Brain Communication. J Nucl Med 2009; 50 : 1072–1075.
19. Peng YP, Qiu YH, Qiu J et al. Cerebellar interposed nucleus lesions suppress lymphocyte function in rats. Brain Res Bull 2006; 71 : 10–17.
20. Pirnik Z, Bundzikova J, Francisty T et al. Effect of liver ischemia-reperfusion injury on the activity of neurons in the rat brain. Cell Mol Neurobiol 2009; 29 : 951–960.
21. Bundzikova J, Pirnik Z, Lackovicova L et al. Activation of different neuronal phenotypes in the rat brain induced by liver ischemia-reperfusion injury: Dual Fos/neuropeptide immunohistochemistry. Cell Mol Neurobiol 2011; 31 : 293–310.
22. Palkovits M, Sebekova K, Gallatz K et al. Neuronal activation in the CNS during different forms of acute renal failure in rats. Neuroscience 2009; 159 : 862–882.
23. Heidland A, Sebekova K, Klassen A et al. Mechanisms of acute uremic encephalopathy: early activation of Fos and Fra-2 gene products in different nuclei//areas of the rat brain. J Ren Nutr 2010; 20: S44–S50.
24. Carlson DE, Chiu WC, Fiedler SM et al. Central neural distribution of immunoreactive Fos and CRH in relation to plasma ACTH and corticosterone during sepsis in the rat. Exp Neurol 2007; 205 : 485–500.
25. Petrovický P. Anatomie s topografií a klinickými aplikacemi. III. svazek. Neuroanatomie, smyslová ústrojí a kůže. Martin: Vydavateľstvo Osveta 2002.
26. Mendler L, Pintér S, Kiricsi M et al. Regeneration of reinnervated rat soleus muscle is accompanied by fiber transition toward a faster phenotype. J Histochem Cytochem 2008; 56 : 111–123.
27. Gauthier GF, Burke RE, Lowey S et al. Myosin isozymes in normal and cross-reinnervated cat skeletal muscle fibers. J Cell Biol 1983; 97 : 756–771.
28. Bartness TJ, Song CK. Brain-adipose tissue neural crosstalk. Physiol Behav 2007; 91 : 343–351.
29. Ganong WF. Přehled lékařské fyziologie. 20. vyd. Praha: Galén 2005.
30. Sternberg EM. Neural regulation of innate immunity: a coordinated nonspecific host response to pathogens. Nat Rev Immunol 2006; 6 : 318–328.
31. Tracey KJ. The inflammatory reflex. Nature 2002; 420 : 853–859.
32. Andersson J. The inflammatory reflex – introduction. J Intern Med 2005; 257 : 122–125.
33. Tracey KJ. Understanding immunity requires more than immunology. Nat Immunol 2010; 11 : 561–564.
34. Couzin-Frankel J. Inflammation bares a dark side. Science 2010; 330 : 1621.
35. Szczepanska-Sadowska E, Cudnoch--Jedrzejewska A, Ufnal M et al. Brain and cardiovascular diseases: common neurogenic background of cardiovascular, metabolic and inflammatory diseases. J Physiol Pharmacol 2010; 61 : 509–521.
36. Mravec B, Ondičová K. Nervus vagus. Bratislava: SAP 2010.
37. Meisel C, Schwab JM, Prass K et al. Central nervous system injury-induced immune deficiency syndrome. Nat Rev Neurosci 2005; 6 : 775–786.
38. Koch HJ, Uyanik G, Bogdahn U et al. Relation between laterality and immune response after acute cerebral ischemia. Neuroimmunomodulation 2006; 13 : 8–12.
39. Keyszer G, Langer T, Kornhuber M et al. Neurovascular mechanisms as a possible cause of remission of rheumatoid arthritis in hemiparetic limbs. Ann Rheum Dis 2004; 63 : 1349–1351.
40. Sethi S, Sequeira W. Sparing effect of hemiplegia on scleroderma. Ann Rheum Dis 1990; 49 : 999–1000.
41. Dolan AL. Asymmetric rheumatoid vasculitis in a hemiplegic patient. Ann Rheum Dis 1995; 54 : 532.
42. Thompson M, Bywaters EG. Unilateral rheumatoid arthritis following hemiplegia. Ann Rheum Dis 1962; 21 : 370–377.
43. Yaghmai I, Rooholamini SM, Faunce HF. Unilateral rheumatoid arthritis: protective effect of neurologic deficits. AJR Am J Roentgenol 1977; 128 : 299–301.
44. Arruda AP, Milanski M, Velloso LA. Hypothalamic inflammation and thermogenesis: the brown adipose tissue connection. J Bioenerg Biomembr 2011; 43 : 53–58.
45. Paton JF, Waki H. Is neurogenic hypertension related to vascular inflammation of the brainstem? Neurosci Biobehav Rev 2009; 33 : 89–94.
46. Schwartz PJ. Vagal stimulation for heart failure. Curr Opin Cardiol 2011; 26 : 51–54.
47. Schwartz PJ, De Ferrari GM. Vagal stimulation for heart failure: background and first in-man study. Heart Rhythm 2009; 6: S76–S81.
48. Schwartz PJ, De Ferrari GM, Sanzo A et al. Long term vagal stimulation in patients with advanced heart failure: first experience in man. Eur J Heart Fail 2008; 10 : 884–891.
49. Schwartz PJ. Vagal stimulation for heart diseases: from animals to men. – An example of translational cardiology. Circ J 2010; 75 : 20–27.
50. Wyss JM, Carlson SH. The role of the nervous system in hypertension. Curr Hypertens Rep 2001; 3 : 255–262.
51. Schlaich MP, Sobotka PA, Krum H et al. Renal denervation as a therapeutic approach for hypertension: novel implications for an old concept. Hypertension 2009; 54 : 1195–1201.
52. Krack P, Hariz MI, Baunez C et al. Deep brain stimulation: from neurology to psychiatry? Trends Neurosci 2010; 33 : 474–484.
53. Sani S, Jobe K, Smith A et al. Deep brain stimulation for treatment of obesity in rats. J Neurosurg 2007; 107 : 809–813.
54. Pisapia JM, Halpern CH, Williams NN et al. Deep brain stimulation compared with bariatric surgery for the treatment of morbid obesity: a decision analysis study. Neurosurg Focus 2010; 29: E15.
55. Gourine A, Bondar SI, Spyer KM et al. Beneficial effect of the central nervous system beta-adrenoceptor blockade on the failing heart. Circ Res 2008; 102 : 633-636. 56. Felder RB, Yu Y, Zhang ZH et al. Pharmacological treatment for heart failure: a view from the brain. Clin Pharmacol Ther 2009; 86 : 216–220.
57. Li M, Zheng C, Sato T et al. Vagal nerve stimulation markedly improves long-term survival after chronic heart failure in rats. Circulation 2004; 109 : 120-124.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2011 Číslo 10- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Co dělat při intoleranci statinů?
-
Všetky články tohto čísla
- Kritické zhodnocení optimální farmakoterapie u kandidátů srdeční resynchronizační léčby – zkušenosti jednoho centra
- Náklady na rehospitalizaci pacientů s akutním srdečním selháním
- Očkování proti virové hepatitidě B u pacientů s chronickým selháním ledvin – dvacetileté zkušenosti
- Normální hodnoty tlaků v plicním oběhu u zdravých osob v klidu a při cvičení
- Resynchronizačná liečba srdcového zlyhávania – stále veľa otáznikov
- Diagnostický algoritmus synkop: integrativní přístup
- Léčba akutní exacerbace chronické obstrukční plicní nemoci za hospitalizace a na lůžku intenzivní péče
- Úloha centrálneho nervového systému v etiopatogenéze chorôb periférnych orgánov
- Prognostické faktory u chronické lymfocytární leukemie
- Diagnostika a léčba komunitní pneumonie dospělých
- Benígny solitárny vred slepého čreva
- MR dokumentované vymizení infiltrace infundibula hypofýzy u pacientů s histiocytózou z Langerhansových buněk po léčbě 2-chlorodeoxyadenosinem
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Normální hodnoty tlaků v plicním oběhu u zdravých osob v klidu a při cvičení
- Léčba akutní exacerbace chronické obstrukční plicní nemoci za hospitalizace a na lůžku intenzivní péče
- Resynchronizačná liečba srdcového zlyhávania – stále veľa otáznikov
- Prognostické faktory u chronické lymfocytární leukemie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



