Aerobní a specifický trénink nádechových svalů u pacientů s chronickým srdečním selháním – přehledový článek
Aerobic and specific inspiratory muscle training in patients with chronic heart failure
Foreign specialists understand modern cardiac rehabilitation in patients with chronic heart failure (CHF) as a multidisciplinary process. Despite huge advances in the treatment of this severe disease in the Czech Republic, virtually no attention is paid to outpatient rehabilitation care for these patients, although appropriately chosen physical activity demonstrably improves quality of life and reduces the cost of treatment provided to these patients. This review highlights the great benefits of cardiac rehabilitation for patients with CHF.
Keywords:
chronic heart failure – combined training – aerobic capacity – quality of life – Threshold IMT – inspiratory muscle
Authors:
F. Dosbaba 1,2; P. Žurková 1,3; O. Ludka 4,5; R. Vysoký 1,6,7; L. Baťalík 1,2; J. Špinar 4,5; O. Kolařík 1,7
Authors‘ workplace:
Rehabilitační oddělení FN Brno2 Kardiovaskulární rehabilitace Ladislav Baťalík3 Klinika nemocí plicních a TBC LF MU a FN Brno4 Interní kardiologická klinika LF MU a FN Brno5 Mezinárodní centrum klinického výzkumu, FN u sv. Anny v Brně6 Ústav preventivního
1
Published in:
Kardiol Rev Int Med 2014, 16(5): 380-384
Category:
Cardiology Review
Overview
Moderní kardiovaskulární rehabilitace u pacientů s chronickým srdečním selháním (CHSS) je v zahraničí chápána jako multidisciplinární proces. I přes obrovské pokroky v léčbě tohoto těžkého onemocnění není zatím v České republice věnována prakticky žádná pozornost ambulantní rehabilitační péči o nemocné s chronickým srdečním selháním. Přitom vhodně nastavená pohybová aktivita prokazatelně zvyšuje kvalitu života a omezuje náklady na léčbu těchto nemocných. Tento přehledový článek poukazuje na velký přínos kardiovaskulární rehabilitace pro pacienty s CHSS.
Klíčová slova:
chronické srdeční selhání – kombinovaný trénink – aerobní kapacita – kvalita života – Threshold IMT – inspirační svalstvo
Úvod
Srdeční selhání (SS) se řadí mezi jednu z nejvýznamnějších příčin morbidity a mortality v civilizovaných zemích. Prevalence se v evropské populaci pohybuje v rozmezí 0,4 – 2,0 %. Počet úmrtí vzrůstá rovnoměrně se stárnutím populace, průměrný věk pacientů se SS činí 74 let. Prevalence se u osob starších 70 let pohybuje kolem 10 %. Akutní srdeční selhání může v konečném důsledku vést ke smrti. Nejčastěji však vede ke chronicitě, a celoživotní léčba je tak nezbytná [1,2]. Socioekonomické dopady tohoto onemocnění na pacienty, jejich rodiny i zdravotnický systém jsou obrovské. Uvádí se, že přibližně 45 % nově vzniklých SS je rehospitalizováno do jednoho roku s průměrnou délkou hospitalizace 11 dnů [3]. Následné rehospitalizace velmi výrazně snižují kvalitu života a navyšují náklady na léčbu těchto pacientů.
Řada randomizovaných klinických studií popisuje benefity plynoucí z pravidelné pohybové aktivity, jež v konečném důsledku přinášejí menší riziko vzniku kardiovaskulárních příhod a zvýšení šancí na přežití. Pravidelný trénink může nejen zmírnit symptomy, ale i zlepšit aerobní kapacitu, kvalitu života, morbiditu i mortalitu [4,5]. Pravidelný aerobní trénink je doporučován i Evropskou směrnicí pro diagnostiku a léčbu akutního a chronického srdečního selhání 2012, kde jsou oficiálně uznány jeho benefity [6].
Jaké efekty přináší pravidelný aerobní trénink?
Všechny níže popsané benefity vedou ke společnému cíli, a to zajistit, aby postižení SS zvládali běžné denní aktivity a byli schopni většinu těchto aktivit vykonávat bez závislosti na jiné osobě. Kardiovaskulární rehabilitaci proto považujeme za cennou strategii v komplexním přístupu u pacientů se SS.
Neurohumorální efekt zahrnuje snížení sympatikotonie se společným snížením aktivity renin‑angiotenzin‑aldosteronového systému (RAAS), které je spojeno se snížením plazmatické koncentrace angiotenzinu II (AII) a natriuretických peptidů (NAP). K těmto dějům dochází prostřednictvím ovlivňování rostrální ventrolaterální části medulla oblongata, jež je hlavním centrem řízení krevního tlaku, dýchání a srdečních funkcí. Hlavním cílem je tedy dosáhnout pravidelným tréninkem snížení aktivity sympatického nervového systému a zvýšení parasymapatikotonie, což má především za následek snížení tepové frekvence a krevního tlaku, zvýšení srdeční variability, snížení vazokonstrikce s lepší dodávkou krve do myokardu a periferních orgánů včetně kosterního svalstva. Tyto faktory výrazně zlepšují tréninkovou kapacitu na základě lepší funkce myokardu [7].
Optimálně nastavený aerobní trénink má nesporný endoteliální efekt. Dochází k obnově fyziologické funkce endotelu cév zvýšením endoteliální produkce oxidu dusnatého (NO) a snížením oxidačního stresu prostřednictvím poklesu množství volných kyslíkových radikálů. Tyto radikály mají charakter nepárového elektronu, jenž je velmi reaktivní a výrazně se podílí na narušování nesmáčenlivosti povrchu cév [8].
Protizánětlivý efekt vede ke snížení hladiny markerů zánětu v krvi – interleukin 6 (IL‑6), interleukin 1 (IL‑1), tumor necrosis factor (TNF), dále se podílí na snížení oxidačního stresu a skrze podporu anabolických dějů můžeme tréninkem zlepšit i aerobní metabolizmus v kosterních svalech, ale také zabránit apoptóze kosterních myocytů. Tyto faktory společně se sníženou aktivitou cytokinů následně vedou ke zvýšení kontraktility myokardu a zabraňují též srdeční remodelaci [9].
Kardiovaskulární efekt vede k úpravě srdečního výdeje cestou změny enddiastolického a endsystolického objemu levé komory. Zvyšuje se také citlivost myofilament k vápníkovým kationtům (Ca2+), což vede společně s jinými faktory k nárůstu ejekční frakce. Pravidelná pohybová aktivita také omezuje riziko vzniku ischemických příhod [10].
V kosterních svalech dochází k normalizaci metabolizmu, zvýšení aerobní kapacity a lepší využitelnosti kyslíku tkáněmi prostřednictvím zvýšení počtu mitochondrií, lepšího využívání kyslíku a redukce oxidačního stresu. Nárůst vrcholové spotřeby kyslíku (VO2peak) společně s hodnotou anaerobního prahu (ANP) a se zmnožením kapilár vede k oddálení nástupu anaerobního metabolizmu, a tím k lepší toleranci zátěže. U netrénovaných pacientů je patrný značný úbytek svalové hmoty, který je způsoben pohybovou inaktivitou, ale také apoptózou buněk kosterní svaloviny. Dlouhodobé zvýšení hladiny cytokinů je dále spojeno se svalovým katabolizmem [10,11].
Aerobní trénink má také svůj podíl na úpravě parametrů bronchopulmonálního systému. Dochází k výraznému nárůstu vitální kapacity plic, maximální minutové ventilace a k ekonomičtější extrakci a využitelnosti kyslíku z vdechovaného vzduchu [12].
Indikace a preskripce k zahájení kombinovaného tréninku
Testování pacientů s CHSS je podobné jako u jiných pacientů s kardiovaskulárními onemocněními. V jeho průběhu je nutné především důkladně vyhodnotit reakci na zátěž a stanovit funkční kapacitu. U pacientů s CHSS očekáváme výrazné snížení funkční kapacity, proto je nezbytné tréninkový protokol striktně individualizovat. Navíc se v průběhu zátěžového testu mohou objevit některé symptomy, které musíme bezpodmínečně brát v úvahu při preskripci tréninku. Testováním těchto pacientů odhadujeme limitace nebo dokonce i kontraindikace vysoce intenzivního tréninku. Pacienti nesmí během tréninku vykazovat žádné známky dekompenzace, v ideálním případě je vhodné zahájit trénink až po několika měsících, kdy je pacient klinicky stabilní a kompenzovaný. Po vyhodnocení výše uvedených faktorů nastavíme trénink v následném rozmezí: pro tepovou frekvenci (TF) 40 – 80 % z maxima, ze spotřeby kyslíku (VO2) 40 – 80 % z maxima, 65 – 80 % z vrcholového tréninkového maxima a dle Borgovy škály Rated Perceived Exertion (RPE) na 11 – 16 dle vnímání zátěže a na 3 – 6 dle symptomů [13]. V zahraničí, zejména v USA, se měří i udává spotřeba kyslíku pomocí metabolických ekvivalentů (MET). O středně intenzivním tréninku hovoříme v rozpětí 3 – 6 MET. Aktivity, které vyžadují spotřebu energie vyšší než 6 MET, představují vysokou intenzitu tréninku. Aerobní aktivity se v ambulantním provozu vykonávají na bicyklovém ergometru, chodníku či veslici [14].
Při hodnocení jednotlivých parametrů zátěžového testu jsou pro nás prognosticky nejvýznamnější VO2 a poměr minutové ventilace a výdeje oxidu uhličitého (VE/ VCO2 slope). Oba tyto parametry v sobě reflektují efektivitu ventilace a vážnost funkčního stavu, proto jsou obecně považovány za silné prognostické ukazatele. V klinické praxi považujeme kombinaci VO2 < 10 ml. kg– 1.min–1 a VE/ VCO2 slope > 40 za markery velmi špatné prognózy a závažnosti stavu srdečního selhání [12].
Trénink
Z výsledků metaanalýzy řady zahraničních klinických studií vyplývá signifikantní pokles úmrtí i následných opakovaných rehospitalizací u pacientů s CHSS, kteří absolvovali ambulantní řízenou rehabilitaci [15].
Nastavení tréninkových hodnot u pacientů s CHSS se řídí podobnými pravidly jako např. u infarktu myokardu (IM). Nejnovější studie se shodují, že trénink by měl probíhat ideálně 30 – 60 min 3× týdně. Intenzita tréninku se v ideálním případě pohybuje od 70 do 80 % maximálních (vrcholových) hodnot parametrů zmiňovaných výše v závislosti na symptomy limitovaných příznacích stanovených zátěžovým testem [16]. Pro dosažení maximálního možného efektu je doporučován některými studiemi trénink intervalový o vysoké intenzitě, který je přínosnější než trénink kontinuální o střední intenzitě. Za vysokou intenzitu považujeme 90 – 95 % maximální symptomy limitovanou tepovou frekvenci (TFmaxSL), jež se pravidelně střídá s aktivní pauzou o výrazně nižší intenzitě v poměru 4 : 3 [17].
Současná guidelines American Heart Assocation zdůrazňují důležitost odporového tréninku, jenž tvoří nezbytnou součást precizní preskripce pohybové aktivity u pacientů s CHSS. Pokud tento trénink zařazujeme do ambulantně řízeného programu, pak již hovoříme o tréninku kombinovaném. Odporový trénink prokazatelně zlepšuje kvalitu života tím, že zvyšuje svalovou sílu, vytrvalost, redukuje symptomy SS, přispívá k redukci cévních a svalových abnormit, a to vše bez nepříznivých kardiovaskulárních důsledků. Vhodně nastavené statické zatížení pacientů s CHSS zlepšuje aerobní metabolizmus v kosterním svalstvu, podporuje neoangiogenezi a zvyšuje využitelnost kyslíku. S posilováním začínáme na 40 – 50 % one ‑ repetition maxima (1 - RM) s nízkým počtem opakování (5 – 7×). Práci vs pauzu volíme v poměru 1 : 2. Při dobré toleranci zvyšujeme zátěž na 50 – 60 % 1 - RM [18,19]. Ztráta svalové hmoty a snížení aerobního metabolizmu vede k tzv. svalové myopatii, jež postihuje nejvíce dechové svalstvo. Kombinovaný trénink společně se specifickým respiračním tréninkem u populace pacientů s CHSS výrazně redukuje vznik a rozsah této patologie [8].
Riziko tréninku
Studie zajímající se o riziko vzniku náhlé kardiální příhody u pacientů s CHSS během řízeného ambulantního tréninku ukazují, že benefity plynoucí z tréninkového programu jednoznačně převyšují možná rizika. Riziko je nízké, uvádí se četnost jedna náhlá příhoda na 50 – 150 000 tréninkových hodin [20]. Jiná studie dokonce uvádí, že riziko náhlé srdeční smrti je jedna příhoda na 750 000 tréninkových hodin [21].
Trénink nádechových svalů u nemocných s chronickým srdečním selháním
CHSS je onemocněním, které ve svém důsledku postihuje nejen srdce, ale i příčně pruhované svaly, cévy, neurohormonální systém a plíce [22]. Nemocní s CHSS trpí dušností, únavou a intolerancí fyzické námahy, což významně negativně ovlivňuje kvalitu jejich života. Dechové svaly hrají významnou úlohu ve vývoji příznaků a omezení pohybových aktivit hlavně u plicních, kardiálních a neuromuskulárních onemocnění. Výskyt oslabení nádechových svalů a nepoměr mezi zatížením svalů a jejich výkonností vede k rozvoji dušnosti, snížení pohybové výkonnosti, rozvoji hypoventilace a respiračnímu selhání. Oslabení síly výdechových svalů může mít vliv na efektivitu kašle, jenž má za následek neadekvátní odstranění hlenů z dýchacích cest, které je spojeno s vyšším rizikem infekce dýchacích cest, zejména v terénu městnání [23]. Oslabení obou skupin dechových svalů pak signifikantně koreluje s mírou dušnosti [24].
První výzkumná práce zabývající se tréninkem nádechových svalů pochází z roku 1995 a je dílem autorů Mancini et al [25]. Je všeobecné známé, že jedním z hlavních příznaků CHSS je únava během zátěže a dušnost, které jsou důsledkem vnitřních abnormalit kosterních svalů. Námahová dušnost nastává při zvýšeném zatížení dechových svalů nebo v důsledku jejich samotného oslabení. Snížení síly dechových svalů reflektuje zvýšenou dechovou práci u nemocných se SS. Restrikční ventilační dechový vzorec, dechová nedostatečnost a zvýšení mrtvého prostoru je jedním z aspektů SS a částečně přispívá k přetěžování dechových svalů. Pokles síly nádechových svalů (PIMAX) může být z důvodu generalizované dysfunkce kosterních svalů. Meyer et al [26] ve své studii uvádějí, že chronické srdeční selhání je mimo jiné charakterizováno dysfunkcí dechových svalů a že síla dechových svalů je nezávislým prediktorem prognózy u této skupiny nemocných.
Preskripce k tréninku nádechových svalů
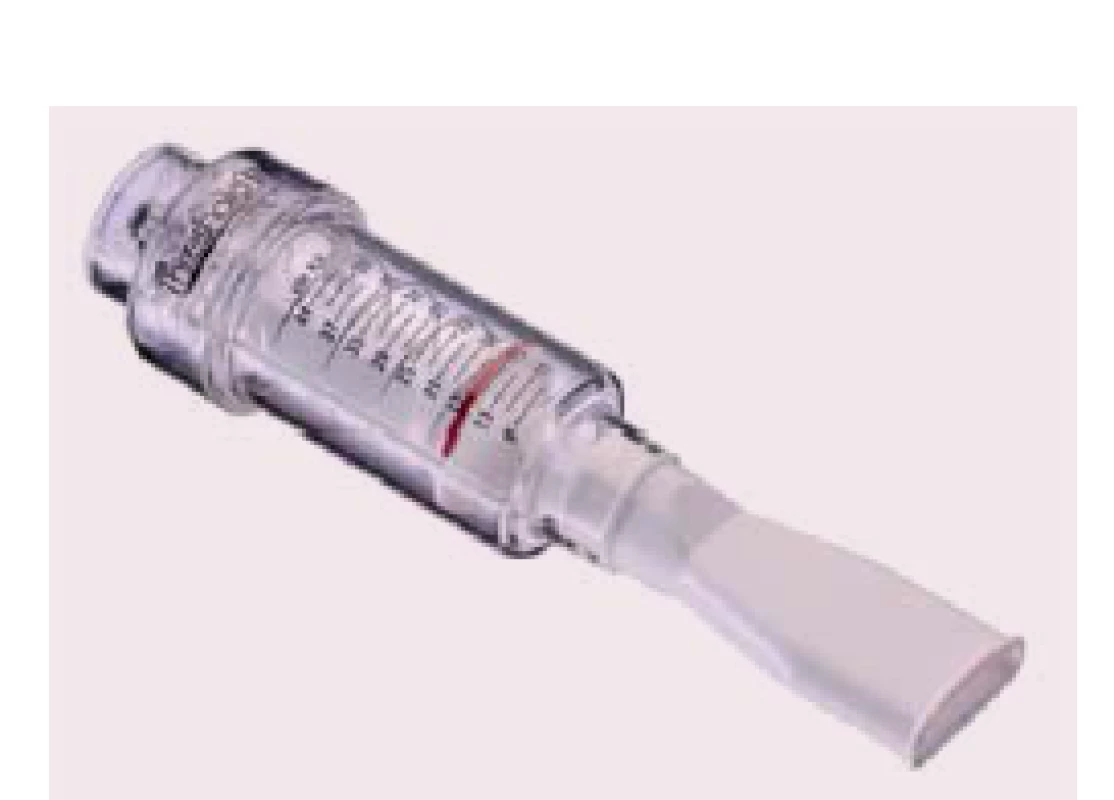
Ke stanovení míry tréninkové zátěže je nutno vyšetřit sílu nádechových svalů pomocí měření maximálního nádechového okluzního ústního tlaku (PIMAX). Jeho velikost je interindividuální a je ovlivněna věkem, pohlavím, tělesnou hmotností, výškou a kooperací při provedení měření. Na podkladě 12 publikovaných studií (tab. 1) s využitím dechové pomůcky Threshold IMT® (obr. 1) je nejvíce efektivní preskripce tréninku nádechových svalů při 30 % PIMAX po dobu 30 min, s frekvencí tréninku 5 – 7 dnů v týdnu po dobu 4 – 12 týdnů. Největší snížení dušnosti u dosavadních studií bylo zaznamenáno přibližně po čtyřech týdnech tréninku [27]. Za dostatečnou sílu nádechových svalů, jež bychom chtěli pravidelným tréninkem dosáhnout, považujeme hodnotu > 70 % PIMAX. Velmi podstatné je věnovat pozornost indikacím a kontraindikacím v rámci tréninku nádechových svalů (tab. 2).
![Přehled studií tréninku nádechových svalů s pomůckou Threshold IMT (Philips Respironics<sup>®</sup>) u pacientů se SS (upraveno dle Cahalin et al) [27].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/09acf132734279ca841044ebfbe8e5fd.png)
![Přehled indikací a kontraindikací tréninku nádechových svalů u nemocných s CHSS (upraveno dle Cahalin et al) [27].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/18537adfd345822b0c09c01a883535a1.png)
Závěr
Na základě dostupných informací se domníváme, že ambulantně řízený kombinovaný trénink a specifický trénink nádechových svalů by se měl zakomponovat do standardní kardiorespirační rehabilitace u nemocných s CHSS, kteří udávají námahovou dušnost a snížení síly nádechových svalů (PIMAX < 70 % náležitých hodnot) s verifikovanými nízkými funkčními parametry transportního systému [27]. Velmi významným aspektem je motivace pacientů k dlouhodobému provádění tréninku, jenž může významně zvýšit kvalitu života vlivem zmírnění dechových potíží, snížit četnost opakovaných hospitalizací, což vede k poklesu nákladů za zdravotnickou péči. Vlivem narůstajícího počtu seniorské populace bude kardiovaskulární rehabilitace nezbytnou součástí komprehenzivní péče o pacienty s CHSS.
Podpořeno Evropským fondem pro regionální rozvoj – projektem FNUSA ‑ ICRC No. CZ.1.05/ 1.1.00/ 02.0123 a projektem MZ ČR 65269705 (FNB, Brno, Česká republika).
Doručeno do redakce: 25. 7. 2014
Přijato po recenzi: 16. 8. 2014
doc. MUDr. Ondřej Ludka, Ph.D.
www.fnbrno.cz
oludka@fnbrno.cz
Sources
1. Nieminen MS, Brutsaert D, Dickstein K et al. The EuroHeart Survey Investigators. EuroHeart Failure Survey II (EHS II): a survey on hospitalized acute heart failure patients: description of population. European Heart Journal 2006. doi:10.1093/ eurheartj/ ehl193.
2. Mosterd A, Hoes AW. Clinical epidemiology of heart failure. Heart 2007; 93 : 1137 – 1146.
3. Cowie MR, Mosterd A, Wood DA et al. The epidemiology of heart failure. Eur Heart J 1997; 18 : 208 – 225.
4. Myers J, Prakash M, Froelicher V et al. Exercise capacity and mortality among men referred for exercise testing. N Engl J Med 2002; 346 : 793 – 801. doi: 10.1056/ NEJMoa011858.
5. Kavanagh T, Mertens DJ, Hamm LF et al. Prediction of long‑term prognosis in 120169 men reffered for cardiac rehabilitation. Circulation 2002; 106 : 666 – 671.
6. McMurray J, Adamopoulos S, Anker S et al. ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur Heart J 2012; 33 : 1787 – 1847. doi: 10.1093/ eurheartj/ ehs104.
7. Roveda F, Middlekauff HR, Rondon MU et al. The effects of exercise training on sympathetic neural activation in advanced heart failure: a randomized controlled trial. J Am Coll Cardiol 2003; 42 : 854 – 860.
8. Brum PC, Bacura AV, Cunha TF et al. Skeletal myopathy in heart failure: effects of aerobic exercise training. Exp Physiol 2014; 99 : 616 – 620. doi: 10.1113/ expphysiol.2013.076844.
9. Bozkurt B, Kribbs SB, Clubb FJ Jr et al. Pathophysiologically relevant concentrations of tumor necrosis factor‑alpha promote progressive left ventricular dysfunction and remodeling in rats. Circulation 1998; 97 : 1382 – 1391. doi: 10.1161/ 01.CIR.97.14.1382.
10. Piepoli MF. Exercise training in chronic heart failure: mechanisms and therapies. Eur Heart J Feb 2013; 21 : 85 – 90. doi: 10.1007/ s12471 ‑ 012 ‑ 0367 ‑ 6.
11. Hambrecht R, Niebauer J, Fiehn E et al. Physical training in patients with stable chronic heart failure: effects on cardiorespiratory fitness and ultrastructural abnormalities of leg muscles. J Am Coll Cardiol 1995; 25 : 1239 – 1249.
12. Balady GJ, Arena R, Sietsema K et al. Clinician's Guide to Cardiopulmonary Exercise Testing in Adults: A Scientific Statement From the American Heart Association. Circulation 2010; 122 : 191 – 225. doi: 10.1161/ CIR.0b013e3181e52e69.
13. American College of Sports Medicine. ACSM’s Guidelines for Exercise Testing and Prescription. 8th ed. Baltimore: Lippincott Williams & Wilkins 2009.
14. Quinn B. Pharmacological treatment of heart failure. Crit Care Nurs Q 2007; 30 : 299 – 306.
15. Piepoli MF, Davos C, Francis DP et al. ExTraMATCH Collaborative. Exercise training meta‑analysis of trials in patients with chronic heart failure (ExTraMATCH). BMJ 2004; 328 : 189.
16. Patwala AY, Woods PR, Sharp L et al. Maximizing patient benefit from cardiac resynchronization therapy with the addition of structured exercise training: a randomized controlled study. J Am Coll Cardiol 2009; 53 : 2332 – 2339. doi: 10.1016/ j.jacc.2009.02.063.
17. Wisløff U, Stoylen A, Loennechen JP et al. Superior cerdiovascular effect of aerobic interval training versus moderate continuous training in heart failure patients: a randomized study. Circulation 2007; 115 : 3086 – 3094.
18. Mandic S, Myers J, Selig SE et al. Resistance versus aerobic exercise training in chronic heart failure. Curr Heart Fail Rep 2012; 9 : 57 – 64. doi: 10.1007/ s11897 ‑ 011 ‑ 0078 ‑ 0.
19. Beckers PJ, Denollet J, Possemiers NM et al. Combined endurance‑resistance training vs. endurance training in patients with chronic heart failure: a prospective randomized study. Europ Heart J 2008; 29 : 1858 – 1866. doi: 10.1093/ eurheartj/ ehn222.
20. Rognmo O, Moholdt T, Bakken H et al. Cardiovascular risk of high ‑ versus moderate ‑ intensity aerobic exercise in coronary heart disease patiens. Circulation 2012; 126 : 1436 – 1440. doi: 10.1161/ CIRCULATIONAHA.112.123117.
21. Jolliffe JA, Rees K, Taylor RS et al. Exercise‑based rehabilitation fot coronary heart disease. Cochrane Database Syst Rev 2001; 1: CD001800.
22. Brubaker PH. Exercise intolerance in congestive heart failure: a lesson in exercise physiology. J Cardiopulm Rehabil 1997; 17 : 217 – 221.
23. Moran F, Piper A, Elborn JS et al. Respiratory muscle pressures in non‑CF bronchiectasis: repeatability and reliability. Chron Respir Dis 2010; 7 : 165 – 171. doi: 10.1177/ 1479972310375595.
24. McParland C, Krishnan B, Wang Y et al. Inspiratory muscle weakness and dyspnea in congestive heart failure. Am Rev Respir Dis 1992; 146 : 467 – 472.
25. Mancini DM, Henson D, La Manca J et al. Benefit of selective respiratory muscle training on exercise capacity in patients with chronic congestive heart failure. Circulation 1995; 91 : 320 – 329.
26. Meyer FJ, Borst MM, Zugck C et al. Respiratory muscle dysfunction in congestive heart failure: clinical correlation and prognostic significance. Circulation 2001; 103 : 2153 – 2158.
27. Cahalin LP, Arena R, Guazzi M et al. Inspiratory muscle training in heart disease and heart failure: a review of the literature with a focus on method of training and outcomes. Expert Rev Cardiovasc Ther 2013; 1 : 161 – 177. doi: 10.1586/ erc.12.191.
28. Padula CA, Yeaw E, Mistry S. A home‑based nurse ‑ coached inspiratory muscle training intervention in heart failure. Appl Nurs Res 2009; 22 : 18 – 25. doi: 10.1016/ j.apnr.2007.02.002.
29. Stein R, Chiappa GR, Güths H et al. Inspiratory muscle training improves oxygen uptake efficiency slope in patients with chronic heart failure. J Cardiopulm Rehabil Prev 2009; 29 : 392 – 395. doi: 10.1097/ HCR.0b013e3181b4cc41.
30. Winkelmann ER, Chiappa GR, Lima CO et al. Addition of inspiratory muscle training to aerobic training improves cardiorespiratory responses to exercise in patients with heart failure and inspiratory muscle weakness. Am Heart J 2009; 158 : 768.e1 – 768.e7. doi: 10.1016/ j.ahj.2009.09.005.
31. Bosnak ‑ Guclu M, Arikan H, Savci S et al. Effects of inspiratory muscle training in patients with heart failure. Respir Med 2011; 105 : 1671 – 1681. doi: 10.1016/ j.rmed.2011.05.001.
32. Mello PR, Guerra GM, Borile S et al. Inspiratory muscle training reduces sympathetic nervous aktivity and improves inspiratory muscle weakness and quality of life in patients with chronic heart failure: a clinical trial. J Cardiopulm Rehabil Prev 2012; 32 : 255 – 261. doi: 10.1097/ HCR.0b013e31825828da.
33. Cahalin LP, Semigran MJ, Dec GW. Inspiratory muscle training in patients with chronic heart failure awaiting cardiac transplantation: results of a pilot clinical trial. Phys Ther 1997; 77 : 830 – 838.
34. Johnson PH, Cowley AJ, Kinnear WJ. A randomized controlled trial of inspiratory muscle training in stable chronic heart failure. Eur Heart J 1998; 19 : 1249 – 1253.
35. Weiner P, Waizman J, Magadle R et al. The effect of specific inspiratory muscle training on the sensation of dyspnea and exercise tolerance in patients with congestive heart failure. Clin Cardiol 1999; 22 : 727 – 732.
36. Martinez A, Lisboa C, Jalil J et al. Selective training of respiratory muscle in patients with chronic heart failure. Rev Med Chil 2001; 129 : 133 – 139.
37. Dall’Ago P, Chiappa GR, Guths H et al. Inspiratory muscle training in patients with heart failure and inspiratory muscle weakness: a randomized trial. J Am Coll Cardiol 2006; 47 : 757 – 763.
38. Chiappa GR, Roseguini BT, Vieira PJ et al. Inspiratory muscle training improves blood flow to resting and exercising limbs in patients with chronic heart failure. J Am Coll Cardiol 2008; 51 : 1663 – 1671. doi: 10.1016/ j.jacc.2007.12.045.
Labels
Paediatric cardiology Internal medicine Cardiac surgery CardiologyArticle was published in
Cardiology Review

2014 Issue 5
-
All articles in this issue
- Ledviny a srdeční selhání
- Léčba anémie a nedostatku železa z pohledu hematologa
- Léčba anémie a nedostatku železa u chronického srdečního selhání
- Léčba sideropenní anémie v gastroenterologii
- Léčba anémie z nedostatku železa z pohledu nefrologa
- Aerobní a specifický trénink nádechových svalů u pacientů s chronickým srdečním selháním – přehledový článek
- Profil nemocných s akutním srdečním selháním léčených v přednemocniční péči
- Ruptura aneuryzmatu nekoronárního Valsalvova sinu jako raritní příčina bolesti na hrudi – kazuistika
- Co nám přináší studie PARADIGM‑HF
- Diagnostika a léčba osteoporózy
- Antifosfolipidový syndrom – diagnostika, manifestace a léčba
- Systémová sklerodermie
- Současné použití biologik v léčbě revmatoidní artritidy
- Nežádoucí účinky biologické léčby v revmatologii
- Srdeční selhání a CHOPN – přehledový článek
- Diabetes mellitus a srdeční selhání
- Cardiology Review
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Léčba anémie a nedostatku železa z pohledu hematologa
- Antifosfolipidový syndrom – diagnostika, manifestace a léčba
- Nežádoucí účinky biologické léčby v revmatologii
- Systémová sklerodermie
