Léčba anémie a nedostatku železa u chronického srdečního selhání
Treatment of anaemia and iron deficiency in chronic heart failure
Iron deficiency is an important co ‑ morbidity in patients with heart failure. A major factor in the pathogenesis of anaemia, it is also a separate condition with serious clinical consequences (e. g. impaired exercise capacity) and poor prognosis in heart failure patients. Experimental evidence suggests that iron therapy in iron ‑ deficient patients may activate molecular pathways that can be cardio ‑ protective. Clinical studies have demonstrated favourable effects of IV iron on the functional status, quality of life, and exercise capacity in HF patients. IV iron supplementation has become a novel therapy in HF patients with iron deficiency.
Keywords:
anaemia – iron deficiency – heart failure – therapy of anaemia
Authors:
J. Vítovec 1; J. Špinar 2,3; L. Špinarová 1
Authors‘ workplace:
I. interní kardioangiologická klinika LF MU a FN u sv. Anny v Brně
1; Interní kardiologická klinika LF MU Brno
2; Mezinárodní centrum klinického výzkumu, Brno
3
Published in:
Kardiol Rev Int Med 2014, 16(5): 364-369
Category:
Cardiology Review
Overview
Nedostatek železa je důležitou komorbiditou u nemocných se srdečním selháním a hlavním faktorem v patogenezi anémie se závažnými klinickými následky (např. snížená zátěžová kapacita) a zhoršenou prognózou nemocných se srdečním selháním. Experimentální nálezy předpokládají, že léčba železem při jeho nedostatku může aktivovat molekulární pochody s následnou ochranou myokardu. Klinické studie demonstrují příznivý vliv nitrožilně podávaného železa na funkční stav, kvalitu života a zátěžovou kapacitu u nemocných se srdečním selháním. Nitrožilní podávání železa se stává novou léčbou u srdečního selhání při nedostatku železa.
Klíčová slova:
anémie – nedostatek železa – srdeční selhání – léčba anémie
Anémie je podle Světové zdravotnické organizace definována snížením plazmatické koncentrace hemoglobinu (Hb) u mužů < 130 g/ l a u žen < 120 g/ l. U srdečního selhání se vyskytuje podle různých zdrojů u 4 – 61 % nemocných s chronickým srdečním selháním (CHSS) v návaznosti na jeho tíži [1,2]. V současnosti je zřejmé, že anémie je významná komorbidita při srdečním selhání, která je zodpovědná za špatnou kvalitu života, a může být ukazatelem nepříznivé prognózy [2,3]. Anémie vede k chronickému objemovému přetížení levé srdeční komory, které způsobuje zvýšenou spotřebu kyslíku v myokardu, dilataci a hypertrofii levé komory. To vše při CHSS dále negativně ovlivňuje srdeční funkci a působí progresi srdečního selhání. Mnohé post hoc analýzy randomizovaných a kontrolovaných klinických studií konzistentně ukázaly, že anémie je při CHSS silným a nezávislým prediktorem horší prognózy [2 – 4]. Retrospektivní analýzou dat ze studie COMET bylo doloženo, že nově vzniklá anémie v průběhu pětiletého sledování byla nezávisle sdružena s vyšší morbiditou i mortalitou [5]. Všechna tato data jasně ukazují, že anémie je při CHSS známkou špatné prognózy nemocného. Hlavními faktory, které se podílejí na vzniku anémie, jsou neadekvátní produkce erytropoetinu, útlum funkce kostní dřeně, retence tekutin a hlavně nedostatek železa (Iron Deficience – ID) (obr. 1) [4,6,7].
Fyziologická úloha železa
Železo má zásadní úlohu při transportu kyslíku (komponenta hemoglobinu), při metabolizmu srdečního a kosterního svalstva (komponenta oxidačních enzymů a proteinů dýchacího řetězce), při syntéze a odbourávání bílkovin, lipidů, ribonukleových kyselin (komponenta enzymatická) a při funkci mitochondrií. Železo je nezbytné pro optimální krvetvorbu. Nedostatek železa vede k rezistenci na hematopoetické růstové faktory (např. erytropoetin) a narušuje diferenciaci a zrání všech typů hematopoetických buněk [8,9]. Skladuje se v myoglobinu.
Hlavní dráhy obratu železa
Průměrný příjem železa je 10 – 20 mg/ den, ovšem pouze 10 – 20 % železa se ze stravy za normálních okolností vstřebává prostřednictvím specifických transportních systémů, především duodenálními enterocyty. V organizmu se nitrobuněčné železo vyskytuje ve dvojmocné formě (Fe2+) a mimobuněčné cirkulující železo v trojmocné formě (Fe3+). Utilizované železo představuje cirkulující a nitrobuněčné železo. Cirkulující železo v trojmocné formě je vázáno na transferin, který slouží jako rezervoár rozpustného železa, dodává železo do cílových buněk a neutralizuje vlastnosti železa spočívající v tvorbě volných radikálů. Naprostá většina nitrobuněčného železa se nachází v hemoglobinu v erytrocytech a v cirkulujících retikulocytech. Uložené železo se nachází v játrech, v kostní dřeni a v buňkách sleziny v netoxické formě feritinové, které je vylučováno do mimobuněčného prostoru. Systémový metabolizmus železa je řízen mechanizmy, na nichž se podílí hepcidin a jeho receptor (ferroportin), zatímco nitrobuněčný metabolizmus železa je řízen komplexem proteinů regulujících železo. Hepcidin blokuje střevní absorpci železa a odklání jej z oběhu do retikuloendoteliálního systému. Pokles vstřebávání železa ze střev spolu s jeho hromaděním v retikuloendoteliálních zásobách snižuje dostupnost železa pro cílové tkáně [9 – 11].
![Deficit Fe u srdečního selhání: mechanizmy [4].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/c1dfc3b2540493f2b71f0cf9b67c8d39.png)
Diagnóza a klasifikace nedostatku železa
Je třeba rozlišovat dva typy ID: absolutní a funkční nedostatek. Absolutní odráží depleci zásob železa, často při nedotčených mechanizmech homeostázy železa a erytropoézy. Mezi nejčastější příčiny patří: nízké množství železa ve stravě, narušená absorpce ze zažívacího ústrojí (GI) a ztráty krve z GI, menoragie. Funkční nedostatek odráží inadekvátní přísun železa pro naplnění jeho požadavku přes normální či hojné zásoby železa v organizmu, protože železo je zadržováno uvnitř buněk retikuloendoteliálního systému a není dostupné pro buněčný metabolizmus. Snížený přísun železa do erytroblastů a retikulocytů omezuje erytropoézu a právě ID je nejčastější příčinou anémie. Hodnoty metabolizmu železa u srdečního selhání jsou uvedeny v tab. 1.
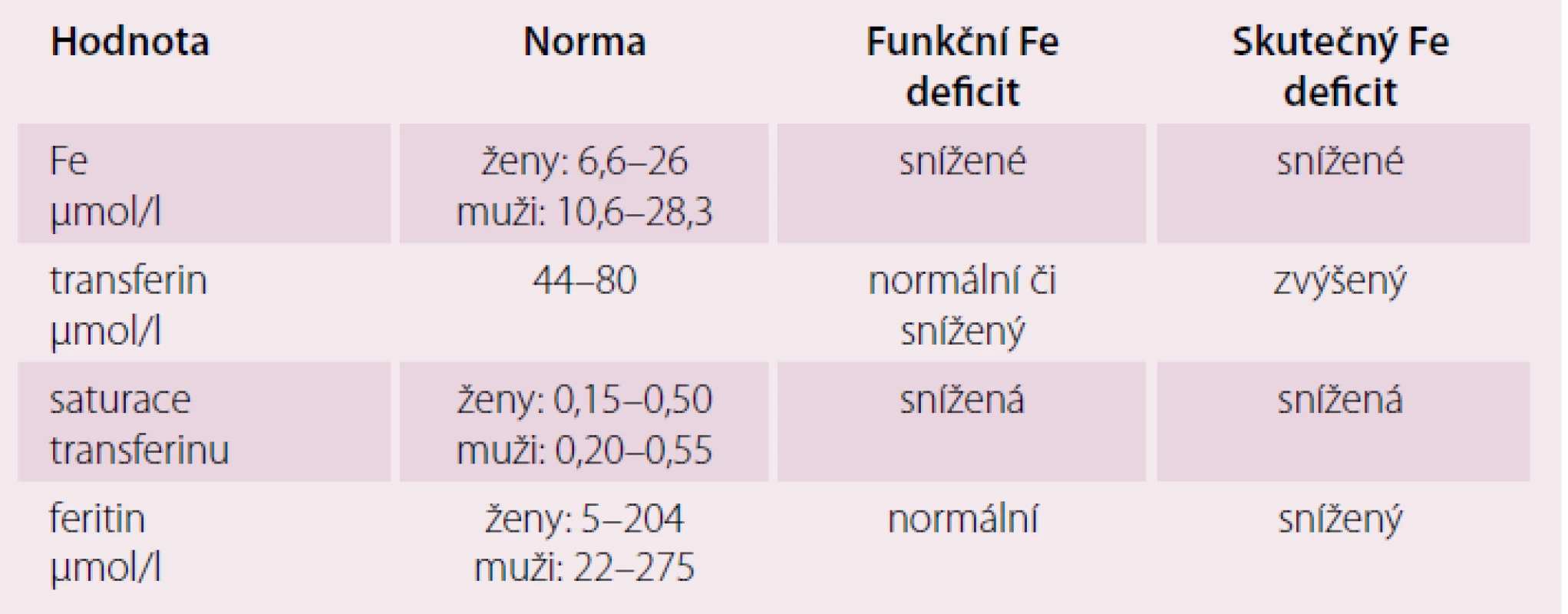
Absolutní a funkční deficience železa při srdečním selhání
Předpokládá se, že na rozvoji absolutní ID při HF se podílejí tyto mechanizmy:
- nedostatečný přísun železa v potravě,
- špatná GI absorpce, narušený duodenální transport železa, lékové interakce (např. omeprazol) nebo potraviny snižující absorpci,
- GI krevní ztráty.
Na základě některých studií byl prokázán suboptimální přísun železa v potravě, zejména u pacientů s pokročilým srdečním selháním [12,13].
Incidence deficience železa u pacientů se srdečním selháním
Ezekowitz et al poskytli první důkaz svědčící o tom, že se ID často vyskytuje spolu s anémií u pacientů se srdečním selháním. V této studii byla anémie přítomna u 17 % pacientů propuštěných z nemocnice pro srdeční selhání a nedostatek Fe byl diagnostikován ve 21 % případů anémie [14]. Witte et al zkoumali stav železa u ambulantních pacientů s chronickým selháním na základě sérové hladiny feritinu. Deficience železa (feritin 0,30 mg/ l) byla zjištěna u 13 % pacientů s CHSS bez ohledu na ejekční frakci levé komory [15].
Jedinou studii, v níž byl hodnocen stav železa u pacientů s CHSS na základě zlatého standardu (biopsie kostní dřeně), prezentovali Nanas et al. Prokázali nedostatek Fe u 27 (73 %) z 37 anemických pacientů s pokročilým, dekompenzovaným srdečním selháním [16].
Deficit železa a prognóza při srdečním selhání
Prognostický dopad ID u pacientů s CHSS byl zkoumán pouze v rámci dvou observačních, prospektivních studií. Autoři Varma et al zkoumali soubor 120 pacientů se systolickou dysfunkcí (LVEF ≤ 45 %), kteří podstoupili perkutánní koronární intervenci, s mediánem následného sledování 30 měsíců. Tito autoři prokázali, že anémie doprovázená ID silně predikuje mortalitu související se srdcem (33 vs 1 % u subjektů bez anémie). U pacientů se systolickým HF bylo zjištěno, že ID je silným nezávislým prediktorem úmrtí a transplantace srdce během tříletého následného sledování. Přítomnost ID zvyšovala riziko špatného výsledku o 60 % během tříletého následného sledování [17,18].
Suplementace železa u pacientů se srdečním selháním
Účinky suplementace železa u pacientů se srdečním selháním byly hlášeny na základě sedmi studií: tři byly otevřené, nekontrolované studie, dvě byly randomizované, otevřené studie a konečně dvě byla randomizovaná, dvojitě zaslepená, placebem kontrolovaná klinická hodnocení. První z těchto studií Bolgera et al popsala 16 případů, kdy nitrožilní (i.v.) podávání sacharózy železa po dobu 5 – 17 dnů anemickým pacientům vedlo k nárůstu hemoglobinu a ke zlepšení příznaků a kapacity zátěže v průběhu tříměsíčního následného sledování [19].
Toblli et al v kontrolované studii potvrdili, že i.v. léčba železem u anemických pacientů s CHSS a s narušenými renálními funkcemi zlepšuje funkční stav, biochemické ukazatele, včetně NT ‑ pro BNP, kapacitu zátěže a kvalitu života [20].
V rámci studie FERRIC ‑ HF (FERRIC Iron Sucrose in Heart Failure) byla i.v. léčba železem v délce 16 týdnů dobře snášena a zlepšovala toleranci zátěže i příznaky. Je zajímavé, že přínosy byly pozorovány i u pacientů s nedostatkem železa bez anémie, i když v nižší míře, a nárůst vrcholové spotřeby kyslíku nebyl spojen se změnami hemoglobinu [21].
Usmanov et al na základě hodnocení pomocí echokardiografie prokázali, že i.v. železo podávané po dobu 26 týdnů pacientům s pokročilým srdečním selháním, anémií a chronickou renální insuficiencí vykazuje příznivé antiremodelační účinky na myokard a zlepšení funkční třídy NYHA [22].
Významná studie FAIR ‑ HF (Ferinject Assessment in patients with IRon deficiency and chronic Heart Failure) byla randomizovaná, dvojitě zaslepená, placebem kontrolovaná, multicentrická studie, do níž bylo zařazeno prozatím nejvíce pacientů s chronickým systolickým srdečním selháním a nedostatkem železa (anemických i bez anémie), kteří následně absolvovali 24týdenní léčbu i.v. železem (200 mg carboxymaltosum ferricum) nebo placebem (2 : 1). Bylo zařazeno 459 pacientů s CHSS s ejekční frakcí levé komory – LVEF pod 40 % u funkční třídy NYHA II nebo LVEF pod 45 % u nemocných NYHA III. Feritin musel být buď pod 100 µg/ l, nebo 100 – 299 µg/ l při saturaci transferinu pod 20 %. Hodnoty hemoglobinu 95 – 135 g/ l. Primárním cílem studie byly změny subjektivních pocitů dle Patient Global Assessment a změny funkční třídy NYHA po 4., 12. a 24. týdnu. Sekundární cíle byly změny v šestiminutovém testu chůze (walk test) a změna kvality života (hodnocená Health‑related Quality of Life). Nemocní dostali 200 mg i.v. carboxymaltosum ferricum a poté 200 mg po čtyřech týdnech do hladiny feritinu 800 ng/ ml nebo 500 ng/ ml, byla‑li saturace 50 % či Hb 160 gr/ l.


Prospěšné účinky léčby železem na změnu globálního hodnocení pacientem a NYHA byly pozorovány napříč celým klinickým spektrem CHSS (graf 1,2) (bez ohledu na vstupní třídu NYHA, hemoglobin, LVEF, etiologii CHSS, přítomnost komorbidit). U léčené skupiny v porovnání s neléčenou rovněž nedošlo k žádnému nárůstu rizika vedlejších účinků, nicméně pozorování bylo omezeno na šest měsíců. Také u sekundárních cílů došlo k příznivému zlepšení v šestiminutovém testu chůze i v kvalitě života (graf 3,4).


Autoři studie udávají trend sníženého výskytu z hlediska první hospitalizace z kardiovaskulárních příčin u léčené skupiny. Bezpochyby je nutno realizovat další a dlouhodobější, randomizovaná, dvojitě zaslepená, placebem kontrolovaná klinická hodnocení, která by potvrdila závěry studie FAIR ‑ HF, včetně snížené mortality a morbidity [23,24].
Na letošním kongresu ESC byla prezentována a následně publikována [25] studie CONFIRM ‑ HF, která měla za cíl prokázat dlouhodobý prospěch a bezpečnost léčby i.v. podávaným železem (Fe) u nemocných se srdečním selháním. Do studie bylo zařazeno 304 nemocných se symptomatickým srdečním selháním s EF ≤ 45 %, BNP > 100 pg/ ml nebo NT ‑ proBNP > 400 pg/ ml, hemoglobinem pod 150 gr/ l a deficientem Fe (feritin < 100 ng/ ml nebo 100 – 300 ng/ ml při saturaci transferinu < 20 %). Randomizace byla 1 : 1 na léčbu i.v. Fe (ferric carboxymaltose sol. – Ferinject Vifor Pharma ve formě i.v. bolus 2 × 10 či 20 ml (což je ekvivalent 1 000 či 2 000 mg Fe)) podaných po dobu minuty a poté opakováno 6., 12., 24., 36. a 52. týden nebo adekvátní množství roztoku NaCl. Injekce byly pro zaslepení pokryty černým obalem. Primárním cílem byla změna vzdálenosti při šestiminutovém testu chůze za 24 týdnů a sekundární cíle hospitalizace pro zhoršené srdeční selhání, změny NYHA či změna kvality života. Ve všech sledovaných parametrech došlo k významnému zlepšení (graf 5,6). Autoři uzavírají, že léčba symptomatického srdečního selhání u nemocných s nedostatkem železa po dobu jednoho roku významně zlepší funkční kapacitu, symptomy, kvalitu života a sníží riziko rehospitalizace pro srdeční selhání [25].


Z hlediska nemocných se jeví podávání carboxymaltosum ferricum jako nejvýhodnější stran nežádoucích účinků a stran zlepšení kvality života nemocných s chronickým srdečním selháním a diagnostikovaným nedostatkem železa. Léčba je indikována při plazmatické koncentraci feritinu < 200 µg/ l a saturaci transferinu < 20 % carboxymaltosum ferricum (Ferinject) až 2 amp. 10 ml/ 500 mg Fe.
Kumulativní dávka karboxymaltózy železa se určuje na základě hmotnosti pacienta a hladiny Hb. Tato dávka nesmí překročit úroveň dle tab. 2.

Závěr
Železo představuje jednu z nutričních složek, která je ústředním bodem buněčného metabolizmu a která má zásadní význam pro udržování homeostázy. Nedostatek železa je závažnou komorbiditou u pacientů se srdečním selháním a dostává se jí rostoucího zájmu nejen jako etiologického faktoru vedoucího a/ nebo zhoršujícího anémii při CHSS, nýbrž také coby samostatného stavu s nepříznivými klinickými a prognostickými důsledky. Až nedávno bylo na základě klinických studií prokázáno, že u pacientů s CHSS a nedostatkem železa bylo nitrožilní podání železa dobře snášeno a vedlo ke zlepšení funkčního stavu, kvality života a kapacity zátěže. Existují předpoklady, že pacienti s CHSS mohou mít příznivý účinek jak z úpravy anémie, tak úpravy nedostatku železa. Příznivé výsledky studií FAIR ‑ HF a CONFIRM ‑ HF ve zlepšení fyzické výkonnosti, kvality života, funkční klasifikace a snížení rehospitalizace pro zhoršení srdečního selhání naznačují, že suplementace Fe u nemocných s poruchou srdeční funkce a anémií vede i ke zlepšení celkové prognózy.
Doručeno do redakce: 13. 9. 2014
Přijato po recenzi: 25. 9. 2014
prof. MU Dr. Jiří Vítovec, CSc., FESC.
www.fnusa.cz
jiri.vitovec@fnusa.cz
www.csnn.eu
Sources
1. Krč I. Diagnostika nejběžnějších typů anémie. Interní medicína pro praxi 2001; 2 : 84 – 88.
2. Tang YD, Katz SD. Anemia in chronic heart failure: prevalence, etiology, clinical correlates, and treatment options. Circulation 2006; 113 : 2454 – 2461.
3. Hradec J. Anémie při chronickém srdečním selhání. Vnitř Lék 2010; 56 : 854 – 859.
4. Kosiborod M, Curtis JP, Wang Y et al. Anemia and Outcomes in Patients With Heart Failure. Arch Intern Med 2005; 165 : 2237 – 2244.
5. Komajda M, Anker SD, Charlesworth A et al. The impact of new onset anemia on morbidity and mortality in chronic heart failure: results from COMET. Eur Heart J 2006; 27 : 1440 – 1446.
6. Jankowska EA, von Haehling S, Anker SD et al. Iron deficiency and heart failure: diagnostic dilemmas and therapeutic perspectives. Eur Heart J 2013; 34 : 816 – 829. doi: 10.1093/ eurheartj/ ehs224.
7. Nanas JN, Matsouka C, Karageorgopoulos D et al.Etiology of anemia in patients with advanced heart failure. J Am Coll Cardiol 2006; 48 : 2485 – 2489.
8. Westenbrink BD, de Boer RA, Voors AA et al. Anemia in chronic heart failure: etiology and treatment options. Curr Opin Cardiol 2008; 23 : 141 – 147. doi: 10.1097/ HCO.0b013e3282f43025.
9. Andrews NC. Disorders of iron metabolism. N Engl J Med 1999; 341 : 1986 – 1995.
10. Wang J, Pantopoulos K. Regulation of cellular iron metabolism. Biochem J 2011; 434 : 365 – 381. doi: 10.1042/ BJ20101825.
11. Nemeth E, Ganz T. The role of hepcidin in iron metabolism. Acta Haematol 2009; 122 : 78 – 86. doi: 10.1159/ 000243791.
12. Pasricha SR, Flecknoe ‑ Brown SC, Allen KJ et al.Diagnosis and management of iron deficiency anaemia: a clinical update. Med J Aust 2010; 193 : 525 – 532.
13. Goddard AF, James MW, McIntyre AS et al. British Society of Gastroenterology. Guidelines for the management of iron deficiency anaemia. Gut 2011; 60 : 1309 – 1316. doi: 10.1136/ gut.2010.228874.
14. Ezekowitz JA, McAlister FA, Armstrong PW. Anemia is common in heart failure and is associated with poor outcomes: insights from a cohort of 12,065 patients with new‑onset heart failure. Circulation 2003; 107 : 223 – 225.
15. Witte KK, Desilva R, Chattopadhyay S et al. Are hematinic deficiencies the cause of anemia in chronic heart failure? Am Heart J 2004; 147 : 924 – 930.
16. Nanas JN, Matsouka C, Karageorgopoulos D et al.Etiology of anemia in patients with advanced heart failure. J Am Coll Cardiol 2006; 48 : 2485 – 2489.
17. Varma A, Appleton DL, Nusca A et al. Iron deficiency anemia and cardiac mortality in patients with left ventricular systolic dysfunction undergoing coronary stenting. Minerva Cardioangiol 2010; 58 : 1 – 10.
18. Jankowska EA, Rozentryt P, Witkowska A et al. Iron deficiency: an ominous sign in patients with systolic chronic heart failure. Eur Heart J 2010; 31 : 1872 – 1880. doi: 10.1093/ eurheartj/ ehq158.
19. Bolger AP, Bartlett FR, Penston HS et al. Intravenous iron alone for the treatment of anemia in patients with chronic heart failure. J Am Coll Cardiol 2006; 48 : 1225 – 1227.
20. Toblli JE, Lombrana A, Duarte P et al. Intravenous iron reduces NT ‑ pro‑brain natriuretic peptide in anemic patients with chronic heart failure and renal insufficiency. J Am Coll Cardiol 2007; 50 : 1657 – 1665.
21. Okonko DO, Grzeslo A, Witkowski T et al. Effect of intravenous iron sucrose on exercise tolerance in anemic and nonanemic patients with symptomatic chronic heartfailure and iron deficiency FERRIC ‑ HF: a randomized, controlled, observerblinded trial. J Am Coll Cardiol 2008; 51 : 103 – 112.
22. Usmanov RI, Zueva EB, Silverberg DS et al. Intravenous iron without erythropoietin for the treatment of iron deficiency anemia in patients with moderate to severe congestive heart failure and chronic kidney insufficiency. J Nephrol 2008; 21 : 236 – 242.
23. Anker SD Comin‑Colet J, Filippatos G et al. FAIR-HF Trial Investigators. Ferric carboxymaltose in patients with heart failure and iron deficiency. N Engl J Med 2009; 361 : 2436 – 2448. doi: 10.1056/ NEJMoa0908355.
24. Jankowska EA, von Haehling S, Anker SD et al.Iron deficiency and heart failure: diagnostic dilemmas and therapeutic perspectives. Eur Heart J 2013; 34 : 816 – 826. doi: 10.1093/ eurheartj/ ehs224.
25. Ponikovski P, van Veldhuisen DJ, Comin‑Colet J et al. CONFIRM ‑ HF Investigators. Beneficial effects of long‑term intravenous iron therapy with ferric carboxymaltose in patients with symptomatic heart failure and iron deficiency. Eur Heart J 2014; 31. doi:10.1093/ eurheartj/ ehu385.
Labels
Paediatric cardiology Internal medicine Cardiac surgery CardiologyArticle was published in
Cardiology Review

2014 Issue 5
-
All articles in this issue
- Ledviny a srdeční selhání
- Léčba anémie a nedostatku železa z pohledu hematologa
- Léčba anémie a nedostatku železa u chronického srdečního selhání
- Léčba sideropenní anémie v gastroenterologii
- Léčba anémie z nedostatku železa z pohledu nefrologa
- Aerobní a specifický trénink nádechových svalů u pacientů s chronickým srdečním selháním – přehledový článek
- Profil nemocných s akutním srdečním selháním léčených v přednemocniční péči
- Ruptura aneuryzmatu nekoronárního Valsalvova sinu jako raritní příčina bolesti na hrudi – kazuistika
- Co nám přináší studie PARADIGM‑HF
- Diagnostika a léčba osteoporózy
- Antifosfolipidový syndrom – diagnostika, manifestace a léčba
- Systémová sklerodermie
- Současné použití biologik v léčbě revmatoidní artritidy
- Nežádoucí účinky biologické léčby v revmatologii
- Srdeční selhání a CHOPN – přehledový článek
- Diabetes mellitus a srdeční selhání
- Cardiology Review
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Léčba anémie a nedostatku železa z pohledu hematologa
- Antifosfolipidový syndrom – diagnostika, manifestace a léčba
- Nežádoucí účinky biologické léčby v revmatologii
- Systémová sklerodermie
