Prima-1 a APR-246 v léčbě nádorových onemocnění
Prima-1 and APR-246 in Cancer Therapy
Background:
p53 is the most mutated protein in cancer and the reactivation of its inactive mutated form represents one possibility for antitumor therapy. Reactivation leads to the initiation of apoptosis followed by the suppression of the malignant phenotype. Prima-1 and its methylated form Prima-1Met (also called APR-246) are compounds capable of reactivating mutated p53. Both are low-molecular substances that have been tested in a number of tumor cell lines and tumors bearing mutated p53.
Aim:
This article summarizes what is currently known about both compounds, describes the possibilities of their use in anti-tumor therapy, and outlines the results of currently undergoing clinical trials of APR-246.
Conclusion:
The results show that the mechanism of action of both compounds is still not clear. The mechanism is only known clearly in the case of Prima-1, and APR-246 is only known to induce apoptosis. The specificity of both substances for mutated p53 differs considerably and depends mainly on the cell model employed and the type of mutation. In addition to p53 reactivation itself, these compounds likely influence other mechanisms that also affect cytotoxic activity.
Key words:
Prima-1Met – APR-246 – Prima-1 – reactivation of p53 – apoptosis
NPU I – LO1413. This work was supported by the project MEYS – NPS I – LO1413.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Accepted: 16. 07. 2018
Authors:
Zatloukalová Pavlína; Galoczová Michaela; Vojtěšek Bořivoj
Authors‘ workplace:
Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno
Published in:
Klin Onkol 2018; 31(Supplementum 2): 71-76
Category:
Review
doi:
https://doi.org/10.14735/amko20182S71
Overview
Východiska:
Nejčastěji mutovaným proteinem u nádorových onemocnění je p53 a jednou z možností protinádorové terapie je reaktivace jeho neaktivní mutované formy. Cílem reaktivací je nastartování apoptózy a potlačení maligního fenotypu. Látkou schopnou reaktivovat mutantní p53 je Prima-1 nebo její metylovaná forma Prima-1Met (označovaná také jako APR-246). Jedná se o nízkomolekulární látky, které byly testovány u řady nádorových buněčných linií, ale i na samotných nádorech nesoucích mutantní p53.
Cíl:
Cílem článku je shrnout dosavadní poznatky o mechanizmu působení Prima-1 a APR-246, popsat jejích využití v protinádorové terapii a zároveň shrnout výsledky klinických studií, jimiž APR-246 aktuálně prochází.
Závěr:
Z dosavadních experimentů vzešla řada protichůdných výsledků upozorňujících na fakt, že mechanizmus účinku látek není stále zcela objasněn. S určitostí jen víme, že Prima-1 i APR-246 indukuje apoptózu nádorových buněk. Specificita látek k mutantnímu p53 je však velmi variabilní a odvíjí se především od použitého buněčného modelu a typu mutace. Kromě samotné reaktivace p53 jsou pravděpodobně ovlivněny i další buněčné mechanizmy, které cytotoxický účinek látek modifikují.
Klíčová slova:
Prima-1 (MET) – APR-246 – Prima-1 – reaktivace p53 – apoptóza
Úvod
Protein p53 je nádorový supresor, jehož klíčovou funkcí je regulace buněčného cyklu a apoptózy v odpovědi na různé druhy buněčného stresu. Jako „strážce genomu“ zamezuje kumulaci mutací, a tím přispívá k omezení vzniku maligního fenotypu. U téměř poloviny nádorových onemocnění dochází k mutacím TP53. Sekvenováním exomů více než 3 000 vzorků u 12 nejčastěji se vyskytujících lidských nádorů byla zjištěna přítomnost mutace TP53 u 42 % analyzovaných vzorků, nejčastěji pak u karcinomu vaječníku a endometria, nejméně naopak u karcinomu ledvin [1]. U nádorů s velmi špatnou prognózou, jako jsou „high-grade“ serózní karcinom vaječníku, triple negativní karcinom prsu, nádor jícnu či plic se uvádí přítomnost mutované formy p53 (p53mut) dokonce až v 80 % případů [2]. Nádory s p53mut jsou obvykle charakterizovány horší prognózu, zvýšenou invazivitou a metastazováním.
Nejčastějším typem mutací TP53 jsou bodové mutace, které mění smysl kodonu a jejichž výsledkem je substituce jedné aminokyseliny za jinou. Téměř 90 % z nich je lokalizováno v DNA vazebné doméně p53 [3], kde přispívají k nesprávnému sbalování proteinu, znemožňují jeho vazbu na DNA cílových genů a omezují tak jeho nádorově supresorovou funkci v buňce [4]. Nemutovaná forma p53 (p53wt) se v normálních buňkách vyskytuje ve velmi nízkých hladinách, a to z důvodu regulované degradace E3-ubikvitin ligázou MDM2. Naopak v případě p53mut je interakce s MDM2 narušená a vede k jeho omezené degradaci a kumulaci v buňkách [5]. p53mut může navíc získat nové onkogenní vlastnosti přispívající k přežití nádorových buněk nebo ke vzniku rezistence k chemoterapii [6].
V současné době je vyvíjeno značné úsilí získat nové látky specificky se vázající na p53mut, schopné vyvolat buněčnou apoptózu či podpořit další mechanizmy potlačující růst a proliferaci buněk nebo alespoň zvýšit citlivost buněk k chemoterapeutikům. Mezi látky, které byly již v minulosti testovány a jejichž antiproliferativní účinek je spojen s reaktivací p53, patří např. MIRA-1 [7], CP 31398 [8], PhiKan083 [9], ale také Prima-1 (p53 reactivation and induction of massive apoptosis) a APR-246 [10,11].
Mechanizmus působení Prima-1 a APR-246
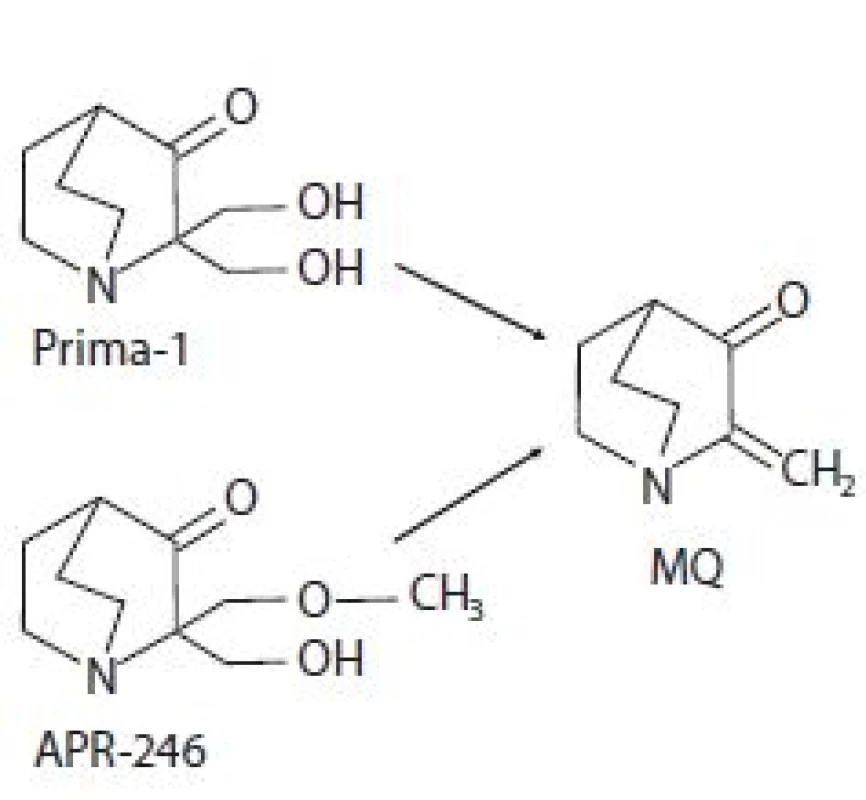
Prima-1 byla identifikována v roce 2002 v rámci screeningu knihovny nízkomolekulárních látek amerického Národního onkologického institutu (National Cancer Institute – NCI). Jeho cílem bylo nalézt látky schopné změnit nefunkční konformaci p53mut na funkční p53wt a tím reaktivovat funkci p53 jako nádorového supresoru schopného potlačit růst nádorů [12]. Chemicky se jedná o 2,2-bis (hydroxymethyl) -1-azabicyklo[2,2,2]oktan-3-on (obr. 1) [10,12]. Analýzou strukturních analogů byla poté odhalena metylovaná forma označující se jako Prima-1Met neboli APR-246, chemicky 2-hydroxymethyl-2-methoxymethyl-aza-bicyklo[2,2,2]oktan-3-on (obr. 1). Biologická aktivita obou sloučenin je dána konverzí na methylen quinuclidinon (MQ), ke které dochází spontánně při fyziologickém pH (obr. 1) [13]. Jeho struktura obsahuje dvojnou vazbu udělující MQ slabé elektrofilní vlastnosti a umožňující mu fungovat jako Michaelův akceptor, tzn. preferenčně interagovat se slabými nukleofily. Slabé nukleofily jsou v buněčném prostředí zastoupeny zejména thiolovými skupinami na cysteinech obsažených ve strukturách proteinů či redoxních regulátorů. V případě p53 se MQ kovalentně váže na centrální část proteinu, která obsahuje 10 cysteinových reziduí [13]. Počítačovou analýzou strukturních modelů p53 byla identifikována vazebná kapsa obsahující cysteiny Cys124, Cys135 a Cys141 [14]. In vitro studie pak prokázaly, že primární roli při reaktivaci p53mut pomocí Prima-1 hraje alkylace Cys124 [14], která je spouštěčem alkylací ostatních cysteinů destabilizovaného p53, které jej nakonec termodynamicky uvězní v transkripčně aktivní konformaci [15] a navrátí mu schopnost transaktivovat cílové geny. Vazbou MQ na Cys277 a Cys124 dochází k reaktivaci p53 nesoucího mutaci v R175H. Alkylace pouze Cys277 zvyšuje termostabilitu p53wt a p53 nesoucích mutace R175H a R273H [16]. Dále bylo zjištěno, že Prima-1 zvyšuje expresi chaperonu Hsp90α, který také může napomáhat správnému sbalování p53 [17].
In vitro a in vivo studie u různých nádorových modelů prokázaly schopnost Prima-1 i APR-246 indukovat apoptózu [18–20] a zástavu buněčného cyklu [19,20]. Větší cytotoxicitu obecně vykazuje APR-246, a to především díky vyšší lipofilitě a schopnosti lépe penetrovat buněčnou membránou [11,21]. Reaktivace p53 pomocí Prima-1 či APR-246 byla studována především v souvislosti s bodovými mutacemi měnícími smysl kodonu. Reaktivační efekt obou látek byl ale také prokázán u buněčných linií s TP53 nesoucích bodové mutace vedoucí ke vzniku zkrácených forem proteinu či mutace způsobující posun čtecího rámce [22]. V současné době se objevují studie upozorňující na cytotoxický efekt obou látek u buněčných linií s deletovanou či nemutovanou formou p53, tzn. na cytotoxický efekt nezávislý na mutaci v p53 [22–24].
Reaktivace p53 způsobuje indukci apoptózy prostřednictvím vnitřní mitochondriální dráhy, a to regulaci pro-apoptotických a anti-apoptotických proteinů rodiny Bcl-2. Řada publikací popsala reaktivaci apoptózy indukovanou Prima-1 nebo APR-246, avšak s rozdílnými výsledky v expresi pro-apoptotických proteinů PUMA, BAX a APAF-1. U plicních buněčných linií APR-246 indukovala zvýšení aktivace kaspázy-2 a zvýšení exprese PUMA a BAX [25]. V jiné studii bylo prokázáno, že APR-246 indukuje expresi proteinů APAF-1 a PUMA, nikoli však BAX [26]. Naopak indukce apoptózy po expozici Prima-1 nebo APR-246 nebyla zjištěna u nemalobuněčného karcinomu plic (non-small-cell lung cancer – NSCLC) [27], rakoviny prostaty [28] nebo sarkomu měkkých tkání [29]. V této souvislosti nebyly u p53wt ani p53mut detekovány změny buněčného cyklu [27,28], přítomnost apoptotických tělísek [28] ani nedocházelo ke štěpení PARP [27,29], které by jinak poukazovalo na aktivaci apoptotických mechanizmů. U nádorových linií sarkomu měkkých tkání bylo zjištěno, že APR-246 aktivuje signální dráhu JNK [29] a tím spouští apoptózu v závislosti na mutantním stavu p53 u buněčných linií odvozených od nádorů tlustého střeva [30]. V protikladu k těmto studiím bylo ovšem také publikováno, že indukce apoptózy je podmíněná inhibicí signální dráhy JNK u linií odvozených od nádorů prsu [31]. Rozdílné výsledky tedy upozorňují na nejasnosti v mechanizmu účinku Prima-1 i APR-246 a poukazují na možnou přítomnost dalších elementů či mechanizmů, které by mohly ovlivňovat jejich cytotoxickou aktivitu.
Procesy indukované Prima-1 nebo APR-246 nezávislé na přítomnosti p53mut
Jak bylo zmíněno výše, cytotoxicita APR-246 i Prima-1 se může projevit bez ohledu na přítomnost p53mut. Mimo reaktivaci p53mut mají Prima-1 i APR-246 schopnost aktivovat procesy vedoucí k indukci apoptózy, které jsou však na p53 proteinu nezávislé (schéma 1). APR-246 je inhibitorem thioredoxin reduktázy (TrxR1), enzymu katalyzujícího redukci thioredoxinu. MQ se váže na selenocysteiny obsažené ve struktuře TrxR1, čímž mění jeho funkci z reduktázy na NADPH oxidázu vedoucí ke zvýšené produkci reaktivních forem kyslíku (reactive oxygen species – ROS) a tím k indukci apoptózy [23]. Inaktivace TrxR1 může být podpořená společným použitím APR-246 a inhibitorů PARP-1 [32]. MQ se také může vázat na cysteiny glutationu a tím snížit jeho intracelulární hladinu a podpořit vznik ROS [33]. Zvýšená hladina ROS následně indukuje autofagii, jak bylo prokázáno u nádorových buněk exprimujících p53mut i p53wt [34]. Dále bylo zjištěno, že p53 vykazuje modulační efekt na autofagii vyvolanou Prima-1 u buněk s p53wt. Prima-1 omezuje autofagii, zatímco v přítomnosti p53mut autofagii spouští a podporuje [34]. Proteomická analýza navíc ukázala, že kromě proteinů vnitřní mitochondriální apoptotické dráhy jsou do mechanizmu působení Prima-1 zapojeny také proteiny anaerobní glykolýzy [35], které naopak můžou napomáhat nádorovým buňkám bránit se apoptotickým signálům.

Dalším mechanizmem přispívajícím k cytotoxicitě Prima-1 je stres endoplazmatického retikula, tzv. UPR (unfolded protein response) (schéma 1). K aktivaci UPR dochází při kumulaci chybně sbalených proteinů. Buňka se snaží obnovit normální stav tím, že degraduje tyto proteiny a zároveň zvyšuje expresi molekulárních chaperonů. V případě selhání těchto regulačních mechanizmů je spuštěna apoptóza. Prima-1 zvyšuje expresi chaperonů, a to zejména proteinů teplotního šoku Hsp70 [24] a Hsp90 [17]. Zvyšuje expresi CHOP [24], který spouští apoptózu indukovanou UPR [36]. Navíc bylo potvrzeno, že deplece CHOP výrazně snižuje cytotoxicitu Prima-1 [24].
Přestože je APR-246 nejčastěji zmiňovaná v souvislosti s reaktivací p53, její efekt byl prokázán rovněž u ostatních členů proteinové rodiny p53 (p63 a p73). Proteiny rodiny p53 sdílejí stejnou organizační strukturu zahrnující N-terminální transaktivační doménu, DNA-vazebnou doménu a C-terminální oligomerizační doménu. Díky částečné homologii v oligomerizační doméně mohou tvořit heterotetramery a vysoká homologie v DNA-vazebné doméně indikuje jejich schopnost vázat se také na stejné cílové geny. Všechny geny kódující proteiny rodiny p53 exprimují řadu izoforem. Díky existenci alternativních promotorů či počátků translace vznikají N-koncově zkrácené izoformy, díky různým místům sestřihu pak C-koncově zkrácené izoformy. N-koncově nezkrácené izoformy TAp63 a TAp73 pak vykazují největší homologii s p53 a rovněž se uplatňují v indukci apoptózy a zástavě buněčného cyklu [37]. Na rozdíl od TP53 hrají TP63 a TP73 roli zejména v ontogenezi a v nádorech jsou mutovány jen velmi zřídka [38]. Mutace v TP63 jsou např. hlavní příčinou EEC (ectrodactyly-ectodermal dysplasia-clefting) syndromu, charakteristického ektrodaktylií, ektodermální dysplazií a rozštěpy rtu nebo patra. APR-246 je schopná reaktivovat R240W a R304W mutantní formy TAp63γ, které odpovídají hot-spot mutacím R175H a R273H p53, a to u keratinocytů [39] a také u indukovaných pluripotentních buněk pacientů s EEC syndromem [40]. Dále bylo zjištěno, že APR-246 je schopná obnovit pro-apoptotickou funkci mutantních forem TAp63γ a TAp73β u nádorových buněk [41]. APR-246 může navíc indukovat p73-dependentní apoptózu bez ohledu na mutaci p53 [42].
Cytotoxicita a terapeutické využití Prima-1 a APR-246
Distribuce látky do jednotlivých orgánů byla testována pomocí intravenózní aplikace radioaktivně značené Prima-1. Bylo zjištěno, že Prima-1 není schopná překonávat hemoencefalickou bariéru, akumuluje se ale v ledvinách a je vylučována močí [43].
Prima-1 i APR-246 byly testovány u řady lidských malignit a cytotoxický účinek se lišil v závislosti na použité nádorové linii či nádoru (IC50 v rozmezí 0,75–200 µl) [44]. Rozdílná cytotoxicita APR-246 byla pozorovaná u buněčných linií nesoucích stejnou mutaci v p53, ale i u vzorků získaných ze stejného nádoru, ale v různých fázích histopatologické diferenciace (odlišný „grading“) [18]. Cytotoxický účinek APR-246 se neprojevil u vzorků získaných od pacientů s chronickou B lymfocytární leukemií (B CLL) nesoucích hemizygotní delece v TP53 [45]. Omezený nebo téměř žádný cytotoxický efekt Prima-1 nebyl pozorován u nenádorových buněk krve [42,45] a fibroblastů [11,46].
Cytotoxická aktivita APR-246 byla testovaná in vitro a ex vivo v rámci mnoha studií, a to samostatně nebo v kombinaci s běžně používanými cytostatiky. V léčbě řady karcinomů se uplatňují sloučeniny platiny, které vytvářejí kovalentní vazby s purinovými bázemi v DNA, čímž omezují její replikaci a aktivují signální dráhu p53. Bylo zjištěno, že APR-246 obnovuje citlivost k cisplatině u buněk získaných z high-grade serózních ovariálních (HGSO) karcinomů nesoucích rezistenci k cisplatině [47,48]. Synergický efekt APR-246 a cisplatiny byl pozorován u nádorových buněk získaných z ascitu HGSO karcinomů nesoucích v DNA-vazebné doméně mutaci v p53 měnící smysl kodonu, ale i u vzorků nesoucích p53wt nebo zkrácenou formu p53 [48]. Synergický efekt Prima-1 anebo APR-246 s cisplatinou byl dále zjištěn u buněčných linií kolorektalního karcinomu [11], adenokarcinomu plic [11], karcinomu hlavy a krku [46] a karcinomu slinivky břišní [49]. Na xenogenním modelu in vivo karcinomu plic [7], jícnu [22] a vaječníku [47] byl také potvrzen synergický účinek Prima-1 nebo APR-246 a cisplatiny. Další látkou znemožňující replikaci DNA vazbou na oba řetězce (interkalací) nebo inhibicí topoizomerázy II je doxorubicin. Synergický efekt s Prima-1 nebo APR-246 in vitro a ex vivo byl pozorován u karcinomu vaječníku [47,48], štítné žlázy [50], slinivky břišní [49], prsu [17] a mnohočetného myelomu [42]. V současné době je APR-246 testovaná v kombinaci s karboplatinou a pegylovaným lipozomálním doxorubicinem v klinické studii fáze Ib/II u HGSO karcinomu (NCT02098343, NCT03268382). V klinické studii NCT0299989 fáze Ib/II je APR-246 testovaná v kombinaci s cisplatinou a 5-fluorouracilem při léčbě pokročilého a metastazujícího karcinomu jícnu s mutací v p53.
Další látkou testovanou v kombinaci s APR-246 je olaparib, který se řadí do skupiny inhibitorů PARP regulujících reparaci poškozené DNA. Vyřazením mechanizmu opravy dochází ke zvýšení citlivosti nádorových buněk k léčbě. Silný synergický efekt s APR-246 byl pozorován u NSCLC, a to bez ohledu na přítomnost mutace v p53 [51]. APR-246 navíc zvýšila citlivost k olaparibu u buněk s p53mut, které byly k olaparibu rezistentní [51]. Synergický efekt s olaparibem byl pozorován i u prsních nádorových linií s p53mut [52].
p53mut se příliš často nevyskytuje v kožních nádorech (cca v 17 %) a pravděpodobně nehraje výraznější roli při rozvoji maligního melanomu (MM). Přesto byl zjištěn synergický efekt u kombinovaného použití APR-246 a vemurafenibu. Vemurafenib je specifický inhibitor mutace BRAFV600E, která má za následek zvýšení aktivity BRAF kinázy vedoucí k nekontrolovanému buněčnému růstu [53]. K mutaci BRAF dochází přibližně u 50 % kožních melanomů, z nichž právě mutace V600E je nejčastější [54]. Pokud není gen BRAF mutovaný, není ani vemurafenib účinný. APR-246 v kombinaci s vemurafenibem potlačuje přirozenou i získanou rezistenci k tomuto léčivu. APR-246 zvyšuje citlivost nádorových buněk k vemurafenibu bez ohledu na přítomnost mutace v p53, což bylo potvrzeno u buněk MM nesoucích BRAFV600E, v 3D kultuře, ale i na xenogenním modelu in vivo [26,55]. Dalším kompetitivním inhibitorem mutace BRAF, který selektivně inhibuje kinázu BRAFV600E, je dabrafenib. V současné době probíhá klinická studie NCT03391050 fáze Ib/II, jejímž cílem je posoudit bezpečnost a léčebné účinky APR-246 v kombinaci s dabrafenibem u pacientů s neresekovatelným a/nebo metastazujícím melanomem s pozitivní mutací BRAF.
Kombinovaný účinek byl testován u APR-246 a bortezomibu. Jedná se o inhibitor proteazomu, ve kterém dochází k odbourávání nepotřebných proteinů. Inhibicí proteazomu dochází k omezení proteolýzy proteinů podílejících se na regulaci buněčného cyklu a apoptózy. Kombinovaný účinek obou látek byl prokázán u mnohočetného myelomu bez závislosti na přítomnosti mutace v p53 [24].
V první ukončené klinické studii (NCT00900614) byla APR-246 podávána v monoterapii s eskalací dávky pacientům s hematologickými malignitami (n = 15) a pacientům s karcinomem prostaty (n = 7), tedy typem solidního nádoru s vysokým zastoupením p53mut. Studie prokázala klinicky dobrou toleranci k léku a příznivý farmakokinetický profil. Maximální tolerovaná dávka byla stanovená na 60 mg/kg. Vedlejší negativní účinek toxicity limitující dávku představovala zvýšená aktivita jaterních transamináz ALT/AST, která u jednoho pacienta dosahovala stupně 3–4. Nejčastějšími limitujícími toxickými účinky pak byly poruchy centrální nervové soustavy jako únava, dezorientace, závrať a bolest hlavy dosahující stupně 1 nebo 2. K projevům docházelo již v průběhu či krátce po infuzi, ale poruchy se jevily jako reverzibilní. Farmakokinetika látky vykazovala rozdíly mezi jednotlivými pacienty a nebyla závislá na dávce ani čase, biologický poločas rozpadu (t1/2) byl stanoven na 4–5 hod [56].
Poslední probíhající klinická studie NCT03072043 fáze Ib/II je zaměřená na léčebné účinky APR-246 v kombinaci s azacitidinem. Cílem je zjistit, zda tato kombinovaná terapie zlepšuje celkové přežití pacientů s hematologickými maligními onemocněními, jako jsou akutní a chronická myeloidní leukemie, myelodysplastický syndrom a myeloproliferativní choroby.
APR-246 byla také testovaná v kombinaci s radioterapií. Bylo zjištěno, že záření senzitizuje nádorové buněčné linie prostaty nesoucí p53mut a linie s deletovaným p53. Žádný účinek neměla APR-246 v kombinaci se zářením na nádorové linie nesoucí p53wt a na lidských fibroblastech [28].
Závěr
Prima-1 a APR-246 jsou látky vykazující protinádorový účinek u řady nádorových onemocnění. Hlavním mechanizmem účinku v buňce je indukce apoptózy. Obě látky zvyšují expresi genů zapojených do kontroly buněčného cyklu a apoptózy v nádorových buňkách nesoucích p53mut i p53wt. V posledních letech se ukazuje, že mohou účinně indukovat procesy, které jsou na aktivitě p53 nezávislé, čímž se rozšiřují možnosti jejich klinického využití. Cytotoxická aktivita látek byla testovaná in vitro u řady nádorových linií a na xenogenních modelech in vivo, a to v monoterapii nebo v kombinaci s běžně používanými cytostatiky. V kombinaci s jinými léčivy byl velmi často zjištěn synergický účinek. Látky navíc zvyšují citlivost nádorových buněk k danému cytostatiku, dokonce napomáhají překlenout rezistenci k použitému léčivu, jejíž vznik velmi často přispívá k selhání protinádorové léčby. V kombinaci s chemoterapií či ionizujícím zářením by obě tyto látky v budoucnosti mohly nabídnout nové možnosti pro léčbu agresivnějších typů nádoru.
Práce byla podpořena projektem MŠMT – NPU I – LO1413.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Pavlína Zatloukalová, Ph.D.
Regionální centrum aplikované molekulární onkologie
Masarykův onkologický ústav
Žlutý kopec 7 656 53 Brno
e-mail: pavlina.zatloukalova@mou.cz
Přijato: 16. 07. 2018
Sources
1. Kandoth C, McLellan MD, Vandin F et al. Mutational landscape and significance across 12 major cancer types. Nature 2013; 502 (7471): 333–339. doi: 10.1038/nature12634.
2. Duffy MJ, Synnott NC, Crown J. Mutant p53 as a target for cancer treatment. Eur J Cancer 2017; 83 : 258–265. doi: 10.1016/j.ejca.2017.06.023.
3. Bieging KT, Mello SS, Attardi LD. Unravelling mechanisms of p53-mediated tumour suppression. Nat Rev Cancer 2014; 14 (5): 359–370. doi: 10.1038/nrc3711.
4. Selivanova G, Wiman KG. Reactivation of mutant p53: molecular mechanisms and therapeutic potential. Oncogene 2007; 26 (15): 2243–2254. doi: 10.1038/sj.onc.1210295.
5. Lane DP. Cancer. p53, guardian of the genome. Nature 1992; 358 (6381): 15–16. doi: 10.1038/358015a0.
6. Brosh R, Rotter V. When mutants gain new powers: news from the mutant p53 field. Nat Rev Cancer 2009; 9 (10): 701–713. doi: 10.1038/nrc2693.
7. Bykov VJ, Issaeva N, Zache N et al. Reactivation of mutant p53 and induction of apoptosis in human tumor cells by maleimide analogs. J Biol Chem 2005; 280 (34): 30384–30391. doi: 10.1074/jbc.M501664200.
8. Luu Y, Bush J, Cheung KJ Jr et al. The p53 stabilizing compound CP-31398 induces apoptosis by activating the intrinsic Bax/mitochondrial/caspase-9 pathway. Exp Cell Res 2002; 276 (2): 214–222. doi: 10.1006/excr.2002.5526.
9. Boeckler FM, Joerger AC, Jaggi G et al. Targeted rescue of a destabilized mutant of p53 by an in silico screened drug. Proc Natl Acad Sci U S A 2008; 105 (30): 10360–10365. doi: 10.1073/pnas.0805326105.
10. Bykov VJ, Issaeva N, Selivanova G et al. Mutant p53-dependent growth suppression distinguishes PRIMA-1 from known anticancer drugs: a statistical analysis of information in the National Cancer Institute database. Carcinogenesis 2002; 23 (12): 2011–2018.
11. Bykov VJ, Zache N, Stridh H et al. PRIMA-1 (MET) synergizes with cisplatin to induce tumor cell apoptosis. Oncogene 2005; 24 (21): 3484–3491. doi: 10.1038/sj.onc.1208419.
12. Bykov VJ, Issaeva N, Shilov A et al. Restoration of the tumor suppressor function to mutant p53 by a low-molecular-weight compound. Nat Med 2002; 8 (3): 282–288. doi: 10.1038/nm0302-282.
13. Lambert JM, Gorzov P, Veprintsev DB et al. PRIMA-1 reactivates mutant p53 by covalent binding to the core domain. Cancer Cell 2009; 15 (5): 376–388. doi: 10.1016/j.ccr.2009.03.003.
14. Wassman CD, Baronio R, Demir Ö et al. Computational identification of a transiently open L1/S3 pocket for reactivation of mutant p53. Nat Commun 2013; 4 : 1407. doi: 10.1038/ncomms2361.
15. Kaar JL, Basse N, Joerger AC et al. Stabilization of mutant p53 via alkylation of cysteines and effects on DNA binding. Protein Sci 2010; 19 (12): 2267–2278. doi: 10.1002/pro.507.
16. Zhang Q, Bykov VJN, Wiman KG et al. APR-246 reactivates mutant p53 by targeting cysteines 124 and 277. Cell Death Dis 2018; 9 (5): 439. doi: 10.1038/s41419-018-0463-7.
17. Rehman A, Chahal MS, Tang X et al. Proteomic identification of heat shock protein 90 as a candidate target for p53 mutation reactivation by PRIMA-1 in breast cancer cells. Breast Cancer Res 2005; 7 (5): R765–R774. doi: 10.1186/bcr1290.
18. Aryee DN, Niedan S, Ban J et al. Variability in functional p53 reactivation by PRIMA-1 (Met) /APR-246 in Ewing sarcoma. Br J Cancer 2013; 109 (10): 2696–2704. doi: 10.1038/bjc.2013.635.
19. Lambert JM, Moshfegh A, Hainaut P et al. Mutant p53 reactivation by PRIMA-1MET induces multiple signaling pathways converging on apoptosis. Oncogene 2010; 29 (9): 1329–1338. doi: 10.1038/onc.2009.425.
20. Zandi R, Selivanova G, Christensen CL et al. PRIMA-1Met/APR-246 induces apoptosis and tumor growth delay in small cell lung cancer expressing mutant p53. Clin Cancer Res 2011; 17 (9): 2830–2841. doi: 10.1158/1078-0432.CCR-10-3168.
21. Bykov VJN, Eriksson SE, Bianchi J et al. Targeting mutant p53 for efficient cancer therapy. Nat Rev Cancer 2018; 18 (2): 89–102. doi: 10.1038/nrc.2017.109.
22. Liu DS, Read M, Cullinane C et al. APR-246 potently inhibits tumour growth and overcomes chemoresistance in preclinical models of oesophageal adenocarcinoma. Gut 2015; 64 (10): 1506–1516. doi: 10.1136/gutjnl-2015-309770.
23. Peng X, Zhang MQ, Conserva F et al. APR-246/PRIMA-1MET inhibits thioredoxin reductase 1 and converts the enzyme to a dedicated NADPH oxidase. Cell Death Dis 2013; 4: e881. doi: 10.1038/cddis.2013.417.
24. Teoh PJ, Bi C, Sintosebastian C et al. PRIMA-1 targets the vulnerability of multiple myeloma of deregulated protein homeostasis through the perturbation of ER stress via p73 demethylation. Oncotarget 2016; 7 (38): 61806–61819. doi: 10.18632/oncotarget.11241.
25. Shen J, Vakifahmetoglu H, Stridh H et al. PRIMA-1MET induces mitochondrial apoptosis through activation of caspase-2. Oncogene 2008; 27 (51): 6571–6580. doi: 10.1038/onc.2008.249.
26. Bao W, Chen M, Zhao X et al. PRIMA-1Met/APR-246 induces wild-type p53-dependent suppression of malignant melanoma tumor growth in 3D culture and in vivo. Cell Cycle 2011; 10 (2): 301–307. doi: 10.4161/cc.10.2.14538.
27. Magrini R, Russo D, Ottaggio L et al. PRIMA-1 synergizes with adriamycin to induce cell death in non-small cell lung cancer cells. J Cell Biochem 2008; 104 (6): 2363–2373. doi: 10.1002/jcb.21794.
28. Supiot S, Zhao H, Wiman K et al. PRIMA-1 (met) radiosensitizes prostate cancer cells independent of their MTp53-status. Radiother Oncol 2008; 86 (3): 407–411. doi: 10.1016/j.radonc.2008.01.001.
29. Grellety T, Laroche-Clary A, Chaire V et al. PRIMA-1 (MET) induces death in soft-tissue sarcomas cell independent of p53. BMC Cancer 2015; 15 : 684. doi: 10.1186/s12885-015-1667-1.
30. Li Y, Mao Y, Brandt-Rauf PW et al. Selective induction of apoptosis in mutant p53 premalignant and malignant cancer cells by PRIMA-1 through the c-Jun-NH2-kinase pathway. Mol Cancer Ther 2005; 4 (6): 901–909. doi: 10.1158/1535-7163.MCT-04-0206.
31. Wang T, Lee K, Rehman A et al. PRIMA-1 induces apoptosis by inhibiting JNK signaling but promoting the activation of Bax. Biochem Biophys Res Commun 2007; 352 (1): 203–212. doi: 10.1016/j.bbrc.2006.11.006.
32. Yin ZX, Hang W, Liu G et al. PARP-1 inhibitors sensitize HNSCC cells to APR-246 by inactivation of thioredoxin reductase 1 (TrxR1) and promotion of ROS accumulation. Oncotarget 2018; 9 (2): 1885–1897. doi: 10.18632/oncotarget.21277.
33. Tessoulin B, Descamps G, Moreau P et al. PRIMA-1Met induces myeloma cell death independent of p53 by impairing the GSH/ROS balance. Blood 2014; 124 (10): 1626–1636. doi: 10.1182/blood-2014-01-548800.
34. Russo D, Ottaggio L, Foggetti G et al. PRIMA-1 induces autophagy in cancer cells carrying mutant or wild type p53. Biochim Biophys Acta 2013; 1833 (8): 1904–1913. doi: 10.1016/j.bbamcr.2013.03.020.
35. Lee K, Wang T, Paszczynski AJ et al. Expression proteomics to p53 mutation reactivation with PRIMA-1 in breast cancer cells. Biochem Biophys Res Commun 2006; 349 (3): 1117–1124. doi: 10.1016/j.bbrc.2006.08.152.
36. Wang XZ, Lawson B, Brewer JW et al. Signals from the stressed endoplasmic reticulum induce C/EBP-homologous protein (CHOP/GADD153). Mol Cell Biol 1996; 16 (8): 4273–4280.
37. Murray-Zmijewski F, Lane DP, Bourdon JC. p53/ p63/p73 isoforms: an orchestra of isoforms to harmonise cell differentiation and response to stress. Cell Death Differ 2006; 13 (6): 962–972. doi: 10.1038/sj.cdd.4401914.
38. Orzol P, Holcakova J, Nekulova M et al. The diverse oncogenic and tumour suppressor roles of p63 and p73 in cancer: a review by cancer site. Histol Histopathol 2015; 30 (5): 503–521. doi: 10.14670/HH-30.503.
39. Shen J, van den Bogaard EH, Kouwenhoven EN et al. APR-246/PRIMA-1 (MET) rescues epidermal differentiation in skin keratinocytes derived from EEC syndrome patients with p63 mutations. Proc Natl Acad Sci U S A 2013; 110 (6): 2157–2162. doi: 10.1073/pnas.1201993110.
40. Shalom-Feuerstein R, Serror L, Aberdam E et al. Impaired epithelial differentiation of induced pluripotent stem cells from ectodermal dysplasia-related patients is rescued by the small compound APR-246/PRIMA-1MET. Proc Natl Acad Sci U S A 2013; 110 (6): 2152–2156. doi: 10.1073/pnas.1201753109.
41. Rökaeus N, Shen J, Eckhardt I et al. PRIMA-1 (MET) /APR-246 targets mutant forms of p53 family members p63 and p73. Oncogene 2010; 29 (49): 6442–6451. doi: 10.1038/onc.2010.382.
42. Saha MN, Jiang H, Yang Y et al. PRIMA-1Met/APR-246 displays high antitumor activity in multiple myeloma by induction of p73 and Noxa. Mol Cancer Ther 2013; 12 (11): 2331–2341. doi: 10.1158/1535-7163.MCT-12-1166.
43. Lambert JM, Gorzov P, Veprintsev DB et al. PRIMA-1 reactivates mutant p53 by covalent binding to the core domain. Cancer Cell 2009; 15 (5): 376–388. doi: 10.1016/j.ccr.2009.03.003.
44. Perdrix A, Najem A, Saussez S et al. PRIMA-1 and PRIMA-1 (Met) (APR-246): from mutant/wild type p53 reactivation to unexpected mechanisms underlying their potent anti-tumor effect in combinatorial therapies. Cancers (Basel) 2017; 9 (12): pii: E172. doi: 10.3390/cancers9120172.
45. Nahi H, Lehmann S, Mollgard L et al. Effects of PRIMA-1 on chronic lymphocytic leukaemia cells with and without hemizygous p53 deletion. Br J Haematol 2004; 127 (3): 285–291. doi: 10.1111/j.1365-2141.2004.05210.x.
46. Roh JL, Kang SK, Minn I et al. p53-Reactivating small molecules induce apoptosis and enhance chemotherapeutic cytotoxicity in head and neck squamous cell carcinoma. Oral Oncol 2011; 47 (1): 8–15. doi: 10.1016/j.oraloncology.2010.10.011.
47. Mohell N, Alfredsson J, Fransson A et al. APR-246 overcomes resistance to cisplatin and doxorubicin in ovarian cancer cells. Cell Death Dis 2015; 6: e1794. doi: 10.1038/cddis.2015.143.
48. Fransson A, Glaessgen D, Alfredsson J et al. Strong synergy with APR-246 and DNA-damaging drugs in primary cancer cells from patients with TP53 mutant high-grade serous ovarian cancer. J Ovarian Res 2016; 9 (1): 27. doi: 10.1186/s13048-016-0239-6.
49. Izetti P, Hautefeuille A, Abujamra AL et al. PRIMA-1, a mutant p53 reactivator, induces apoptosis and enhances chemotherapeutic cytotoxicity in pancreatic cancer cell lines. Invest New Drugs 2014; 32 (5): 783–794. doi: 10.1007/s10637-014-0090-9.
50. Messina RL, Sanfilippo M, Vella V et al. Reactivation of p53 mutants by prima-1 [corrected] in thyroid cancer cells. Int J Cancer 2012; 130 (10): 2259–2270. doi: 10.1002/ijc.26228.
51. Deben C, Lardon F, Wouters A et al. APR-246 (PRIMA-1 (MET)) strongly synergizes with AZD2281 (olaparib) induced PARP inhibition to induce apoptosis in non-small cell lung cancer cell lines. Cancer Lett 2016; 375 (2): 313–322. doi: 10.1016/j.canlet.2016.03. 017.
52. Synnott NC, Murray A, McGowan PM et al. Mutant p53: a novel target for the treatment of patients with triple-negative breast cancer? Int J Cancer 2017; 140 (1): 234–246. doi: 10.1002/ijc.30425.
53. Arenbergerova M, Puzanov I. BRAF mutation: a novel approach in targeted melanoma therapy. Klin Onkol 2012; 25 (5): 323–328.
54. Davies H, Bignell GR, Cox C et al. Mutations of the BRAF gene in human cancer. Nature 2002; 417 (6892): 949–954. doi: 10.1038/nature00766.
55. Krayem M, Journe F, Wiedig M et al. p53 Reactivation by PRIMA-1 (Met) (APR-246) sensitises (V600E/K) BRAF melanoma to vemurafenib. Eur J Cancer 2016; 55 : 98–110. doi: 10.1016/j.ejca.2015.12.002.
56. Lehmann S, Bykov VJ, Ali D et al. Targeting p53 in vivo: a first-in-human study with p53-targeting compound APR-246 in refractory hematologic malignancies and prostate cancer. J Clin Oncol 2012; 30 (29): 3633–3639. doi: 10.1200/JCO.2011.40.7783.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2018 Issue Supplementum 2
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- Variabilita buněčné populace solidních nádorů a její význam pro diagnostiku a terapii nádorových onemocnění
- Využití mitochondriálních procesů v cílené terapii nádorových onemocnění
- Ferroptóza jako nový typ buněčné smrti a její role v léčbě rakoviny
- Možnosti využití p63 v bioptické diagnostice
- Význam membránových proteinů v léčbě nádorových onemocnění a možnosti jejich dalšího studia
- Vliv metylace DNA na vznik nádorových onemocnění
- Úloha proteinu HSP70 v nádorech a jeho využití jako terapeutický cíl
- Úloha proteínu HSF1 v nádorovej transformácii
- Proteíny HDM2 a HDMX v ľudských nádoroch
- Prima-1 a APR-246 v léčbě nádorových onemocnění
- Acetylsalicylová kyselina a její potenciál v chemoprevenci kolorektálního karcinomu
- Exprese a funkční charakterizace miR-34c u karcinomu děložního hrdla
- Současné metody analýzy mikroRNA
- Proteogenomická platforma na identifikáciu nádorovo špecifických antigénov
- Subpopulace cirkulujících myeloidních supresových buněk u pacientů s kolorektálním karcinomem – explorativní analýza jejich potenciálu jako biomarkeru
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Vliv metylace DNA na vznik nádorových onemocnění
- Ferroptóza jako nový typ buněčné smrti a její role v léčbě rakoviny
- Možnosti využití p63 v bioptické diagnostice
- Současné metody analýzy mikroRNA
