Proteogenomická platforma na identifikáciu nádorovo špecifických antigénov
Proteogenomic Platform for Identification of Tumor Specific Antigens
Background:
Although immune responses to “cancer neoantigens” have been known for decades, the first neoantigen vaccines emerged only very recently. Current developments in genomics and proteomics have enabled descriptions of tumor mutational landscapes, and the immunogenicity of corresponding neoantigens can now be predicted either in silico or in vitro. Cancer regression could be achieved via a combination of neoantigen vaccination and an appropriate immunology approach. Research in model organisms and the results of initial clinical trials of neoantigen vaccines have shown them to be effective.
Purpose:
We aim to emphasize the importance of neoantigen vaccines in personalized cancer treatment and describe their preparation. We summarize mutations leading to expression of an immunogenic antigen necessary for vaccine development. The processes leading to activation of T-cell anticancer immunity in a patient are briefly introduced. We especially focus on the identification of high confidence neoantigens by next-generation sequencing (NGS) and mass spectrometry (MS), which is key element in the process of designing neoantigen vaccines. Briefly, we describe a proteogenomic platform for confident identification of mutant peptides in biological material. We mention the possibility of neoantigen quantification in biological material using mass spectrometry such as SRM (selected reaction monitoring) and SWATH (sequential windowed acquisition of all theoretical fragment ion spectra). Successful clinical studies demonstrating the potential of neoantigen vaccination in personalized cancer treatment are summarized at the end of the paper.
Key words:
vaccination – mass spectrometry – neoplasms – organ-specific neoantigen
This work was supported by the project MEYS – NPS I – LO1413.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Accepted: 9. 7. 2018
Authors:
Faktor Jakub; Hernychová Lenka; Vojtěšek Bořivoj; Hupp Theodore
Authors‘ workplace:
Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno
Published in:
Klin Onkol 2018; 31(Supplementum 2): 102-107
Category:
Review
doi:
https://doi.org/10.14735/amko20182S102
Overview
Východiská:
Potenciál neoantigénov v indukcii protinádorovej imunitnej odpovede je už desaťročia známy, avšak prvé neoantigénové vakcíny boli vyvinuté len nedávno. Rozvoj genomických a proteomických metód umožnil popis somatických mutácií v nádore a imunogénnosť korešpondujúcich neoantigénov môže byť predpovedaná in silico prípadne in vitro. Kombinácia neoantigénovej vakcinácie so správnym imunologickým postupom umožňuje docieliť regresiu nádoru. Štúdie neoantigénových vakcín na modelových organizmoch dokazujú vysokú účinnosť postupu a dokonca prvé klinické štúdie zaznamenávajú úspech.
Cieľ:
Cieľom je priblížiť význam neoantigénových vakcín v personalizovanej protinádorovej liečbe a objasniť mechanizmus ich prípravy. Článok popisuje typy mutácií s potenciálom expresie imunogénnych neoantigénov nutných pre tvorbu efektívnej vakcíny a približuje aj ostatné procesy nutné k aktivácii T bunkovej protinádorovej odpovede pacienta. Predovšetkým je zameraný na identifikáciu vysokopravdepodobných neoantigénových sekvencií aplikáciou metód sekvenovania novej generácie a hmotnostnej spektrometrie (mass spectrometry – MS), čo je pre tvorbu vakcíny kľúčové. V článku je popísaný princíp proteogenomickej platformy, ktorá vznikla na našom pracovisku za účelom konfidentnej identifikácie mutantných peptidov v biologickom materiáli. Zmieňuje sa aj o možnosti kvantifikácie neoantigénov MS metódami monitorovania vybraných reakcií (selected reaction monitoring – SRM) a SWATH (sequential windowed acquisition of all theoretical fragment ion spectra). Potenciál neoantigénovej vakcinácie v protinádorovej terapii dokazujú úspešné klinické štúdie zhrnuté v závere článku.
Kľúčové slová:
vakcinácia – hmotnostná spektrometria – neoplazmy – antigény – peptidy
Úvod
V súčasnosti sa voľba protinádorovej terapie zakladá prevažne na výsledkoch histopatologického vyšetrenia, symptómoch ochorenia a na informáciach o predošlej liečbe pacienta. Dnešné terapeutické postupy sú príliš generalizované a použité liečivá pôsobia nešpecificky, čo vedie k vedľajším účinkom a k nedostatočnej terapeutickej účinnosti. Výsledkom je nízky benefit pacienta z liečby, nízka kvalita života pacienta a pomerne krátka doba prežívania. S príchodom omics metód došlo ku kvalitnejšej charakterizácii nádorov na úrovni genómu, proteómu a metabolómu [1]. Molekulárne-biologická charakterizácia odhalila mnohé nové nádorové markery a terapeutické ciele, ktoré lepšie stratifikujú pacientov a umožňujú cielenie liečby. Detailná charakteristika nádoru pomáha lekárom zvoliť lepší liečebný postup, prípadne aplikovať postup presne „šitý na mieru“. K ďalšiemu rozvoju personalizovaných liečebných postupov by mohla výrazne prispieť kombinácia štandardných terapeutických postupov, molekulárnej diagnostiky a imunoterapie.
Začiatky imunoterapie siahajú až do 19. storočia, keď v roku 1891 americký chirurg W. B. Coley zacielil imunitný systém proti inoperabilnému nádoru (sar-kóm) injekciou živej streptokokovej kultúry priamo do nádorového tkaniva [2]. Niekoľko desaťročí neskôr bola na myších modeloch objavená a popísaná protinádorová imunita [3]. Pre lepšie pochopenie nádorovo špecifických imunitných odpovedí bol kľúčový objav dendritických buniek potencujúcich T bunky [4] a charakterizácia hlavného histokompatibilitného komplexu (major histocompatibility complex – MHC) molekúl prezentujúcich antigény [5]. Následne bolo dokázané, že myši, ale aj ľudský imunitný systém špecificky reagujú na nádorové antigény pomocou T buniek, ktoré sa radia medzi tumor infiltrujúce lymfocyty (TIL) [6,7]. Ďalším podstatným objavom pre tvorbu efektívnych liečebných postupov šitých na mieru bol objav imunogenicity neoantigénov produkovaných dôsledkom expresie génov so somatickou mutáciou alebo transláciou vírusových génov [8]. Využitie vírusových antigénov pre imunoterapiu je limitované na nádory vzniknuté vírusovou infekciou. Neoantigény vznikajúce zo somatických mutácií sú výsledkom genetickej nestability a transformácie nádorov. Preto sa predpokladá ich širšie využitie v protinádorovej terapii. Neoantigény sú v súčasnosti pravdepodobne najzaujímavejším cieľom modernej imunoterapie, najmä kvôli tomu, že imunitný systém si voči nim nevytvára toleranciu [9].
Tumor špecifické neoantigény
Imunoterapia cielená na vlastné antigény s charakteristicky zvýšenou expresiou v nádorovom tkanive sa ukazuje ako neefektívna a úspešnosť tohto prístupu je zriedkavá [9,10]. Vlastné antigény sú prítomné aj v zdravom tkanive, majú nízku imunogénnosť a imunitný systém má voči nim zvýšenú toleranciu, zatiaľ čo neoantigény sú nádorovo špecifické a pravdepodobne imunogénne. Najčastejšie vznikajú jednonukleotidovými variáciami (single nucleotide variants – SNV), ktoré vedú k zámene jednej aminokyseliny v sekvencii proteínu. Ich imunogénnosť je zaručená kontaktom mutovanej časti sekvencie s T bunkou. Mutácia sa však môže vyskytnúť aj v mieste ukotvenia na MHC molekulu, čo môže ovplyvniť prezentáciu wild type antigénov [11,12]. SNV sú často jedinečné pre pacienta, no môžu poslúžiť aj na tvorbu terapeutických postupov pre väčšie kohorty pacientov, pokiaľ sa často opakujú.
Inzercie a delécie spôsobujúce posun čítacieho rámca sú ďalším bohatým zdrojom neoantigénov. Posun čítacieho rámca je spôsobený zaradením alebo vymazaním nukleotidu v kódujúcej sekvencii antigénu, pričom transláciou potom vzniká neoantigén s úplne odlišnou sekvenciou v porovnaní s vlastným antigénom. Predpokladá sa vysoká imunogénnosť. Laumont et al vo svojej štúdii dokazujú, že antigény vzniknuté posunom čítacieho rámca alebo transláciou nekódujúcich oblastí sú prezentované molekulami ľudského leukocytového antigénu (human leukocyte antigen – HLA) a môžu vyvolať špecifickú reakciu imunitného systému. Odhaduje sa, že až 10 % peptidov prezentovaných molekulami HLA pochádza z nekódujúcich oblastí genómu alebo z produktov vzniknutých posunom čítacieho rámca [13]. Alternatívne môžu neoantigény vznikať pri translokáciách chromozómov alebo počas peptidového splicingu. Pri translokácii chromozómov dochádza k spojeniu 5’ konca génu s 3’ koncom iného génu a tak vzniká fúzny proteín. Translokácia chromozómov je charakteristická pre sarkómové ochorenia a zabezpečuje nádorovým bunkám nesmrteľnosť. Ukázalo sa, že časť sekvencie novovzniknutého fúzneho proteínu charakteristického pre synoviálny sarkóm sa viaže na HLA molekuly a indukuje cytotoxické T bunky [14]. Peptidový splicing sa typicky odohráva v proteazóme, pričom dochádza k vyštiepeniu segmentu z proteínu a k tvorbe neoantigénu fúziou zvyšných segmentov [15]. Metódami hmotnostnej spektrometrie (mass spectrometry – MS) bol popísaný fúzny peptid zložený z dvoch segmentov sekvencie proteínu SP110 spojených v opačnom poradí. Chromatografickou analýzou eluátu HLA prezentovaných peptidov bolo dokázané, že fúzny peptid je prezentovaný na HLA molekulách a rozpoznávaný CD8+ T bunkami [16].
Identifikácia neoantigénov je komplikovaná a vyžaduje zapojenie MS, kde dochádza k limitácii, pokiaľ nie sú dostupné metódy schopné predpovedať sekvenciu neoantigénu. Výskum imunogénnych ligandov prezentovaných na HLA molekulách vyžaduje kombináciu viacerých analytických techník pre úspešnú identifikáciu a popis ich využiteľnosti pre protinádorovú terapiu.
Identifikácia tumor špecifických neoantigénov
Identifikáciu neoantigénov na genómovej úrovni umožnil rozvoj sekvenovania novej generácie (next generation sequencing – NGS) metód exómového alebo RNA sekvenovania. Úskalia identifikácie neoantigénov metódami NGS spočívajú vo výskyte polymorfizmov, v heterogenite nádoru, v chybách pri sekvenovaní a v analýze dát. Navyše, zostavovanie genómovej sekvencie je komplikované prítomnosťou paralógnych sekvencií, repetíciami, mobilnými elementami (transpozóny), chybami v prepise RNA do cDNA, chybami v referenčnej sekvencii a to môže viesť k identifikácii falošne pozitívnych mutácií v sekvenovanom genóme [17]. NGS metódy prispeli k identifikácii množstva mutácií v rôznych typoch nádorového tkaniva a bolo zistené, že výskyt mutácií v nádorovom tkanive je determinovaný typom nádoru. Všetky identifikované mutácie však nemusia byť prekladané na ribozómoch a nemusia získať podobu neoantigénu. Metódy MS umožňujú výskum na úrovni proteómu a poskytujú priamu informáciu o existencii neoantigénu. Analýza MS dát je však závislá na dostupnosti referenčnej databázy skúmaných proteínov a je temer nemožná bez vedomosti o tom, čo sa vo vzorke hľadá. Práve preto sa kombinácia NGS a MS metód javí ako ideálna. NGS metódy poskytnú referenčnú databázu kandidátnych genómových mutácií a MS metódami sa overí prítomnosť príslušných neoantigénov na proteínovej úrovni.
Výber tumor špecifických neoantigénov vhodných pre protinádorovú terapiu a mechanizmus aktivácie neoantigénovej imunitnej odpovede
Identifikované neoantigény môžu skutočne v bunke vznikať, no nemusia byť imunogénne, pretože nedochádza k ich prezentácii HLA molekulami a k ich rozpoznávaniu T bunkami. Pravdepodobnosť úspešnej prezentácie neoantigénu závisí od afinity a stability komplexu neoantigén – HLA [11]. Afinita neoantigénu k HLA molekule pacienta môže byť predpovedaná in silico a pre tento účel bol v minulosti vyvinutý algoritmus NetMHC [18]. Výsledky in silico predikcie môžu byť nepresné a skreslené, pretože sú založené na výpočtových metódach. Tvorba komplexu neoantigén – HLA môže byť otestovaná aj in vitro. V súčasnosti sú dostupné in vitro testy, ktoré popisujú afinitu a stabilitu komplexu v nanomolárnych koncentráciách a pri fyziologických podmienkach [19]. Testovanie in silico a in vitro stále nie je zárukou výberu imunogénneho neoantigénu. Neoantigény potencujúce protinádorovú imunitnú odpoveď musia byť spracované dendritickými bunkami in vivo a prezentované HLA molekulami na ich povrchu. Tvorba špecifickej protinádorovej imunitnej odpovede je podmienená kontaktom HLA neoantigénového komplexu na povrchu dendritických buniek s T bunkovým receptorom (T-cell receptor – TCR) na povrchu CD4+ a CD8+ T buniek. Po aktivácii T bunky neoantigénom je sila imunitnej odozvy závislá na kostimulácii sprostredkovanej imunostimulačnými cytokínmi (IL-12, IFN-α). Následne, aktivované T bunky musia byť dopravené k tumoru, kde TCR musia špecificky rozoznať HLA neoantigénové komplexy prezentované nádorovými bunkami. Na záver dochádza k lýze rakovinových buniek uvoľnením cytotoxických granulocytov.
Identifikácia a popis HLA prezentovaných neoantigénov potencujúcich imunitný systém pacienta je podstatným krokom k tvorbe efektívnej neoantigénovej vakcíny a k personalizácii liečby. Súčasný rozvoj proteomických metód a metód sekvenovania nukleových kyselín umožnil zacieliť náš výskum na ich identifikáciu vo vzorkách ľudských nádorov.
Proteogenomická platforma na identifikáciu neopeptidov v biologickom materiáli
Proces tvorby neoantigénovej vakcíny potencujúcej protinádorovú imunitnú odpoveď je komplexný a ponúka mnoho možností optimalizácie. Podstatnou časťou tvorby neoantigénovej vakcíny je popis charakteristických mutácií (obr. 1). Genomické metódy nedávajú priamu odpoveď na otázku, či je konečný produkt zodpovedný za aktiváciu T buniek prítomný v nádorovom tkanive. Náš výskum prebiehal na úrovni proteómu, kde sme priamo skúmali prítomnosť a kvantitu efektorovej molekuly – neoantigénu. Proteomická príprava peptidovej vzorky pre MS a MS analýza prebehla podľa publikovaných protokolov [20–22]. V skratke, melanómová bunečná línia A375 bola napestovaná do 80% konfluencie a lyzovananá do 8 M močoviny v 0,1 M Tris-HCl, pH 8,5. Bunečné lyzáty A375 boli spracované podľa protokolu štiepenia proteínov na filtri (filter-aided sample preparation – FASP) a odsolené podľa Bouchala et al [20,21]. K detekcii neoantigénov sme využili základné MS metódy. Identifikácia proteínov prebiehala v dáta dependentnom akvizičnom móde na hmotnostnom spektrometri Triple TOF 5600+ [22]. Problematika MS analýzy neoantigénov spočívala hlavne v nedostupnosti referenčných databáz potrebných na prehľadávanie MS dát. Bežne dostupné referenčné databázy obsahujú sekvencie proteínov vo wild type formách a ich použitie k detekcii mutantných foriem proteínov je limitované. MS metódy sú založené na meraní pomeru hmotnosti k náboju (m/z) a identita mutovaného proteínu nemôže byť z bežnej wild type referenčnej databázy priradená napriek tomu, že mutovaný proteín bol počas MS analýzy detekovaný. Dôvodom je zmena molekulárnej hmotnosti proteínu a zmena fragmentačného spektra, prípadne tvorba nového miesta pre proteolytické štiepenie vplyvom mutácie. K identifikácii mutantných foriem proteínov je nevyhnutná tvorba vlastnej referenčnej databázy s mutantnými sekvenciami proteínov. Genomické metódy NGS poskytujú možnosť de novo celogenómového sekvenovania a identifikáciu genetických mutácií na úrovni DNA alebo RNA. Filtráciou založenou na počte readov alebo na abundancii varianty sme získali databázu vysokopravdepodobných mutácií. Následne bola odvodená referenčná databáza mutantných foriem proteínov preložením genetickej informácie do aminokyselinovej sekvencie. Takto pripravená mutantná referenčná databáza bola potom použitá na prehľadávanie MS dát (obr. 1). Pre každý mutantný proteín/peptid je k dispozícii štatistika vyjadrujúca pravdepodobnosť, s ktorou bol identifikovaný. Mutantné proteíny/peptidy identifikované s vysokou konfidenciou pravdepodobne vznikajú v mutovanej forme, no napriek tomu môže dochádzať aj k nesprávnemu priradeniu fragmentačného (MS/MS) spektra k sekvencii mutovaného proteínu. Výsledky MS analýzy vyžadujú dôkladnú kontrolu a validáciu. Kontrola pokrytia mutantnej pozície ako aj kontrola fragmentačného spektra neoantigénu vylúči možnosť identifikácie wild type peptidu. MS metódy nemusia zaznamenať podstatné nízkoabundantné peptidy pod detekčným limitom metódy. Efektivitu procesu identifikácie neoantigénov sme zvýšili znížením komplexity vzorky preseparáciou. Dôležitým faktorom bola ortogonalita preseparačnej metódy na separačnú metódu v druhom chromatografickom rozmere [23]. Efektívna dvojdimenzionálna chromatografická metóda (dvojrozmerná kapalinová chromatografia (2D LC)) využíva odlišné mechanizmy separácie v prvom a druhom chromatografickom rozmere. Dobrým príkladom je náš systém s preseparáciou v bázickej reverznej fáze nasledovaný separáciou v kyslej reverznej fáze. Aplikáciou dvojrozmernej kvapalinovej chromatografie spojenej s tandemovou hmotnostnou spektrometriou (2D LC-MS/MS) možno mnohonásobne zvýšiť počet identifikácií a zvýšiť pokrytie v mutovanej časti sekvencie. Možnosti optimalizácie procesu LC-MS identifikácie neoantigénov spočívajú aj v použití chipových chromatografických kolón vynikajúcich nižším protitlakom, lepšiou separáciou a reproducibilitou oproti klasickým kapilárnym kolonám. Optimálnou 2D LC-MS/MS metódou sme identifikovali až desiatky neoantigénov.
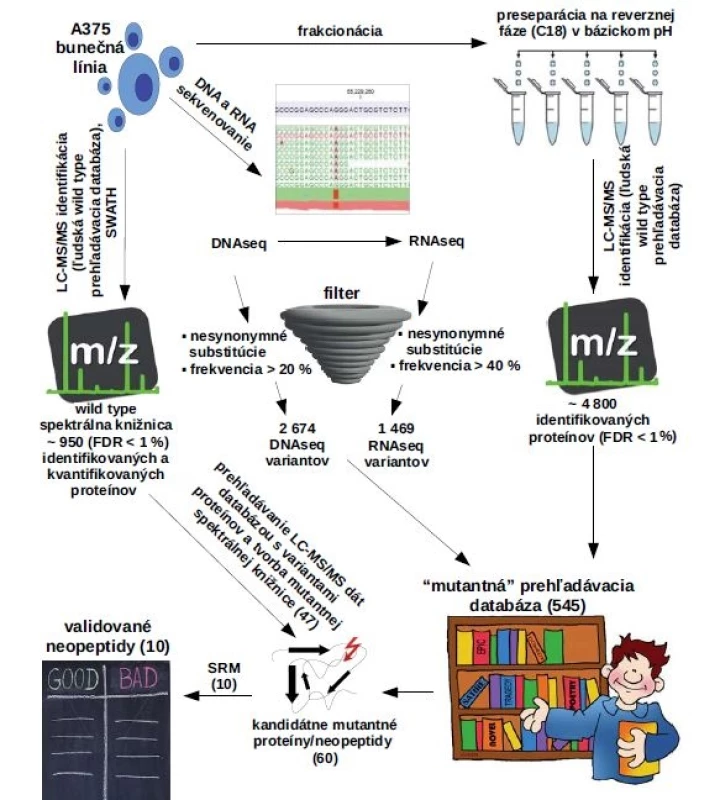
Cielená proteomika ponúka možnosť validácie LC-MS/MS dát. Metódu SRM (selected reaction monitoring) sme zacielili na konkrétne vybrané kandidátne neoantigény. Informácie potrebné pre tvorbu SRM metódy sme získali z MS/MS dát príslušných neoantigénov. Výsledné SRM dáta boli spracované podľa dobre definovaných pravidiel implementovaných v softvéri Skyline [24]. Dôveryhodnosť SRM validácie neoantigénov sme zvýšili použitím príslušných ťažkých foriem neoantigénov s izotopovým značením, ktoré slúžia ako referenčné peptidy. Referenčné izotopovo značené peptidy sme museli dôkladne navrhnúť. Izotopovo značená aminokyselina by mala byť v takej pozícii, aby sa spolu so zamenenými aminokyselinami vyskytovala v čo najväčšom počte fragmentových iónov. Fragmentačné spektrá referenčných peptidov sa musia dokonale podobať spektrám neoantigénov a retenčný čas oboch foriem musí byť identický. Úspešne validovaný neoantigén sa potom dá považovať za exprimovaný na proteínovej úrovni [25]. V prípade, že je predmetom záujmu kvantita neoantigénu, metóda SRM ponúka možnosť absolútnej kvantifikácie. Relatívna kvantifikácia metódou SWATH (sequential windowed acquisition of all theoretical fragment ion spectra) je výnimočná svojou robustnosťou a schopnosťou kvantifikovať všetky detekovateľné proteíny v jednom chromatografickom behu [26]. Do budúcna sa dá predpokladať aplikácia metódy SWATH pre robustnú kvantifikáciu viacerých mutantných foriem peptidov alebo neoantigénov v rôznych typoch vzoriek za rôznych podmienok. Pre úspešnú kvantifikáciu bude kľúčové vytvorenie spektrálnej knižnice obsahujúcej MS/MS spektrá mutantných proteínov (obr. 1). Po úspešnej identifikácii a validácii neoantigénov je potrebné pokračovať výberom peptidov, ktoré sú prezentované imunitným systémom a sú imunogénne. Z počiatočného listu tisícov variantov identifikovaných metódami NGS sa dostávame k stovkám alebo desiatkam neoantigénov, ktoré sú skutočne exprimované na proteínovej úrovni. Následnou dôkladnou validáciou in silico, in vitro a in vivo sa okruh kandidátov zúži ešte viac, až sa dostávame k listu niekoľkých kandidátov vhodných pre tvorbu protinádorovej vakcíny. Identifikácia neoantigénov použiteľných pre tvorbu protinádorových vakcín je multidisciplinárna záležitosť vyžadujúca kolektív vedcov so znalosťami z medicíny, imunológie, molekulárnej biológie, biochémie a analytickej chémie. Napriek zložitosti problematiky vzniklo niekoľko publikácií, kde sa autorom aspoň čiastočne podarilo využiť vlastné neoantigény pacienta k remisii nádorového ochorenia (viď nižšie).
Úspešné aplikácie neoantigénových vakcín v protinádorovej terapii
Ott et al pripravili personalizované neoantigénové nádorovo-špecifické vakcíny pre pacientov s melanómom [27]. Pre vakcináciu bolo vybraných 20 neoepitopov na základe DNA a RNA sekvenovania a modelovania afinity k HLA molekulám. Vakcíny boli aplikované subkutánne. U pacientov bola detekovaná indukcia CD4+ a CD8+ T bunkovej odpovede, pričom T bunky špecificky rozlišovali nádorové neoantigény od wild type antigénov. U 4 zo 6 pacientov došlo k remisii ochorenia počas 25 mesiacov od vakcinácie. Dvaja pacienti s relapsom ochorenia boli dodatočne liečení anti-PD1 biologickou liečbou, ktorá viedla k expanzii neoepitop-špecifických buniek a ku kompletnej remisii ochorenia. Sahin et al použili k protinádorovej vakcinácii molekuly RNA kódujúce neoantigény, ktoré zároveň slúžili ako adjuvans a potencovali imunitnú reakciu [28]. Molekuly RNA kódovali 27-aminokyselinové sekvencie obsahujúce neoepitopy s vysokou pravdepodobnosťou väzby na molekuly MHC I. a II. triedy. Vakcinácia pacientov s pokročilým melanómom viedla ku špecifickej imunitnej reakcii cielenej proti neoepitopom vybraných neoantigénov. V resektáte metastatického melanómového tkaniva bola objavená T bunková infiltrácia spojená s neoepitop-špecifickou elimináciou nádorových buniek. U 2 z 5 pacientov došlo k remisii metastatického melanómu. Jeden z pacientov relaboval po tom, čo došlo k úniku nádoru spod kontroly imunitného systému. Dodatočnou administráciou liečby inhibítormi imunitných kontrolných bodov bol efekt protinádorovej vakcinácie obnovený a zosilnený.
Komentované klinické štúdie dokazujú účinnosť neoantigénovej vakcinácie v praxi. K širšiemu popisu úspešnosti a efektivity neoantigénovej vakcinácie v protinádorovej terapii bude však nutné rozšíriť skupinu pacientov a pokúsiť sa aplikovať vakcináciu na rôzne typy nádorov. Súčasné poznatky naznačujú, že neoantigénovú vakcináciu je vhodné kombinovať s komplementárnymi liečebnými postupmi. Ako úspešná sa javí kombinácia s inhibítormi imunitných kontrolných bodov. K tvorbe neoantigénových protinádorových vakcín je potrebné doriešiť komplikácie s identifikáciou imunogénnych neoepitopov, aktiváciou T bunkovej odpovede v mieste tumoru a s adaptáciou tumoru na imunitnú reakciu. Problematická môže byť aj postupná strata HLA molekúl na povrchu nádorovej bunky, tvorba fyzickej bariéry, sekrécia imunosupresívnych molekúl, prípadne rekruitácia buniek zodpovedných za utlmenie imunitnej reakcie. Navyše, podľa matematických modelov, sa vplyvom neoantigénovej vakcinácie predpokladá postupná selekcia subpopulácie nádorových buniek bez prezentácie neoantigénu HLA molekulami.
Záver
Neoantigénová vakcinácia má potenciál zmeniť súčasné prístupy k liečbe nádorových ochorení a individualizovať protinádorovú liečbu. Budúcnosť tohto postupu bude závisieť od automatizácie procesu získavania imunogénnych neoepitopov pacienta a od úspešnosti získavania kontroly nad procesmi vedúcimi k protinádorovej imunite. Podstatné bude aj načasovanie a voľba správneho režimu prídavnej liečby.
Práca bola podporená projektom MŠMT – NPU I – LO1413.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Jakub Faktor
Regionální centrum aplikované molekulární onkologie
Masarykův onkologický ústav
Žlutý kopec 7 656 53 Brno
e-mail: jakub.faktor@mou.cz
Přijato: 9. 7. 2018
Sources
1. Vucic EA, Thu KL, Robison K et al. Translating cancer ‘omics’ to improved outcomes. Genome Res 2012; 22 (2): 188–195. doi: 10.1101/gr.124354.111.
2. McCarthy EF. The toxins of William B. Coley and the treatment of bone and soft-tissue sarcomas. Iowa Orthop J 2006; 26 : 154–158.
3. Klein G, Sjorgen HO, Klein E et al. Demonstration of resistance against methylcholanthrene-induced sarcomas in the primary autochthonous host. Cancer Res 1960; 20 : 1561–1572.
4. Steinman RM, Cohn ZA. Identification of a novel cell type in peripheral lymphoid organs of mice. I. Morphology, quantitation, tissue distribution. J Exp Med 1973; 137 (5): 1142–1162.
5. Klein J. Seeds of time: fifty years ago Peter A. Gorer discovered the H-2 complex. Immunogenetics 1986; 24 (6): 331–338.
6. Bevan MJ, Cohn M. Cytotoxic effects of antigen-and mitogen-induced T cells on various targets. J Immunol 1975; 114 (2 Pt 1): 559–565.
7. Knuth A, Danowski B, Oettgen HF et al. T-cell-mediated cytotoxicity against autologous malignant melanoma: analysis with interleukin 2-dependent T-cell cultures. Proc Natl Acad Sci U S A 1984; 81 (11): 3511–3515.
8. Wölfel T, Van Pel A, De Plaen E et al. Immunogenic (tum-) variants obtained by mutagenesis of mouse mastocytoma P815. VIII. Detection of stable transfectants expressing a tum-antigen with a cytolytic T cell stimulation assay. Immunogenetics 1987; 26 (3): 1780–1787.
9. Wirth TC, Kühnel F. Neoantigen targeting-dawn of a new era in cancer immunotherapy? Front Immunol 2017; 8 : 1848. doi: 10.3389/fimmu.2017.01848.
10. Jäger D, Jäger E, Knuth A. Immune responses to tumour antigens: implications for antigen specific immunotherapy of cancer. J Clin Pathol 2001; 54 (9): 669–674.
11. Garstka MA, Fish A, Celie PH et al. The first step of peptide selection in antigen presentation by MHC class I molecules. Proc Natl Acad Sci U S A 2015; 112 (5): 1505–1510. doi: 10.1073/pnas.1416543112.
12. Dubey P, Hendrickson RC, Meredith SC et al. The immunodominant antigen of an ultraviolet-induced regressor tumor is generated by a somatic point mutation in the DEAD box helicase p68. J Exp Med 1997; 185 (4): 695–705.
13. Laumont CM, Perreault C. Exploiting non-canonical translation to identify new targets for T cell-based cancer immunotherapy. Cell Mol Life Sci 2018; 75 (4): 607–621. doi: 10.1007/s00018-017-2628-4.
14. Worley BS, van den Broeke LT, Goletz TJ et al. Antigenicity of fusion proteins from sarcoma-associated chromosomal translocations. Cancer Res 2001; 61 (18): 6868–6875.
15. Vigneron N, Stroobant V, Chapiro J et al. An antigenic peptide produced by peptide splicing in the proteasome. Science 2004; 304 (5670): 587–590. doi: 10.1126/science.1095522.
16. Warren EH, Vigneron NJ, Gavin MA et al. An antigen produced by splicing of noncontiguous peptides in the reverse order. Science 2006; 313 (5792): 1444–1447. doi: 10.1126/science.1130660.
17. Kumar S, Banks TW, Cloutier S. SNP discovery through next-generation sequencing and its applications. Int J Plant Genomics 2012; 2012 : 831460. doi: 10.1155/2012/831460.
18. Hoof I, Peters B, Sidney J et al. NetMHCpan, a method for MHC class I binding prediction beyond humans. Immunogenetics 2009; 61 (1): 1–13. doi: 10.1007/s00251-008-0341-z.
19. Harndahl M, Justesen S, Lamberth K et al. Peptide binding to HLA class I molecules: homogenous, high-throughput screening, and affinity assays. J Biomol Screen 2009; 14 (2): 173–180. doi: 10.1177/1087057108329453.
20. Wisniewski JR, Ostasiewicz P, Mann M. High recovery FASP applied to the proteomic analysis of microdissected formalin fixed paraffin embedded cancer tissues retrieves known colon cancer markers. J Proteome Res 2011; 10 (7): 3040–3049. doi: 10.1021/pr200019m.
21. Bouchal P, Roumeliotis T, Hrstka R et al. Biomarker discovery in low-grade breast cancer using isobaric stable isotope tags and two-dimensional liquid chromatography-tandem mass spectrometry (iTRAQ-2DLC-MS/MS) based quantitative proteomic analysis. J Proteome Res 2009; 8 (1): 362–373. doi: 10.1021/pr800622b.
22. Faktor J, Bouchal P. Building mass spectrometry spectral libraries of human cancer cell lines. Klin Onkol 2016; 29 (Suppl 4): 54–58. doi: 10.14735/amko20164S54.
23. Gilar M, Olivova P, Daly AE, et al. Orthogonality of separation in two-dimensional liquid chromatography. Anal Chem 2005; 77 (19): 6426–6434. doi: 10.1021/ac050923i.
24. Finney GL, Blackler AR, Hoopmann MR et al. Label-free comparative analysis of proteomics mixtures using chromatographic alignment of high-resolution muLC-MS data. Anal Chem 2008; 80 (4): 961–971. doi: 10.1021/ac701649e.
25. Carr SA, Abbatiello SE, Ackermann BL et al. Targeted peptide measurements in biology and medicine: best practices for mass spectrometry-based assay development using a fit-for-purpose approach. Mol Cell Proteomics 2014; 13 (3): 907–917. doi: 10.1074/mcp.M113.036095.
26. Gillet LC, Navarro P, Tate S et al. Targeted data extraction of the MS/MS spectra generated by data-independent acquisition: a new concept for consistent and accurate proteome analysis. Mol Cell Proteomics 2012; 11 (6): O111.016717. doi: 10.1074/mcp.O111.016717.
27. Ott PA, Hu Z, Keskin DB et al. An immunogenic personal neoantigen vaccine for patients with melanoma. Nature 2017; 547 (7662) : 217 – 221. doi: 10.1038/ nature22
991.
28. Sahin U, Derhovanessian E, Miller M et al. Personalized RNA mutanome vaccines mobilize poly-specific therapeutic immunity against cancer. Nature 2017; 547 (7662) : 222 – 226. doi: 10.1038/ nature23003.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2018 Issue Supplementum 2
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Safety and Tolerance of Metamizole in Postoperative Analgesia in Children
-
All articles in this issue
- Variabilita buněčné populace solidních nádorů a její význam pro diagnostiku a terapii nádorových onemocnění
- Využití mitochondriálních procesů v cílené terapii nádorových onemocnění
- Ferroptóza jako nový typ buněčné smrti a její role v léčbě rakoviny
- Možnosti využití p63 v bioptické diagnostice
- Význam membránových proteinů v léčbě nádorových onemocnění a možnosti jejich dalšího studia
- Vliv metylace DNA na vznik nádorových onemocnění
- Úloha proteinu HSP70 v nádorech a jeho využití jako terapeutický cíl
- Úloha proteínu HSF1 v nádorovej transformácii
- Proteíny HDM2 a HDMX v ľudských nádoroch
- Prima-1 a APR-246 v léčbě nádorových onemocnění
- Acetylsalicylová kyselina a její potenciál v chemoprevenci kolorektálního karcinomu
- Exprese a funkční charakterizace miR-34c u karcinomu děložního hrdla
- Současné metody analýzy mikroRNA
- Proteogenomická platforma na identifikáciu nádorovo špecifických antigénov
- Subpopulace cirkulujících myeloidních supresových buněk u pacientů s kolorektálním karcinomem – explorativní analýza jejich potenciálu jako biomarkeru
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Vliv metylace DNA na vznik nádorových onemocnění
- Ferroptóza jako nový typ buněčné smrti a její role v léčbě rakoviny
- Možnosti využití p63 v bioptické diagnostice
- Současné metody analýzy mikroRNA
