Trombocytopenie u myelodysplastického syndromu
Thrombocytopenia in myelodysplastic syndrome
Thrombocytopenia occurs at the time of diagnosis in approximately 30 % of patients with myelodysplastic syndrome (MDS) and may lead to serious complications in patients with both early and advanced disease. Multilineage dysplasia itself represents an adverse prognostic factor in MDS. A dysregulation of thrombopoiesis resulting in ineffective platelet production and increased apoptotic rate of platelets is the most common reason of thrombocytopenia in MDS patients, an absolute decrease in platelet production represents a less frequent reason of low platelet counts. Treatment approaches to thrombocytopenia include administration of donor platelet concentrates, immune suppression, stem cell transplantation in selected patients and recently administration of thrombopoietin agonists. An effective and relatively safe treatment of thrombocytopenia with thrombopoetin agonists might replace in patients with early MDS indication of potentially more hazardous treatment approaches as immune suppression or stem cell transplantation.
Key words:
myelodysplasia – thrombocytopenia – pathogenesis – treatment – immune supression – romiplostim
Authors:
J. Čermák
Authors‘ workplace:
Ústav hematologie a krevní transfuze Praha, ředitel prof. MUDr. Marek Trněný, CSc.
Published in:
Vnitř Lék 2010; 56(Supplementum 1): 39-42
Category:
16th Parizek's Days, Ostrava-Poruba, March 25th –26th 2010
Overview
Trombocytopenie se vyskytuje v době diagnózy u 30 % nemocných s myelodysplastickým syndromem (MDS) a může být příčinou závažných komplikaci jak v časné, tak v pokročilé fázi onemocnění. Cytopenie přítomná ve více krevních řadách je sama o sobě nepříznivým prognostickým faktorem u MDS. Nejčastější příčinou trombocytopenie u MDS je porucha regulace trombopoézy, která je inefektivní a podléhá ve zvýšené míře apoptóze, méně často je přítomna absolutně snížená produkce trombocytů. V léčbě trombocytopenie se u MDS krom podávání destičkových koncentrátů uplatňuje imunosupresivní léčba, u vybraných nemocných transplantace krvetvorných buněk a probíhají klinické studie s využitím agonistů trombopoetinu. Efektivní a relativně bezpečné podávání těchto látek by mohlo u nemocných s časnou formou MDS nahradit některé náročnější a rizikovější léčebné postupy (transplantace krvetvorných buněk, podávání antithymocytárního globulinu).
Klíčová slova:
myelodysplazie – trombocytopenie – patogeneze – léčba – imunosuprese – romiplostim
Úvod
Myelodysplastický syndrom (MDS) představuje soubor klonálních poruch krvetvorby charakterizovaný v časné fázi mutací kmenové krvetvorné buňky, jež vede jednak k akcentaci proliferace mladších forem krvetvorby, jednak vyvolává jako antigenní podnět imunitní reakci s indukcí tvorby proapoptotických cytokinů cytotoxickými T-lymfocyty, což vede k vystupňovanému zániku zralejších elementů krvetvorby. Vznikající nestabilita genomu se projevuje tendencí k akumulaci dalších mutací vedoucích ke ztrátě fyziologické regulace proliferace a diferenciace a nekontrolovanému nárůstu mladých CD34+ prekurzorů o nízkém stupni apoptózy. Výsledkem je rozvoj akutní myeloidní leukemie (AML).
Incidence trombocytopenie u MDS
Analýza nálezů u rozsáhlé skupiny neléčených nemocných s MDS, která byla podkladem pro vytvoření Mezinárodního prognostického skórovacího systému (IPSS), prokázala přítomnost trombocytopenie (počty trombocytů < 100 × 109/ l) u 30 % nemocných v době diagnózy choroby. Medián délky přežití činil u nemocných s < 100 × 109/ l trombocytů 27 měsíců oproti 60 měsícům u nemocných s > 100 × 109/ l trombocytů v době diagnózy [1]. Při analýze největšího evropského registru nemocných s MDS v Düsseldorfu došlo během pěti let od diagnózy k přechodu do AML u 32 % nemocných s > 100 × 109/ l trombocytů v době diagnózy na rozdíl od 38 % nemocných s < 100 × 109/ l trombocytů [2]. I když izolovaná trombocytopenie bez přítomnosti cytopenie v dalších řadách nebyla vyhodnocena u nemocných s MDS jako statisticky významný nepříznivý prognostický faktor [1], může být příčinou závažných krvácivých komplikací jak u nemocných s časnými formami choroby bez tendence k leukemizaci, tak u nemocných s pokročilými formami choroby léčených chemoterapií.
Etiologie a patogeneze
Ke snížení počtu trombocytů může dojít obecně buď v důsledku jejich snížené produkce v kostní dřeni, či při jejich zvýšeném zániku (obr. 1). Absolutně snížená produkce trombocytů bývá přítomna zejména u tzv. hypoplastické formy MDS charakterizované povšechně sníženou buněčností kostní dřeně [3], méně často bývá trombopoéza redukována u pokročilých forem MDS díky proliferaci patologického klonu. Zdaleka nejčastější příčinou trombocytopenie u MDS je však porucha regulace trombopoézy. Jak již bylo zmíněno výše, mutace vedoucí ke vzniku abnormálního klonu působí současně jako antigenní podnět vedoucí k abnormální aktivaci cytotoxických lymfocytů indukujících apoptózu zralejších elementů krvetvorby. Důsledkem je různý stupeň cytopenie v jednotlivých krevních řadách. Krvetvorba je inefektivní a část krevních elementů zaniká ještě před vyplavením do periferní krve. Zvýšený zánik trombocytů v důsledku přítomnosti protilátek je u MDS poměrně vzácný a většinou je doprovázen jinými autoimunitními fenomény [4]. Zejména u pokročilých forem choroby může k trombocytopenii přispívat i zvýšená konzumpce destiček při aktivaci koagulačního systému.
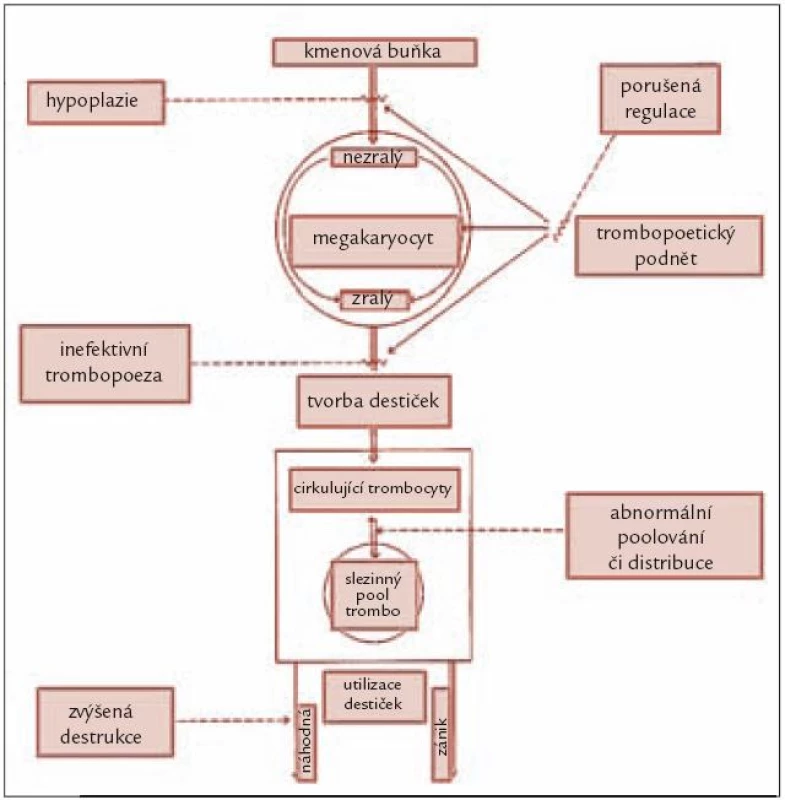
U nemocných s MDS s počty trombocytů < 10 × 109/ l je přítomno vysoké riziko závažných krvácivých komplikací, nicméně krvácet mohou i nemocní s vyššími počty krevních destiček. Cortes et al prokázali u nemocných s MDS vysokou incidenci funkčních poruch destiček, zejména poruchy agregace trombocytů [5]. Recentní nálezy ukazují, že porucha agregace destiček může u MDS vznikat v důsledku snížené exprese některých proteinů sloužících k přenosu signálů z nitra trombocytu na jeho povrch extracelulárně (Talin-1 a Vinculin), což může vést k defektní funkci glykoproteinu GPIIb/ IIIa [6].
Diagnostika
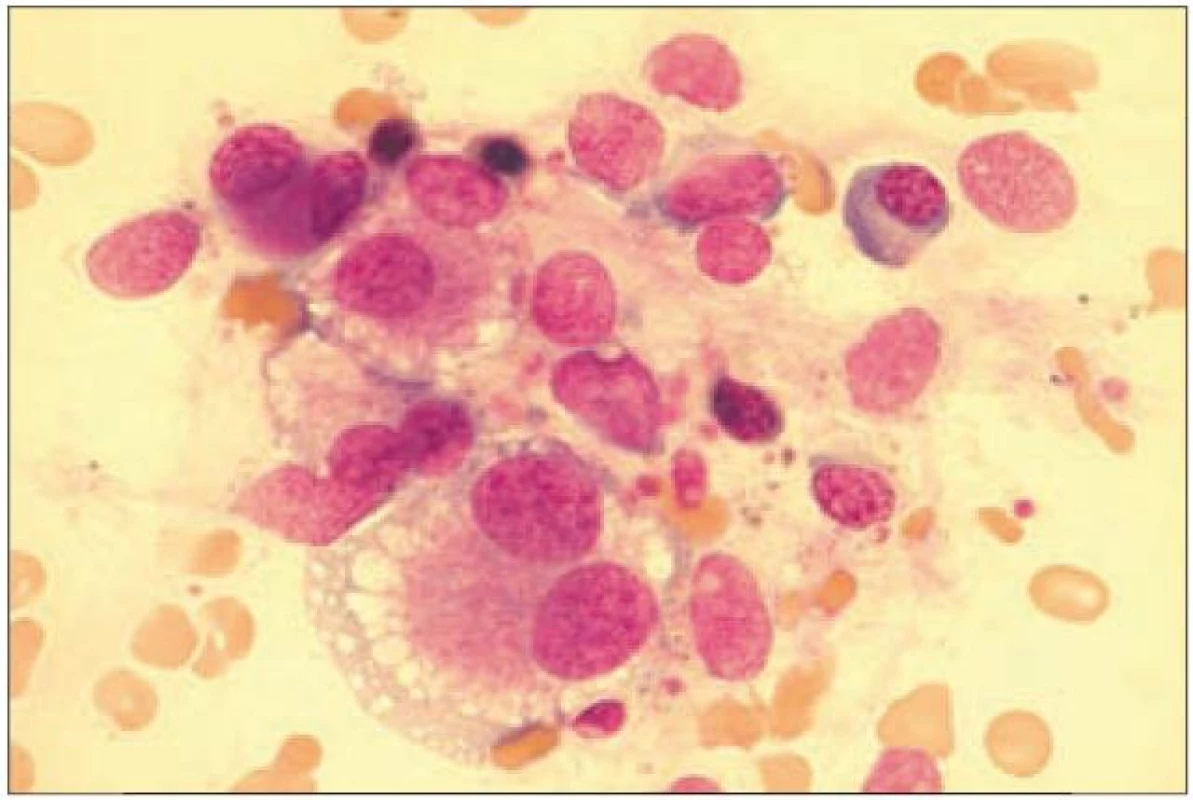
Diagnostika trombocytopenie se u MDSopírá o běžný diagnostický panel zahrnující vyšetření periferního krevního obrazu, aspirátu a trepanobioptického vzorku kostní dřeně. Dysplastické změny v megakaryopoéze odrážejí poruchy proliferace a diferenciace a projevují se v kostní dřeni nejčastěji přítomností mikromegakaryocytů, poruchami lobulizace jader (velké mononukleární jádro, mnohotná malá jádra) či nesouběhem zrání jádra a cytoplazmy (obr. 2). V periferní krvi nacházíme makrotrombocyty a hypogranulární trombocyty [7]. Přítomnost protilátek vázaných na trombocyty můžeme prokázat pomocí průtokové cytometrie.
Léčba
Základní léčebné postupy u trombocytopenických nemocných s MDS jsou uvedeny v tab. 1.

Podpůrná léčba spočívá v podávání destičkových koncentrátů. Vzhledem k riziku vzniku aloprotilátek při opakovaném podávání trombokoncentrátů je doporučováno přípravky před podáním deleukotizovat. Terapeutická indikace je dána přítomností krvácivých projevů v důsledku trombocytopenie, na profylaktické podávání destičkových koncentrátů není u MDS jednotný názor, hodnoty počtu trombocytů, při kterých je indikováno podání trombocytů, se pohybují mezi 10 a 15 × 109/ l, hodnoty se však mohou individuálně výrazně lišit vzhledem k možné přítomnosti funkčních poruch trombocytů či současné aktivace koagulačního systému.
Indikace imunosupresivní léčby u MDS vychází z předpokladu přítomnosti abnormální reakce imunitního systému namířené proti krvetvorným buňkám a vedoucí k jejich zániku – apoptóze. Imunosuprese je používánahlavně u hypoplastické formy MDS (imunitně podmíněného selhání kostní dřeně) či při přítomnosti dalších autoimunitních fenoménů. Nejčastěji užívanými léčivy bývají kortikosteroidy v kombinaci s cyklosporinem A (CS - A), nebo antithymocytární globulin (ATG) v kombinaci s kortikosteroidy a CS - A. Experimentálně byla podávána řada léků, nejnověji alemtuzumab [8]. V naší práci z roku 1997 bylo léčeno CS - A většinou v kombinací s prednisonem 17 nemocných s časným MDS a cytopenií ve 2 či 3 řadách [9]. U 23 % nemocných bylo dosaženo kompletní remise, ze skupiny 12 nemocných, kteří měli trombocytopenii, byl efekt hodnocený vzestupem počtu trombocytů nad 50 × 109/ l přítomen u 66 % nemocných. Rozšířená studie publikovaná v roce 2005 prokázala efekt kombinace prednisonu v dávce 0,4 – 0,5 mg/ kg/ den s CS - A (3 mg/ kg/ den a úprava dle hladiny CS - A v séru) u 45 % nemocných s iniciální trombocytopenií (opět hodnocen vzestup počtu trombocytů nad 50 × 109/ l) [10]. ATG je většinou podáván v dávce 3,75 mg/ kg/ den po dobu pěti dní společně s kortikosteroidy a následnou dlouhodobou léčbou CS - A, odpověď v destičkové řadě byla pozorována u 40 – 50 % nemocných, přičemž nebyl pozorován rozdíl mezi koňským a králičím ATG [11]. Krom práce Molldrema et al nebyl pozorován prognostický význam počtu trombocytů v době léčby na efekt podávání ATG [12].
Určitý efekt na vzestup počtu trombocytů mělo podávání syntetického androgenu Danazolu, zejména u nemocných s přítomností protilátek proti trombocytům díky tlumivému účinku Danazolu na expresi receptoru pro Fc fragment imunoglobulinů na povrchu makrofágů [13].
Stimulační efekt na produkci trombocytů byl prokázán i u některých interleukinů (IL-3, IL-6), zejména v kombinaci s nízkodávkovanou chemoterapií [14].
Přítomnost trombocytopenie může hrát roli při indikaci nemocných s časnými formami MDS k transplantaci krvetvorných buněk (SCT). Nález cytopenie ve více řadách spolu s nepříznivými změnami karyotypu (dle IPSS) zařazuje nemocné do skupiny se středním – II. rizikem, u kterých by měla být zvážena indikace SCT jako prvé léčebné metody [15]. Relativní indikaci k SCT představuje přítomnost těžké trombocytopenie s opakovanými závažnými krvácivými komplikacemi u nemocných s nízkým či středním – I. rizikem. Dnes přežívá po SCT pět a více let 60 – 75 % nemocných s časnými stadii choroby bez nadbytku blastů [16]. Nicméně je stále přítomna signifikantní peritransplantační mortalita (15 – 30 %), předběžné výsledky neukazují významnější rozdíl mezi užitím myeloablativního a redukovaného přípravného režimu [17], ale je nutné zhodnocení v prospektivní studii.
Nález relativního deficitu trombopoetinu, kdy vzestup jeho hladiny nekoreloval se stupněm trombocytopenie u nemocných s MDS [18], vedl obdobně jako u imunitní trombocytopenické purpury k indikaci podávání agonistů trombopoetinu i u MDS. Romiplostim představuje fúzní protein složený z Fc domény IgG, k jejímž oběma větvím na C konci je kovalentně vázán peptidový řetězec obsahujcí dvě domény pro vazbu na trombopoetinový receptor. Studie fáze I. a II. [19,20] ukázaly dobrou toleranci léku a optimální efektivní dávku 750 µg s. c. jedenkrát týdně, účinek hodnocený vzestupem počtu trombocytů nad 50 × 109/ l byl přítomen u 82 % nemocných. Kombinace podávání romiplostimu a hypometylačních látek rovněž významně snížila incidenci těžké trombocytopenie po podávání azacytidinu a decitabinu [21]. V současné době probíhá randomizovaná studie fáze III podávání romiplostinu u nemocných s MDS oproti placebu. Příznivý efekt romiplostinu u MDS lze spatřovat zejména v možnosti jeho podání nemocným s těžkou trombocytopenií a krvácivými projevy v časných stadiích choroby, kteří jsou v současnosti díky přítomnosti trombocytopenie indikováni k významně rizikovějším léčebným postupům (podávání ATG, transplantace).
doc. MUDr. Jaroslav Čermák, CSc.
www.uhkt.cz
e-mail: cermak@uhkt.cz
Doručeno do redakce: 6. 5. 2010
Sources
1. Greenberg P, Cox C, Le Beau MM et al. International scoring system for evaluating prognosis in myelodysplastic syndromes. Blood 1997; 89 : 2079 – 2088.
2. Germing U, Strupp C, Kuengden A et al. Prospective validation of the WHO proposals for the classification of myelodysplastic syndromes. Haematologica 2006; 91 : 1596 – 1604.
3. Greenberg PL, Young NS, Gattermann N.Myelodysplastic syndromes. Hematology Am Soc Hematol Educ Program 2002; 136 – 161.
4. Enright H, Jacob HS, Vercellotti G et al. Paraneoplastic autoimmune phenomena in patients with myelodysplastic syndromes: response to immunosuppressive therapy. Br J Haematol 1995; 91 : 403 – 408.
5. Cortes JE, List A, Kantarjian H. Myelodysplastic syndromes. In: Pazdu R et al. (eds.) Cancer Management. A Multidisciplinary Approach 9th edition. New York: CMP Health Care Media 2005 : 825 – 842.
6. Czibere AG, Fröbel J, Hartwig S et al. Platelets derived from patients with myelodysplastic syndromes (MDS) show defective platelet aggregation and integrin aIIbb3 receptor (GPIIb/ IIIa) signaling caused by a reduced expression of proteins required inside - out signaling. (Abstr) Blood 2009; 114 : 248.
7. Brunning RD, Orazi A, Germing U et al. Myelodysplastic syndromes/ neoplasms, overview. In: Swerdlow SH, Campo E, Harris NL et al (eds.) WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. Lyon: International Agency for Research on Cancer (IARC) 2008 : 87 – 108.
8. Sloand EM, Olnes MJ, Weinstein B et al. Alemtuzumab treatment of intermediate - 1 (INT - 1) myelodysplasia patients is associated with sustained improvement in blood counts and cytogenetic remission. (Abstr) Blood 2009; 114 : 53.
9. Jonášová A, Neuwirtová R, Čermák J et al. Cyclosporin A therapy in hypoplastic MDS patients and certain refractory anaemias without hypoplastic bone marrow. Br J Haematol 1998; 100 : 314 – 309.
10. Čermák J, Beličková M, Michalová K.Combined immunosuppressive therapy in patients with early MDS (Abstr.) Haematologica 2005; 90 (Suppl 2): 367.
11. Stadler M, Germing U, Klich KO et al. A prospective, randomised, phase II study of horse antithymocyte globulin vs rabbit antithymocyte globulin as immune - modulating therapy in patients with low - risk myelodysplastic syndromes. Leukemia 2004; 18 : 460 – 465.
12. Molldrem JJ, Leifer E, Bahceci E et al. Antithymocyte globulin for treatment of the bone marrow failure associated with myelodysplastic syndromes. Ann Intern Med 2002; 137 : 156 – 163.
13. Buzaid AC, Garewal HS, Lippman SM et al. Danazol in the treatment of myelodysplastic syndromes. Eur J Haematol 1987; 39 : 346 – 348.
14. Zwierzina H, Suciu S, Loeffler - Ragg Jet al. Low-dose cytosine arabinoside (LD - AraC) vs LD - AraC plus granulocyte/ macrophage colony stimulating factor vs LD - AraC plus Interleukin-3 for myelodysplastic syndrome patiens with a high risk of developing acute leukemia: final results of a randomized phas II study (06903) of the EORTC Leukemia Cooperative Group. Leukemia 2005; 19 : 1929 – 1933.
15. Cutler CS, Lee SJ, Greenberg P et al. A decision analysis of allogeneic bone marrow transplantation for the myelodysplastic syndromes: delayed transplantation for low - risk myelodysplasia is associated with improved outcome. Blood 2004, 104 : 579 – 585.
16. Deeg HJ. Reducing the frequency of relapse after hematopoietic cell transplantation for MDS. (Abstr). Leukemia Res 2009; 33 (Suppl 1): 28 – 29.
17. Martino R, Iacobelli S, Brand R et al. Retrospective comparison of reduced - intensity conditioning and conventional high-dose conditioning for allogeneic hematopoietic stem cell transplantation using HLA-identical sibling donors in myelodysplastic syndromes. Blood 2006; 108 : 836 – 846.
18. Hellström - Lindberg E, Kanter - Lewensohn L, Nichol J et al. Spontaneous and cytosine-induced thrombocytopenia in myelodysplastic syndromes: serum thrombopoietin levels and bone marrow morfology. Br J Haematol 1999; 105 : 966 – 973.
19. Kantarjian H, Fenaux P, Sekeres MA et al. Phase 1/ 2 study of AMG 531 in thrombocytopenic patients (pts) with low - risk myelodysplastic syndrome (MDS): update including extended tratment (Abstr.). Blood 2007; 110 : 250.
20. Fenaux P, Lyons R, Kantarjian H. An open - label extension study evaluating the long-term safety and efficacy of romiplostin in thrombocytopenic patients (pts) with myelodysplastic syndrome (MDS) (Abstr). Blood 2009; 114 : 2765.
21. Kantarjian H, Giles F, Greenberg P et al. Effect of romiplostim in patients (pts) with low or intermediate risk myelodysplastic syndrome (MDS) receiving azacytidine (Abstr). Blood 2008; 112 : 224.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2010 Issue Supplementum 1
-
All articles in this issue
- Heparinem indukovaná trombocytopenie při léčbě nízkomolekulárními hepariny u dětí. Je čeho se obávat?
- Lokální intravenózní fibrinolýza u dětí a mladistvých
- Chronická imunitní trombocytopenická purpura – úspěšná léčba protilátkami anti‑CD 20
- Trombocytopenie a koagulopatie u hepatopatie: úvod do problematiky
- Monitorace parametrů koagulace a možnosti jejich ovlivnění u pacientů s jaterní cirhózou před invazivními výkony
- Imunitní trombocytopenie, diagnostika, klasifikace, diferenciální diagnostika
- Terapie imunitní trombocytopenie v graviditě
- Trombocytopenie u pacientů s průkazem antifosfolipidových protilátek nebo s antifosfolipidovým syndromem
- Diferenciální diagnostika trombocytopenie v těhotenství
- Syndrom HELLP – průběh onemocnění a aktivita markerů aktivace endotelu
- Porovnání hladin markerů aktivace endotelu v jednotlivých trimestrech.
- Využití parametru IPF (Immature platelet fraction) v laboratorní diagnostice
- Mikropartikule
- Uplatnění průtokové cytometrie v analýze trombocytů
- Změny laboratorních ukazatelů hemostázy u hepatopatií
- Úvodní slovo
- Ambulantní pacient s nově zjištěnou trombocytopenií
- Diferenciální diagnostika trombocytopenie u kriticky nemocných pacientů
- Trombocytopenie u malignit. Úvod do problematiky: příčiny, prognostický význam, význam pro terapii
- Dysplastické změny megakaryopoézy podle WHO klasifikace 2008
- Trombocytopenie u myelodysplastického syndromu
- Trombocytopenie u pacientů s akutní promyelocytární leukemií
- Využití destičkového lyzátu při kultivacích mezenchymálních kmenových buněk
- Trombocytopenie u novorozence
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Trombocytopenie a koagulopatie u hepatopatie: úvod do problematiky
- Monitorace parametrů koagulace a možnosti jejich ovlivnění u pacientů s jaterní cirhózou před invazivními výkony
- Diferenciální diagnostika trombocytopenie v těhotenství
- Využití parametru IPF (Immature platelet fraction) v laboratorní diagnostice
