-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Intravenózní sedace kombinací dexmedetomidinu a ketaminu u operací v místní anestezii
Dexmedetomidine-ketamine intravenous sedation during local anaesthesia
Objective:
To evaluate the combination of dexmedetomidine and ketamine for analgesic sedation.Design:
Prospective randomised clinical study.Setting:
Department of Anaesthesiology and Intensive Care, University Hospital.Materials and methods:
Patients scheduled for Dupuytren’s contracture repair under local anaesthesia were randomly divided to groups C and D. Group D patients were administered an infusion of dexmedetomidine 1 μg . ml⁻¹ and ketamine 1 mg . ml⁻¹ in normal saline as follows: 10 minutes before surgery a bolus of 0.04 ml . kg⁻¹ (e. g. dexmedetomidine 0.04 µg . kg⁻¹, ketamine 0.04 mg . kg⁻¹) was given, followed by infusion of 2 ml . kg⁻¹. h⁻¹ for the first 10 minutes (dexmedetomidine 2 μg . kg⁻¹ . h⁻¹, ketamine 2 mg . kg⁻¹ . h⁻¹) and 1 ml . kg⁻¹ . h⁻¹ (dexmedetomidine 1 μg . kg⁻¹ . h⁻¹, ketamine 1 mg . kg⁻¹ . h⁻¹) for the rest of surgery. Group C patients were given normal saline. Vital functions, analgesia and Ramsay score were measured.Results:
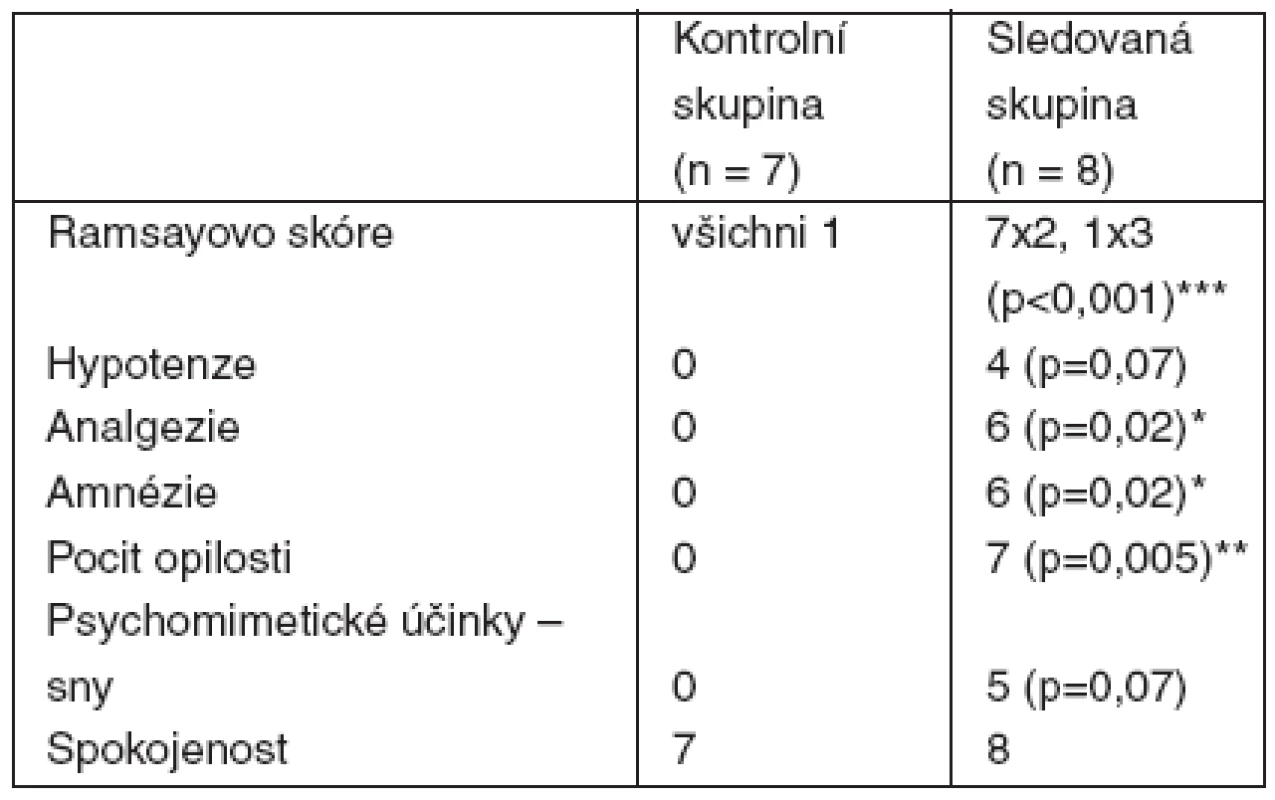
There were 7 patients in group C and 8 patients in group D. The demographic characteristics were comparable between the groups. We found differences between groups C and D in Ramsay score (all group C patients scored 1 point vs. 7 group D patients scored 2 points and one patient scored 3 points, p < 0.001), absence of reaction to painful application of local anaesthetic and tourniquet (0 vs. 6, p = 0.02), amnesia (0 vs. 6, p = 0.02) and light-headedness 1 hour after surgery (0 vs. 7, p = 0.005). Five patients in group D remembered dreams (NS). There was a slight fall in blood pressure (25–30% below base-line) in 4 patients in group D (NS) and no change in ventilation.Conclusions:
The combination of dexmedetomidine and ketamine provides analgesia, amnesia and catatonia with preserved cooperation, and has no respiratory effects.Keywords:
analgesic sedation – dexmedetomidine – ketamine
Autoři: Málek Jiří 1; Hess Ladislav 2; Hrehorová Zuzana 1; Šklíba Vojtěch 1
Působiště autorů: Klinika anesteziologie a resuscitace 3. LF UK Praha a FNKV 1; IKEM Praha 2
Vyšlo v časopise: Anest. intenziv. Med., 19, 2008, č. 2, s. 87-90
Kategorie: Anesteziologie - Původní práce
Souhrn
Cíl studie:
Zjistit bezpečnost a účinnost intravenózní kombinace dexmedetomidin-ketamin.Typ studie:
Prospektivní, randomizovaná, dvojitě slepá studie.Název a sídlo pracoviště:
Klinika anesteziologie a resuscitace.Materiál a metoda:
U pacientů operovaných pro Dupuytrenovu kontrakturu v lokální anestezii byla testována ve skupině D kombinace 50 μg dexmedetomidinu a 50 mg ketaminu v 50 ml F1/1 podle následujícího schématu: 10 minut před provedením lokální anestezie bolus 0,04 ml . kg⁻¹ (dexmedetomidin 0,04 μg . kg⁻¹, ketamin 0,04 mg . kg⁻¹), pak 10 minut kontinuálně rychlostí 2 ml . kg⁻¹hod.⁻¹(dexmedetomidin 2 μg . kg⁻¹. hod.⁻¹, ketamin 2 mg . kg⁻¹. hod.⁻¹) a dále 1 mg . kg⁻¹ . hod.⁻¹ (dexmedetomidin 1 μg . kg⁻¹ . hod.⁻¹, ketamin 1 mg . kg⁻¹ . hod.⁻¹). Pacienti v kontrolní skupině (C) dostávali fyziologický roztok. Sledovali jsme Ramsayovo skóre (RS), kardiorespirační parametry, analgezii a vedlejší účinky.Výsledky:
Celkem 7 pacientů bylo v C a 8 v D, demografické charakteristiky byly shodné. Rozdíly v C vs D byly v RS (v C všichni 1 vs v D 7 pacientů skóre 2 a 1 pacient skóre 3, p < 0,001), ve vymizení reakce na aplikaci lokálního anestetika a turniket (0 vs 6, p = 0,02), v amnézii na výkon (0 vs 6, p = 0,02) a pocitu mírné opilosti přetrvávající 1 hodinu po operaci (0 vs 7, p = 0,005). Pět pacientů v D si pamatovalo živé sny. U 4 pacientů v D byl pokles krevního tlaku (25–30 % pod výchozí hodnotu), porucha dýchání se nevyskytla.Závěr:
Sedace dexmedetomidinem a ketaminem poskytuje dobrou řiditelnost, analgezii i amnézii, neovlivňuje průchodnost dýchacích cest a ventilaci, působí katatonii, ale nepotlačí živé sny po ketaminu.Klíčová slova:
analgosedace – dexmedetomidin – ketaminÚvod
Pacienti přicházející na pracoviště plastické chirurgie dnes očekávají vysoký komfort. Někteří mohou ocenit, že i při použití metod lokoregionální anestezie dostanou dostatečně hlubokou a přitom bezpečnou analgosedaci s rychlým zotavením a minimálními vedlejšími účinky. Tradiční adjuvantní medikace při výkonech v lokální anestezii byla zaměřena primárně na amnézii a sedaci. Se zvyšujícími se požadavky na bezpečnost vystupují do popředí také stabilita oběhu, absence nežádoucích účinků na dýchání, potlačení pooperační nevolnosti a zvracení (PONV) a rychlé zotavení.
Dexmedetomidin (Precedex®) je alfa-2-adrenergní agonista, který působí podobně jako jiná látka této skupiny – klonidin – snížení tonu sympatiku na periferii se stabilizací hemodynamiky, sedaci, anxiolýzu, analgezii a potenciaci účinku jiných anestetik, opioidů a hypnotik [1, 2]. Oproti klonidinu má dexmedetomidin vyšší selektivitu pro alfa-2-sympatoadrenergní receptor, má rychlejší nástup účinku, který se snáze titruje, i kratší biologický poločas (asi 2 hodiny), což ho činí vhodnějším pro využití v anesteziologické péči. Dexmedetomidin se běžně podává ve formě infuze, po jejímž ukončení přetrvává efekt asi 2 hodiny [3]. Publikované práce prokázaly, že dexmedetomidin působí krátkodobou a řiditelnou analgosedaci [4, 5].
Dexmedetomidin aktivuje alfa-2-adrenergní receptory, čímž potlačuje uvolňování neurotransmiterů spojených s bolestí a snižuje peroperační spotřebu opioidních analgetik [3, 6–8]. To by mělo vést ke snížení rizika vzniku dechové deprese a PONV. Jako sedativum je dexmedetomidin srovnatelný s propofolem [3, 9], nepůsobí však na rozdíl od něj dechovou depresi. I při vyšších dávkách mají pacienti zachované spontánní dýchání a udržují si dostatečnou oxygenaci [5].
Pro kardiálně kompromitované pacienty je výhodné to, že dexmedetomidin snižuje spotřebu kyslíku myokardem a prodloužením diastoly zvyšuje průtok krve myokardem [10]. Dexmedetomidin potlačuje rovněž oběhovou reakci na bolest [5],takže injekce lokálního anestetika nejsou doprovázeny zvýšením krevního tlaku a srdeční frekvence.
V naší předchozí práci [11] jsme s úspěchem použili k analgosedaci při výkonech v kosmetické chirurgii klonidin. Současná studie měla potvrdit využitelnost dexmedetomidinu pro analgosedaci při výkonech v místní anestezii.
Soubor a metodika
Po souhlasu etické komise byla provedena prospektivní randomizovaná klinická studie u pacientů indikovaných k operaci Dupuytrenovy kontraktury. Tato operace se v naší nemocnici dělá běžně v místní infiltrační anestezii s jednodenní hospitalizací. Pacienti byli po podepsání poučeného souhlasu náhodně rozděleni na kontrolní (C) a sledovanou (D) skupinu. Sledovaná skupina dostala sedaci směsí dexmedetomidinu a ketaminu, kontrolní skupina fyziologický roztok (FR). U skupiny D byl do 50ml stříkačky naředěn s FR dexmedetomidin (50 μg) a ketamin (50 mg) a lineárním dávkovačem Brown Perfusor® compact byla podávána analgosedace 10 minut před provedením lokální anestezie podle následujícího schématu: nejprve jako nasycovací dávka bolus 1 ml směsi na 25 kg t. h., tj. 0,04 μg . kg-1 dexmedetomidinu a 0,04 mg . kg-1 ketaminu, pak 10 minut kontinuálně infuze rychlostí 2 ml . kg-1. h-1, tj. 2 μg . kg-1.h-1 dexmedetomidinu a 2 mg . kg-1. h-1 ketaminu a po 10 minutách trvale až do konce operace infuze rychlostí 1 ml . kg-1. h-1, tj. 1 μg . kg-1. h-1 dexmedetomidinu a 1 mg . kg-1. h-1 ketaminu. Pacienti ve skupině C dostávali z dávkovače podle téhož schématu FR. Deset minut od úvodního bolusu operatér provedl infiltrační anestezii operačního pole a prováděl operaci běžným způsobem. Kromě standardního monitorování (neinvazivní krevní tlak /TK/, pulzní oxymetrie, EKG, dechová frekvence /DF/) byly zaznamenávány i hodnoty Ramsayova skóre a reakce pacienta na vpich jehly při podání lokálního anestetika. Dále byla nejprve po ukončení operace a podruhé při vizitě u pacienta odpoledne po operaci hodnocena spokojenost pacienta, výskyt snů a halucinací, psychomotorický neklid, výskyt dechové deprese (pokles DF pod 8/min nebo pokles SpO2 pod 91 %), tachykardie (vzestup hodnoty tepové frekvence /P/ o více jak 25 % nad hodnotu před infuzí), bradykardie (pokles P o více jak 25 % pod hodnotu před infuzí nebo pod 50 tepů/min), hypotenze a hypertenze (pokles, respektive vzestup TK o více jak 25 % pod hodnotu před úvodním bolusem, respektive nad ní), PONV a jiné potenciální nežádoucí účinky.
Pro statistickou analýzu byly použity t-test a Fisherův exaktní test. Hodnoty p < 0,05 byly považovány za statisticky významné.
Výsledky
I přes zaslepenost studie byly mezi pacienty zjevné výrazné rozdíly v Ramsayovu skóre, reakci na bolestivou infiltraci patologicky změněné tkáně operované ruky lokálním anestetikem a výskyt pooperační amnézie, proto byla studie odslepena a výsledky zhodnoceny již po prvních 15 sledovaných analgosedacích, kdy se daly očekávat statisticky významné rozdíly. Demografická charakteristika souboru pacientů je v tabulce 1.
Tab. 1. Demografické charakteristiky souboru 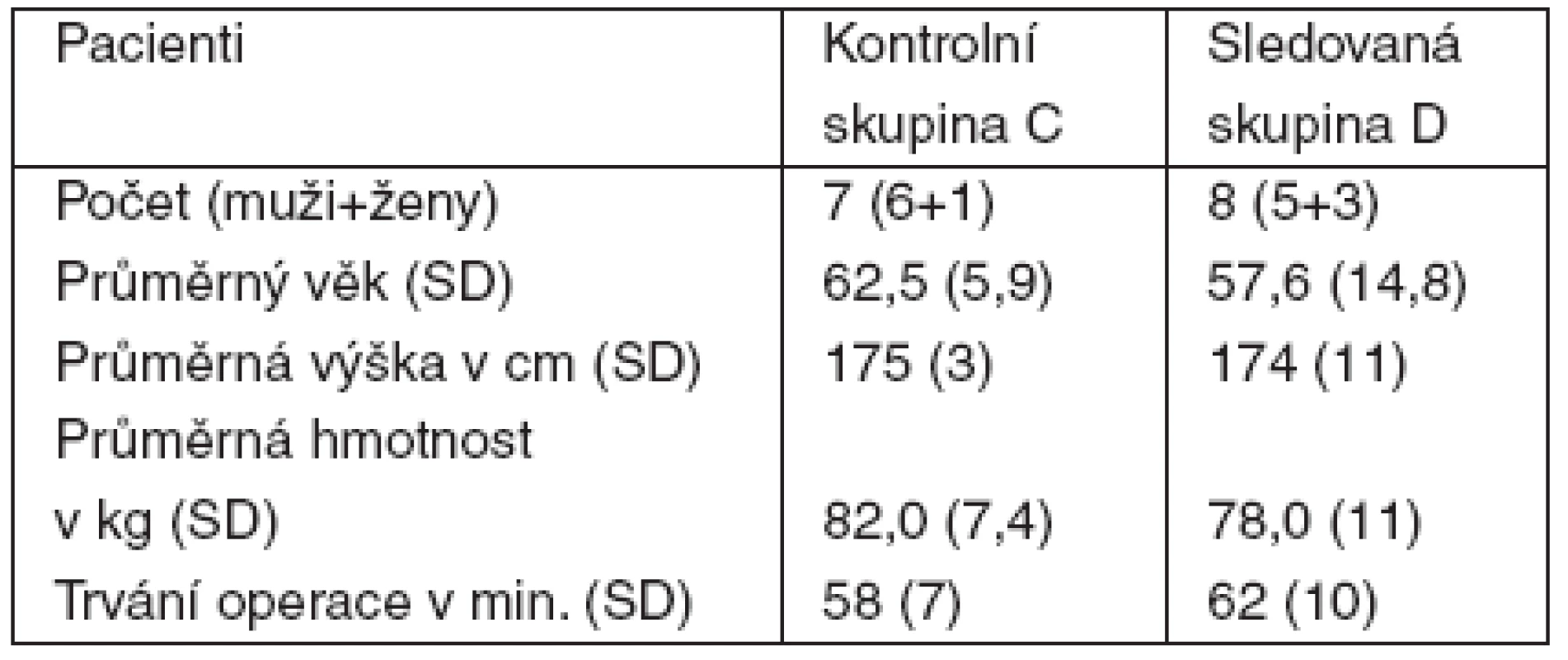
Poznámka: SD – směrodatná odchylka I přes relativně malý rozsah souboru se skutečně v některých parametrech výsledky skupiny D výrazně lišily od skupiny C (tab. 2). Především se ve skupině D průměrně do 10 minut projevil nástup účinku výraznou sedací, anxiolýzou a katatonií. Většina pacientů měla vymizelou reakci na kožní vpich a bolestivou aplikaci většího množství roztoku lokálního anestetika do patologicky změněné tkáně. Jak již bylo uvedeno, i přes zaslepení studie bylo záhy zřejmé, který z pacientů pravděpodobně patří do skupiny D a operatér při známkách kvalitní analgosedace několikrát použil i turniket pro zajištění bezkrevného operačního pole, což pacienti bez problémů tolerovali téměř hodinu. Ramsayovo skóre nabylo prakticky u všech pacientů skupiny D hodnotu 2, jen zcela ojediněle a na krátkou dobu hodnotu 3. Žádný z pacientů ve skupině D si nestěžoval na vedlejší účinky podaných látek, i když ve většině případů měli přechodně barevné vize, 2 pacienti měli i sluchové vjemy a 2 pacienti popisovali složité sny, které pokládali za skutečné. Většina měla pocit příjemné opilosti, navenek však působili zcela klidně a nehybně. Ze svého stavu byli probuditelní verbálním příkazem a byli schopni vyhovět výzvě operatéra k pohybu operovanou končetinou. Na celou operaci nebo její podstatnou část měla většina pacientů amnézii, své prožitky, které lze připisovat ketaminu, si však pamatovali. Po zastavení infuze odezněl klinicky pozorovatelný efekt do 10 minut, přesto pocit mírné sedace na pokoji pokračoval asi 1 hodinu. Kromě poklesu TK u 4 pacientů jsme nepozorovali žádné další reakce – ani oběhové, ani ventilační. Mírná hypotenze nevyžadovala žádnou léčbu a po zastavení infuze rychle odezněla. Průchodnost dýchacích cest byla po celou dobu podávání sledované směsi zcela zachována.
Diskuse
Výhodný účinek alfa-2 agonistů na perioperační průběh, zejména při použití s ketaminem, je dobře známý. Na našem pracovišti jsme vypracovali metodu kombinace ketaminu a klonidinu v kosmetické chirurgii [11] i léčbě popálených. Také zahraniční studie prokázaly, že klonidin poskytuje analgezii, sedaci a hemodynamickou stabilitu [12–14]. Klonidin má v porovnání s dexmedetomidinem nevýhodu prodlouženého nástupu účinku (30–60 minut po intravenózním podání a 2 až 4 hodiny pro perorálním podání) a dlouhého přetrvávání. To činí použití klonidinu hůře řiditelné, navíc je nyní klonidin obtížně dostupný. Dexmedetomidin sdílí výhody klonidinu, navíc jeho farmakokinetika je výhodnější. Je mnohem selektivnější v účinku na alfa-2-sympatoadrenergní receptor (1620 : 1 vs 220 : 1). Má lineárnější vztah mezi dávkou a účinkem, což umožňuje variabilnější dávkování podle požadovaného účinku. Rychlý nástup účinku a kratší biologický poločas umožňují rychlejší reakci na potřeby pacienta i rychlejší zotavení. Přetrvávající účinek po operaci potlačuje pooperační bolest, PONV a stabilizuje oběh. Ve velké studii, týkající se analgosedace v plastické chirurgii, prokázal Bitar et. al. [15], že při použití opioidů byla nejčastější komplikací dechová deprese, nauzea a zvracení. Dexmedetomidin tyto nežádoucí účinky nemá [16, 17]. Recentní metaanalýza 23 studií s 3395 pacienty prokázala, že alfa-2 sympatomimetika snižují v perioperačním období mortalitu a ischemické srdeční příhody [18]. V naší studii byli vybráni zdraví pacienti (ASA 1–2), takže výhodné účinky nemohly být prokázány, kombinace však prokázala svoji bezpečnost a může být použita i u rizikových pacientů.
Přesto je nutno zmínit, že jde o off-label použití, protože přípravek je u nás registrován pouze pro použití pro krátkodobou sedaci pacientů při odvykání od umělé plicní ventilace. Na druhé straně je třeba zdůraznit, že bezpečnost dexmedetomidinu při analgosedaci byla prokázána v řadě prací [7, 19–21], a to i při rozsáhlých operacích, kde snižuje mortalitu a riziko ischémie myokardu [18, 22].
Nežádoucí účinky kombinace dexmedetomidinu a ketaminu byly v našem souboru malé. Mírná hypotenze nevyžadovala žádnou léčbu a po zastavení infuze rychle odezněla. Překvapením bylo, že na rozdíl od práce Levanena et al. [23] se u našich pacientů často vyskytly barevné sny nebo představy, které pokládali za skutečné a pamatovali si je i po probuzení, ačkoliv jinak měli na průběh operace amnézii. Levanen et al. přitom popsali úplné vymizení psychomimetických účinků ketaminu po premedikaci dexmedetomidinem. To se v naší práci nepotvrdilo. Příčinou může být různý design studie: Levanen podal nejprve nitrosvalově dexmedetomidin, a teprve po 20 minutách nitrožilně ketamin. My jsme naopak smísili obě látky v jedné stříkačce pro současnou aplikaci. Zajímavá by byla možnost použít S-ketamin, který by mohl mít – díky příznivějšímu farmakologickému profilu – menší výskyt psychomotorických reakcí. Látka však u nás není registrována a podle ústního sdělení zástupce výrobce se ani s registrací zatím nepočítá. Další možností by bylo přidat ke směsi ketaminu a dexmedetomidinu midazolam, výsledkem by však mohla být významná potenciace útlumu vědomí, případně s poruchou průchodnosti dýchacích cest, jak jsme pozorovali po intramuskulárním podání u popálených pacientů [24]. Tato možnost by vyžadovala další studii.
Konečně zbývá vysvětlit fenomén vysoké spokojenosti pacientů v obou skupinách. Bylo opakovaně zjištěno, že příčiny spokojenosti pacientů jsou multifaktoriální a jen málo souvisejí s intenzitou bolesti a okamžitým diskomfortem, pokud není velmi významný (což u žádného pacienta v naší studii nenastalo), naopak pozitivně korelují se zájmem, jaký je pacientovi věnován ošetřujícím personálem a negativně s nepříjemnými vzpomínkami [25]. Z tohoto aspektu je obecně spokojenost pacientů v klinických studiích vysoká, protože v rámci předoperačního vyšetření i pooperačního sledování jsou péče a zájem personálu poskytnuty ve velké míře bez ohledu na zařazení ve skupině, což bylo zřejmě i důvodem spokojenosti všech pacientů v našem souboru.
Závěr
Vypracované schéma sedace dexmedetomidinem a ketaminem má následující výhody: dobrou řiditelnost, dobrou analgezii i amnézii na operaci, zachovává průchodnost dýchacích cest a neovlivňuje ventilaci, působí katatonii s menším ovlivněním vědomí. Relativní nevýhoda, kterou ovšem pacienti v našem souboru nehodnotili negativně, je to, že nepotlačí živé sny po ketaminu.
Studie vznikla za podpory grantu IGA MZČR NR 8508.
Došlo 13. 11. 2007.
Přijato 5. 1. 2008.
Adresa pro korespondenci:
Doc. MUDr. Jiří Málek, CSc.
Klinika anesteziologie a resuscitace
3. LF UK Praha a FNKV Praha
Šrobárova 50
100 34 Praha 10
e-mail: malekj@fnkv.cz
Zdroje
1. Docherty, J. R. Subtypes of functional alpha-1 and alpha-2 adrenoceptors. Eur. J. Pharmacol., 1998, 361, p. 1–15.
2. Pandharipande, P., Ely, E. W., Maze, M. Alpha-2 agonists: can they modify the outcomes in the Postanesthesia Care Unit? Curr. Drug Targets, 2005, 6, p. 749–754.
3. Arain, S. R., Ebert, T. J. The efficacy, side effects, and recovery characteristics of dexmedetomidine versus propofol when used for intraoperative sedation. Anesth. Analg., 2002, 95, p. 461–466.
4. Hall, J. E., Uhrich, T. D., Barney, J. A. et al. Sedative, amnestic, and analgesic properties of small-dose dexmedetomidine infusions. Anesth. Analg., 2000, 90, p. 699–705.
5. Ebert, T. J., Hall, J. E., Barney, J. A. et al. The effects of increasing plasma concentrations of dexmedetomidine in humans. Anesthesiology, 2000, 93, p. 382–394.
6. Coursin, D. B., Coursin, D. B., Maccioli, G. A. Dexmedetomidine. Curr. Opin. Crit. Care, 2001, 7, p. 221–226.
7. Wahlander, S., Frumento, R. J., Wagener, G. et al. A prospective, double-blind, randomized, placebo-controlled study of dexmedetomidine as an adjunct to epidural analgesia after thoracic surgery. J. Cardiothorac. Vasc. Anesth., 2005, 19, p. 630–635.
8. Unlugenc, H., Gunduz, M., Guler, T. et al. The effect of pre-anaesthetic administration of intravenous dexmedetomidine on postoperative pain in patients receiving patient-controlled morphine. Eur. J. Anaesthesiol., 2005, 22, p. 386–391.
9. Correa-Sales, C., Rabin, B. C., Maze, M. A hypnotic response to dexmedetomidine, an alpha 2 agonist, is mediated in the locus coeruleus in rats. Anesthesiology, 1992, 76, p. 948–952.
10. Willigers, H. M., Prinzen, F. W., Roekaerts, P. M. Comparison of the effects of dexmedetomidine and esmolol on myocardial oxygen consumption in dogs. Eur. J. Anaesthesiol., 2004, 21, p. 957–966.
11. Málek, J., Hess, L., Starec, M., Vokálek, P. Clonidin při analgosedacích u korektivní a kosmetické chirurgie. Anesteziol. neodkl. Péče, 1997, 8, p. 134–136.
12. Britto, J. A., McCoy, D., Fourie, L. R. Clonidine as premedication for rhinoplasty. Plast. Reconstr. Surg., 1997, 100, p. 548–549.
13. Man, D. Premedication with oral clonidine for facial rhytidectomy. Plast. Reconstr. Surg., 1994, 94, p. 214–215.
14. Taittonen, M. T., Kirvela, O. A., Aantaa, R., Kanto, J. H. Effect of clonidine and dexmedetomidine premedication on perioperative oxygen consumption and haemodynamic state. Br. J. Anaesth., 1997, 78, p. 400–406.
15. Bitar, G., Mullis, W., Jacobs, W. et al. Safety and efficacy of office-based surgery with monitored anesthesia care/sedation in 4778 consecutive plastic surgery procedures. Plast. Reconstr. Surg., 2003, 111, p. 150–156.
16. Cortinez, L. I., Hsu, Y. W., Sum-Ping, S. T. et al. Dexmedetomidine pharmacodynamics: part II: Crossover comparison of the analgesic effect of dexmedetomidine and remifentanil in healthy volunteers. Anesthesiology, 2004, 101, p. 1077–1083.
17. Hsu, Y. W., Cortinez, L. I., Robertson, K. M. et al. Dexmedetomidine pharmacodynamics: part I: Crossover comparison of the respiratory effects of dexmedetomidine and remifentanil in healthy volunteers. Anesthesiology, 2004, 101, p. 1066–1076.
18. Wijeysundera, D. N., Naik, J. S., Beattie, W. S. Alpha-2 adrenergic agonists to prevent perioperative cardiovascular complications: a meta-analysis. Am. J. Med., 2003, 114, p. 742–752.
19. Bekker, A. Y., Basile, J., Gold, M. et al. Dexmedetomidine for awake carotid endarterectomy: efficacy, hemodynamic profile, and side effects. J. Neurosurg. Anesthesiol., 2004, 16, p. 126–135.
20. Bekker, A., Sturaitis, M. K. Dexmedetomidine for neurological surgery. Neurosurgery, 2005, 57, Suppl., p. 1–10.
21. Guler, G., Akin, A., Tosun, Z. et al. Single-dose dexmedetomidine reduces agitation and provides smooth extubation after pediatric adenotonsillectomy. Paediatr. Anaesth., 2005, 15, p. 762–766.
22. Oliver, M. F., Goldman, L., Julian, D. G., Holme, I. Effect of mivazerol on perioperative cardiac complications during non--cardiac surgery in patients with coronary heart disease: the European Mivazerol Trial (EMIT). Anesthesiology, 1999, 91, p. 951–961.
23. Levanen, J., Makela, M. L., Scheinin, H. Dexmedetomidine premedication attenuates ketamine-induced cardiostimulatory effects and postanesthetic delirium. Anesthesiology, 1995, 82, p. 1117–1125.
24. Málek, J., Hess, L., Jandová, J., Šimánková, E. Použití intramuskulárního podání dexmedetomidinu u popálených – předběžné výsledky. Anest. intenziv. Med. 2008, 19, č. 2, s. 82–86.
25. Bonnet, F., Marret, E. Influence of anaesthetic and analgesic techniques on outcome after surgery. Br. J. Anaesth., 2005, 95, p. 52–58.
Štítky
Anestéziológia a resuscitácia Intenzívna medicína
Článek Zprávy ČSARIMČlánek Poznámka k pětiletému výročí
Článok vyšiel v časopiseAnesteziologie a intenzivní medicína
Najčítanejšie tento týždeň
2008 Číslo 2- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Metamizol v liečbe pooperačnej bolesti u opioid-tolerantnej pacientky – kazuistika
- e-Konzilium.cz — Masivní plicní embolie při tromboembolické nemoci
-
Všetky články tohto čísla
- Trojhladinová ventilácia pľúc (3LV® – 3 level ventilation) – prvé klinické skúsenosti
- Epidemiologie invazivní kandidózy a kandidémie – stále aktuální problém
- Zprávy ČSARIM
- Report of the meeting of the Section and Board of Anaesthesiology (SBA) Istanbul, Saturday 17th November 2007
- Minimal Monitoring Standards in the Perioperative Period
- Poznámka k pětiletému výročí
- Nozokomiální versus komunitní infekce na JIP
- Laryngeální maska LMA-ProSeal™ – bezpečná možnost zajištění dýchacích cest pro laparoskopické cholecystektomie
- Použití intramuskulárního podání dexmedetomidinu u popálených – předběžné výsledky
- Intravenózní sedace kombinací dexmedetomidinu a ketaminu u operací v místní anestezii
- Klasifikace infekcí v intenzivní péči, srovnání inkubační doby a nosičství
- Teória a zjednodušený matematický model viachladinovej umelej ventilácie pľúc
- Anesteziologie a intenzivní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Nozokomiální versus komunitní infekce na JIP
- Epidemiologie invazivní kandidózy a kandidémie – stále aktuální problém
- Laryngeální maska LMA-ProSeal™ – bezpečná možnost zajištění dýchacích cest pro laparoskopické cholecystektomie
- Trojhladinová ventilácia pľúc (3LV® – 3 level ventilation) – prvé klinické skúsenosti
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy