-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Použití intramuskulárního podání dexmedetomidinu u popálených – předběžné výsledky
Intramuscular dexmedetomidine in burns victims – preliminary results
Objective:
The aim was to evaluate the combination of dexmedetomidine and ketamine and dexmedetomidine, ketamine and midazolam.Design:
Prospective randomised clinical study.Setting:
Department of Anaesthesiology and Intensive Care, University Hospital.Materials and methods Part 1:
Following ethics committee approval and written consent, patients treated for burns were divided into 4 groups according to the intramuscular dose of dexmedetomidine (D) 2 μg .kg⁻¹ or 2.5 μg .kg⁻¹ and ketamine (K) 2.0 mg.kg⁻¹ or 3.0 mg.kg⁻¹.Results Part 1:
Total 43 anaesthetics were given to 18 patients. Combinations D2K2 and D2.5K3 were stopped for insufficient effect or excessive sedation respectively. No respiratory depression, airway obstruction, bradycardia or hypotension appeared and any combination suppressed the psychomimetic reactions to ketamine. The only difference found between D2K3 vs D2.5K2 was preserved cooperation in the former combination (p < 0.05).Materials and methods Part 2:
To suppress the CNS effects of ketamine, either midazolam (M) 1 mg IM or placebo (P) was added to the combination of dexmedetomidine 2 μg . kg⁻¹ + ketamine 2 mg . kg⁻¹ (DKM or DKP combinations). The protocol was identical to Part 1.Results Part 2:
The study was prematurely aborted after signs of excessive sedation in 7 patients and airway obstruction in some patients. Unconsciousness appeared in 5/7 vs. 0/7 in the DKM vs. DKP group (p < 0.05), the quality of anaesthesia improved in 4 patients in the DKM group.Conclusions:
The combination of intramuscular dexmedetomidine 2.5 μg . kg⁻¹ with ketamine 2.0 mg . kg⁻¹ is more likely to preserve cooperation during anaesthesia than dexmedetomidine 2 μg . kg⁻¹with ketamine 3.0 mg . kg⁻¹ IM. Adding 1–2 mg of midazolam may result in vital function disturbances.Keywords:
general anaesthesia – analgesic sedation – management of the burn patient – intramuscular administration – dexmedetomidine – ketamine – midazolam
Autori: Málek Jiří; Hess Ladislav 2; Jandová Jaroslava 1; Šimánková Eva 1
Pôsobisko autorov: Klinika anesteziologie a resuscitace 3. LF Univerzity Karlovy v Praze a FNKV, Praha 1; IKEM, Praha 2
Vyšlo v časopise: Anest. intenziv. Med., 19, 2008, č. 2, s. 82-86
Kategória: Anesteziologie - Původní práce
Súhrn
Cíl studie:
Zjistit bezpečnost a účinnost intramuskulární kombinace dexmedetomidin-ketamin a dexmedetomin-ketamin-midazolam.Typ studie:
Prospektivní, randomizovaná, dvojitě slepá studie.Název a sídlo pracoviště:
Klinika anesteziologie a resuscitace 3. LF UK v Praze a FNKV, Praha.Materiál a metoda, část 1:
Po souhlasu etické komise a poučeném souhlasu byly u popálených pacientů testovány 4 kombinace dexmedetomidinu (D) 2 μg . kg⁻¹, nebo 2,5 μg . kg⁻¹ a ketaminu (K) 2,0 mg . kg⁻¹, nebo 3,0 mg . kg⁻¹ i. m.Výsledky, část 1:
Bylo podáno 43 kombinací 18 pacientům. Kombinace D2K2 byla ukončena předčasně pro nedostatečný efekt, D2.5K3 pro dlouhodobou sedaci. Rozdíl mezi D2K3 a D2.5K2 bylo zachované vědomí v D2K3 vs D2.5K2 (p < 0,05). Kromě psychomimetické reakce ve všech skupinách se nikde nevyskytly významné vedlejší účinky.Materiál a metoda, část 2:
Pro potlačení psychomimetických účinků jsme podali midazolam (M) jako trojkombinaci DKM: dexmedetomidin (D) 2 μg .kg⁻¹ + ketamin (K) 2 mg.kg⁻¹ + M 1 mg i.m. nebo místo M placebo (P).Výsledky, část 2:
Studie byla ukončena předčasně pro významný útlum. Bezvědomí bylo v DKM vs DKP 5/7 vs 0/7 (p < 0,05), kvalita anestezie v DKM se zlepšila u 4 pacientů. U 2 pacientů se zachovaným vědomím v DKM byl při další anestezii podán midazolam 2 mg. Následoval dlouhodobý útlum vědomí provázený bradykardií a hypotenzí.Závěr:
Kombinace dexmedetomidinu 2 μg . kg⁻¹ a ketaminu 3,0 mg . kg⁻¹ i. m. vede spíše k anestezii bez reakce na oslovení, kombinace dexmedetomidinu 2,5 μg . kg⁻¹ a ketaminu 2,0 mg . kg⁻¹ i. m. spíše k analgosedaci se spoluprací. Přidání 1–2 mg midazolamu může vést k významnému ovlivnění vitálních funkcí.Klíčová slova:
celková anestezie – analgosedace – léčba popálení – intramuskulární injekce – dexmedetomidin – ketamin – midazolamÚvod
Použití alfa-2 sympatomimetik v perioperační péči je stále populárnější vzhledem k celé řadě výhodných účinků, kterou tato skupina látek má (např. schopnost tlumit sympatickou odpověď na operační stres a navodit hemodynamickou stabilitu, zesilovat účinek anestetik, opioidů a benzodiazepinů, absence vlastního tlumivého účinku na dýchání). V klinických studiích byl zjištěn menší výskyt srdeční ischémie v perioperační době [1]. Předběžné výsledky naznačují, že alfa-2-agonisté mohou hrát roli v prevenci pooperační nevolnosti a zvracení, potlačení svalového třesu a pooperačního deliria. Kombinace s ketaminem je logická vzhledem k tomu, že na oběh mají obě látky opačné účinky, které by se měly navzájem eliminovat, ani jedna nevyvolává dechovou depresi a analgetické a hypnotické účinky by se měly potencovat (tab. 1).
Tab. 1. Srovnání ketaminu a dexmedetomidinu 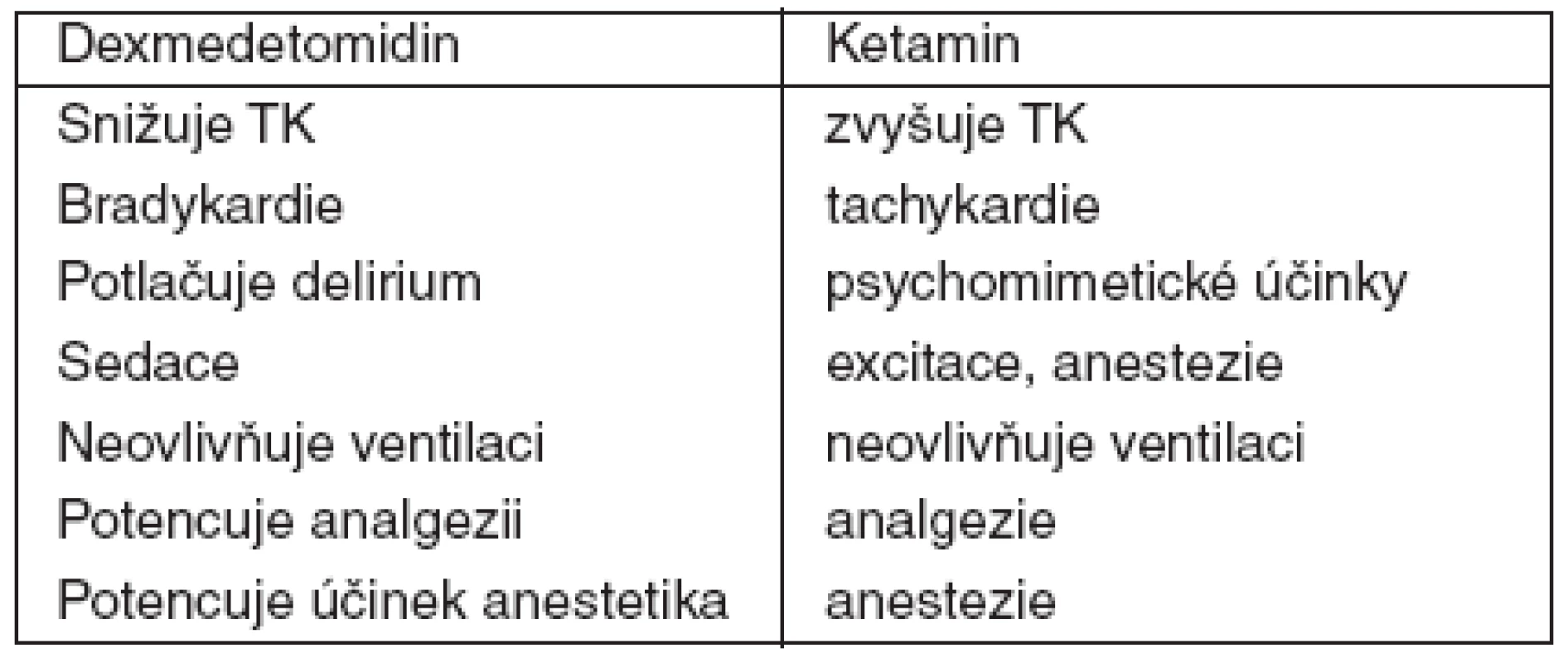
Ketamin se tradičně používá v přednemocniční péči i v anestezii popálených díky jeho schopnostem zachovat spontánní ventilaci a analgetickému účinku. Poměrně nedávno se začal využívat i proti vzniku hyperalgezie po opioidech. Tento účinek spočívá v jeho schopnosti blokovat N-metyl-D-aspartátový (NMDA) receptor [2, 3].
Dexmedetomidin je potentní a vysoce selektivní látka ze skupiny alfa-2 sympatomimetik s význačnými sedativními a vlastními analgetickými účinky, které navíc významně snižují spotřebu anestetik a opioidů během operace [1]. Díky tomu, že potlačuje na periferii účinek sympatiku [4], může potlačit sympatomimetické účinky ketaminu na oběh a na centrální nervový systém. Na druhé straně by ketamin měl potlačit výskyt bradykardie a hypotenze, které byly popsány v souvislosti s použitím dexmedetomidinu [1, 4]. Použití kombinace dexmedetomidinu a ketaminu bylo popsáno u dětí [5, 2, 7], premedikaci dexmedetomidinem před ketaminovou anestezií použili u dospělých úspěšně Lavänen et al. [8].
Na našem pracovišti jsme měli dobrou zkušenost s kombinací alfa-2 sympatomimetika klonidinu s ketaminem v anestezii popálených. Naše předchozí studie [9, 10] potvrdily hypotézu, že přidání klonidinu ke ketaminu vede ke snížení celkové dávky ketaminu, lepší hemodynamické stabilitě během operace a lepšímu zotavení ve srovnání s podáním ketaminu samotného, přesto se nám ale zcela nepodařilo přidáním klonidinu potlačit psychomimetické účinky ketaminu.
Cílem naší studie bylo ověřit bezpečnost a účinnost intramuskulárního podání kombinace dexmedetomidinu a ketaminu, účinek na kvalitu analgosedace, popř. anestezie, a ovlivnění vitálních funkcí. Použití intramuskulárního dexmedetomidinu bylo popsáno zatím jen 2 skupinami autorů [11–18] a zatím nebyly uveřejněny práce kombinující intramuskulární podání směsi obou léků, proto bylo třeba nejprve stanovit základní dávkování a vzájemný poměr obou farmak. Pro případ, že by dexmedetomidin – podobně jako klonidin – neredukoval nežádoucí psychomimetické účinky ketaminu, byla připravena v druhé fázi trojkombinace dexmedetomidin-ketamin-midazolam.
ČÁST 1
Kombinace dexmedetomidin-ketamin
Metodika
Po souhlasu etické komise a poučeném souhlasu pacientů byla provedena randomizovaná prospektivní klinická studie u pacientů s popáleninami 2. a 3. stupně na 10–25 % tělesného povrchu při opakované chirurgické léčbě v celkové anestezii. Vylučovacími kritérii byly: klasifikace ASA IV a více, známá alergie na pokusné léky, epilepsie, nitrolební hypertenze, toxikomanie v anamnéze, psychiatrická onemocnění, AV blok a lokalizace poranění znemožňující přiložit obličejovou masku a použít manžetu pro neinvazivní měření krevního tlaku.
Všichni pacienti byli premedikováni 50 mg petidinu a 0,5 mg atropinu 20 minut před začátkem anestezie (zavedeno jako standardní schéma na Klinice popáleninové medicíny FNKV) a měli zabezpečený periferní žilní vstup. Sledovanými parametry byly: nástup účinku podle sdělení pacienta, zachování reakce na oslovení, nutnost přidání dalšího anestetika, výskyt psychomimetických účinků; z vitálních parametrů to byly: dechová frekvence, neinvazivní krevní tlak (NIBP), saturace arteriální krve kyslíkem (SpO2), tepová frekvence (P). Monitorování bylo zahájeno po příjezdu na operační sál ještě před aplikací sledované kombinace farmak a hodnoty byly dále zaznamenávány každých 5 minut až do zotavení (Glasgow Coma Scale 14 a 15). Pacienti byli náhodně rozděleni do 4 skupin podle vzájemného poměru dávek dexmedetomidinu a ketaminu (tab. 2). Každá kombinace byla během opakovaných anestezií pacientů použita jen jednou. Dávka byla smíchána v jedné stříkačce a aplikována do deltového svalu. Další anesteziologickou péči převzal jiný anesteziolog, který neznal zařazení pacienta do skupiny. Nástup účinku byl zjištěn podle subjektivních pocitů pacienta nebo ztrátou reakce na verbální výzvu. Odstranění starých obvazů začalo zhruba o dalších 5 minut později. V případě známek nedostatečné analgezie (údaj od pacienta, pohyby) byl podán kyslík a oxid dusný obličejovou maskou, dále pak ketamin po 0,5 mg . kg-1 i. v.
Tab. 2. Rozdělení analgosedace do skupin – část 1 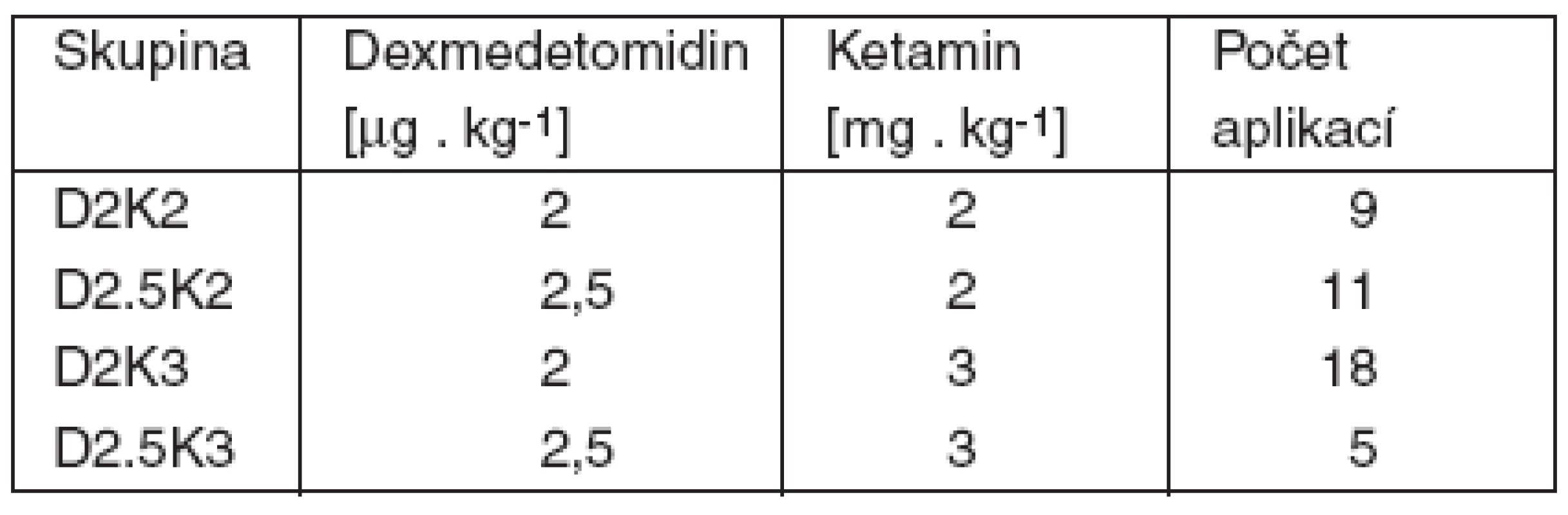
V případě poklesu SpO2 < 90% by byla zahájena manuální podpůrná plicní ventilace okruhem anesteziologického přístroje pomocí obličejové masky. Do protokolu byly zaznamenávány dále změny NIBP a P o více než 25 % výchozích hodnot, SpO2< 90%, psychomimetické projevy a nutnost přidání dalšího anestetika. Kvalita anestezie byla hodnocena pětibodovou škálou:
- 1 – vynikající;
- 2 – velmi dobrá, pouze v některé fázi výkonu nutnost přidání oxidu dusného s kyslíkem;
- 3 – dobrá, nutnost přidání intravenózního anestetika v určité fázi;
- 4 – nutnost doplnit intravenózní anestetikum pro nedostatečný účinek nebo významný psychomotorický neklid od začátku výkonu;
- 5 – významné vedlejší účinky, které znemožňují provést výkon.
Pacienti byli po operaci sledování do GCS >13, popř. do stabilizace dýchání a oběhu, a pak předáni na oddělení. Statistická analýza byla provedena Studentovým t-testem a párovým McNemarovým testem. Hodnota p < 0,05 byla považována za statisticky významnou.
Výsledky
Bylo podáno 43 anestezií celkem 18 pacientům (2–4 anestezie na pacienta), jeden pacient ze studie odstoupil pro nepříjemné psychomimetické reakce po ketaminu během první anestezie (není ve výsledcích dále uveden). Po prvním zhodnocení předběžných výsledků bylo zastaveno podávání kombinace D2K2 pro nedostatečný účinek a D2.5K3 pro nadměrné přespávání po operaci, které u pacientů s popáleninami interferovalo s perorální výživou a rehabilitací. Dále byly prováděny a statisticky hodnoceny jen kombinace D2K3 a D2.5K2. Průměrné trvání operace ve všech skupinách bylo 15–20 minut, analgetický/anestetický účinek jakékoliv kombinace začal za 6–10 minut a trval 25–30 minut. Zotavení do GCS 15 a žádosti pacienta o podání čaje (podle předchozí domluvy s pacienty) trvalo 60–90 minut, s výjimkou skupiny D2.5K3, kde trvalo 4–5 hodin. V žádné skupině se nevyskytla deprese dechu, obstrukce dýchacích cest, bradykardie a hypotenze. V každé skupině se vyskytla jedenkrát tachykardie (P > 25 % výchozí hodnoty). V dalších nežádoucích účincích nebyly mezi skupinami rozdíly. Další srovnání je v tabulce 3.
Tab. 3. Výsledky – část 1 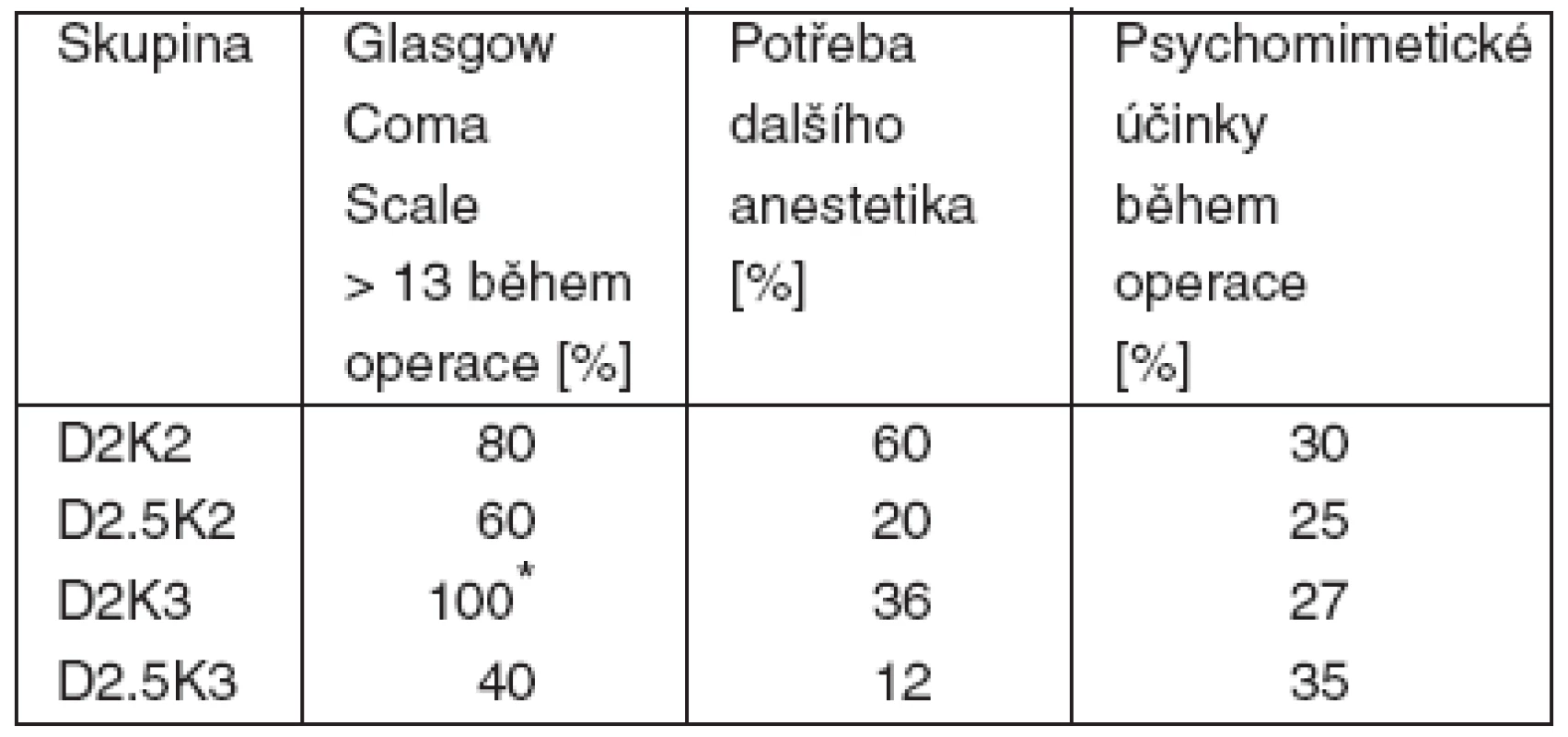
Poznámka: *D2K3 vs D2.5K2; p < 0,05 ČÁST 2
Kombinace dexmedetomidin-ketamin-midazolam
Metodika
V 1. části se nepodařilo vždy potlačit nežádoucí účinky ketaminu na CNS, proto byla po souhlasu etické komise a poučeném souhlasu pacientů podniknuta 2. část randomizované prospektivní klinické studie u pacientů s popáleninami. V části 2 byl přidán ke kombinaci D2K2, která byla v předchozí části hodnocena jako nejméně účinná, 1 mg midazolamu. Zařazovací i vylučovací kritéria byla shodná s částí 1. Všichni pacienti byli premedikováni 50 mg petidinu a 0,5 mg atropinu 20 minut před začátkem anestezie a měli zabezpečen periferní žilní vstup. Sledované parametry, monitorování pacienta a hodnocení nežádoucích účinků byly shodné s částí 1.
Pacienti byli náhodně rozděleni do 2 skupin. Pacientům skupiny DKM byla aplikována směs dexmedetomidinu 2 μμg . kg-1 + ketaminu 2 mg . kg-1 + midazolamu 1 mg, pacientům skupiny DKP bylo místo midazolamu podáno placebo (fyziologický roztok) ve stejném objemu. Každá kombinace byla během opakovaných anestezií pacientů použita jen jednou. U dvou pacientů, kteří při obou typech anestezie měli zachovalé vědomí (viz dále), byla odslepeně podána kombinace dexmedetomidin 2 μg . kg-1 + ketamin 2 mg . kg-1 + midazolam 2 mg. Experimentální léky byly smíchány v jedné stříkačce a aplikovány do m. deltoideus lékařem, který se dále neúčastnil anestezie pacienta, stejně, jako v části 1. Rovněž jako v předchozí části byl sledován nástup účinku a řešena nedostatečná analgezie. Statistická analýza byla provedena McNemarovým testem. Hodnota p < 0,05 byla považována za statisticky významnou.
Výsledky
Studie byla předčasně ukončena a odslepena po aplikaci 7 párů anestezií (minimum pro statistické zhodnocení) pro nežádoucí dlouhodobou sedaci vždy po jedné z dvojice anestezií. Demografické údaje uvádí tabulka 4. Ve skupině DKM se mnohem častěji vyskytovala ztráta vědomí a místo analgosedace došlo k anestezii (tab. 5). U 2 pacientů skupiny DKM se vyskytla porucha průchodnosti dýchacích cest způsobená obstrukcí kořenem jazyka. U 2 pacientů, kteří měli zachované vědomí u obou typů anestezie a kterým byla odslepeně zvýšena dávka midazolamu ve směsi z 1 na 2 mg, bylo vyvoláno dlouhodobé bezvědomí, doprovázené bradykardií a hypotenzí. Hemodynamické parametry se upravily po podání 0,5 mg atropinu, infuzní léčbě krystaloidy, vědomí se obnovilo po aplikaci flumazenilu.
Tab. 4. Demografická data – část 2 
Tab. 5. Výsledky – část 2 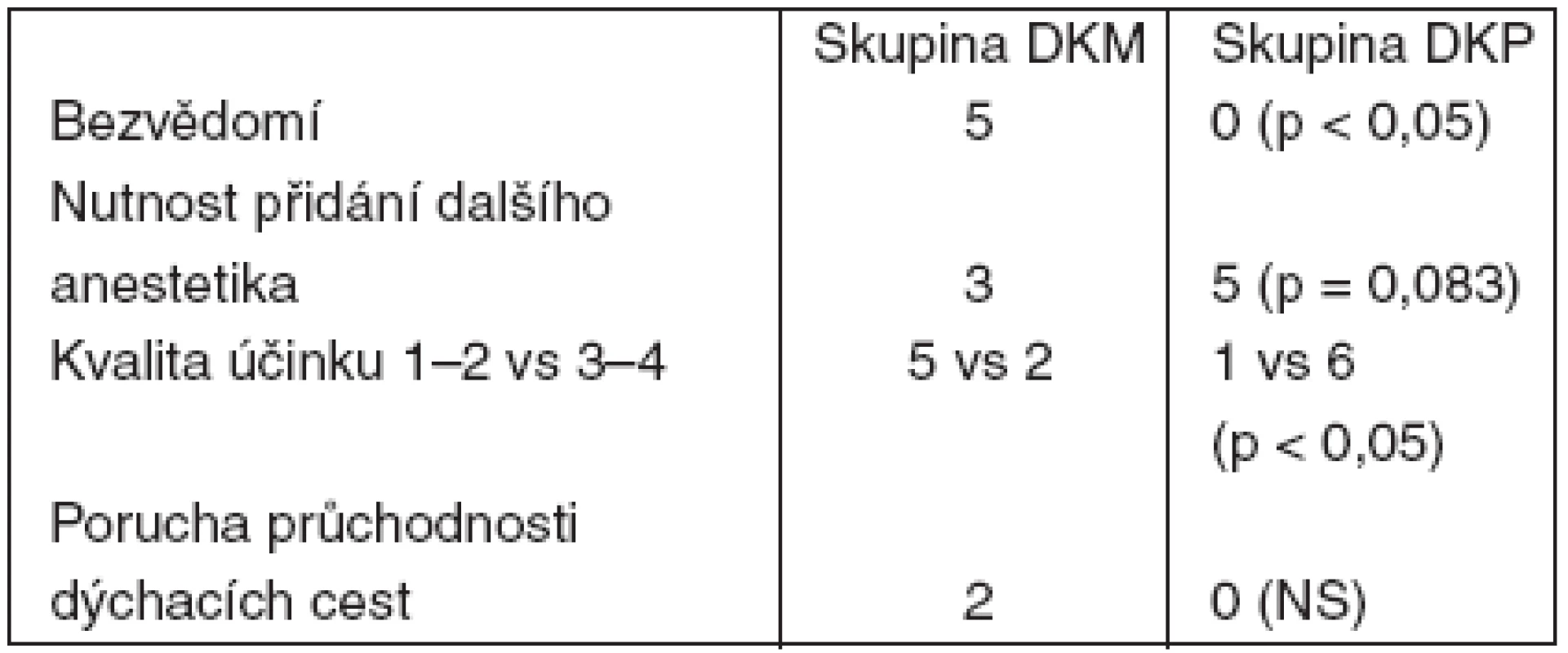
Poznámka: kvalita účinku 1 – vynikající; 2 – velmi dobrá, pouze v některé fázi nutnost přidání oxidu dusného s kyslíkem; 3 – dobrá, nutnost přidání inravenózního anestetika v určité fázi; 4 – nutnost doplnit intravenózní anestetikum pro nedostatečný účinek nebo významný psychomotorický neklid od začátku výkonu; 5 – významné vedlejší účinky, které by znemožnily provést výkon (v souboru se nevyskytlo). NS – statisticky nevýznamný. Diskuse
Kombinace alfa-2 sympatomimetik se používá často v anestezii zvířat [1]. Velkou výhodou je kardiovaskulární stabilita a svalová relaxace. Studií, které se týkají současného podání ketaminu a dexmedetomidinu u lidí, je málo. Levänen et al. [8] použil intramuskulární premedikaci dexmedetomidinem 20 minut před nitrožilní aplikací ketaminu. Pokud je nám známo, současné intramuskulární podání dexmedetomidinu a ketaminu v jedné stříkačce nebylo dosud publikováno.
Výsledky první části prokázaly, že kombinace dexmedetomidinu a ketaminu může být s úspěchem použita na bolestivé výkony, jakými jsou převaz popálených ploch a malé nekrektomie. Ze všech 4 kombinací se jako vhodná ukázala dávka dexmedetomidinu 2 μg . kg-1 + ketaminu 3 mg . kg-1, pokud je žádoucí zachovaná spolupráce pacienta a dávka dexmedetomidinu 2,5 μg . kg-1 + ketaminu 2 mg . kg-1, pokud je třeba větší analgezie a spolupráce není nezbytná. Obě zbývající dávkové kombinace vedly buď k příliš malé analgetické účinnosti (dexmedetomidin 2 μg . kg-1 + ketamin 2 mg . kg-1), nebo naopak k příliš velké sedaci (dexmedetomidin 2,5 μg . kg-1 + ketamin 3 mg . kg-1). Všechny dávky poskytly dobrou hemodynamickou stabilitu, což je ve shodě s ostatními autory [5]. Kombinace ketaminu a dexmedetomidinu skutečně eliminovala možnost vzniku hypotenze a bradykardie po dexmedetomidinu a hypertenze a tachykardie po ketaminu. Další výhodou uvedené kombinace je klinicky zanedbatelný účinek na dýchání a průchodnost dýchacích cest [19]. Dále jsme potvrdili to, že dexmedetomidin potencuje účinek ketaminu [8], což umožňuje snížit jeho dávku. Běžně se uvádí, že intramuskulární dávka ketaminu, která vyvolá ztrátu vědomí je 5–6 mg . kg-1 [19]. Podle našich výsledků dochází k redukci nezbytné dávky asi o 50 %. To by mělo teoreticky vést i ke snížení rizika vzniku vedlejších účinků ketaminu. Levänen et al. [8] popsali úplné vymizení psychomimetických účinků ketaminu po premedikaci dexmedetomidinem. To se v naší práci nepotvrdilo. Příčinou může být různý design studie: Levänen et al. podali nejprve nitrosvalově dexmedetomidin a teprve po 20 minutách nitrožilně ketamin. My jsme naopak smísili obě látky v jedné stříkačce pro intramuskulární podání. Zajímavá by byla možnost použít S-ketamin, který by mohl mít příznivější farmakologický profil s menším výskytem psychomotorických reakcí. Látka však u nás není registrována a podle ústního sdělení výrobce se ani s registrací zatím nepočítá.
Snaha po eliminaci nežádoucích CNS účinků nás vedla k přidání midazolamu ke směsi. Kombinace midazolamu a ketaminu je rutinně používána pro potlačení psychomimetických účinků ketaminu. Kombinace dexmedetomidinu a midazolamu však byla použita pouze v experimentu na zvířeti, kde došlo k významné potenciaci účinku [20], všechny ostatní publikace porovnávaly vzájemnou účinnost obou látek s různým výsledkem. Klonidin, látka, která má podstatně menší selektivitu k alfa2-sympatoadrenrgnímu receptoru, potencoval účinek midazolamu asi dvojnásobně [21].
Protokol naší studie neumožňoval podobný výpočet, přesto lze na základě skutečnosti, že tak malá dávka midazolamu (1–2mg) vyvolala spolehlivě ztrátu vědomí, předpokládat, že hypnotický účinek midazolamu byl zvýšen velmi významně. Nelze vyloučit ani to, že k výskytu nežádoucích účinků přispěla i premedikace petidinem, která je na Klinice popáleninové medicíny FNKV standardní.
Závěr
Můžeme shrnout, že intramuskulární aplikace kombinace dexmedetomidinu a ketaminu v jedné stříkačce může být použita k analgosedaci nebo anestezii popálených. Výhodou je oběhová stabilita a absence poruchy dýchání. Dexmedetomidin však nepotlačí vždy psychomimetické účinky ketaminu. Kombinace dexmedetomidinu 2,0 μg . kg-1 a ketaminu 3,0 mg . kg-1 i. m. vede zpravidla k anestezii s absencí reakce na verbální pokyn; u kombinace dexmedetomidin 2,5 μg . kg-1 a ketamin 2,0 mg . kg-1 i. m. dochází většinou k analgosedaci se zachovanou spoluprací pacienta. Přidání 1–2 mg midazolamu k intramuskulárně aplikované směsi dexmedetomidinu 2,0 μg . kg-1 a ketaminu 2,0 mg . kg-1 vyvolá ztrátu vědomí, s rizikem poruchy průchodnosti dýchacích cest, a dlouhodobou sedaci. V uvedeném dávkování nelze tuto trojkombinaci doporučit k rutinnímu použití v anesteziologické péči.
Došlo 13. 11. 2007.
Přijato 5. 1. 2008.
Adresa pro korespondenci:
Doc. MUDr. Jiří Málek, CSc.
Klinika anesteziologie a resuscitace
3. LF UK Praha a FNKV Praha
Šrobárova 50
100 34 Praha 10
e-mail: malekj@fnkv.cz
Zdroje
1. Pandharipande, P., Ely, E. W., Maze, M. Alpha-2 agonists: can they modify the outcomes in the Postanesthesia Care Unit? Curr. Drug Targets, 2005, 6, p. 749–754.
2. Bell, R. F., Dahl, J. B., Moore, R. A., Kalso, E. Peri-operative ketamine for acute post-operative pain: a quantitative and qualitative systematic review (Cochrane review). Acta Anaesthesiol. Scand., 2005, 49, p. 1405–1428.
3. Schmid, R. L., Sandler, A. N., Katz, J. Use and efficacy of low-dose ketamine in the management of acute postoperative pain: a review of current techniques and outcomes. Pain, 1999, 82, p. 111–125.
4. Aantaa, R., Jalonen, J. Perioperative use of alpha2-adrenoceptor agonists and the cardiac patient. Eur. J. Anaesthesiol., 2006, 23, p. 361–372.
5. Tosun, Z., Akin, A., Guler, G. et al. Dexmedetomidine-ketamine and propofol-ketamine combinations for anesthesia in spontaneously breathing pediatric patients undergoing cardiac catheterization. J. Cardiothorac. Vasc. Anesth., 2006, 20, p. 515–519.
6. Luscri, N., Tobias, J. D. Monitored anesthesia care with a combination of ketamine and dexmedetomidine during magnetic resonance imaging in three children with trisomy 21 and obstructive sleep apnea. Paediatr. Anaesth., 2006, 16, p. 782–786.
7. Scher, C. S., Gitlin, M. C. Dexmedetomidine and low-dose ketamine provide adequate sedation for awake fibreoptic intubation. Can. J. Anaesth., 2003, 50, p. 607–610.
8. Levanen, J., Makela, M. L., Scheinin, H. Dexmedetomidine premedication attenuates ketamine-induced cardiostimulatory effects and postanesthetic delirium. Anesthesiology, 1995, 82, p. 1117–1125.
9. Málek, J., Jandová, J., Kurzová, A., Šimánková, E. Clonidin u popálených pacientů. Anest. neodkl. péče, 1999, 10, p. 186–189.
10. Málek, J., Jandová, J., Hess, L. et al. Clonidine in anaesthesia of burned. Acta Anaesthesiol. Scand., 1998, 42, p. A252.
11. Karaaslan, D., Peker, T. T., Alaca, A. et al. Comparison of buccal and intramuscular dexmedetomidine premedication for arthroscopic knee surgery. J. Clin. Anesth., 2006, 18, p. 589–593.
12. Erkola, O., Korttila, K., Aho, M. et al. Comparison of intramuscular dexmedetomidine and midazolam premedication for elective abdominal hysterectomy. Anesth. Analg., 1994, 79, p. 646–653.
13. Virkkila, M., Ali-Melkkila, T., Kanto, J. et al. Dexmedetomidine as intramuscular premedication for day-case cataract surgery. A comparative study of dexmedetomidine, midazolam and placebo. Anaesthesia, 1994, 49, s. 853–858.
14. Jaakola, M. L., Kanto, J., Scheinin, H., Kallio, A. Intramuscular dexmedetomidine premedication – an alternative to midazolam-fentanyl-combination in elective hysterectomy? Acta Anaesthesiol. Scand., 1994, 38, p. 238–243.
15. Scheinin, H., Jaakola, M. L., Sjovall, S. et al. Intramuscular dexmedetomidine as premedication for general anesthesia. A comparative multicenter study. Anesthesiology, 1993, 78, p. 1065–1075.
16. Virkkila, M., Ali-Melkkila, T., Kanto, J. et al. Dexmedetomidine as intramuscular premedication in outpatient cataract surgery. A placebo-controlled dose-ranging study. Anaesthesia, 1993, 48, p. 482–487.
17. Aantaa, R., Jaakola, M. L., Kallio, A. et al. A comparison of dexmedetomidine, and alpha-2 adrenoceptor agonist, and midazolam as i.m. premedication for minor gynaecological surgery. Br. J. Anaesth., 1991, 67, p. 402–409.
18. Aantaa, R., Kanto, J., Scheinin, M. Intramuscular dexmedetomidine, a novel alpha - 2 adrenoceptor agonist, as premedication for minor gynaecological surgery. Acta Anaesthesiol. Scand., 1991, 35, p. 283–288.
19. Reves, J., Glass, P., Lubarsky, D. A. Nonbarbiturate intravenous anesthetics. In: Miller, R. D., ed. Anesthesia. 5. vyd., Churchill Livingstone : Philadelphia, 2000, p. 240–245.
20. Salonen, M., Reid, K., Maze, M. Synergistic interaction between alpha 2-adrenergic agonists and benzodiazepines in rats. Anesthesiology, 1992, 76, p. 1004–1011.
21. Murai, T., Kyoda, N., Misaki, T. et al. Effects of clonidine on intravenous sedation with midazolam. Anesth. Prog., 1995, 42, p. 135–138.
Štítky
Anestéziológia a resuscitácia Intenzívna medicína
Článek Zprávy ČSARIMČlánek Poznámka k pětiletému výročí
Článok vyšiel v časopiseAnesteziologie a intenzivní medicína
Najčítanejšie tento týždeň
2008 Číslo 2- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Metamizol v liečbe pooperačnej bolesti u opioid-tolerantnej pacientky – kazuistika
- e-Konzilium.cz — Masivní plicní embolie při tromboembolické nemoci
-
Všetky články tohto čísla
- Trojhladinová ventilácia pľúc (3LV® – 3 level ventilation) – prvé klinické skúsenosti
- Epidemiologie invazivní kandidózy a kandidémie – stále aktuální problém
- Zprávy ČSARIM
- Report of the meeting of the Section and Board of Anaesthesiology (SBA) Istanbul, Saturday 17th November 2007
- Minimal Monitoring Standards in the Perioperative Period
- Poznámka k pětiletému výročí
- Nozokomiální versus komunitní infekce na JIP
- Laryngeální maska LMA-ProSeal™ – bezpečná možnost zajištění dýchacích cest pro laparoskopické cholecystektomie
- Použití intramuskulárního podání dexmedetomidinu u popálených – předběžné výsledky
- Intravenózní sedace kombinací dexmedetomidinu a ketaminu u operací v místní anestezii
- Klasifikace infekcí v intenzivní péči, srovnání inkubační doby a nosičství
- Teória a zjednodušený matematický model viachladinovej umelej ventilácie pľúc
- Anesteziologie a intenzivní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Nozokomiální versus komunitní infekce na JIP
- Epidemiologie invazivní kandidózy a kandidémie – stále aktuální problém
- Laryngeální maska LMA-ProSeal™ – bezpečná možnost zajištění dýchacích cest pro laparoskopické cholecystektomie
- Trojhladinová ventilácia pľúc (3LV® – 3 level ventilation) – prvé klinické skúsenosti
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



